Генетика, 2020, T. 56, № 1, стр. 78-88
Генетическая изменчивость мальмы (Salvelinus malma), кунджи (S. leucomaenis) и межвидовых гибридов из реки Утхолок (северо-западная Камчатка)
М. А. Груздева 1, *, А. В. Семенова 1, К. В. Кузищин 1, 2, Е. В. Пономарева 1, А. А. Волков 3, Д. С. Павлов 1, 2
1 Московский государственный университет им. М.В. Ломоносова, кафедра ихтиологии
119234 Москва, Россия
2 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
3 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
107140 Москва, Россия
* E-mail: MG_office@mail.ru
Поступила в редакцию 11.02.2019
После доработки 23.02.2019
Принята к публикации 05.03.2019
Аннотация
Исследована изменчивость мальмы, кунджи и их межвидовых гибридов по девяти микросателлитным локусам ядерной ДНК и гену CO1 митохондриальной ДНК. Показана значительная генетическая дивергенция между двумя видами гольцов по всей совокупности микросателлитных локусов (FST = 0.529; р < 0.001). Мальма характеризуется значительно бóльшей генетической изменчивостью по сравнению с кунджей по показателям средней ожидаемой гетерозиготности (HE) и аллельного разнообразия (AR). Гибридные особи имеют промежуточные значения HE и AR по сравнению с родительскими видами. Исследование полиморфизма гена CO1 выявило три гаплотипа. У всех фенотипических особей кунджи и у гибридов обнаружен один гаплотип, специфичный для кунджи. У рыб, определенных по фенотипическим признакам как мальма, выявлены два гаплотипа, относящихся к мальме. Таким образом, гибридные особи произошли от скрещивания самцов мальмы и самок кунджи. Особи, у которых выявлены гибридные генотипы, за исключением одной, являются гибридами первого поколения (F1). Один голец, возможно, потомок скрещивания гибрида с одним из родительских видов либо гибрид второго поколения F2, что свидетельствует о том, что гибридизация между изученными видами является интрогрессивной.
Анализ проблемы межвидовой гибридизации у костистых рыб в естественных условиях приобретает все большее значение в связи с выявленной в последнее время широкой распространенностью этого явления [1–4]. Интрогрессивная гибридизация рассматривается как существенный фактор увеличения генотипической и фенотипической изменчивости таксонов и потенциальный источник адаптивной эволюции видов вплоть до случаев уникального быстрого видообразования [4–9]. Большую перспективу имеют исследования процессов гибридизации с помощью молекулярных маркеров. Использование локусов ядерной и митохондриальной ДНК позволяет точно идентифицировать особей гибридного происхождения в выборке, оценить степень гибридизации и наличие интрогрессии между родительскими видами, определить материнскую линию гибридов [8, 10–12].
Случаи гибридизации между разными видами с последующей интрогрессией чужеродных генов известны у лососевых рыб семейства Salmonidae, что делает их информативными модельными объектами для изучения процессов интрогрессивной гибридизации [13–21]. Среди лососевых рыб межвидовые гибриды часто возникают у гольцов рода Salvelinus, что ряд исследователей связывает со сложным филогенезом группы [2, 22–30]. В то же время практически все описанные случаи межвидовой гибридизации у гольцов относятся к единичным особям поколения F1 или к отдаленным потомкам гибридных особей – так называемым “следам гибридизации” (traces of hybridization) или “призракам прошлой гибридизации” (the ghost of hybrid past) [8–10, 25, 31, 32].
Единственный случай массовой межвидовой гибридизации в дикой природе описан нами у гольцов из р. Утхолок на северо-западе Камчатки [33, 34]. В этой водной системе начиная с 70-х гг. ХХ в. выявлены фенотипические гибриды между двумя видами гольцов – мальмой Salvelinus malma и кунджей S. leucomaenis [35]. Предварительный анализ, выполненный на небольшой выборке, подтвердил гибридную природу особей с промежуточным фенотипом [34]. В то же время ограниченность материала не позволила решить вопрос, является ли такая гибридизация интрогрессивной, а также получить представление о масштабности данного явления на уровне локальной группировки гольцов.
В связи с этим целью настоящего исследования стал анализ генетической изменчивости мальмы, кунджи и гибридных особей из р. Утхолок с помощью молекулярных маркеров – митохондриального гена, кодирующего цитохром С оксидазу 1 (CO1), и девяти микросателлитных локусов для идентификации видоспецифичных аллелей, установления видовых границ и выявления гибридов, а также исследования степени интрогрессии у родительских видов гольцов.
МАТЕРИАЛЫ И МЕТОДЫ
Район работ, исследованный материал
Река Утхолок расположена на северо-западе Камчатки, ее длина составляет 140 км, на всем своем протяжении она имеет множество притоков. Река не подвергалась антропогенной трансформации, здесь отсутствует хозяйственная деятельность и никогда не проводились акклиматизационные или рыборазводные мероприятия. В реке обитают девять видов рыб, которые сохранили свою первозданную структуру [35]. В водоемах Камчатского полуострова, по мнению разных исследователей, насчитывается до пяти видов гольцов, но в р. Утхолок обитают только два вида – мальма и кунджа. Это массовые виды, они осваивают речной бассейн от истока до устья, их размножение происходит преимущественно в небольших притоках реки [35, 36].
Рыб отлавливали в 2016–2017 гг. в нижнем и среднем течении реки. Мальму, кунджу и их гибриды идентифицировали по признакам внешней морфологии. Мальма и кунджа из р. Утхолок имеют типичную форму тела, окраску, диагностические меристические и краниологические признаки. Гибриды хорошо различимы по окраске головы и тела, размеру, форме и окраске пятен на боках тела [34]. Материалом для исследований послужили выборки мальмы (n = 7), кунджи (n = 32) и фенотипически промежуточных особей, вероятно являющихся межвидовыми гибридами (n = 17).
Анализ молекулярных данных
Для определения материнской линии исследуемых рыб в работе анализировали митохондриальный ген CO1, используя универсальные праймеры для рыб [37]. Микросателлитный анализ был проведен по девяти локусам, разработанным для исследований полиморфизма лососевых рыб: Smm-3, Smm-10, Smm-17, Smm-21, Omy301, SSOSL456, Sco202, Sco211, Sle6 [38–42]. Методики выделения ДНК, амплификации и разделения ПЦР-продуктов, секвенирования последовательностей мтДНК были опубликованы ранее [34].
Статистический анализ
Первичную обработку и множественное выравнивание нуклеотидных последовательностей проводили в программе Geneious® 6.0.5 (Biomatters Ltd.). Родительские виды определяли по видоспецифичным последовательностям гена CO1, депонированным в базе нуклеотидных последовательностей Генбанка (GenBank® (NCBI)), используя онлайн-ресурс BLAST® (NCBI). Данные по всем микросателлитным локусам были проанализированы в целях обнаружения возможных ошибок генотипирования, а также присутствия нуль-аллелей с помощью программы Micro-Cheсker [43].
Основные статистики аллельного разнообразия (частоты аллелей, число видоспецифичных аллелей (APR, учитывались только аллели, частота встречаемости которых >0.05), аллельное разнообразие, скорректированное по минимальному объему выборки (AR), наблюдаемая (HO) и ожидаемая (HE) гетерозиготность), отклонение от равновесия Харди–Вайнберга, коэффициенты инбридинга (FIS) и популяционной дифференциации (FST), оценки неравновесности по сцеплению были получены в программах Genepop 3.3 [44] и Fstat 2.93 [45].
Анализ популяционной структуры и оценку вероятности гибридного происхождения отдельных образцов проводили с использованием двух вариантов метода Байеса на основании многолокусных генотипов в программах Structure 2.3.4 [46] и N-ewHybrids [47]. В программе Structure оценивается вероятность разбиения общей выборки на K генетически самостоятельных групп или кластеров и вычисляется вероятность принадлежности к тому или иному кластеру каждого индивидуума. При расчетах использовали модель, допускающую генетическое смешение и независимость аллельных частот среди кластеров, без использования предварительной информации о происхождении особей. Проведено 105 burn-in- и 106 MCMC- итераций для К от 1 до 3, по пять анализов для каждого значения К.
Программа NewHybrids вычисляет апостериорную вероятность принадлежности каждого индивида к одному из шести заданных генотипических классов: двум классам “чистых” видов (мальмы и кунджи), гибридам первого поколения F1 и второго поколения F2, а также возвратным гибридам с каждым из родительских видов. Анализ проводили без использования предварительной информации о происхождении особей, с построением марковской цепи в течение 106 итераций в пяти повторностях.
Для расположения образцов по степени их генетического родства в многомерном пространстве изменчивости на основании многолокусных генотипов был проведен факторный анализ (Factorial Correspondence Analysis, FCA) в программе Genetix 4.0 [48].
РЕЗУЛЬТАТЫ
Анализ последовательностей генов митохондриальной ДНК
После множественного выравнивания полученных последовательностей исследован участок мтДНК длиной 595 пн, включающий частичную последовательность кодирующего гена CO1. Среди исследованных последовательностей выделены три гаплотипа. У всех фенотипических кундж и гибридов обнаружен один гаплотип, специфичный для кунджи (MF503661). У рыб, определенных по фенотипическим признакам как мальмы, выявлены два гаплотипа (KX145385, MF50365), относящихся к мальме и различающихся на одну транзицию A/G в 455-й позиции в выравнивании.
Изменчивость по микросателлитным локусам
Программа Micro-Cheсker не обнаружила возможных ошибок генотипирования ни в одном из изученных локусов. Показана вероятность наличия нуль-аллелей в локусе Smm-17 у мальмы. Возможно, это связано с небольшим объемом выборки этого вида.
Исследованные микросателлитные локусы в выборках гольцов различались уровнем изменчивости. Число аллелей по разным локусам варьирует от 1 (Smm-10, Sco202) до 27 (Sco211) (табл. 1). Достоверно значимые отклонения от равновесия Харди–Вайнберга (p < 0.05) в распределении генотипов после проведения коррекции Бонферрони наблюдаются в локусе Smm-17 у мальмы. У кунджи распределения генотипов по всем локусам соответствуют теоретическому. В выборках особей с промежуточным фенотипом неравновесны шесть локусов из девяти.
Таблица 1.
Генетическая изменчивость мальмы, кунджи и фенотипически промежуточных особей гольцов (гибридов) по исследованным микросателлитным локусам
| Локус | Salvelinus malma, n = 7 | Salvelinus leucomaenis, n = 32 | Гибриды, n = 17 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A | AR | APR | пн | HO | HE | FIS | A | AR | APR | пн | HO | HE | FIS | A | AR | APR | пн | HO | HE | FIS | |
| Smm-3 | 2 | 2 | – | 122–124 | 0.571 | 0.527 | –0.09 | 2 | 1.2 | – | 116–120 | 0.031 | 0.031 | 0.00 | 4 | 3.5 | 1 | 116–126 | 0.882 | 0.607 | –0.47 |
| Smm-10 | 9 | 9 | 4 | 146–188 | 0.857 | 0.923 | 0.07 | 1 | 1 | – | 158 | 0.000 | 0.000 | 0.00 | 8 | 5.7 | 2 | 146–176 | 0.529 | 0.780 | 0.33 |
| Smm-17 | 5 | 5 | 5 | 113–137 | 0.285 | 0.781 | 0.66 | 2 | 1.2 | – | 119–121 | 0.031 | 0.031 | 0.00 | 2 | 1.4 | – | 111–121 | 0.059 | 0.058 | –0.001 |
| Smm-21 | 7 | 7 | 4 | 117–147 | 0.714 | 0.846 | 0.16 | 2 | 1.9 | – | 113–115 | 0.343 | 0.364 | 0.06 | 8 | 5.8 | 1 | 113–137 | 1.000 | 0.766 | –0.32 |
| Sco202 | 3 | 3 | 1 | 76–84 | 0.428 | 0.384 | –0.12 | 1 | 1 | – | 76 | 0.000 | 0.000 | 0.00 | 3 | 2.4 | – | 76–132 | 0.941 | 0.540 | –0.78 |
| Sco211 | 12 | 12 | 5 | 111–201 | 0.857 | 0.978 | 0.13 | 27 | 10.8 | 5 | 121–203 | 0.967 | 0.957 | –0.01 | 17 | 9.8 | – | 121–207 | 0.941 | 0.934 | –0.01 |
| SSOSL456 | 3 | 3 | 1 | 180–190 | 0.571 | 0.582 | 0.02 | 3 | 2.4 | – | 156–170 | 0.625 | 0.525 | –0.19 | 5 | 3.7 | – | 156–190 | 1.000 | 0.664 | –0.53 |
| Sle6 | 4 | 4 | 2 | 93–101 | 0.285 | 0.395 | 0.29 | 2 | 1.9 | – | 91–93 | 0.406 | 0.364 | –0.11 | 4 | 2.8 | – | 91–103 | 0.412 | 0.393 | –0.05 |
| Omy301 | 7 | 7 | 2 | 62–90 | 0.857 | 0.879 | 0.03 | 3 | 2.9 | – | 66–74 | 0.531 | 0.485 | –0.09 | 8 | 5.8 | – | 62–92 | 0.941 | 0.823 | –0.15 |
| Среднее | 5.8 | 5.8 | 2.7 | 0.603 | 0.700 | 0.14 | 4.8 | 2.7 | 0.6 | 0.326 | 0.306 | –0.06 | 6.6 | 4.5 | 0.4 | 0.745 | 0.618 | –0.21 | |||
Примечание. Полужирным шрифтом выделены оценки FIS, достоверно значимые после коррекции Бонферрони. A – число аллелей; AR – число аллелей, скорректированное по минимальному объему выборки; APR – приватные аллели; пн – число пар нуклеотидов; HO – наблюдаемая гетерозиготность; HE – ожидаемая гетерозиготность; FIS – коэффициент инбридинга.
Семь из девяти исследованных локусов были полиморфны и у мальмы, и у кунджи, с некоторой разницей в аллельном составе между видами. Локусы Smm-10 и Sco202 были мономорфны у кунджи, но полиморфны у мальмы. Локусы Smm-3 и SSOSL456 оказались видоспецифичными, с неперекрывающимся диапазоном размеров аллелей по каждому из локусов. Число приватных аллелей составило 24 (46%) у мальмы и 5 (11%) у кунджи. Оценки корреляции между генотипами по всем выборкам не обнаружили достоверных значений ни по одной паре локусов.
Мальма характеризуется более чем в 2 раза большими оценками аллельного разнообразия (AR) и средней гетерозиготности (HE), чем кунджа: (AR: 7.2 и 3.1 и HE: 0.708 и 0.297 соответственно). Выборки кунджи и мальмы достоверно различаются по частотам аллелей и генотипов по восьми локусам (p < 0.001), недостоверны различия только по локусу Sco211 (p = 0.06). Также значительная генетическая дивергенция между двумя видами гольцов показана при тестировании по всей совокупности локусов (FST = 0.529; p < 0.001).
Выборка особей предположительно гибридного происхождения была полиморфна по всем изученным локусам. Диапазон размеров аллелей в видоспецифичных локусах Smm-3 и SSOSL456 составил от минимальных значений, характерных для кунджи, до максимальных, описанных у мальмы. Коэффициент инбридинга FIS имел отрицательные значения по всем локусам, что свидетельствует об избытке гетерозиготных генотипов. В шести локусах из девяти избыток гетерозигот был достоверно значим (p < 0.05). Гибридные особи характеризуются промежуточными значениями аллельного разнообразия и средней ожидаемой гетерозиготности по сравнению с этими показателями в выборках родительских видов: AR = 4.5 и HE = 0.618.
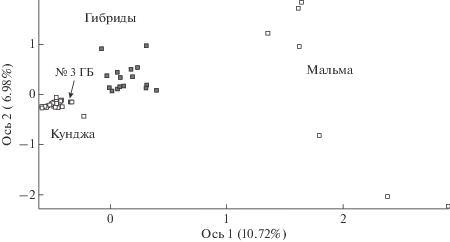
Результаты факторного анализа (FCA) генотипов представлены на рис. 1. Генотипы S. malma и S. leucomaenis формируют две обособленные факторные области. 16 из 17 вероятных гибридов занимают в пространстве промежуточное положение, координаты одной особи (№ 3 ГБ), классифицированной по морфологическим данным как гибридной, локализуются в кластере точек кунджи.
Рис. 1.
Результаты факторного анализа в координатах двух осей для особей мальмы, кунджи и их гибридов из р. Утхолок, полученные на основе анализа генотипов по девяти микросателлитным локусам.
Результаты кластеризации в программе Structure показывают наиболее вероятное число кластеров K = 2, т.е. принадлежность особей суммарной выборки к двум кластерам, соответствующим двум видам гольцов (рис. 2). Первый кластер включает всех особей мальмы с индивидуальной вероятностью принадлежности к кластеру qSM для каждой особи 0.96 и более, средняя вероятность принадлежности выборки мальмы к этому кластеру QSM = 0.985. Второй кластер включает всех особей кунджи, с индивидуальной вероятностью принадлежности к этому кластеру для каждой особи qSL 0.97 и более. Средняя вероятность принадлежности к этому кластеру для выборки кунджи QSL = 0.987. Фенотипически промежуточные экземпляры выявляются как имеющие генетически смешанную природу и попадают в кластеры с индивидуальной вероятностью qSM < 0.64 и qSL < 0.66, что доказывает их гибридное происхождение. Лишь одна особь, отнесенная к гибридной группе по морфологическим признакам (№ 3 ГБ) с вероятностью qSL = 0.96, принадлежит к кластеру кунджи. Для всей выборки гибридов средние значения вероятностей принадлежности к каждому кластеру составляют QSM = 0.531 и QSL = 0.496.
Рис. 2.
Графическое представление результатов анализа в программе Structure выборок мальмы, кунджи и их гибридов из р. Утхолок на основании генотипов по девяти микросателлитным локусам, с заданным числом кластеров К = 2. Р – вероятность принадлежности особей к кластеру.

Программа NewHybrid обнаружила высокие апостериорные вероятности принадлежности к “чистым” классам для S. malma и S. leucomaenis. Все особи, фенотипически классифицированные как мальма, были отнесены к “чистому” родительскому виду 1 со средней вероятностью 0.995; все особи, идентифицированные как кунджа, принадлежали к родительскому виду 2 со средней вероятностью более 0.999 (данные не показаны). 15 образцов из 17 возможных гибридов были классифицированы как гибриды первого поколения F1 с высокими индивидуальными значениями апостериорных вероятностей, варьирующих от 0.962 до 0.999. Особь № 3 ГБ была отнесена к классу кунджи с вероятностью более 99%. Кроме того, особь № 15 ГБ не была однозначно классифицирована, вероятность принадлежности к генетическим классам гибридов F1 и F2 составила 0.841 и 0.074 соответственно.
Особей с промежуточным между кунджей и мальмой фенотипом ловили ежегодно в августе-сентябре в количестве более десятка с 2003 по 2007 гг. Так, в 2003 г. доля гибридов в объединенной выборке (n = 149) составила 12%, в 2004 г. – 11% (n = 165), в 2016 г. – 27% (n = 11), в 2018 г. – 11% (n = 110). В разные годы возраст гибридов варьировал от 5 до 9 лет.
ОБСУЖДЕНИЕ
Результаты сравнительного анализа полиморфизма микросателлитных локусов мальмы и кунджи показывают значительно бóльшую генетическую изменчивость мальмы по сравнению с кунджей по показателям средней ожидаемой гетерозиготности (HE) и аллельного разнообразия (AR). Уровень генетического разнообразия мальмы из р. Утхолок по совокупности исследованных микросателлитных локусов несколько превышает соответствующие оценки в популяциях северной мальмы Российского Дальнего Востока [49–51]. У кунджи из р. Утхолок, напротив, показатели HE и AR меньше, чем в популяциях этого вида в Японии и на Дальнем Востоке [52–55]. У мальмы и кунджи из р. Утхолок выявлен значительный уровень генетической дивергенции (FST = 0.529; p < 0.001). В целом картина генетической изменчивости мальмы и кунджи из р. Утхолок по микросателлитным маркерам соответствует известным различиям между этими видами при симпатричном обитании [42].
По мнению ряда исследователей, в роде Salvelinus кунджа занимает базальное положение и является одним из наиболее дивергировавших генетически обособленных видов [56–58]. Степень дивергенции нуклеотидных последовательностей митохондриальной ДНК кунджи и мальмы, по оценочным данным, составляет около 7% [56, 57]. Предположительно расхождение их от общего предка произошло порядка 10–15 млн лет назад [59, 60]. Наоборот, мальма рассматривается как один из относительно молодых видов, возникших на одном из завершающих этапов дивергенции в роде гольцов [61, 62]. Тем не менее гибриды между этими видами возникают в разных участках их совместного ареала, однако почти во всех случаях речь идет о единичных особях [28, 63].
Река Утхолок является исключением – в ней гибридные особи встречаются на протяжении длительного периода, с начала 70-х гг. ХХ в., численность гибридов высокая и гибридные особи, вылавливаемые в разные годы, принадлежат к разным возрастным классам и, соответственно, разным поколениям [33, 34]. Это свидетельствует о том, что гибридизация мальмы и кунджи в р. Утхолок носит перманентный, продолжающийся во времени, характер.
Все особи, у которых выявлены гибридные генотипы, за исключением одного, являются гибридами первого поколения (F1), что подтверждается значениями апостериорной вероятности, полученной в программе NewHybrids. Один голец гибридного происхождения, который не классифицирован с высоким уровнем вероятности как гибрид первого поколения, возможно, является потомком скрещивания гибрида с одним из родительских видов (возвратным гибридом) либо гибридом второго поколения F2, что возможно свидетельствует о том, что гибридизация интрогрессивная. Необходимо отметить, что разделение возвратных гибридов и представителей “чистых” родительских видов не всегда возможно и требует исследования большого числа локусов и выборок большого объема [64].
Все особи с промежуточными фенотипами и смешанными генотипами на основании микросателлитных локусов ядерной ДНК имели гаплотипы мтДНК кунджи. Таким образом, все исследованные гибридные особи произошли от скрещивания самцов мальмы и самок кунджи.
Межвидовая гибридизация у гольцов в природе имеет широкое распространение, но к настоящему времени чаще всего отмечена в водоемах бассейна Северной Пацифики и прилегающих регионах Арктического бассейна. В литературе описаны разнообразные варианты межвидовых скрещиваний, затрагивающих не менее семи видов, дающих не менее восьми вариантов межвидовой гибридизации [8, 22, 24–28, 30, 63–65]. Столь высокое разнообразие вариантов гибридизации обусловлено, вероятно, бурной геологической историей северо-востока Азии и запада Северной Америки в четвертичном периоде. В это время происходили масштабные перестройки крупных водных бассейнов, фрагментация одних речных систем и соединения разных бассейнов, возникновение и исчезновение крупных плейстоценовых озер. Это приводило к сложным процессам изоляции и расселения разных видов гольцов, возникновению и разрушению контактных зон, многоступенчатым процессам постгляциальной колонизации водоемов [62, 66–74].
Большинство описанных в литературе случаев межвидового скрещивания гольцов констатируют интрогрессивную гибридизацию, когда митохондриальные или ядерные гены одного вида инкорпорированы в геном другого вида. По мнению большинства исследователей, это свидетельствует об отделенной во времени гибридизации (pre-historic), случившейся в основном 14–10 тыс. лет назад [8, 22–25, 75–77]. Случаи интрогрессивной гибридизации в водоемах Северной Америки исследователи связывают, прежде всего, с постгляциальной колонизацией, когда происходили расселение и контакт видов в новых местообитаниях [8, 25, 31, 72, 77–79]. При этом в большинстве работ указывается, что число гибридов F1 в ненарушенных природных водоемах низкое благодаря существованию хорошо выраженных механизмов презиготической изоляции. Как правило, в современную эпоху в случае симпатрии двух или более видов наблюдается их экологическая изоляция из-за пространственного разобщения нерестилищ, временного разрыва сроков нереста и ассортативного скрещивания [27, 63, 76, 79–82].
Таким образом, в подавляющем большинстве описанных случаев межвидовая гибридизация гольцов в естественных водоемах, без влияния человека, имеет следующие особенности: 1) сама гибридизация – событие давней истории; 2) наблюдается интрогрессия ядерного или, что чаще, митохондриального генома одного вида в геном другого; 3) встречаемость и численность гибридов F1 низкие из-за хорошо выраженных механизмов презиготической изоляции; 4) интрогрессивную гибридизацию связывают с процессами постгляциальной колонизации и конкурентного замещения одних видов другими.
Ситуация в р. Утхолок существенно отличается от того, что известно для других водоемов и регионов Голарктики: 1) численность гибридов высокая, она сохраняется на протяжении более 40-летних наблюдений, возраст гибридных особей различен; 2) среди гибридных рыб, выявленных в разные годы, резко преобладают гибриды F1, особи-гибриды F2–Fn отмечены единично; 3) гибридизация в р. Утхолок – перманентный, продолжающийся процесс; 4) в реке существуют условия, при которых происходят системное нарушение презиготического механизма межвидовой изоляции и закономерное появление межвидовых гибридов с высокой частотой.
На наш взгляд, причины высокого уровня межвидовой гибридизации мальмы и кунджи в р. Утхолок заключаются в геоморфологических особенностях реки и биологии размножения этих видов. Нерест мальмы и кунджи происходит в верхнем течении небольших притоков, где нерестилища мальмы и кунджи расположены в непосредственной близости друг от друга, что является очень редким для рек Камчатки [83–85]. Однако нерест этих видов разорван во времени [35, 83]. Высокий уровень межвидовой гибридизации мальмы и кунджив р. Утхолок на совмещенных нерестилищах обеспечивается за счет присутствия тут большого количества карликовых самцов мальмы в осеннее время [35]. Карликовые самцы мальмы становятся текучими уже в конце августа и находятся в таком состоянии до глубокой осени. Во время нереста проходных производителей кунджи многочисленные мелкие (100–150 мм) карликовые самцы мальмы находятся в непосредственной близости от них и участвуют в оплодотворении икры крупных (400–800 мм) самок кунджи, используя тактику “подкрадывания” (sneaking) [34]. Практически все описанные в литературе случаи межвидовой гибридизации у гольцов указывают на то, что самцы мелкого вида оплодотворяют икру самок более крупного вида, используя тактику подкрадывания [24, 63, 86–89].
Таким образом, в р. Утхолок сложилась уникальная природная ситуация, когда в результате нарушения презиготической изоляции, которую наблюдаем “здесь и сейчас”, на протяжении длительного периода, происходит массовая межвидовая гибридизация между филогенетически далекими видами гольцов с образованием жизнеспособных и плодовитых гибридов [34]. В связи с этим необходимы дальнейшие исследования по выяснению дальнейшей судьбы гибридов F1 и оценке уровня интрогрессии, что делает р. Утхолок “природной лабораторией” по изучению микроэволюционных процессов, интрогрессивной гибридизации и проблем ретикулярного формообразования.
Авторы выражают благодарность участникам экспедиции МГУ – ТСА (“The conservation Angler”, Сиэттл, США) – WSC (“Wild Salmon Center”, Портлэнд, США) за помощь в сборе полевого материала.
Работа была выполнена в рамках проекта МГУ “Ноев ковчег”.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Barton N.H., Hewitt G.M. Adaptation, speciation, and hybrid zones // Nature. 1989. V. 341. P. 497–503.
Verspoor E., Hammar J. Introgressive hybridization in fishes: the biochemical evidence // J. Fish Biol. 1991. V. 39. P. 309–334.
Carmichael G.J., Hanson J.N., Schmidt M.E., Morizot D.C. Introgression among apache, cutthroat, and rainbow trout in Arizona // Trans. Am. Fish. Soc. 1993. V. 122. P. 121–130.
Taylor E.B. Evolution in mixed company – evolutionary influences from studies of natural hybridization in Salmonidae // Evolution Illuminated: Salmon and their Relatives / Eds Hendry A.P., Stearns S.C. Oxford: Oxford Univ. Press, 2004. P. 232–263.
Arnold M.L. Natural Hybridization and Evolution. O-xford: Oxford Univ. Press, 1997. 231 p.
Dowling T.E., deMarais B.D. Evolutionary significance of introgressive hybridization in fishes // Nature. 1993. V. 362. P. 444–446.
Harrison R.G. Hybrid Zones and the Evolutionary Process. Oxford: Oxford Univ. Press, 1993. 222 p.
Wilson C.Z., Bernatchez L. The ghost of hybrids past: fixation of arctic charr (Salvelinus alpinus) mitochondrial DNA in an introgressed population of lake trout (S. namaycush) // Mol. Ecol. 1998. V. 7. P. 127–132.
Bougas B., Normandeau E., Audet C., Bernatchez L. Linking transcriptomic and genomic variation to growth in brook charr hybrids (Salvelinus fontinalis, Mitchill) // Heredity. 2013. V. 110. P. 492–500.https://doi.org/10.1038/hdy.2012.117
Woram R.A., McGowan C., Stout J.A. et al. A genetic linkage map for Arctic char (Salvelinus alpinus): evidence for higher recombination rates and segregation distortion in hybrid versus pure strain mapping parents // Genome. 2004. V. 47. P. 304–315. https://doi.org/10.1139/g03-127
Lamaze F.C., Sauvage C., Amandine M. et al. Dynamics of introgressive hybridization assessed by SNP population genomics of coding genes in stocked brook charr (Salvelinus fontinalis) // Mol. Ecol. 2012. V. 21. P. 2877–2895. https://doi.org/10.1111/j.1365-294X.2012.05579.x
Bougas B., Granier S., Audet C., Bernatchez L. The transcriptional landscape of cross-specific hybrids and its possible link with growth in brook charr (Salvelinus fontinalis Mitchill) // Genetics. 2010. V. 186. P. 97–107. https://doi.org/10.1534/110.118158
Avise J.C. Molecular Markers, Natural History and Evolution. N.Y.: Chapman and Hall, 1994. 198 p.
Sloss B.L., Jennings M.T., Franckowiak R., Pratt D.M. Genetic identity of brook trout in Lake Superior south shore streams: potential for genetic monitoring of stocking and rehabilitation efforts // Trans. Amer. Fish. 2008. V. 137. P. 1244–1251. https://doi.org/10.1577/T05-206.1
Hansen M.M., Mensberg K.L. Admixture analysis of stocked brown trout populations using mapped microsatellite DNA markers: indigenous trout persist in introgressed populations // Biol. Letters. 2009. V. 5. P. 656–659. https://doi.org/10.1098/rsbl.2009.0214
Hansen M.M., Fraser D.J., Meier K., Mensberg K.L. Sixty years of anthropogenic pressure: a spatio-temporal genetic analysis of brown trout populations subject to stocking and population declines // Mol. Ecol. 2009. V. 18. P. 2549–2562. https://doi.org/10.1111/j.1365-294X.2009.04198.x
Cooper A.M., Miller L.M., Kapuscinski A.R. Conservation of population structure and genetic diversity under captive breeding of remnant coaster brook trout (Salvelinus fontinalis) populations // Conserv. Genet. 2010. V. 11. P. 1087–1093. https://doi.org/10.1007/s10592-009-9841-0
Marie A.D., Bernatchez L., Garant D. Loss of genetic integrity correlates with stocking intensity in brook charr (Salvelinus fontinalis) // Mol. Ecol. 2010. V. 19. P. 2025–2037.https://doi.org/10.1111/j.1365-294X.2010.04628.x
Marie A.D., Bernatchez L., Garant D. Empirical assessment of software efficiency and accuracy to detect introgression under variable stocking scenarios in brook charr (Salvelinus fontinalis) // Conserv. Genet. 2011. V. 12. P. 1215–1227.https://doi.org/10.1007/s10592-011-0224-y
Marie A.D., Bernatchez L., Garant D. Environmental factors correlate with hybridization in stocked brook charr (Salvelinus fontinalis) // Can. J. Fish. Aquat. Sci. 2012. V. 69. P. 1–10. https://doi.org/10.1139/f2012-027
Winkler K.A., Pamminger-Lahnsteiner B., Wanzenböck J., Weiss S. Hybridization and restricted gene flow between native and introduced stocks of Alpine whitefish (Coregonus sp.) across multiple environments // Mol. Ecol. 2011. V. 20. P. 456–472. https://doi.org/10.1111/j.1365-294X.2010.04961.x
Hammar J., Dempson J.B., Verspoor E. Natural hybridization between Arctic char (Salvelinus alpinus) and Brook trout (S. fontinalis): evidence from Northern Labrador // Can. J. Fish. Aquat. Sci. 1991. V. 48. P. 1437–1445.
Bernatchez L., Glemet H., Wilson C.C., Danzmann R.G. Introgression and fixation of Arctic char (Salvelinus alpinus) mitochondrial genome in an allopatric population of brook trout (S. fontinalis) // Can. J. Fish. Aquat. Sci. 1995. V. 52. P. 179–185.
Baxter J.S., Taylor E.B., Devlin R.H. et al. Evidence for natural hybridization between Dolly Varden (Salvelinus malma) and bull trout (S. confluentus) in a north central British Columbia // Can. J. Fish. Aquat. Sci. 1997. V. 54. P. 421–429.
Glemet H., Blier P., Bernatchez L. Geographical extent of Arctic char (Salvelinus alpinus) mtDNA introgression in brook char populations (S. fontinalis) from eastern Quebec, Canada // Mol. Ecol. 1998. V. 7. P. 1655–1662.
Гудков П.К. Гибрид гольца рода Salvelinus (Salmonidae) из района Тауйской Губы Охотского моря // Тр. Сах. НИРО. 2002. Т. 4. С. 270–276.
Kanda N., Leary R.F., Allendorf F.W. Evidence of introgressive hybridization between bull trout and brook trout // Trans. Amer. Fish. Soc. 2002. V. 131. P. 772–782.
Радченко О.А. Интрогрессивная гибридизация гольцов рода Salvelinus по данным об изменчивости митохондриальной ДНК // Генетика. 2004. Т. 40. № 12. С. 1678–1685.
Davidson W.S., Koop B.F., Jones S.J.M. et al. Sequencing the genome of the Atlantic salmon (Salmo salar) // Genome Biol. 2010. V. 11. P. 403. https://doi.org/10.1186/gb-2010-11-9-403
May-McNally S.L., Quinn T.P., Taylor E.B. Low level of hybridization between sympatric Arctic char (Salvelinus alpinus) and Dolly Varden char (S. malma) higlights their genetic distinctiveness and ecological segregation // Ecol. Evol. 2015. V. 5. P. 3031–3045. https://doi.org/10.1002/ece3.1583
Redenbach Z., Taylor E.B. Evidence for historical introgression along a contact zone between two species of char (Pisces: Salmonidae) in Northwestern North America // Evolution. 2002. V. 56. P. 1021–1035. https://doi.org/10.1111/j.0014-3820.2002.tb01413.x
Mavarez J., Audet C., Bernatchez L. Major disruption of gene expression in hybrids between young sympatric anadromous and resident populations of brook charr (Salvelinus fontinalis Mitchill) // J. Evol. Biol. 2009. V. 22. P. 1708–1720. https://doi.org/10.1111/j.1420-9101.2009.01785.x
Груздева М.А., Кузищин К.В., Семенова А.В. и др. О гибридах между кунджей Salvelinus leucomaenis и мальмой Salvelinus malma в реке Утхолок (Северо-Западная Камчатка) // Сохранение биоразнообразия Камчатки и прилегающих морей: Матер. XVIII межд. науч. конф. Петропавловск-Камчатский: Камчатпресс, 2017. С. 84–88.
Груздева М.А., Кузищин К.В., Семенова А.В. и др. Редкий случай перманентной интрогрессивной гибридизации у гольцов рода Salvelinus (Salmonidae, Salmoniformes) в реке Утхолок, Западная Камчатка // Биология моря. 2018. Т. 44. № 6. С. 381–389. https://doi.org/10.1134/S1063074018060056
Павлов Д.С., Кириллов П.И., Кириллова Е.А. и др. Состояние биоразнообразия лососевых рыб и рыбообразных и среды их обитания в бассейне реки Утхолок. М.: Тов-во науч. изданий КМК, 2016. 197 с.
Пичугин М.Ю. Особенности роста и развития скелета ранней молоди северной мальмы Salvelinus malma malma из рек Западной Камчатки в связи с температурным режимом нерестилищ // Вопр. ихтиологии. 2015. Т. 55. № 4. С. 435–452. https://doi.org/10.7868/S0042875215040128
Ivanova N.V., Zemlak T.S., Hanner R.H., Hebert P.D.N. Universal primer cocktails for fish DNA barcoding // Mol. Ecol. Notes. 2007. V. 7. P. 544–548.https://doi.org/10.1111/j.1471-8286.2007.01748.x
Crane P.A., Lewis C.J., Kretschmer E.J. et al. Characterization and inheritance of seven microsatellite loci from Dolly Varden, Salvelinus malma, and cross-species amplification in Arctic char, S. alpinus // Conserv. Genet. 2004. V. 5. P. 737–741.
Estoup A., Presa P., Krieg F. et al. (CT)n and (GT)n microsatellites: a new class of genetic markers for Salmo trutta L. (brown trout) // Heredity. 1993. V. 71. P. 488–496.
Slettan A., Olsaker I., Lie O. Isolation and characterization of variable (GT)n repetitive sequences from Atlantic salmon, Salmo salar L. // Animal Genet. 1993. V. 24. P. 195–197.
Dehaan P.W., Ardren W.R. Characterization of 20 highly variable tetranucleotide microsatellite loci for bull trout (Salvelinus confluentus) and cross-amplification in other Salvelinus species // Mol. Ecol. Notes. 2005. V. 5. P. 582–585. https://doi.org/10.1111/j.1471-8286.2005.00997.x
Yamaguchi K., Nakajima M., Taniguchi N. Development of microsatellite markers in the Japanese char Salvelinus leucomaenis and its application to closely related species // Fish Genet. Breed. Sci. 2008. V. 38. P. 123–130.
Van Oosterhout C., Hutchinson W.F., Wills D.P.M., Shipley P. MICRO-CHECKER: software for identifying and correcting genotyping errors in microsatellite data // Mol. Ecol. Notes. 2004. V. 4. P. 535–538.https://doi.org/10.1111/j.1471-8286.2004.00684.x
Rousset F. Genepop’007: a complete reimplementation of the Genepop software for Windows and Linux // Mol. Ecol. Resources. 2008. V. 8. P. 103–106. https://doi.org/10.1111/j.1471-8286.2007.01931.x
Goudet J. FSTAT, a program to estimate and test gene diversities and fixation indices (version 2.9.3). 2001. http://www2.unil.ch/popgen/softwares/fstat.htm.
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.
Anderson E.C., Thompson E.A. A model-based method for identifying species hybrids using multilocus genetic data // Genetics. 2002. V. 160. P. 1217–1229.
Belkhir K., Borsa P., Chikhi L. et al. GENETIX 4.05: population genetics software for Windows TM. Université de Montpellier II, Montpellier. 2004. http://www. genetix.univ-montp2.fr/genetix/intro.htm.
Салменкова Е.А., Омельченко В.Т., Радченко О.А. и др. Генетическая дивергенция гольцов рода Salvelinus Кроноцкого озера (полуостров Камчатка) // Генетика. 2005. Т. 41. № 8. С. 1096–1107.
Салменкова Е.А., Омельченко В.Т., Афанасьев К.И. и др. Генетическая дивергенция популяций белого гольца Salvelinus albus, северной и южной форм мальмы S. malma (Salmonidae) по микросателлитным локусам ДНК // Вопр. ихтиологии. 2009. Т. 49. № 6. С. 752–762.
Gordeeva N.V., Chukova E.I., Oleinik A.G. Microsatellite genetic variation of Asian populations of Dolly Varden char // Hydrobiologia. 2010. V. 650. P. 133–144.https://doi.org/10.1007/s10750-010-0104-3
Афанасьев К.И., Рубцова Г.А., Шайхаев Е.Г., Животовский Л.А. Микросателлитная изменчивость кунджи Salvelinus leucomaenis Сахалинской области // Генетика. 2013. Т. 49. № 9. С. 1088–1092.
Салменкова Е.А., Омельченко В.Т., Рубцова Г.А. и др. Популяционно-генетическая дифференциация кунджи Salvelinus leucomaenis (Pallas) российского Дальнего Востока // Генетика. 2014. Т. 50. № 1. С. 52–61.
Yamamoto S., Morita K., Koizumi I., Maekawa K. Genetic differentiation of white-spotted charr (Salvelinus leucomaenis) populations after habitat fragmentation: spatial–temporal changes in gene frequencies // Conserv. Genet. 2004. V. 5. P. 529–538. https://doi.org/10.1023/B:COGE.0000041029.38961.a0
Yamaguchi K., Nakajima M., Taniguchi N. Loss of genetic variation and increased population differentiation in geographically peripheral populations of Japanese char Salvelinus leucomaenis // Aquaculture. 2010. V. 308. P. S20–S27. https://doi.org/10.1016/j.aquaculture.2010.07.032
Oleinik A.G., Skurikhina L.A., Brykov V.A. Divergence of Salvelinus species from northeastern Asia based on mitochondrial DNA // Ecol. Fresh. Fish. 2007. V. 16. P. 87–98. https://doi.org/10.1111/j.1600-0633.2006.00187.x
Олейник А.Г., Скурихина Л.А., Кухлевский А.Д. Вторичный контакт между двумя дивергентными линиями гольцов рода Salvelinus в Северо-Западной Пацифике // Генетика. 2017. Т. 53. № 11. С. 1297–1310.
Osinov A.G., Senchukova A.L., Mugue N.S. et al. Speciation and genetic divergence of three species of charr from ancient Lake El’gygytgyn (Chukotka) and their phylogenetic relationships with other representatives of the genus Salvelinus // Biol. J. Linn. Soc. 2015. V. 116. P. 63–85.
Crête-Lafrenière A., Weir L.K., Bernatchez L. Framing the Salmonidae family phylogenetic portrait: a more complete picture from increased taxon sampling // PLoS One. 2012. V. 7. e46662.
Lecaudey L.A., Schliewen U.K., Osinov A.G. et al. Inferring phylogenetic structure, hybridization and divergence times within Salmoninae (Teleostei: Salmonidae) using RAD-sequencing // Mol. Ph. Evol. 2018. V. 124. P. 82–99. https://doi.org/10.1016/j.ympev.2018.02.022
Осинов А.Г. Северная форма мальмы Salvelinus malma Азии и Северной Америки: аллозимная изменчивость, генетическая дифференциация и происхождение // Вопр. ихтиологии. 2002. Т. 42. № 5. С. 664–677.
Oleinik A.G., Skurikhina L.A., Bondar E.I., Brykov V.A. Phylogeography of Northern Dolly Varden Salvelinus malma (Salmoniformes: Salmonidae) from Asia and North America: an analysis based on the mitochondrial DNA genealogy // J. Ichthyol. 2013. V. 53. P. 820–832. https://doi.org/10.1134/S003294521310007X
Yamamoto S., Kitano S., Maekawa K. et al. Introgressive hybridization between Dolly Varden Salvelinus malma and white-spotted char Salvelinus leucomaenis on Hokkaido Island, Japan // J. Fish Biol. 2006. V. 68. Suppl. A. P. 68–85. https://doi.org/10.1111/j.0022-1112.2006.00994.x
Vähä J.P., Primmer C. Efficiency of model-based Bayesian methods for detecting hybrid individuals under different hybridization scenarios and with different numbers of loci // Mol. Ecol. 2006. V. 15. P. 63–72. https://doi.org/10.1111/j.1365-294X.2005.02773.x
Гриценко О.Ф. О гибриде гольца с кунджей (Salvelinusalpinus (L.) × S. leucomaenis (Pallas)) // Зоол. журн. 1970. Т. XLIX. Вып. 8. С. 1252–1253.
Осинов А.Г., Павлов С.Д. Аллозимная изменчивость и генетическая дивергенция популяций арктического гольца и мальмы (Salvelinus alpinus–S. malma complex) // Вопр. ихтиологии. 1998. Т. 38. №1. С. 47–61.
McPhail J.D. A systematic study of the Salvelinus alpinus complex in North America // J. Fish. Res. Board. Can. 1961. V. 31. P. 1408–1414.
Behnke R.J. Interpreting the phylogeny of Salvelinus // Physiol. Ecol. Japan. Spec. 1989. V. 1. P. 35–48.
Behnke R.J. Trout and Salmon of North America. N.Y.: The Free Press, 2002. 359 p.
Haas G.R., McPhail J.D. The systematics, zoogeography and evolution of Dolly Varden (Salvelinus malma) and bull trout (S. confluentus) in North America // Can. J. Fish. Aquat. Sci. 1991. V. 48. P. 2191–2211.
Kobayashi I., Takano O. Records of major and minor transgression and regression events in the Paleo Sea of Japan during late Cenozoic // Revista Mexicana Ciencias Geologicas. 2001. V. 19. P. 226–234.
Taylor E.B., Redenbach Z., Costello A.B. et al. Nested analysis of genetic diversity in Northwest North American char, Dolly Varden (Salvelinus malma) and bull trout (S. confluentus) // Can. J. Fish. Aquat. Sci. 2001. V. 58. P. 406–420. https://doi.org/10.1139/f00-262
Zachos J., Pagani M., Sloan L. et al. Trends, rhythms, and aberrations in global climate 64 Ma to present // Science. 2001. V. 292. P. 686–693. https://doi.org/10.1126/science.1059412
Олейник А.Г., Скурихина Л.А., Брыков В.А. Филогения гольцов рода Salvelinus по данным анализа митохондриальной ДНК // Генетика. 2015. Т. 51. № 1. С. 63–77.
Dowling T.E., Broughton R.E., DeMarais B.D. Significant role for historical effects in the evolution of reproductive isolation: evidence from patterns of introgression between the cyprinid fishes, Luxilus cornutus and Luxilus chrysocephalus // Evolution. 1997. V. 51. P. 1574–1583. https://doi.org/10.1111/j.1558-5646.1997.tb01480.x
Redenbach Z.A. Molecular evidence of current and historical introgressive hybridization between bull trout (Salvelinus confluentus) and Dolly Varden (S. malma). M.S. thesis. Vancouver: Univ. British Columbia, 2000. 78 p.
Redenbach Z., Taylor E.B. Evidence for historical introgression along a contact zone between two species of char (Pisces: Salmonidae) in northwestern North America // Evolution. 2002. V. 56. P. 1021–1035. https://doi.org/10.1111/j.0014-3820.2002.tb01413.x
Billington N., Hebert P.D.N. Mitochondrial DNA diversity in fishes and its implications for introductions // Can. J. Fish. Aquat. Sci. 1991. V. 48. P. 80–94.
Leary R.F., Allendorf F.W., Forbes S.H. Conservation genetics of bull trout in the Columbia and Klamath River drainages // Conserv. Biol. 1993. V. 7. P. 856–865.
McPhail J.D., Taylor E.B. The Skagit Char Project. Seattle: Skagit Environmental Endowment Commission, 1995. 112 p.
Hagen J., Taylor E.B. Resource partitioning as a factor limiting gene flow in hybridizing populations of Dolly Varden char (Salvelinus malma) and bull trout (S. confluentus) // Can J. Fish. Aquat. Sci. 2001. V. 58. P. 2037–2047. https://doi.org/10.1139/f01-141
Rieman B.E., Peterson J.T., Myers D.L. Have brook trout (Salvelinus fontinalis) displaced bull trout (S. confluentus) along longitudinal gradients in central Idaho streams? // Can. J. Fish. Aquat. Sci. 2006. V. 63. P. 63–78. https://doi.org/10.1139/f05-206
Пичугин М.Ю., Кириллова Е.А., Кириллов П.И. Особенности нерестовых участков кунджи и описание ее личинок из рек Западной Камчатки // Материалы IX межд. научн. конф. “Сохранение биоразнообразия Камчатки и прилегающих морей”. Петропавловск-Камчатский: Камчатпресс, 2008. С. 103–106.
Савваитова К.А., Кузищин К.В., Пичугин М.Ю. и др. Систематика и биология кунджи Salvelinus leucomaenis // Вопр. ихтиологии. 2007. Т. 47. № 1. С. 58–71. https://doi.org/10.1134/S0032945207010067
Павлов Д.С., Савваитова К.А., Кузищин К.В. и др. Состояние и мониторинг биоразнообразия лососевых рыб и среды их обитания на Камчатке (на примере территории заказника “Река Коль”). М.: Тов-во науч. изданий КМК, 2009. 156 с.
McGowan C., Davidson W.S. Unidirectional natural hybridization between brown trout (Salmo trutta) and Atlantic salmon (S. salar) in Newfoundland // Can. J. Fish. Aquat. Sci. 1992. V. 49. P. 1953–1958. https://doi.org/10.1139/f92-216
Wilson C.C., Hebert P.D.N. Natural hybridization between Arctic char (Salvelinus alpinus) and lake trout (S. namaycush) in the Canadian Arctic // Can. J. Fish. Aquat. Sci. 1993. V. 50. P. 2652–2658. https://doi.org/10.1139/f93-288
Kitano S., Maekawa K., Nakano S., Faush K.D. Spawning behavior of bull trout in the upper Flathead drainage, Montana, with special reference to hybridization with brook trout // Trans. Amer. Fish. Soc. 1994. V. 123. P. 988–992.
DeHaan P.W., Schwabe L.T., Ardren W.R. Spatial patterns of hybridization between bull trout, Salvelinus confluentus, and brook trout, S. fontinalis in an Oregon stream network // Conserv. Genet. 2010. V. 11. P. 935–949. https://doi.org/10.1007/s10592-009-9937-6
Дополнительные материалы отсутствуют.


