Генетика, 2020, T. 56, № 1, стр. 35-46
Неканонические функции рибосомного повтора человека
Е. С. Ершова 1, 2, М. С. Конькова 1, Е. М. Малиновская 1, С. И. Куцев 1, Н. Н. Вейко 1, *, С. В. Костюк 1, 2, **
1 Медико-генетический научный центр им. академика Н.П. Бочкова
115478 Москва, Россия
2 Первый Московский государственный медицинский университет им. И.М. Сеченова
119991 Москва, Россия
* E-mail: satelit32006@yandex.ru
** E-mail: svet.kostyuk@gmail.com
Поступила в редакцию 07.02.2019
После доработки 01.04.2019
Принята к публикации 30.05.2019
Аннотация
Рибосомные гены кодируют рибосомную РНК (рРНК), которая является составной частью рибосом. Основная функция рибосомных генов в клетке – это синтез рРНК. Однако рибосомные гены могут выполнять и другие функции в организме. Было обнаружено, что ДНК рибосомных генов (рДНК) является активной биомолекулой, которую можно отнести к семейству DAMPs (danger-associated molecular pattern molecules). Три необычные характеристики рДНК придают ей свойства DAMPs-молекулы: 1) большое содержание неметилированных мотивов CpG – лигандов ДНК-сенсоров TLR9; 2) низкий окислительный потенциал и 3) устойчивость к фрагментации при накоплении однонитевых разрывов в цепях рДНК. Благодаря этим свойствам фрагменты рДНК накапливаются в составе циркулирующей внеклеточной ДНК и стимулируют TLR9–MyD88–NF-kB-сигнальный путь в различных клетках организма. Окисленная рДНК проникает внутрь клеток, где может стимулировать другие ДНК-сенсоры (AIM2, RIG1, STING). Внеклеточная окисленная рДНК достигает структур ядрышка и влияет на уровень рРНК в клетке. Организм защищается от избытка внеклеточной рДНК путем выработки антител к рДНК, которые образуют гораздо более прочные комплексы с рДНК, чем обычные антитела к двуспиральной ДНК. Внеклеточную рДНК целесообразно изучать дальше как потенциальную мишень при терапии аутоиммунных, онкологических и сердечно-сосудистых заболеваний.
Центральным событием в эукариотической клетке является синтез белка (трансляция). Синтез белка осуществляется молекулярными машинами – рибосомами. Рибосома человека состоит из двух основных компонентов – рибосомной РНК четырех типов (18S, 5.8S, 28S и 5S) и примерно 70–80 рибосомных белков. Рибосомная РНК (рРНК) и рибосомные белки образуют структуру, состоящую из двух субъединиц, которая осуществляет процесс трансляции [1]. Гены 28S, 5.8S и 18S рРНК (рДНК) в геноме человека представлены множественными копиями. Диплоидный геном человека содержит в среднем ~400 копий рДНК, которые организованы в тандемные повторы длиной 43 тпн на пяти парах акроцентрических хромосом. Каждая единица повтора включает транскрибируемую область, содержащую гены 28S, 5.8S и 18S рРНК (47S рРНК) длиной 13.3 тпн и нетранскрибируемый межгенный спейсер (рис. 1,а). Вместе с копиями 5S рРНК (гены расположены на первой хромосоме) эти рРНК формируют рибосомы [2].
Рис. 1.
Структурно-функциональная характеристика рибосомного повтора человека. а – схема рибосомного повтора человека. pBR322-rDNA – зонд на область ТО-рДНК, используемый в гибридизации; б – фракции (1–4) рибосомных генов в составе ядрышка; в – распределение CpG-мотивов и (dG)n-мотивов в ТО-рДНК, мтДНК и во фрагменте ДНК E. coli.
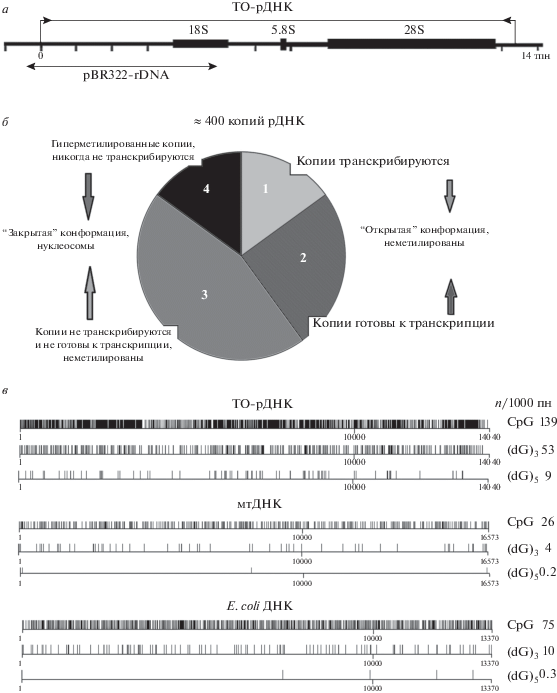
Рибосомные РНК составляют до 80% всей клеточной РНК. В растущей эукариотической клетке каждую минуту синтезируются тысячи рибосом. Таким образом, основная (каноническая) функция рибосомных повторов – это синтез рРНК для рибосом. Транскрипция рДНК осуществляется РНК-полимеразой I в особой клеточной структуре в составе ядра – в ядрышке. Удивительно, но далеко не все копии рДНК транскрибируются даже в активно растущих клетках, где велика потребность в рибосомах. Способность копии рДНК к транскрипции зависит от ее конформации и эпигенетической модификации (метилирования цитозина в сайте CpG). Условно все копии рДНК можно разделить на четыре фракции [3, 4], представленные на рис. 1,б. Суммарную фракцию 1 и 2 называют потенциально активными копиями рДНК. Эти копии неметилированы и содержат модифицированные гистоны H3K4me3 и H3K9ac, которые обычно ассоциированы с транскрипционно активными копиями генов [3]. Количество фракции 1 (реально транскрибируемые в данный момент времени копии рДНК) зависит от потребности клетки в рибосомах. При активном росте и пролиферации размер этой фракции увеличивается. В условиях снижения уровня белкового синтеза фракция 1 уменьшается. По приблизительным оценкам количество потенциально активных копий рДНК в геноме млекопитающих составляет 30–50% от всех копий рДНК [5, 6]. Фракция 3 – это неактивные неметилированные или малометилированные копии рДНК. Предполагается, что эти копии находятся в тех же структурах ядрышка, что и потенциально активные копии, и необходимы для нормального функционирования ядрышка. Копии фракции 3 неактивны, по-видимому, вследствие метилирования некоторых CpG-сайтов в области промотора рДНК [2]. Эти копии содержат нуклеосомы (“закрытая конформация”). Фракция 4 включает неактивные гиперметилированные копии рДНК. Метилирована вся транскрибируемая область рДНК, а не только область промотора. Эти копии локализованы на периферии ядрышка и входят в состав гетерохроматина, окружающего ядрышко. Гиперметилированные копии рДНК встречаются примерно в 20% геномов человека [7]. Эти копии элиминируются из генома в процессе старения [8].
Для функционирования эукариотической клетки важны все типы копий рДНК (как транскрипционноактивные, так и неактивные). Снижение числа неактивных копий приводит к нестабильности всего хроматина ядра, повышает чувствительность клетки к повреждающим воздействиям и способствует ускоренному старению клеток [9, 10]. Уже один этот факт указывает на другие функции рДНК, помимо синтеза рРНК для рибосом. Известно, что ядрышко способно накапливать белки, которые не принимают участия в биогенезе рибосом. Рибосомные гены являются своеобразным временным “хранилищем” многих факторов, которые важны для функционирования всего генома клетки [2]. В последнее десятилетие авторов интересует еще одна новая неканоническая функция рибосомного повтора – способность рДНК выступать в роли активной внеклеточной биомолекулы, которая существенным образом влияет на функционирование генома клетки.
Патоген-ассоциированный пул биомолекул (pathogen-associated molecular pattern molecules, PAMPs) – это набор различных молекул, входящих в состав бактерий и вирусов [11]. Эти молекулы, например бактериальные ДНК и РНК или липополисахариды, обладают различными структурами, которые опознаются клетками иммунной системы с целью развития защитной реакции от патогена. Клетки млекопитающих содержат несколько типов рецепторов, которые опознают PAMPs [12]. В 1994 г. Matzinger [13, 14] впервые высказал предположение о том, что иммунная система распознает не только патогены, но и фрагменты собственных биомолекул, которые образуются при гибели клеток или при ответе клеток на воспаление, гипоксию, стресс в условиях, когда патоген отсутствует. Совокупность эндогенных биомолекул организма, которые воздействуют на клетки того же самого организма, получила название “пул молекул, ассоциированных с повреждением” (danger-associated molecular pattern molecules (DAMPs) по аналогии с PAMPs [15, 16].
Набор DAMPs достаточно широк. В здоровой клетке потенциальные биомолекулы DAMPs могут выполнять самые различные физиологические функции. Однако после высвобождения из поврежденных и погибших клеток эти биомолекулы проявляют выраженную биологическую активность в отношении здоровых клеток организма. Наиболее хорошо описаны такие члены семейства DAMPs, как белок HMGB1, белок S100, белки теплового шока, β-defensins, cathelicidin hCAP1/LL-37, гистоны, бета-амилоид, сахара, фибрин, фибронектин, метаболиты пуринового обмена [17]. DAMPs могут активировать те же самые рецепторы, что и PAMPs. Нуклеиновые кислоты также рассматривают в роли DAMPs [18]. При гибели клеток хроматин клеток фрагментируется и служит основным источником внеклеточной ДНК (вкДНК). ВкДНК интенсивно изучается как маркер самых различных заболеваний [19–21]. Биологическая функция вкДНК изучена в гораздо меньшей степени. Довольно долго предполагали, что ДНК млекопитающих не влияет на клетки иммунной системы. Однако в настоящее время эта точка зрения изменилась. Было показано, что вкДНК и ДНК клеток (клДНК) значительно различаются по содержанию повторяющихся и уникальных последовательностей [22–26], уровню окислительной модификации оснований [27] и уровню метилирования [28–30].
Известно, что в составе вкДНК накапливаются GC-богатые последовательности генома (GC-ДНК). ВкДНК здоровых людей содержит в среднем 54% GC-пар [31], клеточная ДНК – 42% [32]. GC-ДНК могут стимулировать сигнальный путь TLR9–MyD88–NF-kB [33, 34]. ДНК-сенсор TLR9 узнает неметилированный CpG-мотив в бактериальной ДНК [35]. Геном человека примерно в одинаковых количествах содержит три основных GC-богатых умеренных повтора: кольцевая митохондриальная ДНК (мтДНК), теломерный повтор и транскрибируемая область рибосомного тандемного повтора. В составе вкДНК накапливаются все три повтора. Большинство авторов основное внимание уделяют иммуномодулирующему действию внеклеточной мтДНК [36–43]. В меньшей степени исследована внеклеточная теломерная ДНК [44–47], которая, в отличие от мтДНК, способна блокировать активность рецепторов TLR9. Рибосомный повтор в составе вкДНК пока что привлек внимание только нашего научного коллектива. Отчасти этот факт можно объяснить трудностями количественного анализа транскрибируемой области рДНК как в составе клеточной ДНК, так и особенно в составе поврежденных фрагментов вкДНК [24, 48].
В данном обзоре мы впервые обобщили и обсудили проблемы, связанные с количественным анализом внеклеточной рДНК и с ее биологическим действием на клетки человека.
СВОЙСТВА ПОСЛЕДОВАТЕЛЬНОСТИ рДНК
ТО-рДНК – потенциальный лиганд для TLR9
Транскрибируемая область рибосомного повтора человека (ТО-рДНК) – это GC-богатая последовательность. Различные участки ТО-рДНК содержат от 60 до 85% GC-пар. Мы сравнили последовательности классического лиганда TLR9 (фрагмент ДНК Е. coli), ТО-рДНК и мтДНК (рис. 1,в). МтДНК (16.5 тпн), как и ТО-рДНК (13.3 тпн), присутствует в геноме лимфоцитов человека в числе несколько сотен копий [8, 48]. МтДНК содержит большое число неметилированных мотивов CpG, которые придают внеклеточной мтДНК свойства лиганда TLR9 [36–43, 49]. В этом отношении мтДНК является аналогом бактериальной ДНК (рис. 1,в) ТО-рДНК содержит еще больше мотивов CpG, чем мтДНК или бактериальная ДНК (139 копий CpG/1 тпн в сравнении с 26 или 75 копиями CpG/1 тпн). Большинство копий рДНК содержат неметилированные мотивы CpG [50]. Таким образом ТО-рДНК превосходит бактериальную ДНК и мтДНК по содержанию потенциальных участков связывания с рецепторами TLR9.
ТО-рДНК очень легко окисляется
Несмотря на одинаково высокий GC-состав, последовательность ТО-рДНК существенно отличается от мтДНК или бактериальной ДНК присутствием большого числа мотивов (dG)n (n > 2) (рис. 1,в). Мотивы (dG)n интересны тем, что dG в их составе имеет самый низкий потенциал окисления из всех нуклеозидов в составе ДНК [51]. Мы сравнили уровень окисления фрагментов ТО-рДНК и бактериальных фрагментов одинакового GC-состава [52] в обычных условиях и в условиях повышенного уровня синтеза активных форм кислорода (АФК). При инкубировании с клетками, продуцирующими на поверхности синтез АФК, или в присутствии АФК в растворе ТО-рДНК содержала в несколько раз больше маркера окисления 8-oxo-dG, чем бактериальная ДНК, что подтверждает более низкий окислительный потенциал ТО-рДНК по сравнению с бактериальными GC-богатыми ДНК.
ТО-рДНК относительно устойчива к деградации до низкомолекулярных фрагментов
В ряде работ мы исследовали устойчивость ТО-рДНК к фрагментации при действии эндонуклеаз и других агентов, вызывающих образование однонитевых разрывов в цепях ДНК [24, 53, 54]. Это свойство важно, поскольку от молекулярной массы фрагмента циркулирующей вкДНК зависит ее элиминация из кровотока. Ряд ферментов – ДНКаз принимают участие во фрагментации клеточной и внеклеточной ДНК. Большинство ДНКаз вносят в ДНК однонитевые разрывы. При накоплении однонитевых разрывов возникает двунитевой разрыв и молекулярная масса ДНК снижается. Мы установили, что уже на уровне первичной последовательности (в составе выделенной из здоровых клеток ДНК) ТО-рДНК устойчива к двунитевой фрагментации [24, 53]. При одинаковом числе однонитевых разрывов ТО-рДНК, по сравнению с другими повторами генома, в растворе существует в виде высокомолекулярных фрагментов. На уровне клеток мы обнаружили тот же эффект. При токсичном воздействии и при окислительном стрессе в составе выделенной ДНК апоптотических клеток ТО-рДНК содержится в виде длинных фрагментов [24]. Наконец, мы напрямую показали, что фрагменты рДНК, внутривенно введенные крысам, гораздо медленнее элиминируются из кровотока и остаются более высокомолекулярными, чем другие фрагменты крысиной ДНК [54]. Относительная устойчивость ТО-рДНК к фрагментации при накоплении однонитевых разрывов позволяет предположить, что ТО-рДНК накапливается в составе циркулирующей вкДНК.
МЕТОДЫ КОЛИЧЕСТВЕННОГО АНАЛИЗА ВНЕКЛЕТОЧНОЙ ТО-рДНК
Анализ вкДНК имеет несколько ограничений. Основной источник вкДНК – погибшие клетки организма. Апоптоз предполагает значительную фрагментацию ДНК клеток. Частой причиной гибели клеток является окислительный стресс, который сопровождается окислительной модификацией ДНК. Внеклеточная среда, где циркулирует вкДНК, содержит ферменты, гидролизующие ДНК. Таким образом, вкДНК, как правило, сильно фрагментирована, содержит однонитевые разрывы и окислена. Уровень окисления вкДНК даже здоровых людей на порядки превышает уровень окисления ДНК клеток [27, 55]. Поскольку рДНК содержит много легкоокисляющихся мотивов, уровень окисления этого повтора будет выше, чем остальных фрагментов вкДНК. Существуют два основных метода, с помощью которых можно исследовать содержание ТО-рДНК в составе вкДНК, – количественная ПЦР (qPCR) и нерадиоактивная количественная гибридизация (NQH).
qPCR
И геномная ТО-рДНК и особенно внеклеточная ТО-рДНК являются проблемными объектами для количественного анализа с использованием общепризнанного метода qPCR [24, 48]. Мы обнаружили значительное снижение эффективности для ТО-рДНК по сравнению с геном-стандартом B2M2 (1.85 vs 1.99). Величина d(Ct) = = CtB2M2 − CtрДНК варьирует от +5 до –10 [56], что также свидетельствует о низкой эффективности ПЦР в случае рДНК. Низкая эффективность ПЦР обусловлена тандемной природой рибосомного повтора, наличием самокомплементарных участков в рДНК, гетерогенностью копий рДНК с точки зрения метилирования. Кроме того, рДНК содержит разрывы даже в нормальных клетках и легко окисляется, а репарация рибосомного повтора снижена, по сравнению с другими последовательностями. Эффективность ПЦР еще больше снижается в случае анализа образцов вкДНК [48]. Таким образом, метод qPCR практически неприменим для анализа внеклеточной ТО-рДНК.
NQH
Во многих отношениях метод NQH проигрывает методу qPCR. Этот метод неприменим к анализу малокопийных последовательностей и уникальных генов, он требует намного больших количеств ДНК, чем qPCR. Однако метод NQH мало зависит от уровня повреждения анализируемой ДНК. Сигнал снижается только в случае очень сильно фрагментированных образцов ДНК, которые в практике редко встречаются. Для количественного анализа ТО-рДНК в составе вкДНК мы применяем исключительно метод NQH. Поскольку NQH менее чувствителен, чем qPCR, для проведения количественного анализа внеклеточной рДНК, как правило, требуется не меньше 1 мл плазмы.
ФРАГМЕНТЫ ТО-рДНК НАКАПЛИВАЮТСЯ В СОСТАВЕ вкДНК
Циркулирующая вкДНК содержит больший процент GC-пар, чем клеточная ДНК [31]. ТО-рДНК – один из самых протяженных GC-богатых повторов генома. В ряде работ мы показали, что в составе вкДНК человека, как правило, в несколько раз увеличено содержание ТО-рДНК. В табл. 1 приводятся данные, отражающие изменение содержания ТО-рДНК во вкДНК по сравнению с клеточной ДНК. В диплоидном геноме человека содержание ТО-рДНК варьирует от 0.8 до 2.9 пг/нг клеточной ДНК (медиана 1.65 пг/нг), что соответствует 200–700 копиям рДНК [8]. Во вкДНК здоровых людей содержание ТО-рДНК увеличено в 1.5–2 раза по сравнению с клеточной ДНК тех же людей. Содержание ТО-рДНК значительно возрастает при хронических заболеваниях (сердечно-сосудистые заболевания, ревматоидный артрит) и при хроническом внешнем повреждающем воздействии (например, работа в условиях повышенного радиационного фона). При этом, как правило, общая концентрация вкДНК в плазме больных или хронически облучаемых людей снижается, иногда очень значительно, по сравнению с нормой на фоне значительного увеличения активности ДНКазы I плазмы крови [25, 27, 57, 58].
Таблица 1.
Содержание ТО-рДНК в составе вкДНК*
| Тип ДНК |
Группа | ТО-рДНК, пг/нг ДНК | R (вкДНК/клДНК) |
Объем выборки | |
|---|---|---|---|---|---|
| медиана | интервал | ||||
| Клеточная (кл) ДНК | Здоровые люди | 1.65 | 0.8–2.9 | 1 | 651 |
| Внеклеточная (вк) ДНК | Здоровые люди | 2.9 | 0.7–14.1 | 1.7 | 187 |
| Атеросклероз | 16.5 | 0.4–124 | 10 | 30 | |
| Ишемическая болезнь | 18 | 5–41 | 11 | 18 | |
| Гипертония | 10.2 | 0.5–15 | 6.2 | 64 | |
| Инфаркт миокарда | 9.6 | 0.1–40.2 | 5.8 | 7 | |
| Инсульт | 2.2 | 0.1–7.2 | 1.3 | 19 | |
| Ревматоидный артрит | 6.5 | 0.1–21.3 | 3.9 | 14 | |
| Ионизирующее излучение | 4.8 | 0.3–151 | 4.9 | 329 | |
Схема, приведенная на рис. 2, отражает механизм накопления GC-богатых последовательностей генома в составе вкДНК. При остром процессе, который сопровождается гибелью большого числа клеток (например, инсульт, инфаркт, травма, ионизирующее излучение), в первые часы в циркуляцию поступает большое количество ДНК из погибающих клеток. В наших работах мы тестировали два повтора генома человека в составе вкДНК – ТО-рДНК и АT-богатый повтор сателлита 3 (1q12), SatIII [23, 58, 59]. В случае высокой концентрации вкДНК (высокий уровень гибели клеток) содержание ТО-рДНК в составе вкДНК меньше, чем в составе клеточной ДНК (состояние 1, рис. 2). Содержание SatIII, напротив, выше, чем в геноме. Это объясняется различной локализацией повторов в структурах ядра и более активной деградацией АT-богатого повтора до низкомолекулярных фрагментов. Повтор SatIII (1q12) в интерфазном ядре локализован вблизи ядерной мембраны, рДНК – находится в закрытой структуре ядрышка. Часть копий рДНК прочно связана со структурами ядрышка и не экстрагируется из ядер даже при протеиназной обработке [60, 61]. Иными словами, при разрушении клеток повтор SatIII в относительно большем количестве поступает в межклеточную среду, чем ТО-рДНК.
Рис. 2.
Схема, иллюстрирующая образование пула вкДНК с измененными свойствами. Состояние 1 – острый процесс, клетки гибнут, ДНК клеток пополняет пул вкДНК. Увеличивается эндонуклеазная активность; состояние 2 – хронический процесс, уровень гибели клеток снижается, но эндонуклеазная активность остается высокой. Высокомолекулярные GC-богатые фрагменты накапливаются в составе вкДНК.
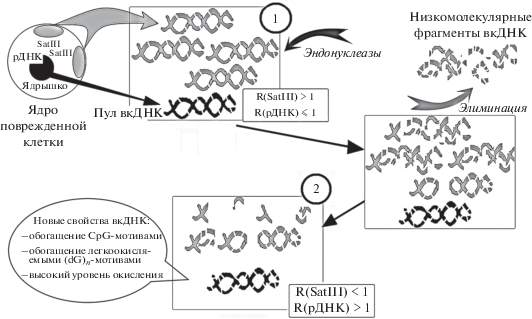
Когда острый процесс затихает или переходит в хроническую фазу, уровень гибели клеток снижается. В плазме к этому времени значительно возрастает эндонуклеазная активность. ВкДНК гидролизуется эндонуклеазами и фрагментируется до низкомолекулярных фрагментов, которые элиминируются из кровотока. Общая концентрация вкДНК и содержание АТ-богатых фрагментов снижаются, даже ниже исходного уровня, который был до заболевания или радиационного воздействия. GC-богатые фрагменты ДНК, в частности ТО-рДНК, устойчивы к фрагментации, несмотря на однонитевые разрывы, и циркулируют в виде высокомолекулярных фрагментов, которые элиминируются медленнее. В результате формируется пул вкДНК с измененными свойствами (состояние 2, рис. 2). Эта ДНК, во-первых, обогащена GC-парами, в том числе и неметилированными CpG-мотивами, которые опознаются рецепторами TLR9; во-вторых, содержит большое число окисленных и/или легкоокисляемых фрагментов (dG)n. Эти два новых свойства делают вкДНК биологически активной молекулой.
ТО-рДНК – АКТИВНАЯ DAMPs-МОЛЕКУЛА В ОРГАНИЗМЕ ЧЕЛОВЕКА
Клетки иммунной системы синтезируют специфические антитела к ТО-рДНК
На потенциальную биологическую активность ТО-рДНК указывает наличие специфичных антител, которые мы обнаружили в сыворотке крови человека [62] и крысы [63]. Сыворотки крови здоровых людей и больных системной красной волчанкой содержат антитела к ТО-рДНК, которые циркулируют как в свободном состоянии, так и в виде комплексов с вкДНК. Эти комплексы устойчивы при высокой ионной силе. Константы ассоциации этих комплексов на порядок выше, чем соответствующие константы обычных комплексов антител к двунитевой ДНК, которые присутствуют в сыворотке крови при заболевании системной красной волчанкой и практически не детектируются в сыворотке здоровых людей. По-видимому, иммунная система здорового человека вырабатывает специфические антитела к ТО-рДНК с целью инактивации и/или элиминации из кровотока этой активной DAMPs-молекулы, которая потенциально может провоцировать воспаление путем активации сигнального пути TLR9–MyD88–NF-kB – провоспалительные цитокины.
ТО-рДНК – активатор TLR9–MyD88–NF-kB сигнального пути
Для исследования биологической активности внеклеточных фрагментов ТО-рДНК на различные типы клеток мы применили две модели: 1) вкДНК выделяли из плазмы крови больных и здоровых людей и определяли содержание в ней ТО-рДНК; 2) использовали модельные конструкции, содержащие фрагменты ТО-рДНК в составе плазмид. Охарактеризованные по содержанию ТО-рДНК образцы вкДНК или модельные конструкции мы добавляли в среду культивирования клеток или в организм крыс.
ДНК-сенсоры TLR9 узнают неметилированные CpG-мотивы внеклеточной ДНК [64]. TLR9 экспрессируются, как на поверхности некоторых клеток, так и в эндосомах. Образование комплексов вкДНК с TLR9 в конечном счете активирует транскрипционный фактор NF-kB [33, 34]. ТО-рДНК содержит много неметилированных CpG-мотивов (рис. 1,в) и, следовательно, может быть лигандом TLR9. Действительно, значительное увеличение экспрессии TLR9 и белка-адаптера MyD88 в присутствии вкДНК с высоким содержанием ТО-рДНК или в присутствии модельных плазмид мы наблюдали в мезенхимных стволовых клетках [65], в лимфоцитах [59] и в эндотелиальных клетках (HUVEC) [66, 67] человека. Способность различных образцов вкДНК стимулировать экспрессию TLR9 и MyD88 в клетках человека возрастает в ряду: контроль < клеточная ДНК < вкДНК (здоровые) < вкДНК (больные инфарктом миокарда) < < вкДНК (больные ревматоидным артритом) ≈ ≈ E. coli ДНК ≈ модельные фрагменты ТО-рДНК.
Таким образом, вкДНК больных с высоким содержанием ТО-рДНК и клонированный фрагмент ТО-рДНК стимулируют экспрессию TLR9 и MyD88 в той же степени, что и бактериальная ДНК. Активация экспрессии TLR9 и MyD88 коррелирует с активацией экспрессии генов NF-kB сигнального пути (NFKB1A, IKBKB, NFRKB, REL, RELA, MAP3K1, MAP4K4). Доказательством активности фактора NF-kB в присутствии фрагментов ТО-рДНК являются его транслокация из цитоплазмы в ядро и экспрессия цитокинов [59, 65 ]. Лимфоциты человека, культивируемые в присутствии вкДНК с высоким содержанием ТО-рДНК и модельных фрагментов ТО-рДНК, секретируют в среду культивирования значительные количества цитокинов IL6 и TNFα. Интересно отметить, что ТО-рДНК является более сильным активатором экспрессии IL6, чем бактериальная ДНК [59]. Образцы клеточной ДНК, вкДНК здоровых доноров с низким содержанием ТО-рДНК и вектора без вставок рДНК модельных плазмид не активируют TLR9–MyD88–NF-kB-сигнальный путь и не стимулируют синтез цитокинов. Ниже описываются реакции различных типов клеток на действие фрагментов ТО-рДНК, в основе большинства которых лежит активация TLR9–MyD88–NF-kB-сигнального пути.
Лимфоциты человека. Фрагменты ТО-рДНК значительно увеличивают активность хроматина ядер лимфоцитов здоровых доноров [68, 69]. В присутствии ТО-рДНК наблюдаются перемещение гетерохроматина в ядре и активация транскрипции рДНК. Эти изменения соответствуют изменениям в лимфоцитах, облученных малыми (стимулирующими) дозами ионизирующего излучения, которые вызывают развитие адаптивного ответа [70]. Интересно отметить, что совместное действие ТО-рДНК и малых доз радиации блокирует адаптивный ответ [68].
Стволовые мезенхимные клетки человека (МСК). В стволовых клетках ТО-рДНК индуцирует кратковременный всплеск синтеза АФК и образование разрывов в ДНК ядер. В результате в клетках возрастает экспрессия генов репарации (BRCA1, PCNA) и антиапоптотических генов (BCL2, BCL2A1, BCL2L1, BIRC3, BIRC2). Фрагменты ТО-рДНК снижают активность каспаз и стимулируют синтез TNFα [65, 66, 71–73]. Прекондиционирование МСК путем культивирования в присутствии фрагментов ТО-рДНК приводит к значительному снижению уровня гибели клеток при действии больших доз ионизирующей радиации [65]. ТО-рДНК индуцирует дифференцировку стволовых клеток [73].
Эндотелиальные клетки человека (HUVEC). ВкДНК с высоким содержанием ТО-рДНК, выделенная из крови больных сердечно-сосудистыми заболеваниями, и модельные фрагменты ТО-рДНК стимулируют значительное увеличение уровня АФК в клетках HUVEC. Способность циркулирующей вкДНК стимулировать синтез АФК напрямую зависит от содержания ТО-рДНК в этой вкДНК [74]. ВкДНК влияет также на уровень синтеза окиси азота в эндотелиальных клетках [74–76]. Этот эффект нелинейно зависит от содержания ТО-рДНК в составе вкДНК. Низкие концентрации ТО-рДНК в среде культивирования (как в составе вкДНК здоровых людей, так и модельные фрагменты) значительно увеличивают синтез окиси азота. Высокие концентрации ТО-рДНК (в составе вкДНК больных сердечно-сосудистыми заболеваниями) снижают уровень окиси азота в эндотелиальных клетках пропорционально концентрации ТО-рДНК в среде культивирования [77, 78]. Можно предположить, что вкДНК с высоким содержанием ТО-рДНК, которая циркулирует в организме больных, изменяет функциональную активность клеток сосудистого эндотелия и должна рассматриваться в качестве одной из мишеней терапии.
Кардиомиоциты крысы. Содержание ТО-рДНК повышено у больных с ишемической болезнью сердца и инфарктом миокарда (табл. 1). Фрагменты ТО-рДНК (в составе вкДНК человека или модельных конструкций) снижают частоту сокращений культивируемых кардиомиоцитов крысы [79]. Снижение частоты сокращений кардиомиоцитов в культуре пропорционально содержанию ТО-рДНК в составе добавляемой циркулирующей ДНК больных острым инфарктом миокарда. Таким образом, циркулирующая вкДНК при инфаркте миокарда потенциально может значительно влиять на частоту сердечных сокращений у больного, вызывая брадикардию.
Влияние ТО-рДНК на артериальное давление у крыс SHR. Во вкДНК людей, больных артериальной гипертонией, как правило, повышается содержание ТО-рДНК (табл. 1). Однако существует небольшая подгруппа пациентов, у которых содержание ТО-рДНК значительно снижено на фоне повышенных значений общей концентрации вкДНК и низкой эндонуклеазной активности крови. Похожие изменения наблюдаются у гипертензивных крыс SHR. Мы обнаружили, что однократное введение в организм крысы фрагментов ТО-рДНК в раннем онтогенезе отодвигает время развития гипертонии. Снижение артериального давления у этих крыс напрямую коррелировало с увеличением эндонуклеазной активности в 3.5 раза и с увеличением содержания собственной ТО-рДНК в составе циркулирующей ДНК [63]. Таким образом, мы показали, что “иммунизация” крыс фрагментами ТО-рДНК способствует увеличению эндонуклеазной активности крови. При этом действует механизм, приводящий к накоплению ТО-рДНК в кровотоке (рис. 2).
Трансфекция внеклеточной ТО-рДНК в клетки
Помимо стимуляции сенсоров TLR9, фрагменты внеклеточной ТО-рДНК могут проникать в структуры клеток и достигать клеточного ядра. Недавно мы показали, что модельные конструкции, содержащие вставки ТО-рДНК, проникают в клетку и даже способны экспрессироваться. Опыт был проведен на примере клеток MCF7, фрагмент рДНК был встроен в плазмиду, содержащую ген флуоресцирующего белка EGFP под CMV-промотором. Введение вставки ТО-рДНК в плазмиду приводит к увеличению в 3 раза содержания плазмиды в клетках. При этом наблюдали экспрессию белка EGFP. Средний уровень экспрессии белка на клетку был ниже, чем при использовании стандартного метода (трансфекция с применением липосом), однако количество клеток, экспрессирующих флуоресцирующий белок, было значительно выше [52].
Возникает вопрос: каким образом внеклеточная ТО-рДНК может проникать в клетку? Известно, что интактные молекулы ДНК не проникают через клеточную мембрану. Требуются дополнительные усилия для трансфекции ДНК в клетки. Мы полагаем, что причиной трансфекции фрагментов внеклеточной ТО-рДНК в клетки является одно из описанных выше свойств рДНК – наличие крайне легко окисляющихся мотивов (dG)n(рис. 1,в).
Ранее мы показали, что окисление внеклеточной ДНК делает ее очень активной DAMPs-молекулой [55, 71, 80–84]. Окисленные фрагменты вкДНК легко проникают в клетки и в ядро. Механизм этого процесса пока не совсем понятен. Мы предполагаем существование клеточных рецепторов, которые опознают окисленную вкДНК и осуществляют транспорт этой ДНК в ядро. Чтобы проникнуть в клетку вкДНК должна быть окислена. Очевидно, что циркулирующая вкДНК больных уже содержит окисленные основания [27, 82], так как окислительный стресс – одна из основных причин гибели клеток.
Неокисленные фрагменты внеклеточной ТО-рДНК могут окисляться при сближении с клеточной мембраной. При взаимодействии фрагментов ТО-рДНК с МСК, HUVEC и MCF7 мы обнаружили очень быстрый клеточный ответ – кратковременный всплеск синтеза АФК [55, 74, 82]. Наиболее интенсивный синтез АФК имеет место в месте контакта вкДНК и клетки. Синтезированных АФК достаточно для окисления мотивов ДНК с низким потенциалом окисления, которых много в составе ТО-рДНК (рис. 1). В области мембран многих клеток экспрессируются ферменты семейства NOX, продуцирующие активные формы кислорода [85, 86]. При взаимодействии клеток с вкДНК наблюдается активация экспрессии, как минимум, одного из членов семейства NOX – фермента NOX4 [52], в том числе и в местах, где локализованы фрагменты вкДНК.
Окисленные фрагменты ТО-рДНК проникают внутрь клетки и накапливаясь в цитоплазме могут индуцировать различный ответ, взаимодействуя с различными ДНК-сенсорами в цитоплазме (TLR9, AIM2, STING, RIG1). Интересно отметить, что фрагменты ТО-рДНК, содержащие маркер окисления 8-oxodG, детектируются в ядрышке [52]. Фрагменты вектора не детектируются в ядрышке. Этот факт может быть еще одним признаком трансфекции ТО-рДНК в ядро и образования комплексов ТО-рДНК с белками ядрышка. Фрагменты внеклеточной ТО-рДНК, проникая в ядрышко, могут конкурировать с рибосомными генами за связывание с факторами, обеспечивающими биогенез рибосом. Косвенное подтверждение этого предположения – снижение количества рРНК в клетках MCF7, которые культивировали в присутствии фрагментов ТО-рДНК [52]. Можно предположить, что фрагменты внеклеточной ТО-рДНК являются одним из способов регуляции активности рибосомных генов в неблагоприятных условиях, когда в межклеточной среде происходит увеличение количества внеклеточной ДНК вследствие гибели клеток.
Работа выполнена при финансовой поддержке РФФИ, проект № 17-29-06017офи_м и в рамках государственного задания Минобрнауки России.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Khatter H., Myasnikov A.G., Natchiar S.K., Klaholz B.P. Structure of the human 80S ribosome // Nature. 2015. V. 520(7549). № 30. P. 640–645. https://doi.org/10.1038/nature14427
McStay B., Grummt I. The epigenetics of rRNA genes: from molecular to chromosome biology // Annu. Rev. Cell Dev. Biol. 2008. V. 24. P. 131–157. https://doi.org/10.1146/annurev.cellbio.24.110707.175259
Hamperl S., Wittner M., Babl V. et al. Chromatin states at ribosomal DNA loci // Biochim. Biophys. Acta. 2013. V. 1829. № 3–4. P. 405–417. https://doi.org/10.1016/j.bbagrm.2012.12.007
Lyapunova N.A., VeikoN., Porokhovnik L. Human rDNA genes: Identification of four fractions, their functions and nucleolar location // Proteins of the Nucleolus: Regulation, Translocation, & Biomedical Functions / Eds O’Day D.H. and Catalano A. © Springer Science + + Business Media Dordrecht, 2013. P. 95–118.
Conconi A., Widmer R.M., Koller T. et al. Two different chromatin structures coexist in ribosomal RNA genes throughout the cell cycle // Cell. 1989. V. 57. № 5. P. 753–761.
French S.L., Osheim Y.N., Cioci F. et al. In exponentially growing Saccharomyces cerevisiae cells, rRNA synthesis is determined by the summed RNA polymerase I loading rate rather than by the number of active genes // Mol. Cell. Biol. 2003. V. 23. № 5. P. 1558–1568.
Ляпунова Н.А., Вейко Н.Н. Рибосомные гены в геноме человека: идентификация четырех фракций, их организация в ядрышке и метафазных хромосомах // Генетика. 2010. Т. 46. № 9. С. 1205–1209.
Malinovskaya E.M., Ershova E.S., Golimbet V.E. et al. Copy number of human ribosomal genes with aging: Unchanged mean, but narrowed range and decreased variance in elderly group // Front. Genet. 2018. V. 9. № 7. P. 306. https://doi.org/10.3389/fgene.2018.00306
Paredes S., Branco A.T., Hartl D.L. et al. Ribosomal DNA deletions modulate genome-wide gene expression: “rDNA-sensitive” genes and natural variation // PLoS Genet. 2011. V. 7. № 4. e1001376. https://doi.org/10.1371/journal.pgen.1001376
Kobayashi T. Ribosomal RNA gene repeats, their stability and cellular senescence // Proc. Jap. Acad., Series B. 2014. V. 90. № 4. P. 119–129.
Bianchi M.E. DAMPs, PAMPs and alarmins: all we need to know about danger // J. Leukoc Biol. 2007. V. 81. № 1. P. 1–5. https://doi.org/10.1189/jlb.0306164
Janeway C.A. Jr. The immune system evolved to discriminate infectious nonself from noninfectious self // Immunol Today. 1992. V. 13. № 1. P. 11–16. https://doi.org/10.1016/0167-5699(92)90198-G
Matzinger P. The danger model: a renewed sense of self // Science. 2002. V. 296. № 12. P. 301–305. https://doi.org/10.1126/science.1071059
Matzinger P. Tolerance, danger, and the extended family // Annu. Rev. Immunol. 1994. V. 12. P. 991–1045. https://doi.org/10.1146/annurev.iy.12.040194.005015
Chan J.K., Roth J., Oppenheim J.J. et al. Alarmins: awaiting a clinical response // J. Clin. Invest. 2012. V. 122. P. 2711–2719. https://doi.org/10.1172/JCI62423
Pisetsky D.S. The origin and properties of extracellular DNA: from PAMP to DAMP // Clin. Immunol. 2012. V. 144. № 1. P. 32–40. https://doi.org/10.1016/j.clim.2012.04.006
Kato J., Svensson C.I. Role of extracellular damage-associated molecular pattern molecules (DAMPs) as mediators of persistent pain // Prog. Mol. Biol. Transl. Sci. 2015. V. 131. P. 251–279. https://doi.org/10.1016/bs.pmbts.2014.11.014
Magna M., Pisetsky D.S. The alarmin properties of DNA and DNA-associated nuclear proteins // Clin. Ther. 2016. V. 38. № 5. P. 1029–1041. https://doi.org/10.1016/j.clinthera.2016.02.029
Pös O., Biró O., Szemes T., Nagy B. Circulating cell-free nucleic acids: characteristics and applications // Eur. J. Hum. Genet. 2018. V. 26. № 7. P. 937–945. https://doi.org/10.1038/s41431-018-0132-4
Aucamp J., Bronkhorst A.J., Badenhorst C.P.S., Pretorius P.J. The diverse origins of circulating cell-free DNA in the human body: a critical re-evaluation of the literature // Biol. Rev. Camb. Philos Soc. 2018. V. 93. № 3. P. 1649–1683. https://doi.org/10.1111/brv.12413
Thierry A.R., Messaoudi S., Gahan P.B. et al. Origins, structures, and functions of circulating DNA in oncology // Cancer Metastasis Rev. 2016. V. 35. № 3. P. 347–376. https://doi.org/10.1007/s10555-016-9629-x
Puszyk W.M., Crea F., Old R.W. Unequal representation of different unique genomic DNA sequences in the cell-free plasma DNA of individual donors // Clin. Biochem. 2009. V. 42. № 7–8. P. 736–738. https://doi.org/10.1016/j.clinbiochem.2008.11.006
Veiko N.N., Shubaeva N.O., Ivanova S.M. et al. Blood serum DNA in patients with rheumatoid arthritis is considerably enriched with fragments of ribosomal repeats containing immunostimulatory CpG-motifs // Bull. Exp. Biol. Med. 2006. V. 142. P. 313–316.
Korzeneva I.B., Kostuyk S.V., Ershova E.S. et al. Human circulating ribosomal DNA content significantly increases while circulating satellite III (1q12) content decreases under chronic occupational exposure to low-dose gamma- neutron and tritium beta-radiation // Mutat. Res. 2016. V. 791–792. P. 49–60. https://doi.org/10.1016/j.mrfmmm.2016.09.001
Veiko N.N., Bulycheva N.A., Veiko R.V. et al. Ribosomal repeat in the cell free DNA as a marker for cell death // Biochem. (Moscow) Suppl. Series B: Biomed. Chemistry. 2008. V. 2. P. 198–207.
Aswani A., Manson J., Itagaki K. et al. Scavenging circulating mitochondrial DNA as a potential therapeutic option for multiple organ dysfunction in trauma hemorrhage // Front. Immunol. 2018. V. 8. № 9. P. 891. https://doi.org/10.3389/fimmu.2018.00891
Ershova E.S., Jestkova E.M., Chestkov I.V. et al. Quantification of cell-free DNA in blood plasma and DNA damage degree in lymphocytes to evaluate dysregulation of apoptosis in schizophrenia patients // J. Psychiatr. Res. 2017. V. 87. P. 15–22. https://doi.org/10.1016/j.jpsychires.2016.12.006
Feng H., Jin P., Wu H. Disease prediction by cell-free DNA methylation // Brief Bioinform. 2018. https://doi.org/10.1093/bib/bby029
Jung M., Kristiansen G., Dietrich D. DNA methylation analysis of free-circulating DNA in body fluids // Methods Mol. Biol. 2018. V. 1708. P. 621–641. https://doi.org/10.1007/978-1-4939-7481-8_32
Dietrich D. DNA methylation analysis from body fluids // Methods Mol. Biol. 2018. V. 1655. P. 239–249. https://doi.org/10.1007/978-1-4939-7234-0_18
Sano H., Morimoto C. DNA isolated from DNA/anti-DNA antibody immune complexes in systemic lupus erythematosus is rich in guanine-cytosine content // J. Immunol. 1982. V. 128. P. 1341–1345.
Lander E.S., Linton L.M., Birren B. et al. Initial sequencing and analysis of the human genome // Nature. 2001. V. 409. № 6822. P. 860–921.
Zhang J.Z., Liu Z., Liu J. et al. Mitochondrial DNA induces inflammation and increases TLR9/NF-κB expression in lung tissue // Int. J. Mol. Med. 2014. V. 33. № 4. P. 817–24. https://doi.org/10.3892/ijmm.2014.1650
Honda K., Taniguchi T. IRFs: master regulators of signalling by Toll-like receptors and cytosolic pattern-recognition receptors // Nat. Rev. Immunol. 2006. V. 6. № 9. P. 644–658. https://doi.org/10.1038/nri1900
Bauer S., Kirschning C.J., Häcker H. et al. Human TLR9 confers respon-siveness to bacterial DNA via species-specific CpG motif recognition // Proc. Natl Acad. Sci. USA. 2001. V. 98. № 16. P. 9237–9242. https://doi.org/10.1073/pnas.161293498
Wu B., Ni H., Li J. et al. The impact of circulating mitochondrial DNA on cardiomyocyte apoptosis and myocardial injury after TLR4 activation in experimental autoimmune myocarditis // Cell Physiol. Biochem. 2017. V. 42. № 2. P. 713–728. https://doi.org/10.1159/000477889
Liu Y., Yan W., Tohme S. et al. Hypoxia induced HMGB1 and mitochondrial DNA interactions mediate tumor growth in hepatocellular carcinoma through Toll-like receptor 9 // J. Hepatol. 2015. V. 63. № 1. P. 114–121. https://doi.org/10.1016/j.jhep.2015.02.009
Zhang Q., Raoof M., Chen Y. et al. Circulating mitochondrial DAMPs cause inflammatory responses to injury // Nature. 2010. V. 464. № 7285. P. 104–107. https://doi.org/10.1038/nature08780
Nakahira K., Hisata S., Choi A.M. The roles of mitochondrial damage-associated molecular patterns in diseases // Antioxid. Redox. Signal. 2015. V. 23. № 17. P. 1329–1350. https://doi.org/10.1089/ars.2015.6407
Walko T.D., Bola R.A., Hong J.D. Cerebrospinal fluid mitochondrial DNA: a novel DAMP in pediatric traumatic brain injury // Shock. V. 41. № 6. P. 499–503. https://doi.org/10.1097/SHK.0000000000000160
Wenceslau C.F., McCarthy C.G., Szasz T. et al. Working group on DAMPs in cardiovascular disease. Mitochondrial damage-associated molecular patterns and vascular function // Eur. Heart J. 2014. V. 35. № 18. P. 1172–1177. https://doi.org/10.1093/eurheartj/ehu047
Handa P., Vemulakonda A., Kowdley K.V. et al. Mitochondrial DNA from hepatocytes as a ligand for TLR9: Drivers of nonalcoholic steatohepatitis? // World J. Gastroenterol. 2016. V. 22. № 31. P. 6965–6971. https://doi.org/10.3748/wjg.v22.i31.6965
Lee Y.L., King M.B., Gonzalez R.P. et al. Blood transfusion products contain mitochondrial DNA damage-associated molecular patterns: a potential effector of transfusion-related acute lung injury // J. Surg. Res. 2014. V. 191. № 2. P. 286–289. https://doi.org/10.1016/j.jss.2014.06.003
Polettini J., Behnia F., Taylor B.D. et al. Telomere fragment induced amnion cell senescence: A contributor to parturition? // PLoS One. 2015. 10:e0137188. https://doi.org/10.1371/journal.pone.0137188
Wang L., Yu X., Liu J.P. Telomere damage response and low-grade inflammation // Adv. Exp. Med. Biol. 2017. V. 1024. P. 213–224. https://doi.org/10.1007/978-981-10-5987-2_10
Dey S., Marino N., Bishop K. A plasma telomeric cell-free DNA level in unaffected women with BRCA1 or/and BRCA2 mutations: a pilot study // Oncotarget. 2017. V. 9. № 3. P. 4214–4222. https://doi.org/10.18632/oncotarget.23767
Zinkova A., Brynychova I., Svacina A. et al. Cell-free DNA from human plasma and serum differs in content of telomeric sequences and its ability to promote immune response // Sci. Rep. 2017. V. 7. № 1. P. 2591. https://doi.org/10.1038/s41598-017-02905-8
Chestkov I.V., Jestkova E.M., Ershova E.S. et al. Abundance of ribosomal RNA gene copies in the genomes of schizophrenia patients // Schizophr. Res. 2018. V. 197. P. 305–314. https://doi.org/10.1016/j.schres.2018.01.001
McCarthy C.G., Wenceslau C.F., Goulopoulou S. Circulating mitochondrial DNA and Toll-like receptor 9 are associated with vascular dysfunction in spontaneously hypertensive rats // Cardiovasc Res. 2015. V. 107. № 1. P. 119–130.
doi 10.1093/cvr/cvv137
Brock G.J., Bird A. Mosaic methylation of the repeat unit of the human ribosomal RNA genes // Hum. Mol. Genet. 1997. V. 6. № 3. P. 451–456.
von Sonntag C. Free-Radical-Induced DNA Damage and its Repair: A Chemical Perspective. Berlin. Springer, 2006. P. 423.
Kostyuk S.V., Mordkovich N.N., Okorokova N.A. et al. Increased transfection of the easily oxidizable GC-rich DNA fragments into the MCF7 breast cancer cell // Oxid. Med. Cell. Longev. 2019. V. 2019. Article ID 2348165.
Вейко Н.Н., Спитковский Д.М. Накопление однонитевых разрывов не приводит к возникновению двунитевых разрывов в транскрибируемой области рибосомного повтора человека // Радиац. биология. Радиоэкология. 2000. Т. 40. № 4. С. 396–404.
Костюк С.В., Ершова Е.С., Конорова И.Л. и др. Хроническое действие ионизирующего излучения вызывает увеличение содержания рибосомного повтора в составе циркулирующей ДНК плазмы крови // Мед. генетика. 2013. Т. 12. № 12. С. 20–28.
Ermakov A.V., Konkova M.S., Kostyuk S.V. et al. Oxidized extracellular DNA as a stress signal in human cells // Oxid. Med. Cell Longev. 2013. 649747. https://doi.org/10.1155/2013/649747
Zafiropoulos A., Tsentelierou E., Linardakis M. et al. Preferential loss of 5S and 28S rDNA genes in human adipose tissue during ageing // Int. J. Biochem. Cell Biol. 2005. V. 37. № 2. P. 409–415. https://doi.org/10.1016/j.biocel.2004.07.007
Ershova E., Sergeeva V., Klimenko M. et al. Circulating cell‑free dna concentration and dnasei activity of peripheral blood plasma change in case of pregnancy with intrauterine growth restriction compared to normal pregnancy // Biomed. Reports. 2017. V. 7. № 4. P. 319–324.
Korzeneva I.B., Kostuyk S.V., Ershova L.S. Human circulating plasma DNA significantly decreases while lymphocyte DNA damage increases under chronic occupational exposure to low-dose gamma-neutron and tritium β-radiation // Mutat. Res. 2015. V. 779. P. 1–15. https://doi.org/10.1016/j.mrfmmm.2015.05.004
Speranskii A.I., Kostyuk S.V., Veiko N.N., Kalashnikova E.A. Enrichment of extracellular DNA from the cultivation medium of human peripheral blood mononuclears with genomic CpG rich fragments results in increased cell production of IL-6 and TNF-a via activation of the NF-kB signaling pathway // Biochem. (Moscow) Suppl. Series B: Biomed. Chemistry. 2015. P. 174–184.
Veiko N.N., Egolina N.A., Radzivil G.G. et al. Quantitative analysis of repetitive sequences in human genomic DNA and detection of an elevated ribosomal repeat copy number in patients with schizophrenia (the results of molecular and cytogenetic analysis) // Mol. Biol. (Rus.) 2003. V. 37. P. 349–357.
Veiko N.N., Lyapunova N.A., Bogush A.I., Spitkovskii D.M. Proteins are tightly bound with transcribed regions of human ribosomal genes // Mol. Biol. (Rus.). 1998. V. 32. P. 18–522.
Veiko N.N., Kostyuk S.V., Ermakov A. V. et al. Peripheral blood serum from healthy donors contains antibodies against the fragment of transcribed region of ribosomal repeat // Bull. Exp. Biol. Med. 2007. V. 144. P. 304–308.
Veiko N.N., Neverova M.E., Fidelina O.V. et al. The effect of CpG-rich DNA fragments on the development of hypertension in spontaneously hypertensive rats (SHR) // Biochem. (Moscow) Suppl. Series B: Biomed. Chemistry. 2010. V. 4. P. 269–278.
Hemmi H., Takeuchi O., Kawai T. et al. A Toll-like receptor recognizes bacterial DNA // Nature. 2000. V. 408. № 6813. P. 740–755. https://doi.org/10.1038/35047123
Kostjuk S., Loseva P., Chvartatskaya O. et al. Extracellular GC-rich DNA activates TLR9- and NF-kB-dependent signaling pathways in human adipose-derived mesenchymal stem cells (haMSCs) // Expert. Opin. Biol. Ther. Suppl. 1. 2012. S99–S111. https://doi.org/10.1517/14712598.2012.690028
Kostyuk S.V., Porokhovnik L.N., Ershova E.S. et al. Changes of KEAP1/NRF2 and IKB/NF-κB expression levels induced by cell-free DNA in different cell types // Oxid. Med. Cell Longev. 2018. № 1052413. https://doi.org/10.1155/2018/1052413
Alekseeva A.Y., Kameneva L.V., Kostyuk S.V., Veiko N.N. Reception and following ROS production in endothelial cells // Adv. Exp. Med. Biol. 2016. V. 924. P. 127–131. https://doi.org/10.1007/978-3-319-42044-8_25
Konkova M.S., Ermakov A.V., Efremova L.V. et al. Influence of X-ray and/or CpG-DNA induced oxidative stress on adaptive response in human lymphocytes // Intern. J. Low Radiat. 2010. V. 7. P. 446–452. https://doi.org/10.1504/IJLR.2010.037667
Veiko N.N., Kalashnikova E.A., Kokarovtseva S.N. et al. Stimulatory effect of fragments from transcribed region of ribosomal repeat on human peripheral blood lymphocytes // Bull. Exp. Biol. Med. 2006. V. 142. P. 428–432.
Ermakov A.V., Konkova M.S., Kostyuk S.V. et al. Oxidative stress as a significant factor for development of an adaptive response in irradiated and nonirradiated human lymphocytes after inducing the bystander effect by low-dose X-radiation // Mutat. Res. 2009. V. 669. № 1–2. P. 155–161. https://doi.org/10.1016/j.mrfmmm.2009.06.005
Kostyuk S.V., Malinovskaya E.M., Ermakov A.V. et al. Fragments of cell-free DNA increase transcription in human mesenchymal stem cells, activate TLR-dependent signal pathway, and suppress apoptosis // Biochem. (Moscow) Suppl. Series B: Biomed. Chemistry. 2012. V. 6. P. 68–74.
Sergeeva V.A., Kostyuk S.V., Ershova E.S. et al. GC-rich DNA fragments and oxidized cell-free DNA have different effects on NF-kB and NRF2 signaling in MSC // Adv. Exp. Med. Biol. 2016. V. 924. P. 109–112. https://doi.org/10.1007/978-3-319-42044-8_21
Kostyuk S., Smirnova T., Kameneva L. et al. GC-rich extracellular DNA induces oxidative stress, double-strand DNA breaks, and DNA damage response in human adipose-derived mesenchymal stem cells // Oxid. Med. Cell Longev. 2015. № 782123. https://doi.org/10.1155/2015/782123
Alekseeva A.Yu., Bulycheva N.V., Kostyuk S.V. et al. Cell free DNA (cfDNA) influences nitric oxide and ros levels in human endothelial cells // Circulating Nucleic Acids in Plasma and Serum / Ed. Gahan P.B. Springer Science + Business Media B.V., 2011. P. 219–223.
Efremova L.V., Alekseeva A.Y., Konkova M.S. et al. Extracellular DNA affects NO content in human endothelial cells // Bull. Exp. Biol. Med. 2010. V. 149. P. 196–200.
Kostyuk S.V., Smirnova T.D., Efremova L.V. et al. Enhanced expression of iNOS in human endothelial cells during long-term culturing with extracellular DNA fragments // Bull. Exp. Biol. Med. 2010. V. 149. P. 191–195.
Костюк С.В., Алексеева А.Ю., Конькова М.С. и др. Внеклеточная ДНК влияет на функциональную активность клеток эндотелия // Мед. генетика. 2010. Т. 9. № 1. С. 38–46.
Bulicheva N., Fidelina O., Mkrtumova N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture // Ann. N.Y. Acad. Sci. 2008. V. 1137. P. 273–277. https://doi.org/10.1196/annals.1448.023
Kostyuk S.V., Konkova M.S., Ershova E.S. et al. An exposure to the oxidized DNA enhances both instability of genome and survival in cancer cells // PLoS One. 2013. V. 8:e77469. https://doi.org/10.1371/journal.pone.0077469
Kostyuk S.V., Tabakov V.J., Chestkov V.V. et al. Oxidized DNA induces an adaptive response in human fibroblasts // Mutat. Res. 2013. V. 747–748. P. 6–18. https://doi.org/10.1016/j.mrfmmm.2013.04.007
Kostyuk S.V., Alekseeva A.Y., Kon’kova M.S. et al. Oxidized extracellular DNA suppresses nitric oxide production by endothelial NO synthase (eNOS) in human endothelial cells (HUVEC) // Bull. Exp. Biol. Med. 2014. V. 157. P. 202–206. https://doi.org/10.1007/s10517-014-2525-x
Loseva P., Kostyuk S., Malinovskaya E. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the production of ROS in human mesenchymal stem cells // Expert. Opin. Biol. Ther. Suppl. 1. 2012. S85–S97. https://doi.org/10.1517/14712598.2012.688948
Glebova K., Veiko N., Kostyuk S. et al. Oxidized extracellular DNA as a stress signal that may modify response to anticancer therapy // Cancer Lett. 2015. V. 356. P. 22–33. https://doi.org/10.1016/j.canlet.2013.09.005
Glebova K.V., Veiko N.N., Nikonov A.A. et al. Cell-free DNA as a biomarker in stroke: Current status, problems and perspectives // Crit. Rev. Clin. Lab. Sci. 2018. V. 5. № 1. P. 55–70. https://doi.org/10.1080/10408363.2017.1420032
Brandes R.P., Weissmann N., Schröder K. Nox family NADPH oxidases: Molecular mechanisms of activation // Free Radic. Biol. 2014. V. 76. P. 208–226. https://doi.org/10.1016/j.freeradbiomed.2014.07.046
Дополнительные материалы отсутствуют.


