Генетика, 2020, T. 56, № 1, стр. 89-97
Роль межгенных взаимодействий генов нейротрофической и нейромедиаторной системы в развитии предрасположенности к параноидной шизофрении
А. Э. Гареева 1, 2, *, Э. К. Хуснутдинова 1
1 Институт биохимии и генетики Уфимского научного центра Российской академии наук
450054 Уфа, Россия
2 Башкирский государственный медицинский университет
450008 Уфа, Россия
* E-mail: annagareeva@yandex.ru
Поступила в редакцию 06.02.2019
После доработки 24.04.2019
Принята к публикации 05.06.2019
Аннотация
Цель данного исследования – анализ ген-генных взаимодействий 70 полиморфных вариантов 15 генов системы нейротрофинов и нейрексинов (BDNF, NTRK2, NTRK3, NGF, NXPH1, NRXN1) девяти генов нейротрасмиттерной системы (DRD2, DRD3, DRD4, COMT, GRM3, GRIK2, GRIA2, GRIN2B, RGS2) в детерминации риска развития параноидной шизофрении в этнических группах русских и татар.
Поскольку в основе наследственной предрасположенности к шизофрении, как к многофакторному заболеванию, лежит специфическая комбинация аллелей множества генов, оказывающих влияние на развитие данного заболевания или модифицирующих его клинические проявления, а анализ ассоциации отдельных полиморфных вариантов генов не может дать полного представления о механизмах формирования параноидной шизофрении (ПШ), при прогнозировании риска развития ПШ необходимо учитывать межгенные взаимодействия. Так, при анализе генетической компоненты подверженности шизофрении получено несколько убедительных примеров важности генетических взаимодействий в развитии данного заболевания у китайцев [1, 2], у индусов [3], у англичан [4].
В целом генетические исследования показали сложность генетической архитектуры шизофрении, а также ее полигенную природу. Одна из гипотез состоит в том, что один или несколько путей патогенеза объединяет многие эмпирические данные, полученные при изучении шизофрении. Однако механизмы, благодаря которым эти однонуклеотидные варианты повышают риск шизофрении до сих пор остаются непонятными. Биологическая роль однонуклеотидных полиморфных вариантов ОНП и то, как они взаимодействуют с другими генами и средовыми факторами пока не ясны [5]. Выявлено, что в этиопатогенезе шизофрении принимает участие множество функционально взаимосвязанных генов, среди которых гены дофаминергической, глутаматергической, серотонинергической нейротрансмиссии, семейства нейротрофинов и нейрексинов, сигнальной трансдукции [6–11].
Самым известным подходом моделирования межгенных взаимодействий является биоинформатический метод MDR для изучения мультилокусных генотипов. В программе MDR мультилокусные генотипы суммируются в группы повышенного и пониженного риска заболевания, что позволяет уменьшить размерность числа рассматриваемых параметров. Путем многократного перекрестного пересчета вводимых первичных данных программа выбирает оптимальную модель межгенных взаимодействий, позволяющуя с наиболее высокой точностью и с наименьшей ошибкой предсказывать наличие или отсутствие предрасположенности к определенному заболеванию.
Цель настоящего исследования – анализ межгенных взаимодействий 44 полиморфных вариантов шести генов системы нейротрофинов и нейрексинов (BDNF, NTRK2, NTRK3, NGF, NXPH1, NRXN1) и 26 ОНП девяти генов нейротрасмиттерной системы (DRD2, DRD3, DRD4, COMT, GRM3, GRIK2, GRIA2, GRIN2B, RGS2) в детерминации риска развития параноидной шизофрении в этнических группах русских и татар.
МАТЕРИАЛЫ И МЕТОДЫ
В исследуемые выборки были включены представители двух наиболее распространенных популяций Башкортостана: русских и татар, поскольку известно, что распространенность функционально значимых генетических вариаций, структура гаплотипов и неравновесия по сцеплению, а также их ассоциация с тем либо иным заболеванием зависит от этнической истории популяции [12, 13].
Основная группа исследования включала 257 неродственных индивидов (137 мужского пола, 120 женского пола) с диагнозом параноидной шизофрении с непрерывным и эпизодическим типом течения заболевания. Обследованные являлись пациентами Республиканской клинической психиатрической больнице № 1 Министерства здравоохранения Республики Башкортостан. Диагноз был установлен согласно с международной классификацией болезней десятого пересмотра (МКБ-10). Средний возраст больных составил 24.9 ± 8.9 лет. Средний возраст начала заболевания составил 22.4 ± 7.3 лет. На каждого больного путем индивидуального опроса и анализа истории болезни была заполнена специально разработанная анкета, в которую заносились паспортные данные больных, жалобы, клинико-анамнестические данные, все проводимые общеклинические и специальные методы исследования. Состав общей выборки больных параноидной шизофренией по этнической принадлежности следующий: русские – 108, татары – 149.
В качестве контроля исследованы 349 индивидов (174 русских, 175 татар) той же возрастной группы, не состоявшие на учете у психиатра и нарколога и отрицавшие у себя отягощенную наследственность по психическим заболеваниям. Средний возраст здоровых доноров составил 32.4 ± 12.4 года.
Все участники исследования или их законные представители дали информированное согласие на проведение молекулярно-генетических исследований. Данное исследование было одобрено локальным биоэтическим комитетом ИБГ УФИЦ РАН.
ДНК выделяли из периферической крови стандартным методом фенольно-хлороформной экстракции [14]. Анализ полиморфных локусов DRD2 (rs1800497, rs6275), DRD3 (rs6280), DRD4 (–616C>G, 120-bp VNTR), COMT (rs4680, rs4818), GRIN2B (rs34315573, rs1805502, rs7301328, rs1805482, rs1805247, rs1805476), RGS2 (rs2746073, rs2746072, rs3767488, rs2746071, rs4606), GRIK2 (rs2235076, rs2227283, rs995640, rs2227281), GRM3 (rs274622, rs187993, rs6465084) проводили с помощью метода полимеразной цепной реакции (ПЦР) синтеза ДНК и ПДРФ-анализа с последующим электрофорезом в 7–8%-ном полиакриламидном геле [6–8, 11].
Генотипирование полиморфных вариантов rs6536221, rs4441804 и rs4302506 гена GRIA2 проводили с использованием TaqMan® SNP Genotyping Assays C-29062108_10 и TaqMan® Genotyping Master Mix (Applied Biosystems) согласно протоколу фирмы производителя [8].
Генотипирование 44 полиморфных локусов генов системы нейротрофического фактора и последующее распознавание генотипов производилось на платформе SNPlexTM (Applied Biosystems) и с помощью программы GeneMapper 4.0 (Applied Biosystems) согласно протоколу фирмы производителя [9].
При анализе межгенных взаимодействий определяли тип взаимодействия между локусами (синергия, аддитивность или синонимия) с помощью программ MDR (Multifactor–Dimensionality Reduction) [15, 16]. Кроме того вводилась поправка FDR-BH (False Discovery Rate Bengamini-Hochberg) на число множественных сравнений [17].
РЕЗУЛЬТАТЫ
У больных параноидной шизофренией и в контрольной группе проведена оценка межгенных взаимодействий исследованных полиморфных локусов генов-кандидатов развития данного заболевания в детерминации риска развития данного заболевания. Для выборки моделей мы использовали алгоритм полного поиска (Exhaustive search algorithm), который оценивал все возможные сочетания генотипов в отношении риска развития ПШ, и алгоритм принудительного поиска (Forced search algorithm), при котором полиморфные локусы генов для исследования сочетаний генотипов выбирались вручную. Для каждой модели межгенных взаимодействий сравнивали частоты встречаемости генотипов взаимодействующих генов в выборках больных и здоровых.
Исследование ген-генных взаимодействий у индивидов различной этнической принадлежности показало, что у русских оптимальными моделями, предрасполагающими к развитию параноидной шизофрении, являются двухлокусные модели – DRD2 × COMT и RGS2 × GRIN2B (табл. 1).
Таблица 1.
Ключевые межгенные взаимодействия, детерминирующие предрасположенность к развитию параноидной шизофрении у русских и татар
| Оптимальная модель межгенного взаимодействия | Сбалансированная точность (Bal. Acc.) | Чувствительность (Se) | Специфичность (Sp) |
Воспроизводимость результата (CV Consistency) | p |
|---|---|---|---|---|---|
| Русские | |||||
| DRD2 × COMT | 0.74 | 0.70 | 0.77 | 7/10 | 1.0E-03 |
| RGS2 × GRIN2B | 0.64 | 0.59 | 0.68 | 10/10 | 0.012 |
| Татары | |||||
| GRM3 × DRD2 | 0.71 | 0.62 | 0.81 | 8/10 | 1.0E-03 |
| BDNF × NTRK2 | 0.56 | 0.60 | 0.51 | 10/10 | 1.57E-03 |
| NXPH1 × NTRK3 | 0.62 | 0.63 | 0.61 | 10/10 | 1.01E-04 |
| NTRK3 × BDNF | 0.58 | 0.47 | 0.70 | 10/10 | 0.002 |
В группе лиц с параноидной шизофренией и контроле у русских по этнической принадлежности статистически значимой (p = 0.0107) моделью определена комбинация из двух ДНК-локусов: генов DRD2 (rs1800497) и COMT (rs4680), взаимодействие которых лежит в основе предрасположенности к развитию параноидной шизофрении. Тестируемая сбалансированная точность (Bal. Acc.) данной модели составила 0.74, чувствительность (Se) – 0.70, специфичность (Sp) – 0.77, воспроизводимость результата (CV Consistency) – 7/10 (рис. 1,а, табл. 1).
Рис. 1.
а – сочетания генотипов полиморфных локусов генов DRD2 (rs1800497) и COMT (rs4680), ассоциированных с повышенным и пониженным риском развития ПШ у русских; б – сочетания генотипов полиморфных локусов генов RGS2 (rs2746071) и GRIN2B (rs34315573), ассоциированные с повышенным и пониженным риском развития ПШ у русских.
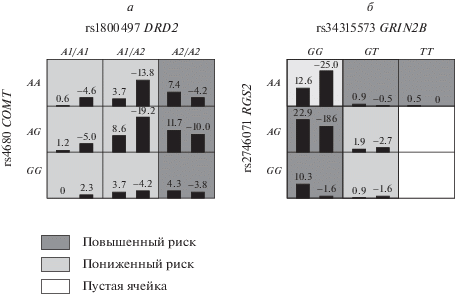
К сочетаниям повышенного риска развития заболевания (выделены темно-серым фоном) были отнесены три различных комбинации генотипов, из которых наиболее значимой оказалась: rs1800497*A2/A2 и rs4680*A/A (p = 0.012, OR = = 3.25, CI95% 1.36–7.79). К сочетаниям пониженного риска развития заболевания (выделены светло-серым фоном) были отнесены три различных комбинации генотипов, однако ни одна из них не достигла статистической значимости (рис. 1,а).
Результаты исследования частично согласуются с данными, полученными вследствие анализа ассоциации по отдельным локусам гена DRD2, показавших, что генотип rs1800497*A2/A2 повышает риск развития ПШ у русских (табл. 2). Однолокусный анализ не установил ассоциации ОНП rs4680 гена COMT с риском развития ПШ ни в одной из этнических групп, тогда как анализ межгенных взаимодействий выявил комбинацию ОНП rs4680 гена COMT и rs1800497 гена DRD2, что возможно объясняется играющим важную роль в детерминации биологических признаков, эпистатическим действием генов [18]. Литературных данных, описывающих данную полученную нами модель ген-генного взаимодействия с риском развития шизофрении не найдено. В некоторых исследованиях показано, что модель ген-генного взаимодействия COMT и DRD2 ассоциирована с творческим потенциалом (rs174675, rs4818 гена COMT; rs1076560, rs4648317 гена DRD2) [19] и нервной анорексией (rs4633 гена COMT и rs1800497 DRD2) [20] у китайцев. Данное взаимодействие генов, приводящее к повышенному риску развития ПШ, можно объяснить во-первых, повышением дофаминовой активности, ассоциированным с аллелем rs1800497*A2 в гене DRD2, при котором отмечается избыток дофамина, а во-вторых, фермент СОМТ, содержащий метионин (аллель rs4680*A в гене СОМТ) в гомозиготном состоянии, обладает четырехкратно меньшей активностью, приводящей к замедлению деградации дофамина в префронтальной коре головного мозга [21].
Таблица 2.
Сочетания генотипов повышенного и пониженного риска развития параноидной шизофрении
| Сочетание генов | Сочетание ОНП и генотипов | p | pfdr | OR | CI 95% |
|---|---|---|---|---|---|
| Русские | |||||
| DRD2 × COMT | rs1800497*A2/A2 × rs4680*A/A | 0.012 | 0.016 | 3.25 | 1.36–7.79 |
| rs1800497*A2/A2 × rs4680*A/G | 0.026 | 0.026 | 2.27 | 1.15–4.46 | |
| RGS2 × GRIN2B | rs2746071*G/G × rs34315573*G/G | 4E-04 | 0.0016 | 7.85 | 2.26–27.18 |
| rs2746071*A/A × rs34315573*G/G | 5E-04 | 0.001 | 0.33 | 0.18–0.61 | |
| Татары | |||||
| NXPH1 × NTRK3 | rs10272916*C/C × rs11631508*A/A | 0.0063 | 0.014 | 3.52 | 1.39–9.05 |
| rs10272916*C/C × rs11631508*G/G | 0.0278 | 0.038 | 0.0005 | 0.66–0.81 | |
| NTRK3 × BDNF | rs3825884*C/T × rs7124442*T/T | 0.0423 | 0.042 | 1.81 | 1.02–3.21 |
| rs3825884*C/T × rs7124442*С/T | 0.0416 | 0.048 | 0.54 | 0.30–0.98 | |
| GRM3 × DRD2 | rs6465084*A/A × rs6275*C/T | 0.001 | 0.007 | 3.16 | 1.62–6.16 |
| rs6465084*A/A × rs6275*T/T | 0.005 | 0.0175 | 3.11 | 1.43–6.76 | |
| rs6465084*G/G × rs6275*T/C | 0.023 | 0.04 | 0.33 | 0.13–0.82 | |
Таким образом эти процессы могут обуславливать избыток дофамина у больных параноидной шизофренией. Полученные нами данные согласуются с гипотезой активации дофаминергической системы при шизофрении.
В группе лиц с ПШ и контроле у русских по этнической принадлежности статистически значимой (p = 0.0107) моделью определена комбинация из двух ДНК-локусов: RGS2 (rs2746071) и GRIN2B (rs34315573), взаимодействие которых лежит в основе предрасположенности к развитию параноидной шизофрении. Тестируемая сбалансированная точность (Bal. Acc.) данной модели составила 0.64, чувствительность (Se) – 0.69, специфичность (Sp) – 0.58, воспроизводимость результата (CV Consistency) – 10/10 (рис. 1,б, табл. 1).
К сочетаниям повышенного риска развития заболевания (рис. 1,б, выделены темно-серым фоном) были отнесены четыре различных комбинации генотипов, из которых наиболее значимой оказалась: rs2746071*G/G и rs34315573*G/G (p = = 0.0004, OR = 7.85, CI95% 2.26–27.18). К сочетаниям пониженного риска развития заболевания были отнесены три различных комбинации генотипов, из которых наиболее значимой оказалась: rs2746071*A/A и rs34315573*G/G (p = 0.0005, OR = = 0.33, CI95% 0.18–0.61) (табл. 2).
Результаты данного исследования частично согласуются с данными, полученными вследствии анализа ассоциации по отдельным локусам гена RGS2, и анализа гаплотипов, показавших, что генотип rs2746071*A/A понижает риск развития ПШ у русских и татар [7]. Однолокусный анализ не установил ассоциации ОНП rs34315573 гена GRIN2B с риском развития ПШ ни в одной из этнических групп, тогда как анализ межгенных взаимодействий выявил комбинацию однонуклеотидных полиморфных вариантов (ОНП) rs34315573 гена GRIN2B и rs2746071 гена RGS2, что возможно объясняется эпистатическим действием генов. Литературных данных, описывающих данную полученную нами модель ген-генного взаимодействия с риском развития шизофрении, не найдено. Данное взаимодействие генов, приводящее к повышенному риску развития ПШ, можно объяснить тем, что RGS2 ускоряет дезактивацию G-белка для снижения ответа нейронального рецептора, сопряженного с G-белком GPCR с нейротрансмиттерами [22], в том числе и с глутаматом. Предположительно это взаимодействие может быть ассоциировано с патогенезом шизофрении и других психических заболеваний, что также согласуется с гипотезой гипофункции глутаматергической системы у больных ПШ [3].
При анализе межгенных взаимодействий у индивидов татарской этнической принадлежности, было выявлено четыре двухлокусных модели, детерминирующих развитие ПШ – BDNF × NTRK2, NXPH1 × NTRK3, BDNF × NTRK3, GRM3 × DRD2 (табл. 1). В группе лиц с ПШ и контроле у татар (по этнической принадлежности) статистически значимой (p = 0.0010) моделью определена комбинация из двух ДНК-локусов: GRM3 (rs6465084) и DRD2 (rs6275), взаимодействие которых лежит в основе предрасположенности к развитию параноидной шизофрении. Тестируемая сбалансированная точность (Bal. Acc.) данной модели составила 0.71, чувствительность (Se) – 0.62, специфичность (Sp) – 0.81, воспроизводимость результата (CV Consistency) – 8/10 (рис. 2,а; табл. 1).
Рис. 2.
а – сочетания генотипов полиморфных локусов генов GRM3 (rs6465084) и DRD2 (rs6275), ассоциированные с повышенным и пониженным риском развития ПШ у татар; б – сочетания генотипов полиморфных локусов генов NXPH1 (rs10272916) и NTRK3 (rs11631508), ассоциированные с повышенным и пониженным риском развития ПШ у татар; в – сочетания генотипов полиморфных локусов генов NTRK3 (rs3825884) и BDNF (rs7124442), ассоциированные с повышенным и пониженным риском развития ПШ у татар.
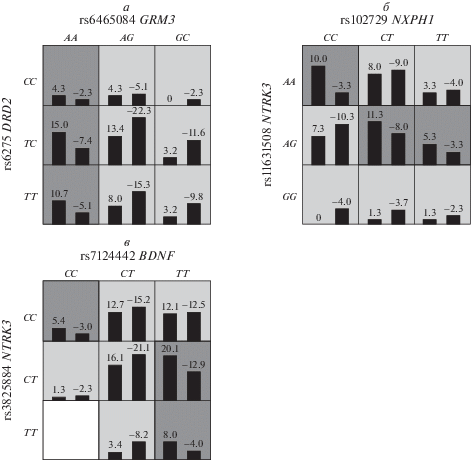
К сочетаниям повышенного риска развития заболевания были отнесены три различных комбинации генотипов, из которых наиболее значимой оказалась: rs6465084*A/A × rs6275*T/T (p = 0.001, OR = 3.16, CI95% 1.62–6.16); rs6465084*A/A и rs6275*C/T (p = 0.005, OR = 3.11, CI95% 1.43–6.76). К сочетаниям пониженного риска развития заболевания были отнесены шесть различных комбинаций генотипов, из которых наиболее значимой оказалась: rs6465084*G/G × rs6275*T/C (p = 0.023, OR = 0.33, CI95% 0.13–0.82) (табл. 2).
Результаты исследования частично согласуются с данными, полученными вследствии анализа ассоциации по отдельным локусам гена GRM3, показавших, что генотип rs6465084*A/A повышает, а rs6465084*G/G – понижает риск развития ПШ у татар [11].
Однако в ходе однолокусного анализа ассоциации ОНП rs6275 гена DRD2 с риском развития ПШ не было установлено ни в одной из этнических групп, тогда как анализ межгенных взаимодействий выявил взаимодействие rs6275 гена DRD2 и rs6465084 гена GRM3. Это возможно объясняется эпистатическим действием генов, играющим важную роль в детерминации биологических признаков [18]. Литературных данных, описывающих данную полученную нами модель ген-генного взаимодействия, не найдено. Однако данное взаимодействие можно объяснить существованием взаимодействия дофаминергической и глутаматергической систем и его роли в патогенезе шизофрении, при котором нарушение в работе этих двух нейротрансмиттерных систем усиливают друг друга [21].
В группе лиц с параноидной шизофренией и контроле татар по этнической принадлежности статистически значимой (p = 0.00157) моделью определена комбинация из двух ДНК-локусов: BDNF (rs1491850) и NTRK2 (rs1899640), взаимодействие которых лежит в основе предрасположенности к развитию параноидной шизофрении. Тестируемая сбалансированная точность (Bal. Acc.) данной модели составила 0.56, чувствительность (Se) – 0.60, специфичность (Sp) – 0.51, воспроизводимость результата (CV Consistency) – 10/10 (табл. 1). Однако поскольку специфичность данной модели составила 51%, она была исключена из дальнейшего анализа.
При исследовании ген-генных взаимодействий изученных полиморфных локусов с помощью программы MDR, определена двухлокусная модель взаимодействия ДНК-локусов NXPH1 (rs10272916) и NTRK3 (rs11631508), приводящая к развитию ПШ в группе татарской этнической принадлежности (рис. 2,б, табл. 1). Тестируемая сбалансированная точность (Bal. Acc.) данной модели составила 0.62, чувствительность (Se) – 0.63, специфичность (Sp) – 0.61, повторяемость результата (CV Consistency) – 10/10, p = 0.00101 (рис. 2,б, табл. 1).
К сочетаниям повышенного риска развития заболевания были отнесены четыре различных комбинации генотипов, из которых наиболее значимой оказалась: rs10272916*C/C и rs11631508*A/A (p = 0.0063, OR = 3.52, CI95% 1.39–9.05). К сочетаниям пониженного риска развития заболевания были отнесены четыре различных комбинации генотипов, из которых наиболее значимой оказалась: rs10272916*C/C и rs11631508*G/G (p = 0.0278, OR = 0.0005, CI95% 0.66–0.81) (табл. 2).
В группе лиц с ПШ и контроле татарской этнической принадлежности обнаружена также статистически значимая двухлокусная модель взаимодействия генов NTRK3 (rs3825884) и BDNF (rs7124442) (рис. 2,в, табл. 1). Сбалансированная точность (Bal. Acc.) данной модели составила 0.58, чувствительность (Se) – 0.47, специфичность (Sp) – 0.70, воспроизводимость результата (CV Consistency) – 10/10, p = 0.001673 (рис. 2,в, табл. 1). Были определены три сочетания генотипов повышенного риска, из которых наиболее значимым оказалось rs3825884*C/T и rs7124442*T/T (p = 0.04, OR = 1.81, CI95% 1.02–3.21) и пять сочетания генотипов пониженного риска, из которых наиболее значимым оказался: rs3825884*C/T и rs7124442*С/T (p = 0.0447, OR = = 0.5, CI95% 0.25–0.98) (табл. 2).
ОБСУЖДЕНИЕ
В результате данного исследования обнаружено взаимодействие ОНП-генов NTRK3 (rs11631508) иNXPH1 (rs10272916), повышающих и понижающих риск ПШ у татар, что частично согласуются с данными, однолокусного анализа ассоциации, показавшего ассоциацию ОНП rs1946698, rs7170062, rs11631508 гена NTRK3 и rs7801099 гена NXPH1 у русских с риском развития ПШ [9]. Литературных данных, описывающих данную полученную нами модель ген-генного взаимодействия, не найдено. Однако известно, что ген NTRK3 вовлечен в развитие олигодендроцитов и миелинизацию нервных волокон головного мозга [23]. Существуют единичные данные, свидетельствующие о роли нейроксифилинов в механизме чувственной обработки информации и координации движений [24] и о вовлеченности гена NXPH1 в развитие заболеваний аутистического спектра у европейцев [25]. На основании данных о повышении уровня экспрессии этих генов в гиппокампе можно предположить об их вовлеченности в патогенез шизофрении.
В результате данного исследования обнаружено взаимодействие ОНП-генов NTRK3 (rs3825884) иBDNF (rs7124442), повышающих и понижающих риск ПШ у татар, что частично согласуeтся с данными однолокусного анализа ассоциации, показавшего ассоциацию ОНП rs1946698, rs7170062, rs11631508 гена NTRK3 у русских. Однако ассоциации отдельных ОНП и гаплотипов гена BDNF с риском развития ПШ у русских и татар нами не выявлено [9]. Литературных данных, описывающих данную полученную нами модель ген-генного взаимодействия, не найдено. Однако интерпретировать данные результаты можно основываясь на важной роли нейротрофических факторов в развитии головного мозга и синаптической пластичности.
Результаты проведенного анализа моделирования межгенных взаимодействий частично согласуются с результатами исследования Z. Lin с соавт., также показавших взаимодействие генов BDNF и NTRK2, повышающих риск развития параноидной шизофрении у китайцев. Однако в исследовании Z. Lin с соавт. была установлена модель с участием одних ОНП: NTRK2 (rs1387923, rs2769605) × BDNF (rs6265) [26], а в данном исследовании – c другими ОНП. Полученные ранее результаты также продемонстрировали взаимодействие генов BDNF и NTRK2 у европейцев [27], африканцев [28] и китайцев [29, 30]. В настоящем исследовании ассоциации с риском развития ПШ ни по отдельным полиморфным локусам rs1491850 гена BDNF rs1899640 гена NTRK2, ни в анализе гаплотипов установлено не было ни в этнической группе русских, ни у татар. Это возможно связано и с размером выборки, а данная модель BDNF × NTRK2 была исключена из дальнейшего анализа, поскольку, специфичность данной модели составила 51%. Необходимо отметить, что шизофрения представляет собой сложное заболевание, поэтому отдельные генетические варианты могут оказывать только незначительные, трудно детектируемые эффекты на его патогенез. Возможно в развитии шизофрении BDNF и его рецептор NTRK2 могут действовать синергично, но пока мы не знаем, как именно. Кроме того известно, что рецептор NTRK2 обладает высокой аффинностью к BDNF и BDNF/NTRK2 сигнальный путь играет ключевую роль в патогенезе шизофрении [31].
На основе полученных данных о моделях межгенных взаимодействий, а также результатов предыдущего исследования, с помощью метода MDR был проведен кластерный анализ, показывающий характер взаимодействия между полиморфными локусами генов нейротрофинов, нейрексинов и нейротрансмиттерных систем у русских и татар (рис. 1, 2).
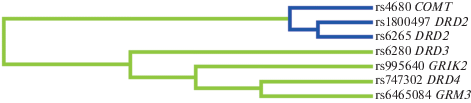
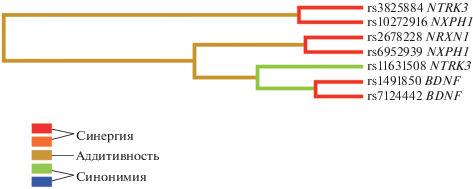
Полиморфные локусы гена NTRK3 и гена NXPH1, а также ОНП гена NRXN1 и NXPH1 действуют синергично, взаимодействия ОНП других генов проявляют синонимичный эффект (рис. 3, 4, 5).
Рис. 3.
Межгенные взаимодействия полиморфных локусов генов нейротрофинов, вовлеченных в формирование предрасположенности к ПШ у татар.
ЗАКЛЮЧЕНИЕ
Таким образом, проведенный анализ межгенных взаимодействий дал возможность установить ДНК-локусы изученных генов, взаимодействующие при формировании предрасположенности к параноидной шизофрении у русских и татар. В обеих этнических группах наблюдаются существенные отличия в структуре и характере взаимосвязей между полиморфными локусами, детерминирующими развитие данного заболевания. Полученные результаты анализа межгенных взаимодействий демонстрируют значимую роль полиморфных вариантов генов DRD2, COMT, RGS2, GRIN2B, GRM3, BDNF, NTRK3, NXPH1, входящих в состав большинства статистических значимых моделей.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Lin Z., Su Y., Zhang C. et al. The interaction of BDNF and NTRK2 gene increases the susceptibility of paranoid schizophrenia // PLoS One. 2013. V. 8. № 9. P. e74264.https://doi.org/10.1371/journal.pone.0074264
Guan L., Wang Q., Wang L. et al. Common variants on 17q25 and gene–gene interactions conferring risk of schizophrenia in Han Chinese population and regulating gene expressions in human brain // Mol. Psychiatry. 2016. V. 21. № 9. P. 1244–1250. https://doi.org/10.1038/mp.2015.204
Kaur H., Jajodia A., Grover S. et al. Synergistic association of PI4KA and GRM3 genetic polymorphisms with poor antipsychotic response in south Indian schizophrenia patients with low severity of illness // Neuropsychiatr. Genet. 2014. V. 165. № 8. P. 635–646. https://doi.org/10.1002/ajmg.b.32268
Benzel I., Bansal A., Browning B.L. et al. Interactions among genes in the ErbB–Neuregulin signalling network are associated with increased susceptibility to schizophrenia // Behav. Brain Funct. 2007. V. 3. № 1. P. 31.https://doi.org/10.1186/1744-9081-3-31
Giusti-Rodríguez P., Sullivan P.F. The genomics of schizophrenia: update and implications // J. Clin. Invest. 2013. V. 123. № 11. P. 4557–4563. https://doi.org/10.1172/JCI66031
Гареева А.Э., Закиров Д.Ф., Хуснутдинова Э.К. Анализ ассоциации полиморфных вариантов гена GRIN2B с параноидной шизофренией и эффективностью терапии типичными нейролептиками у русских и татар из Республики Башкортостан // Генетика. 2013. Т. 49. № 9. С. 1106–1113. https://doi.org/10.7868/S001667581308002X
Гареева А.Э., Закиров Д.Ф., Хуснутдинова Э.К. Полиморфизм гена RGS2: генетические маркеры риска развития шизофрении и фармакогенетические маркеры эффективности типичных нейролептиков // Мол. биол. 2013. Т. 47. № 6. С. 934–941. https://doi.org/10.7868/S0026898413060049
Гареева А.Э., Хуснутдинова Э.К. Полиморфизм генов рецепторов глутамата и риск развития параноидной шизофрении у русских и татар (Республики Башкортостан) // Мол. биол. 2014. Т. 48. № 5. С. 771–781. https://doi.org/10.7868/S0026898414050036
Гареева А.Э., Тракс Т., Кокс С., Хуснутдинова Э.К. Роль генов нейротрофинов и нейрексинов в развитии параноидной шизофрении у русских и татар // Генетика. 2015. Т. 51. № 7. С. 799–811. https://doi.org/10.7868/S0016675815060065
Гареева А.Э., Киняшева К.О., Галактионова Д.Ю. и др. Полиморфизм генов нейромедиаторных систем мозга: поиск фармакогенетических маркеров эффективности галоперидола у русских и татар // Мол. биол. 2015. Т. 48. № 6. С. 771–781. https://doi.org/10.7868/S0026898415050079
Киняшева К.О., Гареева А.Э., Хуснутдинова Э.К. Изучение роли полиморфных локусов генов GRM3 и GAD2 в развитии параноидной шизофрении у русских и татар из Башкортостана // Мед. ген. 2016. Т. 15. № 12. С. 23–28.
Бочков Н.П. Клиническая генетика. М.: ГЭОТАР-МЕД., 2002. 448 с.
Трифонова Е.А., Еремина Е.Р., Урнов Ф.Д., Степанов В.А. Генетическое разнообразие и структура неравновесия по сцеплению гена MTHFR в популяциях северной Евразии // Acta Naturae. 2012. Т. 4. № 1. С. 55–71.
Mathew C.C. The isolation of high molecular weight eucariotic DNA // Methods in Molecular Biology / Ed. Walker J.M. N.Y.; Haman press, 1984. V. 2. P. 31–34.
Ritchie M.D., Hahn L.W., Roodi N. et al. Multifactor-dimensionality reduction reveals high-order interactions among estrogen-metabolism genes in sporadic breast cancer // Am. J. Hum. Genet. 2001. V. 69. № 1. P. 138–147. https://doi.org/10.1086/321276
Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. Royal Stat. Soc. Series B (Methodological). 1995. V. 57. P. 289–300.
Lou X.Y., Chen G.B., Yan L. et al. A generalized combinatorial approach for detecting gene-by-gene and gene-by-environment interactions with application to nicotine dependence // Am. J. Hum. Genet. 2007. V. 80. № 6. P. 1125–1137. https://doi.org/10.1086/518312
Ebstein R.P. The molecular genetic architecture of human personality: beyond self–report questionnaires // Mol. Psychiatry. 2006. V. 11. № 5. P. 427–445. https://doi.org/10.1038/sj.mp.4001814
Zhang S., Zhang M., Zhang J. Association of COMT and COMT–DRD2 interaction with creative potential // Front. Hum. Neurosci. 2014. V. 8. P. 216. https://doi.org/10.3389/fnhum.2014.00216
Peng S., Yu S., Wang Q. et al. Dopamine receptor D2 and catechol–O–methyltransferase gene polymorphisms associated with anorexia nervosa in Chinese Han population // Neurosci. Lett. 2016. V. 616. P. 147–151. https://doi.org/10.1016/j.neulet.2016.01.036
Laruelle M. Schizophrenia: from dopaminergic to glutamatergic interventions // Curr. Opin. Pharmacol. 2014. V. 14. P. 97–102. https://doi.org/10.1016/j.coph.2014.01.001
Kimple A.J., Bosch D.E., Giguère P.M., Siderovski D.P. Regulators of G–protein signaling and their Gα substrates: promises and challenges in their use as drug discovery targets // Pharmacol. Rev. 2011. V. 63. № 3. P. 728–749. https://doi.org/10.1124/pr.110.003038
Otnaess M.K., Djurovic S., Rimol L.M. et al. Evidence for a possible association of neurotrophin receptor (NTRK-3) gene polymorphisms with hippocampal function and schizophrenia // Neurobiol. Dis. 2009. V. 34. № 3. P. 518–524. https://doi.org/10.1016/j.nbd.2009.03.011
Luo X., Huang L., Han L. et al. Systematic prioritization and integrative analysis of copy number variations in schizophrenia reveal key schizophrenia susceptibility genes // Schizophr. Bull. 2014. V. 14. № 3. P. 472–484. https://doi.org/10.1093/schbul/sbu045
Salyakina D., Cukier H.N., Lee J.M. et al. Copy number variants in extended autism spectrum disorder families reveal candidates potentially involved in autism risk // PLoS One. 2011. V. 6. № 10. e26049. https://doi.org/10.1371/journal.pone.0026049
Lin Z., Su Y., Zhang C. et al. The interaction of BDNF and NTRK2 gene increases the susceptibility of paranoid schizophrenia // PLoS One. 2013. V. 17. № 8. e74264. https://doi.org/10.1371/journal.pone.0074264
Bremer T., Diamond C., McKinney R. et al. The pharmacogenetics of lithium response depends upon clinical co–morbidity // Mol. Diagn. Ther. 2007. V. 11. № 3. P. 161–170. https://doi.org/10.1007/BF03256238
Smith E.N., Bloss C.S., Badner J.A. et al. Genome-wide association study of bipolar disorder in European American and African American individuals // Mol. Psychiatry. 2009. V. 14. № 8. P. 755–763. https://doi.org/10.1038/mp.2009.43
Wang Z., Li Z., Gao K. et al. Association of BDNF gene polymorphism with bipolar disorders in Han Chinese population // Genes Brain Behav. 2012. V. 11. № 5. P. 524–528. https://doi.org/10.1111/j.1601-183X.2012.00797.x
Li Z., Zhang Y., Wang Z. et al. The role of BDNF, NTRK2 gene and their interaction in development of treatment-resistant depression: data from multicenter, prospective, longitudinal clinic practice // J. Psychiatr. Res. 2013. V. 47. № 1. P. 8–14. https://doi.org/10.1016/j.jpsychires.2012.10.003
Weickert C.S., Hyde T.M., Lipska B.K. et al. Reduced brain-derived neurotrophic factor in prefrontal cortex of patients with schizophrenia // Mol. Psychiatry. 2003. V. 8. № 6. P. 592–610. https://doi.org/10.1038/sj.mp.4001308
Дополнительные материалы отсутствуют.