Генетика, 2020, T. 56, № 10, стр. 1200-1204
Тандемные слияния в эволюции кариотипа у эфиопских эндемичных грызунов
Н. Ш. Булатова 1, *, Р. С. Наджафова 1, Д. С. Костин 1, Л. А. Лавренченко 1, В. Е. Спангенберг 2
1 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
* E-mail: bulatova.nina@gmail.com
Поступила в редакцию 25.11.2019
После доработки 13.02.2020
Принята к публикации 19.02.2020
Аннотация
Большое число эндемичных видов, типичное для горных эфиопских грызунов, находит соответствие с их впечатляющим кариотипическим разнообразием. Впервые представлены характеристики кариотипа с диплоидным числом 52, новым для рода Stenocephalemys, эндемика Эфиопского нагорья, в котором до сих пор были определены кариотипические характеристики четырех таксонов с диплоидными числами 54, 50 и 46. Новый кариотип ассоциируется с новым видом S. “pseudogriseicauda”, открытым по геномным признакам недавно. Вместе с 46-хромосомным видом, кариотипированным ранее, это уже второй таксон в пределах рода, отмеченный тандемной хромосомной перестройкой, которой уделяется особое внимание в сводках по хромосомной эволюции млекопитающих, однако еще мало изученной у грызунов.
Природа Эфиопского нагорья на северо-востоке Африки характеризуется исключительным разнообразием эндемиков. Эта особенность была отмечена еще Н.И. Вавиловым во время его уникальной экспедиции 1927 г. по изучению генетических ресурсов растительных культур в горных районах Абиссинии и Эритреи [1]. Систематические исследования зоологических таксонов, начавшиеся спустя десятилетия в Эфиопии, которая географически и исторически была в длительной изоляции, привели и продолжают приводить ко множеству открытий в отношении эндемиков, которыми богаты горные районы страны [2]. С применением современных методов на генетической основе достигнут поистине вавиловский масштаб открытий в исследовании эндемичных таксонов млекопитающих, особенно у представителей отряда грызунов. Первоначальный список эндемичных видов, определяемых по зоологическим критериям, включал 14 названий грызунов-эндемиков двух горных эфиопских плато – Восточного и Западного, разделенных Рифтовой долиной [2]. Из этого числа большинство видов были отмечены на обоих плато (восемь видов), еще четыре вида – на Западном плато и лишь два вида – только на Восточном плато. В сравнении с этим исходным списком по первым же анализам кариотипа и аллозимов у грызунов горного массива Бале на Восточном плато [3] были открыты новые эндемики в четырех родах (Mus, Stenocephalemys, Lophuromys, Otomys) – криптические формы, определяемые по кариотипу и аллозимам, позднее получившие видовые наименования [4, 5]. До их открытия четвертый из названных родов, Otomys, в списке эндемиков не состоял [2].
Значительные изменения затронули видовой состав эндемичного для Эфиопии рода Stenocephalemys, который был представлен в исходном списке [2] двумя эндемиками, распространенными, как полагали систематики, один – S. albocaudatus – на Восточном плато, другой – S. griseicauda – на обоих плато. По результатам сравнительно-цитогенетического и главным образом молекулярно-генетического изучения [6–8] к этим двум видам с близкими кариотипами и одинаковым диплоидным числом (2N = 54) в настоящее время присоединены еще два вида c меньшим диплоидным числом (2N = 46), также представленные в начальном списке эндемиков, но под иными родовыми наименованиями [2] – Praomys albipes (Восточное и Западное плато) и P. ruppi (Западное плато), все вместе ныне составляющие единый род Stenocephalemys [5, 8]. Дополнительно к этому два новых не известных ранее таксона видового уровня были открыты в пределах ареала рода в изолированных горных районах на Западном плато. Так, вместо ожидаемого 54-хромосомного кариотипа S. griseicauda у северной границы ареала на Западном плато был обнаружен новый кариотип с диплоидным числом 2N = 50, что параллельно с молекулярно-генетическими данными указывало на видовую обособленность таксона, который получил рабочее наименование Stenocephalemys sp. “A” [5, 6]. Кроме того, найдены аргументы в пользу выделения из классического вида S. griseicauda (2N = 54) на основании молекулярно-генетических критериев отдельной популяции из Дебре Сина на Западном плато под условным названием S. “pseudogriseicauda” [8]. Как выясняется, для Западного плато не исключены и дальнейшие открытия новых кариотипов, возможно новых видов [5]. В настоящем сообщении представлены характеристики кариотипа с новым для рода диплоидным числом 2N = 52 в ассоциации с последним из открытых новых видов, что актуально для изучения состава рода, таксономического определения изолированных популяций горных регионов и понимания их генетических взаимоотношений.
Материал для настоящего исследования собран во время работы Совместной Российско-Эфиопской Биологической Экспедиции (СРЭБЭ) в 2011 и 2015 гг. Препараты метафазных хромосом были получены из клеточной суспензии костного мозга, фиксированной в полевых условиях от двух животных из горного района Дебре Сина (Debre Sina) на Западном плато. Оба были записаны в полевом журнале под родовым названием Stenocephalemys, под номерами 1935 (самка) и 1950 (самец) и определены до вида позже по геномным маркерам. Два этих номера присутствуют в обширной сводке данных молекулярно-генетического изучения этого рода эфиопских грызунов [8], где оба по ядерным маркерам ассоциированы с новым видом под условным названием S. “pseudogriseicauda” и выявляют митотип, классифицированный как “gr-2” в контрасте с соответствующими характеристиками “настоящих” S. griseicauda. Цитогенетический анализ проведен в лаборатории микроэволюции млекопитающих ИПЭЭ РАН согласно стандартной процедуре кариотипирования мелких млекопитающих [9] с применением дифференциальной С-окраски [10] гетерохроматических районов хромосом, ранее применявшейся лишь однажды для идентификации половых хромосом в сравнительном анализе трех видов рода с разными 2N (54 и 46) [11]. Методом FISH при фоновом окрашивании DAPI по протоколу с применением меченых олигонуклеотидов 5'-TAMRA-(CCCTAA)4 [12] было показано распределение сигнала сайтов теломерной ДНК на метафазных хромосомах самки из Дебре Сина для уточнения характера предполагаемых хромосомных перестроек. Всего было просмотрено более 50 метафазных пластинок, их цифровые изображения использованы для установления диплоидного числа и морфологических особенностей хромосомного набора. Пары гомологов в итоговых кариограммах разложены условно в порядке убывания длин хромосом, на врезках на отдельных парах показаны выявленные специфические особенности морфологии некоторых хромосом (рис. 1,а–в). В сравнительном анализе кариотипа S. griseicauda (самец под номером 2724 и самка 2725 из горного района Арси (Arsi) на Восточном плато), применен тот же порядок ранжирования хромосом (рис. 1,г–д), которым отличаются наши кариограммы от первых описаний кариотипа этого вида из региона Бале и, соответственно, от нумерации пар, различной у разных авторов предшествующих публикаций [3, 7, 11]. Эти два экземпляра также представлены в общей таблице данных молекулярно-генетического изучения под видовым названием S. griseicauda и характеризуются митотипом “gr-1” и резкими отличиями от популяций с митотипом “gr-2” по ядерным маркерам [8].
Рис. 1.
Кариотипы видов Stenocephalemys, различных по 2N (52 и 54) и первой паре акроцентриков А1*/A1 (подчеркнуты). 2N = 52 – новый кариотип. S. “pseudogriseicauda”, Дебре Сина: хромосомный набор самки при общей окраске (а) и С-окраске (б), FNA = 52. (в) – на врезке две первых пары хромосом самца, XY и A1* – обычная окраска, и хромосомы X и A1* самки с локализацией теломерного маркера; 2N = 54. S. griseicauda, Арси: хромосомы самца при общей окраске, FNA = 56 (г) и самки при С-окраске, FNA = 57 (д). XX, XY – половые хромосомы, m – маленький метацентрик, st – субтелоцентрики, st? – возможная гетерозигота. На схеме тандемной перестройки (е) стрелкой показано направление центромерно-теломерного слияния двух малых акроцентриков 54-хромосомного кариотипа с образованием большого маркерного акроцентрика 52-хромосомного кариотипа, по аналогии с изученными ранее кариотипами 2N = 54/2N = = 46 [7].
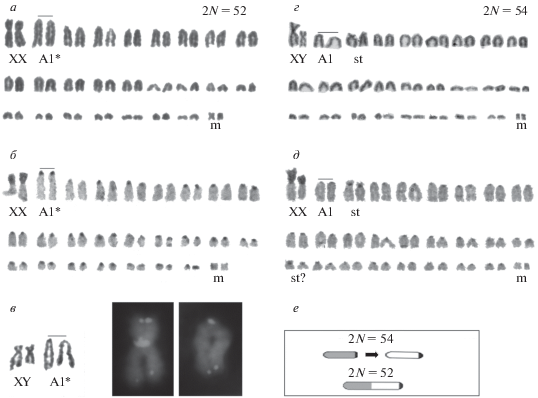
При большом общем сходстве кариотипы двух таксонов разных плато видоспецифичны. У S. “pseudogriseicauda” из Дебре Сина (Западное плато) диплоидное число равно 52, это значение новое для рода. У S. griseicauda из Арси диплоидное число 54 – общее с конспецифическими популяциями Восточного плато. В этих кариотипах преобладающее число пар являются акроцентрическими. Первая пара акроцентриков в кариотипах с 2N = 52 и 54 резко различается величиной и обозначена, соответственно, А1* и А1 в кариограмме. В обоих случаях самая крупная двуплечая пара представлена субмета- и метацентрическими половыми хромосомами XX-XY, мелкая пара – метацентрики, m. В 52-хромосомном кариотипе других двуплечих пар не наблюдается (FN = 56, FNA = 52), тогда как у 54-хромосомных особей короткое плечо определяется еще в некоторых аутосомах, классифицируемых как субтелоцентрики st (рис. 1). В каждом из двух кариотипов (2N = 54, 2N = 52) половая пара выделяется не только морфологией, но и С-положительной окраской короткого плеча. Пара Х-хромосом самки с кариотипом 2N = 52 выглядит гомоморфной, у 54-хромосомной самки половая пара гетероморфная, различия гомологов здесь вызваны изменчивостью длины С-гетерохроматинового плеча (рис. 1,б, д). У самцов Y-хромосома довольно крупная, двуплечая (субметацентрик), но меньше Х‑хромосомы (рис. 1,в, г). Добавочный гетерохроматин короткого плеча и связанная с ним изменчивость формы (соотношение короткого и длинного плеч) и общего размера Х-хромосомы уже известны для кариотипов с разным диплоидным числом, изученных у трех видов из региона Бале – 2N = 54 (S. griseicauda, S. albocaudatus) и 2N = 46 (S. albipes), а для двуплечей Y-хромосомы тех же видов была показана сплошная С-окраска [11].
В нашем материале также впервые показано распределение гетерохроматических районов в полном наборе хромосом S. griseicauda (рис. 1,д). В обоих случаях почти для всех аутосом характерна только прицентромерная локализация С-блоков, кроме маленькой пары метацентриков (m), которая совсем не выявила С-окраски (рис. 1,б, д). Видно, что по результатам С-окраски не обнаруживается участия гетерохроматина в формировании маркерной пары А1* 52-хромосомного кариотипа. С учетом этого, а также разницы в значениях 2N, тандемное межхромосомное слияние двух меньших пар в одну большую могло бы быть причиной образования акроцентрической маркерной пары А1* 52-хромосомного кариотипа, что понижает индекс числа плеч до минимального значения для рода, FNA = 52. Число плеч хромосом 54-хромосомного кариотипа различно у двух нами изученных экземпляров из-за отсутствия мелкой пары субтелоцентриков у самца и гетерозиготности субтелоцентрик/акроцентрик, отмеченной у самки (FNA = 56, FNA = 57, соответственно, рис. 1,г, д). Это снижает диагностическую ценность признака (FNA = 58), входящего в таксономический анализ [6].
В поисках цитологического доказательства тандемного слияния с участием теломерного района была изучена локализация теломерных повторов в 52-хромосомном кариотипе. Хотя фоновая окраска DAPI показывает раздельные неравные две части большого маркерного акроцентрика А1*, однако между частями эухроматина сигнал тДНК не выявляется (рис. 1,в). Это указывает на то, что в данном случае тандемная ассоциация происходила по стандратной схеме структурных перестроек хромосом с разрывами и новыми соединениями без сохранения “лишних” теломер участников межхромосомного слияния. Другой тип перестройки показывает Х-хромосома (рис. 1,в) ярким сигналом теломерного маркера в месте соединения “добавочного” короткого плеча, представленного гетерохроматином, и “основного” эухроматинового длинного плеча, которое по генетическому содержанию является гомологом “истинной” Х-хромосомы, общей для класса млекопитающих. Для каждой хромосомы этого кариотипа показана стандартная полярная локализация точечного теломерного сигнала, как и на изображении маркерного акроцентрика А1* (рис. 1,в).
Диплоидное число хромосом 2N = 52 – новое для рода Stenocephalemys в последовательном и почти полном ряду изменения 2N от большего значения (54) к меньшим (52, 50, 46), кроме не найденного пока диплоидного числа 2N = 48. Анализ хромосомных перестроек между кариотипами с крайними значениями (2N = 54 и 46) ранее показал [7], что их различия могли происходить за счет межхромосомного слияния двух типов, как робертсоновских (слияния акроцентриков центромерными районами), так и тандемных (центромерно-теломерные слияния). По данным G-окраски, в частности, тандемное слияние двух акроцентриков исходного 54-хромосомного набора могло вести к образованию большого маркерного акроцентрика 46-хромосомного кариотипа по схеме (Sg4, Sg11) → (Pa8) в номенклатуре оригинального исследования [7]. Одной аналогичной перестройки достаточно для объяснения происхождения маркерного акроцентрика А1* нового 52-хромосомного кариотипа в сравнении с 54-хромосомным, предположительно исходным ддиплоидным набором (рис. 1,е).
Хромосомные перестройки типа тандемного слияния известны, но менее изучены у млекопитающих, чем робертсоновские перестройки [9]. Интерес к ним связан с обнаружением в некоторых отрядах филетических линий, отмеченных множественными тандемными слияниями [13, 14], что понимается как выражение кариотипической ортоселекции [14]. Подобные примеры не обнаруживались до сих пор у грызунов. Между тем тандемное слияние, характеризующее новый 52-хромосомный кариотип эфиопского грызуна, уже не первый случай для рода Stenocephalemys, но в нашем рассмотрении может быть первым в ряду последовательного сокращения 2N от 54 до 46. Участников тандемного слияния в составе маркерного акроцентрика А1* еще предстоит определить. Однако уже видно, что неважно, окажется ли он одним и тем же или разным у нового таксона и ранее изученного 46-хромосомного вида (S. albipes), поскольку у последнего в кариотипе были идентифицированы одновременно две пары хромосом, которые могли быть образованы путем тандемного слияния [7].
Из сказанного можно заключить, что в данной группе эволюция 2N не связана с одной единственной тандемной перестройкой. Мы допускаем целый спектр тандемных вариаций в ряду изменчивости по 2N в кариотипах Stenocephalemys, возможно в корреляции со сложностью и противоречивостью молекулярных видовых древ рода, построенных по признакам митохондриального (четыре видовых таксона) и ядерного геномов (до шести таксонов) [8], что вызывает особенный исследовательский интерес к этому роду грызунов. Помимо первых сведений по 2N и FNА, включенных в видовые списки геномного исследования Stenocephalemys [5, 8], до сих пор из восьми ветвей в трех группах кластеров ядерного древа достаточно подробно изучены кариотипы представителей лишь трех ветвей (классические виды S. albocaudatus, S. griseicauda, S. albipes). Новые виды и кандидаты в видовые списки еще ждут полного сравнительно-кариологического изучения для установления истинного масштаба тандемных перестроек и их эволюционного значения в модели рода Stenocephalemys эфиопских эндемичных грызунов.
Авторы признательны д. б. н. И.Ю. Баклушинской (ИБР им. Н.К. Кольцова РАН) и зав. лаб., д. б. н. О.Л. Коломиец (ИОГЕН им. Н.И. Вавилова РАН) за помощь в обеспечении лабораторного исследования. Полезными были советы к. б. н. С.В. Павловой (ИПЭЭ им. А.Н. Северцова РАН) по дизайну иллюстраций.
Работа частично поддержана грантом РФФИ № 18-04-00563-а.
Все применимые международные, национальные и институциональные принципы ухода и использования животных были соблюдены.
Исследования людей в качестве объекта не проводились.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Вавилов Н.И. Географические закономерности в распределении генов культурных растений (Предварительное сообщение) // Тр. прикл. бот., генет. и сел. Ленинград: 1927. Т. 17. Вып. 3. С. 411–428.
Yalden D.W., Largen M.J. The endemic mammals of Ethiopia // Mammal Review. 1992. V. 22. P. 115–150.
Lavrenchenko L.A., Milishnikov A.N., Aniskin V.M. et al. The genetic diversity of small mammals of the Bale Mountains Ethiopia // SINET: Ethiopian J. Sci. 1997. V. 20. № 2. P. 213–233.
Lavrenchenko L.A., Bekele A. Diversity and conservation of Ethiopian mammals: What have we learned in 30 years? // Ethiop. J. Biol. Sci. 2017. V. 16 (Suppl.). P. 1–20.
Bryja J., Meheretu Y., Šumbera R. et al. Annotated checklist, taxonomy and distribution of rodents in Ethiopia // Folia Zool. 2019. V. 68. № 3. P. 117–213. https://doi.org/10.25225/fozo.030.2019
Лавренченко Л.А., Верхейен Э. Реконструкция эволюционной истории узкоголовых крыс рода Stenocephalemys (Rodentia, Muridae) на основе анализа полных последовательностей гена цитохрома b // Генетика. 2006. Т. 42. № 4. С. 549–557.
Lavrenchenko L.A., Milishnikov A.N., Aniskin V.M. et al. Systematics and phylogeny of the genus Stenocephalemys Frick, 1914 (Rodentia, Muridae): A multidisciplinary approach // Mammalia. 1999. V. 63. № 4. P. 475–494.
Bryja J., Kostin D., Meheretu Y. et al. Reticulate Pleistocene evolution of Ethiopian rodent genus along remarkable altitudinal gradient // Mol. Phylogenet. Evol. 2018. V. 118. P. 75–87. https://doi.org/10.1016/j.ympev.2017.09.020
Орлов В.Н., Булатова Н.Ш. Сравнительная цитогенетика и кариосистематика млекопитающих. М.: Наука, 1983. 405 с.
Sumner A.T. A simple technique for demonstrating centromeric heterochromatin // Experimental Cell Res. 1972. V. 75. P. 304–306.
Corti M., Scanzani A., Rossi A.R. et al. Karyotypic and genetic divergence in the Ethiopian Myomys – Stenocephalemys complex (Mammalia, Rodentia) // Ital. J. Zool. 1999. V. 66. № 4. P. 341–349. https://doi.org/10.1080/11250009909356275
Stepakov A., Galkina S., Bogomaz D. et al. Modified Synthesis of 6-carboxyfluorescein (6-FAM): Application to Probe Labeling for Conventional Cytogenetics // British J. Applied Sci. & Technol. 2015. V. 7. № 4. P. 423–428. https://doi.org/10.9734/BJAST/2015/15991
Dobigni G., Britton-Davidian J., Robinson T. Chromosomal polymorphism in mammals: an evolutionary perspective // Biol. Rev. 2017. V. 92. P. 1–21. https://doi.org/10.1111/brv.12213
Pavlova S.V., Searle J.B. Chromosomes and speciation in mammals // Mammalian Evolution, Diversity and Systematics / Eds Zachos F.E., Asher R.J. Berlin: De Gruyter, 2018. P. 17–38. https://doi.org/10.1515/9783110341553-002
Дополнительные материалы отсутствуют.


