Генетика, 2020, T. 56, № 10, стр. 1150-1160
Цитогенетические эффекты карбендазима в клетках костного мозга мышей
Н. А. Илюшина *
Федеральный научный центр гигиены им. Ф.Ф. Эрисмана Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека
141014 Московская область, Мытищи, Россия
* E-mail: Ilyushina-na@mail.ru
Поступила в редакцию 22.10.2019
После доработки 06.12.2019
Принята к публикации 14.01.2020
Аннотация
Проведено исследование генотоксической активности фунгицида карбендазима. Показано, что тестируемый технический продукт карбендазима в диапазоне доз 125–2000 мг/кг массы тела индуцировал статистически значимое зависимое от дозы увеличение частоты полихроматофильных (ПХЭ) и нормохроматофильных эритроцитов (НХЭ) с микроядрами в костном мозге мышей линии CD-1. После введения доз 250–2000 мг/кг массы тела наблюдали накопление клеток, содержащих два микроядра и более. Методом ДНК-комет не выявлено повышения уровня разрывов и щелочелабильных сайтов в ДНК клеток костного мозга и печени мышей после введения карбендазима технического в дозах до 2000 мг/кг массы тела; поэтому можно полагать, что наблюдаемое накопление клеток с микроядрами обусловлено анеугенным действием карбендазима. Кроме того, обнаружено зависимое от дозы увеличение доли макроцитов/гигантоцитов и гантелеобразных клеток с перетяжками среди ПХЭ и НХЭ, что свидетельствует об ингибирующем действии тестируемого пестицида на процессы цитокинеза. Накопление полихроматофилов, содержащих пикнотические ядра, после воздействия карбендазима вероятно вызвано нарушением процесса экструзии ядер. Обсуждается возможный общий механизм, лежащий в основе нарушения кариокинеза, цитокинеза и экструзии ядер в эритроидных клетках костного мозга млекопитающих.
Пестициды из группы фунгицидов представляют собой вещества, предназначенные для борьбы с грибковыми заболеваниями растений. В настоящее время применяются как химические, так и биологические фунгицидные средства. В качестве химических фунгицидов используют соединения различных классов: стробилурины, бензимидазолы, морфолины, хиноны, имидазолы, триазолы и др. Карбендазим относится к классу бензимидазолов и является метаболитом беномила и тиофанат-метила. Препараты на основе карбендазима применялись и до сих пор применяются в ряде стран в качестве системного фунгицида против болезней пшеницы, ячменя, ржи, свеклы сахарной, подсолнечника, яблони, цитрусовых, семенного картофеля и других культур. Однако всестороннее изучение этого соединения выявило серьезные неблагоприятные эффекты и показало, что оно является высокоопасным веществом.
Обзор данных, полученных в независимых исследованиях, приведен в публикациях [1, 2]. Карбендазим проявляет токсичность даже в низких дозах, воздействуя на печень и вызывая изменения гематологических и биохимических параметров у крыс [3]. Показано, что беномил и его метаболит карбендазим обладают репродуктивной токсичностью, оказывая неблагоприятное воздействие на репродуктивную систему самцов лабораторных животных. При введении указанных пестицидов у крыс наблюдали уменьшение массы семенников и придатков яичек, уменьшение количества сперматозоидов [4]. Кроме того, у крыс и хомячков имели место изменение морфологии и снижение подвижности сперматозоидов, а также гистологические изменения в семенниках [5]. Низкие дозы карбендазима нарушали сперматогенез у мышей [6]. Lu с соавт. получили результаты, свидетельствующие о том, что в токсичность карбендазима могут быть вовлечены механизмы, зависимые от андрогенов и рецепторов андрогенов [7]. Согласно проведенным исследованиям карбендазим является мощным эндокринным дизраптором [8]. Он ингибировал ароматазу in vitro [9, 10] и in vivo [11], снижал экспрессию гена рецептора эстрогена альфа [12]. С воздействием карбендазима на эндокринную систему отчасти могут быть связаны его эмбриотоксические и тератогенные свойства. Высокие дозы этого пестицида снижали прирост массы у беременных крыс, хомяков и кроликов и увеличивали внутриутробную гибель плода. В дозах 30 мг/кг массы тела и выше карбендазим вызывал многочисленные нарушения развития органов [13]. Значимые токсические эффекты у беременных самок крыс, гибель эмбрионов и замедленное развитие плода наблюдали после воздействия карбендазима в дозах 35 и 160 мг/кг массы тела [14]. В экспериментах на лягушках [15] и мышах [16] обнаружена повышенная смертность эмбрионов и различные мальформации скелета и внутренних органов.
Карбендазим является анеугеном [17, 18] и может быть классифицирован как возможный канцероген для человека [19].
В связи с серьезными неблагоприятными воздействиями карбендазима на нецелевые организмы некоторые страны отказались от его использования в сельском хозяйстве.
Карбендазим, так же как и беномил, не одобрен Европейской комиссией и не применяется в большинстве стран Европейского Союза [20–22]; тиофанат-метил пока разрешен в Европе, пересмотр решения о его использовании состоялся в конце 2019 г. Карбендазим и беномил не применяют в сельском хозяйстве в США [2, 23]. В настоящее время карбендазим производится и продается на рынке несколькими компаниями в основном в Китае. В нашей стране зарегистрировано 15 препаративных форм, содержащих карбендазим в качестве единственного действующего вещества, и три препарата, которые содержат в своем составе карбендазим в сочетании с другими средствами: азоксистробином, карбоксином, флутриафолом. Кроме того, зарегистрировано пять препаратов на основе беномила и четыре препарата, содержащих тиофанат-метил [24]. С 2009 г. применение пестицидов на основе беномила и карбендазима в Российской Федерации ограничено только зерновыми, сахарной свеклой и (при необходимости) семенными посевами. По токсиколого-гигиеническим характеристикам беномил и карбендазим отнесены ко 2-му класcу опасности (включая 2-й класс по тератогенности и эмбриотоксичности). По стойкости в почве карбендазим относится к 1-му классу опасности.
Целью настоящего исследования было изучение способности технического продукта карбендазима индуцировать образование микроядер в эритроцитах костного мозга и повреждений ДНК в клетках печени и костного мозга мышей in vivo.
МАТЕРИАЛЫ И МЕТОДЫ
Исследовали технический продукт карбендазима с содержанием действующего вещества 98%.
Эксперименты проводили на мышах линии CD-1. Животных получали из питомника Филиала “Андреевка” ФГБУН “Научный центр биомедицинских технологий” Федерального медико-биологического агентства России. Проведение исследований одобрено этическим комитетом ФБУН “ФНЦГ им. Ф.Ф. Эрисмана” Роспотребнадзора.
Генотоксичность карбендазима технического оценивали с использованием микроядерного теста in vivo в соответствии с рекомендациями OECD № 474 [25] и метода ДНК-комет в соответствии с рекомендациями OECD № 489 [26].
В контрольных и экспериментальных группах использовали по 10 животных на каждую дозу (5 самцов и 5 самок). Технический продукт карбендазима вводили внутрижелудочно в дозах 62.5, 125, 250, 500, 1000 и 2000 мг/кг массы тела 3 раза во временных точках 0, 24 и 48 ч. Одновременно в качестве отрицательного контроля вводили наполнитель (растительное масло). В качестве положительного контроля внутрибрюшинно вводили метилметансульфонат (ММС) в дозе 60 мг/кг массы тела 2 раза, одновременно со вторым и третьим введением исследуемого пестицида.
Через 3 ч после третьего введения животных подвергали эвтаназии методом цервикальной дислокации. Для микроядерного теста костный мозг из одной бедренной кости вымывали эмбриональной сывороткой теленка, и готовили по два микропрепарата костного мозга от каждого животного в соответствии с общепринятой методикой [27]. Микропрепараты красили, используя набор “Leuсodif 200” (Erba Lachema s.r.o., CZ), независимо кодировали и исследовали микроскопически (микроскоп Nikon Eclipse Ci-L, Япония), подсчитывая по 4000 ПХЭ для оценки индукции микроядер, а также определяли долю ПХЭ от общего числа эритроцитов, подсчитывая не менее 500 эритроцитов для каждого животного.
Для анализа ДНК-комет костный мозг из второй бедренной кости мыши вымывали охлажденным фосфатным буфером, содержащим 10% ДМСО и 20 мМ ЭДТА-Na2 (буфер 1). Предварительно готовили и сушили гель-слайды с тонким слоем тугоплавкой агарозы. Суспензию клеток костного мозга (60 мкл) вносили в легкоплавкую агарозу, нагретую до 37°С, пипетировали и капали по 35 мкл на подогретый гель-слайд, накрывали покровным стеклом. Слайды охлаждали и после полного застывания агарозы осторожно снимали покровные стекла.
Ткань печени гомогенизировали в буфере 1, давали отстояться крупным частицам дебриса и отбирали 60 мкл. Далее все манипуляции проводили так же, как описано выше для костного мозга.
Стадии лизиса, денатурации, электрофореза и фиксации проводили при монохромном желтом освещении. Лизис осуществляли, используя охлажденный (4°C) раствор, содержащий 100 мМ ЭДТА-Na2; 10 мМ Трис; 2.5 М NaCl; 1% Triton X-100; 10% ДМСО (pH 10), при 4°С в течение 21–24 ч. Гель-слайды выдерживали в буфере для электрофореза, содержащем 300 мМ NaOH и 1 мМ ЭДТА-Na2, в течение 30 мин для денатурации и реализации щелочелабильных сайтов ДНК в разрывы. Электрофорез проводили в камерах CSL-COM20 (Cleaver Scientific Ltd., UK) с охлаждаемыми до 7°C платформами (CSL-CHILLER, Cleaver Scientific Ltd., UK) при 300 мА и 0.7 В/см (CS-300V Cleaver Scientific, UK) в течение 30 мин. Гель-слайды нейтрализовали (PBS, 10 мин) и дегидратировали (75%-ный раствор этанола, 10 мин), сушили на воздухе и окрашивали SYBR Green I в течение 30 мин.
Микроскопический анализ проводили на эпифлуоресцентном микроскопе (Nikon Eclipse Ni-U, Япония), оснащенном камерой scA1300-32fm и программой для захвата изображения. Анализ ДНК-комет осуществляли с помощью программы анализа изображений Comet Assay IV (Perceptive Instruments Ltd., UK). На каждом микропрепарате считали не менее 75 клеток (не менее 150 клеток на каждую ткань каждого животного). В качестве показателя повреждений ДНК использовали процентное содержание ДНК в хвосте кометы (% ДНКвхвосте).
Статистический анализ осуществляли с помощью программы SPSS Statistics v. 22.0 (IBM Corporation, N.Y., США). Для обработки данных, полученных в анализе ДНК-комет, использовали t-тест Даннетта и коэффициент ранговой корреляции Спирмена. Анализ результатов, полученных в микроядерном тесте in vivo, осуществляли в рамках двухфакторной регрессионной модели для распределения Пуассона [28]; для сравнения с группами отрицательного контроля использовали 95%-ные доверительные интервалы Вальда для каждой группы. Наличие зависимости эффекта от дозы оценивали с использованием критерия Мантеля–Хензеля [29].
РЕЗУЛЬТАТЫ
Исследуемый технический продукт карбендазима в высокой дозе подавлял эритропоэз в костном мозге мышей CD-1. После введения 2000 мг карбендазима на 1 кг массы тела животных медианное значение доли ПХЭ от общего числа эритроцитов достигало 20%, что составляет около 40% от уровня в группе отрицательного контроля.
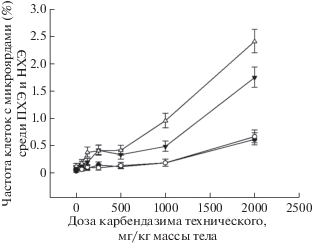
Карбендазим индуцировал образование микроядер, которые наблюдали в ПХЭ и НХЭ костного мозга мышей. При этом статистически значимые эффекты по сравнению с сопутствующим отрицательным контролем выявлены после введения карбендазима в дозах 125 мг/кг м.т. и выше. Методом Мантеля–Хензеля показана линейная зависимость наблюдаемых эффектов от дозы (p = 0.000) (рис. 1).
Рис. 1.
Зависимость частоты ПХЭ и НХЭ с микроядрами в костном мозге самок и самцов мышей линии CD-1 от дозы карбендазима технического. ▼ – ПХЭ с микроядрами (♀); ⚫ – НХЭ с микроядрами (♀); Δ – ПХЭ с микроядрами (♂); ⚪ – НХЭ с микроядрами (♂).
После введения доз 250–2000 мг/кг м.т. на микропрепаратах появлялись ПХЭ, содержащие два микроядра и более (рис. 2,б–ж). Причем клетки с тремя и более микроядрами были отмечены только начиная с дозы 500 мг/кг м.т. Кроме типичных микроядер в клетках также присутствовали остатки хроматинового материала в виде бобовидных структур (рис. 2,и). Частота ПХЭ с множественными микроядрами статистически значимо повышалась с увеличением дозы карбендазима (p = 0.000) (рис. 3,а). При высоких дозах также встречались клетки с пылинками Вейденрейха, свидетельствующими о глубокой дезинтеграции ядра (рис. 2,ж; 4,д).
Рис. 2.
Клетки костного мозга мышей линии CD-1 после введения карбендазима технического. а–е – ПХЭ с разным количеством микроядер в одной клетке; ж – ПХЭ с микроядрами и пылинками Вейденрейха; з – клетка с типичным микроядром и бобовидной хроматиновой структурой.
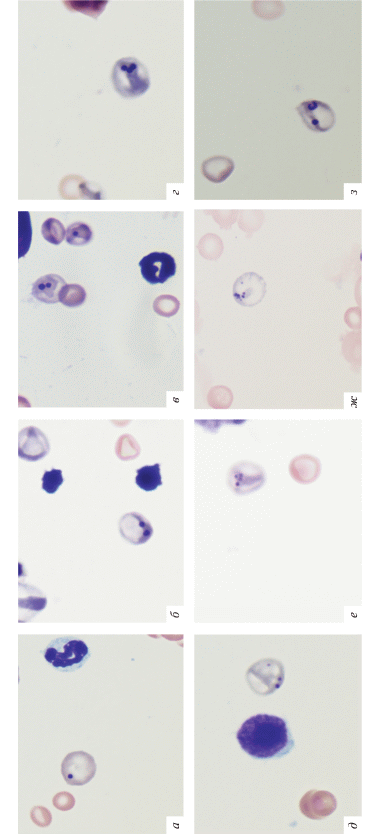
Рис. 3.
Зависимость частоты встречаемости ПХЭ с двумя и более микроядрами (а) и полихроматофилов увеличенного размера (б) от дозы карбендазима технического. Показаны индивидуальные значения для каждого животного в группах обработки (n = 10 в каждой группе).
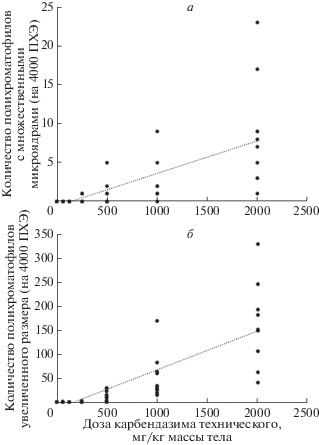
При микроскопическом анализе также отмечали полихроматофильные и нормохроматофильные клетки, размер которых был увеличен в 2 и более раз, по сравнению с нормой (макроциты/гигантоциты). Их количество статистически значимо зависело от дозы технического продукта (рис. 3,б; 4,а–д). Кроме макроцитов/гигантоцитов среди ПХЭ и НХЭ встречались гантелеобразные клетки с перетяжкой (рис. 4,е–и).
Рис. 4.
Влияние карбендазима технического на цитокинез в клетках эритроидного ряда. а – полихроматофил увеличенного размера без микроядер; б–г – полихроматофилы увеличенного размера с одним и несколькими микроядрами; д – полихроматофильный гигантоцит с микроядрами и пылинками Вейденрейха; е, ж – полихроматофилы с перетяжкой; з, и – нормохроматофилы с перетяжкой.
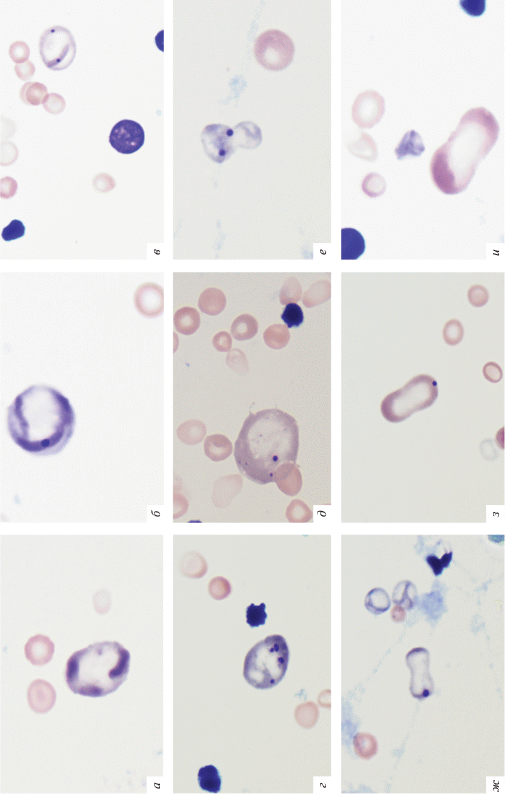
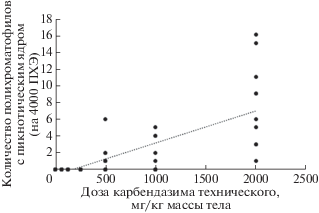
С увеличением дозы технического продукта карбендазима, вводимого животным, возрастала частота полихроматофильных клеток с невытолкнутым плотным пикнотическим ядром (рис. 5, 6).
Рис. 5.
Клетки костного мозга мышей линии CD-1 после введения карбендазима технического. а: 1 – ПХЭ с одним микроядром, 2 – полихроматофил с пикнотическим ядром, 3 – макроцит с ядерными пылинками Вейденрейха; б: 1 – полихроматофил с пикнотическим ядром.
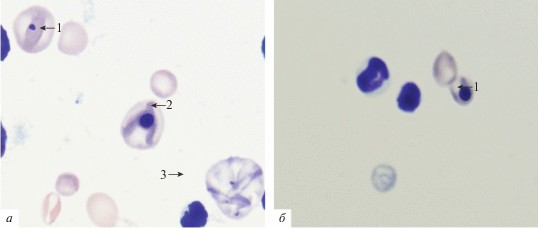
Рис. 6.
Зависимость частоты встречаемости полихроматофилов с пикнотическим ядром от дозы карбендазима. Показаны индивидуальные значения для каждого животного в группах обработки (n = 10 в каждой группе).
С использованием метода электрофореза отдельных клеток (анализа ДНК-комет) в щелочных условиях было показано, что карбендазим технический не индуцировал повреждения ДНК в клетках костного мозга и печени мышей CD-1 в диапазоне доз от 62.5 до 2000 мг/кг м.т. Содержание ДНК в хвосте комет после воздействия карбендазима значимо не отличалось от значения, полученного для отрицательного контроля, тогда как используемый в качестве положительного контроля ММС вызывал статистически значимый эффект (табл. 1).
Таблица 1.
Результаты оценки повреждений ДНК в клетках костного мозга и печени мышей CD-1 методом ДНК-комет
| Доза карбендазима, мг/кг массы тела | Костный мозг | Печень |
|---|---|---|
| медиана % ДНКвхвосте (25/75% квартиль) |
медиана % ДНКвхвосте (25/75% квартиль) |
|
| 0 | 1.87 (1.60/2.74) | 0.96 (0.51/1.58) |
| 62.5 | 1.66 (1.01/2.43) | 0.92 (0.54/2.09) |
| 125 | 1.22 (0.76/1.77) | 1.28 (0.80/1.74) |
| 250 | 1.59 (1.29/2.01) | 1.62 (1.11/2.02) |
| 500 | 2.69 (1.49/3.62) | 1.28 (0.29/1.80) |
| 1000 | 2.46 (1.44/3.48) | 0.71 (0.36/1.03) |
| 2000 | 2.99 (1.73/3.80) | 1.08 (0.57/1.42) |
| Положительный контроль (ММС, 60 мг/кг м.т.) | 22.03** (18.24/28.71) | 32.14** (23.77/46.44) |
ОБСУЖДЕНИЕ
Пестициды, относящиеся к разным химическим классам, могут быть токсичными по отношению к органу-мишени. Например, триазоловые пестициды вызывали снижение доли ПХЭ среди общего числа эритроцитов в костном мозге мышей в разной степени в зависимости от их химической структуры [30]. Проведенное исследование показало, что тестируемый технический продукт карбендазима в высоких дозах вызывал подавление эритропоэза в костном мозге мышей CD-1. В дозах 125–2000 мг/кг массы тела он вызывал статистически значимое зависимое от дозы повышение частоты микроядер в ПХЭ и НХЭ костного мозга мышей CD-1. Причем с увеличением дозы возрастало количество клеток, содержащих два микроядра и более. В анализе ДНК-комет не было обнаружено ДНК-повреждающего действия карбендазима, что подтверждает анеугенный механизм его действия.
Было показано, что с увеличением дозы возрастает количество полихроматофильных клеток с плотным пикнотическим ядром. Наблюдаемые клетки с такими ядрами нельзя отнести к полихроматофильным нормобластам, в которых хотя и начинается процесс пикноза, но ядро все еще имеет колесовидную структуру. В норме такие плотные пикнотические ядра наблюдаются в оксифильных нормобластах. Именно на стадии оксифильных нормобластов происходит выталкивание ядра. Вероятно, наблюдаемый нами эффект: присутствие плотных пикнотических ядер в полихроматофилах свидетельствует о том, что карбендазим задерживает или нарушает процесс выталкивания ядра при созревании эритроидных клеток.
Кроме того, после внутрижелудочного введения мышам карбендазима технического происходило зависимое от дозы накопление полихроматофилов и нормохроматофилов увеличенного размера (в 2 и более раз превышающего норму). Одной из причин накопления макроцитов/гигантоцитов может быть нарушение процесса цитокинеза. Это подтверждается наличием клеток гантелеобразной формы. Такая форма типична для делящихся клеток на стадии телофазы. Однако в данном случае на микропрепаратах наблюдали безъядерные клетки с явно выраженной перетяжкой среди ПХЭ и НХЭ, которые в норме уже не содержат ядра и не делятся. Вероятно, карбендазим предотвращал образование сократимого кольца или ингибировал его сокращение, вызывая блокировку цитокинеза и задержку клеток в телофазе.
Полученные результаты согласуются с ранее опубликованными материалами. Подробный обзор таких исследований до 2004 г. приведен в публикации [31]. В большинстве тестов по оценке генных мутаций у бактерий он не оказывал мутагенного действия. С использованием дрожжей Saccharomyces не обнаружено ни обратных мутаций, ни конверсии генов при действии карбендазима в концентрациях до 40 мкг/мл [32]. На лимфоцитах человека in vitro в исследовании индукции сестринских хроматидных обменов (Banduhn, Obe, 1985) получены отрицательные результаты [33]. В анализе ДНК-комет карбендазим не индуцировал повреждения ДНК в культурах клеток млекопитающих [34, 35]. Также не обнаружено повреждений ДНК с использованием теста оценки внепланового синтеза ДНК [36]. Карбендазим не оказывал кластогенного действия на клетки CHO и лимфоциты периферической крови человека (тест учета хромосомных аберраций) [34, 36]. Однако в ряде исследований было обнаружено, что карбендазим индуцировал образование микроядер в клетках млекопитающих. При этом микроядра содержали целые хромосомы с центромерами, что характерно для действия анеугенов [17, 37–39].
Уже ранние биохимические исследования механизма действия производных бензимидазола показали, что ингибирование митоза у грибов вероятно опосредовано связыванием этих соединений с белком тубулином, из которого формируются микротрубочки веретена деления [40]. Микротрубочки образованы димерами α- и β-тубулина, которые взаимодействуют нековалентно и играют ключевую роль в клеточном делении, опосредуя сегрегацию хромосом в митозе и мейозе, а также организацию, перемещение и расположение органоидов. Было установлено, что бензимидазолы взаимодействуют с β2-тубулином [41]. Кроме того, карбендазим, беномил и тиабендазол ингибируют полимеризацию α1-/β2-тубулинов. Однако все три соединения не были способны дестабилизировать уже полимеризованные микротрубочки [42]. Таким образом, имеющиеся в литературе данные свидетельствуют в пользу предположения о том, что анеугенное действие карбендазима обусловлено его взаимодействием с тубулинами микротрубочек веретена деления.
Что касается обнаруженного в данном исследовании нарушения цитокинеза, то следует отметить, что состоящий из микротрубочек цитоскелет контролирует не только сегрегацию хромосом, но и положение сократимого кольца и завершение клеточного деления [43]. Для осуществления деления необходим зависимый от микротрубочек транспорт компонентов мембраны к борозде деления. Показано, что образованная микротрубочками особая структура в борозде деления – FMA (furrow microtubule array) необходима для цитокинеза у эмбрионов Xenopus, а именно для формирования новых мембранных структур во время цитокинеза [44]. Деполимеризация микротрубочек в эмбрионах Xenopus после начала дробления блокировала завершение деления [45]. Наряду с FMA микротрубочки срединного тела также вносят большой вклад в процесс цитокинеза. Ингибирование гамма-тубулина во время митоза приводило к нарушению структуры срединного тела и блокированию завершения цитокинеза [46, 47].
Одной из моделей, предложенных для объяснения механизма экструзии (выталкивания) ядра, является цитокинетическая модель, согласно которой процесс выталкивания представляет собой определенную форму клеточного деления, при котором ядро отделяется от цитоплазмы в результате активного процесса, основанного на механизме цитокинеза [48]. Ядро становится плотным в результате конденсации хроматина, изолируется от цитоплазмы кольцом цитоплазматических мембран и перемещается в одну сторону клетки. Оксифильный эритробласт затем разделяется на две дочерние структуры – ретикулоцит, содержащий большую часть цитоплазмы, и пиреноцит, содержащий конденсированное ядро, заключенное в тонкий цитоплазматический слой. Большая часть пиреноцитов поглощается и разрушается макрофагами [49]. Таким образом, экструзия ядра представляет собой асимметричное деление, при котором необходима реорганизации цитоскелета. При этом было показано важное значение реорганизации и стабильности микротрубочек в этом процессе [50]. Микротрубочки играют ключевую роль в поляризации эритробластов при подготовке к экструзии, опосредуя движение ядер [51, 52].
Таким образом, на основании полученных в данном исследовании результатов и имеющихся литературных данных можно предполагать, что карбендазим не только нарушает процессы кариокинеза, приводя к накоплению клеток с микроядрами (анеугенное действие), но и подавляет цитокинез и экструзию ядер в ходе созревания клеток эритроидного ряда. При этом все наблюдаемые нарушения, вероятно, могут быть опосредованы одним и тем же механизмом, основанным на взаимодействии карбендазима с тубулинами.
Подготовка статьи не имела финансовой поддержки.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Автор выражает благодарность к. б. н. Н.С. Аверьяновой за помощь в проведении анализа ДНК-комет и м. н. с. Г.В. Масальцеву за помощь в осуществлении статистической обработки результатов.
Список литературы
Factsheet carbendazim. Available at: https://www.pan-europe.info/facsheets/carbendazim.
Singh S., Singh N., Kumar V. et al. Toxicity, monitoring and biodegradation of the fungicide carbendazim // Environ. Chem. Lett. 2016. V. 14. № 3. P. 317–329. https://doi.org/10.1007/s10311-016-0566-2
Muthuviveganandavel V., Muthuraman P., Muthu S., Srikumar K. Toxic effects of carbendazim at low dose levels in male rats // J. Toxicol. Sci. 2008. V. 33. № 1. P. 25–30. https://doi.org/10.2131/jts.33.25
Carter S.D., Hess R.A., Laskey J.W. The fungicide methyl benzimidazole carbamate causes infertility in male Sprague-Dawley rats // Biol. of Reprod. 1978. V. 37. № 3. P. 709–717. https://doi.org/10.1095/biolreprod37.3.709
Gray L.E., Jr., Ostby J., Linder R. et al. Carbendazim induced alterations of reproductive development and function in the rat and hamster // Fund. and Appl. Tox. 1990. V. 15. № 2. P. 281–297. https://doi.org/10.1016/0272-0590(90)90055-O
Liu J., Zhang P., Zhao Y., Zhang H. Low dose carbendazim disrupts mouse spermatogenesis might Be through estrogen receptor related histone and DNA methylation // Ecotoxicology and Environmental Safety. 2019. V. 176. P. 242–249. https://doi.org/10.1016/j.ecoenv.2019.03.103
Lu S.Y., Liao J.W., Kuo M.L. et al. Endocrine-disrupting activity in carbendazim-induced reproductive and developmental toxicity in rats // J. Toxicol. Environ. Health A. 2004. V. 67. № 19. P. 1501–1515. https://doi.org/10.1080/15287390490486833
Mnif W., Hassine A.I.H., Bouaziz A. et al. Effect of endocrine disruptor pesticides: A review // Int. J. Environ. Res. Public Health. 2011. V. 8. № 6. P. 2265–2303. https://doi.org/10.3390/ijerph8062265
Morinaga H., Yanase T., Nomura M. et al. A Benzimidazole fungicide, benomyl, and its metabolite, carbendazim, induce aromatase activity in a human ovarian granulose-like tumor cell line (KGN) // Endocrinology. 2004. V. 145. № 4. P. 1860–1869. https://doi.org/10.1210/en.2003-1182
Kawaratani Y., Matsuoka T., Hirata Y. et al. Influence of the carbamate fungicide benomyl on the gene expression and activity of aromatase in the human breast carcinoma cell line MCF-7 // Environ. Toxicol. Pharmacol. 2015. V. 39. № 1. P. 292–299. https://doi.org/10.1016/j.etap.2014.11.032
Kim D.-J., Seok S.H., Baek M.W. et al. Benomyl induction of brain aromatase and toxic effects in the zebrafish embryo // J. Appl. Toxicol. 2009. V. 29. № 4. P. 289–294. https://doi.org/10.1002/jat.1405
Rama E.M., Bortolan S., Vieira M.L. et al. Reproductive and possible hormonal effects of carbendazim // Regul. Toxicol. Pharmacol. 2014. V. 69. № 3. P. 476–486. https://doi.org/10.1016/j.yrtph.2014.05.016
Minta M., Biernacki B. Embryotoxicity of carbendazim in hamsters, rats, and rabbits // Bul. Veterinary Institute in Pulawy (Poland). 1982. V. 25. P. 42–52.
Sitarek K. Embryolethal and teratogenic effects of carbendazim in rats // Teratogenesis Carcinogenesis and Mutagenesis. 2001. V. 21. № 5. P. 335–340. https://doi.org/10.1002/tcm.1021
Yoon C.S., Jin J.H., Park J.H. et al. Toxic effects of carbendazim and n-butyl isocyanate, metabolites of the fungicide benomyl, on early development in the African Clawed frog, Xenopus laevis // Inc. Environ. Toxicol. 2008. V. 23. № 1. P. 131–144. https://doi.org/10.1002/tox.20338
Farag A., Ebrahim H., ElMazoudy R., Kadous E. Developmental toxicity of fungicide carbendazim in female mice // Birth Defects Res. B Dev. Reprod. Toxicol. 2011. V. 92. № 2. P. 122–130. https://doi.org/10.1002/bdrb.20290
Sarrif A.M., Bentley K.S., Fu L.J. et al. Evalution of benomyl and carbendazim in the vivo aneuploidy/micronucleus assay in BDF1 mouse bone marrow // Mutat. Res. Fundamental and Molecular Mechanisms of Mutagenesis. 1994. V. 310. № 1. P. 143–149. https://doi.org/10.1016/0027-5107(94)90018-3
Tweats D.J., Johnson G.E., Scandale I. et al. Genotoxicity of flubendazole and its metabolites in vitro and the impact of a new formulation on in vivo aneugenicity // Mutagenesis. 2016. V. 31. № 3. P. 309–321. https://doi.org/10.1093/mutage/gev070
Goodson W.H., Lowe L., Carpenter D.O. et al. Assessing the carcinogenic potential of low-dose exposures to chemical mixtures in the environment: the challenge ahead // Carcinogenesis. 2015. V. 36. Suppl. 1. P. S254–S296. https://doi.org/10.1093/carcin/bgv039
EU Pesticides database. Available at: http://ec.europa.eu/food/plant/pesticides/eu-pesticides-database/ public/?event=activesubstance.detail&language=EN& selectedID=1080.
Carbendazim (Ref: BAS 345F). IUPAC. Available at: https://sitem.herts.ac.uk/aeru/iupac/Reports/116.htm.
Benomyl (Ref: T 1991). IUPAC. Available at: https://sitem.herts.ac.uk/aeru/iupac/Reports/66.htm.
Pesticides: Registration. Benomyl RED Facts. Available at: https://archive.epa.gov/pesticides/reregistration/web/html/benomyl_fs.html.
Справочник пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. М.: ООО “Изд-во Листерра”, 2019. 872 с.
Mammalian Erythrocyte Micronucleus Test. OECD Test TG 474 / OECD Guidelines for the Testing of Chemicals, Section 4. Paris: OECD, 2016.
In vivo mammalian alkaline comet assay. OECD Test № 489 / OECD Guidelines for the Testing of Chemicals, Section 4. Paris: OECD, 2016.
Методические рекомендации. Оценка мутагенной активности факторов окружающей среды в клетках разных органов млекопитающих микроядерным методом. М.: Межведомственный науч. совет по экологии человека и гигиене окружающей среды РФ, 2001. 22 с.
McCullagh P., Nelder J.A. Generalized linear models. London, GB: Chapman and Hall/CRC, 1989. 511 p. Available at: http://www.utstat.toronto.edu/~brunner/oldclass/2201s11/readings/glmbook.pdf.
Agresti A. Categorical data analysis. 3rd ed. Hoboken, New Jersey, USA: John Wiley and Sons, Inc., 2013. 752 p.
Ilyushina N., Goumenou M., Stivaktakis P.D. et al. Maximum tolerated doses and erythropoiesis effects in the mouse bone marrow by 79 pesticides’ technical materials assessed with the micronucleus assay // Toxicol. Rep. 2019. V. 6. P. 105–110. https://doi.org/10.1016/j.toxrep.2018.12.006
Carbendazim (methyl benzimidazol-2-yl carbamate). Wiley Online Library. Available at: https://onlinelibrary.wiley.com/doi/full/10.1002/3527600418.mb1060521e4014.
Albertini S. Influence of different factors on the induction of chromosome malsegregation in Saccharomyces cerevisiae D61.M by bavistan and assessment of its genotoxic property in the Ames test and in Saccharomyces cerevisiae D7 // Mutat. Res. 1989. V. 216. № 6. P. 327–340. https://doi.org/10.1016/0165-1161(89)90043-5
Banduhn N., Obe G. Mutagenicity of methyl 2-benzimidazolecarbamate, diethylstilbestrol and estradiol: structural chromosomal aberrations, sister-chromatid exchanges, C-mitoses, polyploidies and micronuclei // Mutat. Res. 1985. V. 156. № 3. P. 199–218. https://doi.org/10.1016/0165-1218(85)90065-5
Vigreux C., Poul J.M., Deslandes E. et al. DNA damaging effects of pesticides measured by the single cell gel electrophoresis assay (comet assay) and the chromosomal aberration test, in CHOK1 cells // Mutat. Res. 1998. V. 419. № 1–3. P. 79–90. https://doi.org/10.1016/S1383-5718(98)00126-0
Lebailly P., Vigreux C., Godard T. et al. Assessment of DNA damage induced in vitro by etoposide and two fungicides (carbendazim and chlorothalonil) in human lymphocytes with the comet assay // Mutat. Res. 1997. V. 375. № 2. P. 205–217. https://doi.org/10.1016/S0027-5107(97)00015-8
McCarroll N.E., Protzel A., Ioannou Y. et al. A survey of EPA/OPP and open literature on selected pesticide chemicals. III. Mutagenicity and carcinogenicity of benomyl and carbendazim // Mutat. Res. 2002. V. 512. № 1. P. 1–35. https://doi.org/10.1016/S1383-5742(02)00026-1
Elhajouji A., Van Hummelen P., Kirsch-Volders M. Indications for a threshold of chemically-induced aneuploidy in vitro in human lymphocytes // Environ. Mol. Mutagen. 1995. V. 26. № 4. P. 292–304. https://doi.org/10.1002/em.2850260405
Verma J.R., Rees B.J., Wilde E.C. et al. Evaluation of the automated MicroFlow® and Metafer™ platforms for high-throughput micronucleus scoring and dose response analysis in human lymphoblastoid TK6 cells // Archives Toxicology. 2017. V. 91. № 7. P. 2689–2698. https://doi.org/10.1007/s00204-016-1903-8
Tanaka R., Sasanami T., Toriyama M. et al. Aneugenic effects of carbendazim and griseofulvin as assayed in the in vitro maturation system of mouse oocytes // Environ. Mutagen Res. 2004. V. 26. № 3. P. 203–206. https://doi.org/10.3123/jems.26.203
Davidse L.C. Mode of action of methyl benzimidazol-2-yl-carbamate (MBC) and some biochemical aspects of acquired resistance against this fungicide in Aspergillus nidulans // System Fungizide / Eds Lyr H., Potter C. Berlin: Akad. Verlag, 1975.
Li J., Katiyar S.K., Edlind T.D. Site-directed mutagenesis Saccharomyces cerevisiae beta-tubulin: interaction between residue 167 and benzimidazole compounds // FEBS Lett. 1996. V. 385. № 1–2. P. 7–10. https://doi.org/10.1016/0014-5793(96)00334-1
Zhou Y., Xu J., Zhu Y. et al. Mechanism of action of the benzimidazole fungicide on Fusarium graminearum: Interfering with polymerization of monomeric tubulin but not polymerized microtubule // Phytopathology. 2016. V. 106. № 8. P. 807–813. https://doi.org/10.1094/PHYTO-08-15-0186-R
Straight A.F., Field C.M. Microtubules, membranes and cytokinesis // Curr. Biol. 2000. V. 10. № 20. P. 760–770. https://doi.org/10.1016/S0960-9822(00)00746-6
Danilchik M.V., Funk W.C., Brown E.E., Larkin K. Requirement for microtubules in new membrane formation during cytokinesis of Xenopus embryos // Dev. Biol. 1998. V. 194. № 1. P. 47–60. https://doi.org/10.1006/dbio.1997.8815
Larkin K., Danilchik M.V. Microtubules are required for completion of cytokinesis in sea urchin eggs // Dev. Biol. 1999. V. 214. № 1. P. 215–226. https://doi.org/10.1006/dbio.1999.9395
Shu H.B., Li Z., Palacios M.J. et al. A transient association of gamma-tubulin at the midbody is required for the completion of cytokinesis during the mammalian cell division // J. Cell Sci. 1995. V. 108. № 9. P. 2955–2962.
Julian M., Tollon Y., Lajoie-Mazenc I. et al. Gamma-tubulin participates in the formation of the midbody during cytokinesis in mammalian cells // J. Cell Sci. 1993. V. 105. № 1. P. 145–156.
Keerthivasan G., Wickrema A., Crispino J.D. Erythroblast enucleation // Stem. Cells Int. 2011. Article ID 139851. 9 p. https://doi.org/10.4061/2011/139851. Available at: https://www.hindawi.com/journals/sci/2011/139851/.
Migliaccio A.R. Erythroblast enucleation // Haematologica. 2010. V. 95. № 12. P. 1985–1988. https://doi.org/10.3324/haematol.2010.033225
Xie S., Yan B., Feng J. et al. Altering microtubule stability affects microtubule clearance and nuclear extrusion during erythropoiesis // J. Cellular Physiology. 2019. V. 234. № 11. P. 19833–19841. https://doi.org/10.1002/jcp.28582
Kobayashi I., Ubukawa K., Sugawara K. et al. Erythroblast enucleation is a dynein-dependent process // Experim. Hematology. 2016. V. 44. P. 247–256. https://doi.org/10.1016/j.exphem.2015.12.003
Konstantinidis D.G., Pushkaran S., Johnson J.F. et al. Signaling and cytoskeletal requirements in erythroblast enucleation // Blood. 2012. V. 119. № 25. P. 6118–6127. https://doi.org/10.1182/blood-2011-09-379263
Дополнительные материалы отсутствуют.


