Генетика, 2020, T. 56, № 10, стр. 1136-1149
Изменения метилирования ДНК, индуцированные диоксинами и диоксиноподобными соединениями, как возможный предиктор развития заболеваний
Н. С. Кузьмина 1, *, Т. М. Лыонг 2, А. В. Рубанович 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Совместный Российско-Вьетнамский Тропический научно-исследовательский и технологический центр
Хошимин, Южное отделение, 3, Вьетнам
* E-mail: nin-kuzmin@yandex.ru
Поступила в редакцию 10.12.2019
После доработки 15.01.2020
Принята к публикации 20.01.2020
Аннотация
Диоксины и диоксиноподобные соединения – стойкие органические загрязнители (СОЗ), экотоксиканты техногенного происхождения, самым опасным среди которых является 2,3,7,8-тетрахлордибензо-р-диоксин (ТХДД). Особенностью действия рассматриваемых генотоксикантов, отличающей их от других СОЗ, является гормоноподобная активность, которая реализуется через связывание с особым клеточным белком – рецептором ароматических углеводородов AhR (Aryl hydrocarbon receptor). В настоящей работе рассмотрены феноменологические аспекты индукции диоксинами и диоксиноподобными соединениями нарушений метилирования ДНК, выявленных в исследованиях in vitro и in vivo. В работах с использованием экспериментальных моделей твердо установлены мультигенерационные и трансгенерационные эффекты индуцированных диоксинами локус-специфических нарушений метилирования и их сопряженность с репродуктивными дисфункциями и врожденными пороками развития. Обсуждаются важность и актуальность изучения отдаленных эпигенетических последствий диоксинового воздействия у человека и потенциальная значимость таких исследований для превентивной диагностики развития соматических и репродуктивных патологий.
Проблемы экологической безопасности тесным образом связаны с повсеместным распространением в окружающей среде стойких органических загрязнителей (СОЗ), к которым относятся хлорорганические пестициды (ДДТ, альдрин, хлордан, гексахлорбензол, мирекс и др.), полихлорированные бифенилы (ПХБ), полихлордибензодиоксины (ПХДД), полихлордибензофураны (ПХДФ). Для этих соединений характерны очень высокая токсичность, устойчивость к разрушающему действию различных факторов, выраженная персистентность, сверхкумуляция и биоаккумуляция, метаболическая активация, миграция на новые территории из первичного очага загрязнения [1–3]. Несмотря на то что ряд СОЗ, входящих в список Стокгольмской конвенции (хлорорганические пестициды), запрещены к производству и использованию, остается еще ряд более токсичных диоксинов (ПХДД) и диоксиноподобных соединений (ПХБ и ПХДФ), являющихся побочными продуктами разных производств (производство гербицидов и пестицидов, нефтепереработка, электротехника, целлюлозно-бумажная и химическая промышленность, мусоросжигающие заводы и др.). Поэтому лица, занятые на этих производствах, а также жители территорий, прилегающих к крупным предприятиям, представляют собой группу риска по развитию индуцированной рассматриваемыми генотоксикантами патологии.
Диоксины – обобщенное название большой группы гетероциклических полихлорированных соединений, в структуре которых присутствуют два ароматических кольца, связанных между собой двумя кислородными мостиками. Самым опасным среди этих токсикантов является 2,3,7,8-тетрахлордибензо-р-диоксин (ТХДД) – суперэкотоксикант техногенного происхождения [1]. Документированные случаи масштабного воздействия диоксинов и диоксиноподобных соединений на популяции человека, такие как применение американской армией дефолианта “Agent Orang” (АО) в ходе Вьетнамской войны (1961–1971 гг.), авария на химическом заводе в г. Севезо (Италия, 1976 г.), утилизация отходов электроники в Китае, промышленное загрязнение риса области Ю-Ченг (Тайвань, 1979), производство феноксигербицидов (Россия, Новая Зеландия), свидетельствуют о разнообразии спектра эффектов, индуцированных этими мощными генотоксикантами, включая отдаленные последствия. К ним относятся злокачественные новообразования (рак простаты, органов дыхания, множественная миелома, лимфогранулематоз, неходжкинские лимфомы, саркома мягких тканей, лейкемии), поздняя порфирия кожи, хлоракне, периферическая нейропатия, болезнь Паркинсона, ишемическая болезнь сердца, иммунодефицитные состояния, врожденные аномалии развития, патологии репродуктивной системы. Получены результаты, воспроизводимые в разных исследованиях и свидетельствующие об изменении одного из важных признаков, характеризующих популяцию и ее репродуктивное здоровье, – пониженный показатель соотношения полов (мужской/женский) у потомков отцов, подвергшихся воздействию диоксинов [4–15].
Особенностью действия диоксинов и диоксиноподобных соединений, отличающей их от других СОЗ, является гормоноподобная активность, которая реализуется через связывание этих токсикантов с особым клеточным белком – рецептором ароматических углеводородов AhR (Aryl hydrocarbon receptor, или диоксиновый рецептор ДР) и ядерного переносчика ДР (ЯПДР, или ARNT). Последний обеспечивает специфическое связывание лигандированной формы AhR с диоксинчувствительными элементами (ДЧЭ) – ДНК-последовательностями, расположенными в регуляторных (промоторных) регионах диоксинзависимых генов [1, 16–21]. Так, накопление в клетках монооксигеназ Р-450 – CYP1A1 и CYP1A2 является ключевым показателем активации комплексом ТХДД–ДР соответствующих генов [22, 23]. В целом показано, что кроме этих локусов возможно инициирование продолжительной активности свыше 300 генов, что может приводить к запуску каскада реакций, приводящих к повреждениям клеточных структур [24, 25]. Так, разнообразный спектр отдаленных цитотоксических и цитогенетических эффектов (повышенный уровень сестринских хроматидных обменов, аберраций хромосом, микроядер, кариологические изменения) выявлен у жителей загрязненных диоксинами регионов Вьетнама – результат применения армией США (1961–1971 гг.) дефолиантов – гербицидных препаратов, основной рецептурой которых была смесь н-бутиловых эфиров 2,4-ди- и 3,4,5-трихлорфеноксиуксусных кислот с технологическими примесями ТХДД [26–28]. Следует подчеркнуть, что при отсутствии рассматриваемого токсического воздействия AhR-рецепторы опосредуют многие процессы, необходимые для поддержания клеточного гомеостаза, иммунитета, ответа на некоторые стрессовые воздействия, т.е. необходимы для нормального функционирования клетки и организма в целом [1].
Используемые до настоящего времени классические методы генотоксикологии не позволяют выявить эффекты, которые бы обладали очевидной прогностической ценностью в отношении здоровья индивида. Между тем, так как диоксиновая патология имеет длительный латентный период одной из основных задач молекулярной токсикологии этих соединений является обнаружение маркеров перенесенного генотоксического воздействия, которые можно рассматривать в качестве предикторов развития отдаленной соматической и репродуктивной патологии. Поэтому проблема оценки эпигенетических изменений, в частности модификаций в метилировании ДНК, индуцированных диоксинами и диоксиноподобными соединениями, является очень важной и актуальной. И это обусловлено двумя фактами. Во-первых, показано, что внешние генотоксические воздействия радиационной и химической природы могут приводить к изменениям паттернов метилирования ДНК [29–33]. Во-вторых, имеются воспроизводимые результаты, свидетельствующие о высокой точности оценки биологического возраста – интегрального показателя состояния здоровья индивида, на основе “CpG-часов”, а его повышение по сравнению с календарным отмечено при различных соматических заболеваниях (злокачественные новообразования, инсульты, гипертензия и др.) [34–41]. Накопилось достаточно много данных, свидетельствующих о связи ряда патологий, в том числе возраст-ассоциированных, с изменениями эпигенома [42–46]. Кроме того, оценка индуцированных изменений эпигенома – необходимая задача для детализации механизмов токсического действия диоксинов и диоксиноподобных соединений.
В настоящей работе рассмотрены феноменологические аспекты индукции диоксинами и диоксиноподобными соединениями нарушений метилирования ДНК, выявленных в исследованиях in vitro и in vivo. Обсуждается потенциальная значимость наблюдаемых изменений для превентивной диагностики развития соматических и репродуктивных патологий у лиц, подвергшихся действию этих генотоксикантов, а также у их потомков.
ДНК-МЕТИЛИРОВАНИЕ КАК ЭПИГЕНЕТИЧЕСКАЯ МОДИФИКАЦИЯ ГЕНОМА ЧЕЛОВЕКА
Сайты метилирования
Как известно, ДНК-метилирование – эпигенетическая модификация генома, не связанная с нарушением последовательности ДНК, но играющая ключевую роль в регуляции многих биологических процессов (экспрессия генов, ремоделирование структуры хроматина, инактивация Х-хромосомы, геномный импринтинг, стабильность хромосом) [47–49]. Сайтами метилирования ДНК в геноме человека являются преимущественно СрG-динуклеотиды; 5-метилцитозин склонен к реакции деаминирования с образованием тимина. Это законное основание не распознается системами репарации, поэтому цитозин характеризуется высокой частотой мутирования в CpG-контексте (CG>TG), а наиболее распространенный однонуклеотидный полиморфизм в геноме человека – это замена цитозина на тимин (С>Т). Поэтому эволюционно сложилось, что наблюдаемая частота СрG-динуклеотидов в несколько раз ниже (примерно в 5 раз) ожидаемой (0.04, так как частота цитозина – 0.2, гуанина – 0.2) [50, 51]. В геноме человека 5-метилцитозин составляет около 1% всех нуклеотидов в ДНК, а метилированное состояние характерно для 70% СрG-динуклеотидов. Метилированные участки ДНК свойственны хроматину, в состав которого входит поздно реплицирующаяся ДНК (составляют около 98% генома, частота СрG-динуклеотидов приблизительно 1 : 80), труднодоступная для транскрипционных факторов. Большинство метилированных цитозинов локализовано в диспергированных (LTR, LINE, SINE, Alu) и тандемных повторах (сателлитная ДНК), которые составляют по крайней мере половину человеческого генома. Такое эпигенетическое маркирование защищает геном от инсерционного мутагенеза за счет подавления активности чужеродных генетических элементов и обеспечивает стабильность центромерных, перицентромерных и субтеломерных регионов, подавляя ДНК-рекомбинационные события [47, 52–55].
СрG-островки
Неметилированные СpG-динуклеотиды представлены в основном в СрG-островках – специфичных районах ДНК, характеризующихся содержанием G+C не ниже 0.5 и отношением наблюдаемого СрG-состава к ожидаемому не ниже 0.6, в пределах последовательности не короче 200 пн. Приблизительно 60% этих элементов генома ассоциированы с промоторами генов, абсолютное большинство которых постоянно экспрессируются (гены “домашнего хозяйства”). Остальные 40% СрG-островков удалены от сайтов старта транскрипции, являются внутригенными или межгенными и называются “орфанные СpG-островки”, так как они не ассоциированы с соответствующими промоторами, но выполняют похожие функции [47, 49]. В СpG-островках частота СpG-динуклеотидов в 7–10 раз выше (приблизительно 1 : 10–20), а уровень замен CG>TG почти в 7 раз ниже, чем в других регионах генома [55]. Показано, что связывание таких TFs, как Sp1 и CTCF, обеспечивает локальное неметилированное состояние ДНК. Хроматин, в состав которого входят CpG-островки, характеризуется крайне малым содержанием гистона Н1, гиперацетилированием гистонов H1 и Н4, практически полным отсутствием нуклеосомной структуры. Высокое содержание CpG-динуклеотидов, характерное для этих элементов генома, способствует связыванию с хроматином белка Cfp1 – интегрального компонента метилтрансферазного комплекса Setd1, катализирующего присоединение трех метильных групп к гистону Н3К4. Этот метилированный гистон в свою очередь вызывает модификацию других гистоновых белков и способствует активации транскрипции [56–60].
В отдалении вплоть до 2 и 4 тпн от промоторных СрG-островков расположены, соответственно, так называемые “берега” (СGI shores) и “шельфы” (CGI shelfs), которые характеризуются более низкой плотностью СpG-динуклеотидов, но тоже вовлечены в регуляцию генной экспрессии. Показано, что “берега” СрG-островков часто перекрываются с тканеспецифичными дифференциально-метилированными регионами (DMRs) [49, 61, 62]. Следует подчеркнуть, что метилирование CpG-динуклеотидов промоторов генов сопряжено с подавлением транскрипции, но не элонгации. Внутригенные CpG-островки в большей степени подвержены метилированию, блокирующему использование альтернативных промоторов. Большая роль в регуляции экспресcии некодирующих РНК (ncRNAs), энхансерной активности, РНК процессинга (альтернативные сайты сплайсинга и полиаденилирования) отводится метилированию внутригенных CpG [63, 64].
Метилирование СрG-островков и транскрипция
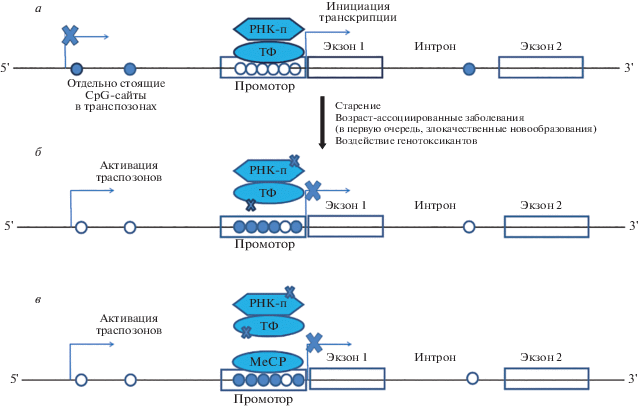
Как правило, метилирование СрG-островков промоторов часто рассматривается как механизм генного сайленсинга, опосредованного протеинами, содержащими метил-СрG-связывающий домен (MBD). А именно связывание этих белков с метилированными СpG-динуклеотидами СpG-островков с последующим рекрутированием гистоновых деацетилаз приводит к компактизации хроматина и подавлению экспрессии генов. Другой возможный механизм связан с изменением эффективности связывания позитивных и негативных факторов транскрипции (TFs) с их сайтами узнавания: например, если соответствующие СpG метилированы, связывание факторов транскрипции с ДНК промоторного региона гена будет ингибировано (рис. 1). Однако показано, что отсутствие метилирования не обязательно ассоциировано с активным состоянием гена, а подавление его экспрессии может быть обеспечено другими эпигенетическими механизмами (например, функционированием белков polycomb репрессивного комплекса, PсGTs, который опосредует метилирование H3K27, что ассоциировано с компактизацией хроматина). Таким образом, метилирование цитозина в контексте СрG-островков может быть не причиной, а следствием генной репрессии, вызванной модификациями хроматина и стабилизированной рассматриваемым эпигенетическим изменением ДНК [63].
Рис. 1.
Метилирование СpG-островков промоторов активно работающих генов и репрессия транскрипции. ТФ – факторы транскрипции (особенность – наличие ДНК-связывающего домена 6–18 пн); РНК-п – РНК-полимераза; МеСР – белки, специфически связывающиеся с метилированными цитозинами. а – нормальная ситуация: неметилированный СpG-островок генного промотора, доступный для ТФ, и метилированные отдельно стоящие СpG-динуклеотиды (внутригенные, находящиеся в транспозоне); б, в – показаны два механизма репрессии транскрипции при метилировании СpG-островков: б – посредством ингибирования связывания ТФ с сайтами узнавания, содержащими 5-метилцитозин, и в – посредством белков МеСР, препятствущих доступу ТФ к регуляторным элементам.
Распределение CpG-сайтов по уровню метилирования
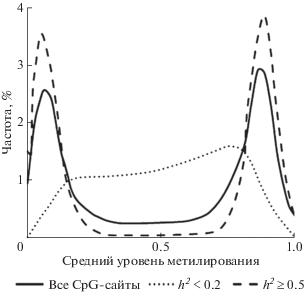
Результаты широкогеномного близнецового исследования метилирования (769 пар монозиготных близнецов и 424 пары дизиготных близнецов) указывают на отчетливый бимодальный характер распределения CpG-сайтов (411 169 сайтов) по уровню этой эпигенетической модификации (рис. 2). Бимодальность обусловлена наличием в геноме гипо- и гиперметилированных сайтов с низким коэффициентом наследуемости (h2 < 0.2), ассоциированнных, как правило, с промоторами активных и репрессированных генов. Эти сайты характеризуются низкой межиндивидуальной вариабельностью и возраст-ассоциированными изменениями метилирования. Напротив, сайты с промежуточным уровнем и высоким коэффициентом наследования метилирования (h2 ≥ 0.5), как правило, характеризуются высокой межиндивидуальной вариабельностью такого эпигенетического маркирования, отсутствием изменений с возрастом. В наибольшей степени эти CpG представлены в берегах CpG-островков (СGI shores), межгенных промежутках, дистальных промоторных элементах (энхансеры, сайленсеры), downstream регионах, а в наименьшей степени – в проксимальных промоторах, CpG-островках и шельфах CpG-островков. Сайты, характеризующиеся высокой вариабельностью метилирования, обусловленной действием стохастических факторов и факторов окружающей среды, стабильностью в течение старения индивида, но низким коэффициентом наследуемости рассматриваемой модификации, представлены в большей степени в CpG-островках. Высоковариабельные CpG с низким коэффициентом наследуемости метилирования, но характеризующиеся возраст-ассоциированными изменениями, в большей степени представлены в шельфах CpG-островков, внутригенно, дистальных промоторных регионах [65].
Рис. 2.
Распределение CpG-сайтов в геноме человека по уровню метилирования (по результатам, представленным в [65]). CpG-cайты, характеризующиеся h2 < 0.2 – низким коэффициентом наследования метилирования, ассоциированы, в первую очередь, с промоторами активных и репрессированных генов; CpG-cайты, характеризующиеся h2 ≥ 0.5 – высоким коэффициентом наследования метилирования, представляют собой, в первую очередь, отдельно стоящие CpG-динуклеотиды (внутригенные и межгенные, а также расположенные в энхансерах и сайленсерах).
ИЗМЕНЕНИЯ МЕТИЛИРОВАНИЯ ДНК, ИНДУЦИРОВАННЫЕ ДИОКСИНАМИ: ЭКСПЕРИМЕНТАЛЬНЫЕ ИССЛЕДОВАНИЯ in vitro И in vivo
Изменение тотального уровня метилирования ДНК
Внутриутробное воздействие TХДД на беременных мышей C57BL/6J (28 или 64 мкг/кг, 10 или 10.5 дней гестации) приводило к повышению тотального уровня метилирования ДНК, активности гистонацетилтрансферазы и количества ацетилированного H3, возрастанию экспрессии метилсвязывающих протеинов MBDs (МеСР) и ДНК-метилтрансферазы DNMT3A при снижении уровня метилирования промотора гена DNMT3A по сравнению с контролем. Эти изменения регистрировались через 3–7 дней в небной ткани мышиных эмбрионов, что сопровождалось индукцией у них патологии – расщелины неба. Авторы предполагают причинную взаимосвязь между наблюдаемыми фактами [66–68].
Нарушения импринтинга
Продемонстрировано, что антенатальное воздействие (стадия гонадогенеза и дифференциация пола) на крыс ТХДД (100 или 500 нг/кг/сут, 8–14-й день беременности) приводит к морфофункциональным отклонениям развития яичников. Кроме того показано, что хотя средние уровни метилирования DMR2 (диференциально-метилированный регион-2) гена Igf2 и ICR (регион контроля импринтинга) локуса H19 не меняются, имеет место повышенная частота этой эпигенетической модификации некоторых СpG-сайтов, что сопровождалось пониженной экспрессией рассматриваемых импринтированных локусов [69].
В другой работе показано, что у крыс-самцов, являющихся потомками подвергшихся воздействию ТХДД беременных самок (200 или 800 нг/кг/сут; 8–14-й день беременности), снижена экспрессия Igf2 в печени, что сопровождалось повреждением клеток этого органа и повышением активности печеночных ферментов в сыворотке крови. Наряду с этим выявлено гиперметилирование H19 (ICR) наряду с гипометилированием области DMR2 гена Igf2. Все эти изменения продемонстрированы как в F1, так и F3 поколении, что свидетельствует о трансгенерационных эффектах, индуцированных ТХДД, проявляющихся в соматических тканях потомства особей, перенесших воздействие [70].
В экспериментальной работе с мышиными эмбрионами, развитие которых (культура in vitro) начиная от одноклеточной стадии и вплоть до бластоцисты проходило в условиях воздействия ТХДД (концентрация в среде 10 нM) и после этого трансплантированных интактным самкам-реципиентам, показано повышение уровня гиперметилирования контрольного региона импринтинга генов H19/Igf2, возрастание метилтрансферазной активности и снижение экспрессии рассматриваемых локусов как у преимплантационных, так и 14-дневных эмбрионов (Е14), по сравнению с эмбрионами, не подвергавшимися воздействию диоксина. При этом вес Е14, развившихся из экспонированной бластоцисты, был почти на 20% ниже соответствующего показателя в контроле [71].
Показано, что экспрессия метилтрансферазы DNMT1 в соматических клетках регулируется транскрипционным фактором Sp1. Кроме того, промоторный регион DNMT3b содержит сайт связывания Sp1. Имеются сведения о модуляции ДНК-связывающей активности Sp1 в условиях трансплацентарного диоксинового воздействия. Установлено, что и AhR/ARNT, и Sp1 конститутивно экспрессируются в преимплантационных эмбрионах. Результаты экспериментов in vitro с использованием CYP1A1 промотора свидетельствовали о синергитическом энхансерном эффекте [72–78].
Локус-специфические изменения метилирования
В эксперименте in vitro показано, что воздействие ТХДД на первичные кератиноциты человека HEKs приводило к подавлению транскрипции генов клеточного цикла (опухолевых супрессоров) p16/INK4a и TP53 через индукцию метилирования промоторов этих локусов, сопряженную с активацией AhR-зависимого сигнального пути, что в конечном итоге приводило к ингибированию старения клеток и их иммортализации [79].
Выявлено гиперметилирование промотора BRCA1 как результат рекрутирования ДНК-метилтрансферазы 1 к регуляторной области гена и снижение экспрессии этого локуса у потомков крыс Sprague-Dawley, подвергшихся будучи беременными воздействию ТХДД. Основываясь на информации, что ген BRCA-1 человека и крысы содержит “диоксинчувствительные” элементы, которые являются связывающими мишенями для арил-гидрокарбонового рецептора AhR, исследователи провели дополнительные эксперименты с введением в диету животных ресвератрола – антагониста AhR, стимулирующего экспрессию репрессора AhR (AhRR), что привело к снижению выраженности рассматриваемых эпигенетических изменений [80].
Воздействие ТХДД (25 мкг/кг) на мышей C57BL/6 с экспериментально-индуцированным колитом (результат введения DSS) приводило к улучшению клинической картины и ослаблению выраженности воспалительного процесса, что сопровождалось ингибированием пролиферации Т-хелперов 17 (Th17-клетки) и увеличением количества регуляторных Т-клеток (Tregs) в собственной пластинке (LP) и мезентериальных лимфатических узлах (MN). Выявленные изменения были ассоциированы с AhR-зависимым влиянием диоксина на измененный статус метилирования CpG-островков промотора Foxp3 (повышенное метилирование при колите в отсутствие действия ТХДД) и промотора IL-17 (деметилирование при колите в отсутствие действия ТХДД), т.е. наблюдались частичное деметилирование Foxp3 и индукция метилирования IL-17 в Т-клетках [81]. Таким образом, в данном случае диоксиновое воздействие приводило к положительному адаптивному эффекту.
Показано, что действие ТХДД на мышей (самцов и самок) во время их внутриутробного периода развития (15.5-й день гестации, т.е. завершенный органогенез, 10 мкг на 1 кг массы тела беременной самки), а в последующем через молоко матери приводит к снижению у них способности к зачатию и неблагоприятным исходам беременности при скрещивании с интактными особями противоположного пола: преждевременные роды, снижение веса плаценты и новорожденных детенышей (F2-поколение), что сопровождалось уменьшением уровней мРНК генов прогестероновых рецепторов PGRA и PGRB и повышением транскрипционной активности TLR4, опосредующих экспрессию провоспалительных цитокинов в плаценте [82]. В последующей работе ряд вышеперечисленных изменений выявлен и для F2–F3 поколений животных, где также был показан повышенный уровень экспрессии гена AhR в сперматоцитах [83, 84]. Следует отметить, что последний эффект был сопряжен со снижением фертильности у мужчин в популяционных исследованиях [85].
Так как полученные результаты свидетельствуют об изменениях репродуктивной системы у самцов-мышей F3-поколения, речь идет о “чистом” трансгенерационном эффекте, индуцированном диоксиновым воздействием и наблюдаемом в клетках зародышевого пути, что привело к изучению эпигенетических механизмов этого феномена. В широкогеномном исследовании метилома плаценты показано, что в F1 и F3 генерациях 15% генов являются дифференциально-метилированными. В частности, показано гиперметилирование промоторного региона гена PGR и гипометилирование импринтированного гена инсулиноподобного фактора роста Igf2, что приводило к снижению уровней мРНК этих локусов. Таким образом, скрещивание мышей-самцов, подвергшихся внутриутробному воздействию ТХДД, с интактными самками приводило к индукции эпигенетических изменений в плаценте, ее дисфункциям и неблагоприятным исходам беременности, в том числе преждевременным родам, причем эти признаки характеризовались трансгенерационной передачей в ряду поколений [86].
Широкогеномное изучение метилома (MeDIP-Chip анализ) спермы крыс F3-поколения – потомков самок, подвергшихся будучи беременными воздействию ТХДД (8–14-й дни гестации, суммарная концентрация 0.7 мкг на 1 кг массы тела), выявило 50 дифференциально-метилированных регионов, сопряженных с промоторами генов, в первую очередь сигналлинга и транскрипции (в том числе рибосомальные протеины, хемокиновый сигналлинг, клеточная цитотоксичность, опосредованная естественными киллерами, и т.д.). То есть речь идет о локусах, сопряженных с общеклеточными функциями, а не со специфическими клеточными путями. Наряду с выявленными эпигенетическими изменениями в поколениях F1 и F2 у особей как женского, так и мужского пола наблюдались те или иные врожденные гистологические и морфологические нарушения развития органов мочеполовой системы [87–89].
Существенное понижение соотношения полов (мужской/женский) выявлено не только в потомстве (F2-поколение) самцов-мышей, подвергшихся до скрещивания с интактными самками воздействию ТХДД (0.004–4 мкг на 1 кг веса), но и в потомстве особей мужского пола, подвергшихся действию этого диоксина во время внутриутробного воздействия, а в последующем лактационно (1 мкг на 1 кг веса самки-матери) [90, 91]. Аналогичный эффект выявлен в экспериментах на zebrafish [92]. Исследования спермы мышей (воздействие ТХДД in vitro, 1 час, 0.025–2.5 мкг/мл) показали дозозависимые пониженные жизнеспособность и способность к оплодотворению у сперматозоидов, несущих Y-хромосому [93].
Широкогеномное исследование метилома (глубокое бисульфитное секвенирование, WGBS) клеток семенников взрослых особей рыб zebrafish (отряд карпообразные), подвергшихся сублетальному воздействию ТХДД на 3–7-й неделе после фертилизации, выявило 397 дифференциально-метилированных СpG-сайтов (284 гипо- и 113 гиперметилированных), причем 69% DMR локализованы в пределах 100 тпн от соответствующего локуса и только 9% в пределах 10 тпн. Внутригенные СpG-сайты с дифференциальным метилированием в большей степени локализованы в интронах, чем в экзонах. Гены DMR ассоциированы с репродуктивными функциями, эпигенетическими модификациями, развитием и дифференцировкой, РНК-регуляцией, клеточным циклом, морфологическими свойствами [94]. Хотя принято считать, что метилирование промоторов связано с дифференциальной экспрессией генов, наибольшая ассоциация с транскрипцией отмечена для СpG-сайтов, локализованных в пределах 10 тпн от гена (дистальнее или проксимальнее). Это свидетельствует о более сложных взаимосвязях между транскриптомом и метиломом [95 ] .
Таким образом, на настоящий момент большинство исследований эпигенетических модификаций, индуцированных диоксинами, относится к экспериментальным работам на лабораторных животных, подвергшихся внутриутробному воздействию этих генотоксикантов. Изучены локус-специфические нарушения метилирования, включая анализ импринтированных генов у особей как F1-, так и F3-поколения, т.е. соответственно у животных, подвергшихся непосредственному воздействию ТХДД (стадия внутриутробного развития), и у неэкспанированных самцов/самок – потомков представителей F2-поколения. Следует отметить, что F2-особи развивались из зиготы, в которой один из геномов подвергся диоксиновому воздействию. Эти работы проведены с целью оценки эпигенетических механизмов таких последствий диоксинового воздействия как индуцированные врожденные дефекты развития, в первую очередь органов мочеполовой системы, а также репродуктивные дисфункции у особей разных поколений (F1, F3).
ИЗМЕНЕНИЯ МЕТИЛИРОВАНИЯ ДНК, ИНДУЦИРОВАННЫЕ ДИОКСИНАМИ И ДИОКСИНОПОДОБНЫМИ СОЕДИНЕНИЯМИ, У ЧЕЛОВЕКА
Изучение индуцированных диоксинами и диоксиноподобными соединениями эпигенетических модификаций в популяциях человека – важная, но сложная проблема. Это связано с тем, что в большинстве случаев речь идет о комбинированном действии СОЗ, в первую очередь различных хлорорганических пестицидов в сочетании с воздействием диоксинов/диоксиноподобных соединений. Тем не менее имеется несколько работ, где оценивалась ассоциативная связь нарушений паттерна метилирования ДНК с содержанием в сыворотке крови различных СОЗ. В первую очередь эти исследования касаются оценки тотального уровня 5-метилцитозина и метилирования LINE1, Alu-повторов.
Так, у эскимосов Гренландии выявлена обратная корреляция между концентрацией стойких органических загрязнителей в плазме крови (органохлориды: ДДТ, ДДЕ, ГХЦГ, ГХБ, оксихлордан, α-хлордан, мирекс, полихлорированные дифенилы) и уровнем метилирования LINE1, Alu-повторов в лейкоцитах [96]. Другое исследование на корейской популяции, характеризующейся на порядок более низкими уровнями содержания в сыворотке СОЗ, также показало значимую обратную ассоциативную связь между концентрацией хлорорганических пестицидов (оксихлордан, ДДЕ, транс-нонахлор) в сыворотке крови и уровнем метилирования Alu-повторов. Аналогичные зависимости, не достигшие, однако, статистической значимости, выявлены и для других СОЗ, относящихся к группам полихлорированных бифенилов (ПХБ) и полибромированных дифениловых эфиров (ПБДЕ) [97]. Повышенная концентрация ПХБ126, диоксина ТХДД и пестицида ДДE была сопряжена с повышенным уровнем тотального гиперметилирования у пожилых представителей шведской популяции [98]. Показана сопряженность воздействия ДДT/E в пренатальный период развития (оценка концентраций пестицида и его метаболита в сыворотке крови беременной женщины) с гипометилированием Alu-повтора в клетках пуповинной крови новорожденных детей. Аналогичная ассоциация для LINE-1 получена при рассмотрении комбинированного воздействия органохлоридных пестицидов с полибромированными дифениловыми эфирами (PBDEs) [99].
В широкогеномном исследовании метилома пуповинной крови 12 новорожденных (microarray, Illumina 450 К) выявлено 1131 CpG-сайтов (690 гиперметилированных и 441 гипометилированных), ассоциированных с высокими уровнями пестицида ДДТ в сыворотке крови матери; 272 CpG-сайта относились к генным промоторам. Гиперметилирование двух CpG промоторной области BRCA1 было верифицировано на выборке, охватывающей 126 новорожденных детей [100].
Трагические события операции “Ranch Hand”, предпринятой армией США, во время которой в рамках программы по уничтожению растительности над южной и центральной частью Вьетнама, Лаосом и Камбоджей было распылено свыше 74 млн литров гербицидов, представляли собой уникальную ситуацию, когда миллионы людей (военные и мирные жители) подверглись воздействию препарата рецептуры “Оранжевый агент” (ОА) с технологическими примесями ядовитого ТХДД (в среднем 13 мкг/кг препарата).
Имеется лишь одно исследование с использованием кандидатного подхода (анализ CpG-островков двух генов CYP1A1 и IGF2), свидетельствующее о гипометилировании 9 из 16 проанализированных CpG-сайтов CYP1A1 в лейкоцитах крови детей, родившихся от родителей – ветеранов Вьтнамской войны. По мнению авторов, нельзя исключать защитный характер рассматриваемой модификации и трансгенерационную природу этого эффекта. Значимых нарушений в метилировании промотора импринтированного IGF2 локуса у потомков экспанированных индивидов не выявлено [101].
Таким образом, сведения относительно изменений паттернов метилирования, индуцированных диоксинами и диоксиноподобными соединениями у человека, крайне фрагментарны и недостаточны. Кроме того, следует отметить, что в широкогеномных исследованиях метилома лиц, подвергшихся действию различных химических генотоксикантов, как правило, не приводится анализ направленности индуцированных эффектов, затрагивающих определенный локус, в зависимости от расположения в нем исследованных CpG-сайтов (например, область CpG-островка промотора и транскрибируемая часть гена).
ВОЗРАСТ-АССОЦИИРОВАННЫЕ ИЗМЕНЕНИЯ МЕТИЛОМА
“CpG-часы”
В целом представленные выше данные свидетельствуют о реальности индукции диоксинами и диоксиноподобными соединениями нарушений метилирования ДНК (исследования in vitro и in vivo). В то же время одной из первостепенных задач изучения отдаленных эффектов генотоксического воздействия является поиск маркеров перенесенного экспанирования, которые могут дать интегральную оценку состояния здоровья индивида. Очевидно, что таким предиктором может быть биологический возраст.
Предсказательная модель биологического старения человека (353 CpG-часы), построенная на основе регрессионного анализа сопряженности календарного возраста с изменениями уровней метилирования 353 CpG-сайтов, отличается высокой точностью (корреляция между календарным и эпигенетическим возрастом составляет 0.96; ошибка прогноза составляет ±3.6 года), воспроизводимостью и способна идентифицировать индивидов с замедленным и ускоренным старением. Механизмы рассматриваемых возраст-ассоциированных изменений метилирования не понятны. Экспериментально доказано, что, с одной стороны, нельзя утверждать наличие связи CpG-часов с митотическим возрастом, а с другой стороны, DNAm не является маркером клеточного старения [34]. Эти данные неоднократно воспроизводились, а исходная панель эпигенетических маркеров была существенно упрощена: 73 CpG-часы [35], 3 CpG-часы [36], 8 CpG-часы [37].
Повышенный “эпигенетический возраст” и заболевания
Несмотря на то что речь идет о закономерном онтогенетическом явлении, показана связь ускоренного старения (оценка показателя ∆, т.е. разности между эпигенетическим и хронологическим возрастом) с рядом патологий, в том числе возраст-ассоциированных заболеваний и риском смертности [38, 39, 102–108].
Так, показана связь Δ с антенатальными (состояние матери во время беременности: курение, индекс массы тела, содержание селена, уровень холестерина) и ранними постнатальными факторами (вес при рождении, родоразрешение кесаревым сечением) [102]. Имеются данные о повышении эпигенетического возраста, определенного при исследовании лейкоцитов крови, при ВИЧ-инфицировании, синдроме Дауна, болезни Паркинсона, ранней менопаузе, снижении общих показателей когнитивных функций и физического здоровья (скорость ходьбы, функции легких и др.) у пожилых людей (70 лет и выше) [38, 103–106]. Отмечено, что “биологический возраст” клеток раковых опухолей, определенный по гиперметилированию, в среднем превышает календарный возраст больного на 36 лет [34]. Показана сопряженность повышенного эпигенетического возраста с риском раннего ишемического инсульта (57 лет и моложе), причем коррелятивная связь этого заболеваниями с артериальной гипертензией, сахарным диабетом, дислипидемией наблюдается также у лиц этой более молодой группы [39]. Показано, что для индивидов, характеризующихся преждевременным старением (Δ больше 5 лет), риск смертности увеличен на 16% (независимо от состояния здоровья и образа жизни). Наследуемость (h2) Δ составляет 0.43 [107]. Превышение эпигенетического возраста по сравнению с календарным на один год, что выявлено при исследовании лейкоцитов крови, сопряжено с повышенным риском заболеваемости раком и смертности от этой патологии в течение последующих 3–5 лет (Hazard ratio, коэффициент риска HR = 1.06, 95%-ный CI 1.02–1.10 и HR = 1.17, 95%-ный CI 1.07–1.28 соответственно) [108].
Кроме того, множество исследований возраст-ассоциированных изменений метилирования посвящено локусам, отобранным на основе их патогенетической значимости в индукции рака и других заболеваний, сопряженных с возрастом. Так, отмечена возрастная зависимость гиперметилирования CpG-островков генов, вовлеченных в опухолевую супрессию, антиоксидантную защиту, детоксикацию ксенобиотиков, репарацию ДНК, регуляцию иммунного ответа, системы коагуляции, выявленного в клетках нормальных тканей. Это подтверждают и результаты широкогеномных исследований метилирования (EWAS) [40]. Однако патогенетическая роль гиперметилирования промоторов этих генов в развитии тех или иных заболеваний остается неясной. В любом случае эти эпигенетические нарушения могут рассматриваться как биомаркеры повышенного риска развития тех или иных заболеваний у здоровых индивидов.
В заключение этого раздела следует отметить, что в целом старение, последствия генотоксических воздействий и возраст-ассоциированные заболевания сопровождаются общими эпигенетическими нарушениями, в частности гиперметилированием CpG-островков промоторов ряда генов и гипометилированием повторяющихся элементов генома (LINE1, Alu-повторы) (рис. 1).
ЗАКЛЮЧЕНИЕ
В исследованиях с использованием экспериментальных моделей твердо установлены мультигенерационные и трансгенерационные эффекты индуцированных диоксинами локус-специфических нарушений метилирования и их сопряженность с репродуктивными дисфункциями и врожденными пороками развития. Эффекты наблюдаются в F3-поколении особей – потомков родителей (F1-поколение), подвергшихся диоксиновому воздействию в антенатальный период развития и лактационно, что свидетельствует о трансгенерационном феномене передачи эпигенетических изменений в ряду поколений. Следует отметить, что использованные в экспериментах концентрации ТХДД составляли, как правило, 0.1–25 мкг/кг массы тела животного. Судя по всему, уровни диоксинового воздействия в исследованных популяциях человека либо существенно ниже этого диапазона, либо находятся на нижней его границе. Например, возникшая при распылении АО загрязненность подстилающей поверхности почв могла достигать 10–22 мкг на 1 м2. В зоне токсического действия диоксинов проживало около 4.5 млн человек, а в организм каждого индивида могло проникнуть до 15 мкг ТХДД. С течением времени наблюдалось перераспределение диоксинов, снижение их уровней в почвах и появление рассматриваемых генотоксикантов во всех биотических компонентах среды, что приводило к накоплению в организме человека, преимущественно в тканях, обогащенных липидами [1]. С учетом этих данных, а также результатов, рассмотренных в предыдущих разделах, проблема изучения отдаленных эпигенетических последствий воздействия диоксинов и диоксиноподобных соединений в нескольких поколениях людей приобретает особую важность и актуальность. В конечном итоге это даст возможность выявить превентивные эпигенетические маркеры репродуктивных патологий, преждевременного старения и развития ассоциированных с возрастом заболеваний у лиц, подвергшихся несколько десятилетий назад, в разные периоды онтогенеза, воздействию рассматриваемых генотоксикантов, а также у их потомков.
Работа частично выполнена в рамках темы государственного задания Минобрнауки России “Генетические технологии в биологии, медицине, сельскохозяйственной и природохозяйственной деятельности” (№ 0112-2019-0002), подтемы “Генотоксиканты и антигеноксиканты окружающей среды: маркеры отдаленного воздействия и генетические риски развития широко распространенных заболеваний”.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Румак В.С., Умнова Н.В., Софронов Г.А., Павлов Д.С. Молекулярная токсикология диоксинов. СПб.: Наука, 2013. 63 с.
Van den Berg M., De Jongh J., Poiger H., Olson J.R. The toxicokinetics and metabolism of polychlorinated dibenzo-p-dioxins (PCDDs) and dibenzofurans (PCDFs) and their relevance for toxicity // Crit. Rev. Toxicol. 1994. V. 24. № 1. P. 1–74. https://doi.org/10.3109/10408449409017919
Румак В.С., Чинь Куок Кхань, Кузнецов А.Н. и др. Воздействие диоксинов на окружающую среду и здоровье человека // Вестник РАН. 2009. Т. 79. № 2. С. 124–131.
Viluksela M., Pohjanvirta R. Multigenerational and transgenerational effects of dioxins // Int. J. Mol. Sci. 2019. V. 20. № 12. E 2947. https://doi.org/10.3390/ijms20122947
National Academies of Sciences, Engineering, and Medicine. Veterans and Agent Orange: Update 11 (2018). Washington, DC: The National Academies Press, 2018. 716 p. https://doi.org/10.17226/25137
Жученко Н.А., Умнова Н.В., Румак В.С. и др. Врожденные морфогенетические варианты и генетический полиморфизм системы детоксикации ксенобиотиков у детей из загрязненных диоксинами районов в южном Вьетнаме // Вестник РАМН. 2006. № 7. С. 3–10.
Eskenazi B., Mocarelli P., Warner M. et al. Relationship of serum TCDD concentrations and age at exposure of female residents of Seveso, Italy // Environ Health Perspect. 2004. V. 112. № 1. P. 22–27. https://doi.org/10.1289/ehp.6573
Baccarelli A., Giacomini S.M., Corbetta C. et al. Neonatal thyroid function in Seveso 25 years after maternal exposure to dioxin // PLoS Med. 2008. V. 5. № 7. e161. https://doi.org/10.1371/journal.pmed.0050161
Ni H.G., Zeng H., Tao S., Zeng E.Y. Environmental and human exposure to persistent halogenated compounds derived from e-waste in China // Environ. Toxicol. Chem. 2010. V. 29. № 6. P. 1237–1247. https://doi.org/10.1002/etc.160
Guo Y.L., Hsu P.C., Hsu C.C., Lambert G.H. Semen quality after prenatal exposure to polychlorinated biphenyls and dibenzofurans // Lancet. 2000. V. 356. № 9237. P. 1240–1241. https://doi.org/10.1016/S0140-6736(00)02792-6
Carpenter D.O. Polychlorinated biphenyls (PCBs): routes of exposure and effects on human health // Rev. Environ. Health. 2006. V. 21. № 1. P. 1–23. https://doi.org/10.1515/reveh.2006.21.1.1
Mocarelli P., Gerthoux P.M., Ferrari E. et al. Paternal concentrations of dioxin and sex ratio of offspring // Lancet. 2000. V. 355. № 9218. P. 1858–1863. https://doi.org/10.1016/S0140-6736(00)02290-X
Mocarelli P., Gerthoux P.M., Needham L.L. et al. Perinatal exposure to low doses of dioxin can permanently impair human semen quality // Environ. Health Perspect. 2011. V. 119. № 5. P. 713–718. https://doi.org/10.1289/ehp.1002134
Ryan J.J., Amirova Z., Carrier G. Sex ratios of children of Russian pesticide producers exposed to dioxin // Environ. Health Perspect. 2002. V. 110. № 11. A699–A701. https://doi.org/10.1289/ehp.021100699
‘t Mannetje A., Eng A., Walls C. et al. Sex ratio of the offspring of New Zealand phenoxy herbicide producers exposed to 2,3,7,8-tetrachlorodibenzo-p-dioxin // Occup. Environ. Med. 2017. V. 74. № 1. P. 24–29. https://doi.org/10.1136/oemed-2016-103771
Ema M., Sogawa K., Watanabe N. et al. cDNA cloning and structure of mouse putative Ah receptor // Biochem. Biophys. Res. Commun. 1992. V. 184. № 1. P. 246–253. https://doi.org/10.1016/0006-291x(92)91185-s
Burbach K.M., Poland A., Bradfield C.A. Cloning of the Ah-receptor cDNA reveals a distinctive ligand-activated transcription factor // Proc. Natl Acad. Sci. USA. 1992. V. 89. № 17. P. 8185–8189. https://doi.org/10.1073/pnas.89.17.8185
Petrulis J.R., Perdew G.Y. The role of chaperone proteins in the aryl hydrocarbon receptor core complex // Chem. Biol. Interact. 2002. V. 141. № 1–2. P. 25–40. https://doi.org/10.1016/s0009-2797(02)00064-9
Henry E.C., Gasiewicz T.A. Agonist but not antagonist ligands induce conformational change in the mouse aryl hydrocarbon receptor as detected by partial proteolysis // Mol. Pharmacol. 2003. V. 63. № 2. P. 392–400. https://doi.org/10.1124/mol.63.2.392
Soshilov A., Denison M.S. Role of the Per/Arnt/Sim domains in ligand-dependent transformation of the aryl hydrocarbon receptor // J. Biol. Chem. 2008. V. 283. № 47. P. 32995–33005. https://doi.org/10.1074/jbc.M802414200
Richter C.A., Tillitt D.E., Hannink M. Regulation of subcellular localization of the aryl hydrocarbon receptor (AhR) // Arch. Biochem. Biophys. 2001. V. 389. № 2. P. 207–217. https://doi.org/10.1006/abbi.2001.2339
Mulero-Navarro S., Fernandez-Salguero P.M. New trends in aryl hydrocarbon receptor biology // Front. Cell Dev. Biol. 2016. V. 4. Article 45. https://doi.org/10.3389/fcell.2016.00045
Okino S.T., Whitlock J.P., Jr. Dioxin induces localized, graded changes in chromatin structure: Implications for Cyp1A1 gene transcription // Mol. Cell. Biol. 1995. V. 15. № 7. P. 3714–3721. https://doi.org/10.1128/mcb.15.7.3714
Puga A., Ma C., Marlowe J.L. The aryl hydrocarbon receptor cross-talks with multiple signal transduction pathways // Biochem. Pharmacol. 2009. V. 77. № 4. P. 713–722. https://doi.org/10.1016/j.bcp.2008.08.031
Sartor M.A., Schnekenburger M., Marlowe J.L. et al. Genomewide analysis of aryl hydrocarbon receptor binding targets reveals an extensive array of gene clusters that control morphogenetic and developmental programs // Environ. Health Perspect. 2009. V. 117. № 7. P. 1139–1146. https://doi.org/10.1289/ehp.0800485
Сычева Л.П., Можаева Т.Е., Умнова Н.В. и др. Цитогенетические и другие кариологические показатели в эксфолиативных клетках вьетнамских детей из района применения диоксинсодержащих гербицидов // Вестник РАМН. 2008. № 1. С. 19–23.
Sycheva L.P., Umnova N.V., Kovalenko M.A. et al. Dioxins and cytogenetic status of villagers after 40 years of agent Orange application in Vietnam // Chemosphere. 2016. V. 144. P. 1415–1420. https://doi.org/10.1016/j.chemosphere.2015.10.009
Румак В.С., Умнова Н.В., Софронов Г.А. Молекулярные и клеточные аспекты токсичности диоксинов // Вестник РАМН. 2014. № 3–4. С. 77–84. https://doi.org/10.15690/vramn.v69.i3-4.1000
Antwih D.A., Gabbara K.M., Lancaster W.D. et al. Radiation-induced epigenetic DNA methylation modification of radiation-response pathways // Epigenetics. 2013. V. 8. № 8. P. 839–848. https://doi.org/10.4161/epi.25498
Kuzmina N.S., Lapteva N.Sh., Rubanovich A.V. Hypermethylation of gene promoters in peripheral blood leukocytesin humans long term after radiation exposure // Environ. Res. 2016. № 146. P.10–17. https://doi.org/10.1016/j.envres.2015.12.008
Kuzmina N.S., Lapteva N.Sh., Rusinova G.G. et al. Gene hypermethylation in blood leukocytes in humans long term after radiation exposure – Validation set // Environ Pollut. 2018. № 234. P. 935–942. https://doi.org/10.1016/j.envpol.2017.12.039
Ruiz-Hernandez A., Kuo C.C., Rentero-Garrido P. et al. Environmental chemicals and DNA methylation in adults: a systematic review of the epidemiologic evidence // Clin. Epigenetics. 2015. V. 7. № 1. P. 55. https://doi.org/10.1186/s13148-015-0055-7
Martin E.M., Fry R.C. Environmental influences on the epigenome: exposure-associated DNA methylation in human populations // Annu. Rev. Public Health. 2018. V. 39. P. 309–333. https://doi.org/10.1146/annurev-publhealth-040617-014629
Horvath S. DNA methylation age of human tissues and cell types // Genome Biol. 2013. V. 14. № 10. R115. https://doi.org/10.1186/gb-2013-14-10-r115
Hannum G., Guinney J., Zhao L. et al. Genome-wide methylation profiles reveal quantitative views of human aging rates // Mol. Cell. 2013. V. 49. № 2. P. 359–367. https://doi.org/10.1016/j.molcel.2012.10.016
Weidner C.I., Lin Q., Koch C.M. et al. Aging of blood can be tracked by DNA methylation changes at just three CpG sites // Genome Biology. 2014. V. 15. № 2. R24. https://doi.org/10.1186/gb-2014-15-2-r24
Vidal-Bralo L., Lopez-Golan Y., Gonzale A. Simplified assay for epigenetic age estimation in whole blood of adults // Front. Genet. 2016. V. 7. P. 126. https://doi.org/10.3389/fgene.2016.00126
Marioni R.E., Shah S., McRae A.F. et al. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936 // Int. J. Epidemiol. 2015. V. 44. № 4. P. 1388–1396. https://doi.org/10.1093/ije/dyu277
Soriano-Tárraga K., Giralt-Steinhauer E., Mola-Caminal M. et al. Ischemic stroke patients are biologically older than their chronological age // Aging. 2016. V. 8. № 11. P. 2655–2666. https://doi.org/10.18632/aging.101028
Zampieri M., Ciccarone F., Calabrese R. et al. Reconfiguration of DNA methylation in aging // Mechanisms of Ageing and Development. 2015. V. 151. P. 60–70. https://doi.org/10.1016/j.mad.2015.02.002
Van Otterdijk S.D., Mathers J.C., Strathdee G. Do agerelated changes in DNA methylation play a role in the development of age-related diseases? // Biochem. Soc. Transact. 2013. V. 41. № 3. P. 803–807. https://doi.org/10.1042/BST20120358
Flanagan J.M., Munoz-Alegre M., Henderson S. et al. Gene-body hypermethylation of ATM in peripheral blood DNA of bilateral breast cancer patients // Hum. Mol. Genet. 2009. V. 18. № 7. P. 1332–1342. https://doi.org/10.1093/hmg/ddp033
Al-Moundhri M.S., Al-Nabhani M., Tarantini L. et al. The prognostic significance of whole blood global and specific DNA methylation levels in gastric adenocarcinoma // PLoS One. 2010. V. 5. № 12. e. 15585. https://doi.org/10.1371/journal.pone.0015585
Tahara T., Maegawa S., Chung W. Examination of whole blood DNA methylation as a potential risk marker for gastric cancer // Cancer Prev. Res. 2013. V. 6. № 10. P. 1093–1100. https://doi.org/10.1158/1940-6207.CAPR-13-0034
Lakshmi Sana V.V., Naushad S.M., Reddy C.A. et al. Oxidative stress in coronary artery disease: epigenetic perspective // Mol. Cell. Biochem. 2013. V. 374. № 1–2. P. 203–211. https://doi.org/10.1007/s11010-012-1520-7
Kim G.H., Ryan J.J., Archer S.L. The role of redox signaling in epigenetics and cardiovascular disease // Antioxid. Redox Signal. 2013. V. 18. № 15. P. 1920–1936. https://doi.org/10.1089/ars.2012.4926
Jones P.A., Takai D. The role of DNA methylation in mammalian epigenetics // Science. (N.Y.) 2001. V. 293. № 5532. P. 1068–1070. https://doi.org/10.1126/science.1063852
Suzuki M.M., Bird A. DNA methylation landscapes: provocative insights from epigenomics // Nat. Rev. 2008. V. 9. № 6. P. 465–476. https://doi.org/10.1038/nrg2341
Jones P.A. Functions of DNA methylation: islands, start sites, gene bodies and beyond // Nat. Rev. 2012. V. 13. № 7. P. 484–492. https://doi.org/10.1038/nrg3230
Pfeifer G.P. Mutagenesis at methylated CpG sequences // Curr. Top Microbiol. Immunol. 2006. V. 301. P. 259–281. https://doi.org/10.1007/3-540-31390-7_10
Bird A.P. DNA methylation and the frequency of CpG in animal DNA // Nucl. Acids Res. 1980. V. 8. № 7. P. 1499–1504. https://doi.org/10.1093/nar/8.7.1499
Robertson K.D., Wolffe A.P. DNA methylation in health and disease // Nat. Rev. 2000. V. 1. № 1. P. 11–19. https://doi.org/10.1038/35049533
Jaco I., Canela A., Vera E., Blasco M.A. Centromere mitotic recombination in mammalian cells // J. Cell Biol. 2008. V. 181. № 6. P. 885–892. https://doi.org/10.1083/jcb.200803042
Blasco M.A. The epigenetic regulation of mammalian telomeres // Nat. Rev. 2007. V. 8. № 4. P. 299–309. https://doi.org/10.1038/nrg2047
Tomso D.J., Bell D.A. Sequence context at human single nucleotidepolymorphisms: overrepresentation of CpG dinucleotide at polymorphic sitesand suppression of variation in CpG islands // J. Mol. Biol. 2003. V. 327. № 2. P. 303–308. https://doi.org/10.1016/s0022-2836(03)00120-7
Brandeis M., Frank D., Keshet I. et al. Sp1 elements protect a CpG island from de novo methylation // Nature. 1994. V. 371. № 6496. P. 435–438. https://doi.org/10.1038/371435a0
Maurano M.T., Wang H., Kutyavin T., Stamatoyannopoulos J.A. Widespread site-dependent buffering of human regulatory polymorphism // PLoS Genet. 2012. V. 8. № 3. e1002599. https://doi.org/10.1371/journal.pgen.1002599
Lin I.G., Tomzynski T.J., Ou Q., Hsieh C.L. Modulation of DNA binding protein affinity directly affects target site demethylation // Mol. Cell Biol. 2000. V. 20. № 7. P. 2343–2349. https://doi.org/10.1128/mcb.20.7.2343-2349.2000
Stadler M.B., Murr R., Burger L. et al. DNA-binding factors shape the mouse methylome at distal regulatory regions // Nature. 2011. V. 480. № 7378. P. 490–495. https://doi.org/10.1038/nature10716
Thomson J.P., Skene P.J., Selfridge J. et al. CpG islands influence chromatin structure via the CpG-binding protein Cfp1 // Nature. 2010. V. 464. № 7291. P. 1082–1086. https://doi.org/10.1038/nature08924
Illingworth R.S., Bird A.P. CpG islands: a rough guide // FEBS Lett. 2009. V. 583. № 11. P. 1713–1720. https://doi.org/10.1016/j.febslet.2009.04.012
Illingworth R.S., Gruenewald-Schneider U., Webb S. et al. Orphan CpG islands identify numerous conserved promoters in the mammalian genome // PLoS Gen. 2010. V. 6. № 9. e1001134. https://doi.org/10.1371/journal.pgen.1001134
Kulis M., Queirós A.C., Beekman R., Martín-Subero J.I. Intragenic DNA methylation in transcriptional regulation, normal differentiation and cancer // Biochim. Biophys. Acta. 2013. V. 1829. № 11. P. 1161–1174. https://doi.org/10.1016/j.bbagrm.2013.08.001
Maunakea A.K., Nagarajan R.P., Bilenky M. et al. Conserved role of intragenic DNA methylation in regulating alternative promoters // Nature. 2010. V. 466. № 7303. P. 253–257. https://doi.org/10.1038/nature09165
Van Dongen J., Nivard M.G., Willemsen G. et al. Genetic and environmental influences interact with age and sex in shaping the human methylome // Nat. Commun. 2016. V. 7. P. 11115. https://doi.org/10.1038/ncomms11115
Yuan X., Qiu L., Pu Y. et al. Histone acetylation is involved in TCDD induced cleft palate formation in fetal mice // Mol. Med. Rep. 2016. V. 14. № 2. P. 1139–1145. https://doi.org/10.3892/mmr.2016.5348
Wang C., Yuan X.G., Liu C.P. et al. Preliminary research on DNA methylation changes during murine palatogenesis induced by TCDD // J. Craniomaxillofac. Surg. 2017. V. 45. № 5. P. 678–684. https://doi.org/10.1016/j.jcms.2017.02.004
Zhang W., Zhou S., Gao Y. et al. Alterations in DNA methyltransferases and methyl-CpG binding domain proteins during cleft palate formation as induced by 2,3,7,8-tetrachlorodibenzo-p-dioxin in mice // Mol. Med. Rep. 2018. V. 17. № 4. P. 5396–5401. https://doi.org/10.3892/mmr.2018.8521
Zhang X., Ji M., Tan X. et al. Role of epigenetic regulation of Igf2 and H19 in 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD)-induced ovarian toxicity in offspring rats // Toxicol. Lett. 2019. V. 311. P. 98–104. https://doi.org/10.1016/j.toxlet.2019.04.034
Ma J., Chen X., Liu Y. et al. Ancestral TCDD exposure promotes epigenetic transgenerational inheritance of imprinted gene Igf2: Methylation status and DNMTs // Toxicol. Appl. Pharmacol. 2015. V. 289. № 2. P. 193–202. https://doi.org/10.1016/j.taap.2015.09.024
Wu Q., Ohsako S., Ishimura R. et al. Exposure of mouse preimplantation embryos to 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) alters the methylation status of imprinted genes H19 and Igf2 // Biol. Reprod. 2004. V. 70. № 6. P. 1790–1797. https://doi.org/10.1095/biolreprod.103.025387
Bigey P., Ramchandani S., Theberge J. et al. Transcriptional regulation of the human DNA methyltransferase (dnmt1) gene // Gene. 2000. V. 242. № 1–2. P. 407–418. https://doi.org/10.1016/s0378-1119(99)00501-6
Kishikawa S., Murata T., Kimura H. et al. Regulation of transcription of the Dnmt1 gene by Sp1 and Sp3 zinc-finger proteins // Eur. J. Biochem. 2002. V. 269. № 12. P. 2961–2970. https://doi.org/10.1046/j.1432-1033.2002.02972.x
Ishida C., Ura K., Hirao A. et al. Genomic organization and promoter analysis of the Dnmt3b gene // Gene. 2003. V. 310. P. 151–159. https://doi.org/10.1016/s0378-1119(03)00545-6
Worrad D.M., Schultz R.M. Regulation of gene expression in the preimplantation mouse embryo: temporal and spatial patterns of expression of the transcription factor Sp1 // Mol. Reprod. Dev. 1997. V. 46. № 3. P. 268–277. https://doi.org/10.1002/(SICI)1098-2795(199703)46: 3<268::AID-MRD5>3.0.CO;2-N
Wu Q., Ohsako S., Baba T. et al. Effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) on preimplantation mouse embryos // Toxicology. 2002. V. 174. № 2. P. 119–129. https://doi.org/10.1016/s0300-483x(02)00047-1
Kobayashi A., Sogawa K., Fujii-Kuriyama Y. Cooperative interaction between AhR/Arnt and Sp1 for the drug-inducible expression of CYP1A1 gene // J. Biol. Chem. 1996. V. 271. № 21. P. 12310–12316. https://doi.org/10.1074/jbc.271.21.12310
Nayyar T., Zawia N.H., Hood D.B. Transplacental effects of 2,3,7,8-tetrachlorodibenzo-p-dioxin on the temporal modulation of Sp1 DNA binding in the developing cerebral cortex and cerebellum // Exp. Toxicol. Pathol. 2002. V. 53. № 6. P. 461–468. https://doi.org/10.1078/0940-2993-00219
Ray S.S., Swanson H.I. Dioxin-induced immortalization of normal human keratinocytes and silencing of p53 and p16INK4a // J. Biol. Chem. 2004. V. 279. № 26. P. 27187–27193. https://doi.org/10.1074/jbc.M402771200
Papoutsis A.J., Selmin O.I., Borg J.L., Romagnolo D.F. Gestational exposure to the AhR agonist 2,3,7,8-tetrachlorodibenzo-p-dioxin induces BRCA-1 promoter hypermethylation and reduces BRCA-1 expression in mammary tissue of rat offspring: preventive effects of resveratrol // Mol. Carcinog. 2015. V. 54. № 4. P. 261–269. https://doi.org/10.1002/mc.22095
Singh N.P., Singh U.P., Singh B. et al. Activation of aryl hydrocarbon receptor (AhR) leads to reciprocal epigenetic regulation of FoxP3 and IL-17 expression and amelioration of experimental colitis // PLoS One. 2011. V. 6. № 8. e23522. https://doi.org/10.1371/journal.pone.0023522
Ding T., McConaha M., Boyd K.L. et al. Developmental dioxin exposure of either parent is associated with an increased risk of preterm birth in adult mice // Reprod. Toxicol. 2011. V. 31. № 3. P. 351–358. https://doi.org/10.1016/j.reprotox.2010.11.003
Bruner-Tran K.L., Osteen K.G. Developmental exposure to TCDD reduces fertility and negatively affects pregnancy outcomes across multiple generations // Reprod. Toxicol. 2011. V. 31. № 3. P. 344–350. https://doi.org/10.1016/j.reprotox.2010.10.003
Bruner-Tran K.L., Ding T., Yeoman K.B. et al. Developmental exposure of mice to dioxin promotes transgenerational testicular inflammation and an increased risk of preterm birth in unexposed mating partners // PLoS One. 2014. V. 9. № 8. e105084. https://doi.org/10.1371/journal.pone.0105084
Bidgoli S.A., Karimi M., Asami Z. et al. Association between testicular Aryl hydrocarbon receptor levels and idiopathic male infertility: A case-control study in Iran // Sci. Total. Environ. 2011. V. 409. № 18. P. 3267–3273. https://doi.org/10.1016/j.scitotenv.2011.03.024
Ding T., Mokshagundam S., Rinaudo P.F. et al. Paternal developmental toxicant exposure is associated with epigenetic modulation of sperm and placental Pgr and Igf2 in a mouse model // Biol. Reprod. 2018. V. 99. № 4. P. 864–876. https://doi.org/10.1093/biolre/ioy111
Manikkam M., Tracey R., Guerrero-Bosagna C., Skinner M.K. Dioxin (TCDD) induces epigenetic transgenerational inheritance of adult onset disease and sperm epimutations // PLoS One. 2012. V. 7. № 9. e46249. https://doi.org/10.1371/journal.pone.0046249
Manikkam M., Guerrero-Bosagna C., Tracey R. et al. Transgenerational actions of environmental compounds on reproductive disease and identification of epigenetic biomarkers of ancestral exposures // PLoS One. 2012. V. 7. № 2. e31901. https://doi.org/10.1371/journal.pone.0031901
Nilsson E., Larsen G., Manikkam M. et al. Environmentally induced epigenetic transgenerational inheritance of ovarian disease // PLoS One. 2012. V. 7. № 5. e 36129. https://doi.org/10.1371/journal.pone.0036129
Ishihara K., Warita K., Tanida T. et al. Does paternal exposure 2,3,7,8-tetrachlorodibenzo-p-dioxin (TCDD) affect the sex ratio of offspring? // J. Vet. Med. Sci. 2007. V. 69. № 4. P. 347–352. https://doi.org/10.1292/jvms.69.347
Ikeda M., Tamura M., Yamashita J. et al. Repeated in utero and lactational 2,3,7,8-tetrachlorodibenzo-p-dioxin exposure affects male gonads in offspring, leading to sex ratio changes in F2 progeny // Toxicol. Appl. Pharmacol. 2005. V. 206. № 3. P. 351–355. https://doi.org/10.1016/j.taap.2004.11.019
Baker T.R., King-Heiden T.C., Peterson R.E., Heideman W. Dioxin induction of transgenerational inheritance of disease in zebrafish // Mol. Cell. Endocrinol. 2014. V. 398. № 1–2. P. 36–41. https://doi.org/10.1016/j.mce.2014.08.011
You Y.A., Mohamed E.A., Rahman M.S. et al. 2,3,7,8-Tetrachlorodibenzo-p-dioxin can alter the sex ratio of embryos with decreased viability of Y spermatozoa in mice // Reprod. Toxicol. 2018. V. 77. P. 130–136. https://doi.org/10.1016/j.reprotox.2018.02.011
Akemann C., Meyer D.N., Gurdziel K., Baker T.R. Developmental dioxin exposure alters the methylome of adult male zebrafish gonads // Frontiers in Genetics. V. 9. Article 719. https://doi.org/10.3389/fgene.2018.00719
McGaughey D.M., Abaan H.O., Miller R.M. et al. Genomics of CpG methylation in developing and developed zebrafish // G3. 2014. V. 4. № 5. P. 861–869. https://doi.org/10.1534/g3.113.009514
Rusiecki J.A., Baccarelli A., Bollati V. et al. Global DNA hypomethylation is associated with high serum-persistent organic pollutants in Greenlandic Inuit // Environ. Health Perspect. 2008. V. 116. № 11. P. 1547–1552. https://doi.org/10.1289/ehp.11338
Kim K.Y., Kim D.S., Lee S.K. et al. Association of low-dose exposure to persistent organic pollutants with global DNA hypomethylation in healthy Koreans // Environ. Health Perspect. 2010. V. 118. № 3. P. 370–374. https://doi.org/10.1289/ehp.0901131
Lind L., Penell J., Luttropp K. et al. Global DNA hypermethylation is associated with high serum levels of persistent organic pollutants in an elderly population // Environ Int. 2013. V. 59. P. 456–461. https://doi.org/10.1016/j.envint.2013.07.008
Huen K., Yousefi P., Bradman A. et al. Effects of age, sex, and persistent organic pollutants on DNA methylation in children // Environ. Mol. Mutagen. 2014. V. 55. № 3. P. 209–222. https://doi.org/10.1002/em.21845
Yu X., Zhao B., Su Ya. et al. Association of prenatal organochlorine pesticide dichlorodiphenyltrichloroethane exposure with fetal genome-wide DNA methylation // Life Sciences. 2018. V. 200. P. 81–86. https://doi.org/10.1016/j.lfs.2018.03.030
Giuliani C., Biggs D., Nguyen T.T. et al. First evidence of association between past environmental exposure to dioxin and DNA methylation of CYP1A1 and IGF2 genes in present day Vietnamese population // Env. Pol. 2018. V. 242. Part A. P. 976–985. https://doi.org/10.1016/j.envpol.2018.07.015
Simpkin A.J., Hemani G., Suderman M. et al. Prenatal and early life influences on epigenetic age in children: a study of mother – offspring pairs from two cohort studies // Hum. Mol. Genet. 2016. V. 25. № 1. P. 191–201. https://doi.org/10.1093/hmg/ddv456
Horvath S., Levin A.J. HIV-1 infection accelerates age according to the epigenetic clock // J. Infect. Disease. 2015. V. 212. № 10. P. 1563–1573. https://doi.org/10.1093/infdis/jiv277
Horvath S., Garagnani P., Bacalini M.G. et al. Accelerated epigenetic aging in Down syndrome // Aging Cell. 2015. V. 14. № 3. P. 491–495. https://doi.org/10.1111/acel.12325
Horvath S., Ritz B.R. Increased epigenetic age and granulocyte counts in the blood of Parkinson’s disease patients // Aging. 2015. V. 7. № 12. P. 1130–1142. https://doi.org/10.18632/aging.100859
Levine M.E., Lu A.T., Chen B.H. et al. Menopause accelerates biological aging // PNAS. 2016. V. 113. № 33. P. 9327–9332. https://doi.org/10.1073/pnas.1604558113
Marioni R.E., Shah S., McRae A.F. et al. DNA methylation age of blood predicts all-cause mortality in later life // Genome Biol. 2015. V. 16. № 1. P. 25. https://doi.org/10.1186/s13059-015-0584-6
Zheng Y., Joyce B.T., Colicino E. et al. Blood epigenetic age may predict cancer incidence and mortality // EBioMed. 2016. V. 5. P. 68–73. https://doi.org/10.1016/j.ebiom.2016.02.008
Дополнительные материалы отсутствуют.


