Генетика, 2020, T. 56, № 10, стр. 1171-1183
Кариологическая и молекулярно-генетическая дивергенция керчаков рода Myoxocephalus Gill, 1859 (Cottidae)
О. А. Радченко 1, *, И. Н. Морева 2, А. В. Петровская 1
1 Институт биологических проблем Севера Дальневосточного отделения
Российской академии наук
685000 Магадан, Россия
2 Национальный научный центр морской биологии им. А.В. Жирмунского Дальневосточного отделения
Российской академии наук
690041 Владивосток, Россия
* E-mail: radchenko@ibpn.ru
Поступила в редакцию 30.12.2019
После доработки 20.02.2020
Принята к публикации 05.03.2020
Аннотация
Проведено кариологическое и молекулярно-генетическое исследование керчаков рода Myoxocephalus. Молекулярно-генетический анализ показал, что в современном составе род гетерогенен и разделяется на тихоокеанскую и арктически-атлантическую группы. В тихоокеанской группе обнаружена тесная филогенетическая связь видов M. stelleri, M. polyacanthocephalus, M. jaok. Представитель арктически-атлантической группы M. quadricornis является монотипическим и сестринским с Me-galocottus platycephalus. На основе молекулярно-генетических и кариологических данных выявлены близкородственные отношения M. scorpius и керчаков тихоокеанской группы. Анализ M. brandtii, M. ochotensis и M. jaok из разных частей ареалов показал отсутствие кариологической изменчивости. Установлены степень и направления дивергенции кариотипов тихоокеанских видов M. brandtii, M. ochotensis, M. jaok, M. polyacanthocephalus, M. stelleri, а также M. scorpius.
Род Myoxocephalus – самый многочисленный в группе морских бычков-керчаков подсемейства Myoxocephalinae (Cottidae). Виды рода являются представителями прибрежных и шельфовых вод северных морей Тихого, Атлантического и Северного Ледовитого океанов [1, 2]. На основании морфологических признаков в роде были выделены два подрода – Myoxocephalus и Littocottus [3]. Первый объединял 11 видов и два подвида, среди них – длинношипый керчак M. octodecemspinosus и керчак-эней M. aenaeus, обитающие в Северной Атлантике. Европейский керчак M. scorpius с подвидами M. s. scorpius и M. s. groenlandicus распространены шире и встречаются в прилегающих к Атлантике арктических морях. Мраморный M. stelleri, снежный M. brandtii, бугорчатый M. tuberculatus, охотский M. ochotensis керчаки и керчак яок M. jaok известны из северо-западной части Тихого океана, в ареал последнего входят арктические воды. Многоиглый M. polyacanthocephalus и бородавчатый M. verrucosus керчаки обитают в северной части Тихого океана и в арктических морях. Самый широкий ареал у чукотского керчака M. scorpioides – Северо-Западная Атлантика, арктические моря, северная часть Тихого океана. Подрод Littocottus представлен черным керчаком M. (Littocottus) niger из северной части Тихого океана [1, 3].
В современном каталоге содержатся данные о 14 видах рода [4]. Род Triglopsis, включавший четырехрогого бычка T. quadricornis и бычка Томпсона T. thompsonii, вновь сведен в синонимию к роду Myoxocephalus [1, 3, 5–8]. Подвиды европейский M. s. scorpius и гренландский M. s. groenlandicus керчаки признаны младшими синонимами M. scorpius. Единое мнение о таксономическом статусе M. verrucosus отсутствует. По мнению одних специалистов бородавчатый керчак является валидным видом [1]. В электронном каталоге видов рыб Мирового океана M. verrucosus рассматривается в синонимии M. scorpius [4]. Основанием для пересмотра таксономического статуса M. s. scorpius, M. s. groenlandicus и M. verrucosus послужили результаты ДНК-штрихкодирования [2, 9, 10].
Для решения вопросов происхождения, родственных отношений, эволюции рода Myoxocephalus привлекались большей частью морфологические методы [3, 11]. В работе Кауэн [12] представлена реконструкция филогенетических отношений видов рода на основе морфологических признаков, сейсмосенсорной системы, аллозимной изменчивости.
После ревизии подсем. Myoxocephalinae 1979 г. сравнительный морфологический анализ видов рода Myoxocephalus не проводился. Генетические исследования дальневосточных представителей этой группы немногочисленны [2, 10, 13, 14]. Получены данные о митохондриальном геноме M. polyacanthocephalus из Японского и Охотского морей [15]. Изучены кариотипы M. scorpius из Белого моря и пяти дальневосточных керчаков (M. stelleri, M. brandtii, M. polyacanthocephalus, M. ochotensis, M. jaok) [16, 17]. Кариологические исследования M. brandtii, M. jaok и M. ochotensis ограничены изучением экземпляров из одной точки ареалов видов.
Цель настоящей работы – определить с помощью молекулярно-генетического и кариологического анализов уровень изменчивости, степень и направления дивергенции видов рода Myoxocephalus, уточнить их родственные отношения.
МАТЕРИАЛЫ И МЕТОДЫ
Объем и районы сбора материала представлены в табл. 1. Идентификация экземпляров проведена по внешним морфологическим признакам [3].
Таблица 1.
Материал, использованный в работе
| Вид (№ образца) | Район сбора | Гены (номер в GenBank) | ||
|---|---|---|---|---|
| COI | 16S рРНК | цитb | ||
| M. stelleri (1754) | Японское море, з. Восток | KY062754 | KY062665 | MH595735 |
| M. stelleri (1736) | О. Шикотан, б. Горобец | MN115307 | MN097163 | MN115343 |
| M. stelleri (1737) | О. Шикотан, б. Крабовая | MN115308 | MN097164 | MN115344 |
| M. stelleri (1991) | Японское море, з. Ольга | MN115311 | MN097167 | MN115347 |
| M. stelleri (2149) | Японское море, б. Золотая | MN115314 | MN097170 | MN115350 |
| M. stelleri (2148) | Японское море, б. Джигит | MN115318 | MN097174 | MN115354 |
| M. stelleri (2084) | Японское море, о. Сахалин, з. Александровский | MN115320 | MN097176 | MN115356 |
| M. stelleri (1985) | » | MN115319 | MN097175 | MN115355 |
| M. stelleri (1973) | Татарский пролив, з. Чихачева | MN115324 | MN097180 | MN115360 |
| M. stelleri (1748) | Охотское море, устье р. Уты | MN115326 | MN097182 | MN115362 |
| M. polyacanthocephalus (1745) | О. Шикотан, б. Горобец | MN115338 | MN097194 | MN115374 |
| M. polyacanthocephalus (1746) | » | MN877715 | MN871867 | MN877740 |
| M. polyacanthocephalus (1764) | Охотское море, устье р. Уты | MN877716 | MN871868 | MN877741 |
| M. polyacanthocephalus (1765) | Охотское море, б. Шестакова | MN877717 | MN871869 | MN877742 |
| M. polyacanthocephalus (1849) | Охотское море, о. Спафарьева | MN877718 | MN871870 | MN877743 |
| M. polyacanthocephalus (1853) | » | MN877719 | MN871871 | MN877744 |
| M. jaok (1728)* | О. Кунашир, б. Первухина | MN877720 | MN871872 | MN877745 |
| M. jaok (1822) | » | MN877721 | MN871873 | MN877746 |
| M. jaok (1772)* | Охотское море, б. Шестакова | MN877722 | MN871874 | MN877747 |
| M. jaok (1773) | » | MN877723 | MN871875 | MN877748 |
| M. jaok (1774) | » | MN877724 | MN871876 | MN877749 |
| M. jaok (1775) | » | MN877725 | MN871877 | MN877750 |
| M. jaok* | Охотское море, з. Одян | – | – | – |
| M. jaok* | Охотское море, западная Камчатка, б. Пычгыгын | – | – | – |
| M. jaok* | Охотское море, западная Камчатка, б. Квачина | – | – | – |
| M. jaok (1829) | Японское море, з. Восток | MN115336 | MN097192 | MN115372 |
| M. ochotensis (1805) | Охотское море, о. Спафарьева | MN115339 | MN097195 | MN115375 |
| M. ochotensis (1900) | Охотское море, з. Одян | MH595733 | MH588265 | MH595734 |
| M. ochotensis (1905) | » | MN877726 | MN871878 | MN877751 |
| M. ochotensis (1950) | Охотское море, о. Недоразумения | MN877727 | MN871879 | MN877752 |
| M. ochotensis* | Охотское море, о. Б. Шантар | – | – | – |
| M. ochotensis* | » | – | – | – |
| M. brandtii (1741)* | О. Шикотан, б. Отрадная | MN115337 | MN097193 | MN115373 |
| M. brandtii* | О. Шикотан, б. Димитрова | – | – | – |
| M. brandtii (1742) | » | MN877728 | MN871880 | MN877753 |
| M. brandtii (1743) | » | MN877729 | MN871881 | MN877754 |
| M. brandtii (1760)* | Японское море, з. Восток | MN877730 | MN871882 | MN877755 |
| M. brandtii (1761) | » | MN877731 | MN871883 | MN877756 |
| M. brandtii (1988)* | Татарский пролив, з. Шебунина | MN877732 | MN871884 | MN877757 |
| M. brandtii* | Татарский пролив, з. Чихачева | – | – | – |
| M. brandtii (1990)* | Японское море, з. Ольга | MN877733 | MN871885 | MN877758 |
| M. brandtii (2092) | Японское море, о. Русский | MN877734 | MN871886 | MN877759 |
| M. brandtii (2093) | » | MN877735 | MN871887 | MN877760 |
| M. quadricornis (2079) | Восточно-Сибирское море, устье р. Пучевеем | MN877736 | MN871888 | MN877761 |
| M. quadricornis (2167) | » | MN877737 | MN871889 | MN877762 |
| M. scorpius (bg) | Северное море | KJ205094 | – | – |
| M. scorpius (bg) | Чукотское море | NC042186 | – | – |
| M. quadricornis (bg) | Швеция, оз. Скиресьон | KJ128649 | – | – |
| M. thompsonii (bg) | США, Висконсин, оз. Мичиган | HQ557195 | – | – |
| M. thompsonii (bg) | Канада, Онтарио, оз. Верхнее | KX145285 | – | – |
| M. scorpioides (bg) | Канада, Гудзонов залив | MG421646 | – | – |
| M. octodecemspinosus (bg) | Канада, Новая Шотландия | KC015729 | – | – |
| M. aenaeus (bg) | » | KC015709 | – | – |
| Triglopsis quadricornis (bg) | Канада, Гудзонов залив, з. Джеймс | EU524913 | – | – |
| Porocottus minutus | Охотское море, о. Недоразумения | MH172269 | MH167465 | MH172287 |
| Microcottus sellaris | Японское море, о. Русский | MN877738 | MN871890 | MN877763 |
| Megalocottusp latycephalus | Охотское море, б. Шестакова | MH016197 | MH012123 | MH016217 |
| Megalocottus platycephalus (bg) | Берингово море, з. Нортон-Саунд | UW150203 | – | – |
| Argyrocottus zanderi | О. Шикотан, б. Крабовая | MN877739 | MN871891 | MN877764 |
| Enophrys diceraus | Охотское море, б. Шестакова | KY052781 | KY038367 | MN877765 |
| Alcichthys elongatus | Японское море, з. Восток | MH172282 | MH167478 | MH172300 |
Молекулярно-генетический анализ. Проанализирован полиморфизм нуклеотидных последовательностей генов COI, цитохрома b, 16S рРНК мтДНК длиной 1008, 747, 600 пар нуклеотидов (пн) соответственно. Внешняя группа представлена шестью видами из семейства Cottidae, что обусловлено необходимостью тестирования монофилии рода Myoxocephalus и определения положения M. quadricornis.
Геномная ДНК выделена из мышечной ткани по стандартной методике, включающей лизис ткани 1% SDS в присутствии протеиназы К (0.2 мг/мл) и депротеинизацию фенолом [18]. Для амплификации и секвенирования ДНК использованы универсальные праймеры, описанные ранее [19]. В программе MEGA 6 [20] выровнены нуклеотидные последовательности, определены показатели изменчивости мтДНК и генетические дистанции, реконструировано филогенетическое дерево методом NJ (neighbor joining). В программе Model-test v. 3.7 [21] с использованием критерия Akaike выбраны оптимальные модели нуклеотидных замещений. В программе MrBayes v. 3.1.2 [22] методом байесовского анализа выполнен филогенетический анализ мтДНК; из 10 001 деревьев первые 1001 с нестабильными параметрами моделей нуклеотидных замещений отброшены, на основе остальных получены консенсусные деревья и апостериорные вероятности их ветвления. Узлы ветвления с оценками вероятности ≥95% приняты как достоверные [23].
Кариологический анализ. Материалом для работы послужили хромосомные препараты от восьми самок, четырех самцов и двух ювенильных особей M. brandtii, от четырех самок, трех самцов M. ochotensis, от семи самок, четырех самцов и пяти ювенильных особей M. jaok, приготовленные по методу воздушного высушивания [24]. Хромосомы окрашивали рутинно 4%-ным раствором красителя Гимза (Giemsa) и анализировали их качество под микроскопом, после чего готовили серии препаратов для подробного анализа. Кариотипы описаны на основании исследования у M. brandtii – 380, у M. ochotensis – 100 и у M. jaok – 250 метафазных пластинок.
В хромосомных наборах выделяли несколько морфологических типов хромосом. Равноплечие метацентрические (М) и неравноплечие субметацентрические (СМ) хромосомы относили к двуплечим, субтелоцентрические (СТ) с очень коротким вторым плечом и акроцентрические (А) с невидимым вторым плечом – к одноплечим. Размеры коротких плеч третьей пары хромосом у M. brandtii и M. ochotensis не позволяют однозначно определить их морфологию (СМ или СТ), поэтому число хромосомных плеч обозначено с учетом обоих возможных вариантов: 44 + 2. Для сравнения использованы данные об основных признаках кариотипов япономорского и охотоморского M. stelleri, M. brandtii и M. jaok из Японского моря, M. ochotensis из Охотского моря, M. scorpius из Белого моря [16, 17].
РЕЗУЛЬТАТЫ
Молекулярно-генетический анализ. Полученные последовательности генов мтДНК размещены в GenBank/NCBI (номера в табл. 1). В мтДНК видов рода Myoxocephalus (без учета внешних групп) обнаружено: для гена COI – 125 (12.4%), цитохрома b – 104 (13.9%), 16S рРНК – 10 (1.7%) филогенетически информативных сайтов.
Выявлены нуклеотидные сайты, маркирующие керчаков рода Myoxocephalus. Во-первых, обнаружены замены нуклеотидов, объединяющие виды рода (кроме M. quadricornis) и отличающие их от видов внешней группы: 2, 5 и 12 замен для генов 16S рРНК, цитохрома b и COI. Во-вторых, выявлены сайты, нуклеотидный состав которых маркирует виды Myoxocephalus, определяя их генетическое сходство или различие: 10, 81 и 102 сайта-маркера для генов 16S рРНК, цитохрома b и COI. В последовательностях гена 16S рРНК M. brandtii обнаружена делеция аденина, отличающая его от других видов. Минимальные р-дистанции (табл. 2) получены при сравнении M. stelleri с M. polyacanthocephalus (1.67%), M. ochotensis (1.80%), M. jaok (1.89%). Максимальные оценки установлены между мтДНК M. quadricornis и остальных видов рода – от 6.96 до 7.68%.
Таблица 2.
Средние значения р-дистанций (в %) по данным о нуклеотидных последовательностях генов COI, цитохрома b, 16S рРНК мтДНК. По диагонали даны значения р-дистанций в пределах видов
| Вид | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. M. stelleri | 0.35 | ||||||||||
| 2. M. polyacanthocephalus | 1.67 | 0.11 | |||||||||
| 3. M. jaok | 1.89 | 2.05 | 0.56 | ||||||||
| 4. M. ochotensis | 1.80 | 2.44 | 2.66 | 0.13 | |||||||
| 5. M. brandtii | 2.59 | 2.95 | 2.96 | 2.78 | 0.18 | ||||||
| 6. M. quadricornis | 7.07 | 6.98 | 7.19 | 6.96 | 7.68 | 0.21 | |||||
| 7. Porocottus minutus | 8.19 | 8.25 | 8.55 | 8.33 | 8.49 | 8.31 | – | ||||
| 8. Microcottus sellaris | 9.80 | 10.11 | 10.43 | 9.84 | 10.52 | 7.14 | 11.01 | – | |||
| 9. Megalocottus platycephalus | 8.10 | 7.96 | 8.28 | 8.13 | 8.78 | 2.79 | 10.34 | 8.24 | – | ||
| 10. Argyrocottus zanderi | 9.78 | 9.76 | 9.50 | 9.50 | 9.50 | 9.24 | 10.87 | 11.44 | 10.41 | – | |
| 11. Enophrys diceraus | 10.86 | 10.84 | 10.88 | 10.79 | 11.39 | 8.95 | 11.52 | 11.34 | 10.40 | 12.93 | – |
| 12. Alcichthys elongatus | 15.70 | 15.31 | 15.56 | 15.75 | 15.43 | 14.95 | 15.12 | 16.13 | 14.83 | 15.66 | 16.63 |
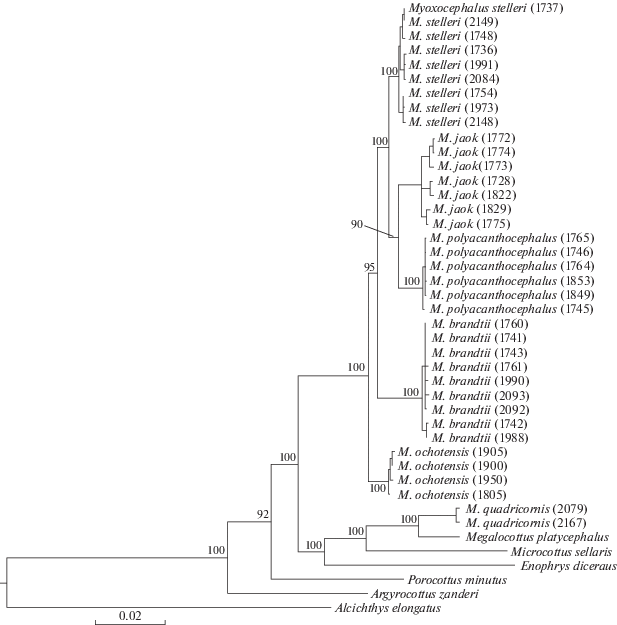
В основании филогенетического дерева (рис. 1) расположены ДНК-линии Alcichthys elongatus, Argyrocottus zanderi, Porocottus minutus. МтДНК других видов внешней группы, Enophrys diceraus, Microcottus sellaris и Megalocottus platycephalus, объединяются с ДНК-линией M. quadricornis. Типы мтДНК остальных видов рода Myoxocephalus образуют единую группу, в которой базальную позицию занимает M. ochotensis, терминальную – M. stelleri. Основные узлы ветвления имеют достоверную статистическую поддержку.
Рис. 1.
Байесовское дерево, полученное на основе анализа нуклеотидных последовательностей генов COI, цитохрома b, 16S рРНК мтДНК. Числа в основаниях кластеров – оценки апостериорной вероятности. В скобках – номера образцов.
Кариологический анализ. На основании проведенного анализа установлено, что кариотипы видов содержат: M. brandtii – 44 хромосомы (2n), среди них 2 М, 2 СМ-СТ, 18 СТ и 22 А хромосомы, число хромосомных плеч (NF) – 46 + 2 (рис. 2,а); M. ochotensis – 2n = 42, состоит из 2 М, 2 СМ-СТ, 18 СТ и 20 А хромосом, NF = 44 + 2 (рис. 2,б); M. jaok – 2n = 24, включает 16 М, 4 СМ и 4 А хромосомы, NF = 44 (рис. 2,в).
Рис. 2.
Кариограммы: Myoxocephalus brandtii из залива Чихачева, Татарский пролив Японского моря – 2n = 44, NF = 46 + + 2 (а); M. ochotensis из бухты Топазная (о. Большой Шантар) Охотского моря – 2n = 42, NF = 44 + 2 (б); M. jaok из бухты Квачина (Западная Камчатка) Охотского моря – 2n = 24, NF = 44 (в). М – мета-, СМ – субмета-, СМ-СТ – субмета‑субтело-, СТ – субтело-, А – акроцентрические хромосомы. Ув.: 10 × 100.
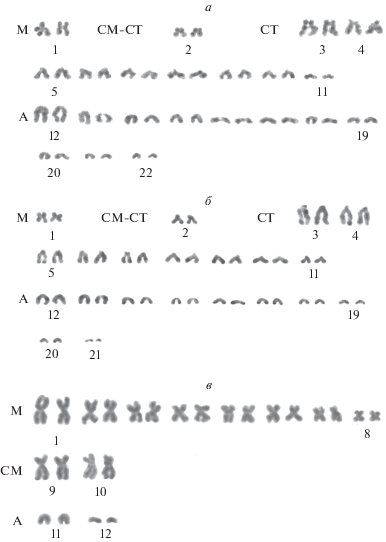
Пары М, СМ-СТ хромосом и две пары крупных СТ хромосом рассматриваются нами как маркерные в кариотипах M. brandtii и M. ochotensis (рис. 2,а, б: пары 1–4). Дополнительным маркерным признаком кариотипа M. brandtii является пара крупных А хромосом (рис. 2,а: пара 12). Изменчивость по числу и морфологии хромосом у изученных видов не обнаружена; различия между кариотипами самцов и самок не выявлены.
Установлены общие признаки кариотипов M. brandtii, M. ochotensis, M. jaok и ранее изученных видов керчаков. M. ochotensis имеет одинаковое число хромосомных плеч с M. polyacanthocephalus и M. stelleri (44 + 2), а M. jaok с M. scorpius (NF = 44). В кариотипах видов можно выделить сходные по размерам и морфологии маркерные хромосомы. Средние М хромосомы M. brandtii (рис. 2,а: пара 1) соответствуют по размерам седьмой паре М хромосом M. jaok (рис. 2,в). Размеры мелких М хромосом M. ochotensis (рис. 2,б: пара 1) соответствуют размерам хромосом восьмой пары у M. jaok (рис. 2,в) и мелких М хромосом M. polyacanthocephalus. Крупные М хромосомы M. jaok (рис. 2,в: пара 3) сходны по размеру с крупными М хромосомами M. polyacanthocephalus, япономорского M. stelleri и M. scorpius. Две пары одинаковых по размеру СМ хромосом M. jaok (рис. 2,в: пары 9, 10) сопоставимы по размеру с крупными маркерными СМ хромосомами япономорского M. stelleri и M. scorpius. В кариотипах большинства видов рода Myoxocephalus присутствует пара СМ-СТ хромосом (кроме M. jaok и M. scorpius), две пары крупных СТ хромосом (кроме M. jaok) и пара крупных СТ или А хромосом (кроме M. jaok, M. ochotensis и M. scorpius) (табл. 3).
Таблица 3.
Основные признаки и маркерные хромосомы кариотипов видов рода Myoxocephalus
| Вид | 2n | Хромосомная формула | NF | Маркерные хромосомы | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Мк | Мс | Мм | СМк | СМс | СМм | СМ-СТ | СТк | Ак | ||||
| M. stelleri (Охотское море) | 44 | 2 СМ-СТ + 28 СТ + 14 А | 44 + 2 | – | – | – | – | – | – | 2 | 6 | – |
| M. brandtii | 44 | 2 М + 2 СМ-СТ + 18 СТ + 22 А | 46 + 2 | – | 2 | – | – | – | – | 2 | 4 | 2 |
| M. ochotensis | 42 | 2 М + 2 СМ-СТ + 18 СТ + 20 А | 44 + 2 | – | – | 2 | – | – | – | 2 | 4 | – |
| M. polyacanthocephalus | 40 | 4 М + 2 СМ-СТ + 20 СТ + 14 А | 44 + 2 | 2 | – | 2 | – | – | – | 2 | 6 | – |
| M. stelleri (Японское море) | 40 | 2 М + 2 СМ + 2 СМ-СТ + 20 СТ + 14 А | 44 + 2 | 2 | – | – | 2 | – | – | 2 | 6 | – |
| M. scorpius | 36 | 2 М + 6 СМ + 28 СТ, А | 44 | 2 | – | – | 2 | 4 | – | – | 4 | – |
| 37 | 2 М + 5 СМ + 30 СТ, А | 44 | 2 | – | – | 1 | 4 | – | – | 4 | – | |
| 38 | 2 М + 4 СМ + 32 СТ, А | 44 | 2 | – | – | – | 4 | – | – | 4 | – | |
| M. jaok | 24 | 16 М + 4 СМ + 4 А | 44 | 4 | 8 | 4 | 4 | – | – | – | – | – |
ОБСУЖДЕНИЕ
Исследования морфологических признаков и строения сейсмосенсорной системы стали основой для реконструкции филогенетических отношений керчаков рода Myoxocephalus. Наиболее генерализированным видом рода признан M. stelleri. К филогенетически древней группе были отнесены: M. stelleri, несколько отклонившийся в сторону от других видов, довольно молодой вид M. brandtii, M. polyacanthocephalus и M. jaok. Арктически-атлантические керчаки и M. ochotensis, M. verrucosus, M. tuberculatus включены в филогенетически молодую группу видов [3].
Молекулярно-генетический анализ показал существенную изменчивость мтДНК в роде Myoxocephalus. Значения р-дистанций варьируют в широких пределах – от 1.67% между M. stelleri и M. polyacanthocephalus до 7.68% между M. brandtii и M. quadricornis. Генетически сходные M. stelleri, M. polyacanthocephalus и M. jaok дифференцированы на 1.67–2.05%. Немного больше от них отличаются M. ochotensis (1.80–2.66%) и M. brandtii (2.59–2.96%). Эти тихоокеанские виды образуют на филогенетическом дереве (рис. 1) единую группу, в границах которой ДНК-линии дифференцируются следующим образом: первой – M. ochotensis, следом M. brandtii, затем M. polyacanthocephalus вместе с M. jaok и последней – M. stelleri. Ассоциация M. polyacanthocephalus и M. jaok не имеет достоверной поддержки и, если исходить из значений р-дистанций (табл. 2), каждый из этих видов генетически ближе к M. stelleri, чем друг к другу. Аналогичные уровни различий и родственные связи были получены ранее в исследовании дальневосточных керчаков по данным о генах COI и цитохрома b [13], за исключением центрального положения M. ochotensis в кладе группы, что, возможно, связано с отсутствием в анализе M. polyacanthocephalus.
Оценки дивергенции между мтДНК M. quadricornis и остальных видов достаточно высокие для сравнений в пределах одного рода; среднее значение составляет 7.18%. Близкие величины имеют р-дистанции между M. quadricornis и видами других родов: M. quadricornis/M. sellaris – 7.14%, M. quadricornis/P. minutus – 8.31%, M. quadricornis/E. diceraus – 8.95% (табл. 2). При этом уровень дифференциации мтДНК M. quadricornis и M. platycephalus очень низкий и соответствует межвидовым различиям в роде Myoxocephalus – 2.79%.
На филогенетическом дереве (рис. 1) линия мтДНК M. quadricornis располагается отдельно от кластера тихоокеанских видов Myoxocephalus, образуя общую группу с видами из других родов семейства Cottidae – M. platycephalus, M. sellaris, E. diceraus. Достоверность положения M. quadricornis, обособленного от представителей рода Myoxocephalus и ассоциированного с видами внешней группы, подтверждается высокими оценками вероятности узлов ветвления.
Молекулярно-генетические данные показывают, что род Myoxocephalus генетически неоднороден, и предполагают, что M. quadricornis и остальные изученные виды рода принадлежат к разным филогенетическим группам. Для проверки этих выводов был проведен сравнительный анализ с использованием данных по последовательностям участка гена COI мтДНК всех видов рода Myoxocephalus, имеющимся в Банке генов (www.ncbi.nlm.nih.gov), а также M. platycephalus.
На NJ-дереве, построенном по данным о гене COI (рис. 3), род Myoxocephalus разделяется на две группы. В первой группе к тихоокеанским видам примыкает ДНК-линия M. scorpius, представленная образцами из разных регионов Арктики – Северного и Чукотского морей. Структура кластера тихоокеанских видов (рис. 3) отличается от показанной на рис. 1, ДНК-линии дифференцируются в следующем порядке: M. brandtii, M. jaok, M. ochotensis, M. polyacanthocephalus, M. stelleri. Однако здесь часть узлов ветвления не имеет надежной поддержки. Во второй группе к кластеру M. quadricornis + M. platycephalus присоединяются североатлантические виды M. octodecemspinosus и M. aenaeus, а также арктический M. scorpioides. К нашим M. quadricornis из Восточно-Сибирского моря добавляются экземпляры из Атлантики, как морские, так и озерные формы.
Рис. 3.
Дерево NJ, полученное на основе анализа нуклеотидных последовательностей фрагмента гена COI, в том числе данных из GenBank/NCBI. Числа в основаниях кластеров – достоверные бутстрэп-поддержки (≥70%; [23]).
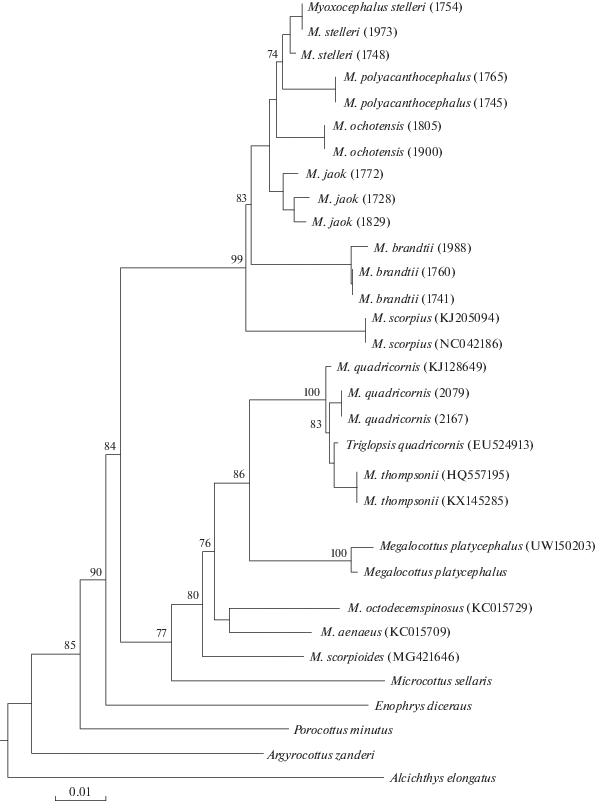
Единое мнение о статусе вида M. quadricornis отсутствует. Его относят к роду Triglopsis [3, 6, 8], рассматривают в составе рода Myoxocephalus [1, 2], объединяют с M. thompsonii в комплекс видов или разделяют на подвиды M. quadricornis quadricornis и M. q. thompsonii [5, 7, 25]. Наши данные не подтверждают разделения M. quadricornis на подвиды: ДНК-линии не объединяются в какие-либо группы и не образуют ассоциаций в соответствии с местами обитания; M. thompsonii из североамериканских озер находится в середине кластера (рис. 3). Он отличается от остальных M. quadricornis на 0.65%, примерно так же, как и M. quadricornis из Восточно-Сибирского моря (0.54%; табл. 4).
Таблица 4.
Средние значения р-дистанций (в %) по данным о нуклеотидных последовательностях участка гена COI мтДНК
| Вид | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. M. stelleri | |||||||||||||||||||
| 2. M. jaok | 1.39 | ||||||||||||||||||
| 3. M. polyacanthocephalus | 1.55 | 2.06 | |||||||||||||||||
| 4. M. ochotensis | 1.43 | 1.83 | 2.41 | ||||||||||||||||
| 5. M. brandtii | 3.04 | 3.32 | 3.55 | 3.90 | |||||||||||||||
| 6. M. quadricornis | 8.14 | 7.91 | 9.11 | 8.08 | 9.12 | ||||||||||||||
| 7. M. thompsonii (HQ557195) | 8.65 | 8.42 | 9.28 | 8.59 | 9.28 | 0.86 | |||||||||||||
| 8. M. quadricornis (KJ128649) | 7.96 | 7.73 | 8.59 | 7.90 | 8.93 | 0.52 | 0.69 | ||||||||||||
| 9. Triglopsis quadricornis (EU524913) | 8.13 | 7.90 | 8.76 | 8.08 | 9.11 | 0.34 | 0.52 | 0.17 | |||||||||||
| 10. M. thompsonii (KX145285) | 8.65 | 8.42 | 9.28 | 8.59 | 9.28 | 0.86 | 0 | 0.69 | 0.52 | ||||||||||
| 11. M. aenaeus | 7.33 | 6.99 | 8.08 | 7.73 | 8.76 | 5.15 | 5.33 | 4.64 | 4.81 | 5.33 | |||||||||
| 12. M. octodecemspinosus | 8.46 | 8.00 | 8.98 | 8.64 | 8.98 | 5.35 | 5.35 | 5.01 | 5.18 | 5.35 | 3.80 | ||||||||
| 13. M. scorpioides | 7.39 | 6.99 | 8.08 | 7.90 | 8.02 | 5.33 | 5.67 | 4.98 | 5.15 | 5.67 | 4.12 | 3.97 | |||||||
| 14. M. scorpius | 3.49 | 3.38 | 4.47 | 4.12 | 4.81 | 7.74 | 8.25 | 7.56 | 7.73 | 8.25 | 7.90 | 8.64 | 8.59 | ||||||
| 15. Microcottus sellaris | 8.95 | 8.84 | 9.47 | 9.47 | 9.87 | 8.09 | 8.61 | 7.92 | 8.09 | 8.61 | 7.57 | 7.27 | 6.54 | 10.15 | |||||
| 16. Porocottus minutus | 8.55 | 8.84 | 8.95 | 9.47 | 9.01 | 10.51 | 10.50 | 10.33 | 10.50 | 10.50 | 9.98 | 9.33 | 9.64 | 9.98 | 10.34 | ||||
| 17. Megalocottus platycephalus | 8.86 | 8.56 | 8.85 | 9.04 | 9.50 | 4.40 | 4.67 | 3.95 | 4.13 | 4.67 | 4.31 | 5.57 | 5.55 | 8.77 | 8.62 | 11.99 | |||
| 18. Enophrys diceraus | 9.18 | 8.89 | 8.78 | 10.15 | 9.64 | 9.99 | 10.50 | 10.33 | 10.15 | 10.50 | 9.64 | 9.86 | 9.12 | 10.67 | 10.86 | 9.83 | 10.67 | ||
| 19. Argyrocottus zanderi | 10.25 | 9.68 | 11.00 | 10.65 | 10.31 | 9.80 | 9.97 | 9.62 | 9.79 | 9.97 | 9.97 | 10.54 | 9.28 | 11.00 | 10.67 | 10.33 | 10.84 | 12.56 | |
| 20. Alcichthys elongatus | 13.69 | 14.03 | 14.09 | 14.78 | 13.52 | 12.73 | 12.71 | 12.89 | 12.71 | 12.71 | 13.06 | 12.78 | 12.71 | 14.95 | 13.94 | 12.39 | 12.89 | 13.43 | 12.54 |
Сравнительный анализ полученных данных и результатов аналогичных молекулярно-генетических исследований показывает определенное сходство в уровнях дифференциации, структуре филогенетических деревьев, взаимосвязях ДНК-линий рода Myoxocephalus [5, 8, 9]. Род Myoxocephalus распадается на две группы: одна включает таксоны из Тихого океана, другая – из Арктики и Северной Атлантики. К группе тихоокеанских видов, в которой, как правило, терминальная позиция у M. stelleri и M. polyacanthocephalus, а базальная – у M. brandtii, присоединяется M. scorpius. Арктически-атлантическая группа представлена M. scorpioides, M. octodecemspinosus, M. aenaeus, M. quadricornis/thompsonii (Triglopsis quadricornis).
Интерес представляет положение последнего вида, которое в целом совпадает у разных авторов. В работе финских исследователей [5] так называемый комплекс M. quadricornis расположен внутри клады рода Myoxocephalus; авторы считают, что признание валидности рода Triglopsis сделало бы остальных Myoxocephalus парафилетической группой. По данным об изменчивости гена цитохрома b и интрона 7S рРНК [8] T. quadricornis и M. platycephalus объединяются и образуют вместе с M. cf. scorpioides и M. sellaris отдельную группу, родственную с видами Myoxocephalus. Используя штрих-коды ДНК, Мекленбург с соавт. [2] определяют M. quadricornis и M. platycephalus как сестринские виды, находящиеся в кладе рода Myoxocephalus; генетические дистанции между M. quadricornis и видами Myoxocephalus (среднее значение 6.4; диапазон 5.1–9.2%) совпадают с различиями в пределах Myoxocephalus (6.5; 2.1–10.5%), тем самым опровергая существование рода Triglopsis. К сожалению, авторы не обсуждают столь необычное положение одного рода в кладе другого, не приводят дистанции между близкими родами семейства Cottidae, не сопоставляют уровни дифференциации видов и родов.
По нашим данным (табл. 4), генетические отличия видов рода Myoxocephalus в пределах тихоокеанской и арктически-атлантической групп составляют в среднем 3.42% (диапазон 1.39–4.81) и 4.86% (3.8–5.67) соответственно, дистанция между этими группами много выше – 8.36% (6.99–9.28). Такой же уровень различий получен при сравнениях видов из близких родов: арктически-атлантическая группа Myoxocephalus/Microcottus – 7.84%, тихоокеанская группа Myoxocephalus/Megalocottus – 8.83%, тихоокеанская группа Myoxocephalus/Porocottus – 8.86%. При этом M. platycephalus, расположенный внутри кластера арктически-атлантической группы Myoxocephalus, отличается от ее видов всего на 4.66%.
Результаты кариологического исследования показали, что хромосомные наборы экземпляров M. ochotensis, M. brandtii и M. jaok (рис. 2) из разных районов их ареалов идентичны ранее описанным для этих видов [17]. В отличие от M. scorpius из Белого моря и M. stelleri из Охотского и Японского морей, у которых обнаружен полиморфизм, обусловленный робертсоновскими транслокациями, изученные виды стабильны по числу хромосом [16, 17]. Установлено, что кариотипы дальневосточных видов M. ochotensis, M. brandtii, M. jaok, M. polyacanthocephalus, охотоморского, япономорского M. stelleri и европейского M. scorpius имеют общие признаки, указывающие на их близкое родство (табл. 3).
Керчаки различаются по числу и морфологии хромосом (табл. 3), причиной этого могло стать разное число робертсоновских транслокаций, произошедших в их кариотипах. У видов Myoxocephalus наблюдается уменьшение NF (табл. 3), что может являться следствием перицентрической инверсии в ходе эволюции хромосомных наборов [17]. Бычки различаются по наличию маркерных для каждого вида и для групп видов хромосом (табл. 3).
Наибольшее 2n имеют охотоморский M. stelleri (2n = 44, NF = 44 + 2) и M. brandtii (2n = 44, NF = = 46 + 2). Однако у охотоморского M. stelleri в отличие от всех других представителей рода отсутствуют двуплечие хромосомы и содержится самое большое количество одноплечих СТ и А хромосом (табл. 3). В соответствии с гипотезой об эволюции кариотипов рыб в направлении уменьшения диплоидного числа хромосом [16, 26] кариотип охотоморского M. stelleri является наименее дивергировавшим и близким к предковому. К наименее кариологически продвинутым видам можно также отнести M. brandtii и M. ochotensis (2n = 42). M. polyacanthocephalus (2n = 40), япономорский M. stelleri (2n = 40) и M. scorpius (2n = 36–38) – более молодые по сравнению с ними. Среди изученных видов кариологическая продвинутость M. jaok максимальная. Его хромосомный набор содержит наименьшее 2n (24) и состоит преимущественно из М и СМ хромосом, СМ-СТ и СТ хромосомы в нем отсутствуют (табл. 3; рис. 2,в). Маркерные СМ-СТ хромосомы отсутствуют и у M. scorpius. Выделить их в кариотипе этого вида не представляется возможным из-за сильной спирализации хромосом в представленной автором кариограмме [16].
Изученные виды бычков различаются по количеству и размерам маркерных М и СМ хромосом. Возможно дивергенция видов рода Myoxocephalus от охотоморского M. stelleri шла в следующих направлениях: у M. brandtii с образованием пары М хромосом среднего размера; у M. ochotensis – пары мелких М хромосом; у M. polyacanthocephalus – двух пар М хромосом (мелких и крупных); у япономорского M. stelleri и M. scorpius – двух пар крупных М и СМ хромосом, а у M. scorpius еще двух пар СМ хромосом сходных размеров; у M. jaok – восьми пар М хромосом (крупных, средних и мелких размеров) и двух пар крупных СМ хромосом.
Результаты кариологического исследования видов рода Myoxocephalus частично согласуются с данными реконструкции филогенетических отношений на основе молекулярно-генетических и морфологических признаков. С помощью молекулярно-генетического и кариологического анализов установлено, что тихоокеанские виды образуют единую филогенетическую группу; выявлены близкородственные отношения керчаков тихоокеанской группы и европейского M. scorpius. Направления дивергенции кариотипов керчаков (охотоморский M. stelleri – M. brandtii – M. polyacanthocephalus – M. jaok) совпадают с направлениями упрощения строения сейсмосенсорной системы в филогенетически более древней группе видов [3]. Вид M. brandtii, отличающийся от всех изученных бычков по числу хромосомных плеч (46 + 2) возможно является представителем отдельной эволюционной линии среди тихоокеанских видов рода Myoxocephalus, что согласуется с полученными данными о его обособленности на основании морфологических и молекулярно-генетических признаков. M. scorpius, по сравнению с большинством тихоокеанских видов, наиболее кариологически продвинут. Обнаруженный у европейского керчака полиморфизм по числу хромосом [16] может указывать на незавершенность процесса эволюции его кариотипа и являться еще одним подтверждением вывода о молодости этого вида, сделанного на основе морфологических данных.
Однако заключения о кариологической примитивности или продвинутости некоторых тихоокеанских видов не согласуются с отдельными выводами на основе молекулярно-генетических и морфологических признаков. В отличие от всех изученных керчаков вид M. jaok имеет максимально продвинутый кариотип. M. ochotensis, отнесенный по морфологическим признакам к филогенетически молодой группе видов, по кариологическим данным близок к наименее продвинутым охотоморскому M. stelleri и M. brandtii. Разная степень дивергенции кариотипов M. stelleri из Японского и Охотского морей не согласуется с данными молекулярно-генетических исследований, согласно которым представители этого вида образуют единую филогенетически наиболее молодую группу рода. Возможно, значительная часть обнаруженных несоответствий в оценках степени дивергенции изученных видов керчаков объяснима неравномерностью эволюции молекулярно-генетических, кариологических и морфологических признаков.
Таким образом, на основании молекулярно-генетических исследований установлено, что род Myoxocephalus в современном составе является гетерогенным. Он разделяется на тихоокеанскую и арктически-атлантическую группы, генетические отличия которых соответствуют отличиям близких родов семейства Cottidae. В тихоокеанской группе обнаружена более тесная филогенетическая связь M. stelleri, M. polyacanthocephalus, M. jaok и отличия от них M. ochotensis и M. brandtii; близким родством с этой группой характеризуется M. scorpius. Виды арктически-атлантической группы объединяются с видами других родов, в качестве сестринских выступают M. quadricornis и M. platycephalus. M. quadricornis и M. thompsonii относятся к одному виду, который является монотипическим и характеризуется невысоким уровнем внутривидового полиморфизма мтДНК, не связанного с географическим распространением.
Значительное сходство общей структуры кариотипов изученных тихоокеанских видов и европейского M. scorpius свидетельствует об их близком родстве. Кариологически примитивными видами рода Myoxocephalus являются охотоморский M. stelleri, M. brandtii, M. ochotensis. По сравнению с ними M. polyacanthocephalus, япономорский M. stelleri, M. scorpius – кариологически продвинутые и более молодые. M. jaok сильно отличается от всех исследованных видов по числу и морфологии хромосом, что указывает на его значительную и, вероятно, быструю дивергенцию. Дивергенция кариотипов изученных бычков от охотоморского M. stelleri могла идти в трех направлениях: 1) M. brandtii; 2) M. ochotensis + M. polyacanthocephalus; 3) япономорский M. stelleri + M. scorpius. На основании полученных данных положение M. jaok в предложенной схеме не ясно. Керчак яок может являться заключительным звеном любого из предложенных направлений либо представлять отдельную эволюционную линию, дивергировавшую от охотоморского M. stelleri независимо от других бычков рода Myoxocephalus.
Для уточнения степени и направлений дивергенции кариотипов керчаков, определения статуса видов арктически-атлантической группы и установления их положения в системе семейства Cottidae необходимы дальнейшие кариологические и молекулярно-генетические исследования большей части арктических, атлантических и беринговоморских видов, а также проведение ревизии всего рода Myoxocephalus на основе морфологических признаков.
Работа выполнена при поддержке Программы “Дальний Восток” (проект № 18-4-002).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Парин Н.В., Евсеенко С.А., Васильева Е.Д. Рыбы морей России: аннотированный каталог. М.: Тов-во науч. изд. КМК, 2014. 733 с.
Mecklenburg C.W., Mecklenburg T.A., Sheiko B.A. et al. Pacific Arctic Marine Fishes. CAFF Monitoring Series Report № 23. Akureyri, Iceland: Conserv. Arctic Flora and Fauna, 2016. 406 p.
Неелов А.В. Сейсмосенсорная система и классификация керчаковых рыб (Cottidae: Myoxocephalinae, Artediellinae). Л.: Наука, 1979. 208 с.
Fricke R., Eschmeyer W.N., van der Laan R. (eds.). Eschmeyer’s catalog of fishes: Genera, species, references. 2019. (http://researcharchive.calacademy.org/research/ ichthyology/catalog/ fishcatmain.asp). Electronic version accessed March 01, 2019.
Kontula T., Väinöla, R. Relationships of Palearctic and Nearctic “glacial relict” Myoxocephalus sculpins from mitochondrial DNA data // Mol. Ecol. 2003. V. 12. P. 3179–3184.
Богуцкая Н.Г., Насека А.М. Каталог бесчелюстных и рыб пресных и солоноватых вод России с номенклатурными и таксономическими комментариями. М.: КМК, 2004. 389 с.
Page L.M., Espinoza-Perez H., Findley L.T. et al. Common and Scientific Names of Fishes from the United States, Canada, and Mexico, 7th ed. Bethesda: Am. Fisheries Society, Special Publ. 34, 2013. 243 p.
Knope M.L. Phylogenetics of the marine sculpins (Teleostei: Cottidae) of the North American Pacific Coast // Mol. Phylogenet. Evol. 2013. V. 66. P. 341–349.
Mecklenburg C.W., Steinke D. Ichthyofaunal baselines in the Pacific Arctic region and RUSALCA study area // Oceanography. 2015. V. 28. № 3. P. 158–189.
Mecklenburg C.W., Møller P.R., Steinke D. Biodiversity of Arctic marine fishes: taxonomy and zoogeography // Marine Biodiversity. 2011. V. 41. P. 109–140.
Шмидт П.Ю. Рыбы Охотского моря. М.; Л.: Изд-во АН СССР, 1950. 370 с.
Cowan G.I. McT. Relationships within the genus Myoxocephalus (Pisces: Cottidae) based on morphological and biochemical data using numerical and conventional methods of analysis // Can. J. Zool. 1972. V. 50. № 5. P. 671–682.
Подлесных А.В., Морева И.Н. Изменчивость и связи дальневосточных видов керчаков Myoxocephalus и Megalocottus (Cottidae) по маркерам мтДНК и кариологическим данным // Генетика. 2014. Т. 50. № 9. С. 1075–1083.
Kartavtsev Y.Ph., Rozhkovan K.V., Masalkova N.A. Phylogeny based on two mtDNA genes (Co-1, Cyt-B) among Sculpins (Scorpaeniformes, Cottidae) and some other scorpionfish in the Russian Far East // Mitochondrial DNA. November 28. 2014.
Balakirev E.S., Kravchenko A.Yu., Saveliev P.A. et al. Complete mitochondrial genome of the great sculpin Myoxocephalus polyacanthocephalus (Cottoidei: Cottidae) // Mitochondrial DNA. Part B. 2019. V. 4. № 2. P. 2361–2362.
Васильев В.П. Эволюционная кариология рыб. М.: Наука, 1985. 299 с.
Рязанова И.Н. Эволюция керчаков (Myoxocephalus и Megalocottus) Японского и Охотского морей на основании кариологических данных: Дис. … канд. биол. наук. Владивосток: ИБМ ДВО РАН, 2008. 127 с.
Maniatis T., Fritsch E.F., Sambrook J. Molecular Cloning, A Laboratory Manual. N.Y.: Cold Spring Harbor Lab., 1982. 480 p.
Морева И.Н., Радченко О.А., Петровская А.В., Борисенко С.А. Молекулярно-генетический и кариологический анализ двурогих бычков группы Enophrys diceraus (Cottidae) // Генетика. 2017. Т. 53. № 9. С. 1086–1097.
Tamura K., Stecher G., Peterson D. et al. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0 // Mol. Biol. Evol. 2013. V. 30. P. 2725–2729.
Posada D., Crandall K.A. Modeltest: testing the model of DNA substitution // Bioinformatics. 1998. V. 14. P. 817–818.
Ronquist F., Huelsenbeck J.P. MRBAYES 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. P. 1572–1574.
Leache A.D., Reeder T.W. Molecular systematic of the Eastern Fence Lizard (Sceloporus undulatus): a comparison of parcimony, likelihood, and Bayesian approaches // Systematic Biol. 2002. V. 51(1). P. 44–68.
Kligerman A.D., Bloom S.E. Rapid chromosome preparations from solid tissues of fishes // J. Fish. Res. Board Can. 1977. V. 34. P. 266−269.
Goto A., Yokoyama R., Sideleva V.G. Evolutionary diversification in freshwater sculpins (Cottoidea): a review of two major adaptive radiations // Environ. Biol. Fish. 2014. V. 98. P. 307–335. https://doi.org/10.1007/s10641-014-0262-7
Гарбар А.В., Манило В.В., Корнюшин А.В. Вероятные направления эволюции кариотипов европейских представителей Lymnaeidae (Mollusca, Gastropoda, Pulmonata) в свете современных представлений о филогении семейства // Вестн. зоологии. 2004. Т. 38. № 2. С. 29–37.
Дополнительные материалы отсутствуют.


