Генетика, 2020, T. 56, № 10, стр. 1218-1223
Анализ ассоциации гаплотипов с болезнью Альцгеймера и умеренными когнитивными нарушениями в русской популяции
К. В. Вагайцева 1, *, А. В. Бочарова 1, Е. А. Колесникова 2, В. В. Маркова 1, О. А. Макеева 1, Л. И. Минайчева 1, И. А. Жукова 3, Н. Г. Жукова 3, В. А. Степанов 1
1 Научно-исследовательский институт медицинской генетики, Томский национальный исследовательский медицинский центр Российской академии наук
634050 Томск, Россия
2 Национальный исследовательский Томский государственный университет
634050 Томск, Россия
3 Сибирский государственный медицинский университет
634050 Томск, Россия
* E-mail: kseniya.simonova@medgenetics.ru
Поступила в редакцию 27.12.2019
После доработки 20.01.2020
Принята к публикации 21.01.2020
Аннотация
Проведен анализ ассоциаций гаплотипов 894 образцов ДНК пожилых людей из русского населения г. Томска по 49 SNP. В качестве анализируемых маркеров были отобраны SNP, показавшие ранее ассоциации с болезнью Альцгеймера или вариабельностью когнитивных способностей в широкогеномных ассоциативных исследованиях. В результате проведенного анализа выявлены блоки сцепления на хромосомах 1, 2, 6, 8, 11, 19, 20. Показаны значимые ассоциации, полученные с учетом 50 000 пермутаций, для гаплотипов, локализованных на 1-й и 19-й хромосомах в генах CR1 и APOE, APOC1 соответственно. Полученные нами результаты подтверждают роль генов APOE и CR1 в патогенезе болезни Альцгеймера в русской популяции.
Болезнь Альцгеймера (БА) – нейродегенеративное заболевание, наиболее распространенная форма деменции. Изменения, лежащие в основе клинических проявлений заболевания, возникают задолго до проявления первых симптомов, развиваются медленно в ходе досимптоматической фазы. Данная фаза сопровождается когнитивными нарушениями, которые чаще всего описываются как умеренные когнитивные нарушения (УКН). В ходе ухудшения когнитивных способностей человека фаза УКН переходит в клиническую деменцию альцгеймеровского типа [1]. Многочисленные широкогеномные ассоциативные исследования (GWAS) болезни Альцгеймера и вариабельности когнитивных способностей выявили несколько тысяч генетических маркеров, при этом вклад их в наследственную компоненту невелик [2, 3]. Подавляющее большинство маркеров, найденных в GWAS, за исключением структурных вариантов аполипопротеина Е (APOE), вносят лишь минорный вклад в подверженность к БА с поздним проявлением. К тому же только некоторые из показанных ассоциаций воспроизводятся в репликативных исследованиях [4, 5].
Одной из продуктивных стратегий выявления генетических маркеров, лежащих в основе многофакторных признаков, является анализ структуры неравновесия по сцеплению в области генов-кандидатов и поиск ассоциированных с заболеванием гаплотипов. Такой подход может существенно повысить статистическую мощность ассоциативного исследования [6]. При этом важно учитывать тот факт, что структура неравновесия по сцеплению является результатом генетико-демографической истории популяции [7, 8].
В данной публикации представлены результаты анализа ассоциаций гаплотипов SNP-маркеров, локализованных в генах, вовлеченных в формирование и развитие болезни Альцгеймера и вариабельность когнитивных способностей.
В работе были использованы две выборки из популяции русских г. Томска. Было обследовано 704 человека, средний возраст которых составил 71.8 ± 5.6 года, собранных в ходе когортного исследования по первичной профилактике БА без диагноза БА [9]. Подробная характеристика выборки представлена ранее [10]. В выборке было проведено нейропсихологическое тестирование с использованием Монреальской шкалы оценки когнитивных функций (MoCA). На основе результатов тестирования выборка была разделена на две подвыборки. В выборку с умеренными когнитивными нарушениями или недиагностированной деменцией вошли 86 пожилых людей, набравших менее 18 баллов теста MoCA. Контрольную выборку составили 618 обследуемых. Группа больных БА (190 обследуемых) была набрана из пациентов с диагнозом БА (код G30 по МКБ-10), обследованных на кафедре неврологии и нейрохирургии Сибирского государственного медицинского университета (г. Томск). Диагноз устанавливали в соответствии с критериями МКБ-10, DSM-IV и NINCDS/ADRDA1.
В качестве анализируемых маркеров были отобраны однонуклеотидные полиморфные варианты, показавшие ассоциацию с болезнью Альцгеймера или вариабельностью когнитивных способностей в широкогеномных ассоциативных исследованиях, проведенных на выборках европейцев или при полноэкзомном ассоциативном анализе, выполненном для русской популяции (табл. 1) (https:// www.ebi.ac.uk/gwas/, В.А Степанов и др., неопубликованное). Распределение частот генотипов изучаемых полиморфных вариантов в выборках соответствовало равновесию Харди–Вайнберга, за исключением rs6051449 (p = 0.0016), rs4629318 (p = 0.0239), rs599255 (p = 0.025) в контрольной выборке и rs12989701 (p = 0.0193), rs6051449 (p = = 0.0109) в выборке БА.
Таблица 1.
Характеристика анализируемых маркеров (по данным National Center for Biotechnology Information)
| Локус | Хромосома | Замена | Ген | Локализация/тип мутации |
|---|---|---|---|---|
| rs6656401 | 1 | A/G/T | CR1 | Интрон |
| rs3818361 | 1 | A/G | CR1 | » |
| rs12989701 | 2 | C/A | LOC105373605 | Регуляторная область |
| rs7561528 | 2 | G/A | LOC105373605 | Межгенная область |
| rs4629318 | 3 | G/A | LOC105376926, CNTN4 | Интрон |
| rs2120609 | 3 | T/C | LRRN1, LOC107986007 | Синонимичная замена |
| rs17518584 | 3 | C/T | CADM2 | Интрон |
| rs17194490 | 3 | G/T | CNTN4 | » |
| rs339285 | 3 | T/C | CNTN4-AS1, CNTN4 | Синонимичная замена |
| rs12494658 | 3 | T/C | CADM2-AS2, CADM2 | Интрон |
| rs3214684 | 4 | T/– | TMEM131L | » |
| rs1466662 | 4 | A/T | DCHS2 | » |
| rs16897515 | 6 | C/A | LOC105375107, POM121L2 | Миссенс-мутация |
| rs17693963 | 6 | A/C/G | – | Регуляторная область |
| rs1635 | 6 | C/A/T | ZKSCAN4, NKAPL | Миссенс-мутация |
| rs1553960 | 7 | A/C/G | RADIL, PAPOLB | » |
| rs12674330 | 7 | G/A | RBAK-RBAKDN, RBAK | Синонимичная замена |
| rs3750009 | 7 | A/C | RADIL, PAPOLB | Миссенс-мутация |
| rs10503253 | 8 | C/A | CSMD1 | Интрон |
| rs2616984 | 8 | A/G | CSMD1 | » |
| rs2279590 | 8 | T/C | CLU | Некодирующая область |
| rs1532278 | 8 | T/C | CLU | » |
| rs12361953 | 11 | C/G/T | LUZP2 | Интрон |
| rs1021261 | 11 | G/T | LUZP2 | » |
| rs530965 | 11 | C/T | TENM4 | » |
| rs12290811 | 11 | T/A | TENM4 | » |
| rsл472926 | 11 | C/T | CDON | » |
| rs3802824 | 11 | C/G/T | KIRREL3 | 5'UTR |
| rs599255 | 13 | C/T | FARP1 | Интрон |
| rs3783006 | 13 | G/C | STK24 | » |
| rs58079876 | 16 | G/A/T | CDH15 | Некодирующая область |
| rs2279349 | 16 | G/A/C | ANKRD11 | Синонимичная замена |
| rs17594526 | 18 | C/T | TCF4 | Интрон |
| rs17512836 | 18 | T/C | TCF4 | » |
| rs6859 | 19 | A/G | NECTIN2 | 3'UTR |
| rs769449 | 19 | G/A | APOE | Некодирующая область |
| rs429358 | 19 | T/C | APOE | Миссенс-мутация |
| rs4420638 | 19 | A/G | APOC1 | Межгенная область |
| rs157580 | 19 | G/A | TOMM40 | Интрон |
| rs2075650 | 19 | A/G | TOMM40 | » |
| rs730819 | 20 | G/A | PTPRA, VPS16 | » |
| rs1178017 | 20 | G/T | PTPRA | » |
| rs1178016 | 20 | C/T | PTPRA | Сплайсинг |
| rs2274669 | 20 | C/G/T | PCED1A | Синонимичная замена |
| rs6051449 | 20 | A/C | VPS16 | Интрон |
| rs1010304 | 20 | A/G | CHD6 | » |
| rs6129846 | 20 | C/A/G/T | CHD6 | » |
| rs138880 | 22 | A/C | BRD1 | » |
| rs61746062 | 22 | C/T | KLHDC7B | Синонимичная замена |
Структуру неравновесия по сцеплению определяли с помощью Haploview 4.2. Частоты гаплотипов определяли с помощью EM алгоритма. LD между парами SNP оценивалось с помощью коэффициента D' и коэффициента корреляции r2 Пирсона. Блочная структура определялась посредством алгоритма “Solidspine LD”. Для анализа ассоциаций гаплотипов с уровнем когнитивных способностей использовали пермутационный тест, количество пермутаций составило 50 000.
В результате проведенного анализа блоки сцепления были выявлены на хромосомах: 1, 2, 6, 8, 11, 19, 20 (рис. 1). Блоки сцепления, локализованные на 6-й хромосоме, выявленные на выборке пожилых людей без диагноза болезнь Альцгеймера и с поставленным диагнозом, различаются по своей структуре. В выборке больных сцепление показано для двух маркеров из трех (rs17693963, rs1635) (рис. 1, табл. 2).
Рис. 1.
Блоки сцепления на хромосомах 1, 2, 6, 8, 11, 19, 20: Хр. 1 – блок сцепления на 1-й хромосоме, Хр. 2 – блок сцепления на 2-й хромосоме, Хр. 6а – блок сцепления на 6-й хромосоме в выборке здоровых пожилых, Хр. 6б – блок сцепления на 6-й хромосоме в выборке больных БА, Хр. 8 – блок сцепления на 8-й хромосоме, Хр. 11 – блок сцепления на 11-й хромосоме, Хр. 19 – блок сцепления на 19-й хромосоме, Хр. 20 – блок сцепления на 20-й хромосоме. Цветовая гамма отображает силу сцепления между SNP: ярко-красный – сильное сцепление (D' = 1, LOD > 2), красный и розовый –значительное сцепление (D' < 1, LOD > 2), белый – слабое сцепление (D' < 1, LOD < 2). Ячейка сиреневого цвета обозначает невозможность расчета неравновесия по сцеплению вследствие низкой частоты минорного аллеля полиморфизма (D' = 1, LOD < 2).
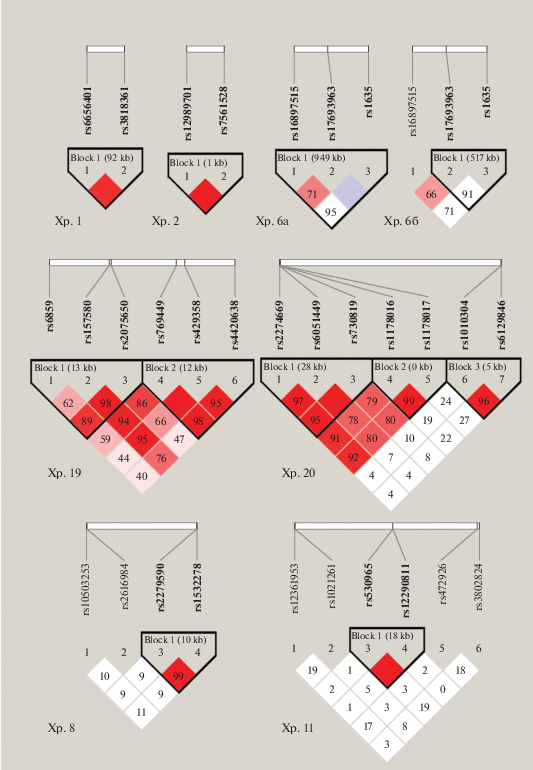
Таблица 2.
Результаты анализа ассоциации выявленных гаплотипов с болезнью Альцгеймера и умеренными когнитивными нарушениями
| Хромосома (маркеры, составляющие блок) | Низкие баллы MoCA | Болезнь Альцгеймера | ||||
|---|---|---|---|---|---|---|
| гаплотип | χ2 | р | гаплотип | χ2 | р | |
| Хр. 1 (rs6656401, rs3818361) |
GG | 0.881 | 0.78 | GG | 6.831 | 0.028 |
| AA | 1.316 | 0.589 | AA | 6.871 | 0.027 | |
| GA | 0.515 | 0.864 | GA | 1.322 | 0.6 | |
| AG | 0.055 | 0.998 | AG | 1.023 | 0.687 | |
| Хр. 2 (rs12989701, rs7561528) |
CG | 0.252 | 0.887 | CG | 0.198 | 0.904 |
| CA | 0.147 | 0.917 | CA | 4.256 | 0.079 | |
| AA | 1.134 | 0.517 | AA | 2.922 | 0.187 | |
| Хр. 6 (rs16897515*, rs17693963, rs1635) |
CAG | 0.128 | 0.994 | |||
| AAG | 0.124 | 0.995 | AG | 0.367 | 0.807 | |
| CAT | 0.017 | 1 | AT | 0.398 | 0.794 | |
| ACG | 3.044 | 0.279 | CG | 0.037 | 0.977 | |
| CCG | 2.244 | 0.465 | ||||
| Хр. 8 (rs2279590, rs1532278) |
CC | 0.239 | 0.828 | CC | 3.219 | 0.143 |
| TT | 0.8 | 0.685 | TT | 3.52 | 0.115 | |
| TC | 2.693 | 0.242 | TC | 0.074 | 0.964 | |
| Хр. 11 (rs530965, rs12290811) |
CT | 0.231 | 0.885 | CT | 0.217 | 0.899 |
| TT | 0.088 | 0.957 | TT | 0.576 | 0.727 | |
| TA | 1.353 | 0.5 | TA | 0.156 | 0.919 | |
| Хр. 19 (rs6859, rs157580, rs2075650) |
GGA | 3.423 | 0.377 | GGA | 0.052 | 1 |
| GAA | 0.015 | 1 | GAA | 3.153 | 0.424 | |
| AAA | 1.056 | 0.933 | AAA | 0.285 | 0.999 | |
| AAG | 0.858 | 0.963 | AAG | 2.786 | 0.52 | |
| AGA | 0.015 | 1 | AGA | 1.21 | 0.913 | |
| GAG | 0.13 | 1 | GAG | 1.584 | 0.833 | |
| Хр. 19 (rs769449, rs429358, rs4420638) |
GTA | 2.911 | 0.47 | GTA | 14.562 | 0.001 |
| ACG | 6.008 | 0.101 | ACG | 4.391 | 0.22 | |
| GTG | 0.897 | 0.956 | GTG | 0.431 | 0.997 | |
| GCG | 0.087 | 1 | GCG | 0.388 | 0.998 | |
| Хр. 20 (rs2274669, rs6051449, rs730819) |
CAG | 1.985 | 0.55 | CAG | 1.693 | 0.712 |
| TCA | 1.122 | 0.839 | TCA | 2.008 | 0.643 | |
| CCA | 0.139 | 1 | CCA | 0.065 | 1 | |
| Хр. 20 (rs1178016, rs1178017) |
CG | 0.808 | 0.897 | CG | 1.462 | 0.8 |
| TT | 1.103 | 0.852 | TT | 1.439 | 0.805 | |
| Хр. 20 (rs1010304, rs6129846) |
AC | 0.466 | 0.981 | AC | 0.017 | 1 |
| GT | 1.303 | 0.696 | GT | 0.025 | 1 | |
Результаты анализа ассоциации выявленных гаплотипов с УКН и БА представлены в табл. 2. Значимые ассоциации, полученные с учетом 50 000 пермутаций, показаны для блоков сцепления, локализованных на 1-й и 19-й хромосомах. Блок сцепления, расположенный на 1-й хромосоме, локализован в гене CR1. Белок CR1 является трансмембранным гликопротеином I типа, играет свою роль при клиренсе бета-амилоида, нейровоспалении и тауопатии. Впервые ассоциация данного гена с болезнью Альцгеймера была показана в 2009 г., на настоящий момент 17 широкогеномных ассоциативных исследований выявили ассоциацию с БА для шести SNP, локализованных в гене CR1 [3, 11].
Блоки сцепления, локализованные на хромосоме 19, для русской популяции описаны ранее и включают в себя SNP нескольких генов: NECTIN2, TOMM40, APOE, APOC1. Значимая ассоциация с болезнью Альцгеймера показана для гаплотипа второго блока, включающего в себя полиморфные варианты генов APOE и APOC1. При этом маркеры гена APOE также показали ассоциацию с БА индивидуально (rs769449, р = 0.0000; rs429358, р = 0.0005). APOE на настоящий момент остается ведущим фактором риска для наиболее распространенной формы болезни Альцгеймера с поздним проявлением. Предполагаются два механизма влияния APOE на развитие БА. С одной стороны, он способствует накоплению бета-амилоида, с другой, – повреждает цитоскелет и митохондрии нейронов при стрессе [12].
Ассоциации анализируемых гаплотипов с УКН при выбранных условиях анализа (50 000 пермутаций) выявлены не были. Вероятно, свою роль в этом также сыграл объем выборки пожилых людей, набравших менее 18 баллов теста MoCA.
Таким образом, полученные нами результаты подтверждают роль генов APOE и CR1 в патогенезе болезни Альцгеймера в русской популяции.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Cummings J.L. Alzheimer’s disease // N. Engl. J. Med. V. 351. № 1. P. 56–67. https://doi.org/10.1056/NEJMra040223
Zhu Z., Lin Y., Li X. et al. Shared genetic architecture between metabolic traits and Alzheimer’s disease: a large-scale genome-wide cross-trait analysis // Hum. Genet. 2019. V. 138. № 3. P. 271–285. https://doi.org/10.1007/s00439-019-01988-9
Jansen I.E., Savage J.E., Watanabe K. et al. Genome-wide meta-analysis identifies new loci and functional pathways influencing Alzheimer’s disease risk // Nat. Genet. 2019. V. 51. № 3. P. 404–413. https://doi.org/10.1038/s41588-018-0311-9
Zhu X.C., Yu J.T., Jiang T. et al. CR1 in Alzheimer’s disease // Mol. Neurobiol. 2015. V. 51. № 2. P. 753–765. https://doi.org/10.1007/s12035-014-8723-8
Zhang S., Li X., Ma G. et al. Polymorphism contributes to Alzheimer’s disease susceptibility in Caucasian but not East Asian populations // Mol. Neurobiol. 2016. V. 53. № 3. P. 1446–1451. https://doi.org/10.1007/s12035-015-9098-1
Трифонова Е.А., Спиридонова М.Г., Габидулина Т.В. и др. Анализ структуры неравновесия по сцеплению и ассоциации полиморфных вариантов гена MTHFR с коронарным атеросклерозом // Генетика. 2012. Т. 48. № 10. С. 1207–1220.
Slatkin M. Linkage disequilibrium–understanding the evolutionary past and mapping the medical future // Nat. Rev. Genet. 2008. V. 9. № 6. P. 477–485. https://doi.org/10.1038/nrg2361
Lawson D.J., Hellenthal G., Myers S., Falush D. Inference of population structure using dense haplotype data // PLoS Genet. 2012. V. 8. № 1. E.1002453. https://doi.org/10.1371/journal.pgen.1002453
Makeeva O., Markova V., Zhukova I. et al. A comparison of neuropsychological performance between US and Russia: Preparing for a global clinical trial // Alzheimers Dement. 2014. V. 10. № 6. P. 760–768. https://doi.org/10.1016/j.jalz.2014.02.008
Степанов В.А., Бочарова А.В., Вагайцева К.В. и др. Редкий вариант в гене сортилинподобного рецептора 1: связь с показателями когнитивных функций у пожилых // Журн. неврол. и психиатрии им. С.С. Корсакова. 2018. Т. 118. № 5. С. 92–95.
Lambert J.C., Heath S., Even G. et al. Genome-wide association study identifies variants at CLU and CR1 associated with Alzheimer’s disease // Nat. Genet. 2009. V. 41. № 10. P. 1094–1099. https://doi.org/10.1038/ng.439
Fulmer T. APOE in AD // Science-Business eXchange. 2012. V. 5. № 9. P. 221. https://doi.org/10.1038/scibx.2012.221
Дополнительные материалы отсутствуют.


