Генетика, 2020, T. 56, № 11, стр. 1262-1278
Роль ортологов гена TFL1 в определении архитектоники растений
Е. А. Крылова *
Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений
им. Н.И. Вавилова
190000 Санкт-Петербург, Россия
* E-mail: e.krylova@vir.nw.ru
Поступила в редакцию 07.05.2020
После доработки 03.06.2020
Принята к публикации 17.06.2020
Аннотация
Одним из важнейших признаков в доместикации и селекции растений является тип роста стебля, который может быть детерминантным (законченным) или индетерминантным (незаконченным). У отдельных таксонов выделяют полудетерминантный тип. У разных культур могут отдаваться предпочтения сортам с различным типом роста стебля, поэтому среди покрытосеменных растений по данному признаку наблюдаются ярко выраженные гомологические ряды в наследственной изменчивости. В обзоре рассмотрены молекулярно-генетические механизмы контроля типа роста стебля у двудольных и однодольных растений, лежащие в основе фенотипической изменчивости. Представлены сведения об известных генах-гомологах TFL1 арабидопсиса. Проведенное сравнение современных данных о генетическом контроле типа роста стебля у представителей разных таксонов покрытосеменных растений позволяет подчеркнуть высокую эволюционную консервативность механизмов молекулярно-генетического контроля инициации цветения, а также консервативность функции генов, участвующих в этом процессе.
Культивируемые виды растений отличаются от диких родичей по комплексу признаков, совокупность которых названа “синдромом доместикации” [1]. В процессе селекции значительные изменения происходили в архитектонике растений, напрямую связанной с типом роста стебля. Выделяют два основных типа – индетерминантный и детерминантный. У растений с индетерминантным (незаконченным) типом роста стебля апикальная меристема побега сохраняет свою пролиферативную активность на протяжении всей жизни растения, флоральные меристемы закладываются при этом на периферии апикальной. Для таких растений характерно соцветие открытого типа. Растения с детерминантным (законченным) типом роста стебля характеризуются переходом к репродуктивной стадии с формированием хорошо развитого терминального соцветия (закрытого типа), происходит ограничение роста стебля. Такой тип роста стебля рассматривается как один из важнейших признаков “синдрома доместикации” двудольных растений. Тип роста стебля является селекционно значимым признаком, непосредственно взаимосвязанным с ростом растения в длину, урожайностью, продолжительностью цветения. При выращивании многих сельскохозяйственных культур (например, томатов, фасоли, сои и других) предпочтение отдается сортам с детерминантным типом роста. Такие растения имеют компактную форму куста, удобную для механизированного возделывания и последующей уборки. Изменчивость, наблюдаемая для данного признака, на фенотипическом уровне формирует гомологические ряды в различных таксонах в полном соответствии с Законом гомологических рядов в наследственной изменчивости, сформулированным Николаем Ивановичем Вавиловым в 1920 г. [2]. Н.И. Вавилов отмечал, что “закон гомологических рядов показывает исследователю-селекционеру, что следует искать. Он намечает правильности в нахождении звеньев, расширяет кругозор, вскрывает огромную амплитуду видовой изменчивости” [3, с. 53]. Сегодня понимание молекулярных механизмов формирования признаков у одного вида растений позволяет на основе гомологии быстро выделять соответствующие гены у других видов, для того чтобы маркировать их с целью создания ускоренных методов отбора селекционного материала с заданными свойствами.
В отношении рассматриваемого признака Николай Иванович отмечал, что “среди самых разнообразных и генетически не связанных семейств, как Gramineae, Papilionaceae, Urticaceae, Solanaceae, Rosaceae (у гороха, фасоли, пшеницы, ячменя, малины, хмеля, энотеры, примулы и т.д.) наблюдается образование карликовых форм и в противоположность им гигантов” [2, c. 51]. У многих таксонов такие контрастные формы связаны именно с изменчивостью по типу роста стебля. Можно предполагать, что сходные молекулярные и клеточные механизмы, лежащие в основе развития всех видов высших растений, позволят наблюдать, по крайней мере, у отдельных таксономических групп сходные механизмы контроля типа роста стебля. С целью понять, насколько широко гомологичные ряды изменчивости простираются на молекулярном уровне, проведено обобщение и сравнение современных данных о генетическом контроле типа роста стебля у представителей разных таксонов.
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ ТИПА РОСТА СТЕБЛЯ У МОДЕЛЬНОГО РАСТЕНИЯ Arabidopsis thaliana (L.) Heynh.
Архитектоника растения взаимосвязана с функционированием апикальной меристемы побега, состоящей из недифференцированных клеток. Переход растения к репродуктивной фазе развития контролируется рядом экзогенных и эндогенных факторов. Молекулярно-генетический контроль индукции цветения наиболее подробно изучен на модельном растении Arabidopsis thaliana (L.) Heynh. Развитие цветка включает несколько стадий: переход вегетативной апикальной меристемы в генеративную, формирование флоральных меристем, а затем образование отдельных органов цветка. Инициация формирования флоральной меристемы находится под контролем трех основных генов LFY (LEAFY), AP1 (APETALA1) и TFL1 (TERMINAL FLOWER1) [4, 5].
Ключевую роль при формировании флоральной меристемы играет ген LFY. При достижении критического уровня экспрессии LFY в апексе происходит изменение активности клеток апикальной меристемы и закладка флоральных меристем [5–8]. При этом экспрессия гена отмечается только на периферии апикальной меристемы. Незначительная экспрессия LFY отмечается в зачатках листовых примордиев в ходе вегетативной фазы развития растения, при переходе к репродуктивной фазе наблюдается усиление экспрессии. У мутантов арабидопсиса lfy вместо цветков закладываются боковые побеги, только в верхней части растения закладываются цветки с аномальной морфологией. Органы этих цветков расположены спирально, при этом число органов может быть уменьшено [5–8]. Результаты экспериментов с трансгенными растениями арабидопсиса, в которых экспрессия гена LFY находится под контролем промотора гена 35S вируса мозаики цветной капусты, также подтверждают роль гена LFY в образовании флоральных примордиев. Трансгенные растения переходили к цветению раньше по сравнению с растениями дикого типа. Вместо боковых побегов формировались одиночные цветки. Главный побег заканчивался терминальным цветком, у некоторых растений цветок формировался практически над розеточными листьями. Таким образом, у растений со сверхэкспрессией гена LFY происходит преобразование побегов в цветки, в то время как у мутантов lfy наоборот – цветков в побеги или побегоподобные структуры [5–7].
LFY рассматривается как интегратор информации различных сигналов инициации цветения. Время перехода растения к цветению зависит от уровня экспрессии гена. Отмечено, что при увеличении числа копий гена в растениях дикого типа происходит ускорение цветения. Паттерн экспрессии LFY влияет на структуру соцветий, у растений арабидопсиса дикого типа образуется соцветие открытого типа, в то время как у мутантов со сверхэкспрессией LFY формируется терминальный цветок [5–7]. Изменение структуры соцветий непосредственно связано и с изменением типа роста стебля растений.
Необходимо отметить, что ген LFY, играющий ключевую роль в процессе инициации образования флоральной меристемы, также инициирует и образование органов цветка [9, 10]. Ген LFY активирует транскрипцию гена AGAMOUS (AG) во внутренних мутовках цветка. Однако для активации экспрессии AG кроме LFY необходимо участие второго транскрипционного фактора – WUS, при связывании LFY и WUS с регуляторными цис-элементами во 2-м интроне гена AG происходит запуск его транскрипции [9].
Ген WUS, кодирующий гомеодомен-содержащий транскрипционный фактор, необходим для поддержания пролиферативной активности клеток апикальной меристемы побега. В апикальной меристеме побега экспрессия WUS отмечена в центральной зоне в группе клеток, которые образуют “организующий центр” меристемы. Экспрессия гена также отмечена в меристеме соцветия и во флоральной меристеме. У мутантов wus апикальная меристема побега сильно уменьшена, после образования нескольких листьев закладка новых листовых примордиев не происходит, меристема перестает функционировать. У цветков мутантов отмечено уменьшенное число тычинок и плодолистиков, чаще всего формируется одна тычинка. Антагонистом гена WUS в поддержании пролиферативной активности клеток апикальной меристемы являются гены CLAVATA, которые регулируют и ограничивают область экспрессии WUS [11, 12].
В процессе развития цветка ген WUS активирует экспрессию гена AG. Этот ген экспрессируется в центральной части флоральной меристемы, из которой будут развиваться генеративные органы цветка. Продукт гена AG является транскрипционным фактором с MADS-доменом. AG блокирует экспрессию WUS во флоральной меристеме, после чего она становится детерминированной и не способной к дальнейшей пролиферативной активности. Цветки мутантов по гену AG содержат многократно повторяющиеся последовательности лепестков и чашелистиков, генеративные органы не формируются, флоральная меристема при этом недетерминированна [9, 10]. Таким образом, процессы инициации формирования флоральной меристемы и определение идентичности органов цветка тесно взаимосвязаны.
Геном-антагонистом LFY является ген TFL1, подавляющий переход меристемы соцветия во флоральную меристему [5, 13, 14]. Транскрипция гена отмечена в нижней части центральной зоны апикальной меристемы главного и боковых побегов, но не во флоральных меристемах. Уровень экспрессии гена поддерживается на низком уровне в течение вегетативной стадии. Растения с мутациями по гену TFL1 переходят раньше к цветению, тем самым подтверждая роль TFL1 как репрессора цветения растения. У мутантов вскоре после индукции цветения происходит превращение меристемы соцветия во флоральную, образуется небольшое соцветие с несколькими цветками, само соцветие заканчивается терминальным цветком (рис. 1) [5, 13–15]. Такой фенотип мутантов объясняется отсутствием нормально функционирующего белка TFL1, в связи с чем экспрессия генов LFY и AP1 отмечается не только на периферии, но и в центральной зоне апикальной меристемы побега (рис. 2). Раннее формирование генеративной меристемы приводит к сокращению продолжительности вегетационного периода. При сверхэкспрессии TFL1 у растений наблюдались продолжительная вегетативная стадия развития, более поздний переход к цветению с образованием сильно разветвленных соцветий [16].
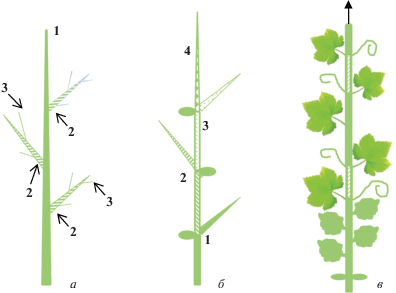
Рис. 1.
Схематичное изображение разных типов роста у растений дикого типа, а также у мутантов по гомологам гена TFL1. a – арабидопсис, б – львиный зев, в – томат, г – табак (модифицировано по [5]).
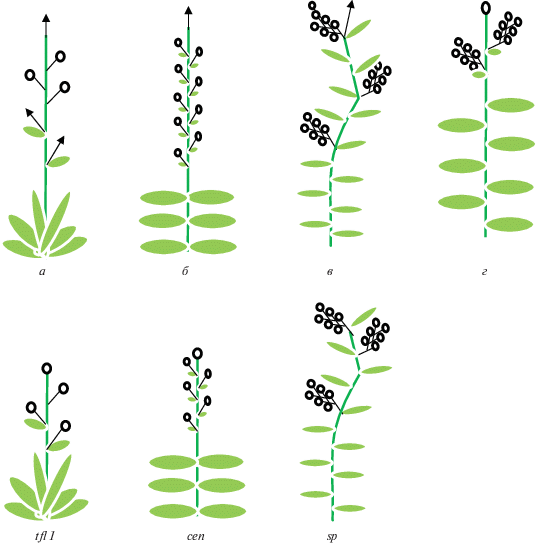
Рис. 2.
Паттерн экспрессии генов идентичности флоральных меристем LFY, AP1, TFL1 у растений арабидопсиса дикого типа, у tfl1 мутантов и у трансгенных растений со сверхэкспрессией TFL1. МС – меристема соцветия, ФМ – флоральная меристема. Красный цвет – экспрессия генов LFY, AP1; синий цвет – экспрессия TFL1 (модифицировано по [13]).
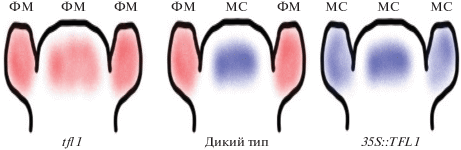
Для изучения экспрессии гена TFL1 у арабидопсиса был проведен комплексный анализ [17]. На основе результатов серии экспериментов было установлено, что для определения специфичности транскрипции гена необходимо функционирование пяти главных регуляторных цис-элементов. Элементы, расположенные в 5'-области, необходимы для обеспечения правильного уровня экспрессии, в то время как элементы 3'-области обеспечивают пространственно-временной паттерн экспрессии гена. Участок, расположенный на расстоянии 1000/1300 пар нуклеотидов (пн) после старт-кодона гена TFL1, необходим для экспрессии гена в вегетативных меристемах, а также для регуляции транскрипции в меристеме соцветия и для блокировки экспрессии в листьях и цветках. Следующий элемент (участок на расстоянии 1600/2000 пн после старт-кодона) обеспечивает транскрипцию гена в пазушных меристемах. И наконец, цис-элемент (участок на расстоянии 2800/3300 пн после старт-кодона) необходим для поддержания экспрессии в меристеме соцветия. Таким образом, наиболее важные регуляторные цис-элементы расположены в 3'-области, при этом регуляция экспрессии гена TFL1 в апикальной и пазушных меристемах вероятно связана с разными цис-элементами [17].
TFL1 является негативным регулятором экспрессии LFY [5, 13–15]. TFL1 относится к небольшому семейству генов CENTRORADIALIS/TERMINAL FLOWER 1/SELF–PRUNING (CETS). В состав данного семейства у арабидопсиса кроме гена TFL1 входят еще пять генов, а именно MOTHER OF FT AND TFL1 (MFT), FLOWERING LOCUS T (FT), TWIN SISTER OF FT (TSF), BROTHER OF FT AND TFL1 (BFT), ARABIDOPSIS THALIANA CENTRORADIALIS HOMOLOG (ATC). Все перечисленные гены участвуют в контроле цветения растения. По результатам филогенетического анализа эти гены можно разделить на три группы: группа MFT, группа FT-подобных генов (FT и TSF) – активаторы цветения, группа TFL1-подобных генов (TFL1, ATC, BFT) – ингибиторы цветения [4]. Экспрессия гена TFL1 отмечается строго в центре апикальной меристемы. Экспрессия ATC детектировалась только в тканях, окружающих сосудистый пучок в гипокотилях двухнедельных проростков арабидопсиса [4]. Экспрессия BFT была отмечена в апикальной меристеме побега, молодых листьях, а также в меристемах пазушных соцветий. При этом экспрессия этого гена имеет суточный паттерн. Кроме этого уровень экспрессии BFT был больше в условиях длинного дня, в то время как экспрессия ATC, напротив, увеличивалась в условиях короткого дня [18, 19].
Продукт гена TFL1 относится к группе белков, связывающих фосфатидилэтаноламин (PEPB) и принимающих участие в сигнальных путях регуляции роста и дифференциации. Данное семейство белков является эволюционно консервативной группой, которая выявлена у всех таксонов, начиная с бактерий до животных и растений. Число генов в составе семейства PEBP у разных покрытосеменных растений различается. У риса обнаружено 19 генов, у кукурузы – 24, в то время как у арабидопсиса – 6 [20–22]. Лучше всего охарактеризованы белковые продукты генов TFL1 и FT [23, 24]. Продукты двух генов способны взаимодействовать с белковым продуктом гена FLOWERING LOCUS D (FD). В индуктивных условиях поступающий из листьев по флоэме в апикальную меристему побега белок FT взаимодействует с FD, образовавшийся комплекс активирует экспрессию генов идентичности флоральных меристем. В неиндуктивных условиях короткого дня TFL1 образует гетеродимер с белком FD, что приводит к блокировке транскрипционной активности FD. Таким образом, FT способствует переходу растения от вегетативного развития к репродуктивной стадии, инициируя цветение. TFL1 действует как репрессор инициации цветения [25].
Белковые продукты генов TFL1 и FT имеют около 60% идентичности. Однако замена всего одной аминокислоты (His88Tyr в TFL1 и Tyr85His в FT) приводит к изменению функции этих белков на противоположную. Так, белок FT становится репрессором цветения, а TFL1 приобретает функции активатора цветения, которые в норме присущи белку FT [23, 24]. Баланс между двумя белками контролирует архитектонику растения и регулирует закономерности формирования вегетативных и репродуктивных органов. Это также важно при адаптации растений к различным условиям окружающей среды [14, 23–25].
Далее мы остановимся на гене TFL1 как основном репрессоре цветения, что в свою очередь непосредственно связано с типом роста стебля растения в целом. В настоящее время в разных систематических группах покрытосеменных растений выявлены гомологи гена TFL1 арабидопсиса. Идентификация гомологичных генов или ортологов является важнейшим этапом при изучении геномов различных растений. Следуя закону гомологических рядов Н.И. Вавилова, при установлении гена, определяющего изменчивость по признаку у одного растения, мы можем ожидать идентификацию гомологичного гена, контролирующего тот же признак, и у родственных видов.
ГОМОЛОГИ TFL1 У ТРАВЯНИСТЫХ РАСТЕНИЙ С СОЦВЕТИЯМИ ОТКРЫТОГО ТИПА
Одним из классических объектов для изучения генетической регуляции цветения, а также развития цветка является львиный зев (Antirrhinum majus L.). В целом архитектоника львиного зева сходна с арабидопсисом, для этих растений характерно образование соцветия открытого типа простая кисть. Среди гомологов TFL1 одним из первых был охарактеризован ген CENTRORADIALIS (CEN) львиного зева [26]. У мутантов cen закладывается терминальный цветок, ниже которого образуется около 10 цветков (рис. 1). В ходе серии экспериментов были изучены морфологические особенности формирования соцветий мутантов cen. Для поддержания вегетативного роста растения выращивали в условиях короткого дня (КД), а затем для индукции образования соцветий их переводили в условия длинного дня (ДД). Только через 7 дней перевода мутантов в ДД наблюдались заметные изменения в морфологии апикальной меристемы [26].
Экспрессия CEN детектирована в центральной субапикальной зоне меристемы побега, при этом CEN начинает экспрессироваться только через несколько дней после инициации цветения. Отсутствием экспрессии гена до перехода к цветению объясняют то, что в отличие от мутантов tfl1 мутация по гену CEN не влияет на время перехода растения к цветению. Трансформация растений табака геном CEN под контролем промотора гена 35S приводила к продолжительному вегетативному росту и значительной задержке перехода к цветению, в то время как у 35S::TFL1 растений такого эффекта не наблюдалось [27].
В настоящее время CEN рассматривается как наиболее вероятный ортолог гена арабидопсиса ATC [4, 18]. Экспрессия ATC была выявлена только в гипокотилях молодых растений и не фиксировалась в меристеме соцветия. При потере функции TFL1 его функционально заменяет ген ATC [4, 18]. Такое предположение было сделано на основании экспериментов с трансгенными растениями, в которых ген ATC конститутивно экспрессировался под контролем промотора гена 35S вируса мозаики цветной капусты в мутантах с потерей функции TFL1. Было получено 50 трансгенных линий с конструкцией 35S::ATC/tfl1-17, у большинства растений отмечалось наличие одного или двух признаков, свойственных мутантам tfl1 (переход к раннему цветению и/или образование терминального цветка). В последующих экспериментах было показано, что фенотип мутантов atc и tfl1 различается. У мутантов atc не наблюдалось образования терминального цветка, время перехода к цветению у таких растений не менялось по сравнению с растениями дикого типа. Фенотип двойных мутантов atc tfl1 был схожим с фенотипом tfl1 мутантов. У таких растений формировался терминальный цветок, наблюдался более ранний переход к цветению по сравнению с растениями дикого типа. На основании различий паттерна экспрессии генов ATC и TFL1, а также фенотипа мутантов atc можно предположить, что ген ATC не участвует в регуляции идентичности меристемы соцветия [4].
У одного из представителей семейства крестоцветных рапса (Brassica napus L.) был описан ортолог TFL1 арабидопсиса. Рапс является одной из важнейших масличных культур, для которой характерно формирование соцветий открытого типа. Геномная формула рапса ААСС, B. napus является результатом гибридизации между видами B. rapa L. (АА-геном) и B. oleracea L. (СС-геном). В одном из первых исследований было идентифицировано три гомолога TFL1 – BNTFL1-1, BNTFL1‑2 и BNTFL1-3. Экспрессия генов была отмечена в цветках. Белковые продукты трех генов имеют высокую гомологию между собой, а также с TFL1 арабидопсиса (более 80%). Анализ нуклеотидных последовательностей показал, что гены BNTFL1-1 и BNTFL1-3, вероятно, являются дупликацией одной предковой формы, в то время как BNTFL1-2 имеет независимое происхождение. Авторы исследования [28] предположили, что гены BNTFL1-1 и BNTFL1-3 связаны с СС-геномом рапса, а BNTFL1-2 – с АА-геномом рапса. Ортологи TFL1 также были идентифицированы у видов B. rapa и B. oleracea. На основе результатов анализа нуклеотидных последовательностей выделенных ортологов был показан высокий уровень гомологии BNTFL1-1 и BNTFL1-3 с ортологом у B. oleracea, а для гена BNTFL1-2 отмечен высокий уровень гомологии с ортологом на хромосоме А10 B. rapa [28, 29]. В дальнейшем с использованием различных подходов был идентифицирован ген BnTFL1 (=Bnsdt1), локализованный на хромосоме А10 B. napus [30]. Авторами исследования было высказано предположение о том, что именно этот ген является гомологом гена TFL1 арабидопсиса. Максимальный уровень экспрессии BnTFL1 был зафиксирован в апексе побега, при этом сходный паттерн был отмечен у образцов с разными типами роста стебля [30, 31]. В последующем были отсеквенированы аллели у образцов с индетерминантным (BnA10.TFL1) и с детерминантным (BnA10.tfl1) типами роста стебля. Были идентифицированы четыре однонуклеотидные замены в экзонах, в интронах были обнаружены 15 SNP, две инсерции размером 2 и 6 пн, одна делеция размером 2 пн. BnA10.TFL1 кодирует белок длиной 178 аминокислот. При анализе белковых последовательностей у образцов с разными типами роста стебля были обнаружены различия в двух аминокислотах. Так, фенилаланин и лейцин у образцов с индетерминантным типом роста были заменены на лейцин и фенилаланин. В настоящий момент остается неясным как замены этих двух аминокислот влияют на экспрессию гена BnA10.TFL1. Филогенетический анализ выявил высокую степень гомологии (85%) между BnA10.TFL1 и TFL1 арабидопсиса [31]. В экспериментах с мутантами арабидопсиса tfl1 со сверхэкспрессией BnA10.TFL1 наблюдалось восстановление фенотипа, характерного для растений дикого типа, у растений был отмечен индетерминантный тип роста стебля. Таким образом, было показано, что BnA10.TFL1 выполняет сходные с TFL1 функции, принимает участие в контроле перехода растения к цветению [30, 31].
Для большинства видов семейства крестоцветных характерно развитие длинного цветоноса, однако у некоторых видов, таких как Jonopsidium acaule (Desf.) Rchb., Idahoa scapigera, Leavenworthia crassa, одиночные цветки закладываются прямо в пазухах листьев, собранных в розетку [5, 32, 33]. У Jonopsidium acaulе авторами исследования были выделены два гомолога LFY арабидопсиса – vcLFY1 и vcLFY2. Гены высоко гомологичны между собой и имеют сходный паттерн экспрессии с LFY, однако уровень экспрессии значительно выше, чем у растений арабидопсиса. Авторы исследования связывают архитектонику растения, закладку одиночных цветков с уровнем экспрессии ортологов LFY, не исключая при этом изменения в уровне и паттерне экспрессии ортологов TFL1 [32]. Фенотип растений Leavenworthia crassa связывают с изменениями в цис-регуляторных элементах, а также в кодирующей части гена LcrLFY [33].
Для большинства сортов огурца (Cucumis sativus L.) характерен индетерминантный тип роста стебля [34]. Направление селекции по созданию сортов с детерминантным типом роста рассматривается как одно из перспективных при выращивании в открытом грунте с целью использования механизированной уборки урожая. В первых работах по изучению молекулярных механизмов контроля типа роста стебля у огурца были идентифицированы пять гомологов TFL1 – CsTFL1a, CsTFL1b, CsTFL1c1, CsTFL1c2, CsTFL1d [34]. Однако анализ структурно-функциональной организации генов, паттерна экспрессии, филогенетических взаимосвязей не смог установить какой их пяти выявленных гомологов контролирует тип роста стебля. В последующих исследованиях было показано, что ген CsTFL1 экспрессируется в центре апикальной меристемы побега после перехода растения к цветению [35]. Кроме этого, экспрессия гена была детектирована в субапикальной зоне пазушных меристем, при этом не фиксировалась во флоральных меристемах, а также в органах цветка. В опытах с трансгенными растениями арабидопсиса, в которых ген CsTFL1 конститутивно экспрессировался под контролем промотора гена 35S, у всех растений был отмечен поздний переход к цветению. Однако задержка перехода к цветению у растений 35S::CsTFL1 была не настолько значительна по сравнению с растениями со сверхэкспрессией TFL1 [16, 35]. В гене CsTFL1 у образца с детерминантным типом роста была идентифицирована несинонимичная замена, происходила замена серина на пролин. Исследователи предполагают, что именно эта замена влияет на функцию белка CsTFL1, при нарушении которой растения переходят к детерминантному типу роста с образованием терминального цветка [35]. Комплекс полученных результатов в очередной раз подтверждает консервативную функцию TFL1 в процессе регуляции перехода растения к цветению.
Среди представителей зернобобовых лучше всего изучены гены-ортологи TFL1 у гороха (Pisum sativum L.) и сои (Glycine max (L.) Merr.). В настоящее время идет активное изучение молекулярно-генетических механизмов контроля роста стебля у фасоли (Phaseolus vulgaris L.), различных видов рода Vigna Savi, а также у других зернобобовых [36, 37].
Для гороха в отличие от арабидопсиса характерно соцветие сложная кисть. После перехода к цветению вегетативная апикальная меристема становится первичной меристемой соцветия. Эта меристема в свою очередь формирует вторичные меристемы соцветия [5, 36–38].
У гороха были выделены три гомолога гена TFL1 – PsTFL1a, PsTFL1b, PsTFL1c [37]. На основе результатов комплексного изучения авторы исследования предположили, что PsTFL1a является гомологом TFL1 и соответствует гену гороха DET (DETERMINATE). Экспрессия гена DET/PsTFL1a фиксировалась в апексе побега только после начала цветения и отмечалась в ходе всей репродуктивной стадии развития растений. Мутации в гене PsTFL1a не оказывали влияния на время перехода растения к цветению. У мутантов наблюдался переход первичной меристемы соцветия во вторичную, закладывалось 1–2 цветка. Ген PsTFL1a определяет идентичность первичной меристемы соцветия у гороха. Для гена PsTFL1c не было зафиксировано тканеспецифичного паттерна экспрессии, а также изменений в уровне накопления транскриптов в зависимости от наступления цветения. Мутации в гене PsTFL1c связаны с более ранним переходом к цветению. Таким образом, в отличие от арабидопсиса, у которого поддержка недетерминированности роста, а также время перехода растения к цветению контролируются геном TFL1, у растений гороха как минимум два гена – DET/PsTFL1a и LF/PsTFL1c регулируют эти процессы [37–39].
У сои известно три типа роста – индетерминантный, детерминантный, а также полудетерминантный, или промежуточный. В настоящее время определен дигенный характер наследования типа роста стебля у сои [40–43]. Были идентифицированы два гена Dt1 и Dt2, эпистатическое взаимодействие которых определяет тип роста [40]. Ген Dt1 определяет индетерминантный тип роста, в то время как растения с генотипом dt1 dt1 имеют детерминантный тип роста. Однако ген Dt2 в присутствии доминантного аллеля Dt1 определяет полудетерминантный тип роста растений [43]. Dt1 неполностью доминантен dt1, растения с генотипом Dt1dt1 также имеют полудетерминантный тип роста, в то время как Dt2 полностью доминирует над dt2 [40, 43]. В последующих работах были расшифрованы нуклеотидные последовательности двух генов, определена их хромосомная локализация, охарактеризованы паттерны экспрессии [41–43]. Экспрессия гена Dt1 (=GmTFL1b) была отмечена в апикальной меристеме побега и корнях растений, при этом накопление транскрипта в апикальной меристеме наблюдалось в ходе вегетативного развития у образцов с индетерминантным и детерминантным типами роста [41]. Анализ нуклеотидных последовательностей гена GmTFL1b у образцов с разными типами роста показал наличие однонуклеотидных замен. С несинонимичной заменой в четвертом экзоне связывают переход растения к детерминантному типу роста, у образца с детерминантным типом роста происходит замена аргинина на триптофан. Авторы исследования предположили, что замена аргинина критически влияет на функцию GmTFL1b, белок теряет способность связываться с белком FD и не может блокировать экспрессию генов идентичности флоральных меристем LFY и AP1 [41]. Ген Dt2 кодирует белок с ДНК-связывающим MADS-доменом, экспрессия этого гена отмечена в области апикальной меристемы, блокируя при этом экспрессию Dt1 [43].
Для растений каянуса (Cajanus cajan (L.) Millsp.) также характерны три типа роста стебля. С использованием методов классического генетического анализа был определен дигенный характер наследования этого признака у каянуса, гены были обозначены как Dt1 и Dt2 [44, 45]. Для растений с генотипами Dt1Dt1Dt2Dt2, Dt1_Dt2_ или Dt1_dt2dt2 характерен индетерминантный тип роста, dt1dt1Dt2_ – полудетерминантный тип, а для растений с генотипом dt1dt1dt2dt2 – детерминантный тип роста стебля [45]. В отличие от сои признак полудетерминантного типа роста является рецессивным. Позже были определены нуклеотидная последовательность, а также паттерн экспрессии гена CcTFL1, контролирующего тип роста стебля каянуса [46]. При этом авторы исследования не указывают на соответствие выделенного ими гена CcTFL1 с генами Dt1 и Dt2 каянуса [46].
У фасоли также был идентифицирован гомолог TFL1 – PvTFL1y, определен ортолог TFL1 у коровьего гороха (Vigna unguiculata (L.) Walp.) – VuTFL1, у маша (Vigna radiata (L.) Wilczek) – Vrdet1 [47–51]. В настоящее время для этих видов предполагается моногенный контроль типа роста стебля с участием TFL1-подобных генов.
ГОМОЛОГИ TFL1 У ТРАВЯНИСТЫХ РАСТЕНИЙ С СОЦВЕТИЯМИ ЗАКРЫТОГО ТИПА
Другой в отличие от арабидопсиса механизм контроля типа роста стебля описан у представителей семейства пасленовых томата (Solanum lycopersicum L.) и табака (Nicotiana tabacum L.). Для этих растений характерно образование соцветий закрытого типа.
В отличие от арабидопсиса с моноподиальным типом ветвления для томатов характерен симподиальный тип ветвления стебля. При моноподиальном нарастании боковые побеги отходят от долгорастущего побега первого порядка. При симподиальном типе ветвления стебля, характерном для томата, рост главного побега заканчивается формированием терминального соцветия. Дальнейший рост побега продолжается за счет боковой почки, расположенной в пазухе самого верхнего листа. Появляется боковой побег (ось второго порядка), который смещает соцветие в сторону. При закладке у этого бокового побега трех листьев происходит также формирование терминального соцветия и рост этого побега прекращается. Так, ось второго порядка заменяется осью третьего порядка, развивающейся снова из почки, которая расположена ниже в пазухе самого верхнего листа. Снова появляется боковой побег и рост продолжается (рис. 3). Таким образом, непрерывность роста стебля томата обеспечивается закладкой симподиальных ветвей. Стебель растения при этом представляет систему последовательно заменяющих друг друга, растущих вверх боковых ветвей возрастающих порядков (рис. 1). Такой тип нарастания преобладает у большинства двудольных растений.
У томатов был описан ген SELF-PRUNING (SP) [54, 55]. Мутации в гене SP не влияют на архитектонику соцветия и на время перехода растения в репродуктивную фазу. У мутантов sp уменьшается число узлов у симподиального побега, число таких симподиальных ответвлений уменьшается до двух и тем самым прекращается рост растения в целом. При сверхэкспрессии гена наблюдается увеличение числа листьев между соцветиями, а также на самих соцветиях [54]. В экспериментах с мутантами sp со сверхэкспрессией гена CEN наблюдалось восстановление индетерминантного типа роста. У растений арабидопсиса со сверхэкспрессией SP отмечалось увеличение продолжительности вегетативного роста [55]. Необходимо отметить, что в отличие от TFL1 экспрессия SP отмечена во всех типах меристем (апикальных, флоральных, пазушных) всех побегов, а также в листьях на ранних стадиях развития растения, а затем и в меристеме соцветий. Ген SP входит в состав семейства генов, для которых характерна высокая гомология нуклеотидных последовательностей кодирующих частей генов между собой, а также с генами сходного семейства арабидопсиса. В семейство SP томата входят шесть генов (SP, SP9D, SP2I, SP3D, SP5G и SP6A), ген SP9D, вероятно, является гомологом TFL1, экспрессируется в апексе побега, а также в корнях [56].
У томата был обнаружен полудетерминантный тип роста стебля [57]. С использованием методов классического генетического анализа было показано, что кроме гена SP этот тип роста контролируется вторым геном, обозначенным как Sdt. Такой тип роста является рецессивным признаком, при анализе гибридов второго поколения наблюдалось расщепление в соотношении 12 : 3 : 1 (индетерминантный : детерминантный : полудетерминантный). Авторы исследования предположили дигенный контроль признака типа роста стебля у томата [57].
Иной механизм контроля типа роста стебля описан у другого представителя семейства пасленовых – табака. Главный побег заканчивается терминальным цветком, ниже которого из пазушных меристем развиваются следующие цветки соцветия (рис. 1). Боковые побеги развиваются ниже из пазух листьев на главном побеге. Сходно с главным побегом эти ветви имеют фазу вегетативного роста до его завершения закладкой терминального цветка. Таким образом, архитектоника растений табака сходна с фенотипом мутантов cen или tfl1, для которых также характерно развитие терминального соцветия.
У табака выделены семь гомологичных CEN генов – гены CET (CET1–7) [27]. При анализе белковых последовательностей CET, SP, CEN и TFL1 было показано, что СET2/4, SP и CEN высоко гомологичны между собой. При этом гены СET2 и CET4 имеют высокий уровень гомологии между собой и вероятно являются копиями одного предкового гена. Экспрессия этих генов не отмечена в апикальной меристеме главного побега, а экспрессия ортологов гена LFY – NFL1 и NFL2 (Nicotiana FLO LFY), напротив, отмечена в апикальной меристеме главного побега уже с самых ранних стадий развития. В отсутствие экспрессии СET2 и CET4 в апикальной меристеме главного побега при высоком уровне экспрессии NFL1 и NFL2 происходит закладка терминального цветка у растений табака [27]. Как и у арабидопсиса, наблюдается антагонизм действия между СET2/CET4 и NFL1/NFL2. Экспрессия СET2 и CET4 зафиксирована в апексе боковых побегов уже на начальных этапах развития. Одна из предполагаемых функций СET2 и CET4 заключается в продлении вегетативной фазы роста растения, что и задерживает переход растения к цветению. При переходе боковых побегов к репродуктивной стадии экспрессия генов СET2 и CET4 прекращается, при этом увеличивается уровень экспрессии NFL [27].
Интересным примером вероятно TFL1-независимой инициации перехода к цветению является регуляция этого процесса у бальзамина садового (Impatiens balsamina L.). У этих растений известны сорта как с индетерминантным, так и с детерминантным типами роста стебля. При этом цветение у этого растения наступает в условиях короткого дня (КД), а при длинном дне (ДД) продолжается вегетативное развитие. Необычная особенность отмечена для сортов I. balsamina с детерминантным типом роста. Так, в случае перевода в непродуктивные условия растение ДД, уже находившееся на стадии репродуктивного развития, возвращается к вегетативному росту. Для растений с индетерминантным типом роста такой особенности не отмечено [58].
У растений I. balsamina был выделен ортолог гена TFL1, паттерн экспрессии которого был определен у сортов с разными типами роста в условиях КД и ДД [58]. Экспрессия IbTFL1 отсутствовала в зоне апикальной меристемы главного побега, а также в меристеме терминального соцветия у растений вне зависимости от типа роста. Экспрессия гена была детектирована только в пазушных меристемах в ходе вегетативной стадии развития. В апикальной меристеме у растений с индетерминантным типом роста была отмечена экспрессия IbLFY, однако даже в отсутствие экспрессии IbTFL1 растение не переходило к репродуктивной фазе. Такая неспособность IbLFY инициировать переход апикальной меристемы во флоральную вероятно и объясняет отсутствие необходимости экспрессии IbTFL1 в апикальной меристеме сортов с индетерминантным типом роста, а также у сортов с детерминантным типом в условиях ДД. Авторы исследования предположили, что IbTFL1 не участвует в процессе инициации перехода апикальной меристемы во флоральную, а также не связан с поддержанием индетерминантного типа роста растения. По-видимому, инициация закладки терминального цветка у I. balsamina контролируется системой других генов (не TFL1 и LFY), в качестве наиболее вероятного кандидата рассматривается ген AP1 [5, 58].
ГЕНЕТИЧЕСКИЙ КОНТРОЛЬ РОСТА СТЕБЛЯ У МНОГОЛЕТНИХ РАСТЕНИЙ
У многолетних древесных растений контроль типа роста изучен не настолько подробно по сравнению с однолетними растениями. Многолетние растения отличаются от однолетних, в первую очередь, наличием продолжительной ювенильной стадии, в течение которой происходит образование только вегетативных побегов. Стадия цветения у многолетних растений может быть продолжительна. В связи с этим изучение молекулярно-генетических механизмов контроля роста у таких растений осложнено, данные получены при изучении экспрессии предполагаемых ортологов, а также с использованием трансгенных растений. Как правило, экспрессия гомологов TFL1 фиксировалась в тканях апикальных почек и стеблей.
Рассмотрим особенности экспрессии гена TFL1 у некоторых представителей семейства Rosaceae Juss. В одном из первых исследований был выделен ген MdTFL1 у яблони Malus domestica Borkh. [59]. Экспрессия MdTFL1 была отмечена в апикальных почках вегетативных побегов, в стебле и корнях проростков. Максимальный уровень экспрессии был зафиксирован в апикальных почках в середине лета. Трансгенные растения арабидопсиса со сверхэкспрессией MdTFL1 переходили к цветению значительно позже по сравнению с растениями дикого типа, имели сходный фенотип с растениями 35S::TFL1. Исходя из полученных результатов, авторы предположили, что ген MdTFL1 гомологичен TFL1. Позже Мимида с коллегами выделили четыре гомолога MdTFL1-1 (MdTFL1), MdTFL1-2 (MdTFL1a), MdCENa и MdCENb [60]. Паттерн экспрессии четырех генов был различен. Экспрессия MdTFL1 и MdTFL1a была отмечена в апикальных почках генеративных и вегетативных побегов, в тканях стеблей и корней у 14-дневных проростков. Однако при этом экспрессия MdTFL1a была детектирована в тычинках и цветоносах. Транскрипты MdCENa были обнаружены в лепестках, цветоложе и корнях, сходный паттерн экспрессии был отмечен и для гена MdCENb. Гены MdTFL1-1 и MdTFL1-2 вероятно функционируют как репрессоры цветения и регулируют идентичность вегетативной меристемы, в то время как MdCENa и MdCENb не принимают участия в контроле перехода растения к цветению [60, 61]. На основе результатов филогенетического анализа, а также изучения паттерна и уровня экспрессии выделенных генов авторы предположили субфункционализацию у TFL1/CEN-подобных гомологов путем изменения экспрессии в некоторых органах и тканях в ходе эволюции генома яблони [60, 61].
Для других представителей семейства Rosaceae, а именно некоторых сортов лесной земляники (Fragaria vesca L.) и розы характерен продолжительный период цветения, при этом для таких растений характерен короткий ювенильный период. Сорта земляники нейтрального дня, способные цвести и плодоносить несколько раз на протяжении одного вегетационного сезона, представляют особый интерес для селекционеров. У сортов розы с продолжительным цветением все побеги заканчиваются соцветием, для таких растений характерен детерминантный тип роста стебля. У сортов с однократным весенним цветением отмечен индетерминантный тип роста, соцветия образуются из пазушных меристем. У растений лесной земляники апикальная меристема побега дает начало развитию соцветия, у сортов с продолжительным цветением из пазушных меристем также закладываются соцветия [62].
Коллективом авторов было проведено исследование молекулярно-генетического механизма контроля типа цветения и возможной роли в этом процессе гена TFL1 [62, 63]. В ходе исследования были идентифицированы гомологи генов TFL1/FT у розы и земляники. У сортов розы с неоднократным и продолжительным цветением был обнаружен ретротранспозон во втором интроне гена RoKSN – гомологе TFL1, происходила блокировка транскрипции гена. Ген RoKSN терял функцию репрессора цветения. У сортов розы с однократным весенним цветением наблюдалось изменение уровня экспрессии гена в ходе вегетационного периода, весной экспрессия гена RoKSN отмечалась на низком уровне, что не приводило к блокировке цветения. После первого цветения вновь образующиеся побеги сохраняли вегетационный рост, наблюдалось накопление транскриптов RoKSN, в то время как уровень экспрессии RoFT и RoLFY снижался.
У сортов земляники нейтрального дня была обнаружена делеция в кодирующей области гена FvKSN – гомологе TFL1, что приводило к сдвигу рамки считывания. Таким образом, такие растения приобрели способность цвести несколько раз в период вегетации. Мутации генов RoKSN, FvKSN приводили к изменению сезонности цветения, а также к сокращению срока вегетационного периода таких растений [62, 63].
Виноград (Vitis vinifera L.) относится к многолетним древесным лианам. Для винограда характерен непродолжительный ювенильный период с последовательным образованием листьев одного за другим. До 6–10-го узлов для побега характерен моноподиальный тип ветвления. Однако после формирования 6–10 узлов сбоку от главной оси в пазухе зачатка верхнего листа образуется меристематический бугорок, который быстро развивается, обгоняет главную ось и продолжает рост побега. Главная ось замедляется в развитии, отклоняется в сторону, формируется усик. Такой тип ветвления побега называется симподиальным. Новая точка роста продолжает рост главного стебля до формирования следующего узла, на котором вновь отклоняется в сторону и формируется второй усик. Образовавшийся сбоку новый бугорок формирует следующую точку роста и продолжает рост побега. На третьем узле смещения точки роста не происходит и усик не образуется. Таким образом, в последующем по всей длине побега винограда наблюдается смешанный моноподиально-симподиальный тип ветвления [53, 64] (рис. 3). Вследствие неравномерного удлинения междоузлий усики и листья закладываются напротив друг друга, при этом на каждом третьем междоузлии усик отсутствует. Несмотря на то что усики винограда и расположены напротив листьев, они представляют собой не видоизмененный супротивный лист, а являются верхушками симподиального побега, сдвинутыми в сторону, но развившимися из верхушечных почек (рис. 3). В пазухах листьев закладываются почки, которые вступают в период покоя в конце лета первого сезона. Из них на будущий год разовьются новые побеги. Эти почки представляют собой зачаточный укороченный побег со сходной архитектоникой главного побега, уже в течение первого месяца развития происходит закладка 3–8 листовых примордиев со спиральным филлотаксисом [53, 64–66].
Процесс перехода к цветению у винограда отличается рядом особенностей по сравнению с другими растениями. При неподходящих для цветения условиях у растения будут образовываться усики. Однако в благоприятных условиях запускается программа дальнейшего репродуктивного развития с образованием соцветия [53]. Для наступления цветения винограда необходимы два вегетационных периода. Процессы инициации цветения начинаются еще в почках первого года, однако все дальнейшие процессы развития продолжаются только весной следующего года. Соцветие винограда – это соцветие сложного типа, имеющее моноподиальный тип ветвления. На главной оси соцветия происходит закладка боковых осей, цветки распускаются акропетально.
В исследованиях по идентификации и функциональному анализу вероятных ортологов генов арабидопсиса, участвующих в инициации цветения у винограда, были охарактеризованы три гена – VFL (ортолог LFY), VFUL-L и VAP1 [53]. Экспрессия этих генов отмечалась в пазушных меристемах вне зависимости от пути их дальнейшего развития. У винограда был идентифицирован и гомолог TFL1 – VvTFL1 [64]. Анализ экспрессии проводили в спящих почках. Экспрессию VvTFL1 фиксировали в течение первых двух месяцев развития спящей почки, в то время как экспрессию VFL (ортолога LFY) – в течение первых четырех месяцев. Различия в экспрессии этих генов связаны с двумя фазами развития, происходящими в спящих почках до вступления их в период покоя. В ходе первой фазы происходит инициация закладки бутона, а также 6–8 листовых примордиев, после чего активность апекса снижается. В течение этой фазы развития фиксируется экспрессия двух генов – VvTFL1 и VFL. В экспериментах с трансгенными растениями табака и арабидопсиса со сверхэкспрессией VvTFL1 наблюдалась значительная задержка задержка перехода к цветению [64]. Кроме этого паттерн экспрессии VvTFL1 был сходным с паттерном экспрессии гена SP томата – экспрессия была отмечена в клетках внешних слоев, а также в примордиях, развивающихся из меристемы. Экспрессия TFL1 у арабидопсиса и его ортолога у львиного зева отмечалась в нижней части апикальной меристемы. Это напрямую отражает архитектонику растения: для арабидопсиса и львиного зева характерен моноподиальный тип ветвления, для томата – симподиальный, а для винограда – сочетание этих двух типов ветвления.
В последующих исследованиях у винограда были выделены три гомолога TFL1 – VvTFL1A (=VvTFL1), VvTFL1B и VvTFL1C [65, 66]. Анализ паттерна экспрессии этих генов проводили в спящих почках первого сезона. Весной в почках детектировалась экспрессия только VvTFL1A и VvTFL1C, в течение периода покоя никакой экспрессии не было зафиксировано. В течение второго сезона была отмечена экспрессия генов VvTFL1A и VvTFL1B. При этом максимальный уровень накопления транскриптов VvTFL1A был зафиксирован на стадии набухания почек с постепенным уменьшением при дальнейшем прорастании почек. В ходе вегетативного роста растения экспрессия гена VvTFL1A отмечалась в апексе побега в процессе всего развития, в междоузлиях, на ранних стадиях развития – в усиках. Экспрессия VvTFL1С была также зафиксирована в апексах, VvTFL1В – только в апексах молодых побегов [65]. Наличие экспрессии этих трех генов в спящих почках первого сезона, а также в ходе начальных стадий развития соцветия свидетельствует об их участии в поддержании недерминированности роста меристемы. Последующее отсутствие экспрессии после инициации флоральной меристемы также подтверждает роль этих генов. Экспрессия VvTFL1A была детектирована на начальных этапах развития усиков. У трансгенных растений арабидопсиса и табака со сверхэкспрессией VvTFL1A наблюдались задержка цветения и инициации флоральных меристем, продление вегетативной стадии развития. Кроме этого фенотип некоторых растений арабидопсиса отличался измененной архитектоникой соцветия, у этих растений развивалось новое дополнительное соцветие внутри обычного соцветия [65, 66]. При сверхэкспрессии VvTFL1A у винограда происходили изменения на осях соцветия 3-го и 4-го порядка [67]. Такие модификации напрямую связаны с размером и формой кисти винограда, а также со временем созревания. Увеличение уровня экспрессии гена авторы исследования связывают с инсерцией транспозона в промоторной области гена (в позиции –305 пн). Согласно высказанной гипотезе у мутантов с потерей функции VvTFL1A вероятно будет закладываться небольшое количество усиков и минимально разветвленных соцветий [67].
Переход винограда к цветению отличается от перехода к репродуктивной фазе развития однолетних растений. От других многолетних древесных растений виноград отличает наличие непродолжительной ювенильной стадии развития. Важным этапом в развитии является формирование модифицированных побегов – усиков или соцветий. Вегетативная апикальная меристема побега арабидопсиса дает начало наземным вегетативным органам растения, а при индуктивных условиях происходит превращение в меристему соцветия. В то время как у винограда вегетативная апикальная меристема способна преобразовываться в два типа меристем – меристему, из которой будет развиваться усик, и меристему, из которой будет формироваться соцветие. При этом вне зависимости от дальнейшей судьбы этих меристем в них отмечена экспрессия генов VFL, VFUL-L и VAP1. В зачатках усиков экспрессия VFL отмечена только на ранних стадиях развития, а VFUL-L и VAP1 экспрессируются на всех этапах развития. Гены VFL, VFUL-L и VAP1 экспрессируются и в ходе развития соцветия. Переход к инициации цветения и развитию соцветия авторы исследований отмечали только при увеличении и достижении критического уровня экспрессии VFL. Таким образом, функция гена VFL винограда сходна с ролью гена LFY, как интегратора сигналов от разных путей инициации цветения [53, 66]. Паттерн экспрессии гена VvTFL1A у винограда, а также фенотип трансгенных растений арабидопсиса и табака позволяют предположить роль гена VvTFL1A в поддержании недетерминированности роста. Кроме этого ген VvTFL1A участвует в определении архитектоники соцветий винограда. Однако для установления функций других TFL1-подобных генов винограда необходимы дальнейшие исследования [66].
ГОМОЛОГИ TFL1 У ОДНОДОЛЬНЫХ РАСТЕНИЙ
Ниже остановимся на роли гомологов TFL1 у представителей класса однодольных.
Кукуруза (Zea mays L.) относится к однодомным растениям с однополыми цветками. При переходе к цветению апикальная меристема побега превращается во флоральную, образуется мужское соцветие метелка. Женские соцветия расположены в пазухах листьев. У кукурузы были идентифицированы 24 гена ZEA CENTRORADIALIS (ZCN) в составе семейства PEBP, шесть из которых авторы исследования относят к TFL1-подобным генам [21].
Группой исследователей был проведен анализ экспрессии шести TFL1-подобных генов в апексах побегов, метелках и початках [21, 68]. Экспрессия генов ZCN1 и ZCN3 была отмечена в ходе вегетативной стадии развития, а также в метелках и початках. Значительное накопление транскрипта ZCN3 наблюдалось после перехода к цветению. Экспрессия ZCN6 детектировалась на низком уровне в апексах и в примордиях метелок. Экспрессия ZCN2 и ZCN6 отмечалась до и после перехода к цветению. Накопление транскриптов ZCN4 и ZCN5 фиксировалось после перехода к цветению в метелках и початках. Пять из шести этих TFL1-подобных генов кукурузы экспрессировались и в корнях. В соответствии с паттерном экспрессии авторы исследования подразделили эти гены на две группы. Экспрессия первой группы генов (ZCN1, ZCN2, ZCN3 и ZCN6) была отмечена до и после перехода к цветению, что свидетельствует об участии продуктов этих генов в ходе вегетативной и репродуктивной стадии развития растения. Два гена ZCN4 и ZCN5 экпрессировались только после перехода к цветению. Возможно, это связано с разделением функций между генами для независимого поддержания функции апикальной и флоральной меристем.
Для уточнения функций идентифицированных генов было проведено обширное исследование на трансгенных растениях кукурузы со сверхэкспрессией генов ZCN1–6 [68]. При сверхэкспрессии некоторых генов ZCN наблюдалась более продолжительная стадия вегетативного роста, переход к цветению задерживался. Кроме этого было отмечено изменение архитектоники метелок и початков. При сверхэкспрессии ZCN1, ZCN2, ZCN4 и ZCN5 цветение растений задерживалось, у метелок наблюдалось увеличение числа латеральных ветвей. Фенотип таких растений позволяет предположить участие этих генов в процессе перехода к цветению, а также в поддержании недетерминированности меристемы. При увеличении уровня экспрессии генов ZCN3 и ZCN6 не было отмечено значительных изменений фенотипа растений, не менялось время перехода к цветению, но у таких растений изменялась морфология метелок.
У кукурузы описан белок DLF1, функция которого сходна с функцией белка FD арабидопсиса [8, 69]. С использованием дрожжевой двугибридной модели было показано, что только ZCN2 из всех шести описанных TFL1-подобных белков взаимодействует с DLF1 с образованием гетеродимера. На основании комплекса полученных результатов авторы исследования предположили, что наиболее вероятным ортологом TFL1 является ген ZCN2 [8, 68]. Однако в следующей работе был выделен ген ZmTFL1 (=ZCN1) как гомолог TFL1 [70]. Сверхэкспрессия этого гена у мутантов tfl1–14 арабидопсиса задерживала цветение, для растений был характерен индетерминантный тип роста стебля. Полученные результаты согласуются с результатами проведенных ранее исследований [8, 68]. Установление молекулярно-генетического механизма перехода растений кукурузы к цветению требует дальнейших исследований.
Для изучения особенностей генетики развития однодольных растений в качестве модельного объекта используют рис (Oryza sativa L.). Соцветие риса закладывается из апикальной меристемы побега. Метелка имеет ось главного порядка, которая заканчивается терминальным цветком. За несколько дней до появления метелки наблюдается быстрый рост стебля.
У риса были идентифицированы гены RCN1 и RCN2 как возможные гомологи TFL1/CEN [71]. Экспрессия двух генов была зафиксирована в листьях, корнях, цветках, вегетативных и генеративных меристемах. При этом уровень экспрессии RCN2 был значительно выше в меристемах, чем в других тканях. У трансгенных растений арабидопсиса со сверхэкспрессией генов RCN1 и RCN2 наблюдалось позднее цветение и формирование разветвленного соцветия. У 35S::RCN1 и 35S::RCN2 растений риса переход к репродуктивной фазе также задерживался, было отмечено замедление роста стебля. У таких растений закладывалось большее число листьев до перехода к репродуктивной стадии, задерживалось развитие метелки. Соцветие риса относится к соцветиям закрытого типа, главная ось заканчивается цветком, боковые ветви также заканчиваются цветками. У трансгенных растений изменялась морфология метелки, закладывалось большее число узлов на главной оси соцветия, метелка становилась более компактно упакованной. Таким образом, результаты комплексного исследования позволяют предположить участие генов RCN1 и RCN2 в регуляции продолжительности вегетативного роста растения, а также в контроле архитектоники растения.
При изучении паттерна экспрессии генов RCN не было отмечено различий в зависимости от фотопериода [71]. Экспрессия генов детектировалась в сосудистых тканях стебля и корня. В апексе побега экспрессия была также зафиксирована в сосудистых тканях в ходе вегетативной и репродуктивной стадий развития растения. Результаты экспериментов показали, что RCN транспортируются в апикальную меристему по флоэме. Для активации перехода к цветению ген риса Hd3a (гомолог FT) образует комплекс с 14-3-3 белками и OsFD1 (гомолог FD). Происходит активация транскрипции гена OsMADS15, который является гомологом гена AP1. Авторами исследования была предложена модель регуляции инициации цветения у риса. Образование гексамерного белкового комплекса, состоящего из димера RCN, димера 14-3-3 белков, димера FD, приводит к блокировке инициации цветения [72].
Анализ молекулярно-генетических механизмов перехода к цветению у представителей класса однодольных подтверждает консервативность функций гена TFL1.
ЗАКЛЮЧЕНИЕ
Анализ молекулярно-генетического механизма контроля типа роста стебля, а также процесса перехода к цветению у разных видов растений свидетельствует о том, что пространственно-временной паттерн экспрессии генов идентичности флоральных меристем является решающим. Особенности экспрессии ортологов генов LFY и TFL1 у разных представителей покрытосеменных растений свидетельствуют об их возможном участии в эволюции структуры соцветий. У растений с открытым типом соцветий (например, арабидописис, львиный зев) экспрессия ортологов LFY отмечалась на периферии апикальной меристемы соцветий, при этом экспрессия этих генов не фиксировалась в центральной зоне. В растениях дикого типа в субапикальной центральной зоне меристемы экспрессируется ген TFL1, основная функция которого заключается в поддержании недетерминированности роста апикальной меристемы побега, а также в контроле перехода на репродуктивную фазу развития растения.
У растений с закрытым типом соцветий (например, томат, табак) экспрессия ортологов LFY наблюдалась и в центральной зоне апикальной меристемы, что приводило к образованию терминального цветка у этих растений. При этом паттерн экспрессии ортологов TFL1 у растений с закрытым типом соцветий может различаться.
Гомологи TFL1 обнаружены у многих покрытосеменных растений, отмечена высококонсервативная структура гена, характерно наличие трех интронов и четырех экзонов. Однако функция гомологов TFL1 у других растений может отличаться. У арабидопсиса ген TFL1 контролирует продолжительность вегетативной фазы развития, а также время перехода растения к цветению, в то время как у растений гороха как минимум два гена (DET/PsTFL1a и LF/PsTFL1c) регулируют эти же процессы. У львиного зева и томата гомологи TFL1 (CEN и SP) не контролируют время перехода к цветению. Вероятно, может существовать и TFL1-независимый механизм контроля типа роста стебля у растений, как, например, система отличных от TFL1 и LFY генов у Impatiens balsamina. Роль регуляторных цис-элементов TFL1-подобных генов у различных представителей исследована недостаточно.
Несмотря на таксономическую удаленность различных представителей покрытосеменных растений, можно отметить, что общая схема инициации цветения у них одинаковая, а многие гены, принимающие участие в этом этапе развития растения, гомологичны. Совокупность накопленных результатов подтверждает высокую эволюционную консервативность механизмов молекулярно-генетического контроля инициации цветения, а также консервативность функций генов, участвующих в этом процессе.
Статья подготовлена в рамках государственного задания ВИР согласно тематическому плану НИР по теме № 0481-2019-0001 “Геномные и постгеномные технологии для выявления новых генетических маркеров селекционно значимых свойств и новых аллельных вариантов хозяйственно ценных генов в генофонде культурных растений и их диких родичей”.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Список литературы
Hammer K. Das Domestikation syndrome // Die Kulturpflanze. 1984. Bd 32. № 1. S. 11–34. https://doi.org/10.1007/bf02098682
Вавилов Н.И. Закон гомологических рядов в наследственной изменчивости: [доклад] // Тр. III Всерос. съезда по селекции и семеноводству (4–13 июня 1920 г.). Саратов, 1920. Вып. 1. С. 41–56.
Вавилов Н.И. Закон гомологических рядов в наследственной изменчивости. М.; Л.: Сельхозгиз, 1935. 56 с.
Mimida N., Goto K., Kobayashi Y. et al. Functional divergence of the TFL1-like gene family in Arabidopsis revealed by characterization of a novel homologue // Genes to Cells. 2001. V. 6. P. 327–336. https://doi.org/10.1046/j.1365-2443.2001.00425.x
Benlloch R., Berbel A., Serrano-Mislata A., Madueno F. Floral initiation and inflorescence architecture: a comparative view // Mol. Plant. 2007. V. 100. № 3. P. 659–676. https://doi.org/10.1093/aob/mcm146
Weigel D., Alvarez J., Smyth D.R. et al. LEAFY controls floral meristem identity in Arabidopsis // Cell. 1992. V. 69. P. 843–859. https://doi.org/10.1016/0092-8674(92)90295-n
Weigel D., Nilsson O.A. Developmental switch sufficient for flower initiation in diverse plants // Nature. 1995. V. 377. P. 495–500. https://doi.org/10.1038/377495a0
Blázquez M.A., Soowal L.N., Lee I., Weigel D. LEAFY expression and flower initiation in Arabidopsis // Development. 1997. V. 124. P. 3835–3844.
Lenhard M., Bohnert A., Jurgens G., Laux T. Termination of stem cell maintenance in Arabidopsis floral meristems by interactions between WUSCHEL and AGAMOUS // Cell. 2001. V. 105. P. 805–814. https://doi.org/10.1016/s0092-8674(01)00390-7
Liu X., Kim Y.J., Muller R. et al. AGAMOUS terminates floral stem cell maintenance in Arabidopsis by directly repressing WUSCHEL through recruitment of Polycomb group proteins // Plant Cell. 2011. V. 23. № 10. P. 3654–3670. https://doi.org/10.1105/tpc.111.091538
Laux T., Mayer K.F.X., Berger J., Jürgens G. The WUSCHEL gene is required for shoot and floral meristem integrity in Arabidopsis // Development. 1996. V. 122. P. 87–96.
Ikeda M., Mitsuda N., Ohme-Takagi M. Arabidopsis WUSCHEL is a bifunctional transcription factor that acts as a repressor in stem cell regulation and as an activator in floral patterning // The Plant Cell. 2009. V. 21. P. 3493–3505. https://doi.org/10.1105/tpc.109.069997
Périlleux C., Bouché F., Randoux M., Orman-Ligeza B. Turning meristems into fortresses // Trends in Plant Sci. 2019. V. 24. № 5. P. 431–442. https://doi.org/10.1016/j.tplants.2019.02.004
Moraes T.S., Dornelas M.C., Martinelli A.P. FT/TFL1: calibrating plant architecture // Front. Plant Sci. 2019. V. 10. P. 1–6. https://doi.org/10.3389/fpls.2019.00097
Alvarez J., Guli C.L., Yu X.-H., Smyth D.R. terminal flower: a gene affecting inflorescence development in Arabidopsis thaliana // The Plant J. 1992. V. 2. № 1. P. 103–116. https://doi.org/10.1111/j.1365-313X.1992.00103.x
Ratcliffe O.J., Amaya I., Vincent C.A. et al. A common mechanism controls the life cycle and architecture of plants // Development. 1998. V. 125. P. 1609–1615.
Serrano-Mislata A., Fernández-Nohales P., Doménech M.J. et al. Separate elements of the TERMINAL FLOWER 1 cis-regulatory region integrate pathways to control flowering time and shoot meristem identity // Development. 2016. V. 143. P. 3315–3327. https://doi.org/10.1242/dev.135269
Huang N.-C., Jane W.-N., Chen J., Yu T.-S. Arabidopsis thaliana CENTRORADIALIS homologue (ATC) acts systemically to inhibit floral initiation in Arabidopsis // Plant J. 2012. V. 72. P. 175–184. https://doi.org/10.1111/j.1365-313X.2012.05076.x
Yoo S.J., Chung K.S., Jung S.H. et al. BROTHER OF FT AND TFL1 (BFT) has TFL1-like activity and functions redundantly with TFL1 in inflorescence meristem development in Arabidopsis // Plant J. 2010. V. 63. P. 241–253. https://doi.org/10.1111/j.1365-313X.2010.04234.x
Chardon F., Damerval C. Phylogenomic analysis of the PEBP gene family in cereals // Mol. Evol. 2005. V. 61. P. 579–590. https://doi.org/10.1007/s00239-004-0179
Danilevskaya O., Meng X., Hou Z. et al. A genomic and expression compendium of the expanded PEBP gene family from maize // Plant Physiol. 2008. V. 146. P. 250–264. https://doi.org/10.1104/pp.107.109538
Karlgren A., Gyllenstrand N., Kallman T. et al. Evolution of the PEBP gene family in plants: functional diversification in seed plant evolution // Plant Physiol. 2011. V. 156. P. 1967–1977. https://doi.org/10.1104/pp.111.176206
Ahn J.H., Miller D., Winter V.J. et al. Divergent external loop confers antagonistic activity on floral regulators FT and TFL1 // EMBO J. 2006. V. 25. № 3. P. 605–614. https://doi.org/10.1038/sj.emboj.7600950
Hanzawa Y., Money T., Bradley D. A single amino acid converts a repressor to an activator of flowering // Proc. Natl Acad. Sci. USA. 2005. V. 102. № 21. P. 7748–7753. https://doi.org/10.1073/pnas.0500932102
Wickland D.P., Hanzawa Y. The FLOWERING LOCUS T/TERMINAL FLOWER 1 gene family: functional evolution and molecular mechanisms // Mol. Plant. 2015. V. 8. P. 983–997. https://doi.org/10.1016/j.molp.2015.01.007
Bradley D., Carpenter R., Copsey L. et al. Control of inflorescence architecture in Antirrhinum // Nature. 1996. V. 379. P. 791–797. https://doi.org/10.1038/379791a0
Amaya I., Ratcliffe O.J., Bradley D.J. Expression of CENTRORADIALIS (CEN) and CEN-like genes in tobacco reveals a conserved mechanism controlling phase change in diverse species // Plant Cell. 1999. V. 11. № 8. P. 1405–1418. https://doi.org/10.1105/tpc.11.8.1405
Mimida N., Sakamoto W., Murata M., Motoyoshi F. TERMINAL FLOWER 1-like genes in Brassica species // Plant Sci. 1999. V. 142. P. 155–162. https://doi.org/10.1016/s0168-9452(99)00020-5
Guo Y., Hans H., Christian J., Molina C. Mutations in single FT- and TFL1-paralogs of rapeseed (Brassica napus L.) and their impact on flowering time and yield components // Front. Plant Sci. 2014. V. 5. № 282. P. 1–12. https://doi.org/10.3389/fpls.2014.00282
Li K., Yao Y., Xiao L. et al. Fine mapping of the Brassica napus Bnsdt1 gene associated with determinate growth habit // Theor. Appl. Genet. 2018. V. 131. P. 193–208. https://doi.org/10.1007/s00122-017-2996-z
Jia Y., Li K., Liu H. et al. Characterization of the BnA10.tfl1 gene controls determinate inflorescence trait in Brassica napus L. // Agronomy. 2019. V. 9. P. 722. https://doi.org/10.3390/agronomy9110722
Shu G., Amaral W., Hileman L.C., Baum D.A. LEAFY and the evolution of rosette flowering in violet cress (Jonopsidium acaule, Brassicaceae) // Am. J. Bot. 2000. V. 87. № 5. P. 634–641. https://doi.org/10.2307/2656849
Sliwinski M.K., White M.A., Maizel A. et al. Evolutionary divergence of LFY function in the mustards Arabidopsis thaliana and Leavenworthia crassa // Plant Mol. Biol. 2006. V. 62. P. 279–289. https://doi.org/10.1007/s11103-006-9020-3
Sato H., Heang D., Sassa H., Koba T. Identification and characterization of FT/TFL1 gene family in cucumber // Breed. Sci. 2009. V. 59. P. 3–11. https://doi.org/10.1270/jsbbs.59.3
Wen C., Zhao W., Liu W. et al. CsTFL1 inhibits determinate growth and terminal flower formation through interaction with CsNOT2a in cucumber // Development. 2019. V. 146. P. 1–12. https://doi.org/10.1242/dev.180166
Крылова Е.А., Хлесткина Е.К., Бурляева М.О., Вишнякова М.А. Детерминантный характер роста зернобобовых культур: роль в доместикации и селекции, генетический контроль // Экол. генетика. 2020. V. 18. № 1. P. 43–58. https://doi.org/10.17816/ecogen16141
Benlloch R., Berbel A., Ali L. et al. Genetic control of inflorescence architecture in legumes // Frontiers in Plant Sci. 2015. V. 6. P. 1–14. https://doi.org/10.3389/fpls.2015.00543
Singer S.R., Hsiung L.P., Huber S.C. Determinate (det) mutant of Pisum sativum (Leguminosae: Papilionoideae) exhibits an indeterminate growth // Am. J. Bot. 1990. V. 77. № 10. P. 1330–1335. https://doi.org/10.1002/j.1537-2197.1990.tb11384.x
Foucher F., Morin J., Courtiade J. et al. DETERMINATE and LATE FLOWERING are two TERMINAL FLOWER1/ CENTRORADIALIS homologs that control two distinct phases of flowering initiation and development in pea // The Plant Cell. 2003. V. 15. № 11. P. 2742–2754. https://doi.org/10.1105/tpc.015701
Bernard R.L. Two genes affecting stem termination in soybeans // Crop Science. 1972. V. 12. № 2. P. 235. https://doi.org/10.2135/cropsci1972.0011183X001200020028x
Liu B., Watanabe S., Uchiyama T. et al. The soybean stem growth habit gene Dt1 is an ortholog of Arabidopsis TERMINAL FLOWER1 // Plant Physiol. 2010. V. 153. № 1. P. 198–210. https://doi.org/10.1104/pp.109.150607
Tian Z., Wang X., Lee R. et al. Artificial selection for determinate growth habit in soybean // Proc. Natl Acad. Sci. USA. 2010. V. 107. № 19. P. 8563–8568. https://doi.org/10.1073/pnas.1000088107
Ping J., Liu Y., Sun L. et al. Dt2 is a gain-of-function MADS-domain factor gene that specifies semideterminacy in soybean // The Plant Cell. 2014. V. 26. № 7. P. 2831–2842. https://doi.org/10.1105/tpc.114.126938
Gupta S.C., Kapoor R.K. Inheritance of growth habit in pigeonpea // Crop Sci. 1991. V. 31. P. 1456–1459.
Gumber R.K., Singh S. Genetics of flowering patterns in pigeonpea: further evidence for two gene control // Euphytica. 1997. V. 96. P. 233–236. https://doi.org/10.1023/A:1003086519511
Mir R.R., Kudapa H., Srikanth S. et al. Candidate gene analysis for determinacy in pigeonpea (Cajanus spp.) // Theor. Appl. Genet. 2014. V. 127. P. 2663–2678. https://doi.org/10.1007/s00122-014-2406-8
Kwak M., Velasco D., Gepts P. Mapping homologous sequences for determinacy and photoperiod sensitivity in common bean (Phaseolus vulgaris) // J. Heredity. 2008. V. 99. № 3. P. 283–291. https://doi.org/10.1093/jhered/esn005
Kwak M., Toro O., Debouck D.G., Gepts P. Multiple origins of the determinate growth habit in domesticated common bean (Phaseolus vulgaris) // Annals of Botany. 2012. V. 110. № 8. P. 1573–1580. https://doi.org/10.1093/aob/mcs207
Repinski S.L., Kwak M., Gepts P. The common bean growth habit gene PvTFL1y is a functional homolog of Arabidopsis TFL1 // Theor. Appl. Genet. 2012. V. 124. № 8. P. 1539–1547. https://doi.org/10.1007/s00122-012-1808-8
Dhanasekar P., Reddy K.S. A novel mutation in TFL1 homolog affecting determinacy in cowpea (Vigna unguiculata) // Molecular Genetics and Genomics. 2014. V. 290. № 1. P. 55–65. https://doi.org/10.1007/s00438-014-0899-0
Li S., Ding Y., Zhang D. et al. Parallel domestication with a broad mutational spectrum of determinate stem growth habit in leguminous crops // Plant J. 2018. V. 96. P. 761–771. https://doi.org/10.1111/tpj.14066
Коровина О.Н. Иллюстрированное руководство по морфологии цветковых растений. СПб.: ВИР, 1997. 154 с.
Carmona M.J., Cubas P., Martínez-Zapater J.M. VFL, the grapevine FLORICAULA/LEAFY ortholog, is expressed in meristematic regions independently of their fate // Plant Physiol. 2002. V. 130. P. 68–77. PMIDhttps://doi.org/10.1104/pp.002428
Pnueli L., Carmel-Goren L., Hareven D. et al. The SELF-PRUNING gene of tomato regulates vegetative to reproductive switching of sympodial meristems and is the ortholog of CEN and TFL1 // Development. 1998. V. 125. № 11. P. 1979–1989.
Pnueli L., Gutfinger T., Hareven D. et al. Tomato SP-interacting proteins define a conserved signaling system that regulates shoot architecture and flowering // Plant Cell. 2001. V. 13. № 12. P. 2687–2702. https://doi.org/10.1105/tpc.010293
Carmel-Goren L., Liu Y.S., Lifschitz E., Zamir D. The SELF-PRUNING gene family in tomato // Plant Mol. Biol. 2003. V. 52. P. 1215–1222. https://doi.org/10.1023/b:plan.0000004333.96451.11
Elkind Y., Gurnick A., Kedar N. Genetics of semideterminate growth habit in tomato // HortScience. 1991. V. 26. P. 1074–1075. https://doi.org/10.21273/HORTSCI.26.8.1074
Ordidge M., Chiurugwi T., Tooke F., Battey N.H. LEAFY, TERMINAL FLOWER1 and AGAMOUS are functionally conserved but do not regulate terminal flowering and floral determinacy in Impatiens balsamina // Plant J. 2005. V. 44. P. 985–1000. https://doi.org/10.1111/j.1365-313X.2005.02607.x
Kotoda N., Wada M. MdTFL1, a TFL1-like gene of apple, retards the transition from the vegetative to reproductive phase in transgenic Arabidopsis // Plant Sci. 2005. V. 168. P. 95–104. https://doi.org/10.1016/j.plantsci.2004.07.024
Mimida N., Kotoda N., Ueda T. et al. Four TFL1/CEN-like genes on distinct linkage groups show different expression patterns to regulate vegetative and reproductive development in apple (Malus × domestica Borkh.) // Plant and Cell Physiol. 2009. V. 50. № 2. P. 394–412. https://doi.org/10.1093/pcp/pcp001
Mimida N., Li J., Zhang C. et al. Divergence of TERMINAL FLOWER1-like genes in Rosaceae // Biologia Plantarum. 2012. V. 56. № 3. P. 465–472. https://doi.org/10.1007/s10535-012-0113-3
Iwata H., Gaston A., Remay A. et al. The TFL1 homologue KSN is a regulator of continuous flowering in rose and strawberry // Plant J. 2012. V. 69. P. 116–125. https://doi.org/10.1111/j.1365-313X.2011.04776.x
Wang Li-Na, Liu Y.-F., Zhang Y.-M. et al. The expression level of Rosa Terminal Flower 1 (RTFL1) is related with recurrent flowering in roses // Mol. Biol. Rep. 2012. V. 39. P. 3737–3746. https://doi.org/10.1007/s11033-011-1149-8
Boss P.K., Sreekantan L., Thomas M.R. A grapevine TFL1 homologue can delay flowering and alter floral development when overexpressed in heterologous species // Funct. Plant Biol. 2006. V. 33. P. 31–41. https://doi.org/10.1071/FP05191
Carmona M.J., Calonje M., Martínez-Zapater J.M. The FT/TFL1 gene family in grapevine // Plant Mol. Biol. 2007. V. 63. P. 637–650. https://doi.org/10.1007/s11103-006-9113-z
Carmona M.J., Cubas P., Calonje M. et al. Flowering transition in grapevine (Vitis vinifera L.) // Can. J. Bot. 2007. V. 85. P. 701–711. https://doi.org/10.1139/B07-059
Fernandez L., Torregrosa L., Segura V. et al. Transposon-induced gene activation as a mechanism generating cluster shape somatic variation in grapevine // Plant J. 2010. V. 61. P. 545–557. https://doi.org/10.1111/j.1365-313X.2009.04090
Danilevskaya O., Meng X., Ananiev E. Concerted modification of flowering time and inflorescence architecture by ectopic expression of TFL1-like genes in maize // Plant Physiol. 2010. V. 153. P. 238–251. https://doi.org/10.1104/pp.110.154211
Muszynski M.G., Dam T., Li B. et al. Delayed flowering1 encodes a basic leucine zipper protein that mediates floral inductive signals at the shoot apex in maize // Plant Physiol. 2006. V. 142. P. 1523–1536. https://doi.org/10.1104/pp.106.088815
Chang L., Wu L., Chen Y. et al. Expression and functional analysis of the ZCN1 (ZmTFL1) gene, a TERMINAL FLOWER 1 homologue that regulates the vegetative to reproductive transition in maize // Plant Mol. Biol. Rep. 2012. V. 30. P. 55–66. https://doi.org/10.1007/s11105-011-0317-2
Nakagawa M., Shimamoto K., Kyozuka J. Overexpression of RCN1 and RCN2, rice TERMINAL FLOWER 1/ CENTRORADIALIS homologs, confers delay of phase transition and altered panicle morphology in rice // Plant J. 2002. V. 29. № 6. P. 743–750. https://doi.org/10.1046/j.1365-313x.2002.01255.x
Kaneko-Suzuki M., Kurihara-Ishikawa R., Okushita-Terakawa C. et al. TFL1-like proteins in rice antagonize rice FT-like protein in inflorescence development by competition for complex formation with 14-3-3 and FD // Plant Cell Physiol. 2018. V. 59. P. 458–468. https://doi.org/10.1093/pcp/pcy021
Дополнительные материалы отсутствуют.