Генетика, 2020, T. 56, № 12, стр. 1427-1434
Полиморфизм генов CYP2C9, CYP4F2, VKORC1 в популяции бурят
А. Ю. Самбялова 1, *, Т. А. Баирова 1, Е. В. Беляева 1, О. А. Ершова 1, Д. С. Саргаева 2, С. И. Колесников 1, 3
1 Научный центр проблем здоровья семьи и репродукции человека
664003 Иркутск, Россия
2 Республиканская клиническая больница им. Н.А. Семашко
670031 Улан-Удэ, Россия
3 Московский государственный университет им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: sambialova95@mail.ru
Поступила в редакцию 13.01.2020
После доработки 18.02.2020
Принята к публикации 05.03.2020
Аннотация
Охарактеризована распространенность генотипов и аллелей по полиморфным локусам rs1799853 (430C>T) и rs1057910 (A1075C) гена CYP2C9, rs2108622 (1347C>T) гена CYP4F2, rs9923231 (1639G>A) гена VKORC1 в популяции бурят. Выборка включала 197 человек, из них мужчин – 37.1% (n = 73), женщин – 62.9% (n = 124). Средний возраст обследованных – 57.51 ± 10.88 лет. Для идентификации генотипов по изученным полиморфным локусам использовали метод полимеразной цепной реакции в режиме реального времени (РТ-ПЦР). Частота минорных аллелей *2,*3 гена CYP2C9 составила 2.03 и 3.05% соответственно. Аллель T гена CYP4F2 наблюдался с частотой 31.22%, частота обнаружения аллеля A гена VKORC1 составила 85.28%. Полученные данные по частоте аллелей изученных генов имеют значение для оптимизации фармакотерапии варфарина в популяции бурят.
Генетический полиморфизм выполняет важнейшую биологическую роль, определяя разнообразие популяций человека, формируя предрасположенность к различным патологическим состояниям и чувствительность к лекарственным средствам [1, 2]. Нежелательные лекарственные реакции являются одной из основных причин, приводящих к ухудшению качества жизни, инвалидизации и смертности населения в мире [3]. В настоящее время разработаны фармакогенетические тесты, позволяющие персонализировать выбор и дозирование некоторых ЛС, прогнозировать эффективность и безопасность их применения [4]. Так, в США Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (Food and Drug Administration – FDA) одобрило включение в аннотацию к более чем 150 лекарственным средствам информации о необходимости проведения генетического исследования перед их применением, в том числе к варфарину [5].
Варфарин является “золотым стандартом” антикоагулянтной терапии, подавляет синтез витамин К-зависимых факторов свертывания крови (II, VII, IX и X) и антикоагулянтных протеинов C и S в печени [6]. Самой главной проблемой в терапии варфарином является узкое “терапевтическое окно”, превышение которого чревато кровотечениями, а не достижение – повышает риск повторных тромбозов (инфарктов, инсультов). Изменчивость метаболизма варфарина определяется рядом факторов, в том числе питанием, приемом других лекарственных препаратов, а также носительством полиморфных локусов генов CYP2C9 (rs1799853, rs1057910), CYP4F2 (rs2108622), VKORC1 (rs9923231). Распространенность последних широко варьирует в разных расах и этнических группах [7, 8]. На частоту аллелей влияют такие эволюционные процессы как дрейф генов, естественный отбор, миграция, расширение границ обитания популяции.
Российская Федерация является одной из самых многонациональных стран в мире, где проживают 194 этнические группы, что определяет актуальность изучения популяционно-генетической структуры населения страны [Всероссийская перепись населения (2010)]. Однако исследования, направленные на изучение частоты распространения полиморфных маркеров, ассоциированных с метаболизмом варфарина, в популяции бурят – единичны и фрагментарны [9, 10]. Буряты относятся к центрально-азиатскому антропологическому типу североазиатской малой расы внутри большой монголоидной расы. Бурятский язык относится к северной подгруппе монгольской группы алтайской языковой семьи.
Принимая во внимание все вышесказанное, целью настоящего исследования стало: установить частоты генотипов и аллелей полиморфных локусов генов CYP2C9 (rs1799853, 430C>T и rs1057910, A1075C), CYP4F2 (rs2108622, 1347C>T), VKORC1 (rs9923231, 1639G>A) в популяции бурят и сравнить полученные результаты с другими популяциями мира, используя данные литературы.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании приняли участие 197 добровольцев бурятской национальности, не являющихся родственниками и проживающих на территории Республики Бурятия. Средний возраст обследованных составил 57.51 ± 10.88 лет, гендерный состав группы: 37.1% – мужчин, 62.9% – женщин. Этническая принадлежность добровольцев определялась путем самоидентификации и включала оценку генеалогии участника исследования по обеим родительским линиям до третьего поколения. В исследование не включали близких родственников и потомков разноэтнических браков. Набор материала проводился в период 2015–2017 гг. на базе Республиканской клинической больницы им. Н.А. Семашко (г. Улан-Удэ). Исследование проведено с соблюдением принципов Хельсинкской декларации Всемирной медицинской ассоциации (Бразилия, 2013). Протокол исследования одобрен локальным этическим комитетом ФГБНУ “Научный центр проблем здоровья семьи и репродукции человека”. Все добровольцы информированы о научной направленности исследования и дали письменное согласие для участия в нем.
Материалом для молекулярно-генетического исследования являлась ДНК, экстракцию которой проводили из цельной венозной крови. Образцы крови забирали из локтевой вены в пробирки с антикоагулянтом (6%-ный раствор этилендиаминтетрауксусной кислоты; ГОСТ 10652-73). Для выделения ДНК использовали наборы реагентов “ДНК-сорб-В” (ООО “НекстБио”, Россия). Типирование полиморфных вариантов генов CYP2C9 rs1799853, CYP2C9 rs1057910, CYP4F2 rs2108622, VKORC1 rs9923231 осуществляли с помощью метода полимеразной цепной реакции с детекцией результатов в режиме “реального времени” на амплификаторе “ДТ-Прайм” (ООО “НПО ДНК-Технология”, Россия). В работе использовали коммерческие наборы реагентов “ФармакоГенетика Варфарин” (ООО “НПО ДНК-Технология”).
Статистический анализ проводили с помощью пакета комплексной обработки данных Statictica 6.1 (StatSoft Inc., США). Для оценки соответствия распределения генотипов ожидаемым значениям использовали равновесие Харди–Вайнберга (онлайн-калькулятор OEGE Hardy–Weinberg Equilibrium). Для сравнения частот аллелей между анализируемыми группами использовали Z-критерий. Различия считали статистически значимыми при р ≤ 0.05. Кластеризация популяций проводилась по методу Уорда (Ward) с использованием меры расстояния Эвклида.
РЕЗУЛЬТАТЫ
Распределение частот генотипов и аллелей по полиморфным локусам rs1799853 (430C>T) и rs1057910 (A1075C) гена CYP2C9, rs2108622 (1347C>T) гена CYP4F2, rs9923231 (1639G>A) гена VKORC1 в популяции бурят представлено в табл. 1.
Таблица 1.
Распределение частот генотипов и аллелей полиморфных локусов генов CYP2C9, CYP4F2, VKORC1 в популяции бурят
| Ген (полиморфизм) | Частота генотипа, n (%) | χ2 | Частота минорного аллеля, % | ||
| *1*1 | *1*2 | *2*2 | 0.085 | *2 | |
| CYP2C9 rs1799853 (430C>T) |
189 (95.94) |
8 (4.06) |
– | 2.03 | |
| CYP2C9 rs1057910 (A1075C) |
*1*1 | *1*3 | *3*3 | 0.19 | *3 |
| 185 (93.90) |
12 (6.10) |
– | 3.05 | ||
| CYP4F2 rs2108622 (1347C>T) | CC | CT | TT | 2.537 | T |
| 98 (49.75) |
75 (38.07) | 24 (12.18) | 31.22 | ||
| VKORC1 rs9923231 (1639G>A) |
GG | GA | AA | 0.965 | A |
| 6 (3.05) |
46 (23.35) | 145 (73.60) | 85.28 | ||
Распределение частот генотипов по всем изученным полиморфным вариантам соответствовало закону распределения Харди–Вайнберга.
Частоты гомо- и гетерозиготного генотипа по аллелю CYP2C9*1 составили 95.94 и 4.06% соответственно, а по аллелю CYP2C9*3 – 93.90 и 6.10% соответственно. Нами не выявлены носители генотипов *2*2, *3*3 CYP2C9. В исследованной выборке частота минорных аллелей CYP2C9*2 и CYP2C9*3 составила 2.03 и 3.05% соответственно.
По полиморфным локусам генов (1347C>T) CYP4F2 и (1639G>A) VKORC1 выявлены носители всех трех возможных генотипов. Частоты носителей гомозиготного по минорному Т-аллелю и гетерозиготного генотипов составили соответственно 12.18 и 38.07%. Частота T-аллеля CYP4F2 составила 31.22%. Частота генотипов GG, GA, AA rs9923231 (1639G>A) гена VKORC1 составила 3.05, 23.35, 73.60% соответственно. Распространенность аллеля А гена VKORC1 – 85.28%.
ОБСУЖДЕНИЕ
Ген CYP2C9 расположен в кластере генов цитохрома Р450 на хромосоме 10q23.33 и кодирует фермент, состоящий из 490 аминокислот, участвующий в метаболизме 15–20% лекарственных препаратов, включая варфарин. К настоящему времени идентифицировано более 60 аллелей CYP2C9 в различных полиморфных вариантах, которые изменяют функциональную активность фермента, и наиболее изученными из них являются CYP2C9*2 и CYP2C9*3. Нуклеотидная замена цитозина на тимин в 430-м положении приводит к появлению полиморфизма CYP2C9*2. Другая нуклеотидная замена аденина на цитозин в 1075-м положении приводит к появлению полиморфизма CYP2C9*3. У пациентов – носителей CYP2C9*2 и CYP2C9*3 для предотвращения геморрагических осложнений поддерживающие дозы варфарина должны быть ниже, особенно у пациентов с CYP2C9*3 [11].
Наши данные о низкой частоте минорных аллелей *2, *3 гена CYP2C9 согласуются с результатами других исследований, проведенных в популяции бурят. В ранее проведенном исследовании сотрудниками Томского НИИ медицинской генетики показано, что частота аллелей *2, *3 среди бурят составила 2.3 и 1.7% соответственно, что сопоставимо с собственными данными [9]. Сравнение распределения частот аллелей изученных генов в популяции бурят с другими популяциями показало, прежде всего, значительные межпопуляционные различия (табл. 2). Распространенность аллеля CYP2C9*2 широко варьирует в популяциях мира – от 1% в Восточной Азии до 12.4% в Европе [12]. Мы установили, что частота CYP2C9*2 в популяции бурят значимо меньше, чем в европеоидных популяциях: русских (Москва, Воронеж, Ставрополь), иранцев, турок, а также в выборке ненцев. Ненцы – коренной народ севера, относящийся в антропологическом плане к уральской расе, занимающей промежуточное положение между монголоидной и европеоидной расами [13].
Таблица 2.
Частоты минорных аллелей генов CYP2C9, CYP4F2 и VKORC1 в популяциях народов России и Евразии
| Популяция (страна) | Ген/полиморфизм | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| CYP2C9/430C>T | CYP2C9/A1075C | CYP4F2/1347C>T | VKORC1/1639G>A | |||||||||||||
| N | *2 | p | ссылка | N | *3 | p | ссылка | N | T | p | ссылка | N | А | p | ссылка | |
| % | % | % | % | |||||||||||||
| Буряты (РФ) | 197 | 2.03 | – | Своиданные | 197 | 3.05 | – | Своиданные | 197 | 31.2 | – | Своиданные | 197 | 85.3 | – | Своиданные |
| Якуты (РФ) | 89 | 5.05 | 0.30 | [14] | 89 | 6.74 | 0.26 | [14] | 89 | 83.1 | 0.76 | [14] | ||||
| Башкиры (РФ) | 57 | 6 | 0.26 | [15] | 65 | 6.2 | 0.44 | [15] | ||||||||
| Татары (РФ) | 107 | 5.1 | 0.26 | [15] | 129 | 5.4 | 0.44 | [15] | ||||||||
| Селькупы (РФ) | 330 | 4.85 | 0.16 | [16] | 330 | 8.18 | 0.03 | [16] | 330 | 71.8 | 0.00 | [16] | ||||
| Нганасаны (РФ) | 186 | 3.49 | 0.57 | [16] | 186 | 4.3 | 0.7 | [16] | ||||||||
| Ненцы (РФ) | 303 | 6.77 | 0.03 | [16] | 303 | 0.99 | 0.18 | [16] | 258 | 61 | 0.00 | [17] | ||||
| Нанайцы (РФ) | 70 | 0 | 0.53 | [18] | 70 | 5.7 | 0.52 | [18] | ||||||||
| Русские, Иркутск (РФ) | 147 | 6.1 | 0.09 | [19] | 147 | 9.5 | 0.02 | [19] | 147 | 26.1 | 0.36 | [19] | ||||
| Русские, Москва (РФ) | 63 | 13.5 | 0.00 | [20] | 63 | 14.29 | 0.00 | [20] | 63 | 20.6 | 0.14 | [20] | 63 | 38.1 | 0.00 | [20] |
| Русские, Воронеж (РФ) | 290 | 10.5 | 0.00 | [21] | 290 | 6.7 | 0.12 | [21] | ||||||||
| Русские, Ставрополь (РФ) | 25 | 12 | 0.04 | [22] | 25 | 6 | 0.86 | [22] | ||||||||
| Китайцы (Китай) | 4254 | 0.14 | 0.00 | [23] | 220 | 4.5 | 0.6 | [24] | 222 | 27 | 0.40 | [25] | 220 | 91.8 | 0.052 | [24] |
| Японцы (Япония) | 341 | 0 | 0.03 | [26] | 341 | 2.1 | 0.69 | [26] | 125 | 27.2 | 0.52 | [27] | 341 | 91.8 | 0.03 | [26] |
| Корейцы (Южная Корея) | 574 | 0 | 0.00 | [28] | 250 | 4 | 0.78 | [29] | 250 | 41.6 | 0.03 | [29] | 250 | 91.8 | 0.04 | [29] |
| Тайванцы (Тайвань) | 108 | 0 | 0.34 | [30] | 108 | 2 | 0.86 | [30] | 235 | 23.8 | 0.11 | [31] | 108 | 89 | 0.46 | [30] |
| Тайцы (Тайланд) | 250 | 0 | 0.08 | [32] | 250 | 2.4 | 0.9 | [32] | 250 | 22.6 | 0.053 | [32] | 250 | 83.2 | 0.64 | [32] |
| Малайзийцы (Малайзия) | 91 | 0.5 | 0.64 | [33] | 91 | 3.84 | 0.99 | [33] | 88 | 14 | 0.00 | [34] | 91 | 79.1 | 0.25 | [33] |
| Индонезийцы (Индонезия) | 103 | 0 | 0.36 | [35] | 122 | 3.69 | 0.99 | [36] | 122 | 18.9 | 0.02 | [36] | 122 | 77 | 0.08 | [36] |
| Индусы (Индия) | 257 | 3.8 | 0.42 | [37] | 257 | 7.3 | 0.08 | [37] | 445 | 41.8 | 0.01 | [38] | 257 | 10.6 | 0.00 | [37] |
| Иранцы (Иран) | 100 | 27 | 0.00 | [39] | 100 | 9 | 0.052 | [39] | 226 | 32.7 | 0.82 | [40] | 81 | 56 | 0.00 | [39] |
| Турки (Турция) | 127 | 10.8 | 0.00 | [41] | 127 | 12.75 | 0.00 | [41] | 127 | 2 | 0.00 | [41] | 127 | 44 | 0.00 | [41] |
Вместе с тем нами не показано статистически значимых различий с популяцией русских, проживающих в Восточной Сибири, среди которых распространенность CYP2C9*2 составила 6.1%, что ниже, чем в выборке русских, проживающих в Москве. Частота встречаемости аллеля CYP2C9*2 в изученной популяции значимо выше, чем в популяциях Восточной Азии: китайцев, японцев и корейцев.
Рисковой аллель CYP2C9*3 встречается с частотой от 3.4% в популяциях Восточной Азии и до 10.9% в популяциях Южной Азии [12]. Установлено, что частота CYP2C9*3 в популяции бурят значимо меньше, чем в европеоидных популяциях: русских (Москва и Восточная Сибирь) и турок. Также частота CYP2C9*3 в популяции бурят значимо меньше, чем в популяции селькупов, которые в антропологическом плане относятся к уральской расе, занимающей, как было отмечено выше, промежуточное положение между монголоидной и европеоидной расами [42].
Ген CYP4F2 расположен в кластере генов цитохрома Р450 на хромосоме 19p13.12, белок состоит из 520 аминокислот. Нуклеотидная замена цитозина на тимин в 1347-м положении изменяет окислительную активность витамина K1, в результате чего носители аллеля T имеют более высокие уровни этого витамина и нуждаются в более высоких дозах варфарина [43, 44]. Так, по данным сотрудников клиники Маршфилд (Marshfield Clinic, США) суточная доза варфарина у носителей минорного Т-диаллеля на 1 мг выше, чем у носителей гомозиготного генотипа по дикому С-аллелю [45].
Носители Т-аллеля полиморфизма 1347C>T гена CYP4F2 широко варьируют в популяциях мира: от 8.2% в популяциях Африки и до 41.3% в популяциях Южной Азии [12]. По данным представленного исследования в популяции бурят частота Т‑аллеля значимо ниже, чем в популяциях индусов (Индия) и корейцев (Южная Корея), но значимо выше, чем в популяциях малайзийцев, индонезийцев и турок.
“Мишенью” для варфарина является белок субъединица 1 витамин К – эпоксид-редуктазного комплекса (vitamin К epoxide reductase complex, subunit 1) – основной фермент цикла витамина К, который катализирует переход неактивной формы (витамин К 2,3-эпоксид) в активную (витамин К гидрохинолон). В свою очередь активная форма фермента участвует в выработке витамин К-зависимых факторов свертывания крови (фактор II, VII, IX и X). Ген VKORC1 является одним из наиболее важных генетических детерминантов для дозирования варфарина [46–48]. Ген VKORC1 картирован на хромосоме 16p11.2. Нуклеотидная замена гуанина на аденин в 1639-м положении определяет синтез фермента со сниженной функциональной активностью. Существуют данные, что указанный полиморфизм вносит 20–35% в межиндивидуальную вариабельность чувствительности к варфарину [30, 49].
Изученный полиморфизм гена VKORC1 в популяциях мира встречается с разной частотой – от 5.4% в популяциях Африки и до 88.5% в популяциях Восточной Азии [12]. В популяции бурят частота рискового аллеля А гена VKORC1 высокая и составляет 85.3%. При сравнении полученных результатов с данными других азиатских популяций следует отметить статистически значимые различия частоты А-аллеля гена VKORC1 с выборками из Японии, Кореи за счет большей частоты встречаемости А-аллеля в данных популяциях. При этом отсутствуют статистически значимые различия с коренными жителями Тайваня, Тайланда, Индонезии и Малайзии. Распространенность А-аллеля ниже среди русских, представителей уральской расы (селькупов и ненцев), а также среди жителей Индии, Ирана и Турции.
Таким образом, анализ частотных характеристик некоторых полиморфных вариантов генов – метаболизаторов варфарина в популяции бурят и их сравнение с другими популяциями, населяющими Евразийский континент, указывает на вариативность различий частот минорных аллелей генов CYP2C9, CYP4F2, VKORC1. Вместе с тем анализ степени генетического родства изучаемой популяции с другими популяциями, представляющими как монголоидов, так и другие расово-этнические группы, указывает на различия по изученным генам, ассоциированным с метаболизмом варфарина. Тем не менее результаты кластерного анализа демонстрируют наличие единого кластера азиат, объединяющего бурят с популяциями Восточной и Юго-Восточной Азии (тайской, китайской, японской, тайванской, корейской, малайзийской и индонезийской) (рис. 1). Популяции Европы, Южной и Юго-Западной Азии объединяются в другой кластер: индусы, иранцы, турки, венгры, русские, финны, англичане и шотландцы, румыны.
Рис. 1.
Результаты кластерного анализа, полученные при расчете генетических расстояний между анализируемой выборкой бурят и другими популяциями мира. Для построения дендрограммы использованы данные по частоте аллелей генов CYP2C9, CYP4F2, VKORC1 в некоторых мировых популяциях, с использованием данных литературы: для популяции тайцев [32], китайцев [23–25], японцев [26, 27], тайванцев [30, 31], корейцев [28, 29], малайзийцев [33, 34], индонезийцев [35, 36], индусов [37, 38], иранцев [39, 40], турков [41], венгров [50–52], русских (Москва) [20], финнов [12], англичан и шотландцев [12], румын [50–52].
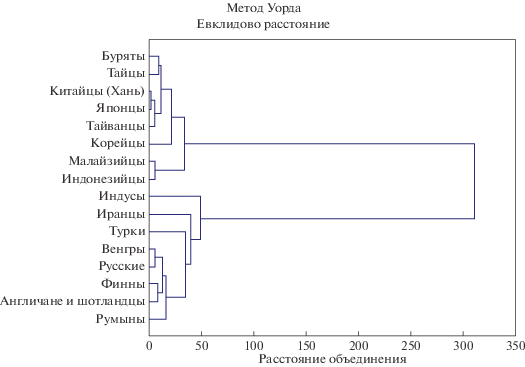
В результате проведенного исследования получены частоты генотипов и аллелей генов – метаболизаторов непрямого антикоагулянта варфарина CYP2C9, CYP4F2, VKORC1 в популяции бурят, проживающих в Восточной Сибири. Наши результаты по частоте минорных аллелей изученных генов согласуются с данными предыдущих исследований, проведенных в бурятской популяции. В целом буряты по изученным полиморфным вариантам наиболее близки к популяциям Восточной и Юго-Восточной Азии и отличаются от популяций Южной и Юго-Западной Азии. Данные по частоте минорных аллелей в популяции бурят, полученные в настоящем исследовании, могут позволить в дальнейшем оптимизировать фармакотерапию варфарина за счет персонализированного подхода при выборе режима и дозы применения лекарственных средств в изученной популяции.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Гончарова И.А., Бабушкина Н.П., Минайчева Л.И. и др. Распространенность аллелей полиморфных вариантов Leu33Pro и Leu66Arg гена ITGB3 у жителей Сибирского региона // Генетика. 2013. Т. 49. № 8. С. 1008–1012. https://doi.org/10.7868/S0016675813070059
Колесникова Л.И., Баирова Т.А., Первушина О.А., Гребенкина Л.А. Связь полиморфизма (192) Q>R гена параоксоназы с липидным профилем и компонентами перекисного окисления липидов и антиоксидантной защиты в популяциях русских и бурят Восточной Сибири // Генетика. 2015. Т. 51. № 2. С. 236–241. https://doi.org/10.7868/S0016675815020095
Alomar M.J. Factors affecting the development of adverse drug reactions // Saudi Pharmaceutical J. 2014. V. 22. № 2. P. 83–94. https://doi.org/10.1016/j.jsps.2013.02.003
Мустафина О.Е., Туктарова И.А., Каримов Д.Д. и др. Полиморфизм генов CYР2D6, CYP3A5 и CYP3A4 в популяциях русских, татар и башкир // Генетика. 2015. Т. 51. № 1. С. 109–119. https://doi.org/10.7868/S0016675815010087
https://www.fda.gov/drugs/science-and-research-drugs/ table-pharmacogenomic-biomarkers-drug-labeling.
Freedman M.D. Oral anticoagulants: pharmacodynamics, clinical indications and adverse effects // The J. Clin. Pharmacol. 1992. V. 32. № 3. P. 196–209. https://doi.org/10.1002/j.1552-4604.1992.tb03827.x
Altshuler D., Donnelly P., International HapMap Consortium. A haplotype map of the human genome // Nature. 2005. V. 437. № 7063. P. 1299–1320. https://doi.org/10.1038/nature04226
Sawyer S.L., Mukherjee N., Pakstis A.J. et al. Linkage disequilibrium patterns vary substantially among populations // Eur. J. Hum. Genet. 2005. V. 13. № 5. P. 677–686. https://doi.org/10.1038/sj.ejhg.5201368
Makeeva O., Stepanov V., Puzyrev V. et al. Global pharmacogenetics: genetic substructure of Eurasian populations and its effect on variants of drug-metabolizing enzymes // Pharmacogenomics. 2008. V. 9. № 7. P. 847–868. https://doi.org/10.2217/14622416.9.7.847
Сангадеева Д.Ц., Дайндоров Д.С., Пушкарев Б.С. и др. Частота генетического полиморфизма VKORC1 среди русских и бурят в Забайкальском крае // Медицина завтрашнего дня. 2017. С. 299–300.
Sanderson S., Emery J., Higgins J. CYP2C9 gene variants, drug dose, and bleeding risk in warfarin-treated patients: A HuG Enet™ systematic review and meta-analysis // Genet. in Medicine. 2005. V. 7. № 2. P. 97–104.
NIH. Genome Reference Consortium, The International Genome Sample Resource. Available online: http://www.1000genomes.org/.
Аверин А.Н., Коренные малочисленные народы: динамика развития // Вестник БГУ. 2015. № 14. С. 70–75.
Vasilyev F.F., Danilova D.A., Kaimonov V.S. et al. Frequency distribution of polymorphisms of CYP2C19, CYP2C9, VKORC1 and SLCO1B1 genes in the Yakut population // Res. in Pharmaceutical Sci. 2016. V. 11. № 3. P. 259–264.
Korytina G., Kochetova O., Akhmadishina L. et al. Polymorphisms of cytochrome p450 genes in three ethnic groups from Russia // Balkan Med. J. 2012. V. 2012. № 3. P. 252–260. https://doi.org/10.1089/gtmb.2017.0036
Корчагина Р.П., Осипова Л.П., Вавилова Н.А. и др. Генетический полиморфизм цитохрома P450 2C9, участвующего в метаболизме лекарственных препаратов, в популяциях коренных жителей Северной Сибири // Сиб. науч. мед. журн. 2011. Т. 31. № 6. С. 39–46.
Лавринов П.А., Белова Н.И., Воробьева Н.А. Полиморфизмы гена VKORC1-1639 G/A и 1173 C/Т в популяции коренных жителей Ненецкого автономного округа // Уч. записки СПбГМУ им. И.П. Павлова. 2014. Т. 21. № 2. С. 33–36.
Шуев Г.Н., Сычёв Д.А., Сулейманов С.Ш. и др. Сравнение частоты полиморфизмов генов CYP2C9, CYP2C19, CYP2D6, ABCB1, SLCO1B1 в этнических группах нанайцев и русских // Фармакогенетика и фармакогеномика. 2016. № 2. С. 12–18.
Баирова Т.А., Новикова Е.А., Белялов Ф.И. и др. Распространенность полиморфизмов генов цитохромов Р450 – метаболизаторов варфарина – в Восточной Сибири // Acta Biomedica Sci. 2018. Т. 3. № 5. С. 39–48. https://doi.org/10.29413/ABS.2018-3.5.6
Sychev D.A., Rozhkov A.V., Ananichuk A.V., Kazakov R.E. Evaluation of genotype-guided acenocoumarol dosing algorithms in Russian patients // Drug Metabolism and Personalized Therapy. 2017. V. 32. № 2. P. 109–114. https://doi.org/10.1515/dmpt-2016-0043
Gaikovitch E.A., Cascorbi I., Mrozikiewicz P.M. et al. Polymorphisms of drug-metabolizing enzymes CYP2C9, CYP2C19, CYP2D6, CYP1A1, NAT2 and of P-glycoprotein in a Russian population // Eur. J. Clin. Pharmacol. 2003. V. 59. № 4. P. 303–312. https://doi.org/10.1007/s00228-003-0606-2
Батурин В.А., Царукян А.А., Колодийчук Е.В. Исследование полиморфизма гена CYP2C9 в этнических группах населения Ставропольского края // Мед. вестник Сев. Кавказа. 2014. Т. 9. № 1. С. 45–48.
Dai D.P., Xu R.A., Hu L.M. et al. CYP2C9 polymorphism analysis in Han Chinese populations: building the largest allele frequency database // The Pharmacogenomics J. 2014. V. 14. № 1. P. 85–92. https://doi.org/10.1038/tpj.2013.2
Li S., Zou Y., Wang X. et al. Warfarin dosage response related pharmacogenetics in Chinese population // PLoS One. 2015. V. 10. № 1. P. e0116463. https://doi.org/10.1371/journal.pone.0116463
Cen H.J., Zeng W.T., Leng X.Y. et al. CYP4F2 rs2108622: a minor significant genetic factor of warfarin dose in Han Chinese patients with mechanical heart valve replacement // Brit. J. Clin. Pharmacol. 2010. V. 70. № 2. P. 234–240. https://doi.org/10.1111/j.1365-2125.2010.03698.x
Yoshizawa M., Hayashi H., Tashiro Y. et al. Effect of VKORC1–1639 G>A polymorphism, body weight, age, and serum albumin alterations on warfarin response in Japanese patients // Thrombosis Res. 2009. V. 124. № 2. P. 161–166. https://doi.org/10.1016/j.thromres.2008.11.011
Sasano M., Ohno M., Fukuda Y. et al. Verification of pharmacogenomics-based algorithms to predict warfarin maintenance dose using registered data of Japanese patients // Eur. J. Clin. Pharmacol. 2019. V. 75. № 7. P. 901–911. https://doi.org/10.1007/s00228-019-02656-7
Yoon Y.R., Shon J.H., Kim M.K. et al. Frequency of cytochrome P450 2C9 mutant alleles in a Korean population // Brit. J. Clin. Pharmacol. 2001. V. 51. № 3. P. 277–280. https://doi.org/10.1046/j.1365-2125.2001.00340.x
Kim K.A., Song W.G., Lee H.M. et al. Multiplex pyrosequencing method to determine CYP2C9* 3, VKORC1* 2, and CYP4F2* 3 polymorphisms simultaneously: its application to a Korean population and comparisons with other ethnic groups // Mol. Biol. Reports. 2014. V. 41. № 11. P. 7305–7312. https://doi.org/10.1007/s11033-014-3617-4
Wen M.S., Lee M., Chen J.J. et al. Prospective study of warfarin dosage requirements based on CYP2C9 and VKORC1 genotypes // Clin. Pharmacol. & Therapeutics. 2008. V. 84. № 1. P. 83–89. https://doi.org/10.1038/sj.clpt.6100453
Lee M.M., Chen C.H., Chou C.H. et al. Genetic determinants of warfarin dosing in the Han-Chinese population // Pharmacogenomics. 2009. V. 10. № 12. P. 1905–1913. https://doi.org/10.2217/pgs.09.106
Wattanachai N., Kaewmoongkun S., Pussadhamma B. et al. The impact of non-genetic and genetic factors on a stable warfarin dose in Thai patients // Eur. J. Clin. Pharmacology. 2017. V. 73. № 8. P. 973–980. https://doi.org/10.1007/s00228-017-2265-8
Gan G.G., Phipps M.E., Lee M.M. et al. Contribution of VKORC1 and CYP2C9 polymorphisms in the interethnic variability of warfarin dose in Malaysian populations // Annals Hematology. 2011. V. 90. № 6. P. 635–641. https://doi.org/10.1007/s00277-010-1119-6
Singh O., Sandanaraj E., Subramanian K. et al. Influence of CYP4F2 rs2108622 (V433M) on warfarin dose requirement in Asian patients // Drug Metabolism and Pharmacokinetics. 2011. V. 26. № 2. P. 130–136. https://doi.org/10.2133/dmpk.DMPK-10-RG-080
Rusdiana T., Araki T., Nakamura T. et al. Responsiveness to low-dose warfarin associated with genetic variants of VKORC1, CYP2C9, CYP2C19, and CYP4F2 in an Indonesian population // Eur. J. Clin. Pharmacol. 2013. V. 69. № 3. P. 395–405. https://doi.org/10.1007/s00228-012-1356-9
Suriapranata I.M., Tjong W.Y., Wang T. et al. Genetic factors associated with patient-specific warfarin dose in ethnic Indonesians // BMC Med. Genet. 2011. V. 12. № 1. P. 80–88. https://doi.org/10.1186/1471-2350-12-80
Kumar D.K., Shewade D.G., Loriot M.A. et al. Effect of CYP2C9, VKORC1, CYP4F2 and GGCX genetic variants on warfarin maintenance dose and explicating a new pharmacogenetic algorithm in South Indian population // Eur. J. Clin. Pharmacol. 2014. V. 70. № 1. P. 47–56. https://doi.org/10.1007/s00228-013-1581-x
Kumar D.K., Shewade D.G., Manjunath S. et al. Inter and intra ethnic variation of vitamin K epoxide reductase complex and cytochrome P450 4F2 genetic polymorphisms and their prevalence in South Indian population // Ind. J. Hum. Genet. 2013. V. 19. № 3. P. 301–310. https://doi.org/10.4103/0971-6866.120817
Namazi S., Azarpira N., Hendijani F. et al. The impact of genetic polymorphisms and patient characteristics on warfarin dose requirements: a cross-sectional study in Iran // Clin. Therapeutics. 2010. V. 32. № 6. P. 1050–1060. https://doi.org/10.1016/j.clinthera.2010.06.010
Khosropanah S., Faraji S.N., Habibi H. et al. Correlation between rs2108622 locus of CYP4F2 gene single nucleotide polymorphism and warfarin dosage in Iranian cardiovascular patients // Iran. J. Pharmaceutical Res.: IJPR. 2017. V. 16. № 3. P. 1238–1246.
Kocael A., Eronat A.P., Tüzüner M.B. et al. Interpretation of the effect of CYP2C9, VKORC1 and CYP4F2 variants on warfarin dosing adjustment in Turkey // Mol. Biol. Reports. 2019. V. 46. № 2. P. 1825–1833. https://doi.org/10.1007/s11033-019-04634-9
Спицына Н.Х., Бычковская Л.С., Макаров С.В. и др. Генетическая изменчивость селькупов Северо-Западной Сибири // Вестник МГУ. 2013. Т. 23. № 3. С. 120–126.
Johnson J.A., Caudle K.E., Gong L. et al. Clinical Pharmacogenetics Implementation Consortium (CPIC) guideline for pharmacogenetics-guided warfarin dosing: 2017 update // Clin. Pharmacol. & Therapeutics. 2017. V. 102. № 3. P. 397–404. https://doi.org/10.1002/cpt.668
Alvarellos M.L., Sangkuhl K., Daneshjou R. et al. PharmGKB summary: very important pharmacogene information for CYP4F2 // Pharmacogenet. and Genomics. 2015. V. 25. № 1. P. 41–47. https://doi.org/10.1097/FPC.0000000000000100
Caldwell M.D., Awad T., Johnson J.A. et al. CYP4F2 genetic variant alters required warfarin dose // Blood. 2008. V. 111. № 8. P. 4106–4112. https://doi.org/10.1182/blood-2007-11-122010
D’Andrea G., D’Ambrosio R.L., Perna P. et al. A polymorphism in the VKORC1 gene is associated with an interindividual variability in the dose-anticoagulant effect of warfarin // Blood. 2005. V. 105. № 2. P. 645–649. https://doi.org/10.1182/blood-2004-06-2111
Rieder M.J., Reiner A.P., Gage B.F. et al. Effect of VKORC1 haplotypes on transcriptional regulation and warfarin dose // New Engl. J. Med. 2005. V. 352. № 22. P. 2285–2293. https://doi.org/10.1056/NEJMoa044503
Yuan H.Y., Chen J.J., Lee M.M. et al. A novel functional VKORC1 promoter polymorphism is associated with inter-individual and inter-ethnic differences in warfarin sensitivity // Hum. Mol. Genet. 2005. V. 14. № 13. P. 1745–1751. https://doi.org/10.1093/hmg/ddi180
Gage B.F., Eby C., Johnson J.A. et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin // Clin. Pharmacol. & Therapeutics. 2008. V. 84. № 3. P. 326–331. https://doi.org/10.1038/clpt.2008.10
Sipeky C., Csongei V., Jaromi L. et al. Vitamin K epoxide reductase complex 1 (VKORC1) haplotypes in healthy Hungarian and Roma population samples // Pharmacogenomics. 2009. V. 10. № 6. P. 1025–1032. https://doi.org/10.2217/pgs.09.46
Sipeky C., Lakner L., Szabo M. et al. Interethnic differences of CYP2C9 alleles in healthy Hungarian and Roma population samples: relationship to worldwide allelic frequencies // Blood Cells, Molecules, and Diseases. 2009. V. 43. № 3. P. 239–242. https://doi.org/10.1016/j.bcmd.2009.05.005
Sipeky C., Weber A., Melegh B.I. et al. Interethnic variability of CYP4F2 (V433M) in admixed population of Roma and Hungarians // Environmental Toxicol. Pharmacol. 2015. V. 40. № 1. P. 280–283. https://doi.org/10.1016/j.etap.2015.05.008
Дополнительные материалы отсутствуют.


