Генетика, 2020, T. 56, № 2, стр. 181-187
Влияние гена quick-to-court на некоторые аспекты брачного поведения у Drosophila melanogaster
Е. Г. Белкина 1, О. Е. Лазебный 1, О. И. Кравчук 1, *
1 Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
* E-mail: kravchuk444@mail.ru
Поступила в редакцию 18.02.2019
После доработки 18.04.2019
Принята к публикации 30.05.2019
Аннотация
quick-to-court (qtc) – недавно открытый ген, участвующий в регуляции полового поведения самцов Drosophila melanogaster. Ранее мы получили линию дрозофил, несущих полную делецию этого гена в гетерозиготном состоянии. Данная работа посвящена исследованию поведенческих особенностей нового делеционного мутанта. Был изучен брачный ритуал у мух с удаленными аристами, что вызывало частичную блокировку акустического канала обмена сигналами между половыми партнерами. Обнаружено, что удаление арист приводит к увеличению времени, необходимого для вступления в копуляцию и к уменьшению частоты копуляций как у мух с делецией qtc, так и у контрольных. Однако между мутантными и контрольными особями были найдены различия. Удаление арист у контрольных самок в большей степени снижало частоту копуляций, чем удаление арист у контрольных самцов, тогда как у делеционных мутантов различия между полами выявлены не были. У контрольных мух латентный период увеличивался только при удалении арист у самок. У мух с делецией qtc латентный период увеличивался как при удалении арист у самок, так и у самцов. Можно предположить, что qtc принимает участие в формировании поведенческого полового диморфизма, но механизм его действия остается до сих пор не ясным.
Брачное поведение является важным изолирующим механизмом, предотвращающим межвидовые скрещивания [1] и поддерживающим целостность вида. Успешное ухаживание, заканчивающееся спариванием и появлением потомства, у Drosophila зависит от множества факторов. Например, самец и самка в ходе ритуала обмениваются различными сигналами: визуальными, тактильными, обонятельными, акустическими [2–7]. Блокирование некоторых стимулов не приводит к полному прекращению брачного ритуала [8]. Для D. melanogaster характерна относительно строгая последовательность поведенческих элементов в процессе ухаживания. Самым длительным из них является брачная песня самца [9], представляющая собой видоспецифический акустический сигнал, который самец генерирует, вибрируя отставленным в сторону крылом. Считается, что звуковая стимуляция нужна для усиления рецептивности самки и демонстрации готовности к спариванию [8, 10–13]. Однако стимулирующий эффект брачной песни не является критичным для распознавания партнера, поскольку бескрылые самцы и самцы с аномальной песней могут спариваться, хотя времени, необходимого для перехода к копуляции, нужно больше, по сравнению с контрольными самцами [14]. Звуковой сигнал представляет собой воздушную волну, заставляющую вибрировать аристы, находящиеся на антеннах, которые превращают звуковую энергию в механический сигнал [11, 15–17]. Считается, что антенны служат в качестве рецепторов, инициирующих преобразование механического сигнала в электрохимический ответ в периферической нервной системе [16, 17]. Удаление антенн у самок приводит к снижению их рецептивности [10]. Самки с удаленными антеннами не способны различать нормальных и бескрылых самцов между собой [19].
За столетнюю историю генетики такого сложного признака как репродуктивное поведение дрозофил [20] исследователям удалось выявить порядка сотни генов, мутации в которых, влияя на множественные биологические процессы, воздействуют и на брачное поведение. Это гены, связанные с морфологией, определением пола, дофаминергической и серотонинергической системами, синтезом феромонов, обучением и памятью, циркадным ритмом. Сравнительно недавно у D. melanogaster был открыт новый ген quick-to-court (qtc), влияющий на половое поведение самцов. Впервые мутация в гене qtc была обнаружена в лабораторной линии с повышенной частотой ухаживания между самцами [21]. Еще одним проявлением мутации было ускорение процесса ухаживания самцов за самками. Кроме того, есть данные об участии qtc в процессе узнавания самок с помощью хеморецепции [22]. Транскрипты qtc присутствуют в основном в голове мух как у самцов, так и у самок. Несмотря на это, мутации qtc приводят к изменениям только полового поведения самцов. Белок QTC был обнаружен в мембранной фракции головы [23]. Молекулярные функции белка QTC остаются до сих пор неизвестными. Чтобы понять, в каких биологических процессах участвует этот белок, мы получили делецию qtc, включающую полную последовательность этого гена [24]. Данная работа посвящена исследованию некоторых поведенческих особенностей нового делеционного мутанта.
МАТЕРИАЛЫ И МЕТОДЫ
Линии дрозофил и скрещивания
y1w1118; pDEL-qtc является встройкой конструкции pDEL-qtc в линию P{y[+t7.7] = CaryP}attP40 [24]. Линия y1w1118; pDEL-qtc была контролем во всех поведенческих тестах. Конструкция pDEL-qtc маркирована геном white, а линия P{y[+t7.7] = = CaryP}attP40 маркирована геном yellow, поэтому особи y1w1118; pDEL-qtc имеют оранжевый цвет глаз и окрас тела дикого типа.
y1w1118; Δqtc/CyO – линия с делецией qtc, полученная из y1w1118; pDEL-qtc с помощью оригинального метода с использованием репарации индуцированного двухцепочечного разрыва [24]. Полученная делеция не живет в гомозиготе, для ее поддержания использовался балансер CyO. В процессе получения делеции мухи теряли маркер yellow и сохраняли маркер white.
Oregon R – линия D. melanogaster дикого типа
Мутации в генах yellow и white оказывают влияние на половое поведение, а CyO на песню мух. Поэтому для всех поведенческих тестов мы получали гетерозиготных особей, скрещивая самцов из линии y1w1118; pDEL-qtc или y1w1118; Δqtc/CyO с самками Oregon R. Были получены контрольная линия с генотипом y+w+; pDEL-qtc/+ и линия с qtc делецией –y+w+; Δqtc/+ (del qtc), имаго которых внешне не отличались от дикого типа.
Поведенческие тесты
Линии дрозофил содержались на манно-дрожжевом корме в пробирках высотой 100 мм и диаметром 25 мм (5–10 мл корма) в термостатируемом помещении при суточном цикле 12 ч света/12 ч темноты и температуре 21 ± 1°С. После вылета из куколок, имаго обездвиживались с помощью холода и сортировались по полу. Виргинные самки и неспарившиеся самцы содержались раздельно в пробирках указанного размера со стандартным кормом в течение 3–4 суток. Поведенческие тесты проводились в таких же пробирках. Каждая особь принимала участие только в одном тесте. Аристы у самок и самцов удалялись при помощи микрохирургических ножниц. Удаление арист производилось за 1–2 суток до постановки экспериментов. Обездвиживание холодом и оперативное вмешательство не оказали влияния на активность имаго. Тест начинался с внесения самца в пробирку с самкой. Если самец не выказывал интереса к самке в течение 10 мин после начала эксперимента, тестируемые особи рассаживались. В случае начала ухаживания регистрировалось время вплоть до копуляции или до истечения 10 мин от начала теста. Такая продолжительность теста используется в исследованиях брачного поведения D. melanogaster [21, 25, 26]. Нами фиксировались три показателя: латентное время (время от внесения самца к самке до начала ухаживания), длительность ухаживания (время от начала ухаживания до наступления копуляции или истечения отведенного времени на тест) и число копуляций. Данные были обработаны с помощью программ Microsoft Excel и Statistica. Частота копуляций сравнивалась с помощью точного критерия Фишера. В связи с тем, что исходные распределения длительности ухаживания и латентных периодов характеризовались правосторонней асимметрией, мы использовали логарифмическое преобразование (y = lg(x + 1)) для их нормализации. Средние по латентным периодам и длительностям ухаживания сравнивали с помощью критерия Стьюдента. Для учета множественных сравнений использовался критерий Бенджамини–Хочберга [27].
РЕЗУЛЬТАТЫ
Изменение брачного поведения при частичной блокировке акустического канала
Для того, чтобы частично блокировать акустический канал, мы удаляли аристы у самцов и самок за 1–2 суток до постановки экспериментов. Далее мы формировали по 35 пар интактных самок и самцов с удаленными аристами или интактных самцов и самок с удаленными аристами (рис. 1,а, в) и проводили наблюдения в течении 10 мин. Пары, у которых в течении 10 мин не начиналось ухаживание, в расчетах не учитывались. Мы фиксировали три показателя: латентное время (время от внесения самца к самке до начала ухаживания), длительность ухаживания (время от начала ухаживания до наступления копуляции или истечения отведенного времени на тест) и число копуляций. Обнаружили значимое увеличение длительности ухаживания по сравнению с контрольными (интактными) мухами (критерий Стьюдента: p = = 0.0042 для самцов без арист, p = 0.00011 для самок без арист). Латентный период увеличивался только при удалении арист у самок (критерий Стьюдента: p = 0.00009). Удаление арист как у самцов, так и у самок приводило к снижению числа пар, вступивших в копуляцию (табл. 1). Присутствие арист у самок в большей степени влияло на частоту копуляции, чем у самцов (точный тест Фишера: p = 0.00001). Увеличение времени, необходимого для вступления в копуляцию и снижение частоты копуляций являлись показателем снижения успешности ухаживания. Наши результаты согласуются с данными, полученными для D. virilis. В экспериментах с D. virilis удаление арист у самок приводило к увеличению длительности ухаживания и снижению частоты копуляций [28]. Известно, что длительность ухаживания возрастает при нарушениях или отсутствии брачной песни, видимо из-за возникающих сложностей в определении брачного партнера [14]. В нашем случае также могли иметь место затруднения в определении брачного партнера из-за того, что самка с удаленными аристами не могла нормально воспринимать брачную песню самца. Таким образом частичная блокировка акустического канала приводила к снижению успешности ухаживания, что выражалось в увеличении времени от начала теста до копуляции и снижении процента копуляции. Удаление арист у самок влияло на брачное поведение и процент копуляции сильнее, чем удаление арист у самцов.
Рис. 1.
Латентный период и длительность ухаживания в ссаживаниях интактных самок и самцов с удаленными аристами (самцы без арист) или интактных самцов и самок с удаленными аристами (самки без арист) по сравнению с интактными. Трансформированные данные. Вертикальные линии представляют собой 95%-ный доверительный интервал. а и в – контрольные мухи, б и г – мухи с делецией qtc.
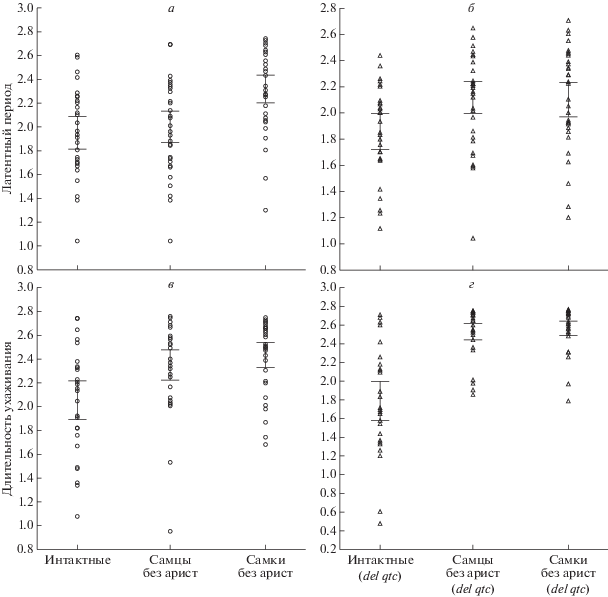
Частичная блокировка акустического канала у мух с делецией qtc
Мутация qtc была впервые была описана, как ускоряющая процесс ухаживания [21]. Мы также обнаружили, что длительность ухаживания у интактных мух с делецией меньше, чем у интактных контрольных (рис. 1). Далее мы повторили эксперимент по удалению арист с дрозофилами, несущими делецию qtc и обнаружили, что частичная блокировка акустического канала у них также приводит к увеличению времени, необходимого для наступления копуляции, а частота копуляций уменьшается. Но в отличие от контрольной линии, латентный период и длительность ухаживания (рис. 1,б, в) одинаково возрастали, как при удалении арист у самцов (критерий Стьюдента: p = 0.00527 и 0.00001 для латентного периода и длительности ухаживания соответственно), так и у самок (p = 0.0107 и 0.00004). Снижение процента копуляций (табл. 2) не зависело от того, у самцов или у самок удалялись аристы.
ОБСУЖДЕНИЕ
Восприятие звуковых сигналов играет важную роль в брачном ритуале дрозофил. Самцы выполняют ведущую звуковую партию, так называемую брачную “песню”, которая нужна для стимуляции самок, а также, являясь видоспецифической, выполняет функцию распознавания партнера своего вида [29]. Самки “слышат”, улавливая вибрации воздуха, аристами, находящимися на антеннах [30] и стимулируются видоспецифичной песней [31]. Ранее было показано, что вероятность успешного исхода брачного ухаживания (копуляции) снижается как в случае с бескрылыми самцами, так и самками без арист [15, 32]. К тому же для нормального воспроизведения брачной песни самцу необходимо ее слышать. Например, мутантные самцы, лишенные слуха, издают брачную песню с измененными частотными характеристиками [33]. Проведенные в настоящей работе эксперименты показали, что удаление арист у самок в большей степени снижало частоту копуляций, чем удаление арист у самцов. Таким образом, нормальное восприятие звука самкой важнее для брачного ритуала, чем “слух” самца. Как правило, в паре D. melanogaster самец исполняет песню, в то время как самка принимает решение о спаривании, основываясь на получаемых сигналах от ухаживающего самца и ее рецептивности [34]. У делеционных мутантов различия между полами отсутствовали: удаление арист у самцов и самок одинаково снижало частоту копуляций. Также, в отличие от контрольных, удаление арист у самцов или самок с делецией одинаково влияло на латентный период и длительность ухаживания.
У D. melanogaster половое поведение самцов формируется и регулируется под воздействием двух транскрипционных факторов: doublesex (dsx) и fruitless (fru), которые созревают (сплайсируются) по-разному у самцов и самок [35]. Ген dsx необходим для инициации ухаживания и песни [36–38]. Специфичная для самцов изоформа fruM определяет развитие нейронов мужского типа и вместе с этим большинство этапов ухаживания самцов [36, 39, 40]. Устранение функции fruM приводит к полной отмене ухаживания самцов, а эктопическая экспрессия fruM у самок формирует у них мужское брачное поведение. В настоящей работе мы исследуем ген qtc, который, видимо, не является транскрипционным фактором. QTC относится к суперскрученным белкам [21], белки такого типа часто связаны с аппаратом Гольджи [41]. qtc экспрессируется как у самцов, так и у самок, различия в уровне транскрипции между полами невелики [21], известно 12 мРНК, образующихся в результате альтернативного сплайсинга. Можно предположить, что у самцов и самок могут присутствовать разные сплайсварианты qtc, которые также, как и разные сплайсварианты dsx и fru участвуют в формировании поведенческого полового диморфизма. Пока это остается предположением, поскольку нет данных о распределении изоформ белка QTC у самцов и самок, а также о молекулярных механизмах его действия.
qtc может участвовать в процессе узнавания полового партнера с помощью феромонов [22]. Также известно, что транскрипты qtc обнаружены в зонах, не связанных с хеморецепцией: сетчатке и оптической доле мозга, в грибовидных телах [21]. Мы предполагаем, что qtc может играть роль в переносе сигналов от различных сенсоров.
Работа поддержана грантом РФФИ (№ 18-04-00177 А) и Государственным заданием ИБР РАН, № 0108-2020-0001.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Andersson M. Sexual selection. Princeton University Press, 1994. 624 p.
Rendel J.M. Mating of ebony vestigial and wild type Drosophila melanogaster in light and dark // Evolution. 1951. V. 5. P. 226–230. https://doi.org/10.1111/j.1558-5646.1951.tb02781.x
Jacobs M.E. The influence of light on mating of D. melanogaster // Ecology. 1960. V. 4. P. 182–188. https://doi.org/10.2307/1931952
Tompkins L., Gross A., Hall J.C. et al. The role of female movement in the sexual behavior of Drosophila melanogaster // Behav. Genet. 1982. V. 12. P. 295–307. https://doi.org/10.1007/BF01067849
Stocker R.F. The organization of the chemosensory system in Drosophila melanogaster: A rewiew // Cell and Tissue Research. 1994. V. 275(1). P. 3–26. https://doi.org/10.1007/BF00305372
Kyriacou C.P., Hall J.C. The function of courtship song rhythms in Drosophila // Anim. Behav. 1982. V. 30. P. 794–801. https://doi.org/10.1016/S0003-3472(82)80152-8
Ritchie M.G., Halsey E.J., Gleason J.M. Drosophila song as a species specific mating signal and the behavioural importance of Kyriacou & Hall cycles in D. melanogaster song // Anim. Behav. 1999. V. 58. P. 649–657. https://doi.org/10.1006/anbe.1999.1167
Hall J.C. The mating of a fly // Science. 1994. V. 264. P. 1702–1714.https://doi.org/10.1126/science.8209251
Lasbleiz C., Ferveur J.F., Everaerts C. Courtship behaviour of Drosophila melanogaster revisited // Anim. Behav. 2006. V. 72(5). P. 1001–1012. https://doi.org/10.1016/j.anbehav.2006.01.027
Mayr E. The role of the antennae in the mating behavior of female Drosophila // Evolution. 1950. V. 4. P. 149–154.
Bennet-Clark H.C. Acoustics of insect song // Nature. 1971. V. 234. P. 255–259. https://doi.org/10.1038/234255a0
Ewing A.W. Functional aspects of Drosophila courtship // Biol. Rev. 1983. V. 58(2). P. 275–292. https://doi.org/10.1111/j.1469-185X.1983.tb00390.x
Greenspan R.J., Ferveur J.F. Courtship in Drosophila // Annu. Rev. Genet. 2000. V. 34. P. 205–232. https://doi.org/10.1146/annurev.genet.34.1.205
von Schilcher F. The role of auditory stimuli in the courtship of Drosophila melanogaster // Anim. Behav. 1976. V. 24. P. 18–26. https://doi.org/10.1016/S0003-3472(76)80095-4
Manning A. Antennae and sexual receptivity in Drosophila melanogaster // Science. 1967. V. 158. P. 136–137.
Cook R.M. Courtship processing in Drosophila melanogaster // Anim. Behav. 1973. V. 21. P. 349–358. https://doi.org/10.1016/S0003-3472(73)80077-6
Göpfert M.C., Robert D. Turning the key on Drosophila audition // Nature. 2001. V. 411. P. 908. https://doi.org/10.1038/35082144
Göpfert M.C., Robert D. The mechanical basis of Drosophila audition // J. Exp. Biol. 2002. V. 205. V. 1199–1208.
Bastock M.A. A gene mutation which changes a behavior pattern // Evolution. 1956. V. 10. P. 421–439. https://doi.org/10.1111/j.1558-5646.1956.tb02868.x
Sturtevant A.H. Experiments on sex recognition and the problem of sexual selection in Drosophila // J. Anim. Behav. 1915. V. 5. P. 351–366.
Gaines P., Tompkins L., Woodard C.T., Carlson J.R. quick-to-court, a Drosophila mutant with elevated levels of sexual behavior, is defective in a predicted coiled-coil protein // Genetics. 2000. V. 154. P. 1627–1637.
Houot B., Fraichard S., Greenspan R.J., Ferveur J.F. Genes involved in sex pheromone discrimination in Drosophila melanogaster and their background-dependent effect // PLoS One. 2012. V. 7. e30799. https://doi.org/10.1371/journal.pone.0030799
Aradska J., Bulat T., Sialana F.J. et al. Gel-free mass spectrometry analysis of Drosophila melanogaster heads // Proteomics. 2015. V. 15. P. 3356–3360. https://doi.org/10.1002/pmic.201500092
Кравчук О.И., Михайлов В.С., Савицкий М.Ю. Простой и эффективный метод получения направленных делеций в геноме дрозофилы // Генетика. 2015. Т. 51. № 11. С. 1325–1329. https://doi.org/10.7868/S0016675815110107
Siegel R.W., Hall J.C. Conditioned responses in courtship behavior of normal and mutant Drosophila // Proc. Nat. Acad. Sci. 1979. V. 76(7). P. 3430–3434.
Tompkins L. Genetic analysis of sex appeal in Drosophila // Behav. Genet. 1984. V. 14(5) P. 411–440.
Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. Roy Statist. Soc. Ser. B. 1995. V. 57(1). P. 289–300.
Белкина Е.Г., Лазебный О.Е., Веденина В.Ю. Роль акустических сигналов в поведении ухаживания Drosophila virilis // Известия РАН. Серия биол. 2016. № 6. С. 645–650. https://doi.org/10.7868/S0002332916060047
Bastock M. Courtship: an ethological study. Chicago: Aldine Publishing, 1967. 220 p.
Cook R.M. Courtship processing in Drosophila melanogaster // Anim. Behav. 1973. V. 21. P. 349–358.
von Schilcher F. The role of auditory stimuli in the courtship of Drosophila melanogaster // Anim. Behav. 1976. V. 24. P. 18–26. https://doi.org/10.1016/S0003-3472(76)80095-4
Ewing A.W. Influence of wing area on the courtship behavior of Drosophila melanogaster // Anim. Behav. 1964. V. 12. P. 316–320. https://doi.org/10.1016/0003-3472[64]90018-1
Tauber E., Eberl D.F. Song production in auditory mutants of Drosophila: The role of sensory feedback // J. Comp. Physiol. A. 2001. V. 187(5). P. 341–348. https://doi.org/10.1007/s003590100206
Dickson B.J. Wired for sex: the neurobiology of Drosophila mating decisions // Science. 2008. V. 322. P. 904–909. https://doi.org/10.1126/science.1159276
Cande J., Stern D.L., Morita T., Prud’homme B., Gompel N. Looking under the lamp post: Neither fruitless nor doublesex has evolved to generate divergent male courtship in Drosophila // Cell Rep. 2014. V. 8(2). P. 363–370. https://doi.org/10.1016/j.celrep.2014.06.023
Kimura K., Hachiya T., Koganezawa M. et al. Fruitless and doublesex coordinate to generate male-specific neurons that can initiate courtship // Neuron. 2008. V. 59(5). P. 759–769. https://doi.org/10.1016/j.neuron.2008.06.007
Rideout E.J., Billeter J.C., Goodwin S.F. The sex-determination genes fruitless and doublesex specify a neural substrate required for courtship song // Curr. Biol. 2007. V. 17(17). P. 1473–1478. https://doi.org/10.1016/j.cub.2007.07.047
Villella A., Hall J.C. Courtship anomalies caused by doublesex mutations in Drosophila melanogaster // Genetics. 1996. V. 143(1). P. 331–344.
Datta S.R., Vasconcelos M.L., Ruta V. et al. The Drosophila pheromone cVA activates a sexually dimorphic neural circuit // Nature. 2008. V. 452. P. 473–477. https://doi.org/10.1038/nature06808
Stockinger P., Kvitsiani D., Rotkopf S. et al. Neural circuitry that governs Drosophila male courtship behavior // Cell. 2005. V. 121(5). P. 795–807. https://doi.org/10.1016/j.cell.2005.04.026
Truebestein L., Leonard T.A. Coiled-coils: The long and short of it // Bioessays. 2016. V. 38(9). P. 903–916. https://doi.org/10.1002/bies.201600062
Дополнительные материалы отсутствуют.


