Генетика, 2020, T. 56, № 2, стр. 201-210
Влияние изменения плоидности генома на мозаичный характер экспрессии гена nptII в эпиаллелях трансгенной линии табака Nu21
Т. В. Маренкова 1, *, Ю. В. Сидорчук 1, В. В. Кузнецов 1, Е. В. Дейнеко 1, 2
1 Федеральный исследовательский центр Институт цитологии и генетики
Сибирского отделения Российской академии наук
630090 Новосибирск, Россия
2 Национальный исследовательский Томский государственный университет
634050 Томск, Россия
* E-mail: marenkova@bionet.nsc.ru
Поступила в редакцию 09.04.2019
После доработки 18.06.2019
Принята к публикации 09.07.2019
Аннотация
Проведена оценка влияния изменения плоидности генома и дозы гена на мозаичный характер проявления экспрессии гена nptII в эпиаллелях трансгенной линии табака Nu21. Показано в целом сохранение профиля экспрессии маркерного гена nptII (высокого в эпиаллеле Nu5 и низкого в эпиаллеле Nu6) при гетероплоидных скрещиваниях диплоидных трансгенных растений (2n = 48) с полиплоидными нетрансгенными растениями (3n = 72, 4n = 96), а также при самоопылении экспериментально полученных тетраплоидных трансгенных растений линии Nu21 (4n = 96) и в их гибридах от скрещивания с нетрансгенными диплоидными растениями. Установлено, что на стабильность экспрессии маркерного гена nptII влияет исходный эпигенетический статус эпиаллелей и направление скрещивания при гибридизации тетраплоидных нетрансгенных растений табака с диплоидными трансгенными растениями линии Nu21.
Транскрипционно-трансляционный аппарат клетки представляет собой сложноорганизованную систему, обеспечивающую не только считывание генетической информации с образованием соответствующего продукта (РНК, белок), но и его регуляцию, т.е. образование продукта в нужное время, в нужном месте и определенном количестве. Одним из интересных типов регуляции экспрессии генов является мозаичный характер его проявления на уровне клеток одной и той же соматической ткани. Примеры мозаичного характера экспрессии генов/трансгенов встречаются в разных таксономических группах: растения, животные, дрожжи, насекомые, одноклеточные зеленые водоросли. Наиболее успешно молекулярно-генетические механизмы исследованы на Drosophila melanogaster в случае эффекта положения мозаичного типа, когда при переносе гена из области эухроматина в окрестности гетерохроматина наблюдается мозаичная экспрессия исследуемого гена, связанная с тем, что в части клеток ген инактивируется, а в другой – может сохранять свою активность [1]. Описаны примеры мозаичной экспрессии генов для таких видов растений как Solanum lycopersicum [2], Antirrhinum [3] и Zea mays [4], обусловленные парамутацией. У трансгенных растений мозаичный характер экспрессии выявлен для генов, активность которых может быть легко визуализирована на уровне фенотипа, т.е. преимущественно для маркерных и репортерных генов, а также генов, участвующих в биосинтезе пигментов. Ярким примером мозаичной экспрессии трансгенов является перенос дополнительных генов хальконсинтетазы (chs) в геном Petunia hybrida, что привело к появлению неравномерно окрашенных пурпурно-белых цветков [5].
Обнаружены различные модификаторы, которые влияют на частоту проявления мозаичного характера экспрессии генов. У трансгенных растений это условия выращивания экспериментального материала: интенсивность освещения, температура, тепличные или полевые условия [10]. При эффекте положения мозаичного типа у D. melanogaster выявлены сотни генетических модификаторов (энхансеров и супрессоров), показано влияние на экспрессию генетического окружения и таких параметров как температура и общее количество гетерохроматина в геноме [1]. Гомологи генов-модификаторов также выявлены у растений, например гены suvh4 и suvh6 у Arabidopsis thaliana [11]. Изменение в геноме числа хромосом за счет увеличения количества целых гаплоидных наборов также является провоцирующим фактором, который может изменять экспрессию как собственных, так и перенесенных генов. Описаны множественные эпигенетические модификации в полиплоидном геноме растений: изменение статуса метилирования генов/группы генов и транспозонных элементов, повторов, модификации гистоновых белков и др. [12]. У трансгенных растений A. thaliana изменения плоидности генома приводило к снижению уровня экспрессии перенесенных генов и транс-инактивации [13, 14].
Ранее нами описан мозаичный характер проявления маркерного гена nptII в клетках соматической ткани листовой пластинки у 4–6-ти недельных проростков трансгенного растения табака Nu21, выращиваемых in vitro на среде с канамицином [6]. Мозаичный фенотип наследовался при самоопылении в Т1–Т4 и у гибридов F1 от скрещивания с диким типом. В геном растения Nu21 встроилась одна инсерция, состоящая из трех сцепленных копий Т-ДНК, в которой две копии ориентированы в прямом направлении, а расположенная между ними Т-ДНК с делецией большей части гена nptII – в противоположном [7]. Среди потомков Nu21 отобраны две линии (Nu5 и Nu6), контрастно различающиеся по частоте возникновения растений-мозаиков. Для потомков линии Nu5 характерна низкая частота появления растений с мозаичным фенотипом, тогда как для линии Nu6 – высокий уровень мозаицизма. Следует отметить, что данные линии различались между собой и по активности гена nptII. Среди потомков в линии Nu5 ген nptII экспрессировался преимущественно стабильно, тогда как в линии Nu6 наблюдалось существенное снижение его активности. Установлено, что мозаичность проявления гена nptII у исследуемых трансгенных растений линий Nu5 и Nu6 обусловлена действием эпигенетических механизмов и связана с метилированием промотора и кодирующей части гена [8]. Эпиаллели гена nptII стабильно сохраняли определенный уровень экспрессии маркерного гена (высокий или низкий) в ряду поколений при самоопылении и в различных типах дигибридных скрещиваний [9].
Ранее нами на основе линии SR1 Nicotiana tabacum L. была создана серия нетрансгенных растений табака с разным уровнем плоидности (n = 24; 2n = 48; 3n = 72 и 4n = 96) [15]. Поскольку полиплоидные растения табака, а также растения трансгенной линии Nu21 получены на одном и том же генотипе, представляло интерес использовать серию полиплоидных нетрансгенных растений в качестве модели для оценки вкладов дозы гена и уровня плоидности генома в стабильность проявления исследуемого nptII гена. В связи с этим целью данного исследования послужило выявление влияния изменения плоидности генома на мозаичный характер экспрессии гена nptII в эпиаллелях трансгенной линии табака Nu21 в гибридах от скрещивания полиплоидных нетрансгенных растений (3n = 72, 4n = 96) с диплоидными трансгенными растениями (2n = 48), несущими эпиаллели гена nptII, а также с использованием экспериментально полученных тетраплоидных трансгенных растений линии Nu21 (4n = 96) и их гибридов от скрещивания с нетрансгенными диплоидными растениями (2n = 48).
МАТЕРИАЛЫ И МЕТОДЫ
Исходный материал
Для гибридологического анализа в качестве диплоидных трансгенных растений (2n = 48), несущих эпиаллели гена nptII, были использованы две линии табака (Nu5 и Nu6), контрастно различающиеся между собой по проявлению мозаицизма [6].
Тетраплоидные гомозиготные трансгенные растения линий Nu5 и Nu6 (4n = 96) получали обработкой в течение суток 0.2% водным раствором колхицина семян Т2, полученных от самоопыления исходного трансформанта Nu21 [16]. Уровень плоидности полученных растений подтверждали по морфометрическому анализу цветков с применением разработанной нами ранее программы “FlowerMorphology” [17], по числу хлоропластов в замыкающих клетках устьиц, а также анализом метафазных пластинок в клетках корешков.
Тетраплоидные нетрансгенные растения табака (4n = 96) были получены нами ранее обработкой колхицином семян табака линии SR1 [15]. Триплоидные нетрансгенные растения (3n = 72) получали переопылением цветков тетраплоидных (4n = 96) и диплоидных (2n = 48) растений табака исходной линии SR1.
Цитологический анализ метафазных пластинок в клетках корешков
Число хромосом у растений табака подсчитывали в меристемах кончиков корней. Кончики корней фиксировали по Карнуа (3 части 96%-ного этанола, 1 часть ледяной уксусной кислоты) в течение суток с предварительной обработкой эмульсией α-бромнафталина в течение ночи при температуре 4°С. Зафиксированный материал дважды промывали 70% этанолом по 2–3 ч, хранили в 70%-ном этаноле при 4°С. Затем корешки отмывали в 1× PBS трехкратно по 5 мин и обрабатывали смесью 2% целлюлазы (Sigma) и 2% пектиназы (Fluka) в 1× PBS при 37°С 1–2 ч, после чего корешки раздавливали в капле 6% ацетокармина и анализировали на микроскопе Axioskop 2 plus, оборудованным камерой AxioCam HRc camera и программным обеспечением AxioVision (Carl Zeiss, Германия). Подсчет числа хромосом проводили на 30 метафазных пластинках.
Гибридологический анализ проявления nptII гена
Возможное влияние уровня плоидности и дозы исследуемого гена nptII на его проявление оценивали в трех вариантах гибридизации, первый из которых включал анализ самоопыленного потомства тетраплоидных растений линий Nu5 и Nu6 гомозиготных по гену nptII (4n = 96). Во втором варианте проводили скрещивания диплоидных (2n = 48) и тетраплоидных гомозиготных трансгенных растений линий Nu5 и Nu6 (4n = 96) с тетраплоидным (4n = 96) и диплоидным (2n = 48) нетрансгенным табаком (дикий тип, w.t., линия SR1) соответственно. В третьем варианте – скрещивания триплоидного нетрансгенного табака (3n = 72) с диплоидными гомозиготными трансгенными растениями линий Nu5 и Nu6 (2n = 48). Скрещивание растений проводили в двух–семикратных повторностях для одного и того же варианта с предварительным удалением пыльников и изоляцией цветков на материнском растении. Для всех комбинаций выполнены только прямые скрещивания. Стабильность экспрессии гена nptII и частоту появления потомков с мозаичным характером экспрессии маркерного гена оценивали по устойчивости к канамицину, как описано ранее [6].
Статистическая обработка полученных данных включала определение медианы (Ме) и интерквантильного размаха (25% процентиль; 75% процентиль), поскольку распределение эмпирических данных не соответствовало нормальному распределению. Для сравнения групп применяли непараметрический дисперсионный анализ Краскела–Уоллиса (программный пакет Statistica 5.5). Критическое значение уровня значимости принималось равным 5%, р – достигнутый уровень значимости.
Анализ экспрессии гена nptII
Тотальную РНК выделяли с помощью реагента ExtractRNA (ЗАО “Евроген”, Россия), РНК обрабатывали DNase I (Thermo Scientific) и 4 мкг РНК брали для получения кДНК (комплементарной ДНК), используя комплект реактивов “Thermo Scientific RevertAid First Strand cDNA Synthesis Kit”. Анализ экспрессии гена nptII проводили при помощи ПЦР в реальном времени на амплификаторе CFX96 (Bio-Rad, США). Структура праймеров: прямой – 5'-CTCGACGTTGTCCCTGAAG-3', обратный – 5'-TCAGCCATGATGGATACTTTC-3', зонд: 5'-FAM‑CTGTCATCTCACCTTGCTCCTGCCG-BHQ1-3'. Программа амплификации: 95°С – 3 мин, далее 5 циклов без детекции: 95°С – 10 с, 61°С – 20 с, 72°С – 5 с; затем 40 циклов с детекцией на стадии отжига (канал FAM): 95°С – 10 с, 61°С – 20 с, 72°С – 5 с. Уровень экспрессии оценивался при помощи ПО “Bio-Rad CFX Manager 2.1”.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Оценка влияния уровня плоидности на проявление nptII-гена у трансгенных растений табака линий Nu5 и Nu6
Отобранные ранее гомозиготные диплоидные трансгенные растения табака двух линий (Nu5 и Nu6), контрастно различающихся по стабильности проявления nptII-гена, были использованы в качестве модели для оценки вклада уровня плоидности в изменение проявления исследуемого маркерного гена. Как показано нами ранее, Т3-потомки данных диплоидных линий (2n = 48, генотип которых можно обозначить как АА, где А – инсерция трансгена, фенотипическое проявление – устойчивость к канамицину) статистически достоверно различались между собой по проявлению nptII-гена [9]. Удвоение числа хромосом у гомозиготных Т3-потомков линий Nu5 и Nu6 позволило нам оценить возможные изменения в проявлении nptII-гена у исследуемых линий на тетраплоидном уровне (4n = 96, генотип АААА).
При обработке растительных тканей колхицином образуются не только растения с удвоенным числом хромосом, но и миксоплоидные. На рис. 1 показано, что отобранные для дальнейшего анализа две группы растений различались по морфологии цветков. Полиплоидные растения (2n = 96) имели более крупные и массивные цветки по сравнению с диплоидными, что подтверждалось подсчетом числа хромосом в метафазных пластинках в клетках корешков. Различия между диплоидными и полиплоидными группами растений подтверждались также подсчетом числа хлоропластов в замыкающих клетках устьиц, а также морфометрическим анализом цветков с применением программы “FlowerMorphology” [17] (данные не представлены).
На рис. 2,б в виде ящичковой диаграммы размаха изменчивости представлены данные по частоте встречаемости растений с мозаичным проявлением nptII-гена среди тетраплоидных трансгенных растений табака линий Nu5(АААА) и Nu6(АААА). Для линии Nu5(АААА) значение медианы и интерквантильного размаха составило Ме = 6.8 (0, 6.5), для Nu6(АААА) Ме = 96.7 (99, 100). Сравнительный анализ полученных данных непараметрическим дисперсионным анализом Краскела–Уоллиса подтвердил наличие статистически значимых различий между линиями (Н = 37.0260, р = 0.0000). Таким образом, на тетраплоидном уровне различия по частоте появления мозаиков между исследуемыми линиями сохранились: частота появления мозаичных потомков у линии Nu6 была в 14 раз выше, чем в тетраплоидной линии Nu5.
Рис. 2.
Сравнительный анализ мозаичного проявления nptII-гена среди T3-потомков от самоопыления тетраплоидных трансгенных растений табака линий Nu5 и Nu6. а – схема скрещивания; б – ящичковая диаграмма частоты появления растений с мозаичным характером экспрессии гена; в – гистограмма частоты отклонений от ожидаемого расщепления (%).
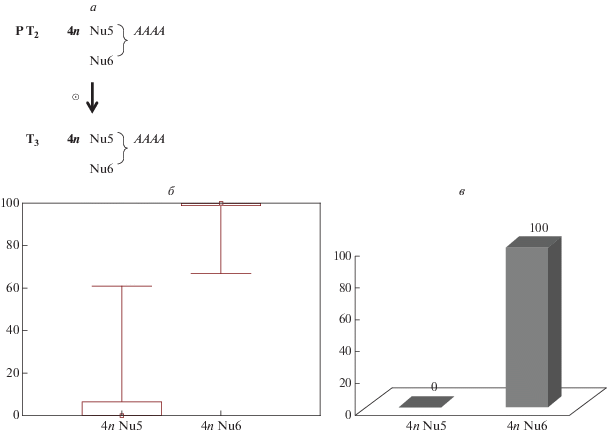
Характер экспрессии анализируемого маркерного гена в тетраплоидных линиях также оценивался по такому признаку, как наличие или отсутствие канамицин-неустойчивых потомков (полностью белых на среде с канамицином). Среди потомков, полученных от самоопыления гомозиготных тетраплоидных трансгенных растений линий Nu5 и Nu6 на среде с канамицином, не ожидалось появления канамицин-неустойчивых растений, поскольку их генотип был представлен как АААА (рис. 2,а). Однако среди потомков, полученных от 23 самоопылений линии Nu6, с высокой частотой наблюдалось появление белых, канамицин-неустойчивых потомков (рис. 2,в). В линии Nu5 из 26 самоопылений все растения проявляли ожидаемый канамицин-устойчивый фенотип (рис. 2,в).
Данные результаты сравнительного анализа частот появления потомков с мозаичным проявлением nptII-гена и частот отклонений от ожидаемого менделевского расщепления среди Т3-потомков для тетраплоидных трансгенных растений достоверно не отличаются от данных, описанных нами ранее для Т3-потомков диплоидных гомозиготных трансгенных растений табака линий Nu5 и Nu6 [9].
На рис. 3 представлены относительные значения уровня экспрессии nptII-гена в исследуемых гомозиготных линиях Nu5 и Nu6 с диплоидным и тетраплоидным наборами хромосом. В линии Nu5 отмечается высокий уровень экспрессии маркерного гена как для диплоидных, так и тетраплоидных растений. Различия между группами по данному признаку статистически не достоверны (H = 1.1363, p = 0.2864). Таким образом, переход из диплоидного состояния в тетраплоидное и соответственное двукратное изменение дозы трансгена не сопровождались изменением уровня экспрессии nptII-гена, что вероятно указывает на частичную супрессию активности трансгена в тетраплоидах. Для линии Nu6 отмечается очень низкий уровень экспрессии маркерного гена в диплоидных и тетраплоидных трансгенных растениях, различия между ними также не достоверны (H = 2.9090, p = 0.0881). Если сравнивать между собой тетраплоидные растения линий Nu5 и Nu6, то между ними сохраняются достоверные отличия по уровню экспрессии маркерного гена (H = 5.3333, p = 0.0209).
Рис. 3.
Уровень экспрессии nptII-гена в трансгенных линиях табака, определенный методом количественной ОТ-ПЦР. Уровень экспрессии № 5/16 принят за 100%. Показана стандартная ошибка среднего. По оси абсцисс указаны номера диплоидных и тераплоидных трансгенных растений табака.
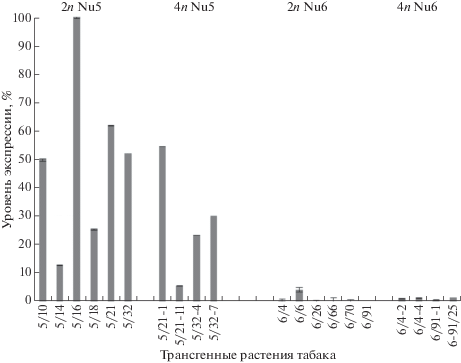
Таким образом, перевод гомозиготных трансгенных растений табака линий Nu5 и Nu6, контрастно различающихся между собой по проявлению гена nptII, из диплоидного состояния в тетраплоидное существенно не повлиял на стабильность проявления исследуемого маркерного гена.
Гетероплоидные скрещивания трансгенных растений табака линий Nu5 и Nu6 с диким типом
Влияние дозы гена и плоидности генома на стабильность экспрессии рекомбинантных генов можно проследить в гетероплоидных скрещиваниях, анализируя проявление гена в полученных гибридах. При условии правильного расхождения бивалентов в мейозе у тетраплоидов скрещивание тетраплоидов с диплоидами ведет к образованию триплоидных гибридов. Скрещивание тетраплоидных нетрансгенных растений табака (4n w.t.; 0000) с диплоидными растениями линий Nu5(АА) и Nu6(AA) дает гибриды с генотипом 00А, то есть в триплоиде представлен тройной набор хромосом и одна инсерция Т-ДНК. В другом варианте гибридизации тетраплоидных растений линий Nu5(AAAA) и Nu6(AAAA) с диплоидными нетрансгенными растениями табака (w.t.; 00) получаются гибриды с генотипом 0АА, то есть в триплоиде представлен тройной набор хромосом и две инсерции Т-ДНК (рис. 4,а). Частоты появления гибридов с мозаичным характером экспрессии гена nptII в данных типах скрещиваний представлены на рис. 4,б.
Рис. 4.
Сравнительный анализ мозаичного проявления nptII-гена при скрещивании нетрансгенных растений табака (w.t.) с гомозиготными растениями линий Nu5 и Nu6 с разным уровнем плоидности. а – схема скрещивания; б – ящичковая диаграмма частоты появления растений с мозаичным характером экспрессии гена; в – гистограмма частоты отклонений от ожидаемого расщепления (%).
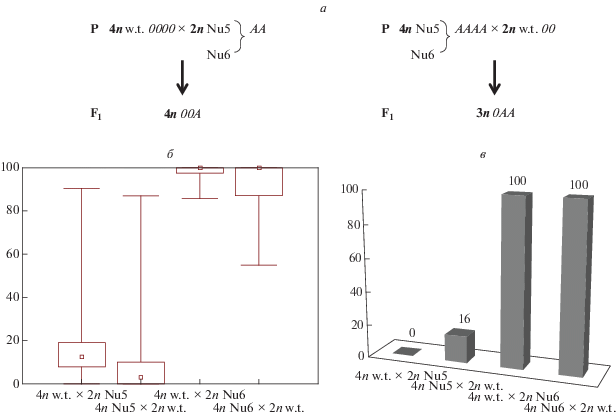
У гибридов от скрещивания тетраплоидных нетрансгенных растений табака с диплоидными растениями линии Nu5 Ме = 20.1 (7.9, 19.1), а в обратном варианте при гибридизации тетраплоидных растений линий Nu5 с диплоидными нетрансгенными растениями табака Ме = 10.9 (0, 10.0). Сравнительный анализ непараметрическим дисперсионным анализом Краскела–Уоллиса выявил наличие статистически значимых различий (Н = 9.2325, р = 0.0024). Таким образом частота появления мозаицизма у гибридов от скрещивания тетраплоидных нетрансгенных растений табака с диплоидными растениями линии Nu5(00А) в два раза выше, чем у гибридов от скрещивания тетраплоидных растений линий Nu5 с диплоидными нетрансгенными растениями табака (0АА). Очевидно, что в данном случае не доза гена, а направление скрещивания влияет на стабильность проявления маркерного гена nptII. Но при этом небольшая частота (16%) отклонения от ожидаемого расщепления по фенотипу устойчивости к канамицину отмечается только у гибридного потомства при скрещивании тетраплоидных растений линий Nu5 с диплоидными нетрансгенными растениями табака (31 скрещивание). В то время как при скрещивания тетраплоидных нетрансгенных растений табака с диплоидными растениями линии Nu5 не было выявлено случаев появления канамицин-неустойчивых гибридов (из 22 скрещиваний) (рис. 4,в).
Для линии Nu6 при скрещивании диплоидных гомозиготных растений с тетраплодными нетрансгенными растениями Ме = 98.2 (85.7, 100), при гибридизации тетраплоидных растений линий Nu6 с диплоидными нетрансгенными растениями табака Ме = 93.9 (97.4, 100). Достоверных, статистически значимых различий между данными вариантами скрещиваний не обнаружено (Н = 1.671, р = 0.1961). Для полученных гибридов линии Nu6 сохраняется как высокая частота появления мозаичных растений, так и высокая частота инактивации экспрессии гена nptII, что проявляется фенотипически на селективной среде: белые, полностью канамицин-неустойчивые растения во всех 23 скрещиваниях для каждого варианта (рис. 4,в).
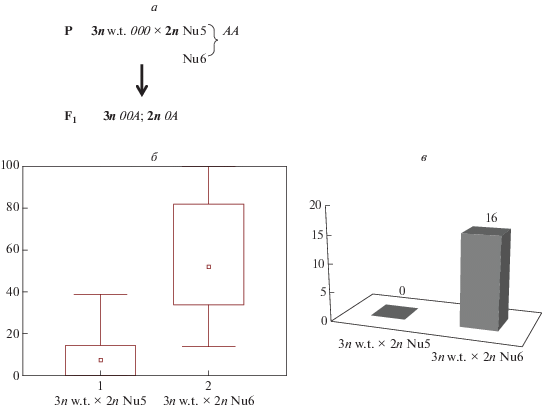
На рис. 5,б представлены результаты оценки частоты появления гибридов с мозаичным характером экспрессии гена nptII при скрещивании триплоидных нетрансгенных растений табака с гомозиготными трансгенными диплоидными растениями линий Nu5 и Nu6. При скрещивании нетрансгенного триплоида с линией Nu5 Ме = 8.8 (0, 14.4), с линией Nu6 Ме = 56.2 (33.9, 82). Различия по частоте появления мозаиков у полученных гибридов статистически достоверны (Н = 27.4448, p = 0.000). На диаграмме четко прослеживается сохранение различий между линиями Nu5 и Nu6, однако для линии Nu6 выявляется существенный сдвиг значения медианы в меньшую сторону, что свидетельствует об увеличении доли растений с более высоким уровнем экспрессии маркерного гена. Ранее при различных вариантах скрещиваний с линией Nu6 аналогичного сдвига получить не удавалось [9]. Следует отметить, что среди гибридов с линией Nu5, полученных из 23 скрещиваний, растений с канамицин-неустойчивым фенотипом выявлено не было, в то время как в 21 скрещивании с линией Nu6 с разной частотой выявлялись белые, канамицин-неустойчивые фенотипы, что приводило к отклонениям от теоретически ожидаемого расщепления (рис. 5,в).
Рис. 5.
Стабильность мозаичного проявления nptII-гена при скрещивании триплоидных нетрансгенных растений табака с гомозиготными диплоидными растениями линий Nu5 и Nu6. а – схема скрещивания; б – ящичковая диаграмма частоты появления растений с мозаичным характером экспрессии гена; в – гистограмма частоты отклонений от ожидаемого расщепления (%).
Полиплоидия широко распространена в мире растений. Полиплоидный организм возникает при дупликации полного генома (автополиплоидия), либо при объединении геномов разных, как правило близкородственных видов (аллоплоидия). Многие таксономические группы современных растений представляют собой полиплоидные ряды с кратным увеличением основного набора хромосом: Triticum, Chrysanthemum, Solanum phureja, Nicotiana, Medicago и др. Nicotiana tabacum является природным аллотетраплоидом (2n = 4x = 48), спонтанно возникшим около 200 тыс. лет назад от скрещивания двух видов табака [18].
При полиплоидии наблюдаются не только генетические изменения в виде добавочного кратного числа хромосом, но и изменения в регуляции и уровне экспрессии многих генов. Исследование экспрессии 18 генов у гаплоидной, диплоидной и тетраплоидной Zea mays показали, что количество белков в клетке в большинстве случаев коррелирует с плоидностью, но для некоторых белков эта зависимость обратная [19]. Анализ AFLP-маркеров у автополиплоидов A. thaliana (4x, 3x) и диплоидной линии до десятого инбредного поколения показал возможность возникновения быстрых генетических изменений и нарушение экспрессии и регуляции активности ряда генов уже в первом поколении после полиплоидизации [20]. Анализ транскриптома серии автополиплоидов Solanum phureja (1x, 2x, 4x) с помощью микрочипов кДНК позволил проанализировать порядка 9000 генов. Статистически значимые различия в уровне экспрессии были обнаружены в 10% случаев и преимущественно для гаплоидов [21]. В настоящей работе не было получено достоверного изменения уровня экспрессии маркерного гена nptII в первом поколении от самоопыления тетраплоидных трансгенных растений линий Nu5 и Nu6, по сравнению с исходными диплоидными растениями. Изменение дозы гена в два раза не привело к увеличению уровня экспрессии анализируемого гена. Возможным механизмом данного явления может быть участие гомологозависимых механизмов эпигенетической инактивации повторяющихся последовательностей в растительном геноме. Выдвинуто предположение, что для цветковых растений РНК-направленное метилирование ДНК служит для более быстрой стабилизации и диплоидизации генома при возникновении полиплоидии [22]. Данное явление “диплоидизации” экспрессии генов у полиплоидов с помощью эпигенетических механизмов описано для Brassica [23].
Показано, что скрещивания диплоидных трансгенных растений A. thaliana, несущих одну копию маркерного гена hpt с тетраплоидными нетрансгенными растениями ведет к потере экспрессии трансгена у части триплоидных гибридов с частотой 11.5% [13, 14]. Подобные нарушения не наблюдались, если скрещивания проводились с диплоидными нетрансгенными растениями. Данный механизм инактивации назвали транскрипционной инактивацией гена, связанной с полиплоидией (polyploidy-associated transcriptional gene silencing, paTGS). Дальнейшие исследования показали, что paTGS регулируется одновременным метилированием ДНК и гистонов, что обеспечивает стойкость инактивации и низкую частоту реактивации [24]. В настоящей работе мы получили схожие результаты: достоверно значимое увеличение частоты появления мозаицизма у гибридов (00А) от скрещивания тетраплоидных нетрансгенных растений табака с диплоидными растениями линии Nu5. Установлено, что на стабильность проявления трансгена у триплоидного гибрида влияет статус плоидности родительских растений и направление скрещивания, поскольку в другом варианте гибридизации тетраплоидных растений линий Nu5 с диплоидными нетрансгенными растениями табака у полученных триплоидов (0АА), частота мозаичного проявления маркерного гена была в два раза ниже. Важно отметить, что данные изменения были отмечены только для эпиаллеля Nu5. Для инактивированного эпиаллеля Nu6 достоверных отличий между такими же скрещиваниями не обнаружено. Таким образом, увеличение числа хромосом может вести к эпигенетическим изменениям в зависимости от исходного эпигенетического статуса линий. В линии Nu5, где отмечается гипометилирование области промотора гена nptII и невысокая частота появления потомков-мозаиков, скрещивание с тетраплоидным нетрансгенным табаком вело к увеличению частоты мозаицизма у гибридов. В линии Nu6, где метилирование захватывает область промотора и кодирующей части гена nptII, аналогичные скрещивания не влияли на уровень экспрессии трансгена. Следовательно, ранее зафиксированная эпигенетическая модификация в линии Nu6 не подвергалась изменениям в триплоидных гибридах, в отличие от активного эпиаллеля линии Nu5.
Исследования на трансгенных растениях показали, что существует глобальная эпигенетическая сеть, которая может регулировать экспрессию гена в зависимости от его хромосомной локализации и нуклеотидной последовательности [25]. Эпиаллели линий Nu5 и Nu6, являющихся потомками одного и того же трансгенного растения (Nu21), имеют одинаковое генетическое окружение. Во всех полученных вариантах гетероплоидной гибридизации и при самоопылении тетраплоидных растений отмечается статистически значимое различие по уровню экспрессии маркерного гена между линиями Nu5 и Nu6. Как показали результаты исследований, изменение плоидности генома не привело к существенным изменениям в ранее установленном эпигенетическом статусе трансгенных эпиаллелей. Следовательно, характер экспрессии генного локуса в полиплоидном растении может зависеть от его исходного эпигенетического состояния. Таким образом изменение числа хромосом является важным источником генетической и эпигенетической изменчивости и может играть важную роль в эволюции и доместикации высших растений.
Работа выполнена в рамках бюджетного проекта 0324-2019-0040 “Генетические основы биотехнологий и биоинформатика”.
Микроскопический анализ был выполнен на базе Центра коллективного пользования микроскопического анализа биологических объектов СО РАН.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Elgin S.C., Reuter G. Position-effect variegation, heterochromatin formation, and gene silencing in Drosophila // Cold Spring Harb. Perspect. Biol. 2013. V. 5. № 8. P. a017780. https://doi.org/10.1101/cshperspect.a017780
Ehlert B., Schottler M.A., Tischendorf G. et al. The paramutated SULFUREA locus of tomato is involved in auxin biosynthesis // J. Exptl. Bot. 2008. V. 59. № 13. P. 3635–3647. https://doi.org/10.1093/jxb/ern213
Bollmann J., Carpenter R., Coen E.S. Allelic interactions at the nivea locus of Antirrhinum // Plant Cell. 1991. V. 3. P. 1327–1336.
Robbins M.L., Wang P., Sekhon R.S., Chopra S. Gene structure induced epigenetic modifications of pericarp color1 alleles of maize result in tissue specific mosaicism // PLoS One. 2009. V. 4. № 12. P. 1–12. https://doi.org/10.1371/journal.pone.0008231
Napoli C., Lemieux C., Jorgensen R. Introduction of a chimeric chalcone synthase gene into Petunia results in reversible co-suppression of homologous genes in trans // The Plant Cell. 1990. V. 2. № 4. P. 279–289. https://doi.org/10.1105/tpc.2.4.279
Маренкова (Новоселя) Т.В., Дейнеко Е.В., Шумный В.К. Мозаичный характер проявления гена nptII у трансгенных растений табака Nu21 // Генетика. 2007. Т. 43. № 7. С. 943–954.
Логинова Д.Б., Шумный В.К., Дейнеко Е.В. Особенности организации Т-ДНК-встройки у трансгенных растений табака линии Nu21 // Вестник ВОГИС. 2010. Т. 14. С. 659–665.
Логинова Д.Б., Меньшанов П.Н., Дейнеко Е.В. Анализ мозаичного проявления nptII-гена у контрастных по мозаицизму линий трансгенных растений табака // Генетика. 2012. Т. 48. № 11. С. 1280–1286.
Маренкова Т.В., Дейнеко Е.В. Гибридологический анализ наследования мозаичного характера экспрессии nptII-гена у трансгенных растений табака // Генетика. 2016. Т. 52. № 6. С. 641–649.
Meyer P., Linn F., Heidmann I. et al. Endogenous and environmental factors influence 35S promoter methylation of a maize A1 gene construct in transgenic petunia and its colour phenotype // Mol. Gen. Genet. 1992. V. 231. P. 345–352.
Ebbs M.L., Bartee L., Bender J. H3 lysine 9 methylation is maintained on a transcribed inverted repeat by combined action of SUVH6 and SUVH4 methyltransferases // Mol. Cell Biol. 2005. V. 25. P. 10507–10515. https://doi.org/10.1128/MCB.25.23.10507-10515.2005
Ding M., Jeffrey Chen Z.J. Epigenetic perspectives on the evolution and domestication of polyploid plant and crops // Curr. Op. Plant Biol. 2018. V. 42. P. 37–48. https://doi.org/10.1016/j.pbi.2018.02.003
Mittelsten Scheid O., Jakovleva L., Afsar K. et al. A change of ploidy can modify epigenetic silencing // Proc. Natl Acad. Sci. USA. 1996. V. 93. № 14. P. 7114–7119.
Mittelsten Scheid O., Afsar K., Paszkowski J. Formation of stable epialleles and their paramutation-like interaction in tetraploid Arabidopsis thaliana // Nat. Genet. 2003. V. 34. № 4. P. 450–454. https://doi.org/10.1038/ng1210
Mursalimov S., Sidorchuk Y., Demidov D. et al. A rise of ploidy level influences the rate of cytomixis in tobacco male meiosis // Protoplasma. 2016. V. 253. № 6. P. 1583–1588. https://doi.org/10.1007/s00709-015-0907-1
Smiley J.H., Stokes G.W. Induction and identification of tetraploidy in Burley Tobacco // Tobacco. 1966. V. 163. № 22. P. 30–32.
Rozov S.M., Deineko E.V., Deyneko I.V. Flower morphology: fully automatic flower morphometry software // Planta. 2018. V. 247. № 5. P. 1163–1173. https://doi.org/10.1007/s00425-018-2856-3
Kenton A., Parokonny A.S., Gleba Y.Y., Bennett M.D. Characterization of the Nicotiana tabacum L. genome by molecular cytogenetics // Mol. Gen. Genet. 1993. V. 240. P. 159–169.
Guo M., Davis D., Birchler J.A. Dosage effects on gene expression in a maize ploidy series // Genetics. 1996. V. 142. № 4. P. 1349–1355.
Liu S., Yang Y., Wei F. et al. Autopolyploidy leads to rapid genomic changes in Arabidopsis thaliana // Theory Biosci. 2017. V. 136. № 3–4. P. 199–206. https://doi.org/10.1007/s12064-017-0252-3
Stupar R.M., Bhaskar P.B., Yandell B.S. et al. Phenotypic and transcriptomic changes associated with potato autopolyploidization // Genetics. 2007. V. 176. № 4. P. 2055–2067. https://doi.org/10.1534/genetics.107.074286
Matzke M.A., Mosher R.A. RNA-directed DNA methylation: an epigenetic pathway of increasing complexity // Nat. Rev. Genet. 2014. V. 15. P. 394–408. https://doi.org/10.1038/nrg3683
Song K., Lu P., Tang K., Osborn T.C. Rapid genome change in synthetic polyploids of Brassica and its implications for polyploid evolution // Proc. Natl Acad. Sci. USA. 1995. V. 92. P. 7719–7723.
Baubec T., Dinh H.Q., Pecinka A. et al. Cooperation of multiple chromatin modifications can generate unanticipated stability of epigenetic states in Arabidopsis // Plant Cell. 2010. V. 22. № 1. P. 34–47. https://doi.org/10.1105/tpc.109.072819
Luo C., Durgin B.G., Watanabe N., Lam E. Defining the functional network of epigenetic regulators in Arabidopsis thaliana // Mol. Plant. 2009. V. 2. P. 661–674. https://doi.org/10.1093/mp/ssp017
Дополнительные материалы отсутствуют.



