Генетика, 2020, T. 56, № 2, стр. 188-200
Изменчивость хлоропластной ДНК отражает историю Tilia cordata s. l. в восточной части ареала
С. А. Семерикова 1, *, И. Ю. Исаков 2, В. Л. Семериков 1
1 Институт экологии растений и животных Уральского отделения Российской академии наук
620144 Екатеринбург, Россия
2 Воронежский государственный лесотехнический университет им. Г.Ф. Морозова,
кафедра лесных культур, селекции и лесомелиорации
394087 Воронеж, Россия
* E-mail: s.a.semerikova@ipae.uran.ru
Поступила в редакцию 14.02.2019
После доработки 04.04.2019
Принята к публикации 29.04.2019
Аннотация
Четвертичная история европейских неморальных лесов на востоке их распространения может значительно отличаться от типичной динамики популяций и ареалов большинства широколиственных видов в Западной и Центральной Европе, характеризующихся выживанием в средиземноморских рефугиумах в ледниковые фазы и расселением в межледниковья. Данное исследование посвящено филогеографии липы мелколистной Tilia cordata Mill. s. s. (Malvaceae) и близких таксонов в Восточной Европе, на Урале, в Сибири и в Крыму. Изменчивость пяти фрагментов хлоропластной ДНК (CDt, HKt, DT, K1K2 и psbJ–petA) была изучена в 29 популяциях с помощью методов рестриктного анализа и секвенирования. Глубокая дивергенция шести выявленных гаплотипов и слабоподдержанная топология филогенетического дерева предположительно соответствуют длительному существованию T. cordata в нескольких изолированных друг от друга областях Западной Палеарктики. Два гаплотипа доминируют на Русской равнине, на Урале и в Сибири. Сопоставление с данными других авторов показывает их отсутствие в Западной и Центральной Европе. Несколько гаплотипов, встреченных на западе России, в Белоруссии и Западной Украине, соответствуют гаплотипам, ранее выявленным в Центральной Европе и в Карпатах. Мы предполагаем, что такое распределение изменчивости хлоропластной ДНК обусловлено сохранением липы в рефугиумах на востоке ареала во время одного или нескольких последних ледниковых интервалов и расселением в позднеледниковье по Русской равнине. Сравнение результатов исследования структуры изменчивости хлоропластной ДНК Tilia cordata s. l. и результатов исследования ядерных микросателлитов позволяет предполагать, что вид, обитавший в плейстоцене на Урале и на Русской равнине, является липой сибирской (T. sibirica), вытесненной позже европейской липой мелколистной и ныне обитающей только в Южной Сибири.
Генетическая структура вида содержит информацию о его демографической истории, флуктуациях ареалов, расположении рефугиумов и путях миграции в ходе ледниковых циклов [1]. Палеонтологические и генетические данные выявляют для большинства видов европейских умеренных лесов модель послеледникового расселения из рефугиумов, располагавшихся в Южной Европе – на Пиренейском, Аппенинском и Балканском п-овах, в Южной Франции и на Кавказе [например, 2, 3]. В то же время некоторые филогеографические исследования [4, обзор] указывают на основной вклад в реколонизацию Северной и Центральной Европы более северных, центрально-европейских рефугиумов, например у бука европейского [5], или о наличии восточных центров колонизации – у вереска обыкновенного [6], ольхи серой [7] и сосны обыкновенной [8, 9].
Возможное выживание широколиственных видов в ледниковые фазы плейстоцена на востоке современного ареала – на Русской равнине, на Урале и в Сибири – имеет существенное значение для эволюции этих видов, поскольку сохранившиеся популяции являются ресурсом генетической изменчивости для растений западной и центральной части континента [10]. В ряде работ по филогеографии европейских лесных видов немногочисленными выборками была представлена восточная часть ареалов дуба черешчатого, липы мелколистной и ольхи черной [2, 11, 12]. Однако в большинстве исследований восточные регионы оказались слабо изучены, и вопрос об их участии в реколонизации умеренных лесов Западной Палеарктики остается нерешенным, хотя отдельные примеры показывают важность учета всего ареала для выявления истории вида [10].
Неморальный евро-сибирский вид умеренного климата липа мелколистная, или сердцевидная T. cordata Mill. s. s. (далее в тексте как T. cordata) является наиболее распространенным видом липы в Евразии [13–15], основная часть ареала которого располагается на территории Западной и Восточной Европы. В европейской части России липа занимает большую часть лесной и лесостепной зон (рис. 1). На восток ее ареал постепенно сужается, достигая на юге Западной Сибири р. Иртыш. Далее в Сибири, за пределами сплошного ареала, липа растет небольшими изолированными “островками” [16]. В верхнем лесном поясе T. cordata встречается в Крыму и на Кавказе, поднимаясь до высоты 1800 м над ур. моря [13]. В горных районах Южной Сибири произрастает близкий таксон – липа сибирская T. sibirica Bayer [13, 17, 18, ссылки]. В одной из последних классификаций рода Tilia [19] липа сибирская рассматривается как подвид T. cordata subsp. sibirica (Fischer ex Bayer) Pigott. Далее в тексте под названием T. cordata s. l. объединяются два таксона – T. cordata и T. sibirica. Исследования на основе изменчивости ядерных микросателлитных локусов показали глубокую дивергенцию T. cordata и T. sibirica, соответствующую среднему плейстоцену [18], однако анализ родственных связей этих двух таксонов, основанный на хлоропластной ДНК, ранее не проводился.
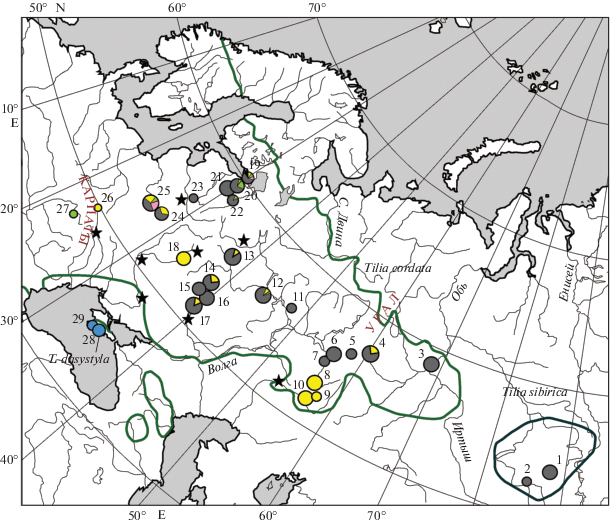
Рис. 1.
Географическое распределение шести хлоропластных гаплотипов в восточной части ареала липы мелколистной (Tilia cordata s. s.), липы сибирской (T. sibirica) и липы опушенностолбиковой (T. dasystyla). Для T. cordata и T. sibirica указаны границы ареалов. Площадь диаграмм пропорциональна размеру выборки. Звездочками обозначены находки пыльцы Tilia в разрезах позднеледниковья (17–12.4 тыс. лет назад) по данным [23]. Цветовые обозначения гаплотипов соответствуют рис. 2, 3. Частоты гаплотипов в выборках приведены в табл. 1.
Наиболее раннее филогеографическое исследование T. cordata [11] было осуществлено с помощью рестриктного анализа четырех фрагментов хлоропластной ДНК (хпДНК), имеющей у покрытосеменных растений материнское наследование. В 17 популяциях было обнаружено 14 гаплотипов. В другой, недавней, работе [20], основанной на ядерных микросателлитах и нуклеотидных последовательностях восьми фрагментов хпДНК общей длиной 2179 пн, были обнаружены шесть гаплотипов у T. cordata и 11 гаплотипов совместно с другим европейским видом T. platyphyllos Scop. Обе работы в основном касались популяций Западной и Центральной Европы, почти не затрагивая более восточные регионы. В Центральной Европе было обнаружено наиболее высокое разнообразие гаплотипов, вероятно обусловленное встречей нескольких миграционных потоков [20]. Предположено существование по крайней мере двух источников реколонизации T. cordata – в Италии и на Балканах [11, 20]. Кроме того, оба исследования предполагают у T. cordata наличие восточного рефугиума. Некоторым основанием для этого было обнаружение в Воронеже так называемого “русского гаплотипа” H4 [11], который не был найден в западных популяциях Европы и значительно отличался от остальных. В работе [20] на существование восточного рефугиума указывало, во-первых, присутствие в Финляндии нового гаплотипа (Hap7), отсутствующего в западных областях, а также отличие по ядерным микросателлитам восточных популяций Центральной Европы от более западных. Среди возможных гипотез о происхождении Hap7, помимо восточного рефугиума, предполагалась его миграция с Кавказа либо миграция через Россию с Балкан [20]. Несомненно, такая неопределенность исходит из недостаточной изученности восточных территорий.
Имеющиеся палеонтологические данные указывают на стабильное присутствие на Русской равнине и на Урале широколиственных видов во всех межледниковьях плейстоцена [21, 22, обзор], хотя таксономическая принадлежность пыльцы липы остается неопределенной. В последний ледниковый максимум (LGM, 24–17 тыс. лет назад) пыльца липы и других широколиственных отмечается для некоторых районов Русской равнины [23, 24], однако возможное происхождение пыльцы в результате переотложения [23, ссылки] не позволяет с определенностью говорить о сохранении этих видов на данной территории во время LGM.
Целью настоящего исследования являются описание филогеографической структуры в восточной части распространения Tilia cordata s. l., проверка гипотезы о восточном рефугиуме липы мелколистной и выявление генетических связей T. cordata и T. sibirica. Для этого с помощью рестриктного анализа и секвенирования была исследована изменчивость пяти фрагментов хлоропластной ДНК в 29 популяциях, расположенных в европейской части России, в Белоруссии, Украине, в Крыму, на Урале и в Сибири. Мы сделали попытку сопоставления выявленной изменчивости хпДНК с результатами других работ [11, 20], а также попытались сравнить наши новые данные с результатами исследования T. cordata и T. sibirica на основе ядерных микросателлитов [18].
МАТЕРИАЛЫ И МЕТОДЫ
Было изучено 29 популяций T. cordata s. l., представляющих восточную часть ареала вида (рис. 1, табл. 1) и расположенных в Белоруссии, на Западной Украине, в европейской части России, на Урале и в Сибири, включая популяции T. sibirica. В Крыму, где описывается как T. cordata, так и спорный таксон T. dasystyla Stev., были собраны две выборки: на горе Кастель (150 м над ур. моря) – T. dasystyla [13] и на склонах г. Ай-Петри (500 м над ур. моря) под пологом сосново-букового леса – T. cordata. Объем выборок составлял от 2 до 26 деревьев, обычно более восьми и в среднем 17.3. Расстояние между отдельными деревьями было не менее 50 м. Выделение геномной ДНК проводилось с помощью CTAB-метода [25] из свежих или высушенных в силикагеле листьев.
Таблица 1.
Характеристика 29 изученных популяций Tilia cordata s. s., T. sibirica (популяционные выборки № 1, 2) и T. dasystyla (№ 28)
| № п/п |
Популяция | Координаты | Объем выборки | Гаплотипы | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| с.ш. | в.д. | t1 | t2 | t3 | t4 | t5 | t6 | |||
| 1 | Кузедеево | 53°19′54′′ | 87°13′59′′ | 23 | 23 | |||||
| 2 | Бия | 52°16′43′′ | 87°07′44′′ | 9 | 9 | |||||
| 3 | Тобольск | 58°18′42′′ | 68°26′54′′ | 25 | 25 | |||||
| 4 | Екатеринбург | 56°53′31′′ | 60°19′34′′ | 29 | 7 | 22 | ||||
| 5 | Комарово | 56°29′22′′ | 58°50′53′′ | 10 | 10 | |||||
| 6 | Чандар | 55°21′27′′ | 56°40′39′′ | 24 | 24 | |||||
| 7 | Уфа | 54°51′41′′ | 55°50′32′′ | 10 | 10 | |||||
| 8 | Юмагузино | 53°01′53′′ | 56°29′50′′ | 25 | 25 | |||||
| 9 | Зилаир | 52°16′55′′ | 57°34′55′′ | 10 | 10 | |||||
| 10 | Малиновка | 51°46′45′′ | 56°50′17′′ | 24 | 24 | |||||
| 11 | Йошкар-Ола | 56°37′27′′ | 47°55′11′′ | 10 | 10 | |||||
| 12 | Нижний Новгород | 55°38′48′′ | 43°35′19′′ | 23 | 2 | 20 | 1 | |||
| 13 | Москва | 55°37′28′′ | 37°33′12′′ | 26 | 3 | 23 | ||||
| 14 | Плющань | 52°49′00′′ | 38°59′00′′ | 24 | 6 | 18 | ||||
| 15 | Морозова гора | 52°36′00′′ | 38°55′00′′ | 19 | 19 | |||||
| 16 | Преображенский монастырь | 52°26′00′′ | 38°58′00′′ | 23 | 23 | |||||
| 17 | Воронеж | 51°43′50′′ | 39°13′28′′ | 25 | 4 | 21 | ||||
| 18 | Брянская обл. | 53°12′00′′ | 34°34′00′′ | 21 | 21 | |||||
| 19 | Ольгино | 59°59′57′′ | 30°01′60′′ | 10 | 1 | 6 | 1 | 1 | 1 | |
| 20 | Сергиевка | 59°53′30′′ | 29°50′16′′ | 19 | 1 | 14 | 4 | |||
| 21 | Луга | 58°52′16′′ | 29°50′56′′ | 26 | 26 | |||||
| 22 | Савино (Новгород) | 58°33′21′′ | 31°26′35′′ | 9 | 8 | 1 | ||||
| 23 | Себежский нац. парк | 56°04′35′′ | 28°20′10′′ | 8 | 8 | |||||
| 24 | Минск | 53°54′42′′ | 27°38′43′′ | 19 | 6 | 13 | ||||
| 25 | Крыжовка | 53°56′58′′ | 27°19′31′′ | 21 | 5 | 9 | 2 | 5 | ||
| 26 | Винники (Львов) | 49°48′23′′ | 24°07′55′′ | 2 | 2 | |||||
| 27 | Креховский монастырь | 50°02′03′′ | 23°47′53′′ | 2 | 2 | |||||
| 28 | Крым, г. Кастель | 44°38′14′′ | 34°23′27′′ | 16 | 16 | |||||
| 29 | Крым, Ай-Петри | 44°29′21′′ | 34°05′46′′ | 11 | 11 | |||||
| Среднее | 17.3 | |||||||||
| Всего | 503 | 117 | 341 | 11 | 27 | 6 | 1 | |||
С помощью метода PCR-RFLP (полиморфизм длин рестриктных фрагментов), в соответствии с [11], было проведено предварительное исследование изменчивости фрагментов хпДНК: CD, HK, DT, K1K2, амплифицированных с использованием универсальных праймеров в соответствии с [26] и обработанных с помощью ректриктаз HinfI и TaqI. При этом использовалась выборка деревьев (96 шт.), представляющая популяции из основных частей ареала. Продукты рестрикции разделяли с помощью электрофореза в 6%-ном полиакриламидном денатурирующем геле с последующим серебряным окрашиванием. Изменчивость показали следующие комбинации фрагмент/рестриктаза: CD/TaqI, CD/HinfI, HK/HinfI, DT/TaqI, K1K2/TaqI, в совокупности позволившие выявить шесть гаплотипов. В связи с неудовлетворительным секвенированием фрагментов CD и HK, амплифицированных с помощью универсальных праймеров [26], нами были разработаны праймеры, специфичные для липы (табл. 2). Кроме того, для полного секвенирования трех из четырех хпДНК-фрагментов были разработаны внутренние праймеры. Для этого были использованы алайнмент пластомов (полных последовательностей хпДНК видов липы), имеющихся в GenBank: T. mandshurica Rupr. & Maxim. – KT894773, T. amurensis Rupr. – MH169579, T. paucicostata Maxim. – KT894775, T. oliveri Szyszyl. – KT894774 [27], и программа Primer 3 [28]. Новые внешние праймеры располагались вблизи сайтов аннилинга универсальных праймеров, поэтому размер фрагментов существенно не изменился и не повлиял на анализ RFLP, что сделало возможным сравнить наши данные с результатами других исследователей [11]. Для сравнения гаплотипов Tilia, полученных в работе [20], с нашими гаплотипами, был секвенирован наиболее изменчивый фрагмент psbJ–petA [29], использованный в [20]. Условия ПЦР для вновь разработанных и универсальных праймеров приведены в табл. 2. ПРЦ-продукты очищали для секвенирования с помощью набора ExoSAP-IT (Affimetrix). Реакция секвенирования проводилась с помощью набора BigDye v. 3.1 (Applied Biosystems), продукты реакции анализировались на автоматическом секвенаторе 3130 Genetic Analyzer (Applied Biosystems). Редактирование и выравнивание полученных последовательностей выполняли вручную в программе BioEdit [30]. Фрагмент psbJ–petA был секвенирован частично, с помощью праймера psbJ, а остальные фрагменты – полностью, для каждого гаплотипа и у нескольких особей (от 1 до 8) – носителей данного гаплотипа, взятых из разных географических регионов (рис. 2).
Таблица 2.
Фрагменты хпДНК, использованные в исследовании Tilia, праймеры и условия ПЦР
| Фрагмент | Праймер | Нуклеотидная последовательность праймера (5'–3') |
Ампли- фикация |
Секвени- рование |
Условия ПЦР | |
|---|---|---|---|---|---|---|
| t (°C) отжига | время элонгации | |||||
| CDt1 | CDt(C) CDt(D) |
GGGGACTGCAAATCCCTTAT TCAGTCCCGACGGATACAAT |
+ + |
+ + |
60 | 3 мин |
| CDt3(D) CDt2(C) CDt2(D) |
AATCCCGAGTTATTGCGAAG TTTTCTTCGTATTTCGTTTCG TGCACACTTACCCCCTGTTT |
+ + + |
||||
| HKt1 | HKt(H) HKt(K) |
TTCACAATCCACTGCCTTGA ATCCGACTAGTTCCGGGTTC |
+ + |
+ + |
60 | 3 мин |
| HKt(2) HKt(3) |
TCTGGTTCACCGCTTTAGGT CATACCAAGGTTAGCACGGTTA |
+ + |
||||
| K1K2 | K1K2(1)2 K1K2(2)2 |
GGGTTGCCCGGGACTCGAAC CAACGGTAGAGTACTCGGCTTTTA |
+ + |
+ + |
53.5 | 3 мин |
| K1K2(3)t3 K1K2(4)t3 |
AGGGGAAGAAGTCGCAAAAT CAGTAGCGAAGGGCTTGAAC |
+ + |
||||
| DT2 | DT(D)2 DT(T)2 |
AACAATTGAACTACAATCCC CTACCACTGAGTTAAAAGGG |
+ + |
+ + |
54.5 | 2 мин |
| psbJ–petA4 | psbJ4 petA4 |
ATAGGTACTGTARCYGGTATT AACARTTYGARAAGGTTCAATT |
+ + |
+ – |
49 | 1 мин |
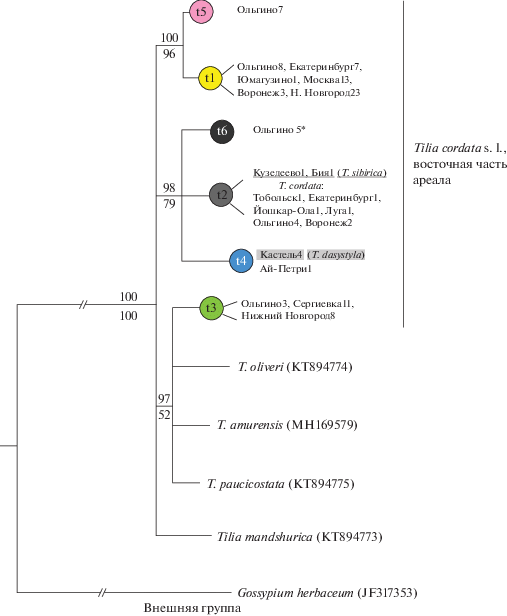
Рис. 2.
Филогенетическое дерево 10 гаплотипов Tilia, построенное с помощью байесовского метода (50%-ный консенсус) на основе нуклеотидных последовательностей пяти фрагментов хпДНК общей длиной 9103 пн. Над линиями приведена статистическая поддержка байесовским методом (значения апостериорной вероятности, %), под линиями – бутстрэп-поддержка (MP, 1000 репликаций). Для гаплотипов (t1–t6) указаны номера образцов, секвенированных для данного гаплотипа из разных популяций. Для гаплотипов восточноазиатских видов лип и для внешней группы приводятся номера пластомов из GenBank. * Гаплотип t6, возможно, принадлежит T. platyphyllos (см. Результаты).
Для филогенетического анализа нуклеотидные последовательности отдельных хлоропластных фрагментов были конкатенированы в общий алайнмент. Кроме шести гаплотипов, встреченных в исследуемой части ареала, в анализ были включены последовательности соответствующих фрагментов восточноазиатских видов лип: T. mandshurica, T. amurensis, T. paucicostata и T. oliveri. В качестве внешней группы был выбран представитель близкородственного Tilia рода хлопчатник (Malvaceae), Gossypium herbaceum L. (JF317353). Филогенетическая реконструкция была произведена с использованием методов максимальной парсимонии (MP) и байесовского подхода (BI). Построение MP-деревьев проводили в программном пакете PAUP*4.0b10 [31] с применением эвристического поиска с опцией ‘MulTrees’ и ‘MaxTrees’ = 500, с использованием алгоритма перестроек ветвей TBR. Для оценки статистической достоверности клад использовали метод бутстрэп с 1000 репликациями. Все признаки были равновзвешены. Пробелы расценивались как пропущенные данные. Инсерции, делеции и инверсии рассматривались как одиночные события и были закодированы как бинарные характеристики (1/0). Байесовский анализ филогении (BI) проводили в программе MrBayes v. 3.1.2 [32] на основе модели нуклеотидных замен GTR + G + I, выбранной с помощью программы Modeltest 3.7 и используя информационный критерий Акаике. Программа MrBayes использовала две MCMC-цепи длиной 10 млн шагов с сохранением каждого 1000-го. Для контроля адекватности длины MCMC-цепей использовали показатель стандартного отклонения частоты расхождения цепей. После 2.5 поколений он стал ниже 0.01, в связи с чем первые 2.5 млн поколений были отброшены как ‘burn-in’. Консенсус-дерево было построено на оставшихся 7.5 млн деревьев. В анализ включены все точковые мутации и инделы, за исключением мутаций числа повторов микросателлитных последовательностей. Для изучения взаимоотношений гаплотипов был также использован подход “reduced median” в программе NETWORK 5.0.1.0 [33].
Поскольку в работе [11] отсутствовали сиквенсные данные, для сравнения наших данных с результатами [11] для каждого фрагмента каждого гаплотипа с помощью BioEdit была построена карта рестриктных фрагментов, которая затем сравнивалась с диаграммами подвижности рестриктных фрагментов, приведенных в [11]. Сравнение с гаплотипами в работе [20] проводилось по таблице полиморфных сайтов [20], так как нуклеотидные последовательности отсутствуют в базе данных GenBank.
Было установлено, что комбинация CD/TaqI (табл. 3) позволяет легко идентифицировать большинство гаплотипов, выявляемых с помощью сиквенсных данных, за исключением уникального гаплотипа t6 из популяции Ольгино, идентичного по подвижности рестриктных бендов гаплотипу t4 (Крым), однако существенно отличавшегося от него по нуклеотидным последовательностям. Это позволило использовать комбинацию CD/TaqI для полномасштабного анализа географического распределения гаплотипов. Такой анализ был проведен для 503 образцов из 29 популяций (рис. 1, табл. 1).
Таблица 3.
Мутации, выявляемые во фрагменте CD методом PCR-RFLP. Определяются пять гаплотипов (t1, t2, t3, t4, t5), гаплотипы t6 и t4 не различаются этим методом
| Комбинация фрагмент/ рестриктаза |
Изменение длин рестриктных фрагментов, пн | Позиция* | Гаплотип | ||||
|---|---|---|---|---|---|---|---|
| t1 | t2 | t3 | t4, t6 | t5 | |||
| CD/TaqI | 471 + 9 ins → 480 | 29 991 | 1 | 0 | 0 | 0 | 0 |
| CD/TaqI | 120 + 327 → 447 | 31 466 | 0 | 0 | 1 | 0 | 0 |
| CD/TaqI | 380 – 6 del → 374 | 30 164 | 0 | 1 | 0 | 0 | 0 |
| CD/TaqI | 359 – 8 del → 351 | 31 107 | 1 | 1 | 0 | 0 | 1 |
* Положение в хлоропластном геноме T. mandshurica, KT894773 [27].
РЕЗУЛЬТАТЫ
При секвенировании пяти фрагментов хпДНК у 20 особей из разных частей ареала и представляющих шесть гаплотипов, выявленных в результате предварительного исследования с помощью рестриктного анализа, дополнительных гаплотипов обнаружено не было. Также не было выявлено новых гаплотипов в ходе полномасштабного популяционного исследования на основе рестриктного анализа. Средняя длина последовательностей фрагментов у T. cordata s. l. составила: CDt – 2522 пар нуклеотидов (пн), HKt – 2001 пн, K1K2 – 2456 пн, DT – 1443 пн, секвенированная часть фрагмента psbJ–petA – 681 пн (табл. 4). Суммарная длина для пяти фрагментов хпДНК у T. cordata s. l. в среднем составила 9103 пн, длина последовательностей после процедуры выравнивания для всех видов вместе с аутгруппой – 9356 пн (табл. 4). Полученные последовательности всех фрагментов для шести гаплотипов Tilia помещены в GenBank (табл. 4). Всего у исследованных образцов T. cordata обнаружено 42 изменчивых признака, из которых 16 точковых мутаций, 16 инверсий и инделов, не связанных с вариацией числа повторов, и 10 микросателлитов (табл. 4). Наиболее изменчивыми оказались фрагменты CDt и HKt (по 15 мутаций), менее изменчивыми – фрагменты K1K2 (5 мутаций), psbJ–petA (4) и DT(3). Образцы, отнесенные с помощью PCR-RFLP к одному гаплотипу, но происходящие из разных частей ареала, при секвенировании полностью совпадали по всем мутациям, включая микросателлиты. Следует отметить, что некоторые микросателлиты были высокоизменчивы (до 4–6 аллелей). Во фрагменте HKt был обнаружен участок со сложным алайнментом, включающим тандемные повторы “TA” и имеющий уникальную последовательность для каждого из шести гаплотипов. Однако внутри гаплотипов у разных особей изменчивости в этом участке также не было обнаружено. Без учета микросателлитов только восемь мутаций были парсимонистически информативными у T. cordata (3 точковые и 5 инделов) и вместе с другими видами липы – 12.
Таблица 4.
Нуклеотидная изменчивость фрагментов хлоропластной ДНК, использованных для филогеографического исследования представителей Tilia
| Фрагмент | Длина алайнмента, пн* |
Средняя длина последовательностей T. cordata, пн |
Число мутаций: точковые/инсерции, делеции, инверсии/ микросателлиты |
Общее число мутаций | Номера последовательностей в GenBank |
|---|---|---|---|---|---|
| T. cordata s. l. и T. dasystyla |
|||||
| CDt | 2571 | 2522 | 5/3/7 | 15 | MK608676–MK608681 |
| HKt | 2070 | 2001 | 4/9/2 | 15 | MK608688–MK608693 |
| K1K2 | 2523 | 2456 | 3/1/1 | 5 | MK608694–MK608699 |
| DT | 1472 | 1443 | 2/1/0 | 3 | MK608682–MK608687 |
| psbJ–petA | 720 | 681 | 2/2/0 | 4 | MK608700–MK608705 |
| Всего | 9356 | 9103 | 16/16/10 | 42 | |
| Всего с восточноазиатскими Tilia |
29/21/13 | 63 |
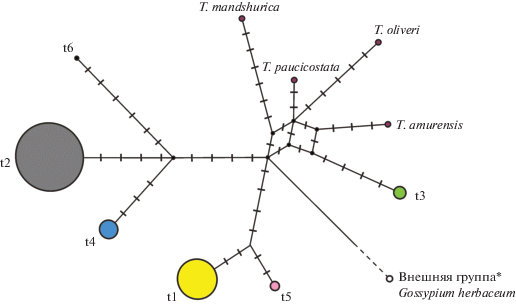
Большинство обнаруженных у T. cordata гаплотипов значительно различаются между собой. Два наиболее распространенных в восточной части ареала гаплотипа (t1 и t2) различаются 19 признаками, в том числе 12 точковыми мутациями и инделами, что сравнимо с различиями между разными видами. Взаимоотношения между гаплотипами иллюстрирует филогенетическая сеть (рис. 3), основная черта которой – расположение гаплотипов на кончиках ветвей, при отсутствии предковых и промежуточных гаплотипов. Кроме того, сеть содержит циклы из-за нескольких гомоплазмичных мутаций.
Рис. 3.
Филогенетическая сеть шести гаплотипов из восточной части ареала Tilia cordata s. l. (t1–t6) и четырех гаплотипов восточноазиатских видов Tilia, построенная на основе нуклеотидных последовательностей пяти фрагментов хпДНК с помощью метода “reduced median” в программе NETWORK [33]. Площадь кругов пропорциональна частоте гаплотипов. Черные поперечные линии обозначают мутации. * При построении филогенетической сети не учитывались мутации, специфичные для внешней группы.
Филогенетические деревья (MP, BI) оказались сходными между собой и с сетью гаплотипов. На рис. 2 представлено байесовское дерево (BI), с указанием значений статистических поддержек клад обоих деревьев. Разрешения дерева в базальной части нет, гаплотипы T. cordata не образуют монофилетическую группу и входят в три разные клады. Наиболее распространенный в восточной части ареала гаплотип t2 объединяется с крымским гаплотипом t4 и уникальным t6 (поддержка 98%/79%, BI и MP). Общее происхождение обнаруживают гаплотипы t1 и t5 (поддержка 100/96). Один из гаплотипов (t3) входит с невысокой поддержкой в кладу (97/52), общую с тремя восточноазиатскими видами (T. amurensis, T. oliveri, T. paucicostata). Гаплотип T. mandshurica не образовал поддержанной клады с другими гаплотипами.
В результате анализа большого числа образцов (503 шт.) получено частотное распределение шести гаплотипов липы в восточной части ареала (рис. 1). Гаплотип t2 (68%, 341 образец в 21 выборке) географически наиболее распространен: от Сибири и Зауралья, где фиксирован, до северо-запада России и Белоруссии, где доминирует в большинстве выборок. Второй по частоте гаплотип t1 (23%, 117 шт. в 14 выборках) распределен неравномерно от Урала до Западной Украины. Обычно его доля значительно меньше, чем t2, однако в некоторых районах гаплотип t1 преобладает. В большинстве случаев в исследованной части ареала встречаются один–два гаплотипа. В западном направлении (в Ленинградской, Новгородской областях, Белоруссии, Украине) гаплотипическое разнообразие увеличивается. Помимо частых гаплотипов (t1 и t2) там появляются новые: t3 – 2.2% (11 особей в шести популяциях), t5 – 1.2% (шесть в двух популяциях), t6 – 0.2% (одна особь), однако присутствие гаплотипа t3 отмечено далеко восточнее его основного ареала – в Нижнем Новгороде (одна особь). Генетически наиболее разнообразными оказались выборки на северо-западе России (Ольгино, пять гаплотипов) и в Белоруссии (Крыжовка, четыре гаплотипа). Наконец, в обеих выборках из Крыма фиксирован гаплотип t4.
При сравнении наших данных с гаплотипами, выделенными при PCR-RFLP анализе в работе [11], было установлено, что наиболее частый в восточных районах “наш” гаплотип t2, несомненно, совпадает с так называемым “русским гаплотипом” (H4) [11]. Также секвенированием фрагмента psbJ–petA подтверждено соответствие t2 гаплотипу Hap7 [20] (мутация С, позиция 503 по [20]). Второй по частоте “наш” t1 не совпадает по сочетанию рестриктных бендов с гаплотипами, описанными в [11]. Он также не совпадает (мутация G, позиция 391) ни с одним из гаплотипов, обнаруженных в Европе в работе [20]. Гаплотип t5 совпал с Hap5 [20] (делеция 32 пн, позиция 514–546). Гаплотип t3 соответствует как Hap1, так и Hap3 [20]. Уникальный гаплотип t6 совпал с Hap10 (делеция 5 пн в поз. 368–372, мутация C, поз. 503), который был отмечен в Зап. Европе, Франции, Англии у T. platyphyllos [20]. Так как в нашей работе при анализе 29 популяций гаплотип t6 не был обнаружен больше нигде, то мы предполагаем его заносное происхождение в выборке Ольгино, которая собиралась в ООПТ “Северное побережье Невской губы” в естественном насаждении, однако по соседству с парком “Ближние Дубки”, где сохранилось большое количество интродуцированных деревьев и кустарников, в том числе отмечается липа крупнолистная (T. platyphyllos).
ОБСУЖДЕНИЕ
В ходе исследования впервые изучена изменчивость хлоропластной ДНК и впервые выявлена филогеографическая структура T. cordata s. l. на Русской равнине, на Урале и в Сибири (рис. 1), позволяющая сделать предположения об истории данного вида в восточной части ареала.
Глубокая филогенетическая дивергенция гаплотипов хлоропластной ДНК отражает историю T. cordata s. l.
Сеть гаплотипов (рис. 3) и филогенетическое дерево (рис. 2) хпДНК T. cordata и родственных ей евроазиатских лип имеют особенности: глубокую дивергенцию гаплотипов, отсутствие “star-like” структур, т.е. полное отсутствие редких гаплотипов, филогенетически близких к каким-либо частым, отсутствие монофилии T. cordata, малое число филогенетически информативных мутаций и низкое разрешение, несмотря на значительную дивергенцию гаплотипов. Отсутствие монофилии хпДНК евроазиатских лип, в отличие от американских видов, отмечалось ранее при исследовании филогении рода [20, 34], что объясняется авторами неполной фиксацией предкового полиморфизма, исторической гибридизацией, сопровождавшейся интрогрессией хпДНК, а также увеличенной способностью липы к вегетативному размножению и как следствие – к длительному существованию клонов и медленному накоплению мутаций, что ведет к отсутствию топологического разрешения в отдельных частях филогенетического дерева [20]. С нашей точки зрения, причиной указанных особенностей является длительное существование липы мелколистной в нескольких изолированных друг от друга ледниковых рефугиумах, малый размер популяций которых ведет к фиксации в них изменчивости и препятствует возникновению “star-like” структур, а изоляция рефугиумов друг от друга исключает фиксацию одного из гаплотипов в масштабах всего вида. В то же время недостаточно сильные репродуктивные барьеры делают отдельные линии хлоропластной ДНК почти независимыми от границ видов, что обусловливает отсутствие монофилии гаплотипов внутри видов Tilia. Так, европейские виды лип T. cordata и T. platyphyllos имеют значительное число общих гаплотипов хпДНК [20], вероятно, в результате сохранения как предкового полиморфизма, так и гибридных контактов. Последнее подтверждается сходством в географическом распространении общих гаплотипов [20]. Низкое разрешение филогенетического дерева хпДНК у липы мелколистной и в целом у европейских лип может быть следствием быстрого формирования основных клад в результате проникновения предкового вида в Западную Палеарктику с последующей географической дифференциацией и сохранением первоначально возникших генетических линий.
Географическое распределение изменчивости хпДНК соответствует существованию рефугиумов в восточной части ареала липы мелколистной
Восточная часть ареала T. cordata по составу гаплотипов резко отличается от западной. Если в Западной и Центральной Европе обнаружено с использованием разных маркеров хпДНК 16 [11] и 5 [20] гаплотипов, то на Русской равнине, на Урале и в Сибири преобладают только два (рис. 1). Наиболее частый на востоке гаплотип t2 соответствует гаплотипу H4 из Воронежа в работе [11]. За пределами России, включая ближайшую к Воронежу изученную популяцию (Словакия), H4 не был обнаружен. Гаплотип t2 также соответствует Hap7 из Восточной Финляндии в работе [20], который нигде больше не встретился, включая наиболее восточные популяции на юге Польши и в Западной Украине. Второй из преобладающих на востоке гаплотип t1 не совпал ни с одним из гаплотипов, выявленных в работах других авторов [11, 20]. Таким образом, с учетом этих данных, гаплотипы t1 и t2 с большой долей вероятности отсутствуют в Центральной и Западной Европе, на западе доходя до Белоруссии, северо-запада России и Западной Украины. Очевидно, что наблюдаемая картина соответствует колонизации восточной территории из рефугиумов, располагавшихся in situ в данной части ареала. Небольшие количества пыльцы широколиственных, найденные в отложениях LGM, свидетельствуют о возможности сохранения на Русской равнине рефугиумов неморальной флоры, которые могли находиться в речных долинах и на склонах возвышенностей [23, 24]. Быстрое появление пыльцы Tilia во многих местах Русской равнины (рис. 1), в том числе в достаточно северных областях и в Предуралье в период позднеледниковья (17–12.5 тыс. лет назад) [23], еще раз свидетельствует об автохтонности липы мелколистной в восточной части ареала.
В популяциях западной части исследуемой территории (северо-запад России, Белоруссия и Западная Украина) происходит резкое увеличение гаплотипического разнообразия за счет появления гаплотипов t3 и t5. Гаплотип t5, встреченный на северо-западе России и в Белоруссии, соответствует Hap5 из [20], найденному в регионе Карпат, t3 соответствует Hap1/Hap3 [20], которые встречены там же. Однако кроме одной выборки из Западной Украины во всех популяциях содержатся также “восточные” гаплотипы (t1, t2). Следовательно, можно предположить колонизацию этих территорий из двух источников. Гаплотипы t5 и t3, распространенные в Западной Украине, на юге Польши, в Чехии и в Венгрии [20], маркируют миграцию липы из Карпат на север и северо-запад, что совпадает с направлением колонизации другими древесными породами, например дубом черешчатым и сосной обыкновенной [2, 9]. Продвижение “западных гаплотипов” на восток ограничено, начиная примерно с меридиана 32° в.д. они практически исчезают в популяциях липы мелколистной. Западная граница распространения “восточных” гаплотипов и граница миграции из восточных рефугиумов на запад еще не до конца определена и, вероятно, проходит по Украине, Польше, Прибалтике и Финляндии.
На Урале установлены отличие популяций Южной Башкирии от более северных популяций и фиксация в них гаплотипа t1 (рис. 1). Возможно, это обусловлено разной историей липы в этих районах, например разными путями колонизации или присутствием на Южном Урале нескольких изолированных друг от друга рефугиумов. По некоторым палеоданным липа отмечалась в фазах LGM на западном склоне Южного Урала [21, 22, обзор] и быстро распространилась в голоцене [23]. Для многих европейских неморальных видов их существование на Урале постулируется на протяжении большей части плейстоцена, исходя из флористических данных [22], однако недостаток датированных палеоботанических находок, относящихся к LGM, оставляет вопрос открытым.
Филогеографические исследования некоторых представителей умеренных и бореальных лесов Северной Евразии – сосны обыкновенной [9], ольхи серой [7], вереска обыкновенного [6], лиственницы сибирской [35], пихты сибирской [36] демонстрируют наличие рефугиумов на Урале или на Русской равнине, что означает возможность существования на Урале рефугиумов и для широколиственных деревьев.
Взаимоотношение липы мелколистной с близкими таксонами
В работе [18], посвященной демографической истории лип мелколистной и сибирской и основанной на ядерных микросателлитных локусах, была установлена глубокая дифференциация (оцененная как средний плейстоцен) исследованных популяций на две однородные группы: первая, располагающаяся на западе – от Западной Европы до Нижнего Иртыша (соответствует T. cordata), и вторая – на юге Сибири (соответствует T. sibirica). С другой стороны, гаплотип t2, отсутствующий у T. cordata в Центральной и Западной Европе и доминирующий, по нашим данным, в Восточной Европе, на Среднем Урале и в Зауралье, фиксирован у T. sibirica. Это может означать длительное существование гаплотипа t2 в Восточной Европе и Сибири, указывая на родственные связи липы в данных регионах.
Представляется маловероятным, что гаплотип t2 был получен обоими таксонами липы от общего предка, поскольку со времени дивергенции двух видов между гаплотипом t2 в Восточной Европе и гаплотипом t2 в Южной Сибири могли бы накопиться различия, которых, однако, не наблюдается даже по быстро мутирующим микросателлитам хпДНК. Другой гаплотип (t1), хотя и отсутствует в Сибири, но широко распространен на Урале и в Восточной Европе, отсутствуя в Центральной и Западной Европе. Мы полагаем, что наиболее правдоподобная интерпретация географического распределения гаплотипов t2 и t1 состоит в их принадлежности сибирской липе, в неблагоприятные периоды плейстоцена сохранявшейся в рефугиумах Южной Сибири и/или Урала и/или Русской равнины. Расселение липы сибирской при улучшении климата в позднем плейстоцене привело к ее распространению по Русской равнине. При дальнейшем потеплении началась экспансия европейской T. cordata, которая благодаря лучшей адаптации к теплому климату начала расселяться на восток, вытесняя сибирскую липу. Оба вида являются близкими родственниками, и вытеснение сибирской липы сопровождалось опылением ее деревьев пыльцой европейской T. сordata и интрогрессивной гибридизацией. Поскольку хлоропластная ДНК у покрытосеменных растений наследуется по материнской линии (и не передается с пыльцой), гаплотипы сибирской липы сохранились у гибридов, несмотря на доминирование ядерных генов европейского вида. Механизм такого замещения описан в работе [37]. Процесс вытеснения сибирской липы липою мелколистной дошел до юга Западно-Сибирской равнины, где липа имеет крайне спорадическое распространение [16], что позволило сохраниться на Алтае и в Кузнецком Алатау автохтонным популяциям сибирской липы. Ранее захват чужой хпДНК путем интрогрессивной гибридизации предполагался при объяснении несовпадения ядерной и хлоропластной филогений рода Tilia [20], следовательно он может быть реализован и на примере видов T. cordata и T. sibirica, родственных по хпДНК, но различающихся по ядерным маркерам.
Родственность гаплотипа t2 крымскому гаплотипу t4 и гаплотипу T. platyphyllos (t6) и значительная обособленность этой линии (рис. 2, 3), возможно, указывают на их древнее происхождение в западно-азиатской части ареала рода Tilia. Крымский гаплотип t4 в основном ареале липы не найден. Содержащие его образцы T. cordata и T. dasystyla из двух крымских популяций не показали различий между собой. Он достаточно дивергентен от других гаплотипов, принадлежащих данной кладе. Дальнейшее исследование генетической изменчивости липы в крымско-кавказском регионе, где выделяется несколько спорных таксонов и возможных гибридов [13], представляет большой интерес.
Авторы благодарят Е.Г. Филиппова, Л.И. Агафонова, Ю.Я. Хрунык, Б.К. Ганнибала, Г.Ю. Конечную, Е.В. Хантемирову, В.В. Кукарских, Е.В. Зиновьева за участие в сборе образцов липы, а также М.В. Модорова, А.И. Цивилева, К.А. Паниковскую, Н.В. Семерикова за помощь в лабораторных анализах и анонимного рецензента за конструктивные замечания.
Работа выполнена в рамках государственного задания Института экологии растений и животных УрО РАН и при финансовой поддержке РФФИ, проект № 18-04-01061A.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Hewitt G.M. Some genetic consequences of ice ages, and their role in divergence and speciation // Biol. J. Linnean Soc. 1996. V. 58. № 3. P. 247–276. https://doi.org/10.1111/j.1095-8312.1996.tb01434.x
Petit R.J., Csaikl U.M., Bordacs S. et al. Chloroplast DNA variation in European white oaks – phylogeography and patterns of diversity based on data from over 2600 populations // Forest Ecol. Management. 2002. V. 156. № 1–3. P. 5–26. https://doi.org/10.1016/S0378-1127(01)00645-4
Heuertz M., Carnevale S., Fineschi S. et al. Chloroplast DNA phylogeography of European ashes, Fraxinus sp. (Oleaceae): roles of hybridization and life history traits // Mol. Ecol. 2006. V. 15. № 8. P. 2131–2140. https://doi.org/10.1111/j.1365-294X.2006.02897.x
Giesecke T., Brewer S. Notes on the postglacial spread of abundant European tree taxa // Veget. History Archaeobotany. 2018. V. 27. № 2. P. 337–349. https://doi.org/10.1007/s00334-017-0640-0
Magri D., Vendramin G.G., Comps B. et al. A new scenario for the Quaternary history of European beech populations: palaeobotanical evidence and genetic consequences // New Phytologist. 2006. V. 171. № 1. P. 199–221. https://doi.org/10.1111/j.1469-8137.2006.01740.x
Санников С.Н., Петрова И.Н., Дымшакова О.С., Черепанова О.Е. Генетическая и фенотипическая дифференциация притобольских и европейских популяций Calluna vulgaris (L.) Hull. // Генетика. 2014. Т. 50. № 9. С. 1050–1058.
Mandak B., Havrdova A., Krak K. et al. Recent similarity in distribution ranges does not mean a similar postglacial history: a phylogeographical study of the boreal tree species Alnus incana based on microsatellite and chloroplast DNA variation // New Phytologist. 2016. V. 210. № 4. P. 1395–1407. https://doi.org/10.1111/nph.13848
Pyhäjärvi T., Salmela M.J., Savolainen O. Colonization routes of Pinus sylvestris inferred from distribution of mitochondrial DNA variation // Tree Genet. Genom. 2008. V. 4. № 2. P. 247–254. https://doi.org/10.1007/s11295-007-0105-1
Semerikov V.L., Semerikova S.A., Putintseva Y.A. et al. Colonization history of Scots pine in Eastern Europe and North Asia based on mitochondrial DNA variation // Tree Genet. Genom. 2018. V. 14. № 1. https://doi.org/10.1007/s11295-017-1222-0
Volkova P.A., Schanzer I.A., Soubani E. et al. Phylogeography of the European rock rose Helianthemum nummularium s. l. (Cistaceae): western richness and eastern poverty // Plant Syst. Evol. 2016. V. 302. № 7. P. 781–794. https://doi.org/10.1007/s00606-016-1299-1
Fineschi S., Salvini D., Taurchini D. et al. Chloroplast DNA variation of Tilia cordata (Tiliaceae) // Canad. J. Forest. Res. 2003. V. 33. № 12. P. 2503–2508. https://doi.org/10.1139/X03-179
Havrdova A., Douda J., Krak K. et al. Higher genetic diversity in recolonized areas than in refugia of alnus glutinosa triggered by continent-wide lineage admixture // Mol. Ecol. 2015. V. 24. № 8. P. 4759–4777. https://doi.org/10.1111/mec.13348
Флора СССР. Т. 15. М.; Л.: Изд-во АН СССР, 1949. 745 с.
Васильев И.В., Связева О.А. Сем. Tiliaceae Juss. – Липовые // Ареалы деревьев и кустарников СССР. Л.: Наука, 1986. Т. 3. С. 85–89.
Рысин Л.П. Липовые леса русской равнины. М.: Т-во науч. изд. КМК, 2014. 194 с.
Науменко Н.И. Островное местонахождение Tilia cordata Mill. в лесостепи Тобол-Ишимского междуречья: к 45-летию работы П.Л. Горчаковского о западносибирском крыле ареала липы мелколистной // Вестн. Удмуртского ун-та. 2009. № 2 (серия 6). P. 49–60.
Хлонов Ю.П. Липы и липняки Западной Сибири. Новосибирск: РИСО СО АН СССР, 1965. 154 с.
Logan S.A., Chytry M., Wolff K. Genetic diversity and demographic history of the Siberian lime (Tilia sibirica) // Perspect. Plant Ecol. Evol. Syst. 2018. V. 33. P. 9–17. https://doi.org/10.1016/j.ppees.2018.04.005
Pigott C.D. Lime-trees and Basswoods: A Biological Monograph of the Genus Tilia. N.Y.: Cambr. Univ. Press, 2012. 395 p.
Phuekvilai P. Relicts, refugia, and reticulation: a study of population history, hybrids and phylogeny in the long-lived flowering tree genus Tilia: Thesis… for the degree of Doctor of Philosophy. Newcastle Univ., 2014. 172 p.
Гричук В.П. История флоры и растительности русской равнины в плейстоцене. М.: Наука, 1989. 183 с.
Куликов П.В. Конспект флоры Челябинской области (сосудистые растения). Екатеринбург–Миасс: Геотур, 2005. 537 с.
Эволюция экосистем Европы при переходе от плейстоцена к голоцену (24–8 тыс. л. н.) / Отв. ред. Маркова А.К., ван Кольфсхотен Т. М.: Тов-во науч. изд. КМК, 2008. 556 с.
Markova A.K., Simakova A.N., Puzachenko A.Y. Ecosystems of Eastern Europe at the time of maximum cooling of the Valdai glaciation (24–18 kyr BP) inferred from data on plant communities and mammal assemblages // Quaternary Intern. 2009. V. 201. P. 53–59. https://doi.org/10.1016/j.quaint.2008.05.020
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. № 6. P. 673–679. https://doi.org/10.1007/BF00226088
Demesure B., Sodzi N., Petit R.J. A set of universal primers for amplification of polymorphic noncoding regions of mitochondrial and chloroplast DNA in plants // Mol. Ecol. 1995. V. 4. № 1. P. 129–131. https://doi.org/10.1111/j.1365-294X.1995.tb00201.x
Cai J., Ma P.F., Li H.T., Li D.Z. Complete plastid genome sequencing of four Tilia species (Malvaceae): a comparative analysis and phylogenetic implications // PLoS One. 2015. V. 10. № 11. https://doi.org/10.1371/journal.pone.0142705
Rozen S., Skaletsky H.J. Primer 3 on the WWW for general users and for biologist programmers // Bioinformatics Methods and Protocols: Methods in Molecular Biology / Eds Krawetz S., Misener S. Totowa, NJ: Humana Press, 2000. P. 365–386.
Shaw J., Lickey E.B., Schilling E.E., Small R.L. Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: the tortoise and the hare III // Am. J. Botany. 2007. V. 94. № 3. P. 275–288. https://doi.org/10.3732/ajb.94.3.275
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids Symp. Series. 1999. V. 41. P. 95–98.
Swofford D.L. PAUP*. Phylogenetic analysis using parsimony (* and other methods). Version 4.0 beta10. Sunderland: Sinauer Associates, Massachusetts, 2002.
Ronquist F., Huelsenbeck J.P. MrBAYES 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. № 12. P. 1572–1574. https://doi.org/10.1093/bioinformatics/btg180
Bandelt H.J., Forster P., Röhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48. https://doi.org/10.1093/oxfordjournals.molbev.a026036
McCarthy D.M., Mason-Gamer R.J. Chloroplast DNA-based phylogeography of Tilia americana (Malvaceae) // Systematic Botany. 2016. V. 41. № 4. P. 865–880. https://doi.org/10.1600/036364416X693964
Semerikov V.L., Semerikova S.A., Polezhaeva M.A. et al. Southern montane populations did not contribute to the recolonization of West Siberian plain by Siberian larch (Larix sibirica): a range-wide analysis of cytoplasmic markers // Mol. Ecol. 2013. V. 22. № 19. P. 4958–4971. https://doi.org/10.1111/mec.12433
Semerikov V.L., Semerikova S.A., Putintseva Y.A. et al. Mitochondrial DNA in Siberian conifers indicates multiple post-glacial colonization centers // Can. J. Forest Res. 2019. V. 49. № 8. P. 875–883. (принята в печать, на online журнала). https://doi.org/10.1139/cjfr-2018-0498
Currat M., Ruedi M., Petit R.J., Excoffier L. The hidden side of invasions: massive introgression by local genes // Evolution. 2008. V. 62. № 8. P. 1908–1920. https://doi.org/10.1111/j.1558-5646.2008.00413.x
Дополнительные материалы отсутствуют.


