Генетика, 2020, T. 56, № 3, стр. 302-312
Сравнительная характеристика трансгенных растений табака, несущих гетерологичные защитные растительные гены разного происхождения
Н. В. Хадеева 1, Е. Ю. Яковлева 1, Т. В. Коростылева 1, *, Е. А. Истомина 1, Я. Е. Дунаевский 2, К. В. Сидорук 3, М. А. Белозерский 2, Т. И. Одинцова 1, В. Г. Богуш 3, А. М. Кудрявцев 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Московский государственный университет им. М.В. Ломоносова, Научно-исследовательский институт
физико-химической биологии им. А.Н. Белозерского
119992 Москва, Россия
3 Государственный научно-исследовательский институт генетики
и селекции промышленных микроорганизмов
117545 Москва, Россия
* E-mail: tatkor@vigg.ru
Поступила в редакцию 02.04.2019
После доработки 15.05.2019
Принята к публикации 30.05.2019
Аннотация
С целью изучения возможности создания устойчивых к фитопатогенам форм растений получена новая коллекция трансгенных растений модельной культуры (табака) с защитными растительными генами: пополнена коллекция растений с геном ингибитора сериновых протеиназ гречихи (ISP) в составе нескольких векторных конструкций с фрагментами гена паутины в качестве возможного энхансера. Получены трансгенные растения табака с геном wamp-1 гевеиноподобного пептида из синтетического вида пшеницы Triticum kiharae и геном дефензина Sm из звездчатки Stellaria media. Трансгенные растения получали методом агробактериальной трансформации. Сравнительное исследование физиологических характеристик трансгенных растений проводили в биотестах in vivo (на изолированных листьях) и in vitro (в луночных биотестах). В зависимости от дизайна конструкции целевой ген в разной степени экспрессировался в тканях трансгенных растений и их семенного и вегетативного потомства, а также придавал их тканям антибактериальную активность, свидетельствующую о синтезе функционального белка. Введение гетерологичных растительных генов разной природы, используемых растением в разных механизмах защиты от фитопатогенов, приводило к примерно одинаковому повышению фитопатогенной активности тканей трансгенных растений табака.
Как известно, идентификация функций генов базируется на анализе фенотипических различий между мутантными формами и диким типом. В этом смысле коллекции инсерционных мутантов могут служить основой для работ по “прямой” и “обратной” генетике. Неотъемлемыми компонентами механизмов защиты растений от вредителей и болезней являются разнообразные вещества белковой природы. В их число входят дефензины, а также некоторые ферменты, например, такие как 1,3-глюканазы, хитиназы, протеазы, ингибиторы протеолитических ферментов и ряд других. Защитные гены растений обладают широким спектром антимикробного действия и эти гены могут быть непосредственно встроены в геном чувствительных к патогенам растений с использованием методов генетической инженерии. Опубликовано большое число работ по получению повышенной устойчивости к фитопатогенам и вредителям при введении разных растительных генов в другие виды растений. В них демонстрируется экспрессия таких белков в клетках других видов и их защитный эффект [1–4]. Положительной чертой введения защитного гетерологичного трансгена является то, что его влияния на качественный состав растения-реципиента либо не наблюдается, либо оно даже меньше, чем при обычном скрещивании [5, 6].
В то же время в ряде исследований на трансгенных растениях табака на примере маркерного nptII гена показано, что гетерологичные гены в новом окружении растительного генома могут отличаться по уровню его экспрессии. Кроме того, их экспрессия может меняться при инбридинге, при этом наблюдаются отклонения от менделевского расщепления [7, 8]. Таким образом, несмотря на определенные успехи, потенциал растительных защитных генов изучен далеко не полностью. Получение коллекций трансгенных растений с разнообразными введенными генами вызывает необходимость изучения экспрессии и наследования трансгенов в потомстве, а также взаимосвязи между местом встраивания и функцией соответствующего целевого гена.
Ранее в НИИ физико-химической биологии им. А.Н. Белозерского была определена полная аминокислотная последовательность гена ингибитора сериновых протеиназ из гречихи и на этой основе синтезирован ген ISP, введенный в векторную конструкцию [9]. Полученные нами ранее с использованием данного вектора трансформанты растений трех видов (табак, картофель и арабидопсис), несущие данный ген (ISP), продемонстрировали повышение фитопатогенной активности тканей по сравнению с нетрансформированными или трансформированными векторной конструкцией без целевого гена растениями, но выявили межвидовые различия по спектру физиологический активности и количеству морфологический мутаций [10–13]. Вышеизложенное свидетельствует о том, что коллекции инсерционных мутантов с различными гетерологичными защитными генами растений являются ценным ресурсом для изучения функций генов и их регуляции [14].
Представляло интерес повышение фитопатогенной активности введенного гена ISP в тканях трансгенных растений и сравнение ее с фитопатогенной активностью защитных растительных генов другой природы. По предварительным данным, полученным К.В. Сидоруком на дрожжах, участки генов могли служить энхансерами для синтеза целевого гена ISP. Ранее было показано, что синтетический ген спидроина 1 не требует модификаций для экспрессии в растениях. Растения были способны поддерживать в своем геноме синтетические гены белков паутины и осуществлять синтез соответствующих белковых продуктов. Эффективность экспрессии этих генов и уровень накопления их продукта зависели от силы промотора, количества повторов, органоспецифичности и вида растения [15, 16].
С целью сравнения эффекта введения других растительных защитных генов для трансформации табака использовали гены антимикробных пептидов (АМП) – дефензина звездчатки Sm (Stellaria media) и противомикробного пептида WAMP из Triticum kiharaе, полученных и охарактеризованных ранее в лаборатории молекулярно-генетических основ иммунитета растений ИОГен РАН [17–20].
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал
Объектом исследования служили трансгенные растения табака (Nicotiana tabacum L.) сорта Самсун с геном ингибитора сериновых протеиназ (BWI-1a) из семян гречихи (ISP) [9], полученные ранее [10, 11]. Для новых циклов трансформации использовали также новые варианты конструкций на основе использованной ранее и содержащей целевой ген ISP, в которые были введены дополнительные гены спидроина: 2s – участок гена спидроина № 1, вариант Е, повторен два раза, 4s – участок гена спидроина № 1, вариант Е, повторен четыре раза. Трансформацию и получение трансгенных растений проводили по отработанной и описанной ранее методике [11, 12].
Кроме того, для трансформации табака были созданы новые векторные конструкции с геном дефензина звездчатки Sm (линии Sm) и геном противомикробного пептида WAMP из Triticum kiharae в двух модификациях: препропептида (W) и сочетания сигнального и зрелого пептида (SHP линии). Векторные конструкции были созданы на основе плазмиды pORE04 и содержали маркерный ген неомицин фосфотрансферазы nptII, а также целевые защитные гены под сильным конститутивным 35S промотором вируса мозаики цветной капусты (рис. 1).
Рис. 1.
Схемы векторных конструкций с генами дефензина Sm из звездчатки и гена WAMP из Triticum kiharae (рORE-SmD, рORE-W, рORE-SHP). SP – область гена, кодирующая сигнальный пептид, CD – область гена, кодирующая С‑концевой продомен. Sm-D1 и WAMP1 – области гена, кодирующие зрелый пептид. PENTCUP2 – криптический конститутивный промотор табака. Р35SCaMV – 35S промотор из вируса мозаики цветной капусты CaMV. TNos – терминатор гена нопалинсинтазы, nptII – ген устойчивости к канамицину. RB и LB – сайты встраивания в растительный геном. N – сайт рестрикции NotI, K – сайт рестрикции KpnI.
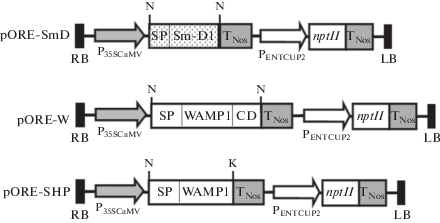
Эти гены были получены и охарактеризованы ранее в лаборатории молекулярно-генетических основ иммунитета растений ИОГен РАН [17–20].
Проверка наличия гена nptII и целевых генов в трансгенных растениях
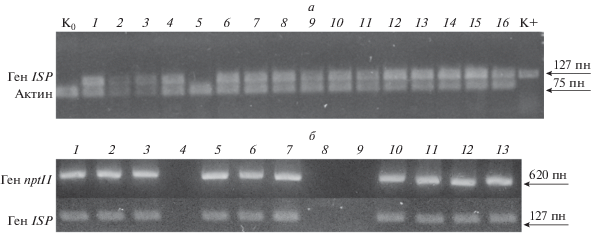
Проверку наличия трансгенной вставки гена ингибитора протеиназ гречихи (ингибитор трипсина) и генов АМП в трансгенных растениях табака проводили методом мультиплексной ПЦР, в которой одновременно используют более одной пары олигонуклеотидных праймеров, что приводит к коамплификации нескольких ДНК-матриц. С одной пары праймеров амплифицируется фрагмент целевого гена, а со второй пары амплифицируется фрагмент гена домашнего хозяйства, используемый в качестве внутреннего контроля на прохождение реакции в данной пробе, для исключения ложноотрицательного результата ПЦР. В качестве гена домашнего хозяйства мы использовали ген β-актина табака. ДНК выделяли из верхних листьев трансгенных растений одной линии. Выделенную ДНК использовали в качестве матрицы для ПЦР со специфическими праймерами к целевому гену ISP (ISP-Dir 5'-GAGAACGAAGATGTGCGCG-3' и ISP-Rev 5'-ACATCACCACTGGGGTGTC-3', в результате ПЦР синтезируется продукт длиной 127 пн) и к гену актина табака (TOB-Act-For 5'-CTGGCATTGCAGATCGTATGA-3' и TOB-Act-Rev 5'-GCGCCACCACCTTGATCTT-3'), в результате ПЦР синтезируется продукт длиной 75 пн. Наличие в трансгенных растениях маркерного гена nptII проводили со специфическими праймерами к гену nptII (nptII-Dir 5'-GCCAACGCTATGTCCTGATA-3' и nptII-Rev 5'-TATTCGGCTATGACTGGGCA-3', в результате ПЦР синтезируется продукт длиной 620 пн). ПЦР проводили, используя набор ПЦР ScreenMix (Евроген, Россия) на амплификаторе Mastercycler Eppendorf по программе: предденатурация – 94°С, 5 мин; 38 циклов (94°С – 30 с; 60°С – 20 с; 72°С – 40 с), и доамплификация 72°С – 3 мин. Продукты амплификации разделяли в 3%-ном агарозном геле (для мультиплексной ПЦР) и 1%-ном геле (для ПЦР на ген nptII). Накопление продуктов ПЦР оценивали по интенсивности свечения фрагментов ДНК в проходящем УФ-свете.
Для доказательства экспрессии целевых генов АМР, ISP и гена nptII в семенном потомстве из отдельных растений была выделена РНК с помощью реагента ExtractRNA (Евроген), проведен синтез кДНК (использовали набор с обратной транскриптазой Mint (Евроген)), и поставлена ПЦР со специфическими праймерами к соответствующему целевому гену и гену nptII.
Бактериальные культуры
В луночных биотестах тестирование устойчивости к бактериальному заражению проводили с использованием штаммов нескольких фитопатогенных бактерий: Pseudomonas syringae pv. tomatoe, Erwinia carotowora, Clavibacter michiganensis pv. michiganensis, любезно предоставленных кафедрой защиты растений Российского государственного аграрного университета – Московской сельскохозяйственной академии им. К.А. Тимирязева.
Определение антибактериальной активности тканей
Для посева газона использовали 18-часовые культуры бактерий, выращенных в жидкой среде LB. В чашках Петри с агаризованной средой LB и посеянным ex tempore газоном соответствующей бактерии стерильным сверлом для резиновых пробок диаметром 0.5 см делали 8–10 лунок. Лунки заполняли одинаковыми по массе гомогенатами тканей асептических растений или равными объемами бесклеточных экстрактов. Учет зон подавления роста бактерий вокруг лунок учитывали через 24 и/или 48 ч.
В биотестах с изолированными листьями их помещали во влажную камеру, наносили повреждения стерильным скальпелем и вносили в них по одной капле ночной культуры эрвинии (Erwinia carotovora). Учет реакции проводили через 18–20 ч.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Полученная нами ранее коллекция трансгенных растений табака с геном ингибитора трипсина из гречихи показала возможность повышения устойчивости к фитопатогенам за счет введения одного из гетерологичных защитных генов растений [10, 11]. Целью дальнейшей работы было также изучение возможности повышения уровня экспрессии целевого антимикробного пептида в трансгенных растениях. Ген ISP был включен в состав векторных конструкций, несущих в качестве маркера ген устойчивости к канамицину nptII. В отличие от исходной, новые конструкции содержали дополнительные элементы (участки гена спидроина). Как упоминалось выше, по предварительным данным, полученным на дрожжах, эти фрагменты могли действовать как энхансеры и усилить экспрессию целевого гена. В результате агробактериальной трансформации с каждым вариантом векторной конструкции были получены новые серии трансгенных растений табака с геном ингибитора протеиназ гречихи BWI-1a (ISP). На основе отбора на селективных средах с канамицином (150 мг/л) с последующей проверкой ДНК-трансформантов посредством ПЦР отобраны растения, содержащие соответствующие вставки.
Представляло интерес сравнение фитопатогенной активности тканей трансгенных растений при введении гетерологичных защитных генов разной природы. С этой целью для трансформации табака были выбраны также ген дефензина из звездчатки (Sm) и защитный ген wamp из Triticum kiharae. Для изучения защитного эффекта генов АМП были получены новые векторные конструкции, которые использовали для агробактериальной трансформации. Кроме маркерного гена nptII, они содержали гены АМП: Sm – ген дефензина звездчатки, W1 – ген пропептида WAMP из Triticum kiharae, SHP – ген сигнального + зрелого пептида WAMP (рис. 1). Как и в случае с геном ингибитора протеиназ ISP из гречихи, отбор регенерантов проходил на селективной среде со 150 мг/л канамицина. Обозначения трансгенных линий с генами АМП: Sm – линии, содержащие дефензин из Stellaria media. SHP – линии, содержащие сигнальный и зрелый пептид WAMP из Triricum kiharae. W – линии, содержащие препропептид WAMP.
С использованием этих конструкций проведена агробактериальная трансформация табака и получены новые серии индивидуальных Km-устойчивых трансформантов. По мере удаления агробактерий у трансформантов проводили скрининг линий на наличие гена nptII. На основе отбора на селективных средах с канамицином с последующей проверкой ДНК-трансформантов посредством ПЦР отобраны растения, содержащие вставки (рис. 2). В опытах с векторными конструкциями, содержащими ген ISP с разным количеством сопутствующих фрагментов гена паутины, скорость регенерации и выживания трансформантов зависела от размеров вектора. В результате с геном ISP для анализа было отобрано новых Km-позитивных трансгенных растений нормальной морфологии с двумя генами спидроина (линия IP 2s) – 17, а трансформантов с четырьмя генами спидроина (линия IP 4s) – пять.
Рис. 2.
Проверка ДНК-трансформированных растений на наличие гена nptII. Растения с геном Sm-дефензина звездчатки (верхний ряд) и антимикробного пептида WAMP из Triricum kiharae линии SHP (нижний ряд). М – маркер молекулярных масс, К0 – нетрансформированное контрольное растение, К+ плазмидная ДНК, содержащая векторную конструкцию, К– контроль на чистоту реакции.

Использование вектора с геном антимикробного препропептида T. kiharae (линии растений W) также влияло на частоту и скорость регенерации трансформантов и позволило отобрать только три канамицин-устойчивых растения нормальной морфологии. При этом при использовании векторных конструкций с дефензином из Stellaria media (Sm-линии), а также с генами сигнального и зрелого антимикробного пептидов Triticum kiharae (SHP-линии) за более короткий период времени отобрано более 50 регенерантов.
Таким образом, только лишь увеличение сложности векторной конструкции вне зависимости от природы целевого гена приводило к затруднению процесса трансформации, снижению процента трансформированных растений и изменению их фенотипа. У таких растений часто наблюдались замедленный рост, карликовость, витрификация, а также более частая гибель в процессе отбора по сравнению с растениями, трансформированными более простыми конструкциями. В результате отбора трансгенных растений с генами АМП получено: 15 Sm-растений табака с дефензином из звездчатки, 25 SHP-растений с генами сигнального и зрелого антимикробного пептидов Triticum kiharae, и только одного растения (W1) с геном пропептида T. kiharae. Все полученные растения поддерживались в асептической культуре черенкованием. У ряда растений в процессе отбора происходило выпадение или нарушение целостности конструкции вектора (табл. 1). Следует отметить, что периодическая проверка коллекции IP трансгенных растений табака с ингибитором протеиназ, полученных ранее после трансформации конструкцией без дополнительных генов (47 линий), не выявила значительных морфологических изменений ни у первичных трансформантов, ни у их семенного потомства первого и второго поколений.
Таблица 1.
Проверка наличия встроенных фрагментов генов у ряда линий с генами дефензина звездчатки (Sm) и антимикробного пептида из Triticum kiharae (SHP, W1) в процессе отбора
| № | Линия | ПЦР-праймеры | № | Линия | ПЦР-праймеры | |||
|---|---|---|---|---|---|---|---|---|
| nptII-Dir + + nptII-Rev | 35Sdir + + M13rev* | SmDdir + + SmDrev* | nptII-Dir + + nptII-Rev | 35Sdir + + M13rev* | ||||
| 1 | Sm1 | + | + | + | 1 | SHP1 | + | + |
| 2 | Sm2 | + | + | + | 2 | SHP3 | – | – |
| 3 | Sm3 | + | + | + | 3 | SHP4 | – | – |
| 4 | Sm4 | + | + | + | 4 | SHP5 | + | + |
| 5 | Sm5 | – | – | – | 5 | SHP6 | + | + |
| 6 | Sm7 | – | – | – | 6 | SHP7 | + | + |
| 7 | Sm8 | + | + | + | 7 | SHP8 | + | + |
| 8 | Sm9 | + | + | + | 8 | SHP9 | + | + |
| 9 | Sm10 | + | + | + | 9 | SHP12 | + | + |
| 10 | Sm11 | + | + | + | 10 | SHP13 | + | + |
| 11 | Sm12 | – | – | – | 11 | SHP15 | + | + |
| 12 | SHP16 | + | + | |||||
| 1 | K0 | – | – | – | 13 | SHP17 | + | + |
| 14 | SHP20 | + | + | |||||
| 1 | W1 | + | + | |||||
Примечание. К0 – контрольное нетрансгенное растение табака. * – использованы последовательности праймеров согласно [21]. “–” – растения не исследовались.
Биотесты
Были проведены также сравнительные луночные биотесты с подавлением роста газона Erwinia тканями и соком новых серий трансгенных растений табака, содержащих указанные выше разныe группы защитных белков. Они также свидетельствовали о наличии функциональных белков во всех изученных вариантах (рис. 3). Сравнение первичной коллекции ISP линий в луночных биотестах с трансформантами, содержащими новые конструкции, показало, что исследованные растения всех вариантов превосходили контрольные по уровню антибактериальной активности, в среднем в 1.5–3 раза как в отношении грамположительных, так и в отношении грамотрицательных бактерий. Однако статистически значимой разницы между ними не наблюдалось (табл. 2, рис. 3).
Рис. 3.
Чашечный биотест с подавлением роста газона Erwinia соком трансгенных растений табака с защитными целевыми генами в составе разных векторных конструкций. К0 – контрольное нетрансгенное растение табака, К1 – контрольное растение, подвергшееся процедуре трансформации “пустой” векторной конструкцией без целевых генов. а: лунки 1–4 – ткани растений, трансформированных конструкцией с двумя генами спидроина; 5–7 – конструкцией с четырьмя генами спидроина;. б: лунки 8–10 – растения, трансформированные конструкцией с генами Sm, 11–13 – с геном wamp-1 линии W1, 14–16 – с геном wamp-1 линии SHP; в – С11, С18 – линии с одним геном ISP, С12 – линия, потерявшая встроенный ген.
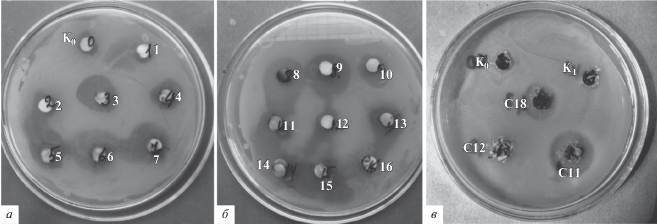
Таблица 2.
Подавление роста газона бактерий тканями трансгенных растений табака
| IP линия, название | Конструкция вектора | Поколение | Число клонов, растений | Радиус зоны подавления роста газона, мм | ||
|---|---|---|---|---|---|---|
| Pseudomonas syringae | Erwinia carotowora | Clavibacter michiganensis | ||||
| К0 | 0 | F0 | 1 раст. | 18 | 20 | 22 |
| Ктр0 | A.t.A281 | T0 | 1 раст. | 35 | 30 | 30 |
| 2s | ISP + 2E1 | T0 | 10 клонов | 40–60 | 60–90 | 50–90 |
| 4s | ISP + 4E1 | T0 | 3 клона | 50–60 | 60–80 | 50–70 |
| С1 | ISP | Т0 | 1 раст. | 38 | – | 40 |
| T1 | 5 раст. | 50–70 | – | 60–70 | ||
| С7 | ISP | T0 | 1 раст. | 42 | – | 75 |
| T1 | 15 раст. | 50–70 | – | 50–75 | ||
| С10 | ISP | T0 | 1 раст. | 70 | – | 60 |
| T1 | 11 раст. | 50–70 | – | 50–55 | ||
| С11 | ISP | T0 | 1 раст. | 70 | – | 60 |
| T1 | 10 раст. | 50–75 | – | 50–55 | ||
| С18 | ISP | T0 | 1 раст. | 80 | – | 70 |
| T1 | 20 раст. | 50–95 | – | 60–70 | ||
| С22 | ISP | T0 | 1 раст. | 70 | – | 80 |
| T1 | 10 раст. | 50–80 | – | 40–70 | ||
Примечание. С1, С7, С10, С11, С18, С22 – линии, содержащие векторные конструкции с геном ингибитора сериновых протеиназ (ISP) у исходных трансгенных линий Т0, их семенного потомства 1-го поколения Т1; 2s, 4s – линии, содержащие ту же конструкцию (ISP) c дополнительными фрагментами гена спидроина у поколения Т0; К0 – контрольное нетрансгенное растение табака, Ктр0 – контрольное растение, подвергшееся процедуре трансформации “пустой” векторной конструкцией без трансгенных вставок; “–” – растения не исследовались.
Данные биотестов были подтверждены молекулярными методами, которые свидетельствовали об экспрессии целевого белка ингибитора трипсина в тканях всех исследованных трансгенных растений, в том числе и у полученных ранее модельных растений табака, картофеля и арабидопсиса [10, 22]. У ограниченной выборки растений с геном ISP была проверена экспрессия введенного гена, подтверждающая наличие функционального целевого белка (рис. 3).
Однако несмотря на общее повышение фитопатогенных свойств тканей, у некоторых новых трансформантов с ингибитором протеиназ ISP с дополнительными участками гена спидроина наблюдалась даже тенденция к снижению их токсического эффекта по сравнению с растениями, трансформированными конструкцией с единственными геном ISP (табл. 2). Это подтверждается также в биотестах с заражением эрвинией изолированных листьев трансгенных растений из разных линий (табл. 3). В биотестах с изолированными листьями нагляднее проявлялась разница между трансформантами с единственным геном ISP (С10, С18) и растениями, трансформированными более сложными конструкциями. У растений, имевших дополнительные гены, рост бактерий подавлялся в меньшей степени. Скорее всего, эти различия можно объяснить тем, что у первой коллекции трансгенных растений с единичным геном ISP в результате длительного отбора были взяты наиболее эффективные варианты. Таким образом, на основании молекулярно-генетического анализа и биотестов очевидно, что ткани всех трансгенных растений, несущих целевой ген ингибитора трипсина (ISP), вне зависимости от конструкции и количества дополнительных генов спидроина, подавляют рост газона бактерий и уменьшают зону лизиса в опытах на изолированных листьях сильнее контрольных. При этом четкой разницы между степенью подавления и количеством дополнительных предполагаемых “энхансерных” генов спидроина в векторной конструкции не выявлено. По-видимому в тканях растений, в отличие от клеток дрожжей, гены спидроина не оказывают стимулирующего влияния на экспрессию целевого гена, хотя увеличение размеров конструкции при трансформации подавляло процессы морфогенеза.
Таблица 3.
Биотесты по заражению эрвинией изолированных листьев трансгенных растений табака с единичным геном ингибитора протеиназ из гречихи (С10, С18) и растений с тем же геном + дополнительными генами спидроина
| Линия | Тип вектора | Средняя площадь зоны лизиса, см2 | Отношение к контролю, % |
|---|---|---|---|
| К0 | 0 | 5.2 | 100 |
| Ктр0 | A.t.A281 | 5.2 | 100 |
| IP 2s-1 | ISP + 2E1 | 4.3 | 82.7 |
| IP 2s-3 | ISP + 2E1 | 4.2 | 80.8 |
| IP 2s-5 | ISP + 2E1 | 4.8 | 92.3 |
| IP 2s-6 | ISP + 2E1 | 4.5 | 86.5 |
| IP 2s-7 | ISP + 2E1 | 4.7 | 90.4 |
| IP 4s-1 | ISP + 4E1 | 3.7 | 71.1 |
| C10 | ISP | 2.1 | 40.4 |
| C18 | ISP | 2.75 | 52.9 |
Рис. 4.
а – проверка наличия трансгенной вставки гена ISP ингибитора протеиназ гречихи (ингибитор трипсина) и контрольного гена β-актина в трансгенных растениях табака поколения Т1. Дорожки 1–3 – семенное потомство линии С1, 4–5 – линии С7, 6–7 – линии С10, 8–13 – линии С18, 14–16 – линии С22. К0 – нетрансформированное контрольное растение, К+ плазмидная ДНК, содержащая целевой ген ISP. б – проверка экспрессии гена ISP и гена npt II в трансгенных растениях табака в поколении Т2. Дорожка 4 – растение 9 линии С10, дорожки 8 и 9 – растения 1 и 2 линии C18, потерявшие Км-устойчивость и фитопатогенную активность в опытах in vitro.
Аналогичные эксперименты были проведены для серии новых трансформантов с другими защитными генами. Для сравнения функциональной активности экспрессируемых в трансгенных растениях разных целевых генов (ISP, Sm и wamp) были также поставлены опыты на изолированных листьях новой коллекции (табл. 4). Как видно из данных таблицы, все растения различались между собой по степени устойчивости внутри каждой серии, тогда как между растениями с разными защитными генами значительной разницы в уровне защиты от фитопатогенов не наблюдалось. Близкие к контрольным растениям клоны обнаружены среди серий трансгенных растений: как с геном ингибитора трипсина ISP (линия IP2s-2), так и с геном wamp-1 (линии SHP2 и SHP8).
Таблица 4.
Биотесты по заражению эрвинией изолированных листьев трансгенных растений табака, несущих защитные растительные гены разной природы
| Линия IP | Средняя площадь зоны лизиса, см2 | Линия Sm | Средняя площадь зоны лизиса, см2 | Линия SHP | Средняя площадь зоны лизиса, см2 |
|---|---|---|---|---|---|
| Кнетрансф | 4.6 | Sm | SHP1 | 2.1 | |
| IP 2s-1 | 1.0 | Sm1 | 2.2 | SHP2 | 4.1 |
| IP2s-2 | 4.4 | Sm2 | 1.78 | SHP3 | 1.6 |
| IP 2s-3 | 1.22 | Sm3 | 1.57 | SHP4 | 2.3 |
| IP 2s-4 | 1.4 | Sm5 | 2.1 | SHP5 | 3.6 |
| IP 2s-5 | 2.57 | Sm6 | 2.0 | SHP6 | 2.9 |
| IP 2s-6 | 1.5 | Sm7 | 2.9 | SHP8 | 5.0 |
| IP 2s-7 | 1.2 | Sm8 | 3.7 | SHP9 | 3.0 |
| IP 2s-8 | 2.4 | Sm10 | 2.5 | SHP12 | 1.8 |
| IP 2s-9 | 1.7 | Sm11 | 2.6 | SHP13 | 3.1 |
| IP 4s-1 | 2.55 | Sm12 | 2.45 | SHP15 | 2.8 |
| WAMP | 3.3 | SHP16 | 2.7 |
Наиболее однородной оказалась группа линий с геном дефензина звездчатки. В остальном во всех группах наблюдался разброс, в том числе даже в сторону некоторого усиления лизиса (растение SHP8). Однако ожидаемого значительного роста устойчивости к патогену мы не наблюдали. Вероятнее всего, как мы и предполагали ранее, на уровень защиты от патогена влияет место встраивания чужеродного гена, а также конструкция вектора. В то же время генетически обусловленная норма реакции организма, по-видимому ограничивает повышение синтеза нового пептида в дополнение к уже имеющимся белкам.
В качестве дополнительных тестов было проанализировано прорастание спор Aspergillus nidulans в экстрактах из листьев контрольных и трансгенных растений с ингибитором протеиназ. Для анализа были взяты растения с исходной конструкцией из разных поколений и растения, трансформированные векторной конструкцией, содержащих, кроме целевого гена, два и четыре гена спидроина (табл. 5). Как видно из приведенных данных, все растения, полученные в результате агробактериальной трансформации векторными конструкциями с гетерологичными защитными генами разной природы, приобретали повышенную устойчивость к бактериальным и грибным патогенам.
Таблица 5.
Прорастание спор аспергилла в экстрактах трансгенных линий табака с геном ISP в составе разных векторных конструкций с генами спидроина (IP-2s, IP-4s) и в растениях второго семенного поколения с единичным геном ISP (11-5-5, 11-7-1, 18-9-6, 22-3-1)
| Линия | Количество спор через 24 ч | Количество спор через 48 ч | ||||
|---|---|---|---|---|---|---|
| общее | проросших | % проросш. | общее | проросших | % проросших | |
| К0 | 549 | 64 | 11.7 | 852 | 141 | 16.5 |
| K1 | 542 | 18 | 3.3 | 359 | 41 | 11.4 |
| K3 | 658 | 52 | 7.9 | 439 | 49 | 11.2 |
| IP 2s-1 | 211 | 1 | 0.5 | 145 | 15 | 10.3 |
| IP 2s-2 | 402 | 21 | 5.2 | 190 | 11 | 5.8 |
| IP 2s-5 | 281 | 11 | 3.9 | 386 | 13 | 3.4 |
| IP 2s-6 | 256 | 6 | 2.3 | 136 | 18 | 13.1 |
| IP 2s-9 | 388 | 5 | 1.5 | 320 | 20 | 6.3 |
| IP 4s-1 | 237 | 1 | 0.4 | 321 | 10 | 3.1 |
| С11-5-5 | 235 | 0 | 0 | 587 | 48 | 8.2 |
| С11-7-1 | 310 | 0 | 0 | 650 | 85 | 13.1 |
| С18-9-6 | 237 | 0 | 0 | 690 | 135 | 20.8 |
| С22-3-1 | 302 | 1 | 0.3 | 364 | 55 | 15.1 |
| ВС7 | 257 | 0 | 0 | 672 | 75 | 11.2 |
Было изучено также семенное потомство поколений Т0 и Т1 ряда индивидуальных ISP-растений из разных трансгенных линий и контрольных: нетрансформированного растения (К0) и растения, трансформированного “пустым” вектором без целевого гена (Ктр0). Проверяли качество семян, а также выборочно изучали их устойчивость к селективному агенту (канамицин). Потомство контрольных линий продемонстрировало полное отсутствие устойчивости к канамицину: у них происходило полное обесцвечивание и гибель проростков через три недели роста на селективной среде, хотя всхожесть их семян на среде с канамицином от всхожести семян трансгенных линий отличалась мало. Количество дефектных семян в потомстве первого поколения у трансгенных линий с единственным целевым геном (С10-2, С11-5, С22-6) ненамного превышало число дефектных семян в потомстве нетрансформированного растения (табл. 6). Анализ семян некоторых трансгенных линий с генами АМП показал аналогичные результаты.
Таблица 6.
Характеристика семян T0 и T1 трансгенных растений с ISP геном. Репродукция 2017 г.
| Линия, растение | % проростков на Km100 | Семена, % | ||
|---|---|---|---|---|
| зеленые | белые | нормальные | мелкие и пустые | |
| Семенное потомство T0 | ||||
| К0 | 0 | 100 | 94.3 | 5.7 |
| IP2s-1 | 95 | 4.5 | 82.7 | 17.3 |
| IP 2s-3 | 12 | 3 | 58.5 | 41.5 |
| IP 2s-8 | 22 | 5 | 48.7 | 51.3 |
| IP 2s-14 | 92 | 5.7 | 67 | 33 |
| IP 4s-1 | – | – | 73.5 | 26.5 |
| IP 4s-2 | – | – | 88 | 12 .0 |
| IP 4s-3 | – | – | 61.8 | 38.2 |
| IP 4s-5 | 78 | 5.1 | 86.1 | 13.9 |
| Семенное потомство T1 линий С10, С11 и С22 | ||||
| С10-2 | 100 | 0 | 86.1 | 13.9 |
| С11-5 | 70 | 4 | 92.8 | 7.2 |
| С22-6 | 100 | 0 | 89.5 | 10.5 |
Как видно из приведенных данных, все растения, трансформированные более сложными векторными конструкциями, имели повышенное (иногда до 50%) количество дефектных семян. Два растения с дополнительными генами спидроина (2s-3, 2s-8), в отличие от семенного потомства других трансгенных линий, обнаружили крайне низкую жизнеспособность семян. В то же время семенное потомство Т1 линий с единственным геном ISP (С10-2, С11-5, С22-6) отличалось высоким качеством семян и устойчивостью к канамицину. По-видимому введение новых фрагментов гетерологичной ДНК часто вызывает нарушение процессов микроспорогенеза в трансгенных растениях, что выражается в появлении большего количества дефектных и нежизнеспособных семян и нарушении расщепления по признаку канамицин-устойчивости (маркерный ген nptII) от моногенного в первом семенном поколении после самоопыления. Аналогичные результаты были получены нами при изучении длительно пассируемой коллекции трансгенных линий табака с единичным геном ISP [22]. Такие отклонения могут свидетельствовать о множественных встройках трансгена [8]. По-видимому более длительный отбор эффективных вариантов позволяет отселектировать более стабильные и жизнеспособные трансгенные клоны, демонстрирующие защитный эффект и нормальный фенотип даже в последующих поколениях.
Подобные нарушения наблюдались нами и при анализе инсерционных мутантов арабидопсиса, трансформированных такой же конструкцией с геном ISP. Обнаружены различия в спектре получаемых инсерционных мутаций при использовании для трансформации одной и той же конструкции у арабидопсиса и табака. У арабидопсиса наблюдалось значительно большее количество морфологических и фенологических отклонений от нормы. Данный факт может быть обусловлен различиями в строении генома этих двух объектов, поскольку геном арабидопсиса состоит преимущественно из уникальных последовательностей, и любая встройка чужеродной ДНК может вызвать мутацию. Кроме того у него спектр мутаций тоже зависел от сложности вектора [12].
Таким образом, результаты свидетельствуют о возможности повышения устойчивости к фитопатогенам у разных видов растений посредством введения дополнительных гетерологичных защитных растительных генов (на примере ингибитора трипсина). Сравнение трасгенных растений разных видов, трансформированных одним и тем же геном, выявило значительные видоспецифические различия: наибольшие значения фитопатогенной активности трансгенных тканей наблюдались у клонов картофеля [10]. Тем не менее более длительный отбор позволяет у всех исследованных видов растений получить эффективные и стабильные клоны, несущие целевой ген ингибитора и обладающие значительной фитопатогенной активностью. Изучение растений, несущих в векторной конструкции дополнительные гены спидроина, показали неэффективность их использования в качестве энхансера в тканях высших растений. В целом на эффективность экспрессии целевого гена в тканях трансгенных растений влияет ряд факторов: место встраивания трансгена, сложность векторной конструкции, количество встроенных копий, эффективность отбора трансформантов (рис. 4).
Работа выполнена по государственному заданию № 0112-2019-0002 “Генетические технологии в биологии, медицине, сельскохозяйственной и природохозяйственной деятельности” и при частичном финансировании гранта РФФИ № 19-016-00069 и № 18-54-00008 (РФФИ – Беларусь) и гранта РНФ № 16-16-00032 (создание конструкций для экспрессии генов АМП пшеницы T. kiharae).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Charity J.A., Hughes P., Anderson M.A. et al. Pest and disease protection conferred by expression of barley β‑hordothionin and Nicotiana alata proteinase inhibitor genes in transgenic tobacco // Functional Plant Biol. 2005. V. 32. P. 35–44.
Lee S.C., Hwang B.K. CASAR82A, a pathogen-induced pepper SAR8.2, exhibits an antifungal activity and its overexpression enhances disease resistance and stress tolerance // Plant Mol. Biol. 2006. V. 61. P. 95–109. https://doi.org/10.1007/s11103-005-6102-6
Ntui V.O., Azadi P., Thirukkumaran G. et al. Increased resistance to fusarium wilt in transgenic tobacco lines co-expressing chitinase and wasabi defensin genes // Plant Pathol. 2011. V. 60. P. 221–231. https://doi.org/10.1111/j.1365-3059.2010.02352.x
Scotton D.C., Da Silva Azevedo M. et al. Expression of the Theobroma cacao Bax-inhibitor-1 gene in tomato reduces infection by the hemibiotrophic pathogen Moniliophthora perniciosa // Mol. Plant Pathol. 2017. V. 18(7). P. 1101–1112. https://doi.org/10.1111/mpp.12463
Khalf M., Goulet C., Vorster J. et al. Tubers from potato lines expressing a tomato Kunitz protease inhibitor are substantially equivalent to parental and transgenic controls // Plant Biotechnology J. 2010. V. 8. P. 155–169. https://doi.org/10.1111/j.1467-7652.2009.00471.x
Herman R.A., Fast B., Scherer P.N. et al. Stacking transgenic event DAS-Ø15Ø7-1 alters maize composition less than traditional breeding // Plant Biotechnology J. 2017. V. 15. Iss. 10. P. 1264–1272. https://doi.org/10.1111/pbi.12713
Дейнеко Е.В., Новоселя Т.В., Загорская А.А. и др. Инактивирование чужеродных генов у трансгенных растений табака (обзор) // Изучение генома и генетическая трансформация растений. Новосибирск: Наука, 2001. С. 132–142.
Дейнеко Е.В. Изучение экспрессии гетерологичных и собственных генов у трансгенных растений (на примере Nicotiana tabacum L.): Дис. … доктора биол. наук. М.: ИОГен РАН им. Н.И. Вавилова, 2004. 31 с.
Belozersky M.A., Dunaevsky Y.E., Musolyamov A.X., Egorov T.A. Complete amino acid sequence of the protease inhibitor from buckwheat seeds // FEBS Letters. 1995. V. 371. P. 264–266.
Dunaevsky Y.E., Khadeeva N.V., Belyakova G.A., Belozersky M.A. Properties, physiological role and possible use in biotechnology of proteinase inhibitor from buckwheat seeds // Eur. J. Plant Sci. and Biotechnol. 2009. V. 3. Special Issue 1. P. 39–44.
Хадеева Н.В., Кочиева Е.З., Чередниченко М.Ю. и др. Использование гена ингибитора протеиназ из семян гречихи для повышения устойчивости растений табака и картофеля к биотическому стрессу // Биохимия. 2009. Т. 74. № 3. С. 320–329.
Хадеева Н.В., Яковлева Е.Ю. Анализ наследования маркерного и целевого генов в семенном и вегетативном потомстве трансгенных растений табака с геном ингибитора сериновых протеиназ гречихи // Генетика. 2010. Т. 46. № 1. С. 58–65.
Хадеева Н.В., Яковлева Е.Ю., Дунаевский Я.Е., Белозерский М.А. Сравнительный анализ инсерционных мутантов табака и арабидопсиса, трансформированных одинаковыми векторными конструкциями // Генетика. 2012. Т. 48. № 2. С. 194–203.
Perez-Martin F., Yuste-Lisbona F.J., Pineda B. et al. A collection of enhancer trap insertional mutants for functional genomics in tomato // Plant Biotechnol. J. 2017. V. 15. P. 1439–1452. https://doi.org/10.1111/pbi.12728
Абдеева И.А., Мусийчук К.А., Абдеев Р.М. и др. Конструирование трансгенных растений табака, экспрессирующих синтетические гены, кодирующие белки – аналоги белков каркасной нити паутины Nephila clavipes // Сб. матер. Междунар. конф. “Клеточные ядра и пластиды растений: биохимия и биотехнология”. Минск, 2004. С. 135–140.
Абдеева И.А. Изучение экспрессии синтетических генов спидроина и стабильности их продуктов в растениях: Дис. … канд. биол. наук. М.: ИОГен РАН им. Н.И. Вавилова. 2004. 25 с.
Rogozhin E.A., Slavokhotova A.A., Grishin E.V. et al. A novel antifungal peptide from leaves of the weed Stellaria media L. // Biochimie. 2015. V. 116. P. 125–132.
Истомина Е.А., Коростылёва Т.В., Рожнова Н.А. и др. Гены гевеиноподобных антимикробных пептидов семейства wamp пшеницы: экспрессия в ответ на действие фитогормонов и факторов внешней среды // Генетика. 2016. Т. 52. № 11. С. 1300–1310. https://doi.org/10.7868/S0016675816110059
Одинцова Т.И., Коростылева Т.В., Уткина Л.Л. и др. Антимикробные пептиды пшеницы // Вавиловский журнал генетики и селекции. 2012. Т. 16. № 1. С. 107–115.
Одинцова Т.И., Славохотова А.А., Истомина Е.А. и др. Молекулярно-генетические основы и роль антимикробных пептидов в устойчивости растений к патогенам // Sci. Rev. Proc. Inter. Sci. Conf. Czech Republic, Karlovy Vary–Russia, Moscow, 29–30 May 2015. Karlovy Vary: Skleněný Můstek–Kirov, MCNIP, 2015. P. 49–51.
Коростылева Т.В., Истомина Е.А., Конопкин А.А. и др. Создание векторных конструкций и трансгенных растений табака с генами АМП // Генетика. 2018. Т. 54. № 13. Приложение. С. S41–S45. https://doi.org/10.1134/S0016675818130088
Хадеева Н.В., Яковлева Е.Ю., Сидорук К.В. и др. Молекулярно-генетический анализ длительнопассируемой коллекции трансгенных растений табака с геном ингибитора сериновых протеиназ гречихи // Генетика. 2017. Т. 53. № 11. С. 1–12. https://doi.org/10.7868/S0016675817110042
Дополнительные материалы отсутствуют.


