Генетика, 2020, T. 56, № 3, стр. 361-365
Различия в экспрессии гена ингибитора амилаз SbAI при длительном низкотемпературном хранении клубней и кратковременном холодовом стрессе у картофеля
М. А. Слугина 1, *, М. А. Филюшин 1, А. А. Мелешин 2, А. В. Щенникова 1, Е. З. Кочиева 1
1 Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
2 Всероссийский научно-исследовательский институт картофельного хозяйства
им. А.Г. Лорха
140051 Московская область, пос. Красково, Россия
* E-mail: mashinmail@mail.ru
Поступила в редакцию 03.04.2019
После доработки 21.05.2019
Принята к публикации 30.05.2019
Аннотация
Анализ экспрессии гена ингибитора амилаз SbAI в клубнях пяти сортов картофеля показал, что в процессе низкотемпературного долговременного (семь месяцев) хранения у всех исследованных сортов картофеля происходит снижение уровня транскрипции данного гена. Исследование динамики экспрессии гена SbAI и содержания крахмала в ответ на кратковременный холодовой стресс в листьях сорта S. tuberosum Надежда и четырех дикорастущих видов картофеля секции Petota выявило резкую индукцию транскрипции гена SbAI с одновременным падением содержания крахмала в листьях.
По объему производства картофель Solanum tuberosum является важнейшей незерновой крахмалоносной культурой в мире. После уборки клубни картофеля хранят при температуре 2–4°С для предотвращения прорастания, сохранения процента влажности и снижения патогенеза. Однако воздействие низких температур приводит к холодовому осахариванию клубней (cold-induced sweetening, CIS), что заключается в накоплении редуцирующих сахаров в результате гидролиза крахмала и сахарозы [1, 2].
Крахмал в растениях накапливается в пластидах: запасной – в амилопластах гетеротрофных органов; транзиентный – в хлоропластах фотосинтезирующих листьев [3, 4]. Гидролитический путь деградации крахмала считается основным, что подтверждается ростом активности крахмал-гидролизующих ферментов [5], прежде всего α-амилаз (AMY, EC 3.2.1.1) и β-амилаз (BAM, EC 3.2.1.2) [6, 7]. В геноме картофеля идентифицировано десять генов BAM и пять AMY, активность продуктов которых специфична к различным субстратам и клеточным структурам (хлоропласты, амилопласты и др.) [8, 9]. Показано, что в ответ на низкие температуры в клубнях картофеля происходит активация транскрипции генов StAmy23, StBAM1 и StBAM9 [8, 10]. Продукты этих генов, α-амилаза StAmy23 и β-амилазы StBAM1 и StBAM9, участвуют в индуцированной холодом деградации крахмала в амилопластах клубней [8]. StBAM9 непосредственно связывается с крахмальными зернами, обеспечивая высвобождение растворимых глюканов, гидролиз которых продолжается в амилопластах под действием StBAM1 и завершается в цитозоле при участии StAmy23 [8].
В свою очередь, активность амилаз регулируется на посттрансляционном уровне ингибитором амилаз (Amylase Inhibitor, AI) [11, 12]. Пространственная структура белков AI высоко консервативна среди различных видов растений [13]. Показано, что AI способен связываться с амилазой либо блокируя активный сайт фермента, либо изменяя его конформацию, тем самым снижая каталитическую активность [14, 15]. У картофеля ген, кодирующий ингибитор амилаз, впервые клонирован у вида S. berthaultii (SbAI) [16]. Экспериментально подтверждено, что белок SbAI взаимодействует с каждой из амилаз – StAmy23, StBAM1 и StBAM9 [16].
Показано, что в клубнях CIS-устойчивых растений картофеля экспрессия гена SbAI выше в сравнении с CIS-чувствительными, что подтверждает наличие негативной корреляции между количеством транскриптов SbAI и содержанием редуцирующих сахаров [16]. При этом показано, что сверхэкспрессия гена SbAI в клубнях CIS-чувствительного картофеля, хранящихся при низких температурах, сопровождается снижением уровня транскрипции генов амилаз (в том числе StBAM1, StBAM9 и StAmy23) и степени деградации крахмала [16]. Подавление экспрессии гена SbAI в клубнях CIS-устойчивого картофеля оказывает незначительное положительное влияние на уровень экспрессии генов амилаз, при этом наблюдается существенный рост содержания редуцирующих сахаров [16]. Таким образом, можно говорить об обратной корреляции между уровнями экспрессии гена ингибитора и генов амилаз. Учитывая посттрансляционный характер ингибирования амилаз белком SbAI, предполагается, что возможным сигналом, запускающим экспрессию амилазных генов в клубнях картофеля, являются концентрации редуцирующих сахаров [16]. Учитывая вышесказанное, подавление каталитической активности амилаз, индуцируемых низкими температурами, – одна из функций SbAI картофеля.
Целью данной работы стало определение профиля экспрессии гомологов гена ингибитора амилаз SbAI при длительном низкотемпературном хранении в клубнях различных сортов S. tuberosum, а также при кратковременном холодовом стрессе в листьях разных видов картофеля (род Solanum, секция Petota).
Профиль экспрессии гена SbAI определяли в клубнях картофеля (S. tuberosum) пяти сортов российской селекции: Барин, Красавчик, Надежда, Северное сияние и Утро. Растения выращивали в 2017 г. в полевых условиях (ВНИИКХ им. А.Г. Лорха). В сентябре клубни были собраны и заложены на хранение в картофелехранилище при температуре 4оС. Экспрессионный анализ был проведен методом РВ-ПЦР в двух биологических повторах в трех временных точках: в сентябре (сразу после сбора урожая), в феврале (спустя пять месяцев хранения) и в апреле (спустя семь месяцев хранения). Таким образом, представленный анализ экспрессии отражает сезонные изменения, происходящие в клубнях с момента сбора урожая до момента начала прорастания.
Профиль экспрессии гена SbAI в ответ на кратковременный холодовой стресс определяли в листьях S. tuberosum (сорт Надежда) и четырех дикорастущих видов картофеля – S. demissum (CGN 20568), S. kurtzianum (ВИГРР K-11969), S. chacoense (ВИГРР K-3678) и S. vernei (ВИГРР K-20832). Данные виды были выбраны, так как обладают различной степенью устойчивости к холодовому стрессу [17]. Растения были выращены при нормальных температурных условиях (23/25°С, 16/8 ч – день/ночь, теплица) и подвергнуты холодовому стрессу (4°С, 72 ч, 16/8 ч – день/ночь, климокамера). Также в листьях определяли содержание общего крахмала. Для этого 500 мг листового материала гомогенизировали в 4.5 мл раствора (33% v/v DMSO; 0.44 мМ HCl), инкубировали при 60°С 30 мин и охлаждали до 25°С. Смесь разводили 1 : 5 водой (mQ), доводили pH до 4.5 и фильтровали. Содержание крахмала в фильтрате определяли спектрофотометрически с использованием набора Starch (R-Biopharm, Швейцария).
На основе последовательности SbAI S. tuberosum (XM_006355976.2) были разработаны специфичные праймеры для определения экспрессии гена методом количественной ПЦР в реальном времени (РВ-ПЦР) (SbAIrtF: 5'-TTGTAACATGGCTCGCGTTC-3' и SbAIrtR: 5'-TGTTGGTGAAGCACTTGGAG-3'). Суммарную РНК из клубней и листьев и синтезированную на ее основе кДНК (GoScript, Promega, США) использовали для определения экспрессии гена SbAI. РВ-ПЦР проводили с применением набора “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ЗАО “Синтол”, Россия) в следующих условиях: 95°C – 5 мин; 40 циклов (95°C – 15 с, 60°C – 50 с). Для оценки уровня относительной экспрессии в качестве референсных использовали гены ef1α и sec3 с использованием праймеров: ef1αF (5'-ATTGGAAACGGATATGCTCCA-3') и ef1αR (5'-TCCTTACCTGAACGCCTGTCA-3') [18]; sec3F (5'-GCTTGCACACGCCATATCAAT-3') и sec3R (5'-TGGATTTTACCACCTTCCGCA-3') [19]. Статистическую обработку полученных данных проводили с помощью программного обеспечения GraphPadPrism 7.02 (https://www.graphpad.com).
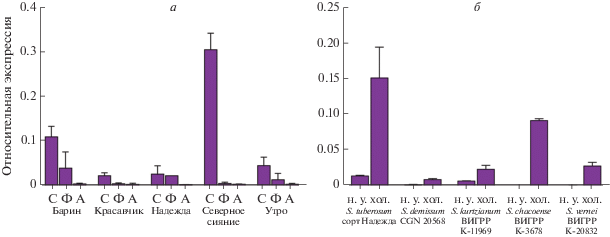
Проведенный анализ экспрессии SbAI показал, что у всех исследованных сортов картофеля в процессе хранения происходит снижение уровня транскрипции данного гена (рис. 1 ,а). В свежесобранных клубнях (сентябрь) уровни экспрессии SbAI существенно различались. Максимальная экспрессия SbAI была детектирована в клубнях сорта Северное сияние, минимальная экспрессия была характерна для сортов Красавчик и Надежда. После пяти месяцев хранения при 4°С (февраль) у сортов Красавчик и Северное сияние произошло наиболее резкое снижение экспрессии SbAI в клубнях, тогда как у сортов Барин и Утро – более плавное, а у сорта Надежда экспрессия SbAI практически не изменилась. После семи месяцев хранения (апрель) у всех исследуемых сортов картофеля были детектированы лишь следовые количества транскриптов гена ингибитора амилаз SbAI.
Полученные данные соотносятся с тем фактом, что при долгосрочном хранении в условиях пониженной температуры в картофелехранилище клубни переходят в состояние физиологического покоя, и биохимические процессы в клетках замедляются. Распад крахмала – основного источника энергии в клубнях происходит с низкой интенсивностью, главным образом для дыхания. Так, показано, что за 2–3 нед. хранения при 10°С клубни теряют около 1 г крахмала при интенсивности дыхания 3–5 мг CO2 кг–1 ч–1 [4]. В зависимости от генотипа и внешних условий стадия физиологического покоя клубней картофеля длится, как правило, 6–12 нед., но для ряда сортов может достигать и 27 нед. [4]. Переход от стадии покоя к прорастанию сопровождается увеличением интенсивности дыхания, потерей воды, повышением содержания гликоалкалоидов, а также накоплением редуцирующих сахаров [4]. Редуцирующие сахара образуются в результате гидролиза крахмала при повышении экспрессии генов амилаз [10, 20] и подавлении экспрессии гена ингибитора амилаз SbAI, что показано в настоящей работе для всех пяти исследуемых сортов S. tuberosum (рис. 1 ,а).
Таким образом, нами было показано снижение уровня экспрессии гена SbAI в процессе длительного хранения клубней при низких температурах в течение семи месяцев. Клубень картофеля – это специализированный запасающий орган, в результате эволюционной адаптации приобретший способность выдерживать длительное воздействие пониженных температур в покоящемся состоянии. Поэтому мы считаем, что полученные результаты в большей мере отражают характер поведения SbAI в ответ на состояние физиологического покоя клубней, нежели на холодовой стресс. В связи с этим для оценки ответа SbAI на воздействие низких температур следующий эксперимент был проведен на листьях растений картофеля, для которых в отличие от клубней температура 4°С является стрессовой.
Ранее экспрессия гена ингибитора амилаз в листьях картофеля в условиях холодового стресса не изучалась. Поэтому в настоящей работе была определена динамика экспрессии гена ингибитора амилаз SbAI в листьях одного из исследуемых сортов S. tuberosum – Надежда до и после воздействия холодового стресса. Одновременно было измерено содержание крахмала в листьях. Как видно из рис. 1 ,б, в ответ на стресс происходит резкое (в 7–8 раз) повышение транскрипции гена SbAI, что сопровождается полным распадом крахмала (от 2.2 до 0 мг/г).
Представлялось интересным сравнить полученные нами данные для S. tuberosum с ответом гена SbAI на холодовой стресс у других видов картофеля, чтобы понять является ли характер экспрессии гена SbAI видоспецифичным или же универсальным для видов картофеля секции Petota [17]. Для этого растения четырех видов картофеля (S. demissum, S. kurtzianum, S. chacoense и S. vernei) с различной степенью устойчивости к низким температурам [17] были проанализированы на предмет изменения профиля экспрессии гена SbAI и содержания крахмала в листьях до и после холодового стресса (рис. 1 ,б).
В результате было выявлено, что у всех анализируемых образцов четырех видов картофеля, как и у S. tuberosum, уровень экспрессии гена ингибитора амилаз SbAI в ответ на холодовой стресс увеличивался (рис. 1 ,б). Как и у S. tuberosum, у остальных четырех видов увеличение уровня экспрессии SbAI сопровождалось резким уменьшением содержания крахмала в листьях: S. demissum – с 0.07 до 0 мг/г, S. kurtzianum – с 1.34 до 0.44 мг/г, S. chacoense – с 2.68 до 0 мг/г; S. vernei – с 1.49 до 0.14 мг/г.
Надо отметить, что анализируемые виды довольно сильно различались как по исходной концентрации крахмала в листьях, так и по степени уменьшения его количества после стресса. Так, у S. tuberosum и S. chacoense после стресса крахмал распался полностью, тогда как исходное его количество было практически одинаковым у данных видов и при этом максимальным среди анализируемых образцов. Уровни экспрессии гена SbAI в листьях S. tuberosum и S. chacoense после стресса были статистически сопоставимы и также характеризовались максимальными значениями. У S. demissum, S. kurtzianum и S. vernei наблюдалась другая динамика. Транскрипция гена SbAI в листьях этих видов также выросла в ответ на стресс, но существенно меньше, чем у S. tuberosum и S. chacoense (рис. 1 ,б). Минимальный рост экспрессии наблюдался у S. demissum, что очевидно соотносится с наименьшим исходным количеством крахмала в листьях среди анализируемых образцов четырех видов. Таким образом, прослеживается корреляция между исходным количеством крахмала в листе и уровнем экспрессии гена ингибитора амилаз в ответ на холодовой стресс. Можно предположить, что воздействие низких температур стимулирует накопление и активность амилаз и, как следствие, усиленную деградацию крахмала. Это согласуется с ранее показанным ростом экспрессии генов амилаз и активности соответствующих ферментов в ответ на воздействие низких температур в листьях картофеля, Arabidopsis thaliana и других видов растений [21–23]. При этом высвобождающиеся сахара могут, в свою очередь, служить сигналом для повышения транскрипции гена ингибитора амилаз SbAI, продукт которого способен предотвращать распад крахмала и/или регулировать данный процесс, и чем больше сахаров, тем выше экспрессия SbAI.
Представленные результаты в совокупности с ранее полученными [2, 12, 22] будут способствовать более глубокому пониманию молекулярно-генетических механизмов ответа картофеля на низкие температуры как при длительном хранении клубней (состояние физиологического покоя), так и при холодовом стрессе.
Работа выполнена при поддержке РФФИ (грант №17-29-08017) и Министерства науки и высшего образования РФ и ФНТП развития сельского хозяйства РФ на 2017- 2025 годы (подпрограмма “Развитие селекции и семеноводства картофеля в Российской Федерации”). Растения выра щивались с использованием эксперимен- тальной установки искусственного климата ЭУИК (Институт биоинженерии ФИЦ Биотехнологии РАН).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Рис. 1.
Изменение экспрессии гена ингибитора амилаз SbAI: а – в процессе низкотемпературного долговременного хранения клубней культивируемого картофеля (С – сентябрь, Ф – февраль, А – апрель); б – в листьях различных видов картофеля в нормальных условиях (н. у.) и в ответ на холодовой стресс (хол.).
Список литературы
Shepherd L.V.T., Bradshaw J.E., Dale M.F.B. et al. Variation in acrylamide producing potential in potato: segregation of the trait in a breeding population // Food Chemistry. 2010. V. 123. P. 568–573.
Chen X., Song B., Liu J. et al. Modulation of gene expression in cold-induced sweetening resistant potato species Solanum berthaultii exposed to low temperature // Mol. Genet. Genomics. 2012. V. 287. P. 411–421.
Zeeman S.C., Smith M.C., Smith A.M. The diurnal metabolism of leaf starch // Biochem. J. 2007. V. 401. P. 13–28. https://doi.org/10.1042/BJ20061393
Benkeblia N., Alexopoulos A.A., Passam H.C. Physiology and biochemistry regulation of dormancy and sprouting in potato tuber (Solanum tuberosum L.) // Fruit, Vegetable and Cereal Science and Biotechnology. 2008. V. 2. P. 54–68.
Cottrell J., Duffus C., Paterson L. et al. The effect of storage temperature on reducing sugar concentration and the activities of three amylolytic enzymes in tubers of the cultivated potato, Solanum tuberosum L. // Potato Research. 1993. V. 36. P. 107–117.
Preiss J. Regulation of the biosynthesis and degradation of starch // Annu. Rev. Plant Physiol. 1982. V. 33. P. 431–454.
Solomos T., Mattoo A.K. Starch-sugar metabolism in potato (Solanum tuberosum L.) tubers in response to temperature variations // Genetic Improvement of Solanaceous Crops / Eds Razdan M.K., Mattoo A.K. Plymouth: Sci. Publ. Inc., 2005. P. 209–234.
Hou J., Zhang H., Liu J. et al. Amylases StAmy23, StBAM1 and StBAM9 regulate cold-induced sweetening of potato tubers in distinct ways // J. Exp. Bot. 2017. V. 68. № 9. P. 2317–2331. https://doi.org/10.1093/jxb/erx076
Van Harsselaar J.K., Lorenz J., Senning M. et al. Genome-wide analysis of starch metabolism genes in potato (Solanum tuberosum L.) // BMC Genomics. 2017. V. 18(1). P. 37. https://doi.org/10.1186/s12864-016-3381-z
Zhang H., Hou J., Liu J. et al. Amylase analysis in potato starch degradation during cold storage and sprouting // Potato Research. 2014. V. 57. P. 47–58.
Liu X., Cheng S., Liu J. et al. The potato protease inhibitor gene, St-Inh, plays roles in the cold-induced sweetening of potato tubers by modulating invertase activity // Postharvest Biology and Technology. 2013. V. 86. P. 265–271.
Mckenzie M.J., Chen R.K., Harris J.C. et al. Post-translational regulation of acid invertase activity by vacuolar invertase inhibitor affects resistance to cold-induced sweetening of potato tubers // Plant Cell Env. 2013. V. 36. P. 176–185.
Lay F., Anderson M. Defensins-components of the innate immune system in plants // Curr. Protein Pept. Sci. 2005. V. 6. P. 85–101.
Barbosa A., Albuquerque E.V.S., Silva M.C.M. et al. Alpha-amylase inhibitor-1 gene from Phaseolus vulgaris expressed in Coffea arabica plants inhibits alpha-amylases from the coffee berry borer pes // BMC Biotechnol. 2010. V. 10. P. 44–51.
Kumari B., Sharma P., Nath A.K. α-Amylase inhibitor in local Himalyan collections of Colocasia: isolation, purification, characterization and selectivity towards a-amylases from various sources // Pestic. Biochem. Physiol. 2012. V. 103. P. 49–55.
Zhang H., Liu J., Hou J. et al. The potato amylase inhibitor gene SbAI regulates cold-induced sweetening in potato tubers by modulating amylase activity // Plant Biotech. J. 2014. V. 12. № 7. P. 984–993. https://doi.org/10.1111/pbi.12221
Machida-Hirano R. Diversity of potato genetic resources // Breed Sci. 2015. V. 65. № 1. P. 26–40. https://doi.org/10.1270/jsbbs.65.26
Lopez-Pardo R., de Galarreta J.I.R., Ritter E. Selection of housekeeping genes for qRT-PCR analysis in potato tubers under cold stress // Mol. Breed. 2013. V. 31. № 1. P. 39–45.
Tang X., Zhang N., Si H., Calderón-Urrea A. Selection and validation of reference genes for RT-qPCR analysis in potato under abiotic stress // Plant Methods. 2017. V. 13. Article 85. https://doi.org/10.1186/s13007-017-0238-7
Davies H.V. Carbohydrate metabolism during sprouting // Am. J. Potato Res. 1990. V. 67. P. 815–827.
Scheidig A., Fröhlich A., Schulze S. et al. Downregulation of a chloroplast-targeted beta-amylase leads to a starch-excess phenotype in leaves // Plant J. 2002. V. 30. № 5. P. 581–591. https://doi.org/10.1046/j.1365-313X.2002.01317.x
Sitnicka D., Orzechowski S. Cold-induced starch degradation in potato leaves – intercultivar differences in the gene expression and activity of key enzymes // Biol. Plantarum. 2014. V. 58. № 4. P. 659–666. https://doi.org/10.1007/s10535-014-0453-2
Thalmann M., Santelia D. Starch as a determinant of plant fitness under abiotic stress // New Phytol. 2017. V. 214. № 3. P. 943–951. https://doi.org/10.1111/nph.14491
Дополнительные материалы отсутствуют.


