Генетика, 2020, T. 56, № 4, стр. 463-470
Исследование повреждений ДНК лимфоцитов периферической крови методом микроядерного теста у жителей прибрежных сел реки Течи, подвергшихся хроническому облучению внутриутробно и постнатально
Ю. Р. Ахмадуллина 1, 2, *, А. В. Возилова 2, А. В. Аклеев 1, 2
1 Уральский научно-практический центр радиационной медицины
Федерального медико-биологического агентства России
454141 Челябинск, Россия
2 Челябинский государственный университет
454001 Челябинск, Россия
* E-mail: akhmadullina.yul@yandex.ru
Поступила в редакцию 24.04.2019
После доработки 22.05.2019
Принята к публикации 24.06.2019
Аннотация
Представлены результаты оценки частоты Т-лимфоцитов периферической крови с микроядрами у жителей прибрежных сел р. Течи, которые в 1950-х гг. подверглись хроническому радиационному воздействию. Исследование проводилось в отдаленный период после начала радиационного воздействия – через 40–60 лет. Облученные лица были представлены двумя группами: лица, облучение которых началось внутриутробно и продолжилось в постнатальный период; и лица, облучение которых пришлось только на постнатальный период. Кумулятивная доза облучения красного костного мозга (ККМ) варьировала от 0.001 до 4 Гр. Также была сформирована группа сравнения из лиц, сопоставимых по возрасту, полу, условиям проживания, но не подвергавшихся аварийному облучению. Результаты исследования показали, что частота лимфоцитов с микроядрами у облученных женщин была значимо выше, чем у облученных мужчин. Частота лимфоцитов с микроядрами у внутриутробно облученных людей была значительно ниже, чем у постнатально облученных людей, и ниже, чем в группе сравнения. Это снижение было отмечено как у женщин, так и у мужчин. При исследовании влияния кумулятивной дозы излучения на ККМ было выявлено повышение частоты лимфоцитов с микроядрами у женщин, подвергшихся воздействию в дозах 0.1–0.49 Гр.
В настоящее время актуальной проблемой радиационной биологии являются отдаленные эффекты хронического облучения человека. Стоит отметить, что данные об отдаленных последствиях ионизирующего излучения на эмбрион и плод человека малочисленны и ограничены результатами обследования детей, рожденных женщинами, прошедшими лучевую терапию во время беременности, а также наблюдениями за здоровьем внутриутробно облученных лиц во время атомной бомбардировки г. Хиросимы и г. Нагасаки, Япония [1, 2]. Как известно, в основе большинства эффектов облучения лежат повреждения ядерной ДНК. В литературе имеются убедительные доказательства того, что мутации ДНК могут оказывать влияние на структуру хроматина, что реализуется в изменении экспрессии соседних генов [3].
В Челябинской области в период с 1949 по 1956 г. ПО “Маяк” осуществляло сбросы жидких радиоактивных отходов в р. Теча, вследствие чего жители прибрежных сел подверглись хроническому низкоинтенсивному радиационному воздействию. Облучение было комбинированным: внешнее гамма-облучение и внутреннее облучение преимущественно за счет инкорпорации 89, 90Sr и 137Cs. Популяция этих людей обследуется специалистами ФГБУН УНПЦ РМ ФМБА России более 60 лет [4, 5]. Исследования, затрагивающие отдаленный период радиационного воздействия, свидетельствуют о повышенном мутационном процессе в соматических клетках обследуемых. Так, например, у облученных людей увеличен уровень нестабильных хромосомных аберраций и TCR-мутаций в лимфоцитах периферической крови [6, 7]. Кроме того, установлено, что в когорте р. Течи повышен риск развития некоторых видов злокачественных новообразований (ЗНО) и лейкозов [8]. Недавно проведенные эпидемиологические исследования в когорте внутриутробно облученных жителей р. Течи выявили увеличение избыточного относительного риска ЗНО с увеличением постнатальной дозы излучения [9].
Среди пострадавшего населения можно отдельно выделить группу лиц, облучение которых началось во внутриутробном периоде и продолжилось постнатально. В тех условиях на эмбрион и плод воздействовало равномерное внешнее гамма-излучение. Внутреннее облучение формировалось за счет равномерного распределения 137Сs, поступавшего с продуктами питания местного производства, речной водой в организм беременной женщины, и неравномерного облучения красного костного мозга (ККМ) за счет накопления в костной ткани плода 89, 90Sr [10].
Все вышеперечисленное свидетельствует о том, что в настоящее время сохраняется актуальность оценки генотоксических эффектов радиационного воздействия в соматических клетках облученных лиц. Одним из признанных методов является исследование повреждений ДНК с помощью микроядерного теста [11].
Цель представленного нами исследования заключалась в изучении исходного уровня Т-лимфоцитов периферической крови с микроядрами у людей, подвергшихся хроническому радиационному (внутриутробному и постнатальному) воздействию на Южном Урале, в отдаленные сроки после начала радиационного воздействия.
МАТЕРИАЛЫ И МЕТОДЫ
Характеристика обследуемых групп
Исследование проводилось среди жителей прибрежных сел р. Течи, которые подверглись хроническому радиационному воздействию.
Критерии включения в группу для исследования: постоянное проживание в одном из сел, расположенных на побережье р. Течи, в период с 01.01.1950 г. (начало радиоактивных сбросов в р. Течу) по 31.12.1960 г. (завершение формирования основной части кумулятивной дозы облучения); дата рождения до 30.12.1960 г. Критериями исключения из исследования были: наличие у обследованных лиц онкологических, аутоиммунных, острых или хронических (период обострения) воспалительных заболеваний, гемобластозов, почечной или печеночной недостаточности, острого нарушения мозгового кровообращения в течение последних трех месяцев; черепно-мозговые травмы; прием антибиотиков, глюкокортикоидов и цитостатиков в течение последних шести месяцев до исследования; рентгенологическое обследование в течение последних шести месяцев.
Характеристика исследованных групп представлена в табл. 1. Группу людей, облученных в период внутриутробного и постнатального развития, составили 118 человек (группа внутриутробно облученных лиц). Средний возраст на год обследования – 59.5 ± 0.3 лет (диапазон 45–66 лет). Средняя доза от внутриутробного (0.03 ± 0.005 Гр) и постнатального (0.28 ± 0.05 Гр) облучения ККМ в сумме составила 0.32 ± 0.05 Гр. Средняя доза у внутриутробно облученных женщин составила 0.30 ± 0.06 Гр, у внутриутробно облученных мужчин – 0.36 ± 0.08 Гр.
Таблица 1.
Характеристика обследуемых лиц
| Группа | Возраст, лет | Пол | Этническая группа | ||||||
|---|---|---|---|---|---|---|---|---|---|
| мужчины | женщины | славяне | татары, башкиры | ||||||
| абс. | % | абс. | % | абс. | % | абс. | % | ||
| Облученные лицаn = 536 | 66.6 ± 0.3 (45–90) | 211 | 39.4 | 325 | 60.6 | 225 | 42 | 311 | 58 |
| Внутриутробно облученныеn = 118 | 59.5 ± 0.3 (45–66) | 44 | 37.3 | 74 | 62.7 | 53 | 45 | 65 | 55 |
| Постнатально облученныеn = 418 | 68.6 ± 0.3 (51–90) | 167 | 40 | 251 | 60 | 172 | 41 | 246 | 59 |
| Группа сравненияn = 300 | 66.2 ± 0.4 (46–84) | 93 | 31 | 207 | 69 | 159 | 53 | 141 | 47 |
Группу постнатально облученных лиц составили 418 человек. В эту группу вошли люди, родившиеся с 1914 по 1949 г. Средний возраст пациентов на момент обследования составил 68.6 ± 0.3 лет (диапазон 51–90 лет). Средняя поглощенная доза на ККМ была равна 0.83 ± 0.03 Гр. Средняя доза у постнатально облученных женщин составила 0.88 ± ± 0.05 Гр, у постнатально облученных мужчин – 0.76 ± 0.04 Гр.
В группу сравнения вошли 300 необлученных лиц 1917–1960 гг. рождения, проживавших в сходных социально-экономических условиях с группой облученных лиц. Их средний возраст был равен 66.2 ± 0.4 лет (диапазон 46–84 лет). Они не подвергались аварийному воздействию ионизирующего излучения.
В табл. 2 представлена дозиметрическая информация, которая была получена в биофизической лаборатории ФГБУН УНПЦ РМ. Кумулятивные дозы облучения на ККМ были рассчитаны на основе дозиметрической системы TRDS 2016 [12].
Таблица 2.
Кумулятивная доза на ККМ, Гр
| Группа | M ± SE | Min–max |
|---|---|---|
| Облученные лица | 0.73 ± 0.03 | 0.001–4.0 |
| Внутриутробно облученные | Внутриутробное излучение: | |
| 0.03 ± 0.005 | 0.00005–0.21 | |
| Постнатальное излучение: | ||
| 0.28 ± 0.05 | 0.0001–2.23 | |
| Сумма: | ||
| 0.32 ± 0.05 | 0.001–2.3 | |
| Постнатально облученные | 0.83 ± 0.03 | 0.006–4.0 |
Образцы крови для исследования забирали у пациентов клинического отделения ФГБУН УНПЦ РМ в соответствии с действующими международными нормами (Хельсинкская декларация 1964 г.) и с разрешения локального этического комитета ФГБУН УНПЦ РМ на основании добровольно подписанного индивидуального информированного согласия. Подробная информация о донорах была получена из “Базы данных человек” ФГБУН УНПЦ РМ.
Микроядерный тест и получение препаратов
Протокол методики микроядерного теста включал несколько этапов: культивирование Т-лимфоцитов периферической крови, блокирование цитокинеза, гипотоническую обработку, фиксацию суспензии клеток, а затем приготовление препаратов [13].
Для исследования использовали образцы цельной крови, взятой из локтевой вены в шприц с гепарином. Приготовление рабочих растворов и постановка культуры клеток выполнялись в стерильных условиях. Для образцов крови готовили культуральные флаконы, каждый из которых содержал 3.3 мл среды RPMI 1640 (Панеко, Россия), 1 мл сыворотки крови эмбриональной телячьей (РАА Laboratories, Австрия), 0.7 мл периферической крови, 7 мкг/мл ФГА (Панеко, Россия). Флаконы инкубировали в CO2-инкубаторе при 37°С и концентрации CO2 5%. Через 48 ч от начала инкубации в пробы добавляли 70 мкл рабочего раствора цитохалазина Б (США) в DMSO (4,5 мкг/мл). Через 72 ч от начала инкубации пробы подвергались гипотонической обработке раствором КCl (0.125 М) и фиксации смесью этанола и ледяной уксусной кислоты в соотношении 3 : 1. Далее из фиксированной клеточной суспензии готовили препараты, которые после высыхания окрашивали 2%-ным красителем Романовского–Гимза в течение двух часов.
Оценку лимфоцитов периферической крови с микроядрами проводили при световой микроскопии 10 × 100 на микроскопе AxioImager (Германия). Подсчет клеток вели с использованием протокола анализа лимфоцитов с микроядрами, разработанного “International Collaborative Projecton Micronucleus Frequency in Human Populations (HUMN)” [14]. Оценивалось количество лимфоцитов с микроядрами на 1000 проанализированных двухъядерных клеток.
Методы статистической обработки
Статистическая обработка полученных данных проводилась при помощи стандартных методов описательной статистики с вычислением медианы и 25 и 75 процентиля. На рисунках данные также представлены медианой и 25 и 75 процентилем. Поскольку распределение частоты клеток с микроядрами не соответствовало нормальному, сравнение групп проводили с использованием U-критерия Манна–Уитни. Нулевая гипотеза об отсутствии различий между сравниваемыми группами отвергалась при p ≤ 0.05 и принималась альтернативная гипотеза о наличии статистически значимых различий [15]. Статистическую обработку данных проводили при помощи табличного редактора Microsoft Excel 2010, а также пакетов прикладных программ SPSS Statistics 21 и SigmaPlot 14.0.
РЕЗУЛЬТАТЫ
Частота лимфоцитов с микроядрами в обследованных группах представлена в табл. 3. В группе облученных лиц частота клеток с микроядрами составила 15‰ (10–21‰), что было сопоставимо с группой необлученных лиц – 16‰ (11–21‰). Обращает на себя внимание тот факт, что у внутриутробно облученных людей частота лимфоцитов с микроядрами (11‰) была значимо ниже, чем у постнатально облученных (16‰) и необлученных людей (16‰), p = 0.0001.
Таблица 3.
Частота клеток с микроядрами, ‰
| Группа | Медиана (25–75%) | |
|---|---|---|
| Облученные лица | 15 (10–21) | |
| Внутриутробно облученные | 11 (8–17) | р1, 2 = 0.0001 |
| Постнатально облученные | 16 (11–23) | |
| Группа сравнения | 16 (11–21) | |
Так как в группе внутриутробно облученных лиц возрастной диапазон был уже, а средний возраст меньше, чем в группах постнатально облученных и необлученных лиц, выявленные различия могли определяться возрастом. Для того чтобы подтвердить или опровергнуть эту гипотезу, мы сформировали одновозрастную группу внутриутробно облученных лиц и группу сравнения, а затем сравнили медианные значения частоты клеток с микроядрами. Эти результаты отражены в табл. 4. Частота лимфоцитов с микроядрами в группе сравнения оставалась значимо выше (р = 0.001), чем в группе внутриутробно облученных лиц. Результаты анализа позволили нам сделать заключение, что возраст не был причинным фактором различий в частоте клеток с микроядрами в группе внутриутробно облученных людей и группе сравнения.
Таблица 4.
Частота клеток с микроядрами в группе внутриутробно облученных лиц и группе сравнения аналогичного возраста, ‰
| Группа | Возраст, лет | Медиана (25–75%) |
|---|---|---|
| Внутриутробно облученные n = 118 | 59.5 ± 0.3 45–66 |
11 (8–17) p = 0.001 |
| Группа сравнения n = 122 | 59.6 ± 0.3 45–66 |
15 (10–21) |
На рис. 1 представлена частота лимфоцитов с микроядрами в зависимости от пола доноров. Как видно, у облученных мужчин частота клеток с микроядрами значимо снижена относительно облученных женщин, р = 0.0001. В группе необлученных мужчин частота клеток с микроядрами была также снижена относительно женщин, но статистической значимости не выявили, р = 0.131.
Рис. 1.
Частота лимфоцитов с микроядрами в зависимости от пола (медиана и 25–75%). * – статистически значимые различия между женщинами и мужчинами.
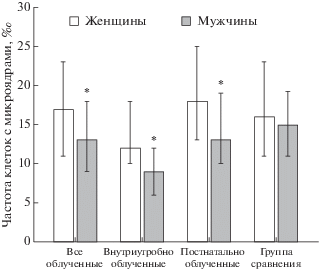
В табл. 5 и 6 представлены результаты исследования частоты лимфоцитов с микроядрами отдельно у женщин и мужчин. Как видно из табл. 5, при исследовании всех облученных женщин не было отмечено отличий от группы сравнения. При рассмотрении внутриутробно облученных женщин частота лимфоцитов с микроядрами была значимо ниже, чем у постнатально облученных и необлученных женщин (12‰ против 18 и 16‰ соответственно, р = 0.0001 и р = 0.004). У постнатально облученных женщин частота клеток с микроядрами значимо выше, чем у необлученных женщин (18 против 16‰, р = 0.04).
Таблица 5.
Частота клеток с микроядрами у женщин, ‰
| Группа | Медиана (25–75%) | |
|---|---|---|
| Облученные лица | 17 (11–23) | |
| Внутриутробно облученные | 12 (10–18) | р1 = 0.0001 р2 = 0.004 |
| Постнатально облученные | 18 (13–25) | р2 = 0.04 |
| Группа сравнения | 16 (11–23) | |
Таблица 6.
Частота клеток с микроядрами у мужчин, ‰
| Группа | Медиана (25–75%) | |
|---|---|---|
| Облученные лица | 13 (9–18) | р2 = 0.039 |
| Внутриутробно облученные | 9 (6–12) | р1 = 0.0001 р2 = 0.0001 |
| Постнатально облученные | 13 (10–19) | |
| Группа сравнения | 15 (11–19) | |
В группе облученных мужчин частота клеток с микроядрами была ниже, чем у необлученных мужчин (табл. 6). У внутриутробно облученных мужчин лимфоциты с микроядрами встречались реже, чем в группе постнатально облученных мужчин, такие же закономерности были получены и при сопоставлении с группой сравнения (9 против 13 и 15‰ соответственно, при р = 0.0001).
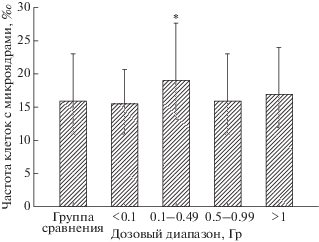
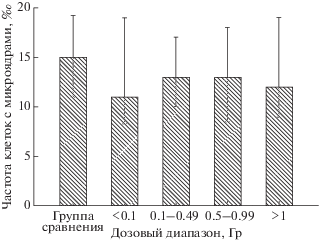
Результаты исследования частоты лимфоцитов с микроядрами в зависимости от кумулятивной дозы излучения на ККМ представлены на рис. 2 и 3. Как видно из рис. 2, частота лимфоцитов с микроядрами была значимо повышена у тех женщин, у которых дозы на ККМ были в диапазоне от 0.1 до 0.49 Гр (относительно группы сравнения и самого низкого дозового диапазона, р = 0.03 и р = 0.02). На рис. 3 видно, что у мужчин не было выявлено значимых отличий в частоте лимфоцитов с микроядрами в зависимости от дозы ионизирующего излучения на ККМ.
ОБСУЖДЕНИЕ
Исследования, посвященные изучению отдаленных цитогенетических эффектов у людей, подвергшихся хроническому радиационному воздействию вследствие проживания в прибрежных селах р. Течи, в ФГБУН УНПЦ РМ проводятся более 50 лет. У облученного населения был отмечен более высокий уровень нестабильных хромосомных аберраций (НХА) по сравнению с группой сравнения. А самый высокий уровень НХА был обнаружен у лиц, в анамнезе которых был хронический лучевой синдром [6]. Помимо методов классической цитогенетики для обследования облученного населения применялся микроядерный тест на предмет оценки адаптационных возможностей клеточных систем [16]. В этих исследованиях было показано, что у жителей радиоактивно загрязненных районов исходный уровень микроядер в Т-лимфоцитах не отличался от группы сравнения, а радиочувствительность и способность к адаптивному ответу Т-клеток облученных была значительно снижена.
В нашем исследовании при рассмотрении группы всех облученных лиц не было найдено отличий в частоте лимфоцитов с микроядрами от группы сравнения. Так как в выборку были включены лица, облучение которых началось внутриутробно и продолжилось постнатально, и лица, у которых облучение затронуло только постнатальный период, то мы рассмотрели частоту клеток с повреждениями в каждой из этих групп. В группе внутриутробно облученных лиц частота лимфоцитов с микроядрами составила 11‰, что значительно ниже, чем в группе постнатально облученных лиц и в группе сравнения (и в той и другой группе медиана частоты лимфоцитов с микроядрами составила 16‰). Эти различия не были связаны с возрастом пациентов, так как при подборе лиц из группы сравнения одного возраста с внутриутробно облученными лицами они сохранились (р = 0.001).
Известно, что пол может влиять на частоту образования микроядер [17]. При сопоставлении частоты клеток с микроядрами у женщин их было больше, чем у мужчин (рис. 1). Эти результаты согласуются с литературными данными. При исследовании механизмов образования микроядер используют FISH-окрашивание хромосомного материала, благодаря чему становится понятно, какой материал ДНК содержат микроядра. Так, в исследовании [18] было показано, что 72% микроядер у женщин содержат Х-хромосому. В некоторых работах есть указания на то, что у женщин чаще всего в микроядрах присутствует инактивированная Х-хромосома [19].
Поскольку частота лимфоцитов с микроядрами зависит от пола, мы сопоставили результаты у облученных и необлученных лиц в соответствии с полом. Тенденция снижения лимфоцитов с микроядрами у внутриутробно облученных лиц разного пола сохранилась. У внутриутробно облученных женщин и мужчин частота клеток с микроядрами была значимо ниже, чем в соответствующих по полу группах сравнения.
Таким образом, мы видим четкую закономерность к снижению частоты лимфоцитов с микроядрами у внутриутробно облученных лиц. В научной литературе сведения об отдаленных цитогенетических эффектах у внутриутробно облученных людей немногочисленны. При исследовании японской популяции, которая 40 лет назад подверглась внутриутробному облучению, не были обнаружены повышенные частоты хромосомных аберраций вопреки ожиданиям авторов. Незначительное повышение частоты хромосомных аберраций (менее 1%) было у облученных в дозах ниже 0.1 Зв. Для интерпретации полученных результатов авторы [20] предложили следующую гипотезу. У плода есть две субпопуляции клеток-предшественников лимфоидного происхождения, которые отличаются по радиочувствительности. Одна из субпопуляций крайне чувствительна к индукции хромосомных транслокаций и гибели клеток, при дозах выше 50 мЗв эти клетки чаще всего быстро погибают. Другая субпопуляция клеток является более радиоустойчивой к индукции хромосомных транслокаций и гибели, возможно из-за хорошей репарационной способности клеток. Авторы предполагают, что гипотеза поможет разрешить спор о том, что значительный риск лейкемии у детей связан с внутриутробным облучением рентгеновскими лучами в низких дозах, тогда как исследования на животных, включающие в основном облучения в высоких дозах, обычно не подтверждают это [20].
При исследовании относительного риска развития рака у внутриутробно облученных жителей прибрежных сел р. Течи не было найдено убедительных доказательств того, что хроническое воздействие в низкой дозе на эмбрион и плод повышает риск развития солидного рака в детском или зрелом возрасте. Как в отношении заболеваемости, так и смертности отмечалась тенденция к снижению относительного риска при увеличении дозы для мягких тканей плода. Авторы [21] высказывают предположение, что полученные эффекты можно объяснить индукцией летальных генетических изменений при более высоких дозах внутриутробного воздействия в клетках эмбриона и плода, которые способны к высокой пролиферативной активности, и последующей элиминацией скомпрометированного потомства в течение внутриутробного и раннего послеродового периода.
Обращает на себя внимание, что у постнатально облученных женщин частота клеток с микроядрами была выше, чем в группе необлученных женщин. Возможно, эти результаты связаны с повышением частоты нарушений сегрегации Х-хромосомы и включением ее в микроядро, как это было указано выше. Также мы не можем исключить вклада долгоживущих субпопуляций Т-лимфоцитов, которые могут вступать в свой первый пострадиационный митоз через много лет после облучения и сохранять в себе цитогенетические маркеры радиационного воздействия в течение многих лет [4].
При изучении частоты клеток с микроядрами в подгруппах людей с разными дозами облучения обнаружено, что у облученных женщин в дозах 0.1–0.49 Гр этот показатель был повышен относительно необлученных лиц и подгруппы людей с самыми низкими дозами облучения ККМ (менее 0.1 Гр). Дозы 0.1–0.5 Гр входят в диапазон средних доз, при которых регистрируются различные отдаленные эффекты хронического облучения эпидемиологическими методами. Также обращает на себя внимание, что эффект был обнаружен только у женщин. Возможно, выявленное повышение частоты клеток с микроядрами связано с половыми различиями в радиочувствительности человека [22].
В исследованиях установлены взаимосвязи повышенной частоты микроядер в двуядерных Т‑клетках с химическими токсикантами и некоторыми физическими агентами, помимо этого имеется зависимость от возраста, пола, диеты, употребления некоторых фармацевтических препаратов, алкоголя и курения [17]. В случае настоящего исследования, которое проводилось в отдаленные сроки после начала радиационного воздействия у жителей р. Течи, образование микроядер в лимфоцитах периферической крови может определяться как влиянием ионизирующего излучения, так и некоторыми из вышеперечисленных факторов. Тем не менее по литературным данным ионизирующая радиация является мощным генотоксикантом и в зависимости от дозы излучения может вносить существенный вклад в развитие отдаленных последствий облучения, например таких, как радиационно-индуцированная нестабильность генома [23].
Таким образом, исходный уровень Т-лимфоцитов периферической крови с микроядрами у внутриутробно облученных жителей прибрежных сел р. Течи был значимо ниже, чем в группе постнатально облученных лиц и в группе сравнения. Частота лимфоцитов с микроядрами у облученных женщин была значимо выше, чем у облученных мужчин. У женщин, облученных постнатально, отмечалась более высокая частота лимфоцитов с микроядрами по сравнению с группой необлученных женщин. При исследовании влияния кумулятивной дозы излучения на ККМ было отмечено повышение частоты лимфоцитов с микроядрами у женщин, подвергшихся воздействию в дозах 0.1–0.49 Гр.
Авторы выражают благодарность З.И. Сыченко за техническое сопровождение исследований.
Работа была поддержана Федеральным медико-биологическим агентством России.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Preston D.L., Cullings H., Suyama A., Funamoto S. et al. Solid cancer incidence in atomic bomb survivors exposed in utero or as young children // J. Natl Cancer Inst. 2008. V. 100. № 6. P. 428–436. https://doi.org/10.1093/jnci/djn045
Boice J.D., Jr., Miller R.W. Childhood and adult cancer after intrauterine exposure to ionizing radiation // Teratology. 1999. V. 59. № 4. P. 227–233.
Gorbunova V., Seluanov A. DNA double strand break repair, aging and the chromatin connection // Mutat. Res./Genet. Toxicology and Environmental Mutagenesis. 2016. V. 788. P. 2–6. https://doi.org/10.1016/j.mrfmmm.2016.02.004
Медико-биологические и экологические последствия радиоактивного загрязнения реки Теча / Под ред. Аклеева А.В., Киселева М.Ф. М.: Медбиоэкстрем, 2001. 532 с.
Пастухова Е.И., Шалагинов С.А., Аклеев А.В. Частота многоплодия у населения радиоактивно загрязненных районов Челябинской области // Вопр. радиац. безопасности. 2011. № 4(64). С. 45–53.
Vozilova A.V., Shagina N.B., Degteva M.O., Akleyev A.V. Chronic radioisotope effects on residents of the Techa river (Russia) region: cytogenetic analysis more than 50 years after onset of exposure // Mutat. Res./Genet. Toxicology and Environmental Mutagenesis. 2013. V. 756. № 1–2. P. 115–118. https://doi.org/10.1016/j.mrgentox.2013.05.016
Akleev A.V., Veremeeva G.A., Kyoizumi S. Long-term effects of chronic radiation exposure on the level of somatic mutations in peripheral blood cells // Радиац. биология. Радиоэкология. 1998. V. 38. № 4. P. 573–585.
Аклеев A.В., Крестинина Л.Ю., Престон Д., Дэвис Ф. и др. Радиационный риск злокачественных новообразований у жителей прибрежных сел реки Течи // Мед. радиология и радиац. безопасность. 2008. Т. 53. № 4. С. 13–37.
Krestinina L.Yu., Kharyuzov Yu.E., Epiphanova S.B., Tolstykh E.I. et al. Cancer incidence after in utero exposure to ionizing radiation in Techa river residents // Radiat. Res. 2017. V. 188. № 3. P. 314–324. https://doi.org/10.1667/RR14695.1
Последствия радиоактивного загрязнения реки Течи / Под ред. докт. мед. наук профессора Аклеева А.В. Челябинск: Книга, 2016. 400 с.
Fenech M. The cytokinesis-block micronucleus technique and its application to genotoxicity studies in human populations // Environ Health Perspect. 1993. № 3. P. 101–107. https://doi.org/10.1289/ehp.93101s3101
Дёгтева М.О., Шагина Н.Б., Воробьева М.И. и др. Современное представление о радиоактивном загрязнении реки Теча в 1949–1956 гг. // Радиац. биология. Радиоэкология. 2016. Т. 56. № 5. С. 523–534. https://doi.org/10.7868/S0869803116050039
Ахмадуллина Ю.Р. Радиочувствительность Т-лимфоцитов периферической крови у потомков первого поколения, отцы которых подверглись хроническому радиационному воздействию: Дис. … канд. биол. наук. М., 2014. 134 с.
Fenech M., Chang W.P., Kirsch-Volders M., Holland N. et al. HUMN project: detailed description of the scoring criteria for the cytokinesis-block micronucleus assay using isolated human lymphocyte cultures // Mutat. Res. 2003. V. 534. № 1–2. P. 65–75. https://doi.org/10.1016/S1383-5718(02)00249-8
Гланц С. Медико-биологическая статистика / Пер. с англ. М.: Практика, 1998. 459 с.
Аклеев А.В., Алещенко А.В., Готлиб В.Я., и др. Адаптивные способности лимфоцитов крови у жителей Южного Урала, подвергшихся хроническому облучению // Радиац. биология. Радиоэкология. 2004. Т. 44. № 4. С. 426–431.
Fenech M., Bonassi S. The effect of age, gender, diet and lifestyle on DNA damage measured using micronucleus frequency in human peripheral blood lymphocytes // Mutagenesis. 2011. V. 26. №1. P. 43–49. https://doi.org/10.1093/mutage/geq050
Tucker J.D., Nath J., Hando J.C. Activation status of the X chromosome in human micronucleated lymphocytes // Hum. Genet. 1996. № 4. P. 471–475.
Norppa H., Falck G.C. What do human micronuclei contain? // Mutagenesis. 2003. V. 18. № 3. P. 221–233.
Ohtaki K., Kodama Y., Nakano M., Itoh M. et al. Human fetuses do not register chromosome damage inflicted by radiation exposure in lymphoid precursor cells except for a small but significant effect at low doses // Radiat. Res. 2004. V. 161. № 4. P. 373–379.
Akleyev A., Deltour I., Krestinina L., Sokolnikov M. et al. Incidence and mortality of solid cancers in people exposed in utero to ionizing radiation: pooled analyses of two cohorts from the Southern Urals, Russia // PLoS One. 2016. V. 11. № 8. P.https://doi.org/10.1371/journal.pone.0160372.eCollection
Alsbeih G., Al-Meer R.S., Al-Harbi N., Bin Judia S. et al. Gender bias in individual radiosensitivity and the association with genetic polymorphic variations // RadiotherOncol. 2016. V. 119. № 2. P. 236–243. https://doi.org/10.1016/j.radonc.2016.02.034
Morgan W.F. Radiation-induced genomic instability // Health Phys. 2011. V. 100. № 3. P. 280–281. https://doi.org/10.1097/HP.0b013e3182082f12
Дополнительные материалы отсутствуют.