Генетика, 2020, T. 56, № 4, стр. 451-462
Хромосомная нестабильность и генетический полиморфизм у рабочих угольных шахт и теплоэлектростанций
В. И. Минина 1, *, Я. А. Савченко 1, М. Л. Баканова 1, А. В. Рыжкова 1, А. О. Соколова 2, А. В. Мейер 2, Т. А. Толочко 2, Е. Н. Воронина 3, В. Г. Дружинин 2, А. Н. Глушков 1
1 Федеральный исследовательский центр угля и углехимии Сибирского отделения
Российской академии наук
650099 Кемерово, Россия
2 Кемеровский государственный университет
650000 Кемерово, Россия
3 Институт химической биологии и фундаментальной медицины Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
* E-mail: vminina@mail.ru
Поступила в редакцию 24.04.2019
После доработки 26.06.2019
Принята к публикации 02.07.2019
Аннотация
Проведен молекулярно-генетический анализ полиморфных вариантов генов CYP1A1, CYP1A2, CYP2D6, CYP2E1, EPHX1, GSTP1, GSTM1, GSTT1, APEX1, hOGG1, PARP1, XPD, XPG, XPC, ATM, NBS1, XRCC1, XRCC2, XRCC3, XRCC4, Ligase IV, SOD2, GPx1, CAT, TР53, TGFβ, TNFα, MTHFR, MTR и выполнен цитогенетический анализ хромосомных аберраций в лимфоцитах крови 288 шахтеров угольных шахт Кузбасса, 365 рабочих угольных теплоэлектростанций и 642 жителей Кемеровской области, не работавших на промышленных предприятиях. Установлено, что частота аберраций хромосом в группе шахтеров (4.06 ± 0.15%) и рабочих теплоэлектростанций (3.19 ± 0.09%) была значимо выше, чем в группе индивидов, не работавших на производстве (1.53 ± 0.05%, р < 0.00001). Повышенная частота повреждений хромосом у шахтеров оказалась связана с генетическими вариантами XPD rs13181 и XRCC4 rs2075685, а у энергетиков – с TGFβ rs1800469.
Условия труда на угольных предприятиях характеризуются выраженным негативным воздействием на организм рабочих. Наиболее опасные токсиканты, связанные с добычей и переработкой угля, – это угольные пылевые частицы разного размера, полициклические ароматические углеводороды, тяжелые металлы, кварц. Кроме того, уголь содержит природные радиоактивные вещества уранового, актиноуранового и ториевого рядов. Комплексное действие этих радиационных и химических факторов способно вызывать различные виды повреждений ДНК, возможно появление эпигенетических аномалий, изменение экспрессии генов, а на уровне популяции – повышение онкологической заболеваемости населения [1–3].
В настоящее время активно изучаются различные генетические биомаркеры эффекта воздействия производственной среды на организм человека (молекулярные, молекулярно-цитогенетические, кариологические и классические цитогенетические тесты). Наиболее богатый материал накоплен в результате анализа нестабильных структурных хромосомных аберраций (ХА) в лимфоцитах крови. Отмечено повышение уровня ХА у рабочих различных угольных предприятий [4–6]. При этом отмечено, что интенсивность хромосомного мутагенеза зависит от конкретных производственных условий и конституциональных особенностей организма, определяемых генетическим полиморфизмом ферментов биотрансформации ксенобиотиков, репарации ДНК, антиоксидантной системы, метилирования ДНК, контроля клеточного цикла и апоптоза и др. [4, 7–14]. В связи с этим цель данного исследования – сравнительный анализ хромосомной нестабильности и полиморфизма генов у рабочих угольных шахт и теплоэлектростанций, работающих на угле.
МАТЕРИАЛЫ И МЕТОДЫ
В марте 2017 г. и апреле 2018 г. было обследовано 1295 человек русской национальности, проживающих в Кемеровской области. В производственные группы включили 288 шахтеров угольных шахт Кузбасса (шахта Березовская и шахта Первомайская), 365 рабочих угольных теплоэлектростанций (Кемеровская ГРЭС и Новокемеровская ТЭЦ) и 642 условно здоровых донора станции переливания крови г. Кемерово, не работавших на промышленных предприятиях (контроль). Характеристика обследованных групп, включенных в исследование, представлена в табл. 1.
Таблица 1.
Характеристика обследованных групп
| Показатели | Шахтеры | Рабочие ТЭС | Контроль |
|---|---|---|---|
| Объем выборки (N) | 288 | 365 | 642 |
| Возраст (лет), M ± St.Err | 48.4 ± 0.5 | 51.5 ± 0.4 | 49.8 ± 0.2 |
| Min–Max | 30–69 | 34–69 | 41–67 |
| Пол: абс. (%) | |||
| Мужчины | 284 (98.6) | 276 (75.6) | 558 (86.9) |
| Женщины | 4 (1.4) | 89 (24.4) | 84 (13.1) |
| Статус курения: абс. (%) | |||
| Курильщики | 141 (48.8) | 137 (37.5) | 261 (40.6) |
| Некурящие | 147 (51.2) | 228 (62.5) | 381 (59.4) |
Критерии включения в исследование: шахтеры – проходчики, горнорабочие очистного забоя, горные мастера, подземный стаж 10 и более лет; рабочие угольной теплоэлектростанции (энергетики) – слесари, машинисты, проработавшие в основных производственных цехах ТЭЦ не менее 10 лет; контроль – доноры крови Кемеровского областного центра крови, не работавшие на промышленных предприятиях, близкого поло-возрастного состава; русская национальность; место рождения – территория Кемеровской области. Критерии исключения: наличие профессионально обусловленной патологии, а также наличие онкологических, инфекционных, аутоиммунных, наследственных заболеваний, прием лекарственных препаратов и рентгенодиагностические процедуры за три месяца до обследования.
Материалом для исследования послужила цельная периферическая кровь, забиравшаяся в асептических условиях квалифицированным медицинским персоналом в вакутейнеры с Li-гепарином и с ЭДТА. Подготовку препаратов для учета хромосомных аберраций выполняли по стандартному протоколу в соответствии с требованиями, описанными нами ранее [15, 16]. Геномную ДНК выделяли из периферической крови с помощью метода фенол-хлороформной экстракции [17]. Анализ полиморфных локусов проводили методом полимеразной цепной реакции синтеза ДНК (ПЦР) на амплификаторах: CFX96 и С1000 (Bio-Rad, США). Протяженные делеции в генах GSTM1 и GSTT1 анализировали методом мультиплексной ПЦР с флуоресцентной детекцией результатов в режиме реального времени, полиморфизм локусов 3801T>C (rs4646903) гена CYP1A1, 163С>A (rs762551) гена CYP1A2, 2549delA (rs35742686) гена CYP2D6, –1055C>T (rs2031920) гена CYP2E1, 341C>T (rs1138272) и 313A>G (rs1695) гена GSTP1, 563G>A (rs3218536) гена XRCC2, 722C>T (rs861539) гена XRCC3, 677C>T (rs1801133) гена MTHFR, 2756A>G (rs1805087) гена MTR, 47Т>С (rs4880) гена SOD2, 599C>T (rs1050450) гена GPx1, –308G>A (rs1800629) гена TNFα, 215G>C (rs1042522) гена TР53 изучали с использованием технологии конкурирующих TaqMan-зондов по программам, рекомендованным производителем набора (ООО “СибДНК”, г. Новосибирск). Полиморфизм локусов 839G>A (rs25489), 1196A>G (rs25487), 580C>T (rs1799782) гена XRCC1, 444T>G (rs1130409) гена APEX1, 977C>G (rs1052133) гена hOGG1, 2285T>C (rs1136410) гена PARP1, 2251A>C (rs13181) гена XPD, 3310G>C (rs17655) гена XPG, 2815C>A (rs2228001) гена XPC, 5557G>A (rs1801516) гена ATM, 553G>С (rs1805794) гена NBS1, –652G>T (rs2075685) гена XRCC4, p.Ala3Val С>T (rs1805389) гена Ligase IV, –262C>T (rs1001179) гена CAT, –509C>T (rs1800469) гена TGFβ, 337T>C (rs1051740) гена EPHX1 определяли методом аллель-специфической ПЦР с использованием наборов “SNP-экспресс” (НПФ “Литех”, г. Москва). Характеристика изученных полиморфных вариантов представлена в табл. 2. Последовательности праймеров и условия проведения исследований были подробно описаны нами ранее [15].
Таблица 2.
Характеристика изученных локусов
| Ген | Полиморфизм | RefSNP | Локализация в геноме |
|---|---|---|---|
| APEX1 | 444T>G | rs1130409 | 14q11.2-q12 |
| hOGG1 | 977C>G | rs1052133 | 3p26.2 |
| PARP1 | 2285T>C | rs1136410 | 1q42.12 |
| XPD | 2251T>G | rs13181 | 19q13.32 |
| XPG | 3310G>C | rs17655 | 13q33 |
| XPC | 2815A>C | rs2228001 | 3p25 |
| АТМ | 5557G>A | rs1801516 | 11q22-q23 |
| NBS1 | 553С>G | rs1805794 | 8q21 |
| XRCC1 | 839G>A | rs25489 | 19q13.2 |
| 1196A>G | rs25487 | 19q13.2 | |
| 580C>T | rs1799782 | 19q13.2 | |
| XRCC2 | 563G>A | rs3218536 | 7q36.1 |
| XRCC3 | 722C>T | rs861539 | 14q32.3 |
| XRCC4 | –652G>T | rs2075685 | 5q14.2 |
| Ligase IV | p.Ala3Val С>T | rs1805389 | 13q33-q34 |
| CYP1A1 | 3801T>C | rs4646903 | 15q22 |
| CYP1A2 | –163С>A | rs762551 | 15q22 |
| CYP2D6 | 2549delA | rs35742686 | 22q13.1 |
| CYP2E1 | –1055C>T | rs2031920 | 10q24.3 |
| EPHX1 | 337T>C | rs1051740 | 1q42.1 |
| GSTP1 | 313A>G | rs1695 | 11q13 |
| 341С>Т | rs1138272 | 11q13 | |
| GPx1 | 599C>T | rs1050450 | 3р21.3 |
| SOD2 | 47Т>С | rs4880 | 6q25.3 |
| CAT | –262C>T | rs1001179 | 11p13 |
| TGFβ | –509C>T | rs1800469 | 19q13 |
| TNFα | –308G>A | rs1800629 | 6 р21.3-р21.2 |
| ТР53 | 215G>C | rs1042522 | 17p13.1 |
| MTHFR | 677C>T | rs1801133 | 1p36.3 |
| MTR | 2756A>G | rs1805087 | 1q43 |
Статистическую обработку результатов выполняли с использованием пакетов прикладных программ “Statistica 10.0”, “SNPStats”, онлайн-ресурса: http://ihg.gsf.de/cgi-bin/hw/hwa1.pl. Нулевую гипотезу отвергали при p < 0.05. При проведении сравнительного анализа частоты ХА в зависимости от генотипов (и их комбинаций) при сопоставлении трех и более групп использовали ранговый критерий Краскела–Уоллиса (Kruskal–Wallis H-test). При обнаружении статистически значимых различий между группами в дальнейшем проводили апостериорные сравнения с помощью критерия Манна–Уитни (UM-W). Для оценки порогового значения показателя частоты ХА использовали расчет величины AUC (Area Under Curve) с помощью ROC-анализа по формуле: AUC = (SP + SE)/2, где SP – специфичность теста, SE – чувствительность теста. Для исследования межгенных взаимодействий использовали метод Multifactor Dimensionality Reduction (MDR). На основании полученных моделей проводили кластерный анализ взаимодействия генов и строили дендрограммы результатов моделирования межгенных взаимодействий. При этом короткие линии указывали на сильное взаимодействие генов, длинные – на слабую связь [18].
РЕЗУЛЬТАТЫ
В результате анализа 260 000 метафазных пластинок установлено, что частота аберраций хромосом в группе шахтеров составила 4.06 ± 0.15% (размах: 0–14.0%), в группе рабочих теплоэлектростанций 3.19 ± 0.09% (размах: 0–12.0%) и была значимо выше, чем в группе индивидов, не работавших на производстве: 1.53 ± 0.05% (размах: 0–8%; р < 0.00001). При этом статистически значимых корреляций между параметрами “частота ХА и возраст, стаж работы или длительность курения” выявлено не было. Уровень цитогенетических нарушений не различался у мужчин и женщин. Анализ качественного спектра повреждений хромосом показал, что в группе шахтеров аберрации как хроматидного (2.34 ± 0.10%), так и хромосомного (1.86 ± 0.08%) типа регистрировались в 2.4 раза чаще, чем в контроле (0.97 ± 0.04 и 0.88 ± ± 0.22% соответственно, р < 0.0001). В группе энергетиков различия с контролем по интегральным показателям достигали 1.5–1.8 раз. Наибольшие отличия отмечены в отношении частоты парных фрагментов (в 3 раза больше), дицентрических хромосом (в 2.6 раз чаще). Обратило на себя внимание сходство данных показателей в группах энергетиков и шахтеров. Частоты дицентрических хромосом с фрагментами не различались в группах шахтеров (0.05 ± 0.01%) и энергетиков (0.05 ± 0.01%) и были значимо выше, чем в контроле (0.02 ± 0.004%; р < 0.0001). Частота кольцевых хромосом в группе энергетиков (0.11 ± 0.02%) регистрировалась в 2.2 раза чаще, чем в контроле (0.05 ± 0.01%; р < 0.001), у шахтеров – в 3.6 раз чаще (0.18 ± 0.02%; р < 0.01).
Анализ распределения частот генотипов показал соответствие равновесию Харди–Вайнберга большинства изученных локусов. Исключением явились локусы APEX1 444T>G rs1130409, NBS1 553C>G rs1805794, EPHX1 337T>C rs1051740, которые в дальнейшем из анализа были исключены. Статистически значимых различий в распределении частот аллелей и генотипов изучаемых полиморфных локусов между группами рабочих и контролем выявлено не было.
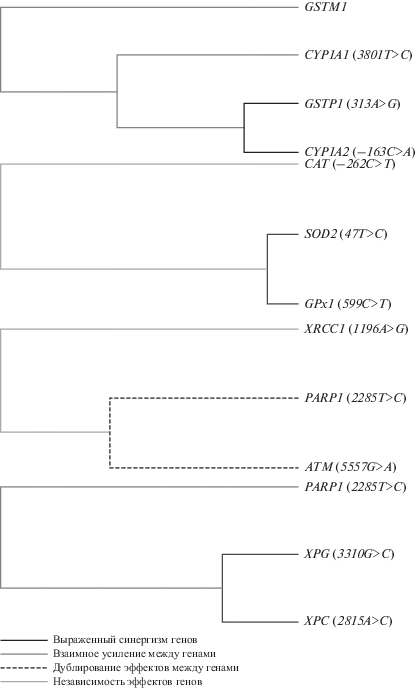
В результате сопоставления молекулярно-генетических и цитогенетических характеристик было установлено, что формирование повышенного уровня частоты аберраций хромосом у шахтеров преимущественно связано с генетическими вариантами: XPD rs13181, XRCC4 rs2075685; у рабочих угольных теплоэлектростанций – с вариантами гена TGFβ rs1800469 (рис. 1). В контрольной группе никаких отличий частоты ХА у индивидов с различными вариантами генотипов изученных генов выявлено не было.
Рис. 1.
Частота хромосомных аберраций в зависимости от генотипов в группах шахтеров и рабочих теплоэлектростанций. Звездочка – р < 0.01 отличие от шахтеров с генотипом ТТ гена XPD, отличие от шахтеров с генотипом GG гена XRCC4; отличие от энергетиков с генотипом СС гена TGFβ.
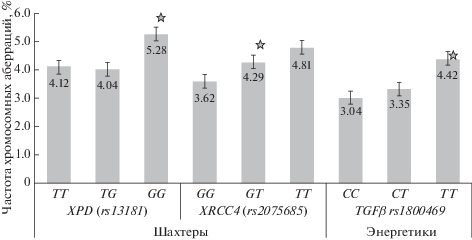
Повышенная частота аберраций хроматидного типа у шахтеров была связана с минорными вариантами генов TGFβ rs1800469 и XPD rs13181, а повышенная частота аберраций хромосомного типа – с минорным генотипом XPD rs13181. Причем все наблюдаемые ассоциации встречались только в группах мужчин курильщиков. Ассоциации вариантов гена XRCC4 rs2075685 с отдельными видами аберраций хромосом не достигали уровня статистической значимости. В группе энергетиков повышенная частота аберраций хроматидного типа была связана с минорными вариантами TGFβ rs1800469 (табл. 3).
Таблица 3.
Частоты аберраций хроматидного и хромосомного типов (%) в зависимости от генотипов в группе шахтеров и рабочих теплоэлектростанций (энергетики)
| Локусы и генотипы | Аберрации хроматидного типа | Аберрации хромосомного типа | |||||
|---|---|---|---|---|---|---|---|
| Ме | Min–Max | M ± St.Err | Ме | Min–Max | M ± St.Err | ||
| Шахтеры | |||||||
| TGFβ rs1800469 C>T |
CC | 1.5 | 0–10.0 | 2.28 ± 0.18* | 2.0 | 0–8.0 | 1.82 ± 0.13 |
| CT | 2.0 | 0–8.5 | 2.27 ± 0.18 | 1.5 | 0–6.5 | 1.70 ± 0.14 | |
| TT | 3.0 | 0–12.0 | 2.97 ± 0.31** | 1.0 | 0–6.0 | 1.52 ± 0.18 | |
| XPD rs13181 T>G |
TT | 2.0 | 0–8.5 | 2.33 ± 0.16 | 2.0 | 0–8.0 | 2.49 ± 0.25 |
| TG | 2.0 | 0–10.0 | 2.25 ± 0.14 | 1.5 | 0–9.0 | 1.78 ± 0.12***** | |
| GG | 2.5 | 0–12.0 | 2.80 ± 0.38*** | 1.5 | 0–11.5 | 1.80 ± 0.13**** | |
| Энергетики | |||||||
| TGFβ rs1800469 C>T |
CC | 1.0 | 0–6.6 | 1.45 ± 0.10 | 1.14 | 0–8.0 | 1.54 ± 0.08 |
| CT | 1.0 | 0–8.5 | 1.66 ± 0.16 | 1.0 | 0–7.0 | 1.67 ± 0.14 | |
| TT | 2.0 | 0–3.5 | 1.83 ± 0.32# | 2.0 | 0–9.0 | 2.60 ± 0.60 | |
| XPD rs13181 T>G |
TT | 1.0 | 0–6.5 | 1.45 ± 0.12 | 1.5 | 0–9.0 | 1.78 ± 0.12 |
| TG | 1.0 | 0–8.5 | 1.58 ± 0.12 | 1.0 | 0–8.0 | 1.52 ± 0.10 | |
| GG | 1.5 | 0–4.5 | 1.64 ± 0.25 | 1.2 | 0–4.7 | 1.41 ± 0.20 | |
Примечание. В группе шахтеров: * при сравнении с аналогичным показателем у обладателей TGFβ ТТ р = 0.001; ** при сравнении с TGFβ СТ р = 0.01; *** при сравнении с XPD TG р = 0.04; **** при сравнении с XPD TT р = 0.004; ***** при сравнении с XPD GG р = 0.0003. В группе энергетиков: # при сравнении с аналогичным показателем у обладателей с TGFβ СС р = 0.03.
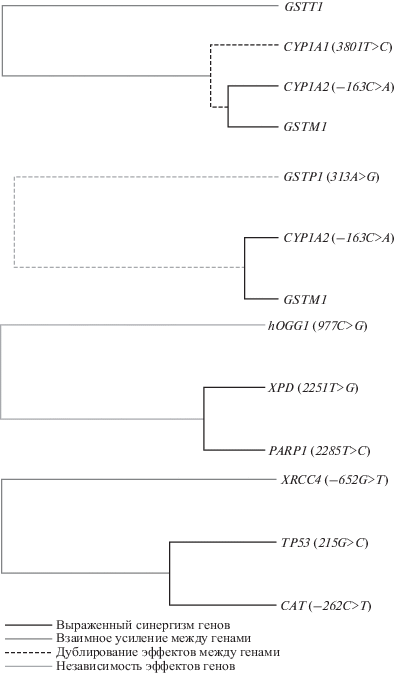
С помощью ROC-анализа было установлено, что пороговое значение частоты ХА 3% является хорошим классификатором разделения обследуемых рабочих на подгруппы с низкой и высокой частотой ХА как для работников угольных шахт (AUC = 0.764, SP = 0.872, SE = 0.656; р < 0.0001), так и для работников угольных теплоэлектростанций (AUC = 0.762, SP = 0.872, SE = 0.651; р < 0.0001). Далее было проведено моделирование межгенных взаимодействий методом MDR-анализа, в результате которого были выбраны оптимальные модели, характеризовавшиеся наиболее высокой значимостью (РSign Test: 0.0001–0.0025), точностью (Precision от 0.8073 до 0.7314) и максимальной воспроизводимостью (во всех случаях CVC 10 из 10). Информативные модели межгенных взаимодействий, предрасполагающих к формированию повышенного уровня ХА, в группе шахтеров (рис. 2): CYP1A1–CYP1A2–GSTP1–GSTM1 (выявлен синергизм эффектов генов CYP1A2 и GSTP1), SOD2–GPx1–CAT (отмечено взаимное усиление эффектов SOD2 и GPx1), РАRP1–АТМ–XRCC1 (выявлено тесное взаимодействие между РАRP1 и АТМ, но их влияние дублировалось), XPG–XPC–РАRP1 (тесное взаимодействие и взаимное усиление эффектов всех локусов); в группе рабочих угольных теплоэлектростанций (рис. 3): CYP1A1–CYP1A2–GSTT1–GSTM1 (тесное взаимодействие между генами CYP1A2 и GSTM1, образовавшими единый кластер с локусом CYP1A1, который дублировал эффекты данных генов), CYP1A2–GSTP1–GSTM1 (как и в первой модели, было показано тесное взаимодействие между полиморфными локусами CYP1A2 и GSTM1, образующими единый кластер с локусом GSTP1, который дублировал эффекты данных генов), XPD–PARP1–hOGG1 (синергизм эффектов XPD и PARP1), TР53–CAT–XRCC4 (кластерный анализ выявил тесное взаимодействие и взаимно усиливающее действие между всеми полиморфными локусами, образующими данную модель).
ОБСУЖДЕНИЕ
Результаты цитогенетического анализа хромосом в лимфоцитах крови жителей Кемеровской области свидетельствуют о высокой генотоксической опасности условий труда рабочих, занятых в угледобывающей промышленности и теплоэнергетике, что согласуется с выводами проведенных ранее исследований [4–6, 16, 19]. Наиболее высокий уровень повреждений хромосом был зарегистрирован у шахтеров, работающих под землей (проходчики, горнорабочие очистного забоя). Однако и у работников теплоэлектростанций (машинисты, слесари) уровень хромосомной нестабильности в 2 раза превышал контрольные значения. Не было отмечено влияния возраста, пола, продолжительности курения и стажа работы на уровень цитогенетических повреждений у обследованных индивидов, что свидетельствует о том, что наблюдаемые эффекты связаны, главным образом, с действием на рабочих генотоксических агентов производственной среды, а влияние других возможных факторов сведено к минимуму.
Важно отметить повышение частоты встречаемости в производственных группах дицентрических и кольцевых хромосом. Это свидетельствует о выраженном воздействии мутагенов лучевой природы на рабочих как при добыче угля, так и при его сжигании в условиях теплоэлектростанций. Данный вывод согласуется с результатами ранее проведенных исследований [15, 16, 19–21].
Широкая межиндивидуальная вариабельность уровня повреждений хромосом одновременно и у экспонированных, и у неэкспонированных индивидов ставит вопрос о существовании генетической предрасположенности к формированию ХА. Исследования, изучающие генетические основы повышенной частоты повреждений хромосом, в основном сосредоточены на анализе генов белков репарации ДНК, метаболизма ксенобиотиков, контрольных точек клеточного цикла и метаболических генов [11–15].
В настоящем исследовании было установлено, что формирование повышенного уровня аберраций хромосом у шахтеров преимущественно связано с генетическими вариантами: XPD rs13181 и XRCC4 rs2075685. Ген XРD/ERCC2 (xeroderma pigmentosum D) локализован на хромосоме 19q13.32 и кодирует фермент хеликазу (5' → 3'), участвующую в эксцизионной репарации нуклеотидов. Замена 2251T>G меняет конфигурацию белка и может влиять на его взаимодействие с хеликазным активатором p44. Функциональное значение вариантов XРD/ERCC2 пока не вполне ясно, но показано, что некоторые варианты могут быть ассоциированы с уменьшением репаративной способности [22]. Изучение повреждений хромосом в связи с полиморфными вариантами гена XPD дало противоречивые результаты. В исследовании Л.Е. Сальниковой [23] было показано, что минорные аллели гена XPD (сайты T2251G (Lys751Gln) и G862A (Asp312Asn)) сопряжены с повышенным уровнем спонтанных аберраций хромосомного типа у здоровых добровольцев и у ликвидаторов последствий аварии на Чернобыльской АЭС. В то же время Vodicka [14] в большой выборке здоровых жителей Богемии и Словакии наблюдал значимо более низкую частоту аберраций хроматидного типа у гомозигот по вариантному аллелю XPD (OR 0.64, 95% CI 0.48–0.85, р = 0.004). В данном исследовании у здоровых шахтеров с минорным генотипом GG гена XPD была зарегистрирована более высокая суммарная частота ХА и частота аберраций хромосомного типа. Ранее подобная ассоциация наблюдалась в группе шахтеров с легочными профессиональными заболеваниями [24]. Можно предположить, что специфические факторы производственной среды угольных шахт (возможно, ионизирующее излучение) способны выступать в качестве триггера для реализации эффектов данного полиморфизма.
В группе шахтеров также был выявлен вклад вариантов гена XRCC4 (X-ray repair cross-complementing protein 4) в формирование высокого уровня хромосомной нестабильности. Данный ген кодирует один из ключевых белков, участвующих в процессе восстановления двунитевых разрывов ДНК по типу NHEJ (негомологичное слияние концов) [25]. Белок XRCC4 усиливает активность Lig4 [26]. В фибробластах, экспонированных ксенобиотиками, усиление экспрессии данного гена приводит к увеличению уровня повреждения ДНК [27]. В настоящем исследовании впервые были показаны более высокие уровни ХА у шахтеров с минорными аллелями XRCC4 (rs2075685). Ранее было показано, что комбинация определенных вариантов генов XRCC4–hOGG1–XRCC1–ADPRT способна модулировать уровень цитогенетических повреждений в лимфоцитах крови шахтеров, измеряемый с помощью микроядерного теста с цитохалазиновым блоком [28].
При обследовании рабочих теплоэлектростанций было впервые установлено, что формирование повышенного уровня аберраций хромосом связано с вариантами гена TGFβ rs1800469. TGFβ (трансформирующий фактор роста β) – полифункциональный цитокин, принимающий участие в регуляции процессов пролиферации, дифференцировки и миграции клеток, инициации апоптоза, а также являющийся центральным звеном в ряде метаболических реакций. TGFβ останавливает клеточный цикл на фазе G1, ингибирует рост клеток, а также способствует индукции апоптоза [29]. Наиболее хорошо изучен однонуклеотидный полиморфизм в промоторной области гена TGFβ –509C>T (rs1800469). Аллель T связан с увеличением количества продуцируемого белка. Были выявлены ассоциации данного полиморфизма и различных многофакторных заболеваний (рак молочной железы, желудка, простаты; хроническая обструктивная болезнь легких, фиброз печени, атеросклеротический кардиосклероз, болезнь Берже, пародонтит, болезнь Альцгеймера, остеопороз и др.) [30]. Взаимосвязь данного полиморфного варианта с накоплением повреждений ДНК у рабочих промышленных предприятий впервые выявлена в настоящем исследовании.
Формирование повышенного уровня ХА в лимфоцитах крови у рабочих угольных теплоэлектростанций ранее связывали с вариантами таких генов, как CYP1А1 (rs4646903), hOGG1 (rs1052133), XRCC1 (rs25487), APEX1 (rs1130409), и c комбинациями локусов: CYP1A1 (rs4646903, T>C)–CYP1A2 (rs762551, C>A)–GSTT1 (del); XRCC1 (rs25487, G>A)–MTHFR (rs1801133, C>T)–GSTT1 (del); XRCC1 (rs25487, G>A)–APEX1 (rs1130409, T>G)–TР53 (rs1042522, G>C) [15].
В настоящем исследовании как у энергетиков, так и у шахтеров наблюдали значимый вклад в накопление повреждений хромосом взаимодействующих генов ферментов биотрансформации ксенобиотиков: CYP1A1 (3801T>C), CYP1A2 (–163C>A), GSTT1 (del), GSTM1 (del), GSTP1 (313A>G). Наличие вариантов, сопряженных с повышением активности ферментов I фазы метаболизма ксенобиотиков, при отсутствии эффективной детоксикации во время II фазы (например, в случае делеции гена GSTТ1 или GSTM1) делает возможным накопление значительного количества повреждений ДНК. Кроме того, в группе рабочих ТЭЦ впервые была выявлена статистически значимая модель, включающая гены репарации ДНК: XPD (2251Т>G), PARP1 (2285T>C) и hOGG1 (977C>G). Ген PARP1 кодирует поли-АДФ-рибозил-полимеразу, которая модифицирует различные ядерные белки, участвует в репарации ДНК и ремоделировании хроматина. Несинонимичный полиморфизм 2285T>C (rs1136410), приводящий к аминокислотной замене Val762Ala, ассоциирован с уменьшением его способности связывания с XRCC1 и другими протеинами, со сниженной функциональной активностью фермента, связан с высоким уровнем микроядер в лимфоцитах (вариант с цитокинетическим блоком) рабочих, контактировавших с высокими дозами формальдегида [10]. Ген hOGG1 кодирует ДНК-гликозилазу, которая удаляет из ДНК остатки 8-оксогуанина, образующегося под действием активных форм кислорода. Ранее было показано, что минорный аллель hOGG1 G (326Cys) ассоциирован со сниженной активностью фермента и приводит к повышению риска хромосомной нестабильности у шахтеров и энергетиков [15, 28]. Нами не было отмечено тенденции к более частой встречаемости генотипов PARP1 и hOGG1 у рабочих с высоким уровнем хромосомных аберраций. Полученные результаты свидетельствуют о важной роли межгенных взаимодействий при формировании повышенного уровня хромосомной нестабильности у сотрудников угольных предприятий.
Еще одна модель, детерминирующая повышенный уровень ХА у рабочих угольных теплоэлектростанций, включала помимо вышеуказанного гена фермента репарации ДНК XRCC4 также ген-триггер TР53 и ген каталазы CAT. Известно, что ТР53 кодирует белок, регулирующий экспрессию генов, вовлеченных в контроль клеточного цикла, репарацию ДНК, апоптоз, антиоксидантную защиту [31]. Полиморфизм rs1042522 в экзоне 4, связанный с заменой Arg>Pro, ассоциирован с накоплением повреждений ДНК и с различными заболеваниями, в том числе раком легкого, груди, кожи и другими формами онкопатологии [32, 33]. Ген CAT кодирует фермент каталазу, расщепляющую перекись водорода до воды и молекулярного кислорода. Замена rs1001179 C>T в промоторной области гена САТ влияет на эффективность связывания с фактором транскрипции и коррелирует с уровнем каталазы в крови [34]. Снижение уровня каталазы на фоне окислительного стресса, развивающегося при действии факторов производственной среды, потенциально способно модифицировать уровень повреждений хромосом в клетках крови.
В группе шахтеров (помимо взаимодействующих генов ферментов биотрансформации ксенобиотиков) была выявлена модель, включающая гены, кодирующие ферменты антиоксидантной системы клетки: супероксиддисмутазу (SOD2), способную превращать супероксидные радикалы в перекись водорода; глутатионпероксидазу (hGPX) и каталазу (САТ), осуществляющие расщепление перекиси водорода до воды и молекулярного кислорода. Cинергизм эффектов наблюдался в отношении локусов SOD2 47С>Т и GPx1 (599C>T) (рис. 1). Полиморфизм 47С>Т гена SOD2, приводящий к замене аланина на валин в 16-м положении, приводит к дестабилизации альфа-спирального участка в белке, что влияет на перенос фермента из цитоплазмы в матрикс митохондрий. В результате у носителей генотипа ТТ накапливается супероксид, что приводит к большей выраженности окислительных повреждений ДНК [35]. Полиморфизм Pro198Leu гена GPx1 может сказываться на каталитической активности фермента, на его сродстве к субстрату, на специфичности, стабильности структуры и т.д. У носителей аллеля Т каталитическая активность фермента ниже на 5% для каждой дополнительной копии Т [36]. Сочетание таких вариантов генов способно приводить к снижению возможности клетки противостоять эффектам окислительного стресса.
Значимую роль в формировании повреждений хромосом у рабочих угольных шахт также играют взаимодействующие гены репарации: РАRP1–АТМ–XRCC1 и РАRP1–XPG–XPC, причем ген РАRP1 наблюдался в моделях взаимодействий генов, у рабочих как угольных шахт, так и теплоэлектростанций. У шахтеров-подземщиков было показано взаимодействие локусов PARP1 2285T>C и АТМ 5557G>A. Протеин АТМ играет ведущую роль в инициации процессов ответа клетки на формирование двунитевых разрывов ДНК (таких как репарация, транскрипция, контроль клеточного цикла, апоптоз) [37]. Замена G>A в гене АТМ (rs1801516) ослабляет взаимодействие с энхансером и способствует альтернативному сплайсингу 39-го экзона [38], приводит к уменьшению уровня экспрессии АТМ и способности распознавания повреждений ДНК [39].
Также значимый вклад в хромосомную нестабильность у шахтеров наряду с РАRP1 демонстрировали гены, кодирующие ферменты эксцизионной репарации нуклеотидов XPG и XPC. XРG взаимодействует с комплексом TFIIH, который обеспечивает прикрепление геликаз и правильное расплетание цепей ДНК, делая их доступными для действия эндонуклеаз. Нарушение взаимодействия XРG–TFIIH приводит к диссоциации геликаз и нарушению белкового комплекса, прерывая процесс репарации. Было показано статистически значимое уменьшение общей частоты хромосомных аберраций и встречаемости аберраций хроматидного типа у обладателей вариантного аллеля С (3310G>C), профессионально контактирующих с цитостатиками [40]. XPC – это ключевой фактор, который сканирует повреждения ДНК и инициирует эксцизионную репарацию нуклеотидов в клетках млекопитающих [41]. Наиболее часто изучаемый SNP в 15-м экзоне приводит к аминокислотной замене XPC Lys939Gln, которая локализуется вблизи С-домена белка на участке, взаимодействующем с субъединицами комплекса TFIIH XPB и p62. Данная замена приводит к снижению функциональной активности фермента [42]. В ряде работ была показана ассоциация минорного аллеля с изменением чувствительности к повреждениям ДНК, индуцированным афлатоксином В1 [43], винилхлоридом в производственных условиях [44].
Сравнивая паттерны генетических маркеров, связанных с хромосомной нестабильностью в группах шахтеров и энергетиков, можно отметить черты сходства: значимый вклад полиморфных вариантов генов ферментов репарации (XPD, XPG, XPC, XRCC4, PARP1, hOGG1, АТМ); генов, участвующих в регуляции процессов пролиферации, дифференцировки и апоптоза (TGFβ1, TР53); генов, координирующих антиоксидантную систему клетки (SOD2, GPx1, САТ) и биотрансформацию ксенобиотиков (CYP1A1, CYP1A2, GSTP1, GSTM1, GSTT1). В то же время характер взаимосвязей между локусами и вклад отдельных изученных генов в моделях существенно варьировали. Исходя из полученных результатов, можно заключить, что суммарный эффект взаимодействия генов оказался намного сильнее вклада отдельных ДНК-локусов. Это указывает на перспективность дальнейшего поиска ассоциаций с хромосомной нестабильностью максимально большого числа взаимодействующих локусов (например, с использованием GWAS-исследований) [45]. Кроме того, накапливаются сведения о значимой роли дисфункции теломер в формировании повреждений хромосом [46] и о существовании эпигенетических факторов, влияющих на стабильность генома [47].
Исследование проведено при финансовой поддержке государственного задания № 0352-2019-0011 и гранта РФФИ 18-44-420017 р-а.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rohr P., Kvitko K., da Silva F.R. et al. Genetic and oxidative damage of peripheral blood lymphocytes in workers with occupational exposure to coal // Mutat. Res. 2013. V. 758(1–2). P. 23–31. https://doi.org/10.1016/j.mrgentox.2013.08.006
Leon-Mejia G., Sosa M.Q., Rohr P. et al. Environmental Health Risk – Hazardous Factors to Living Species. London: In Tech, 2016. P. 191–209. https://doi.org/10.5772/62486
Мейер А.В., Толочко Т.А., Литвин А.В. и др. Кариологический статус буккальных эпителиоцитов шахтеров с профессиональными легочными патологиями // Гигиена и санитария. 2018. Т. 97(3). С. 220–225. https://doi.org/10.18821/0016-9900-2018-97-3
Ada A.O., Demiroglu C., Yilmazer M. et al. Cytogenetic damage in Turkish coke oven workers exposed to polycyclic aromatic hydrocarbons: Association with CYP1A1, CYP1B1, EPHX1, GSTM1, GSTT1, and GSTP1 gene polymorphisms // Arh. Hig. Rada Toksikol. 2013. V. 64(3). P. 359–369. https://doi.org/10.2478/10004-1254-64-2013-2328
Volobaev V.P., Sinitsky M.Y., Larionov A.V. et al. Modifying influence of occupational inflammatory diseases on the level of chromosome aberrations in coal miners // Mutagenesis. 2016. V. 31(2). P. 225–229. https://doi.org/10.1093/mutage/gev080
Савченко Я.А., Минина В.И., Баканова М.Л., Глушков А.Н. Генотоксические и канцерогенные эффекты воздействия факторов производственной среды угледобывающей и углеперерабатывающей индустрии // Генетика. 2019. Т. 55. № 6. С. 643–654. https://doi.org/10.1134/S0016675819060158
Сальникова Л.Е., Чумаченко А.Г., Лаптева Н.Ш. и др. Аллельные варианты полиморфных генов, сопряженные с повышенной частотой хромосомных аберраций // Генетика. 2011. Т. 47. № 11. С. 1536–1544.
Kadioglu E., Kocabas N.A., Demircigil G.C. et al. Assessment of individual susceptibility to baseline DNA and cytogenetic damage in a healthy Turkish population: evaluation with lifestyle factors // Genet. Test Mol. Biomarkers. 2012. V. 16(10). P. 1157–1164. https://doi.org/10.1089/gtmb.2012.0038
Литвяков Н.В., Гончарик О.О., Фрейдин М.Б. и др. Оценка связи полиморфизма генов с частотой и спектром цитогенетических аномалий у здоровых работников Сибирского химического комбината, подвергавшихся радиационному воздействию (microarray исследования) // Радиац. биология. Радиоэкология. 2013. Т. 53. № 2. С. 137–150.
Costa S., Carvalho S., Costa C. et al. Increased levels of chromosomal aberrations and DNA damage in a group of workers exposed to formaldehyde // Mutagenesis. 2015. V. 30(4). P. 463–473. https://doi.org/10.1093/mutage/gev002
Hemminki K., Frank C., Forsti A. et al. Metabolic gene variants associated with chromosomal aberrations in healthy humans // Genes Chromosomes Cancer. 2015. V. 54(4). P. 260–266. https://doi.org/10.1002/gcc.22239
Santovito A., Cervella P., Delpero M. Evaluation of genomic damage in peripheral lymphocytes from occupationally exposed anesthetists: Assessment of the effects of age, sex, and GSTT1 gene polymorphism // J. Biochem. Mol. Toxicol. 2015. V. 29(5). P. 234–239. https://doi.org/10.1002/jbt.21689
Santovito A., Cervella P., Delpero M. Baseline frequency of chromosomal aberrations and sister chromatid exchanges in peripheral blood lymphocytes of healthy individuals living in Turin (North-Western Italy): assessment of the effects of age, sex and GSTs gene polymorphisms on the levels of genomic damage // Ann. Hum. Biol. 2016. V. 43(3). P. 269–278. https://doi.org/10.3109/03014460.2015.1049205
Vodicka P., Musak L., Vodickova L. et al. Genetic variation of acquired structural chromosomal aberrations // Mutat. Res. Gen. Tox. En. 2018. V. 836. P. 13–21. https://doi.org/10.1016/j.mrgentox.2018.05.014
Савченко Я.А., Минина В.И., Баканова М.Л. и др. Роль межгенных взаимодействий в формировании хромосомных нарушений у работников угольных теплоэлектростанций // Генетика. 2018. Т. 54. № 1. С. 96–108. https://doi.org/10.7868/S0016675818010101
Минина В.И., Нелюбова Ю.А., Савченко Я.А. и др. Оценка повреждений хромосом у рабочих угольных теплоэлектростанций // Медицина труда и промышленная экология. 2019. Т. 3. С. 149–154. https://doi.org/10.31089/1026-9428-2019-3-149-154
Sambrook J., Fritsch E., Maniatis T. Molecular Cloning: A Laboratory Manual, 2nd ed. N.Y.: Cold Spring Harbor Lab. Press, 1982. 545 p.
Moore J.H., Gilbert J.C., Tsai C.T. et al. A flexible computational framework for detecting, characterizing, and interpreting statistical patterns of epistasis in genetic studies of human disease susceptibility // J. Theor. Biol. 2006. V. 241(2). P. 252–261. https://doi.org/10.1016/j.jtbi.2005.11.036
Минина В.И., Кулемин Ю.Е., Толочко Т.А. и др. Генотоксические эффекты воздействия производственной среды у шахтеров Кузбасса // Медицина труда и промышл. экология. 2015. № 5. С. 4–8.
Celik M., Donbak L., Unal F. et al. Cytogenic damage in workers from a coal-fired power plant // Mutat. Res. 2007. V. 627(2). P. 158–163. https://doi.org/10.1016/j.mrgentox.2006.11.003
Donbak L., Rencuzogullari E., Yavuz A., Topaktas M. The genotoxic risk of underground coal miners from Turkey // Mutat. Res. 2005. V. 588(2). P. 82–87. https://doi.org/10.1016/j.mrgentox.2005.08.014
Benhamou S., Sarasin A. ERCC2/XPD polymorphisms and lung cancer // Am. J. Epidemiol. 2005. V. 161. P. 1–14.https://doi.org/10.1093/aje/kwi018
Сальникова Л.Е., Чумаченко А.Г., Веснина И.Н. и др. Полиморфизм генов репарации и цитогенетические эффекты облучения // Радиац. биология. Радиоэкология. 2010. Т. 50. № 6. С. 659–662.
Волобаев В.П., Синицкий М.Ю., Кулемин М.Ю. Цитогенетический статус шахтеров угольных шахт с легочными профессиональными заболеваниями и влияние на него аллелей генов XpD и XpG // Экол. генетика. 2015. Т. 13. № 4. С. 12–15.
Oksenych V., Kumar V., Liu X. et al. Functional redundancy between the XLF and DNA-PKcs DNA repair factors in V(D)J recombination and nonhomologous DNA end joining // Proc. Natl Acad. Sci. USA. 2013. V. 110(6). P. 2234–2239. https://doi.org/10.1073/pnas.1222573110
Chen L., Trujillo K., Sung P. et al. Interactions of the DNA ligase IV-XRCC4 complex with DNA ends and the DNA-dependent protein kinase // J. Biol. Chem. 2000. V. 275(34). P. 26196–26205. https://doi.org/10.1074/jbc.M000491200
Rossner P., Rossnerova A., Beskid O. et al. Non-homologous DNA end joining and chromosome aberrations in human embryonic lung fibroblasts treated with environmental pollutants // Mutat. Res. 2014. V. 763–764. P. 28–38. https://doi.org/10.1016/j.mrfmmm.2014.03.006
Sinitsky M., Minina V., Asanov M. et al. Association of DNA repair gene polymorphisms with genotoxic stress in underground coal miners // Mutagenesis. 2017. V. 32(5). P. 501–509. https://doi.org/10.1093/mutage/gex018
Tsutsumi S., Tomisato W., Hoshino T. et al. Transforming growth factor-ß1 is responsible for maturation-dependent spontaneous apoptosis of cultured gastric pit cells // Experim. Biol. Med. 2002. V. 227. P. 402–411. https://doi.org/10.1177/153537020222700606
Бабышкина Н.Н., Малиновская Е.А., Стахеева М.Н. и др. Роль трансформирующего ростового фактора TGF-β1 в патогенезе рака молочной железы // Сиб. онколог. журн. 2010. № 6(42). С. 1–8.
Volodko N., Salla M., Eksteen B. et al. TP53 codon 72 Arg/Arg polymorphism is associated with a higher risk for inflammatory bowel disease development // World. J. Gastroenterol. 2015. V. 21(36). P. 10358–10366.
Vymetalkova V., Soucek P., Kunicka T. et al. Genotype and haplotype analyses of TP53 gene in breast cancer patients: Association with risk and clinical outcomes // PLoS One. 2015. V. 10(7). e0134463. https://doi.org/10.1371/journal.pone.0134463
He T., Wu J., Chen Y. et al. TP 53 polymorphisms and melanoma: A meta-analysis // J. Cancer Res. Ther. 2015. V. 11(2). P. 409–414.
Forsberg L., Lyrenas L., de Faire U., Morgenstern R. A common functional C-T substitution polymorphism in the promoter region of the human catalase gene influences transcription factor binding, reporter gene transcription and is correlated to blood catalase levels // Free Radic. Biol. Med. 2001. V. 30. P. 500–505.
Sutton A., Imbert A., Igoudjil A. et al. The manganese superoxide dismutase Ala16Val dimorphism modulates both mitochondrial import and mRNA stability // Pharmacogenet Genomics. 2005. V. 15. P. 311–319.
Ravn-Haren G., Olsen A., Tjonneland A. et al. Associations between GPX1 Pro198Leu polymorphism, erythrocyte GPX activity, alcohol consumption and breast cancer risk in a prospective cohort study // Carcinogenesis. 2006. V. 27. P. 820–825.
Lavin M.F., Kozlov S., Gatei M., Kijas A.W. ATM-dependent phosphorylation of all three members of the MRN-complex: from sensor to adaptor // Biomolecules. 2015. V. 5(4). P. 2877–2902.
Thorstenson Y.R., Roxas A., Kroiss R. et al. Contributions of ATM mutations to familial breast and ovarian cancer // Cancer Res. 2003. V. 63. P. 3325–3333.
Heikkinen K., Rapakko K., Karppinen S.M. et al. Association of common ATM polymorphism with bilateral breast cancer // Int. J. Cancer. 2005. V. 116(1). P. 69–72.
Musak L., Polakova V., Halasova E. et al. Effect of occupational exposure to cytostatics and nucleotide excision repair polymorphism on chromosomal aberrations frequency // Interdiscip. Toxicol. 2009. V. 2(1). P. 13–17.
Akita M., Tak Y.S., Shimura T. et al. Sumoylation of xeroderma pigmentosum group C protein regulates DNA damage recognition during nucleotide excision // Sci. Rep. 2015. V. 5. e10984. https://doi.org/10.1038/srep10984
Zhang D., Chen C. A meta-analysis of DNA repair gene XPC polymorphisms and cancer risk // J. Hum. Genet. 2008. V. 53(1). P. 18–33.
Long X.D., Huang H.D., Huang X.Y. et al. XPC codon 939 polymorphism is associated with susceptibility to DNA damage induced by aflatoxin B1 exposure // Int. J. Clin. Exp. Med. 2015. V. 8(1). P. 1197–1204.
Qiu Y.L., Wang W., Wang T. et al. DNA repair gene polymorphisms and micronucleus frequencies in Chinese workers exposed to vinyl chloride monomer // Int. J. Hyg. Environ. Health. 2011. V. 214(3). P. 225–230.
Niazi Y., Thomsen H., Smolkova B. et al. Genetic variation associated with chromosomal aberration frequency: A genome-wide association study // Environ. Mol. Mutagen. 2019. 60(1) P. 17–28. https://doi.org/10.1002/em.22236
Hemminki K., Rachakonda S., Musak L. et al. Telomere length in circulating lymphocytes: Association with chromosomal aberrations // Genes Chromosom. Cancer. 2015. V. 54. P. 194–196.
Васильев С.А., Толмачёва Е.Н., Кашеварова А.А. и др. Статус метилирования ретротранспозона LINE-1 при хромосомном мозаицизме на ранних стадиях эмбрионального развития человека // Мол. биология. 2015. Т. 49. № 1. С. 165–174.
Дополнительные материалы отсутствуют.