Генетика, 2020, T. 56, № 4, стр. 488-492
Межштаммовые различия Pyrenophora tritici-repentis по экспрессии генов ToxA и PtrPf2 в культуре
Н. В. Мироненко 1, *, А. С. Орина 1, Н. М. Коваленко 1
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Пушкин, Россия
* E-mail: nina2601mir@mail.ru
Поступила в редакцию 20.04.2019
После доработки 14.06.2019
Принята к публикации 15.06.2019
Аннотация
Впервые использованы признаки относительного уровня экспрессии гена эффектора ToxA и гена фактора транскрипции PtrPf2 in vitro для характеристики коллекции изолятов возбудителя желтой пятнистости пшеницы Pyrenophora tritici-repentis из географически отдаленных популяций. Показано, что две группы изолятов – из Казахстана (Алматинская обл.) и России (Краснодарский край) различаются по степени генетического разнообразия. Группа краснодарских изолятов более гетерогенна по уровню экспрессии обоих генов. Обнаружена положительная взаимосвязь между уровнями экспрессии обоих генов (r = 0.96, p < 0.001) для краснодарских изолятов. Выявлены статистически значимые различия между группами изолятов по уровню экспрессии гена PtrPf2 (р = 0.002). Высокая вирулентность казахстанских изолятов по предварительным данным связана с высоким уровнем экспрессии гена фактора транскрипции PtrPf2 в этих изолятах. Предполагается связь между уровнем экспрессии гена фактора транскрипции PtrPf2 in vitro и способностью изолятов индуцировать некроз на листьях восприимчивого сорта.
Желтая пятнистость листьев – вредоносное и широко распространенное заболевание пшеницы, вызываемое аскомицетным грибом Pyrenophora tritici-repentis Died. [анаморфа Drechslera tritici-repentis (Died.) Shoemaker]. История исследований патосистемы Triticum aestivum L.− Pyrenophora tritici-repentis началась с 80-х гг. прошлого столетия. Особое внимание было уделено генам ToxA и ToxB, кодирующим токсины белковой природы Ptr ToxA и Ptr ToxB, которые считаются основными факторами патогенности гриба [1, 2].
Ген ToxA находится в центре внимания ученых, изучающих молекулярные механизмы взаимоотношений патогена и растения-хозяина [3–8]. В частности, для селекционеров важны сведения о распространении изолятов с геном ToxA в популяциях патогена, обитающих на территориях выращивания пшеницы, поскольку маркеры гена восприимчивости Tsn1 используются для маркер-ориентированной селекции [9–11].
Ген ToxA также представляет особый интерес как чужеродный генетический элемент, попавший в геном P. tritici-repentis путем горизонтального переноса от другого вида гемибиотрофного патогена пшеницы – возбудителя септориоза пшеницы Parastagonospora nodorum (Berk.) Quaedvl., Verkley & Crous [12]. Ранее нами было показано, что с расширением ареала P. tritici-repentis с юга (Краснодарский край, Дагестан, Южный Казахстан) на север (Северо-Западный регион России, Челябинская и Омская области, Северный Казахстан) в популяциях P. tritici-repentis, обитающих на мягкой пшенице, существенно снижается доля изолятов, несущих ген ToxA [13–15].
Взаимодействие генов ToxA и ToxB и комплементарных им генов восприимчивости Tsn1 и Tsc2 в патосистеме Triticum aestivum – Pyrenophora tritici-repentis происходит по типу ген-на-ген, но “в зеркальном отражении” [1, 4]. Однако в наших исследованиях мы столкнулись с многочисленными фактами несоответствия генотипа изолята патогена и ожидаемого фенотипического проявления реакции растения пшеницы на заражение этим изолятом. Так, 61% изолятов из краснодарской популяции 2017 г. имели ген ToxA (ToxA+), но не индуцировали некроз листьев у восприимчивых сортов пшеницы с доминантным аллелем Tsn1 [13]. Отсутствие продукта гена ToxA у изолятов, несущих этот ген, может быть связано с мутационными повреждениями самого гена. Однако ген ToxA отличается большой стабильностью и его мутантные формы неизвестны в изолятах P. tritici-repentis [12, 14, 16–18]. Другой причиной может быть нарушение экспрессии гена на разных этапах реализации наследственной информации. Известно, что первый этап экспрессии генов – транскрипция – регулируется белками, так называемыми факторами транскрипции, которые в настоящее время активно изучаются у фитопатогенных грибов [19]. Недавно у P. tritici-repentis был обнаружен ген PtrPf2, который является ортологом гена PnPf2 ‒ регулятора экспрессии генов SnToxA и SnTox3 в изолятах Parastagonospora nodorum. В опытах по инфильтрации восприимчивого сорта культуральными фильтратами мутантов P. tritici-repentis с делецией PtrPf2 было доказано, что ген PtrPf2 регулирует синтез Ptr ToxA in vitro, т.е. является фактором транскрипции гена ToxA [7].
Цель настоящего исследования – определить “базовый” (видоспецифичный) уровень экспрессии генов ToxA и PtrPf2 у изолятов P. tritici-repentis из разных географических популяций и изучить внутри- и межпопуляционный полиморфизм уровня экспрессии этих генов in vitro.
Материалом исследования служили моноконидиальные изоляты P. tritici-repentis ToxA+, отобранные из казахстанской (Алматинская обл.) и российской (Краснодарский край) популяций в количестве 10 и 12, соответственно. Вирулентность изолятов оценивали по их способности индуцировать некроз на листьях восприимчивого сорта пшеницы Glenlea, имеющего ген восприимчивости Tsn1, по 4-балльной шкале. Фитопатологический тест проводили в двух повторностях.
Для выделения РНК грибы выращивали на среде V-4 [20] в течение семи суток. Выделение РНК из грибных изолятов проводили с помощью RNeasy Plant Mini Kit (Qiagen, Нидерланды). Матрицу кДНК синтезировали методом ОТ-ПЦР на основе 1–2 мкг тотальной РНК с помощью набора реактивов MMLV RT kit (Евроген, Россия). Для оценки экспрессии генов ToxA и PtrPf2 in vitro у изолятов P. tritici-repentis проводили количественную ПЦР с использованием праймеров и протоколов амплификации, опубликованных ранее [7]. Относительный уровень экспрессии гена оценивали по соотношению количества мРНК гена-мишени и референтного гена актина (Act1) и рассчитывали по формуле R = 2–ΔΔCt [21]. Статистическую обработку результатов проводили с помощью программ Microsoft Office Excel 2007 и STATISTICA 10.0. Для характеристики генетического разнообразия использовали коэффициент вариации V, который рассчитывали как отношение стандартного отклонения к среднему, выраженное в процентах. Связь между количественными признаками оценивали с использованием линейного коэффициента корреляции Пирсона r. Определение достоверности различий между полученными данными проводили по t-критерию Стьюдента. Различия считались достоверными при уровне значимости p < 0.05.
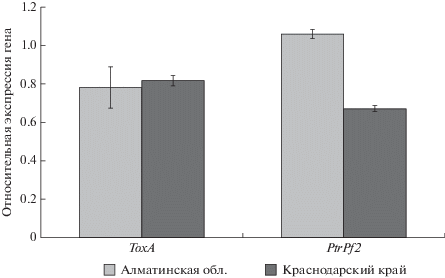
В популяции казахстанских изолятов уровень экспрессии гена ToxA варьировал в диапазоне 0.67–1.00, гена PtrPf2 0.92–1.23, при этом коэффициент вариации (V) этих признаков составил 14 и 10% соответственно. Российские изоляты отличались более высокой гетерогенностью демонстрируемого уровня экспрессии обоих генов: уровень экспрессии ToxA оказался в диапазоне 0.34–1.18, гена PtrPf2 0.32–0.81, а коэффициент вариации этих показателей составил 32 и 23% соответственно. Возможно, это объясняется условиями сбора растительного материала, а именно влиянием растения-хозяина. В Алматинской области листья пшеницы с симптомами желтой пятнистости были собраны с одного поля, засеянного генетически однородным сортом, тогда как в Краснодарском крае листья собирали с нескольких участков, на которых выращивали сорта пшеницы разного генотипа.
В среднем значения уровня экспрессии гена ToxA в казахстанской и российской популяциях оказались практически равны: 0.78 ± 0.11 и 0.82 ± ± 0.02, тогда как уровень экспрессии PtrPf2 был значительно выше в казахстанской популяции (1.06 ± 0.03) по сравнению с российской (0.67 ± 0.01) (рис. 1). У каждого из анализируемых 10 казахстанских изолятов уровень экспрессии PtrPf2 оказался выше, чем ToxA, тогда как у российских изолятов наблюдалось противоположное соотношение: уровень экспрессии PtrPf2 был ниже, чем ToxA. Для российских изолятов обнаружена статистически значимая корреляция значений уровня экспрессии обоих генов (r = 0.96, p < 0.001), тогда как в группе казахстанских изолятов такая взаимосвязь не выявлена.
В двух фитопатологических тестах казахстанские изоляты P. tritici-repentis характеризовались более выраженным проявлением некроза на восприимчивом сорте (средняя 2.7), чем российские изоляты (средняя 1.9), что является фенотипическим проявлением экспрессии ToxA. Выраженная значительная вирулентность казахстанских изолятов, очевидно, связана с более высоким уровнем экспрессии PtrPf2, которая, видимо, определяет фенотипическую экспрессию самого гена-эффектора. Для проверки этого вывода необходимы дополнительные исследования in planta.
Данные о связи конститутивной (=in vitro) экспрессии ToxA в изолятах P. tritici-repentis с их способностью индуцировать некроз на восприимчивых сортах, а также о механизмах регуляции экспрессии этого гена-эффектора крайне ограничены. Известно, что изоляты P. tritici-repentis ToxA+ секретируют токсин Ptr ToxA in vitro [7, 22] и их культуральный фильтрат индуцирует некроз на листьях сортов пшеницы, имеющих в геноме доминантный аллель гена восприимчивости Tsn1 [23]. Показано, что на восприимчивом сорте экспрессия “оригинального гена” ToxA у изолятов Parastagonospora nodorum была во много раз выше, чем экспрессия этого же гена, имеющего природу “чужеродной транслокации” у изолятов P. tritici-repentis [6]. Эти факты свидетельствуют о том, что чужеродный ген ToxA в P. tritici-repentis не может экспрессироваться в процессе заражения растения столь же эффективно, как “свой” ген-эффектор SnToxA в P. nodorum. Вопрос о влиянии экспрессии гена ToxA в изолятах P. tritici-repentis на проявление некротических симптомов на растении затронут в работе, посвященной анализу структуры гена ToxA и распространению в изолятах гриба нового генетического элемента PtrHp1 [8]. Уровень экспрессии гена ToxA был определен у трех европейских и двух австралийских изолятов P. tritici-repentis: показано существенное различие (в 400–1200 раз) между уровнями экспрессии ToxA in vitro в изолятах разного происхождения. Этот факт объясняется тем, что для сравнения с европейскими изолятами авторы взяли австралийский штамм М-4 – продуцент токсина Ptr ToxA. Слабое проявление некроза на восприимчивом сорте при заражении европейскими изолятами авторы связывают с низкой экспрессией ToxA [8], однако влияние PtrPf2 на экспрессию гена-эффектора в этой работе не рассматривали. В настоящей работе разница уровня экспрессии ToxA in vitro у казахстанских и российских изолятов была не столь существенной – максимум в 3 раза, а более значительная вирулентность казахстанских изолятов по сравнению с российскими обусловлена, по предварительным данным, высокой экспрессией гена фактора транскрипции PtrPf2.
Работа выполнена при поддержке гранта РФФИ № 18-04-00128_а.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ciuffetti L.M., Manning V.A., Pandelova I. et al. Host-selective toxins, Ptr ToxA and Ptr ToxB, as necrotrophic effectors in the Pyrenophora tritici-repentis–wheat interaction // New Phytologist. 2010. V. 187. P. 911–919. https://doi.org/10.1111/j.1469-8137.2010.03362.x
Lamari L., Strelkov S.E. The wheat/Pyrenophora tritici-repentis interaction: progress towards an understanding of tan spot disease // Can. J. Plant Pathol. 2010. V. 32. P. 4–10. https://doi.org/10.1080/07060661003594117
Adhikari T.B., Bai J., Meinhardt S.W. et al. Tsn1-mediated host responses to ToxA from Pyrenophora tritici-repentis // Mol. Plant-Microbe Interactions. 2009. V. 22. № 9. P. 1056–1068. https://doi.org/10.1094/MPMI-22-9-1056
Strelkov S.E., Lamari L. Host-parasite interaction in tan spot [Pyrenophora tritici-repentis] of wheat // Can. J. Plant Pathol. 2003. V. 25. P. 339–349. https://doi.org/10.1080/07060660309507089
Manning V.A., Ciuffetti L.M. Necrotrophic effector epistasis in the Pyrenophora tritici-repentis-wheat interaction // PLoS One. 2015. V. 10. № 4. e0123548. https://doi.org/10.1371/journal.pone.0123548
Virdi S.K., Liu Z., Overlander M.E. New insights into the roles of host gene-necrotrophic effector interactions in governing susceptibility of durum wheat to tan spot and Septoria nodorum blotch // G3. 2016. V. 6. P. 4139–4150. https://doi.org/10.1534/g3.116.036525/-/DC1
Rybak K., See P.T., Phan H.T. et al. A functionally conserved Zn2Cys6 binuclear cluster transcription factor class regulates necrotrophic effector gene expression and hostspecific virulence of two major Pleosporales fungal pathogens of wheat // Mol. Plant Pathol. 2017. V. 18. P. 420–434. https://doi.org/10.1111/mpp.12511
Moolhuijzen P.M., See P.T., Oliver R.P., Moffat C.S. Genomic distribution of a novel Pyrenophora tritici-repentis ToxA insertion element // PLoS One. 2018. V. 13. № 10. e0206586. https://doi.org/10.1371/journal.pone.0206586
Faris J.D., Zhang Z., Lu H.J. et al. A unique wheat disease resistance-like gene governs effector-triggered susceptibility to necrotrophic pathogens // Proc. Natl Acad. Sci. USA. 2010. V. 107. P. 13544–13549. https://doi.org/10.1073/pnas.1004090107
Kokhmetova A., Kremneva J., Volkova G. et al. Evaluation of wheat cultivars growing in Kazakhstan and Russia for resistance to tan spot // J. Plant Pathol. 2017. V. 99. P. 161–167. https://doi.org/10.4454/jpp.v99i1.3812
See P.T., Marathamuthu K.A., Iagallo E.M. et al. Evaluating the importance of the tan spot ToxA–Tsn1 interaction in Australian wheat varieties // Plant Pathol. 2018. V. 67. P. 1066–1075. https://doi.org/10.1111/ppa.12835
Friesen T.L., Stukenbrock E.H., Liu Z.H. et al. Emergence of a new disease as a result of interspecific virulence gene transfer // Nat. Genet. 2006. V. 38. P. 953–956. https://doi.org/10.1038/ng1839
Мироненко Н.В., Баранова О.А., Коваленко Н.М. Характеристика географически отдаленных популяций Pyrenophora tritici-repentis по вирулентности и генам токсинообразования ToxA и ToxB // Вестник защиты растений. 2019. № 1. С. 24–29. https://doi.org/10.31993/2308-6459-2019-1(99)-24-29
Мироненко Н.В., Баранова О.А., Коваленко Н.М., Михайлова Л.А. Частота гена ToxA в популяциях Pyrenophora tritici-repentis на Северном Кавказе и северо-западе России // Микология и фитопатология. 2015. Т. 49(5). С. 325–329.
Мироненко Н.В., Баранова О.А., Коваленко Н.М. и др. Генетическая структура популяций Pyrenophora tritici-repentis, существующих на территории России, по микросателлитным маркерам // Генетика. 2016. Т. 52. № 8. С. 885–894.
Ali S., Gurung S., Adhikari T.B. Identification and characterization of novel isolates of Pyrenophora tritici-repentis from Arkansas // Plant Dis. 2010. V. 94. P. 229–235. https://doi.org/10.1094/PDIS-94-2-0229
Leišova-Svobodova L., Hanzalova A., Kucer L. Expansion and variability of the Ptr ToxA gene in populations of Pyrenophora tritici-repentis and Pyrenophora teres // J. Plant Pathol. 2010. V. 92. P. 729–735. https://doi.org/10.4454/jpp.v92i3.319
Aboukhaddour R., Turkington T.K., Strelkov S.E. Race structure of Pyrenophora tritici-repentis (tan spot of wheat) in Alberta, Canada // Can. J. Plant Pathol. 2013. V. 35. P. 256–268. https://doi.org/10.1080/07060661.2013.782470
Tan K.-C., Oliver R.P. Regulation of proteinaceous effector expression in phytopathogenic fungi // PLoS Pathogens. 2017. V. 13(4): e1006241.https://doi.org/10.1371/journal.ppat.1006241
Михайлова Л.А., Гультяева Е.И., Кокорина Н.М. Лабораторные методы культивирования возбудителя желтой пятнистости пшеницы Pyrenophora tritici-repentis // Микология и фитопатология. 2002. Т. 36. № 1. С. 63–67.
Livak K.J., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method // Methods. 2001. V. 25. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Moffat C.S., See P.T., Oliver R.P. Generation of a ToxA knockout strain of the wheat tan spot pathogen Pyrenophora tritici-repentis // Mol. Plant Pathol. 2014. V. 15. P. 918–926. https://doi.org/10.1111/mpp.12154
Liu Z., Friesen T.L., Ling H. et al. The Tsn1–ToxA interaction in the wheat – Stagonospora nodorum pathosystem parallels that of the wheat–tan spot system // Genome. 2006. V. 49. P. 1265–1273. https://doi.org/10.1139/g06-088
Дополнительные материалы отсутствуют.