Генетика, 2020, T. 56, № 4, стр. 471-480
Носительство Y/15 и Y/22 дериватных хромосом в парах с нарушениями репродукции: алгоритм преимплантационного генетического тестирования и специфика наследования
И. Л. Пуппо 1, 2, 3, *, А. Ф. Сайфитдинова 1, 4, Ю. А. Логинова 1, 5, А. А. Кинунен 1, 6, З. Н. Тонян 2, 7, Ю. Р. Пастухова 1, О. А. Леонтьева 1, Р. А. Кузнецова 1, О. Г. Чиряева 3, 7, А. А. Пендина 6, 7, О. А. Ефимова 7, А. В. Тихонов 6, 7, А. В. Петровская-Каминская 7, В. С. Дудкина 7, Л. И. Петрова 7, И. В. Полякова 8, С. Г. Щербак 7, 8, О. С. Глотов 7, 8, Н. К. Бичевая 1
1 Международный центр репродуктивной медицины
197350 Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр им. В.А. Алмазова
197341 Санкт-Петербург, Россия
3 Военно-медицинская академия им. С.М. Кирова
194044 Санкт-Петербург, Россия
4 Российский государственный педагогический университет им. А.И. Герцена
191186 Санкт-Петербург, Россия
5 DiaCarta, Inc., 2600 Hilltop Drive
CA 94806 Richmond, USA
6 Диагностический центр (медико-генетический)
194044 Санкт-Петербург, Россия
7 Научно-исследовательский институт акушерства, гинекологии и репродуктологии
им. Д.О. Отта
199034 Санкт-Петербург, Россия
8 Городская больница № 40
197706 Санкт-Петербург, Россия
* E-mail: il_trofimova@list.ru
Поступила в редакцию 26.04.2019
После доработки 17.05.2019
Принята к публикации 09.07.2019
Аннотация
Представлены результаты преимплантационного генетического тестирования и исходы экстракорпорального оплодотворения (ЭКО) в четырех семьях, где один из супругов является носителем Y/15 или Y/22 дериватной аутосомы: три случая носительства супругом и один – супругой. Показано, что при носительстве дериватной аутосомы супругом происходит ее преимущественное наследование эмбрионами, при этом отклонений в наборе половых хромосом не выявлено. При носительстве дериватной аутосомы супругой, напротив, преимущественного наследования не установлено; ее влияние на расхождение половых хромосом также не выявлено. Во всех случаях у эмбрионов отмечена высокая частота анеуплоидий по хромосомам, не участвующим в образовании дериватной аутосомы. Для исключения наследования дериватной аутосомы потомками можно рекомендовать проведение преимплантационного генетического тестирования, сочетающего флуоресцентную in situ гибридизацию (FISH), позволяющую выявить сателлитную ДНК Y-хромосомы, и секвенирование нового поколения (NGS) или сравнительную геномную гибридизацию (aCGH) для установления других геномных и хромосомных аномалий.
Транслокации между Y-хромосомой и аутосомами встречаются в популяции с частотой примерно 1 на 2000 [1, 2]. Подавляющее число Y/аутосомных транслокаций происходит с вовлечением сателлитной ДНК конститутивного гетерохроматина Y-хромосомы, который преимущественно транслоцируется на короткие плечи акроцентрических хромосом [2, 3]. В результате этого образуется дериватная акроцентрическая аутосома с увеличенным р-плечом, представленным гетерохроматином Y-хромосомы [4]. Точки разрыва на акроцентрических аутосомах находятся в сегментах р11–р13, на Y‑хромосоме – преимущественно в Yq12, но могут локализоваться также в сегменте Yq11.23 [2–4]. Наиболее часто в Y/аутосомные транслокации вовлечены хромосомы 15 и 22, на долю которых приходится 52 и 33% случаев соответственно [2]. Это обусловлено их близким расположением в пахитене из-за высокой гомологии сателлитной ДНК в районах, вовлеченных в транслокацию [2, 5].
Носители дериватных аутосом, образованных в результате Y/акроцентрических транслокаций, фенотипически нормальны. Однако в семьях, где один из супругов является носителем таких дериватных хромосом, могут встречаться нарушение сперматогенеза, невынашивание беременности, повышенная частота образования несбалансированных гамет [6–10], что может быть обусловлено нарушением формирования полового бивалента и последующей сегрегации хромосом [11]. Кроме того, в единичных работах выявлено, что Y/акроцентрические транслокации могут встречаться в кариотипе у пациентов с различными видами опухолей [12–14].
Учитывая гомологию последовательностей сателлитной ДНК хромосом 15 и 22 и сегмента Yq12, а также присутствие псевдоаутосомного района 2 (pseudoautosomal region 2, PAR 2) в сегменте Yq12, интересным представляется оценка наследования дериватной аутосомы и ее возможного влияния на сегрегацию гоносом в зависимости от хромосомы, участвующей в транслокации, и от пола носителя. Применение вспомогательных репродуктивных технологий, в том числе экстракорпорального оплодотворения (ЭКО), рекомендованное носителям дериватных хромосом при медико-генетическом консультировании, позволяет получить материал на доимплантационной стадии эмбрионального развития и проанализировать результат сегрегации хромосом. В рамках преимплантационного генетического тестирования нами был проведен анализ сегрегации Y/15 и Y/22 дериватных аутосом и их возможного влияния на расхождение половых хромосом при мужском и женском носительстве.
МАТЕРИАЛЫ И МЕТОДЫ
Кариотипирование
Кариотипирование ФГА-стимулированных лимфоцитов периферической крови супружеских пар проводили по стандартной методике с использованием QFH/AcD окрашивания [15]. Установление структуры дериватных аутосом проводили с помощью флуоресцентной гибридизации in situ (FISH) по протоколу, рекомендованному фирмой-производителем использованных зондов. Были использованы наборы ДНК-зондов, специфичных к следующим районам: сателлиту III гетерохроматина Y-хромосомы; альфа-сателлитной ДНК центромерных районов хромосом 15 и Y; сателлиту III короткого плеча хромосомы 15; теломерному району длинного плеча хромосомы 15; локусу 22q11.2 и локусу SRY хромосомы Y (Abbott Molecular, США; Kreatech, Нидерланды). Результаты кариотипирования и проведенного молекулярно-цитогенетического анализа приведены в табл. 1.
Таблица 1.
Характеристика обследованных семей
| № семьи | Кариотип носителя дериватной аутосомы | Семейный анамнез | Год цикла ЭКО | Метод оплодотворения | Возраст (♀/♂), лет |
Число проанализированных эмбрионов | Число перенесенных эмбрионов | КБ* | Роды |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 46,XY,der(15)t(Y;15)(q12;p11.2).ish der(15)t(Y;15)(q12;p11.2) (DYZ1+,D15Z1+,D15Z4+,D15S936+) |
Привычное невынашивание беременности, вторичное бесплодие. Тератозооспермия, концентрация и подвижность сперматозоидов в пределах нормальных значений | 2012 | ЭКО | 32/31 | 9 | 2 | 0 | – |
| 2 | 46,XY,der(15)t(Y;15)(q12;p12).ish der(15)t(Y;15)(q12;p11.2) (DYZ1+,D15Z4+,D15S936+) |
Первичное бесплодие, связанное с мужским фактором. Олигоастенотератозооспермия. Микроделеции AZF локуса Y-хромосомы отсутствуют | 2015 | ИКСИ | 31/34 | 8 | 0 | – | – |
| 2016 | ИКСИ | 32/35 | 6 | 0 | – | – | |||
| 2017 | ИКСИ | 33/36 | 12 | 2 | 1 | 1 | |||
| 3 | 46,XY,der(22)t(Y;22)(q11.23;p11.2).ish der(22)t(Y;22)(q11.23;p11.2) (SRY-,DYZ1+,DYZ3-,BCR+) |
Первичное бесплодие, показатели многократных спермограмм в норме | 2017 | ИКСИ | 39/39 | 7 | 2 | 0 | – |
| 2018 | ИКСИ | 40/40 | 5 | 1 | 0 | – | |||
| 4 | 46,XX,der(15)t(Y;15)(q12;p11.2).ish der(15)t(Y;15)(q12;p11.2) (DYZ1+,D15Z4+,D15S936+) | Привычное невынашивание: 4 неразвивающиеся беременности | 2010 | ЭКО | 36/30 | 10 | 1 | 0 | – |
| 2013 | ЭКО | 39/33 | 8 | 1 | 0 | – | |||
| 2014 | ЭКО | 40/34 | 9 | 1 | 1 | – | |||
| 2015 | ЭКО | 41/35 | 11 | 1 | 0 | – |
Характеристика проведенных циклов
Исследование выполнялось на базе Международного центра репродуктивной медицины (семьи 1–3) и НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта (семья 4). Семейный анамнез исследованных пар, год проведения цикла, использованные методы оплодотворения, число проанализированных и перенесенных эмбрионов, а также исходы циклов показаны в табл. 1. Средний возраст мужчин составил 34.7 ± 2.97 года; женщин – 36.3 ± 3.74 лет.
Получение ооцитов, оплодотворение и культивирование in vitro было выполнено согласно стандартным эмбриологическим протоколам [16].
Биопсия, фиксация бластомеров и FISH анализ
Биопсию проводили утром на третий день развития (через 67 ч после инсеминации) на эмбрионах, состоящих не менее чем из шести бластомеров, согласно методике, описанной ранее [16]. Клетки были зафиксированы на предметных стеклах с адгезивным покрытием SuperFrost (Menzel GmbH, Германия) при фазовом контрасте под инвертированным стереомикроскопом по методу Тарковского [17], модифицированному для единичных бластомеров [18]. Денатурацию хроматина ядер бластомеров и зонда, гибридизацию и постгибридизационные отмывки проводили по протоколам, описанным в руководстве по клинической эмбриологии [16]. Анализ сигналов в интерфазных ядрах бластомеров проводили с учетом их размеров, формы и взаимного расположения, как рекомендовано в соответствующих руководствах [16, 19].
Микроскопия
Анализ дифференциально окрашенных препаратов метафазных хромосом проводили на микроскопе Zeiss Axio Imager.A2 (Carl Zeiss, Германия), оборудованном объективами EC Plan-NEOFLUAR 10×/0.3, 20×/0.5, 100×/1.3, Plan-APOCHROMAT 63×/1.4 (для получения фотоизображения использовали универсальную камеру MetaSystems CoolCube1 и программное обеспечение Ikaros v. 5.8 (MetaSystems, Германия)), и на микроскопе ЛЮМАМ РПО 11 (ЛОМО, Россия), оборудованном объективами СХ 20×/0.45 и М-флюар 100×/1.30, тубусной оптикой с линзами от 1.1× до 1.6× (для получения фотоизображения использовали черно-белую CCD камеру накопления сигнала и программное обеспечение Иста-Видео Тест “Видео Тест-Карио 2” (Россия)).
Флуоресцентные сигналы после проведения FISH детектировали с помощью микроскопа Axio Imager.A1 (Carl Zeiss), укомплектованного блоками узкополосных светофильтров для флуорохромов разных длин волн и цифровой камерой AxioCam MRc с CCD матрицей для накопления сигнала (Carl Zeiss), а также микроскопа LEICA DM5000B, оборудованного объективами FLUOTAR 10×/0.3, 20×/0.50, 40×/0.75 63×/1.40–0.60 и 100×/1.40–0.70, автоматической фотонасадкой, камерой высокого разрешения Leica DFC345 FX и блоком светофильтров. Получение и анализ цифровых изображений проводили с помощью специализированного программного обеспечения Axio Vision Rel 4.8 (Carl Zeiss) и Leica Application SuiteV.4.1.0 (Leica Microsystems, Германия).
Биопсия клеток трофэктодермы и NGS
Биопсию клеток трофобласта проводили на стадии бластоцисты на пятый и/или шестой день развития с помощью лазера (метод laser cutting) или путем отрезания затянутого в пипетку фрагмента трофобласта резким движением об край присоски (метод flipping) [16]. Все эмбрионы витрифицировали сразу после биопсии.
Биоптат отмывали от культуральной среды в буфере (1× PBS, 1% PVP) и помещали в эппендорфы с 2 мкл этого же буфера. Полногеномную амплификацию проводили с помощью набора SmarTer PicoPLEX WGA kit (Takara Bio, США), согласно инструкции производителя. Количественную оценку продуктов измеряли на Qubit 4 Fluorometer (Invitrogen, Life technologies, США) с помощью набора Qubit ds DNA BR Assay Kit (Invitrogen, Life technologies), согласно рекомендациям производителя. Электрофоретическое разделение продуктов полногеномной амплификации проводили в 1.5%-ном агарозном геле. Приготовление библиотек проводили набором VeriSeq PGS kit (Illumina, США) с последующей оценкой качества на приборе TapeStation 4200 (Agilent, США) и с последующим высокопроизводительным секвенированием (Next Generation Sequencing, NGS) на аппарате Illumina MiSeq (Illumina). Анализ на численные хромосомные аномалии выполняли с использованием программного обеспечения BluFuse Multi v4.3 (Illumina). Эффективное разрешение метода составляло 20 млн пн.
РЕЗУЛЬТАТЫ
В результате стандартного кариотипирования супружеских пар, проходивших обследование для выявления причин бесплодия, в трех семьях выявлено носительство Y/15 дериватной аутосомы и в одной – Y/22 дериватной аутосомы (рис. 1). Цитогенетический диагноз был подтвержден методом FISH. В этих семьях проанализировано наследование эмбрионами, полученными в рамках программы вспомогательных репродуктивных технологий, Y/15 и Y/22 дериватных аутосом, а также их возможное влияние на сегрегацию половых хромосом в зависимости от пола носителя. Характеристика каждого случая представлена в табл. 1.
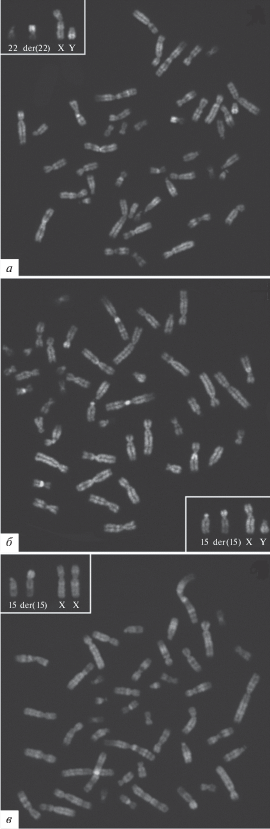
Рис. 1.
Метафазные хромосомы из ФГА-стимулированных лимфоцитов при мужском (а, б) и женском (в) носительстве дериватной Y/22 (а) и Y/15 (б, в) аутосомы. QFH/AcD окрашивание.
Анализ наследования дериватной аутосомы, сегрегации гоносом, а также частоты анеуплоидий по хромосомам, не вовлеченным в перестройку, проводили при помощи оценки комбинации флуоресцентных сигналов в ядрах бластомеров (табл. 2). В двух семьях (№ 2 и 3), где носителем являлся мужчина, дериватная аутосома Y/15 или Y/22 была выявлена у большинства проанализированных эмбрионов: у 24 из 38, а в одной (№ 1) – лишь у половины. В семье, где носителем являлась женщина (№ 4), дериватная аутосома Y/15 была выявлена у половины эмбрионов (19 из 38) (табл. 2).
Таблица 2.
Варианты сегрегации хромосом у носителей Y/15 и Y/22 дериватных аутосом в кариотипе
| № семьи | Кариотип носителя | Вариант сочетания дериватных аутосом, их гомологов и половых хромосом у доимплантационных эмбрионов | Число эмбрионов с определенным вариантом | Число эмбрионов с анеуплоидиями по другим аутосомам | Число эмбрионов без анеуплоидий по другим аутосомам |
|---|---|---|---|---|---|
| 1 | 46,XY,der(15)t(Y;15)(q12;p11.2) | XY, 15, der(15) | 3 | 2 | 1 |
| XY, 15, 15 | 3 | 1 | 2 | ||
| 2 | 46,XY,der(15)t(Y;15)(q12;p12) | XX, 15, der(15) | 9 | 2 | 7 |
| XY, 15, der(15) | 5 | 2 | 3 | ||
| XX, 15 | 1 | 0 | 1 | ||
| XY, 15 | 2 | 1 | 1 | ||
| XXY, der(15) | 1 | 1 | 0 | ||
| XX, 15, 15 | 2 | 2 | 0 | ||
| XY, 15, 15 | 3 | 1 | 2 | ||
| 3 | 46,XY,der(22)t(Y;22)(q11.23;p11.2) | XY, 22, 22, der(22) | 2 | 1 | 1 |
| XY, 22, der(22) | 3 | 1 | 2 | ||
| XY, der(22) | 1 | 0 | 1 | ||
| XX, 22, 22 | 1 | 0 | 1 | ||
| XY, 22, 22 | 1 | 1 | 0 | ||
| XY, 22 | 1 | 1 | 0 | ||
| 4 | 46,XX,der(15)t(Y;15)(q12;p11.2) | XX, 15, der(15) | 8 | 7 | 1 |
| XY, 15, der(15) | 8 | 3 | 5 | ||
| XX, 15, 15, der(15) | 1 | 0 | 1 | ||
| XY, 15, 15, der(15) | 1 | 1 | 0 | ||
| XX, der(15) | 1 | 1 | 0 | ||
| XX, 15 | 3 | 3 | 0 | ||
| XY, 15 | 3 | 3 | 0 | ||
| XY, 15, 15, 15 | 1 | 1 | 0 | ||
| XX, 15, 15 | 3 | 2 | 1 | ||
| XY, 15, 15 | 9 | 4 | 5 |
Набор половых хромосом у 75 из 76 эмбрионов, проанализированных в четырех семьях, соответствовал нормальному – ХХ или XY, и лишь у одного эмбриона (в семье № 2) был выявлен аномальный набор гоносом XXY (табл. 2).
В семьях № 1 и 3, где носителем дериватной аутосомы был мужчина, число эмбрионов анеуплоидных и эуплоидных по остальным проанализированным хромосомам было одинаковым. Однако в семье № 2 преобладали эуплоидные эмбрионы (14 из 23). В семье № 4, напротив, большинство эмбрионов (25 из 38) были анеуплоидными (табл. 2).
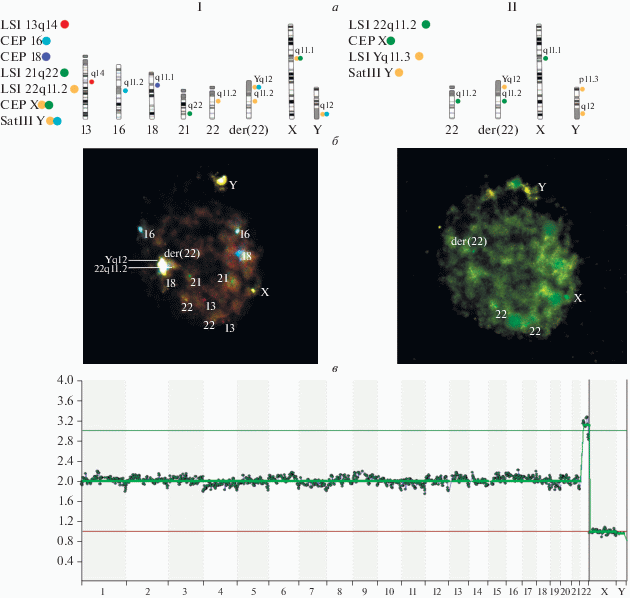
Для трех эмбрионов семьи № 3 с установленными методом FISH на третий день развития анеуплоидиями была проведена их верификация методом NGS на стадии бластоцисты в клетках трофэктодермы (табл. 3). У двух из трех проанализированных методом FISH эмбрионов (№ 4 и 5) была обнаружена дериватная аутосома. Метод NGS не выявил сателлитной ДНК гетерохроматинового района длинного плеча хромосомы Y, но подтвердил анеуплоидии (табл. 3, рис. 2).
Таблица 3.
Результат генетического тестирования после проведения FISH на бластомерах эмбрионов третьего дня развития и NGS на клетках трофэктодермы эмбрионов пятого дня развития
| № эмбриона | Результат FISH диагностики на бластомерах, третий день развития | Результат диагностики методом NGS на клетках трофэктодермы, пятый день развития | Оценка качества эмбрионов на пятый день развития* |
|---|---|---|---|
| 1 | XY, одна копия аутосомы 21, аутосома 22 представлена двумя копиями (22+22); аутосомы 13, 16, 18 представлены двумя копиями | seq[GRCh37]21×1,XY | 4 comp, эмбрион состоит из четырех компактных бластомеров, имплантационный потенциал низкий |
| 4 | XY, аутосома 22 представлена тремя копиями: der(22)+22+22; аутосомы 13, 16, 18, 21 представлены двумя копиями | seq[GRCh37]22×3,XY | ecav+fr, эмбрион на стадии ранней кавитации с фрагментацией, имплантационный потенциал средний |
| 5 | XY, аутосома 22 представлена тремя копиями: der(22)+22+22; три копии аутосом 13 и 21; аутосомы 16 и 18 представлены двумя копиями | seq[GRCh37](13,21,22)×3,XY | hBL5AA, эмбрион на стадии вылупляющейся бластоцисты, высокий имплантационный потенциал |
* Оценка имплантационного потенциала эмбрионов по морфологическим характеристикам на пятый день развития проводилась согласно рекомендациям, описанным в руководстве по клинической эмбриологии [13].
Рис. 2.
Схема гибридизационных смесей (а), результаты гибридизации in situ (б) и высокопроизводительного секвенирования (в) на бластомере и клетках трофэктодермы соответственно, одного эмбриона из семьи № 3.
По результатам проведенной диагностики во всех семьях были выявлены эмбрионы, пригодные для переноса. Однако беременность была зарегистрирована только в семье № 2 после переноса двух эмбрионов. Беременность завершилась рождением в срок клинически здоровых близнецов мужского пола. От пренатального и постнатального кариотипирования супруги отказались.
ОБСУЖДЕНИЕ
В настоящей работе проанализированы результаты преимплантационного генетического тестирования и исходы ЭКО в четырех семьях, где один из супругов является носителем Y/15 или Y/22 дериватной аутосомы, содержащей дополнительную сателлитную ДНК хромосомы Y. При носительстве Y/15 дериватной аутосомы супругой распределение нормальной и дериватной хромосом у эмбрионов составило 1 : 1, что указывает на независимую сегрегацию гомологов в оогенезе. При этом наличие дериватной хромосомы 15 не влияло на расхождение гоносом. По-видимому, это связано с тем, что участок гомологии между Хq и фрагментом Y-хромосомы на аутосоме 15 непротяженный и ограничен районом PAR2 субтеломерной области длинного плеча Y-хромосомы. Известно, что PAR2 содержит только четыре гена и практически не участвует в рекомбинации при формировании XY-бивалента в мужском мейозе [4]. По этой причине, вероятно, дополнительный материал Yq12, присутствующий в результате перестройки на аутосоме, не влияет на конъюгацию и расхождение хромосом Х в оогенезе.
Известно, что в сперматогенезе – в пахитене первого мейотического деления сперматоцитов I порядка – бивалент хромосомы 15 располагается в непосредственной близости от полового бивалента [5]. Помимо этого, дериватные хромосомы, образованные в результате Y-аутосомных транслокаций, могут приводить к нарушению формирования полового бивалента в сперматогенезе, конденсации хроматина аутосомы, ассоциированной с половым бивалентом, что в конечном итоге нарушает сегрегацию хромосом, вплоть до пахитенного ареста и отсутствия или сниженного количества зрелых сперматозоидов в эякуляте [4, 20]. Действительно, в нашем исследовании двое мужчин-носителей Y/15 дериватной аутосомы имели нарушение сперматогенеза (табл. 1), что может указывать на пахитенный арест части клеток вследствие ассоциации дополнительного материала сегмента Yq12 на дериватных хромосомах с половым бивалентом.
В исследовании Chen с коллегами [9] показано нарушение сегрегации гоносом при носительстве Y/15 дериватной аутосомы вне зависимости от пола носителя. Тем не менее, по нашим данным, как при мужском, так и при женском носительстве Y/15 или Y/22 дериватной аутосомы нарушения сегрегации гоносом не происходит, однако, в случае мужского носительства, большинство проанализированных эмбрионов наследуют дериватную хромосому. Преимущественный тип сегрегации хромосом и параметры, от которых он зависит, хорошо охарактеризованы при аутосомных реципрокных транслокациях [4]. Известно, что у мужчин-носителей совместный-1 тип расхождения, при котором две негомологичные хромосомы – дериватная и нормальная расходятся в каждую из дочерних клеток, встречается значительно чаще, чем у женщин-носительниц [21, 22]. В связи с этим, обнаруженное нами преимущественное наследование эмбрионами дериватной хромосомы при мужском носительстве требует дальнейшего исследования, в том числе анализа хромосомного набора и оплодотворяющей способности сперматозоидов мужчины-носителя.
Интересной находкой в нашем исследовании является выявленная у эмбрионов высокая частота анеуплоидий по хромосомам, не участвующим в образовании дериватной аутосомы. При этом, при женском носительстве дериватной хромосомы, число эмбрионов с анеуплоидиями преобладало: 25 анеуплоидных эмбрионов против 13 эмбрионов без анеуплоидий. Связана ли высокая частота анеуплоидий с возрастными особенностями протекания женского гаметогенеза или с межхромосомным эффектом дериватной аутосомы – остается невыясненным. Однако не вызывает сомнения, что эти данные необходимо учитывать при медико-генетическом консультировании пар, где один из супругов является носителем Y/15 или Y/22 дериватной аутосомы.
Проведение преимплантационного генетического тестирования для выявления у эмбрионов Y/15 или Y/22 дериватной аутосомы возможно только методом FISH, позволяющим, в отличие от aCGH и NGS, выявлять дополнительную сателлитную ДНК гетерохроматина Y-хромосомы. Однако учитывая, что FISH выявляет анеуплоидии только по ограниченному числу хромосом, целесообразным представляется после детекции Y/15 или Y/22 дериватной хромосомы у эмбрионов проведение второго этапа диагностики методом aCGH или NGS по клеткам трофэктодермы на пятый день развития. Применение такого подхода позволит обнаружить числовые изменения всех хромосом кариотипа и избежать ошибочной интерпретации результатов из-за высокого уровня мозаицизма, характерного для эмбрионов третьего дня развития [23, 24]. В нашем исследовании генетическое тестирование методом NGS было проведено по клеткам трофэктодермы только для трех эмбрионов, анеуплоидных по результатам диагностики методом FISH. Анеуплоидии, обнаруженные на третий день развития методом FISH, были подтверждены в клетках трофэктодермы методом NGS. Анеуплоидий по другим аутосомам, не включенным в анализ методом FISH, обнаружено не было (табл. 3).
Таким образом, мы не выявили нарушений сегрегации гоносом как у мужчин, так и у женщин-носителей дериватных аутосом, образованных в результате Y/акроцентрических транслокаций, независимо от аутосомы, участвующей в транслокации. Однако в случае носительства Y/15 или Y/22 дериватной аутосомы мужчиной у эмбрионов наблюдается ее преимущественное наследование. Обнаруженный нами высокий уровень анеуплоидий по хромосомам, не вовлеченным в транслокацию, свидетельствует о целесообразности последовательного анализа бластомеров эмбрионов на третий день развития методом FISH с целью выявления дериватных аутосом, а затем клеток трофэктодермы на пятый день развития методом aCGH или NGS для установления числовых изменений всех хромосом кариотипа.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (№ 18-34-00279) (преимплантационное генетическое тестирование в семьях, где носителем дериватной аутосомы является супруг) и Министерства науки и высшего образования Российской Федерации в рамках темы фундаментальных научных исследований 2019–2021 гг. (AAAA-A19-119021290033-1) (кариотипирование всех супружеских пар, а также преимплантационное генетическое тестирование в семье, где носителем дериватной аутосомы является супруга).
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Alitalo T., Tiihonen J., Hakola P. et al. Molecular characterization of Y;15 translocation segregating in a family // Hum. Genet. 1988. V. 79. № 1. P. 29–35. https://doi.org/10.1007/bf00291705
Liehr T. Benign and Pathological Chromosomal Imbalances. Microscopic and Submicroscopic Copy Number Variations (CNVs) in Genetics and Counseling. Elsevier, 2014. 220 p.
Chen P.Y., Yen J.H., Cheng C.F. et al. Prenatal diagnosis of the maternal derivative chromosome der(15)t(q12;p13) in dizygotic twin pregnancy // Tzu. Chi. Medical J. 2016. V. 28. № 4. P. 176–179. https://doi.org/10.1016/j.tcmj.2016.06.002
Gardner R.J.M., Amor D.J. Chromosome Abnormalities and Genetic Counseling. Oxford: Oxford Univ. Press, 2018. 728 p.
Metzler-Guillemain C., Mignon C., Depetris D. et al. Bivalent 15 regularly associates with the sex vesicle in normal male meiosis // Chromosome Res. 1999. V. 7. P. 369–378.
Vianello M.G., Monteverde R., Bonioli E. Cheilognatho-urano-staphyloschisis associated with t(Y;13) // Minerva Pediat. 1974. V. 26. № 10. P. 525–530.
Rajcan-Separovic E., Robinson W.P., Stephenson M. Recurrent trisomy 15 in a female carrier of der(15)t(Y;15)(q12;p13) // Am. J. Med. Genet. 2001. V. 99. № 4. P. 320–324.
Buonadonna A.L., Cariola F., Caroppo E. et al. Molecular and cytogenetic characterization of an azoospermic male with a de-novo Y;14 translocation and alternate centromere inactivation // Hum. Reprod. 2002. V. 17. № 3. P. 564–569. https://doi.org/10.1093/humrep/17.3.564
Chen Y., Chen G., Li Y. et al. A normal birth following preimplantation genetic diagnosis by FISH determination in the carriers of der(15)t(Y;15)(Yq12;15p11) translocations: two case reports // J. Assist. Reprod. Genet. 2007. V. 24. № 10. P. 483–488. https://doi.org/10.1007/s10815-007-9163-4
Маркова Ж.Г., Миньженкова М.В., Мусатова Е.В. и др. Несбалансированные Y-аутосомные транслокации без фенотипических проявлений // Мед. генетика. 2018. Т. 11. С. 7–10. https://doi.org/10.25557/2073-7998
Delobel B., Djlelati R., Gabriel-Robez O. et al. Y-autosome translocation and infertility: usefulness of molecular, cytogenetic and meiotic studies // Hum. Genet. 1998. V. 102. № 1. P. 98–102. https://doi.org/10.1007/s004390050660
Mozziconacci M.-J., Sobol H., Costello R. et al. Askin tumor and acute myeloid leukemia in a patient with constitutional partial Y disomy // Cancer Genet. Cytogenet. 1998. V. 103. № 1. P. 11–14. https://doi.org/10.1016/s0165-4608(97)00354-3
Hoshi N., Fujita M., Mikuni M. et al. Seminoma in a postmenopausal woman with a Y;15 translocation in peripheral blood lymphocytes and a t(Y;15)/45,X Turner mosaic pattern in skin fibroblasts // J. Med. Genet. 1998. V. 35. № 10. P. 852–856. https://doi.org/10.1136/jmg.35.10.852
Buijs A., Terhal P.A., Thunnissen P.L. Philadelphia chromosome of a constitutional der(22)t(Y;22)(q11.2;p11) with a variant t(1;9;22)(p36;q34;q11) in a case of chronic myelogenous leukemia // Cancer Genet. Cytogenet. 2006. V. 168. № 1. P. 80–82. https://doi.org/10.1016/j.cancergencyto.2005.11.009
Кузнецова Т.В., Логинова Ю.А., Чиряева О.Г. и др. Цитогенетические методы // Медицинские лабораторные технологии: руководство по клинической лабораторной диагностике, в 2 т. / Под ред. Карпищенко А.И. СПб.: Интермедика, 1999. С. 623–657.
Корсак В.С. Руководство по клинической эмбриологии. М.: Изд-во мед. книг, 2019. 216 с.
Tarkowski A.K. An air drying method for chromosome preparations from mouse eggs // Cytogenetics. 1966. V. 5. P. 394–400. https://doi.org/10.1159/000129914
Munne S., Dailey T., Finkelstein M. et al. Reduction in signal overlap results in increased FISH efficiency: implications for preimplantation genetic diagnosis // J. Assist. Reprod. Genet. 1996. V. 13. № 2. P. 149–156. https://doi.org/10.1007/bf02072537
Ogilvie C.M., Scriven P.N. Preimplantation genetic diagnosis for chromosome rearrangements // Preimplantation Genetic Diagnosis / Ed. Harper J. Cambridge, 2009. P. 193–202. https://doi.org/10.1017/CBO9780511581571.013
Alves C., Carvalho F., Cremades N. et al. Unique (Y;13) translocation in a male with oligozoospermia: cytogenetic and molecular studies // Eur. J. Hum. Genet. 2002. V. 10. № 8. P. 467–474. https://doi.org/10.1038/sj.ejhg.5200835
Ferguson-Smith M.A., Yates J.R.W. Maternal age specific rates for chromosome aberrations and factors influencing them: report of a collaborative European study an 52965 amniocenteses // Prenatal Diagnosis. 1984. V. 4. P. 5–44. https://doi.org/10.1002/pd.1970040704
Ye Y., Quian Y., Xu C., Jin F. Meiotic segregation analysis of embryos from reciprocal translocation carriers in PGD cycles // Reprod. Biomed. Online. 2012. V. 24. P. 83–90. https://doi.org/10.1016/j.rbmo.2011.08.012
Vanneste E., Voet T., Le Caignec C. et al. Chromosome instability is common in human cleavage-stage embryos // Nat. Med. 2009. V. 15. № 5. P. 577–583. https://doi.org/10.1038/nm.1924
Echten-Arends J.I., Mastenbroek S., Sikkema-Raddatz B. et al. Chromosomal mosaicism in human preimplantation embryos: a systematic review // Hum. Reprod. Update. 2011. V. 17. № 5. P. 620–627. https://doi.org/10.1093/humupd/dmr014
Дополнительные материалы отсутствуют.


