Генетика, 2020, T. 56, № 4, стр. 433-439
Генетическая однородность подвидов каменного глухаря Tetrao parvirostris parvirostris Bonaparte, 1856 и T. p. kamtschaticus Kittlitz, 1858 (Tetraonidae, Aves) по митохондриальной и ядерной ДНК
Л. Н. Спиридонова 1, *, Е. Г. Лобков 2, С. В. Шедько 1, А. П. Крюков 1
1 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения Российской академии наук
690022 Владивосток, Россия
2 Камчатский государственный технический университет
683003 Петропавловск-Камчатский, Россия
* E-mail: spiridonova@biosoil.ru
Поступила в редакцию 22.04.2019
После доработки 04.06.2019
Принята к публикации 24.06.2019
Аннотация
Впервые проведено секвенирование полного митохондриального генома четырех особей двух подвидов каменного глухаря Tetrao parvirostris parvirostris (материковая популяция) и T. p. kamtschaticus (п-ов Камчатка), сем. Tetraonidae. Генетическая дивергенция между материковым и камчатским подвидами составила 0.1% и находится на уровне индивидуальной изменчивости. На фоне высокого гаплотипического разнообразия выявлен низкий нуклеотидный полиморфизм мтДНК и показано отсутствие межподвидовой генетической дифференциации, что может отражать молодость камчатского изолята и консервативность митохондриального генома для вида в целом. Анализ фрагмента ядерного гена OCA2, связанного с окраской и кодирующего транс-мембранный P-белок, выявил идентичность материкового и камчатского подвидов. Такое отсутствие дивергенции по митохондриальному и ядерному маркерам между материковой и камчатской популяциями каменного глухаря противоречит их морфологическим отличиям. Появление изолированной популяции каменного глухаря на Камчатке – вероятно следствие сокращения ранее большого ареала материковой популяции с образованием настоящего разрыва либо недавней инвазии с материка.
Каменный глухарь представлен на Камчатке эндемичным для полуострова подвидом Tetrao parvirоstris kamtschaticus Kittlitz, 1858. Он хорошо отличается морфологически от других подвидов, независимо от того, сколько и где в границах видового ареала их выделять. Эти отличия сводятся, прежде всего, к более светлой окраске оперения камчатских птиц: белые партии в их оперении более обширные и развиты в наибольшей степени. Даже с учетом индивидуальной изменчивости если окраска оперения птиц, принадлежащих T. p. kamtschaticus и другим подвидам, оказывается сходной на одних перьях или участках тела, то всегда сильно отличается на других именно редукцией пигментов у камчатских особей. Кроме того, у камчатских птиц заметна тенденция к более крупным размерам тела [1].
Ареал камчатского каменного глухаря представлен географическим изолятом в границах п‑ова Камчатка (рис. 1). Он регулярно населяет высокоствольные леса к северу до широты рек Карага и Шаманка [1, 2]. Еще севернее известны единичные встречи в бассейне Тымлата, а ранее указывалось на возможность встречи даже в бассейне Вывенки [3], хотя уже многие годы подтверждения тому нет.
Рис. 1.
Ареал подвидов каменного глухаря (по интернет-ресурсу http://www.birds-online.ru/ с авторскими исправлениями): 1 – T. p. parvirоstris (фото, http://xn–80afahik1bacv9b3i.xn–p1ai/taxon/380/kamennyj_gluhar/); 2 – T. p. kamtschaticus (фото Е. Говоровой; Природный парк “Налычево”, Камчатка); 3 – T. p. stegmanni.

Как известно [4, 5], каменный глухарь – таежный вид, ареал которого в общих чертах совпадает с распространением, главным образом, светлохвойных, прежде всего лиственничных и смешанных с лиственницей лесов. В границах п-ова Камчатка каменный глухарь гнездится в лесах разного облика. В бассейне р. Камчатка он населяет в основном хвойные и смешанные леса из лиственницы Каяндера (Larix cajanderi) и ели аянской (Picea ajanensis), сформировавшиеся здесь относительно недавно, буквально за последние несколько тысяч лет в форме “хвойного острова” [6], а по современным данным [7] даже менее того – около полутысячи лет назад. В восточных и западных районах полуострова он населяет только леса из каменной (Betula еrmanii) и плосколистной (Betula platyphylla) берез, так как хвойных древостоев в этой части Камчатки просто нет (за исключением крошечной рощи пихты камчатской Abies gracilis площадью 23 га в низовье р. Новый Семячик). Пойменных лесов, всегда влажных, камчатский каменный глухарь на Камчатке избегает.
Корякское нагорье, Парапольский дол и Пенжинский хребет, лежащие к северу от п-ова Камчатка, образуют область дизъюнкции ареала. Далее к северо-западу каменный глухарь появляется только в верхней части бассейна р. Пенжины, где произрастают лиственничники из Larix dahurica, заходящие сюда со стороны бассейнов Колымы и Анадыря. Эти леса образуют на Пенжине восточную границу лиственничных редколесий, характерных для обширных регионов Восточной Сибири. Здешняя популяция каменного глухаря принадлежит уже номинативному подвиду Tetrao parvirostris рarvirostris Bonaparte, 1856 [8], область распространения которого лежит к западу от Камчатки и занимает большую часть ареала вида на континенте. Основная часть популяции каменного глухаря в бассейне Пенжины сосредоточена именно в границах произрастания лиственничных и смешанных с лиственницей лесов. За их пределами есть информация о возможных встречах с глухарями в долине р. Белой [8].
Учитывая вышесказанное, представляет большой интерес определение генетических различий между камчатским каменным глухарем и его номинативной формой. Это важно, прежде всего, для понимания генетических основ известного в орнитологии феномена, называемого “подвидовым эндемизмом в авифауне Камчатки” [1, 2, 9–13 и др.], суть которого в том, что большинство эндемичных камчатских подвидов отличаются той или иной степенью депигментации оперения [1]. Кроме того, это позволило бы уточнить молекулярными методами таксономический статус верхнепенжинской популяции вида, принадлежность которой к номинативной расе по морфологическим признакам не вызывает сомнений. Поставленные задачи решались молекулярно-генетическими методами с применением маркеров митохондриальной и ядерной ДНК.
МАТЕРИАЛЫ И МЕТОДЫ
Сбор образцов тканей камчатского каменного глухаря проводился в разных районах п-ова Камчатка и бассейна Пенжины. Для анализа полных митохондриальных геномов и ядерного гена OCA2 двух подвидов каменного глухаря использованы по две особи каждого подвида: T. p. parvirostris (верховья р. Пенжины, № 2318, 2528); T. p. kamtschaticus (долина р. Камчатки, № 1-1; юг Камчатки, Елизовский р-н, № 2317). ДНК выделяли из образцов мышечной ткани, фиксированной в 96%-ном этаноле, с помощью набора QIAgenDNeasy® TissueKit (Qiagen, Inc.) по методике производителя.
Секвенирование митохондриальных геномов проведено методом пиросеквенирования на Roche GS Junior. Приготовление быстрой библиотеки с лигированными адаптерами, проведение эмульсионной ПЦР, секвенирование с реагентами GS Junior Titanium Series выполнялись согласно инструкциям фирмы-изготовителя прибора и реактивов – 454 Life Science Corp., Roche Company, Branford, CT 06405, США. Все митогеномы были прочитаны со средним покрытием ×300. Нуклеотидные последовательности собирали с помощью программы GS De Novo Assembler (http://454.com/products/analysis-software/index.asp).
В дополнение к митохондриальной ДНК использован ядерный ген OCA2, отвечающий за синтез интегрального мембранного Р-белка, который переносит тирозин в меланосомы и может влиять на окраску оперения. Синтез фрагмента ядерного гена OCA2 длиной около 1100 пн проводился с праймерами OCA21470-Fw (5'-TTATGGTTACTGGAGTAAAGAGCAG-3') и OCA21659-Rv (5'-CCATATTTTCAGAGACTGGATTCT-3') в 20 мкл реакционной смеси, содержащей 20 нг ДНК, 1× Taq M green Master mix (АлкорБио) и пять пикомолей каждого праймера. Программа амплификации: 95°C – 15 мин; 35 циклов синтеза фрагмента: 95°C – 30 с, 54°C – 20 с, 72°C – 60 с; 72°C – 30 мин. Продукты амплификации были использованы для циклического секвенирования с набором реагентов ABI PRISM®BigDyeTM Terminator v. 3.1. Реакцию присоединения метки проводили с теми же праймерами. Результаты прочитывали на автоматическом лазерном секвенаторе ABI PRISM 3500 (Applied Biosystems, США/Hitachi, Япония). Секвенирование по обоим маркерам выполнено на приборной базе ЦКП “Биотехнология и генетическая инженерия” ФНЦ Биоразнообразия ДВО РАН, г. Владивосток. Полученные последовательности митохондриальной ДНК и гена OCA2 депонированы в базу данных GenBank NCBI (№ 2318 – MK820675, MK881595; 2528 – MK820678, MK881596; 1-1 – MK820676, MK881593; 2317 – MK820677, MK881594 соответственно).
Прямые и обратные последовательности фрагмента гена OCA2 были собраны в пакете программ Staden 1.53 [14] и выровнены в программе ClustalW, предложенной в MEGA7 [15]. Для анализа гаплотипического (H) и нуклеотидного (π) разнообразия [16] митохондриальной ДНК использовали программу DnaSP 5.0 [17]. Количество нуклеотидных замен определено по методу MCL (Maximum Composite Likelihood) по всем позициям кодонов, включающим транзиции и трансверсии. Нуклеотидные замены и скорость замещения были посчитаны по модели GTR-G-I (General Time Reversible + G + I) (BIC = 174252.067), реализованной в MEGA7. Генетические связи гаплотипов анализировали методом ML. Достоверность ветвей филогенетического дерева тестировали при 500 репликациях. Для сравнительного анализа из Генбанка были взяты полные митогеномы следующих представителей сем. Тетеревиные: Tetrao urogallus aquitanicus MG583885; Lyrurus tetrix KF955638; Lagopus lagopus KX609784; Lagopus muta KX609785; в качестве внешней группы использованы Bonasa (Tetrastes) bonasia FJ752435 и Tetrastes sewerzowi NC_025318. Кроме того, дополнительно из Генбанка были использованы последовательности контрольного региона трех образцов каменного глухаря (AF532462 T. p. kamtschaticus (Камчатка), T. p. parvirostris AF532463 (Магадан) и AF532464 (Хабаровск)) и 10 образцов шести подвидов близкородственного обыкновенного глухаря Tetrao urogallus из разных мест обитания (AF532465 T. u. uralensis (Урал); AF532466 T. u. lonnbergi (Мурманск); AF532467 T. u. pleskei (Тверь); AJ297154 T. u. urogallus (Швеция); AY750945, AY750947, AY750948, MG583885 T. u. aquitanicus (Испания, Пиренеи); AY750939, AY750940 T. u. cantabricus (Испания, Кантабрийские горы)). Подвидовая принадлежность некоторых образцов была определена по местам сбора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В результате проведенного секвенирования впервые получены полные митогеномы (16 685–16 696 пар нуклеотидов) для двух подвидов T. parvirostris. Структура (количество и расположение кодирующих генов) митогенома каменного глухаря соответствует данным для видов семейства Tetraonidae, хранящимся в Генбанке. Анализ митогеномов parvirostris и kamtschaticus выявил низкую нуклеотидную изменчивость, а обнаруженные полиморфные сайты (всего 32 замены, из которых 29 уникальные и 3 парсимони-информативные) у этих подвидов перекрываются (табл. 1). Все особи несут уникальные гаплотипы (Hd = 1 ± 0.177), однако их нуклеотидное разнообразие имеет низкое значение (π = 0.00114 ± 0.00027), что указывает на близкородственные связи исследованных птиц материковой и камчатской популяций. Необходимо отметить, что индивидуальные различия исследованных птиц превышают межподвидовые значения.
Наличие в Генбанке последовательностей контрольного региона мтДНК для обыкновенного глухаря Tetrao urogallus позволило провести сравнение двух видов глухарей и их внутривидовой изменчивости. В табл. 2 представлены попарные генетические дистанции между каменным глухарем, обыкновенным глухарем и родами семейства Tetraonidae. Межподвидовые дистанции каменного глухаря оказались на уровне индивидуальных отличий с минимальными значениями (0.1–0.2%). Такая же ситуация наблюдается между подвидами обыкновенного глухаря uralensis, pleskei и lonngbergi (0–0.2%), за исключением двух испанских изолятов aquitanicus и cantabricus, которые дифференцированы от других подвидов глухаря (0.7–1.3%). Несмотря на это, различия между гаплотипами мтДНК птиц из этих изолятов близки к вышеприведенным межподвидовым значениям (0.3%). Дивергенция между двумя видами глухарей (3.2–3.7%) оказалась на порядок выше межподвидовых значений. Филогенетический анализ митохондриальных геномов обнаружил более близкую связь каменного глухаря с тетеревом-косачем L. tetrix (4.7%), чем последнего с обыкновенным глухарем (5.7–6.2%). Такая же ситуация оказалась по различиям митогеномов T. parvirostris и T. urogallus с родом Lagopus (куропатки) (8.5 и 8.9% соответственно). Наибольшие отличия выявлены для митогеномов родов Tetrao и Tetrastes, генетическая дистанция между ними составила в среднем 12–14%. Эти соотношения соответствуют общепринятым в орнитологии представлениям по систематике семейства Tetraonidae.
Таблица 2.
Попарные генетические р-дистанции между видами и подвидами тетеревиных птиц по данным полной последовательности и контрольному региону митохондриальной ДНК
| Вид/подвид | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1. T. p. parvirostris | – | |||||||||||
| 2. T. p. kamtschaticus | 0.002 | – | ||||||||||
| 3. T. u. aquitanicus | 0.032 | 0.033 | – | |||||||||
| 4. T. u. uralensis | 0.036 | 0.036 | 0.011 | – | ||||||||
| 5. T. u. pleskei | 0.037 | 0.037 | 0.013 | 0.002 | – | |||||||
| 6. T. u. lonngbergi | 0.036 | 0.036 | 0.011 | 0.002 | 0.000 | – | ||||||
| 7. T. u. urogallus | 0.037 | 0.037 | 0.007 | 0.016 | 0.018 | 0.016 | – | |||||
| 8. T. u. cantabricus | 0.032 | 0.033 | 0.003 | 0.01 | 0.012 | 0.01 | 0.007 | – | ||||
| 9. L. tetrix | 0.047 | 0.047 | 0.058 | 0.061 | 0.062 | 0.061 | 0.061 | 0.057 | – | |||
| 10. L. lagopus | 0.086 | 0.086 | 0.086 | 0.088 | 0.087 | 0.088 | 0.089 | 0.085 | 0.09 | – | ||
| 11. L. muta | 0.084 | 0.084 | 0.089 | 0.092 | 0.091 | 0.092 | 0.093 | 0.089 | 0.094 | 0.046 | – | |
| 12. T. bonasia | 0.122 | 0.121 | 0.136 | 0.133 | 0.135 | 0.133 | 0.138 | 0.135 | 0.122 | 0.13 | 0.131 | – |
| 13. T. sewerzowi | 0.12 | 0.119 | 0.134 | 0.135 | 0.137 | 0.135 | 0.138 | 0.134 | 0.123 | 0.131 | 0.132 | 0.045 |
Для реконструкции филогенетических отношений использованы образцы с полными митохондриальными геномами совместно с образцами, для которых прочитан только контрольный регион (CR) (рис. 2). Представленное дерево показывает, что этот митохондриальный маркер так же хорошо, как и полный митохондриальный геном, во всех случаях достоверно (100%) разделяет все проанализированные виды тетеревиных. Реконструкция связей иллюстрирует обособление всех представленных видов. Образцы каменного глухаря образуют единый кластер гаплотипов с высокой статистической поддержкой (100%). Этот кластер объединяет не только образцы из Камчатки и Пенжины, но и более южные материковые образцы из Магадана и Хабаровска. Различия между гаплотипами минимальны и обусловлены единичными мутациями.
Рис. 2.
Филогенетические отношения некоторых представителей семейства Tetraonidae, реконструированные по данным полных митогеномов (*) и контрольных регионов (CR) методом максимального правдоподобия. В узлах ветвлений приведены значения бутстреп-поддержки более 95%.
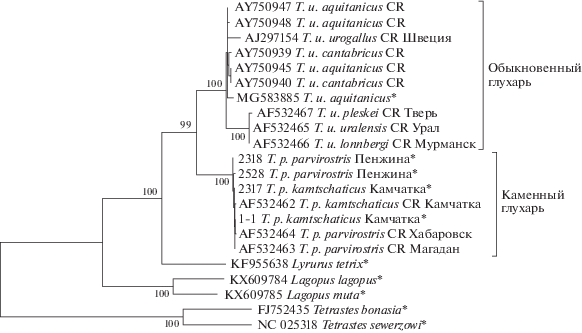
Несколько иная ситуация наблюдается у обыкновенного глухаря, у которого выделяется филогеографическая структура с двумя филогенетическими линиями: западно-европейской (aquitanicus–cantabricus–urogallus) и восточно-европейской (uralensis–pleskei–lonngbergi). Первая филогруппа представлена почти не различающимися образцами от двух изолированных подвидов из Испании и образцом от номинативного подвида из Швеции, дивергировавшим несколько сильнее. Вторая филогруппа гомогенна и соответствует трем подвидам из северной и восточной Европы. В целом этот вид демонстрирует разные уровни внутривидовой дифференциации, что соответствует более обширному ареалу и предположительно более длительному времени его формирования, чем для камчатского подвида каменного глухаря. Необходимо также отметить, что наличие изолятов и обширные ареалы у этих видов обнаружили разную картину становления видовых ареалов, но, несмотря на это, межподвидовые генетические дистанции в филогруппах обоих видов имеют одинаково низкие значения.
Тетерев L. tetrix образует сестринский таксон по отношению к глухарям. Представители родов Tetrastes и Lagopus формируют обособленные монофилетические кластеры. Более подробное рассмотрение филогенетических связей в семействе тетеревиных не входило в задачи настоящей работы.
Полные митохондриальные геномы каменного глухаря ранее не были описаны, а его часть — контрольный регион — использован в нескольких работах по филогении тетеревиных. В них попутно не выявлено различий между теми же двумя подвидами по образцам из Камчатки, Магадана и Хабаровска [18]. Лишь межвидовые сопоставления для построения филогений проведены по трем [19] и пяти митохондриальным генам [20].
В дополнение к анализу митохондриальной ДНК нами проанализированы последовательности фрагмента ядерного гена OCA2 (1097 пн), участвующего в переносе меланина в меланосому, у четырех образцов каменного глухаря. Анализ фрагмента ядерного гена OCA2 не выявил подвидоспецифичных признаков у исследованных образцов. Обе птицы с верховьев р. Пенжины и одна с юга Камчатки по этому маркеру оказались идентичными гетерозиготами, на одном из аллелей выявлена только одна транзиция T/C. Особь с долины р. Камчатка (№ 1-1) оказалась гомозиготой по этому фрагменту. Это свидетельствует о высокой консервативности выбранного фрагмента гена OCA2, несмотря на то что в его состав входят как кодирующие, так и некодирующие участки.
Митохондриальная ДНК издавна служит надежным маркером для решения разнообразных популяционно-генетических и таксономических задач на уровне от подвидового до родового. Благодаря быстрому накоплению мутаций в мтДНК их количество часто служит показателем дивергенции и свидетельством предшествующей изоляции. До недавних пор в анализах использовались один или несколько генов либо участков мтДНК, но в последнее время совершенствование методик молекулярной генетики позволяет получать и сопоставлять полные последовательности митогеномов. При этом разрешающая способность маркера существенно увеличилась. Поэтому даже единичные образцы от каждого подвида, проанализированные нами, дают достоверную оценку сходства или различия геномов. В данном случае различий между камчатским и номинативным материковым подвидами каменного глухаря не обнаружено. Оба подвида образуют единый кластер на филогенетическом дереве (рис. 2) и не имеют подвидоспецифических признаков. Сопоставление двух видов глухарей по анализу отдельного участка мтДНК (CR) подтверждает их монофилетическое происхождение, но демонстрирует разную внутривидовую структуру, отражающую пути микроэволюции. Использованный дополнительно к мтДНК ядерный ген OCA2 также не обнаружил различий между подвидами каменного глухаря. Полученные результаты свидетельствуют о их несомненной близости и относительной молодости камчатского подвида каменного глухаря, что подтверждает приведенные в статье палеогеографические и палеоботанические данные по недавнему формированию камчатских лесов.
Выражаем глубокую признательность камчатским охотникам В.В. Смирнову, П.П. Сычеву и Ю.Ф. Муляру за сбор и доставку образцов глухарей с п-ова Камчатка и бассейна р. Пенжина. Результаты получены с использованием оборудования ЦКП “Дальневосточный вычислительный ресурс” ИАПУ ДВО РАН (https://www.cc.dvo.ru).
Работа выполнена при поддержке программы Дальний Восток Президиума ДВО РАН, грант № 18-4-031.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Лобков Е.Г. Камчатка как локальный центр формообразования у птиц // Биология и охрана птиц Камчатки. М.: Диалог – МГУ, 1999. Вып. 1. С. 5–23.
Лобков Е.Г. Гнездящиеся птицы Камчатки. Владивосток: ДВНЦ АН СССР, 1986. 292 с.
Куренцов А.И. Зоогеография Камчатки // Фауна Камчатской области: Тр. Камчатской комплексной экспедиции. М.; Л.: Изд-во АН СССР, 1963. С. 4–60.
Потапов Р.Л. Отряд Курообразные (Galliformes). Семейство тетеревиные (Tetraonidae). Л.: Наука, 1985. 638 с.
Потапов Р.Л. Каменный глухарь – Tetrao urogalloides Middendorff, 1851 // Птицы СССР. Курообразные, журавлеобразные. Л.: Наука, 1987. С. 186–197.
Хотинский Н.А. Голоцен Северной Евразии: опыт трансконтинентальной корреляции этапов развития растительности и климата: к X Конгрессу INQUA (Великобритания, 1977): моногр. / Под ред. Хотинского Н.А. М.: Наука, 1977. 198 с.
Dirksen V., Dirksen O., Diekmann B. Holocene vegetation dynamics and climate change in Kamchatka Peninsula, Russian Far East // Rev. Palaeobotany and Palynology. 2013. V. 190. P. 48–65. https://doi.org/10.1016/j.revpalbo.2012.11.010
Лобков Е.Г. Птицы бассейна реки Пенжины // Орнитология. М.: МГУ, 2011. Вып. 36. С. 39–102.
Stejneger L. Results of ornithological explorations in the Commander Islands and in Kamchatka // Bull. U. S. Nat. Museum. 1885. 29. 382 p.
Бианки В.В. Отчет о командировке в Камчатку в 1908 году // Изв. Импер. акад. наук. 1909. 1(6). С. 23–52.
Аверин Ю.В. Птицы Камчатского полуострова: Автореф. дис. … докт. биол. наук. Л.: ЗИН АН СССР, 1958. 22 с.
Портенко Л.А. Очерк фауны птиц Корякского нагорья // Проблемы орнитологии. Львов, 1964. С. 57–66.
Лобков Е.Г. Птицы Камчатки (география, экология, стратегия охраны): Докт. дис. М.: МПГУ, 2003. 60 с.
Bonfield J.K., Smith K.F., Staden R. A New DNA Sequence Assembly Program // Nucl. Acids Res. 1995. V. 23. P. 4992–4999.
Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetic analysis version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 33. P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Nei M. Molecular Evolutionary Genetics. N.Y.: Columbia Univ. Press, 1987. 512 p.
Librado P., Rozas J. DnaSP v5: A software for comprehensive analysis of DNA polymorphism data // Bioinformatics. 2009. V. 25. P. 1451–1452. https://doi.org/10.1093/bioinformatics/btp187
Drovetski S.V. Molecular phylogeny of grouse: individual and combined performance of W-linked, autosomal, and mitochondrial loci // Syst. Biol. 2002. V. 51. № 6. P. 930–945. https://doi.org/10.1080/10635150290156033
Dimcheff D.E., Drovetski S.V., Mindell D.P. Phylogeny of Tetraonidae and other galliform birds using mitochondrial 12S and ND2 genes // Mol. Phyl. Evol. 2002. V. 24. P. 203–215. https://doi.org/10.1016/S1055-7903(02)00230-0
Lucchini V., Hoglund J., Klaus S. et al. Historical biogeography and a mitochondrial DNA phylogeny of grouse and ptarmigan // Mol. Phyl. Evol. 2001. V. 20. № 1. P. 149–162. https://doi.org/10.1006/mpev.2001.0943
Дополнительные материалы отсутствуют.



