Генетика, 2020, T. 56, № 5, стр. 514-524
Новый взгляд на оценку клинического значения сверхчисленных маркерных хромосом человека
Т. В. Карамышева 1, Т. А. Гайнер 2, 3, Э. Г. Закирова 1, Н. Б. Рубцов 1, 4, *
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
2 Институт химической биологии и фундаментальной медицины Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
3 ООО “Центр персонализированной медицины”
630090 Новосибирск, Россия
4 Новосибирский государственный университет
630090 Новосибирск, Россия
* E-mail: rubt@bionet.nsc.ru
Поступила в редакцию 30.04.2019
После доработки 30.05.2019
Принята к публикации 23.07.2019
Аннотация
Несмотря на стремительное развитие новых методов молекулярной и молекулярно-цитогенетической диагностики, малые сверхчисленные маркерные хромосомы (мСМХ), впервые описанные в 1961 г., и сегодня представляют собой один из наиболее сложных случаев при проведении диагностики хромосомных патологий человека. В настоящем обзоре рассмотрены новые подходы, методы анализа и описания мСМХ, а также существующие проблемы оценки их возможного влияния на фенотип носителя. Проведен анализ перспектив совершенствования и развития новых методов и подходов для решения проблем, существующих в этой области молекулярно-цитогенетической диагностики хромосомных патологий человека.
Малые сверхчисленные маркерные хромосомы (мСМХ) являются одной из наиболее сложных хромосомных патологий человека для оценки их влияния на формирование фенотипа носителя. Впервые они были описаны в 1961 г. [1]. В большинстве случаев они представляют собой дополнительные элементы кариотипа, небольшой размер которых часто полностью исключает возможность идентификации входящего в них материала при использовании методов, основанных на анализе их морфологии или паттерна хромосомного бэндинга. Идентификация только самых крупных мСМХ, таких как i(5p), i(9p), i(12p), i(18p), может быть проведена на основании анализа их GTG-бэндинга, но и в этих случаях желательна верификация полученных результатов с использованием методов молекулярной цитогенетики: флуоресцентной гибридизации in situ (FISH) и/или сравнительной геномной гибридизации (CGH). Так как они представляют собой инвертированную дупликацию коротких плечей соответствующих хромосом, то их присутствие приводит к тетрасомии по крупным районам, содержащим большое число генов, и вследствие этого к формированию множественных врожденных пороков развития (МВПР). Нарушение генетического баланса большого, но конкретного комплекта генов приводит к формированию определенных и хорошо описанных синдромов [2–6]. В связи с этим оценка клинического значения таких мСМХ, как i(5p), i(9p), i(12p), i(18p), не представляет значительных проблем.
Значительно более сложной задачей является оценка клинического значения мСМХ, в состав которых входит лишь небольшой прицентромерный район одной из хромосом. Проблемы возникают уже на стадии идентификации входящего в состав таких мСМХ материала. Методы дифференциального окрашивания хромосомных районов оказываются неэффективны. Обычно они ограничены возможностью разделения анализируемых дополнительных элементов кариотипа на мСМХ, возникшие из акроцентрических и из двуплечих хромосом. Это обусловлено тем, что мСМХ, возникшие из акроцентрических хромосом, обычно содержат ядрышкообразующие районы (ЯО-районы) и могут быть идентифицированы по наличию вторичной перетяжки или по Ag-NOR окрашиванию активных ЯО-районов [7, 8]. Было замечено, что вероятность возникновения МВПР несколько выше в случае мСМХ, возникших из двуплечих хромосом, что, вероятно, обусловлено повышенной вероятностью присутствия в них эухроматиновых районов за счет вхождения в их состав материала обоих плечей исходной хромосомы.
Частота встречаемости мСМХ у новорожденных колеблется между 0.65–1.5 на 1000 человек [8, 9]. Известны многочисленные случаи семейных мСМХ, не приводящих к формированию каких-либо патологий и передающихся на протяжении нескольких поколений [10]. По некоторым оценкам семейные мСМХ составляют до 40% всех выявленных мСМХ [11]. В то же время присутствие других мСМХ приводит к серьезным нарушениям развития, а в ряде случаев описаны ярко выраженные клинические синдромы [12, 13]. Риск развития аномального фенотипа при наличии мСМХ составляет около 30%. Однако и сегодня полноценная оценка влияния мСМХ на формирование фенотипа носителя во многих случаях является очень сложной задачей, не имеющей надежного решения.
Большинство мСМХ, ассоциированных с МВПР, характеризуются наличием эухроматиновых сегментов, независимо представляют ли они бисателлитные, кольцевые или другие варианты мСМХ [14]. Очевидно, что именно состав присутствующих в мСМХ эухроматиновых районов и определяет их клиническое проявление. Для оценки возможного влияния мСМХ на фенотип носителя имеет значение не только или даже не столько определение происхождения мСМХ, сколько идентификация входящих в ее состав эухроматиновых сегментов исходной хромосомы. В идеале задача цитогенетической диагностики сводится к определению и описанию присутствующего в мСМХ эуроматинового района, т.е. локализации точек разрывов, имевших место при ее возникновении. Решение именно этой задачи открывает путь к формированию достаточно обоснованного прогноза. К сожалению, и в этом случае часто он носит вероятностный характер. Это может быть обусловлено наличием различных комбинаций аллелей генов как в самой мСМХ, так и в нормальных хромосомах, а также мозаичным вариантом присутствия мСМХ в клетках различных тканей. Кроме того, необходимо учитывать возможность однородительской дисомии, часто ассоциированной с de novo возникшими мСМХ.
Стоит отметить, что, несмотря на различное проявление разных эухроматиновых районов в составе мСМХ, существует некоторая положительная корреляция между их размером и тяжестью наблюдаемых аномалий развития. В то же время гетерохроматиновые районы мСМХ, вне зависимости от их размера, не оказывают значительного влияния на фенотип носителя мСМХ. В связи с этим оценка общего размера мСМХ оказывается мало информативна, в то время как выявление в мСМХ эухроматиновых районов может служить указанием на ее негативное влияние на формирование носителя. Задача диагностики в случае присутствия мСМХ сводится к локализации точек разрывов, имевших место при ее возникновении. Решение именно этой задачи позволяет дать относительно обоснованный прогноз фенотипического проявления мСМХ.
К сожалению, приходится признать, что, несмотря на развитие и использование современных методов молекулярно-цитогенетического анализа, надежды на проведение эффективной и надежной диагностики мСМХ, а также на определение их возможного влияния на фенотип носителя оправдались лишь частично. Наибольшие успехи к настоящему времени были достигнуты при разработке методов анализа мСМХ, возникших из 15-й хромосомы человека. Эти мСМХ составляют значительную часть выявленных и описанных мСМХ (~60%), что позволило определить основные горячие точки хромосомных перестроек, приводящих к их возникновению [15]. Далее будут рассмотрены основные проблемы проведения диагностики и оценки значения мСМХ, а также различные методы определения их происхождения, состава и возможности использования полученной информации для оценки влияния выявленных и описанных мСМХ на фенотип носителя.
ОПРЕДЕЛЕНИЕ ПРОИСХОЖДЕНИЯ мСМХ
Определение происхождения мСМХ в основном основано на выявлении в ее прицентромерном районе фрагментов ДНК, гомологичных ДНК прицентромерного района исходной хромосомы. Существует большой набор методов, позволяющих решать эту задачу. К ним могут быть отнесены:
1. Анализ состава альфоидной ДНК прицентромерного района мСМХ [16].
2. FISH ДНК-проб, специфичных прицентромерным и прителомерным районам хромосом, с метафазными хромосомами пациента [17, 18].
3. PRINS – мечение прицентромерных и теломерных ДНК [19].
4. FISH меченой ДНК-библиотеки маркерной хромосомы, полученной изоляцией мСМХ и последующей амплификацией ее ДНК в сиквенс-независимой полимеразной цепной реакции, с хромосомами пациента и здорового донора [20].
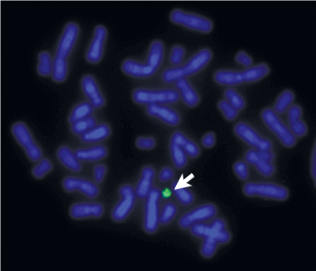
Нам известны лишь два случая, когда перечисленные выше подходы не позволили определить происхождение мСМХ [21]. Вероятно, формирование этих мСМХ было связано с возникновением неоцентромерного района и амплификацией окружающих его повторенных последовательностей. Вероятно поэтому дополнительные исследования не позволили определить и описать входящие в состав этих мСМХ эухроматиновые районы [21]. В случае одной из этих хромосом, которая была исследована нами, FISH полученной из нее микродиссекционной ДНК-пробы, интенсивно окрашивая саму мСМХ, не дала никакого специфического сигнала ни в районах прицентромерного гетерохроматина, ни в эухроматиновых районах хромосом человека (рис. 1).
Рис. 1.
FISH ДНК-пробы, полученной методом микродиссекции маркерной хромосомы (сигнал зеленого цвета). Окраска хромосом красителем DAPI (синий сигнал). Стрелка указывает на сигнал ДНК-пробы на маркерной хромосоме.
В отличие от перечисленных выше методов использование сравнительной геномной гибридизации и массового параллельного секвенирования основано на выявлении нарушения баланса ДНК эухроматиновых районов хромосом. Естественно, эти методы оказались бесполезны при проведении диагностики мСМХ, состоящих только из материала прицентромерного гетерохроматинового района. Их применение не позволяет определить даже из какой хромосомы возникла анализируемая мСМХ. Более того, следует учитывать, что значительное число участков генома характеризуются различными по уровню вариациями в числе копий. Это также осложняет интерпретацию полученных в таких исследованиях результатов, оставляя область определения происхождения мСМХ за методами, основанными на FISH ДНК-проб, специфичных прицентромерным районам хромосом, или микродиссекционных ДНК-проб, полученных из анализируемых мСМХ.
ВЫЯВЛЕНИЕ И ОПИСАНИЕ ЭУХРОМАТИНОВЫХ РАЙОНОВ мСМХ
Развитие молекулярно-цитогенетических методов позволило выявлять наличие и происхождение эухроматиновых районов в перестроенных хромосомах [22–24], в том числе районов, входящих в состав мСМХ [25]. Однако нередко возможность применения этих методов оказывается ограничена их чувствительностью и точностью описания границ интересующего района. Например, применение 24-цветной FISH, принципиально позволяющее определять хромосомное происхождение эухроматиновых районов всех хромосом человека, оказалось малоэффективным при анализе мСМХ, в состав которых входит лишь небольшой район эухроматина. Проблемы обычно возникают, если его размер не достигает 10 млн пн. Для решения проблемы был предложен метод AcroMFISH, при реализации которого сначала определяется происхождение анализируемой мСМХ из двуплечей или акроцентрической хромосомы, а на следующих этапах диагностики определяется исходная хромосома и уточняются границы района, входящего в ее состав [26].
Одним из наиболее эффективных методов определения происхождения и состава мСМХ является создание микродиссекционной ДНК-пробы из маркерной хромосомы с последующим проведением супрессионной FISH с метафазными хромосомами пациента и донора с нормальным кариотипом. Так как значительную часть ДНК такой микродиссекционной ДНК-пробы составляет ДНК прицентромерного района, то стандартная супрессия гибридизации повторенных последовательностей оказывается недостаточной для полного подавления гибридизации в районе прицентромерного гетерохроматина исходной хромосомы, что приводит к его интенсивному окрашиванию. При анализе мСМХ, происходящей из двуплечей хромосомы, сигнал в других прицентромерных районах полностью отсутствует. Несколько более сложная картина может быть при анализе мСМХ, возникшей из акроцентрической хромосомы. Прицентромерные районы акроцентрических хромосом содержат значительное количество гомологичных последовательностей, что при проведении FISH может приводить к появлению сигнала в прицентромерных районах других акроцентрических хромосом. Однако интенсивность такого сигнала оказывается невысокой, что позволяет провести как определение происхождения мСМХ, так и идентификацию входящего в ее состав эухроматинового района, в случае его наличия. Проблема использования этого подхода заключается в недостаточной точности определения дистальной границы эухроматинового района, входящего в состав мСМХ. При проведении FISH с метафазными и даже прометафазными хромосомами точность определения границы сигнала, продуцируемого ДНК-пробой, полученной из мСМХ, к сожалению, не превышает 3 млн пн. Это обусловлено особенностями распластывания хроматина при приготовлении препаратов метафазных и прометафазных хромосом. При проведении FISH с микродиссекционными или сортинговыми ДНК-пробами обычно не удается определить границу района с точностью выше 3–4 млн пн. Обычно она определяется с точностью до одного бэнда, что соответствует в среднем 5–10 млн пн. Увеличить точность при определении границы района можно проведением массового параллельного секвенирования микродиссекционных ДНК-библиотек, полученных из мСМХ [27, 28]. Попытка реализации этого подхода выявила некоторые дополнительные сложности. Как и следовало ожидать, точка разрыва при формировании inv dup(15)(q13) оказалась локализована в участке генома, сильно обогащенном повторенными последовательностями, что значительно осложнило локализацию точки разрыва на основании анализа прочтений уникальных фрагментов ДНК микродиссекционной ДНК-библиотеки, полученных при проведении массового параллельного секвенирования. Тем не менее точность локализации выросла на порядок, достигнув 500 тпн. Попытка дальнейшего уточнения локализации точки разрыва была основана на анализе комбинации вырожденных повторов в установленной перед этим районом точке разрыва. Однаковсе полученные уточнения могли быть отнесены лишь в категорию наиболее вероятной локализации, и все сделанные в результате биоинформатической обработки данных секвенирования выводы требовали последующей экспериментальной проверки.
Использование для определения состава мСМХ микрочиповой сравнительной геномной гибридизации или массового параллельного секвенирования может столкнуться с аналогичными проблемами из-за обогащения района точки разрыва повторенными последовательностями. Однако эти технологии, кроме того, еще и чувствительны к контаминации клетками с нормальным кариотипом, чего практически невозможно избежать при проведении диагностики мСМХ у мозаиков.
Возможно, что для оценки влияния мСМХ на фенотип носителя достаточно локализации точки разрыва в конкретный обогащенный повторами район, и более точная ее локализация не требуется. Однако это предположение требует экспериментальной проверки, причем для всех вариантов мСМХ, так как особенности районов локализации точек разрыва при возникновении мСМХ могут значительно отличаться. Полностью решение такой задачи возможно только при совместной работе всех исследователей, участвующих в разработке методов цитогенетической диагностики и проведении непосредственной диагностики хромосомных патологий. С одной из попыток такого объединения общих усилий цитогенетиков можно ознакомиться на сайте Института генетики человека и антропологии Йенского университета им. Шиллера (www.fish.uniklinikum-jena.de/sSMC.html).
В качестве исторического экскурса стоит вспомнить исследования мСМХ, проводимые до широкого внедрения в лабораторную практику массового параллельного секвенирования, в которых делались попытки изоляции мСМХ для ее последующего детального анализа в гибридах соматических клеток [29]. В отношении этого подхода стоит отметить, что существуют высокие риски хромосомных перестроек при получении гибридов соматических клеток, что ставит под вопрос надежность и достоверность полученных в таких исследованиях результатов. Неудивительно, что после разработки методов массового параллельного секвенирования попытки использования гибридов соматических клеток для анализа состава мСМХ прекратились.
ВОЗМОЖНОСТИ ОЦЕНКИ ВЛИЯНИЯ мСМХ НА ФОРМИРОВАНИЕ ФЕНОТИПА НОСИТЕЛЯ СОВРЕМЕННЫМИ МЕТОДАМИ МОЛЕКУЛЯРНО-ЦИТОГЕНЕТИЧЕСКОГО АНАЛИЗА
Оценка возможного влияния любого отклонения от нормального кариотипа на формирование фенотипа носителя является основной задачей цитогенетической диагностики. Какие возможности и ограничения существуют сегодня при проведении анализа мСМХ? Следует отметить, что эффективность применения современных методов молекулярно-цитогенетического анализа мСМХ может сильно отличаться у различных пациентов в зависимости от конкретных особенностей мСМХ и ее присутствия в клетках различных тканей и органов. Например, как уже упоминалось выше, сравнительная геномная гибридизация и массовое параллельное секвенирование при анализе мСМХ, состоящих только из района прицентромерного гетерохроматина исходной хромосомы, не позволяют определить даже из какой хромосомы возникла мСМХ. Присутствие в хромосомном наборе пациента таких мСМХ не приводит к формированию патологического фенотипа, но следует напомнить, что при возникновении мСМХ de novo велика вероятность однородительской дисомии по исходной хромосоме, т.е. определение происхождения новой мСМХ является необходимым элементом цитогенетической диагностики. Дополнительной проблемой, препятствующей эффективному использованию сравнительной геномной гибридизации и массового параллельного секвенирования, может оказаться присутствие мСМХ только в части клеток пациента. При проведении диагностики у таких пациентов эффективным оказывается использование FISH с соответствующими ДНК-пробами на метафазных хромосомах пациентов. Наиболее эффективным представляется получение микродиссекционной ДНК-пробы из анализируемой мСМХ с последующей ее гибридизацией с метафазными и прометафазными хромосомами пациента и донора с нормальным набором хромосом. В результате такой диагностики будет определена хромосома, из которой возникла анализируемая мСМХ, и в случае наличия в ее составе достаточно крупного эухроматинового района (более 5 млн пн) будет выявлено его присутствие. Дальнейшее уточнение локализации точки разрыва может быть осуществлено проведением FISH с ДНК-пробами, содержащими фрагменты ДНК, гомологичные ДНК из района предполагаемой точки разрыва. К сожалению, в настоящее время такое уточнение достаточно часто не позволяет значительно улучшить оценку возможного клинического значения анализируемой мСМХ из-за отсутствия информации об аналогичных мСМХ. В связи с этим в большинстве случаев такая мСМХ относится в категорию хромосомных перестроек, которые потенциально могут приводить к формированию патологического фенотипа. Однако последние годы непрерывно увеличивается число детально описанных мСМХ (www.fish.uniklinikum-jena.de/sSMC.html, http://www.med.uni-jena.de/fish/ sSMC/00START.htm, http://markerchromosomes.wg.am, http://markerchromosomes.ag.vu), что позволяет рассчитывать на рост возможностей в получении необходимой оценки клинического значения мСМХ при проведении молекулярно-цитогенетической диагностики.
В настоящее время для большинства мСМХ при проведении такой оценки приходится опираться на достаточно простые предположения: 1) мСМХ, не содержащие эухроматинового района, не приводят к формированию патологического фенотипа; 2) мСМХ, содержащие крупный эухроматиновый(ые) район(ы), с высокой вероятностью приводят к формированию патологического фенотипа; 3) мСМХ, содержащие небольшой эухроматиновый(ые) район(ы), могут как приводить, так и не приводить к формированию патологического фенотипа. Отметим, что при анализе мСМХ, не содержащих эухроматинового района, детектированного с помощью описанных выше методов, визуализация эухроматинового района меньшего размера может быть осуществлена с помощью FISH ДНК-пробы, выявляющей диспергированные повторенные последовательности, представленные преимущественно в эухроматиновых районах [30]. Такой подход позволяет детектировать эухроматиновые районы размером до 100 тпн. То есть мСМХ, в составе которой такой подход не выявил эухроматина, с высокой вероятностью не будет приводить к нарушению нормального развития ее носителя. Принципиально такой подход позволяет с большей надежностью отнести анализируемую маркерную хромосому к группе мСМХ, которые с высокой вероятностью не приводят к нарушениям нормального развития.
Анализ мСМХ, содержащих небольшие эухроматиновые районы (до 3 млн пн), показал, что по крайней мере некоторые такие мСМХ не приводят к формированию патологического фенотипа [31–33]. Авторы полагают, что это может быть обусловлено эффектом положения данных эухроматиновых районов в непосредственной близости к блоку гетерохроматина. В случае, если это предположение верно, можно ожидать, что такие небольшие районы эухроматина и в других мСМХ не будут приводить к нарушению развития. Однако нельзя исключить, что замеченный феномен справедлив только для части мСМХ.
Значительно больше возможностей для оценки клинического значения мСМХ открывается при анализе мСМХ, происходящих из хромосомы 15 человека, что обусловлено уже проведенным детальным изучением большого числа таких мСМХ. В ходе исследований маркерных хромосом, возникших из 15-й хромосомы, были определены и описаны горячие точки хромосомных перестроек, приводящих к различным вариантам мСМХ. В связи с этим при проведении цитологической диагностики задача часто сводится к выяснению, к какому из известных типов маркерных хромосом относится мСМХ, выявленная у конкретного пациента. Помимо уже ставших стандартными методов анализа таких мСМХ, в ходе разработки новых методов анализа мСМХ нами были предложены новые варианты описания inv dup(15), основанные на микродиссекции метафазных хромосом и FISH с микродиссекционными ДНК-пробами.
МЕТОДЫ И ПОДХОДЫ МОЛЕКУЛЯРНО-ЦИТОГЕНЕТИЧЕСКОГО ОПИСАНИЯ мСМХ inv dup(15)
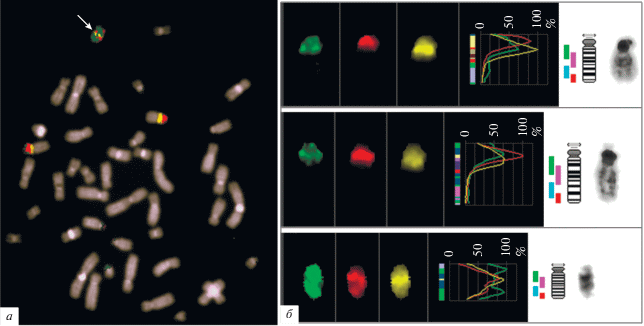
Идея, лежащая в основе наиболее часто используемых подходов, заключается в первоначальном определении происхождения мСМХ из 15-й хромосомы и последующем уточнении локализации точки разрыва. Обычно уточнение проводится методом FISH с ДНК-пробами, гомологичными последовательностям, локализованным в районах, представленных или отсутствующих в разных типах inv dup(15) [34–37]. В отличие от этого подхода предложенные нами методы основаны на сравнении ранее изученных мСМХ (inv dup(15)(q11) и inv dup(15)(q13)) с новой анализируемой мСМХ. Предположение о том, что анализируемая мСМХ представляет собой инвертированную дупликацию коротких плечей и небольшого района длинного плеча одной из акроцентрических хромосом, можно сделать на основании анализа ее морфологии: наличие вторичных перетяжек в обоих плечах мСМХ. Затем оно может быть подтверждено FISH с ДНК-пробой, полученной из хромосомы 15 человека. На рис. 2 приведен пример анализа такой мСМХ (рис. 2,а). Сигнал FISH с ДНК-пробы, полученной из хромосомы 15 человека, был выявлен на двух гомологах хромосомы 15 и на мСМХ, тогда как FISH с ДНК-пробой, полученной из хромосомы 22, окрасив гомологи хромосомы 22, дала только слабый сигнал на спутниках мСМХ (рис. 2,б). Для решения вопроса о наличии или отсутствии в составе мСМХ эухроматиновых районов была проведена совместная гибридизация in situ двух ДНК-проб, полученных из ранее детально описанных мСМХ, представляющих собой inv dup(15), но отличающихся по присутствию в них эухроматинового района. Одна из исследованных мСМХ состояла только из двух копий коротких плечей и прицентромерного гетерохроматинового района длинного плеча, тогда как вторая имела в своем составе дополнительный эухроматиновый район, прилежащий к прицентромерному гетерохроматину [34–37]. Также была получена микродиссекционная ДНК-проба из мСМХ пациента, для которого проводилась цитогенетическая диагностика. Использованные ДНК-пробы были мечены различными флуорохромами, что позволило провести двух- и трехцветную FISH с метафазными хромосомами пациента (рис. 3). При проведении трехцветной FISH профиль интенсивности сигнала ДНК-пробы, полученной из мСМХ пациента, измеренный вдоль хромосомы 15 с помощью программ ISIS4 (META Systems GmbH), в длинном плече хромосомы 15 полностью совпал с профилем интенсивности ДНК-пробы, полученной из ранее изученной мСМХ, содержащей эухроматиновый район q11 → q13 (рис. 4). Это однозначно указывало на наличие в анализируемой хромосоме соответствующего эухроматинового района.
Рис. 2.
FISH хромосомоспецифичной ДНК-пробы с метафазными хромосомами пациента: а – HSA15-специфичной ДНК-пробы (зеленый сигнал); б – HSA22-специфичной ДНК-пробы (зеленый сигнал). Окраска хромосом красителем DAPI
(синий сигнал). → указывает на сигнал ДНК-пробы на гомологах хромосомы 15 (а) и хромосомы 22 (б);  указывает на сигнал ДНК-пробы на маркерной хромосоме inv dup(15) (а) и на мСМХ (б).
указывает на сигнал ДНК-пробы на маркерной хромосоме inv dup(15) (а) и на мСМХ (б).
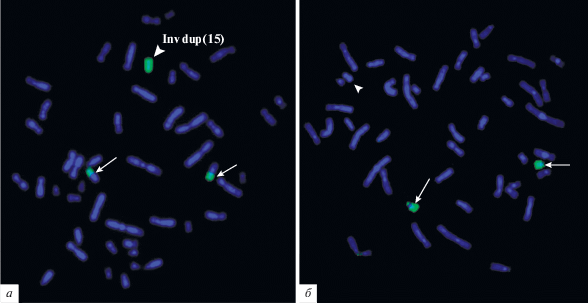
Рис. 3.
Двухцветная FISH районоспецифичных ДНК-проб, полученных из охарактеризованных ранее
мСМХ der(15) с метафазными хромосомами здорового индивида (а) и хромосомами пациента (б). Зеленый сигнал – сигнал FISH микродиссекционной ДНК-пробы, специфичной (15)(pter
→ q11.1); красный сигнал – сигнал FISH микродиссекционной ДНК-пробы, специфичной (15)(pter
→ q13); синий сигнал – окраска ДНК красителем DAPI. Inv dup(15) указывает на маркерную
хромосому; HSA15 – нормальные гомологи хромосомы 15.  указывают на сигнал, выявляемый в коротких плечах акроцентрических хромосом; →,
указывают на сигнал, выявляемый в коротких плечах акроцентрических хромосом; →,  указывают на двухцветные сигналы на гомологах хромосомы 15 и на маркерной хромосоме.
указывают на двухцветные сигналы на гомологах хромосомы 15 и на маркерной хромосоме.
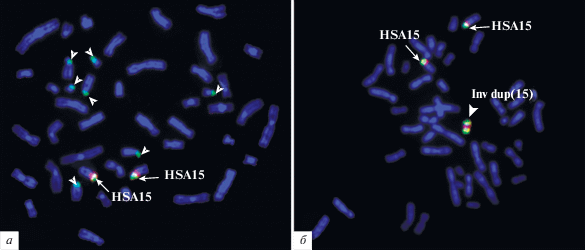
Рис. 4.
Трехцветная FISH ДНК-проб с хромосомами пациента: а – ДНК-пробы, полученной из анализируемой маркерной хромосомы (зеленый сигнал), и ДНК-проб двух тестирующих маркерных хромосом (красный и желтый сигналы); б – профили интенсивностей сигнала вдоль хромосомы 15 и мСМХ. Стрелка указывает на эухроматиновый материал, выявленный на мСМХ.
Так как задачей диагностики в подобных случаях является определение, к какому типу мСМХ относится анализируемая inv dup(15), то проведение диагностики может быть выполнено без получения микродиссекционной ДНК-пробы анализируемой мСМХ. Для этого достаточно проведения двухцветной FISH с микродиссекционными ДНК-пробами, полученными из мСМХ, являющихся inv dup(15)(q11) и inv dup(15)(q13). Если микродиссекционная ДНК-проба, полученная из inv dup(15)(q11), окрашивала на анализируемой хромосоме только спутники и районы, гомологичные прицентромерному району хромосомы 15, то микродиссекционная ДНК-проба, полученная из inv dup(15)(q13), дополнительно окрашивала эухроматиновый район, гомологичный проксимальному району хромосомы 15 (рис. 4). Для наглядности и для того, чтобы избежать маскирования этого района в результате распластывания ДНК фланкирующих его гетерохроматиновых районов, которое могло иметь место при приготовлении препаратов метафазных хромосом, был использован метод многоцветного бэндинга (МСВ) (META Systems GmbH), применение которого позволяет переводить в псевдоцвета соотношение интенсивностей сигналов, полученных при проведении многоцветной FISH (рис. 5).
Рис. 5.
Многоцветный бэндинг р-плеча хромосомы 15 человека. а – двухцветная FISH ДНК-пробы маркерной хромосомы, специфичной (15)(pter → q13) (красный цвет) и ДНК-пробы маркерной хромосомы, специфичной (15)(pter → q11.1) (зеленый цвет), с метафазными хромосомами здорового индивида; б, в, г, д, е – варианты классификаторов псевдоцветов.
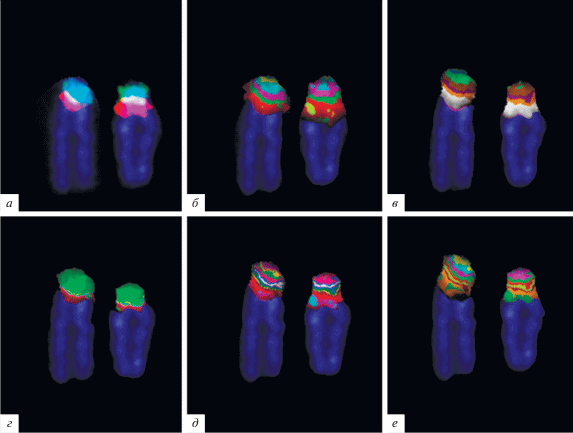
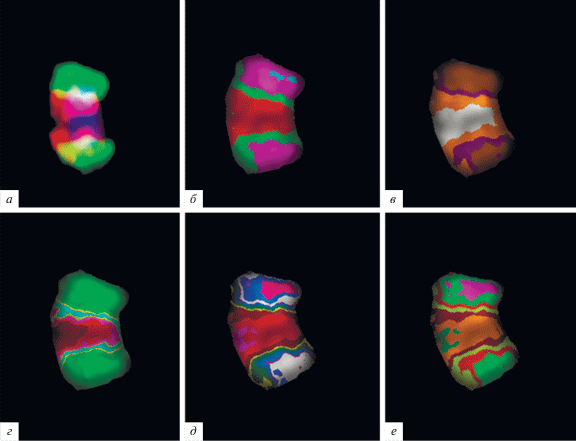
Ранее этот метод был использован при анализе inv dup(15) [38], при котором был применен полный комплект микродиссекционных ДНК-проб, полученных из разных районов хромосомы 15. Нами при проведении МСВ мСМХ была использована пара микродиссекционных ДНК-проб, полученных из маркерных хромосом inv dup(15)(q11) и inv dup(15)(q13). Созданы несколько классификаторов для получения МСВ маркерной хромосомы (рис. 6) и гомологичного района хромосомы 15 (рис. 5). Подобный подход позволяет надежно идентифицировать inv dup(15)(q11) и inv dup(15)(q13).
Рис. 6.
Многоцветный бэндинг маркерной хромосомы. а – двухцветная FISH ДНК-пробы маркерной хромосомы, специфичной (15)(pter → q13) (красный цвет) и ДНК-пробы маркерной хромосомы, специфичной (15)(pter → q11.1) (зеленый цвет) с маркерной хромосомой пациента; б, в, г, д, е – варианты МСВ при разных классификаторах псевдоцветов.
ЗАКЛЮЧЕНИЕ
Несмотря на огромные успехи в развитии новых методов молекулярно-цитогенетического анализа, решение проблемы диагностики и оценки возможного влияния мСМХ на формирование фенотипа носителя остается актуальным. Оно требует точного описания состава мСМХ, а в случаях мозаицизма описания распределения мСМХ в клетках разных тканей и органов. Способы решения второй задачи пока не находятся даже на стадии начальной разработки. Решение первой задачи представляется возможным даже уже при существующих методах хромосомного анализа. Результат изучения мСМХ, представляющих собой inv dup(15), позволяет смотреть в будущее с оптимизмом. Но следует учитывать, что inv dup(15) составляет около 60% всех мСМХ. Доступный для изучения обширный материал значительно упрощает выявление горячих точек хромосомных перестроек и разработку эффективных методов диагностики. Частота встречаемости других мСМХ существенно ниже, и вопрос о существовании в проксимальных районах этих хромосом горячих точек хромосомных перестроек, за исключением хромосомы 22 [9, 12], остается открытым.
Вероятно, в ближайшее время подход к оценке клинического значения мСМХ останется практически прежним. В результате проведенной диагностики анализируемая мСМХ будет отнесена к одной из трех категорий: непатогенная мСМХ; мСМХ, ассоциированная с патологическими фенотипами; мСМХ, вопрос о клиническом проявлении которой не может быть решен в настоящее время. Данные об отсутствии видимого проявления на фенотипе носителя мСМХ, имеющих в своем составе небольшой район эухроматина (не более 3 млн пн), заставляют более внимательно отнестись к таким мСМХ [25]. Возможно, поиск и их детальный анализ позволят пересмотреть параметры мСМХ, которые могут быть отнесены к категории непатогенных маркерных хромосом.
Работа поддержана грантом РФФИ (19-015-00084а) и бюджетным финансированием по теме государственного задания (0324-2019-0042, № госрегистрации: АААА-А17-117071240065-4).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ilbery P.L.T., Lee C.W.G., Winn S.M. Incomplete trisomy in a mongoloid child exhibiting minimal stigmata // Med. J. Aust. 1961. V. 2. № 5. P. 182–184. https://doi.org/10.5694/j.1326-5377.1961.tb69389.x
Magenis R.E., Sheehy R.R., Brown M.G. et al. Parental origin of the extra chromosome in the cat eye syndrome: Evidence from heteromorphism and in situ hybridization analysis // Am. J. Med. Genet. 1988. V. 29. № 1. P. 9–19. https://doi.org/10.1002/ajmg.1320290103
Mears A.J., Duncan A.M., Budarf M.L. et al. Molecular characterization of the marker chromosome associated with cat eye syndrome // Am. J. Hum. Genet. 1994. V. 55. № 1. P. 134–142.
Mears A.J., El-Shanti H., Murray J.C. et al. Minute supernumerary ring chromosome 22 associated with cat eye syndrome: further delineation of the critical region // Am. J. Hum. Genet. 1995. V. 57. № 3. P. 667–673.
Shaffer L.G. American College of Medical Genetics guideline on the cytogenetic evaluation of the individual with developmental delay or mental retardation // Genet. Med. 2005. V. 7. P. 650–654.
Shaffer L.G., Bejjani B.A., Torchia B. et al. The identification of microdeletion syndromes and other chromosome abnormalities: Cytogenetic methods of the past, new technologies for the future // Am. J. Med. Genet. Part C. Semin. Med. Genet. 2007. V. 145. № 4. P. 335–345.
Shaffer L.G., McGowan-Jordan J., Schmid M. ISCN 2013: an international system for human cytogenetic nomenclature // Karger Med. Sci. Publ., 2013.
Liehr T., Claussen U., Starke H. Small supernumerary marker chromosomes (sSMC) in humans // Cytogenet. Genome Res. 2004. V. 107. № 1–2. P. 55–67. https://doi.org/10.1159/000079572
Liehr T. Small supernumerary marker chromosomes – an update // Mol. Cytogenet. 2014. V. 7. № 1. P. 111. https://doi.org/10.1186/1755-8166-7-S1-I11
Giardino D., Finelli P., Russo S. et al. Small familial supernumerary ring chromosome 2: FISH characterization and genotype-phenotype correlation // Am. J. Med. Genet. 2002. V. 111. № 3. P. 319–323. https://doi.org/10.1002/ajmg.10537
Graf M.D., Schwartz S. Molecular approaches for delineating marker chromosomes. // Methods Mol. Biol. 2002. V. 204. P. 211–218. https://doi.org/10.1385/1-59259-300-3:211
Liehr T. Small supernumerary marker chromosomes (sSMC) a guide for human geneticists and clinicians; with contributions by unique (The Rare Chromosome Disorder Support Group). Heidelberg; Dordrecht; London; N.Y.: Springer, 2012. https://doi.org/10.1007/978-3-642-20766-2
Armanet N., Tosca L., Brisset S. et al. Small supernumerary marker chromosomes in human infertility // Cytogenet. Genome Res. 2015. V. 146. № 2. P. 100–108. https://doi.org/10.1159/000438718
Wandstrat A.E., Schwartz S. Isolation and molecular analysis of inv dup(15) and construction of a physical map of a common breakpoint in order to elucidate their mechanism of formation // Chromosoma. 2000. V. 109. № 7. P. 498–505.
Parokonny A.S., Wang N.J., Driscoll J. et al. Atypical breakpoints generating mosaic interstitial duplication and triplication of chromosome 15q11-q13 // Am. J. Med. Genet., Part A. 2007. V. 143. P. 2473–2477.
Yurov Y.B., Soloviev I.V., Vorsanova S.G. et al. High resolution multicolor fluorescence in situ hybridization using cyanine and fluorescein dyes: Rapid chromosome identification by directly fluorescently labeled alphoid DNA probes // Hum. Genet. 1996. V. 97. № 3. P. 390–398.
Micci F., Teixeira M.R., Bjerkehagen B., Heim S. Characterization of supernumerary rings and giant marker chromosomes in well-differentiated lipomatous tumors by a combination of G-banding, CGH, M-FISH, and chromosome- and locus-specific FISH // Cytogenet. Genome Res. 2002. V. 97. № 1–2. P. 13–19. https://doi.org/10.1159/000064038
Nietzel A., Rocchi M., Starke H. et al. A new multicolor-FISH approach for the characterization of marker chromosomes: centromere-specific multicolor-FISH (cenM-FISH) // Hum. Genet. 2001. V. 108. № 3. P. 199–204.
Cervantes A., Guevara-Yáñez R., López M. et al. PCR-PRINS-FISH analysis of structurally abnormal sex chromosomes in eight patients with Turner phenotype // Clin. Genet. 2001. V. 60. № 5. P. 385–392. https://doi.org/10.1034/j.1399-0004.2001.600512.x
Рубцов Н.Б., Карамышева Т.В., Матвеева В.Г. и др. Обратная in situ гибридизация ДНК-зондов аномальных хромосом в диагностике хромосомных патологий // Генетика. 2001. Т. 37. № 11. С. 1545–1552.
Mackie Ogilvie C., Harrison R.H., Horsley S.W. et al. A mitotically stable marker chromosome negative for whole chromosome libraries, centromere probes and chromosome specific telomere regions: a novel class of supernumerary marker chromosome? // Cytogenet Genome Res. 2001. V. 92. № 1–2. P. 69–73. https://doi.org/10.1159/000056871
Pinkel D., Straume T., Gray J.W. Cytogenetic analysis using quantitative, high-sensitivity, fluorescence hybridization // Proc. Natl Acad. Sci. USA. 2006. V. 83. P. 2934–2938.
Cremer T., Landegent J., Brückner A. et al. Detection of chromosome aberrations in the human interphase nucleus by visualization of specific target DNAs with radioactive and non-radioactive in situ hybridization techniques: diagnosis of trisomy 18 with probe L1.84 // Hum. Genet. 1986. V. 74. P. 346–352.
Gerdes A.M., Pandis N., Bomme L. et al. Fluorescence in situ hybridization of old G-banded and mounted chromosome preparations // Cancer Genet. Cytogenet. 1997. V. 98. P. 9–15.
Hamid Al-Rikabi A.B., Pekova S., Fan X. et al. Small supernumerary marker chromosome may provide information on dosage-insensitive pericentric regions in human // Curr. Genomics. 2018. V. 19. № 3. P. 192–199. https://doi.org/10.2174/1389202918666170717163830
Langer S., Fauth C., Rocchi M. et al. AcroM fluorescent in situ hybridization analyses of marker chromosomes // Hum. Genet. 2001. V. 109. № 2. P. 152–158.
Speicher M.R. Fluorescence in situ hybridization (FISH) techniques // Encyclopedia of Life Sciences. John Wiley and Sons, Ltd., 2005. P. 1–7.https://doi.org/0.1038/npg.els.0005779
Ten Bosch J.R., Grody W.W. Keeping up with the next generation: Massively parallel sequencing in clinical diagnostics // J. Mol. Diagnostics. 2008. V. 10. P. 484–492.
Raimondi E., Balzaretti M., Moralli D. et al. Gene targeting to the centromeric DNA of a human minichromosome // Hum. Gene Ther. 1996. V. 7. № 9. P. 1103–1109. https://doi.org/10.1089/hum.1996.7.9-1103
Morozkin E.S., Loseva E.M., Karamysheva T.V. et al. A method for generating selective DNA probes for the analysis of C-negative regions in human chromosomes // Cytogenet. Genome Res. 2011. V. 135. № 1. P. 1–11. https://doi.org/10.1159/000330124
Tsuchiya K.D., Opheim K.E., Hannibal M.C. et al. Unexpected structural complexity of supernumerary marker chromosomes characterized by microarray comparative genomic hybridization // Mol. Cytogenet. 2008. V. 1. P. 7.
Liehr T. Small supernumerary marker chromosomes (sSMCs): A spotlight on some nomenclature problems // J. Histochem. Cytochem. 2009. V. 57. № 11. P. 991–993.
Liehr T., Ewers E., Kosyakova N. et al. Handling small supernumerary marker chromosomes in prenatal diagnostics // Expert Rev. Mol. Diagnostics. 2009. V. 9. № 4. P. 317–324.
Rubtsov N., Karamysheva T., Babochkina T. et al. A new simple version of chromosome microdissection tested by probe generation for 24-multi-color FISH, Multi-color banding (MCB), ZOO-FISH and in clinical diagnostics // Medgen. 2000. V. 12. P. 65.
Рубцов Н.Б., Карамышева Т.В., Гайнер Т.А. Сверхчисленные маркерные хромосомы // Мед. генетика. 2003.Т. 2. № 6. С. 248–258.
Рубцов Н.Б., Карамышева Т.В., Гайнер Т.А., Шкляева О.А. Анализ маркерных хромосом: ДНК пробы для оценки возможного клинического значения маркерной хромосомы // Мед. генетика. 2003. Т. 2. № 12. С. 520–527.
Гайнер Т.А., Матвеева В.Г., Каримова О.Г. и др. Исследование кариотипа человека: верификация диагноза // Цитология. 2016. Т. 58. № 6. С. 482–487.
Webb T., Hardy C., King M. et al. A clinical, cytogenetic and molecular study of ten probands with supernumerary inv dup(15) marker chromosomes // Clin. Genet. 1998. V. 53. P. 34–43.
Дополнительные материалы отсутствуют.


