Генетика, 2020, T. 56, № 6, стр. 677-689
Дифференциация северной азиатской кеты (Oncorhynchus keta W.) по микросателлитным маркерам
М. В. Шитова 1, *, Ю. Н. Хохлов 2, 3, А. И. Никифоров 4, П. К. Афанасьев 5, С. Ю. Орлова 6, А. Н. Ельников 6, А. В. Бугаев 7, Т. А. Ракицкая 1, В. Д. Прохоровская 1, Т. В. Малинина 1, Д. В. Политов 1, К. И. Афанасьев 1, 6, Г. А. Рубцова 1, Л. А. Животовский 1, 6, **
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Тихоокеанский научно-исследовательский рыбохозяйственный центр,
Чукотское отделение
689000 Анадырь, Россия
3 Пермское краевое отделение общероссийской общественной организации
“Всероссийское общество охраны природы”
614025 Пермь, Россия
4 Московский государственный институт международных отношений (Университет)
119454 Москва, Россия
5 Главное бассейновое управление по рыболовству и сохранению водных биологических ресурсов
115114 Москва, Россия
6 Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии
107140 Москва, Россия
7 Камчатский филиал Всероссийского научно-исследовательского института рыбного хозяйства и океанографии
683000 Петропавловск-Камчатский, Россия
* E-mail: shitova-m@rambler.ru
** E-mail: levazh@gmail.com
Поступила в редакцию 24.05.2019
После доработки 21.11.2019
Принята к публикации 14.01.2020
Аннотация
В работе была проанализирована 41 выборка кеты северной части ареала по десяти микросателлитным локусам. В северной части ареала азиатской кеты однозначно выделяются такие группы выборок как “Магаданская область”, “северная часть Камчатки”, “р. Пенжина”, “бассейн р. Анадырь”. Популяции кеты из р. Апука и группы “Корякское нагорье” показывают слабую генетическую дифференциацию от остальных групп. Наблюдается положительная связь между географической широтой и средней ожидаемой гетерозиготностью на данной части ареала. Кета реки Пенжина показывает генетическую близость с кетой из бассейна реки Анадырь.
Значительные экологические отличия условий существования отдельных территориальных группировок кеты северной части ареала предопределяют интерес к изучению своеобразного комплекса популяционно-генетических характеристик существующих стад кеты.
За северную часть ареала азиатской кеты в данном исследовании принята территория, расположенная между береговой линией Северного Ледовитого океана и 58° северной широты.
Кета северной части азиатского ареала размножается преимущественно естественным способом. Исключение составляют лишь стада кеты Магаданской области, где часть стад воспроизводится искусственно на лососевых рыбоводных заводах (ЛРЗ). Естественные нерестилища кеты данной части ареала характеризуются рядом особенностей, связанных с природными и климатическими характеристиками местности. Нерестилища находятся преимущественно на территории вечной мерзлоты, и реки, расположенные на этой территории, характеризуются активно меандрирующими руслами (границы русла рек непостоянны и меняются в достаточно короткий временной промежуток). В связи с этим и границы нерестовых участков непостоянны, под воздействием паводков нерестилища замываются аллювиальными отложениями в одних местах и возникают в других. Следствием непостоянства границ нерестовых участков является повышенная смертность икры и эмбрионов в зимнее время, особенно при резких падениях уровня воды [1]. Еще одной особенностью данной территории является низкая лесистость, например, лесистость территории Анадырского бассейна составляет лишь 5%, в то время как оптимальное значение для лососевых рек составляет 40–45% территории [2].
Реки Анадырского лимана (реки Анадырь, Канчалан и Великая) – самые северные реки, в которые заходит на нерест промышленно-значимое число производителей кеты. Средняя численность нерестового стада кеты Анадырского бассейна – 2 млн рыб, возврат производителей составляет примерно 0.75% от скатившейся молоди [2]. В реках ледовитоморского бассейна кета тоже нерестится (вплоть до р. Лена), но численность ее невысока и промышленный лов не ведется (осуществляется вылов только для нужд коренного населения). В реку Анадырь заходит основная часть кеты из Анадырского лимана (85–90%) [2], основные нерестилища начинаются в районе с. Марково. Река Белая является крупным левым притоком р. Анадырь. В р. Белая нерестится 15–20% кеты, заходящей в р. Анадырь [2].
По мнению С.В. Путивкина [3] стада кеты Анадырского бассейна обитают в экстремальных природных условиях. Возможно с этим связан крайне низкий уровень ее естественного воспроизводства (в 25–30 раз ниже, чем на Камчатке) [2].
Реки западного побережья Камчатского полуострова преимущественно равнинные, а реки восточного побережья и Корякского нагорья горного типа более мелководны и короче. Кета занимает около 20% площади нерестовых участков Камчатского края [2].
Реки северной части Охотского моря по гидрологическому режиму близки к арктическому типу. Непостоянство гидрометеорологических факторов оказывает существенное воздействие на естественное воспроизводство кеты в реках северной части Охотского моря, в связи с этим выживаемость кеты в реках в разные годы отличается в 100 и более раз [4]. Повышение уровня воды в теплый сезон (почти весь сток, до 90–95%, приходится на теплый сезон, на холодные месяцы приходится только 3–5% годового стока), высокие температуры воздуха в летний период, промерзание нерестовых бугров – все эти факторы оказывают существенное влияние на выживаемость, а впоследствии и на возврат производителей кеты в реки северной части Охотского моря [2].
Анализ генетического разнообразия и популяционно-генетической структуры кеты северной части ареала изучался рядом исследователей по небольшому количеству выборок на аллозимных локусах и мтДНК.
В монографии Н.В. Варнавской [5] показано, что на основе анализа 40 аллозимных локусов стада кеты Азиатского побережья разделяются на три основных кластера – север Дальнего Востока России (р. Амур, Магаданская обл., Камчатка, Чукотка), юг Дальнего Востока России (Приморье и южная часть Сахалина) и Япония. Кластер северных российских популяций разделился на два больших кластера: в один вошли популяции бассейнов р. Анадырь и р. Пенжина, в другой – стада Магадана и Камчатки.
Выявлен высокий уровень генетического обмена внутри крупных речных систем таких как Анадырь и Пенжина [5]. Авторы работы связывают это с изменчивостью границ русла северных рек (эффект меандрирования), как это показано на примере р. Камчатка, где в течение шести лет велись подробные наблюдения за границами русла и связанных с этим нарушений границ элементарных популяций [6].
В работах ряда авторов [7, 8] на основе анализа аллозимных локусов были обнаружены существенные межгодовые колебания частот генов в выборках из притоков р. Анадырь и у ряда камчатских выборок.
В работах Е.А. Салменковой с соавт. [9–11] показано, что группировка кеты р. Анадырь более схожа с северо-сахалинской кетой, чем с магаданской и камчатской группами, что входит в противоречие с результатами ранней работы Н.В. Варнавской [5].
Ни в одной из приведенных работ не была выявлена гетерогенность анадырского стада кеты (хотя в исследованиях анализировалась кета нескольких притоков данной реки – Майн, Белая, Ваеги, Еропол, и нерестилища в русле Анадыря (с. Марково)).
В обширных исследованиях С. Сато с соавт. и С. Абе с соавт. [12, 13] изучались гаплотипы 48 локальных стад, было показано, что кета северной части ареала азиатского побережья разделилась на два кластера. В первый вошли р. Анадырь, некоторые реки Северо-Западной Камчатки и северного побережья Охотского моря, во второй – реки Западной Камчатки, некоторые реки северного побережья Охотского моря и р. Амур. На американском побережье кета северной части ареала тоже разделилась на два больших кластера. Первый включает выборки Северо-Западной Аляски, с которыми объединяются выборки Восточной Камчатки (бассейн р. Камчатка). Второй кластер представлен кетой Юго-Восточной Аляски, Британской Колумбии и штата Вашингтон.
В работе Л.А. Животовского с соавт. [14] дана наиболее подробная классификация региональных группировок кеты российского Дальнего Востока, полученная на основе данных об изменчивости микросателлитных маркеров: (1) южная кета (группы: Приморье, Итуруп, Кунашир), (2) кета юго-западного Сахалина, (3) кета р. Амур, (4) охотоморская кета Сахалина (группы: Северо-Восточный Сахалин и Юго-Восточный Сахалин вместе с зал. Анива), (5) северная кета (группы: Камчатка, североохотоморское побережье материка, Чукотка).
Учитывая вышеизложенную информацию можно заключить, что вопрос о популяционной структуре и генетических отношениях популяций северной кеты до сих пор является слабоизученным. В связи с этим становится актуальным подробный анализ популяционно-генетической структуры кеты северной части ареала на основе анализа более дифференцирующих маркеров.
Популяционно-генетическая структура северной кеты интересна и с точки зрения базовых вопросов формирования популяционной структуры вида на территориях с экстремальными для вида условиями, т.е. на границах ареала. Решение этих вопросов может найти свое применение как в природоохранной, так и в хозяйственной деятельности на подобных территориях.
Цель данного исследования – подробная оценка генетического разнообразия и популяционно-генетической структуры северной кеты.
МАТЕРИАЛЫ И МЕТОДЫ
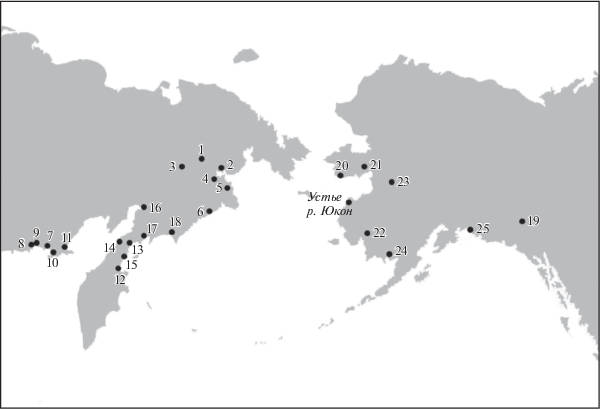
Материалом для работы послужили образцы кеты, собранные в период с 2009 по 2011 гг. в реках Чукотского АО, в р. Апука в 2011 г. (Камчатский край) и в реке Ола в 2002 г. (Магаданская обл.), а также в реках штата Аляска (США) и Канады в период с 2001 по 2010 гг. (выборки предоставлены в рамках международного сотрудничества по линии NPAFC11). Дополнительно, к исследованию привлекались данные из работ Л.А. Животовского с соавт. и К.И. Афанасьева с соавт. [14, 15]. Список всех выборок, используемых в работе, представлен в табл. 1. Всего в работе была проанализирована 41 выборка (1686 образцов). Объем каждой выборки варьирует от 16 до 50 образцов, средний объем выборки – 41 образец. Некоторые реки представлены несколькими выборками, собранными в течение одного года или в разные годы. Все исследованные выборки представлены производителями кеты, собранными непосредственно в реках, исключение составляют две выборки из р. Апука за 2011 г. – Kam11ApuBEarl и Kam11ApuBLate – эти выборки собраны в Олюторском заливе на входе в русло реки. Две выборки представлены мальками – р. Кулькуты за 2007 г. (Mag07KulHY) и р. Яма за 2007 г. (Mag07YamHY) (обе из Магаданской обл.).
Таблица 1.
Исследованный материал
| Регион | № на карте | Место сбора, река | Год сбора | Номера выборок из рис. 5 | Название выборки | Количество исследованных образцов, N |
|---|---|---|---|---|---|---|
| Россия, Чукотский АО | 1 | Белая | 2009 | 1 2 |
Chuk09BelaR1 Chuk09BelaR2 |
43 27 |
| 2 | Канчалан | 2009 | 3 | Chuk09KanchalR | 42 | |
| 3 | Анадырь | 2007 | 4 5 6 |
Chuc07AnaR1* Chuc07AnaR2* Chuc07AnaR3* |
50 50 50 |
|
| 2009 | 7 8 9 |
Chuk09AnadrMarR1 Chuk09AnadrMarR2 Chuk09AnadrMarR3 |
29 31 31 |
|||
| 4 | Великая | 2009 | 10 11 12 |
Chuk09VelikR1 Chuk09VelikR2 Chuk09VelikR3 |
29 34 31 |
|
| 5 | Туманская | 2009 | 13 | Chuk09TumanR | 44 | |
| 6 | Хатырка | 2011 | 14 | Chu11HatR | 77 | |
| Россия, Магаданская область | 7 | Ола | 1999 | 15 | Mag99OlaR* | 43 |
| 2002 | 16 | Mag02OlaR | 32 | |||
| 8 | Тауй | 1999 | 17 | Mag99TauR* | 34 | |
| 9 | Яна | 2002 | 18 | Mag02YanR* | 33 | |
| 2007 | 19 20 |
Mag07YanR2* Mag07YanR3* |
17 31 |
|||
| 10 | Кулькуты | 2007 | 21 22 |
Mag07KulHY* Mag07KulR* |
50 50 |
|
| 11 | Яма | 2007 | 23 | Mag07YamHY* | 50 | |
| Россия, Камчатский край | 12 | Хайлюля | 2003 | 24 | Kam03XaiR** | 50 |
| 2007 | 25 | Kam08HaiR** | 47 | |||
| 13 | Кичига | 2008 | 26 | Kam08KichR** | 45 | |
| 14 | Палана | 2008 | 27 | Kam08PalR** | 47 | |
| 15 | Дранка | 2008 | 28 | Kam08DraR** | 46 | |
| 16 | Пенжина | 2008 | 29 30 |
Kam08PenE1** Kam08PenE2** |
46 46 |
|
| 17 | Вывенка | 2008 | 31 | Kam08VyvR** | 47 | |
| 18 | Апука | 2011 | 32 33 34 |
Kam11ApuBEarl Kam11ApuBLate Kam11ApuR |
28 44 16 |
|
| Канада (Британская Колумбия) | 19 | Теслин (Teslin) (приток р. Юкон) | 2001 | – | Alas01TeslR | 46 |
| США, штат Аляска | 20 | Снейк (Snake) | 2001 | – | Alas01SnakeR | 45 |
| 21 | Тубутулик (Tubutulik) |
2009 | – | Alas09TubuR | 39 | |
| 22 | Салмон (Salmon) |
2007 | – | Alas07SalmR | 42 | |
| 23 | Нулато (Nulato) (приток р. Юкон) | 2003 | – | Ala03NulR | 48 | |
| 24 | Ловитла (Lowithla) |
2010 | – | Ala10LowR | 48 | |
| 25 | Беатрап (Beartrap Creek) | 2008 | – | Ala08BeaCB | 48 |
Молекулярно-генетическая методика анализа
Микросателлитный анализ образцов проводился по методике, опубликованной в работе К.И. Афанасьева с соавт. [15].
Характеристика использованных микросателлитных локусов представлена в табл. 2.
Таблица 2.
Характеристики микросателлитных локусов кеты
| Локус | Размер продукта, пн | Число обнаруженных аллелей/ожидаемая гетерозиготность (Не)/число исследованных рыб |
|---|---|---|
| Ssa20.19 | ~74–86 | 6/0.478/844 |
| Ssa197 | ~113–135 | 11/0.463/843 |
| Ogo2 | ~176–202 | 13/0.675/779 |
| Oke3 | ~210–340 | 10/0.715/808 |
| Oke11 | ~91–103 | 7/0.498/828 |
| Oki1 | Oki1-1: ~176–280 Oki1-2: ~90–102 |
Oki1-1 – 25/0.897/757 Oki1-2 – 4/0.435/852 |
| One103 | ~115–243 | 30/0.759/814 |
| One109 | ~111–167 | 13/0.777/808 |
| Ots3 | ~76–124 | 18/0.735/826 |
Примечание. В таблицу вошли данные только по 21 выборке, которые не были опубликованы ранее: выборки под номерами 1–3, 7–14, 32–34 (из табл. 1), а также выборки из Канады и США.
Методы статистического анализа
Расчет частот аллелей, наблюдаемой гетерозиготности (HO), оценки межпопуляционной дифференциации (θp, аналог FST) и, в частности, коэффициентов попарного сходства популяций (coancestry identity), доверительного бутстрэп-интервала для θp, а также проведение статистических тестов на соответствие наблюдаемых по каждому локусу генотипических распределений равновесию Харди–Вайнберга осуществляли с использованием программ GDA [16], в соответствии с руководством Б.С. Вейра [17]. Показатель μ (эффективное число аллелей) рассчитывали по формуле, предложенной Л.А. Животовским [18].
Для вычисления общего уровня значимости по нескольким тестам (для десяти тестов на равновесие Харди–Вайнберга) использовали комбинированный тест Фишера [19]. Для оценки значимости регрессии использовали критерий Фишера (F). Для кластеризации использовали генетические расстояния Рейнолдса [17]. Кластеризацию по методу невзвешенных парногрупповых средних (UPGMA) с проведением бутстрэп-тестирования узлов ветвления (100 реплик) осуществляли в модулях Neighbor и Consense пакета программ PHYLIP v3.67 [20]. Дерево визуализировали в программе TreeGraf [21]. Генетическую сеть строили с использованием расстояний Рейнолдса в программе SplitsTree [22]. В программах Structure2.3.3 [23] и Structure Harvester [24] проводили тест на гетерогенность выборок и выявляли оптимальное количество популяций: burnin – 100 000, количество MCMC после burnin – 1 000 000, значения K от 1 до 6, с пятью повторами для каждой К.
РЕЗУЛЬТАТЫ
Из 22 выборок, проанализированных в данной работе, только в двух выборках наблюдается отклонение от равновесия Харди–Вайнберга. Поправка Бонферрони для 22 тестов составила 0.00227. Общий уровень значимости по десяти локусам для каждой выборки составил: Chuk09BelaR1 – 0.277; Chuk09BelaR2 – 0.0022; Chuk09KanchalR – 0.100; Chuk09AnadrMarR1 – 0.655; Chuk09AnadrMarR2 – 0.434; Chuk09AnadrMarR3 – 0.082; Chuk09VelikR1 – 0.729; Chuk09VelikR2 – 0.138; Chuk09VelikR3 – 0.407; Chuk09TumanR – 0.152; Chu11HatR – 0.027; Mag02OlaR – 0.013; Kam11ApuBEarl – 0.051; Kam11ApuBLate – 0.059; Kam11ApuR – 0.488; Alas01TeslR – 0.906; Alas01SnakeR – 0.00005; Alas09TubuR – 0.005; Alas07SalmR – 0.029; Ala03NulR – 0.526; Ala10LowR – 0.476; Ala08BeaCB – 0.392.
При введении поправки Бонферрони отклонение от равновесия Харди–Вайнберга наблюдается только в выборках Chuk09BelaR2 и Alas01SnakeR.
Генетическое разнообразие
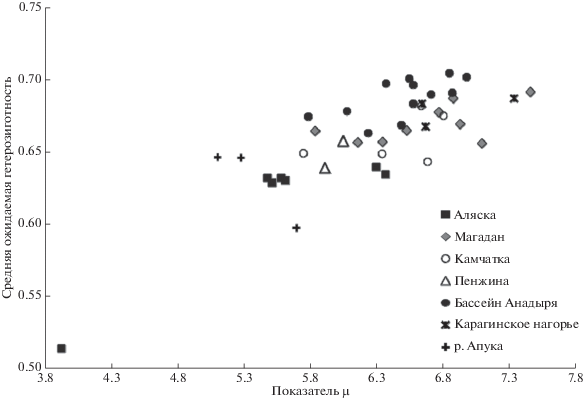
На рис. 2 показано генетическое разнообразие по двум параметрам: средняя ожидаемая гетерозиготность и показатель μ.
По количеству эффективного числа аллелей (показатель μ) все выборки из бассейна р. Анадырь расположены в промежутке от 5.7 до 7.5 аллелей, в этот промежуток также входят все выборки из р. Пенжина, северной части Камчатского края и Магаданской обл. (за исключением двух выборок из р. Апука – Kam11ApuBEarl и Kam11ApuR). Все три выборки из группы “Корякское нагорье” обладают показателем μ выше 6.5 аллелей. Выборки восточного побережья Тихого океана (из США и Канады) обладают показателем μ ниже 6.5 аллелей. Наименьшее разнообразие по обоим показателям отмечено у кеты из реки Теслин (Канада). Также, сниженное значение показателя μ отмечено и у выборок из р. Апука. Наибольшее значение показателя μ отмечено у кеты рек Хатырка (из группы “Корякское нагорье”) и Кулькуты (Магаданская обл.).
Наибольшим показателем средней ожидаемой гетерозиготности отличаются выборки из рек Анадырского бассейна, “Карагинского нагорья” и магаданские выборки, все они входят в интервал от 65 до 71% (некоторые выборки из Анадырского бассейна превышают 70%-е значение гетерозиготности). Все выборки с восточного побережья Тихого океана (США и Канада) и кета из р. Апука имеют значение гетерозиготности ниже 65%. Выборки из рек Пенжина и северной части Камчатки укладываются в промежуток от 64 до 69% (не превышая 70%-е значение), ряд выборок имеют значение гетерозиготности ниже 65%.
Региональная дифференциация
Межрегиональные оценки дифференциации приведены в табл. 3. В целом между восточным и западным побережьем Тихого океана межрегиональная дифференциация равна 3.1% [1.2%, 5.7%]22. Наибольшую межгрупповую дифференциацию показывает группа выборок “Аляска”, она отличается от всех регионов (табл. 1). В основном попарные значения коэффициента дифференциации на восточном побережье около 2–4%, в то время как для северной части западной Пацифики попарные сравнения обычно не превышают 2%.
Таблица 3.
Внутри- и межрегиональные оценки дифференциации (θр, %)
| Северная часть Камчатки | Река Пенжина | Магаданская область | Бассейн р. Анадырь | Корякское нагорье | Река Апука | Аляска (без ручья Беатроп) |
|
|---|---|---|---|---|---|---|---|
| Северная часть Камчатки | 0.9 [0.4, 1.3] |
||||||
| p. Пенжина | 1.6 [0.7, 2.5] |
–0.2 [–0.6, 0.3] |
|||||
| Магаданская область | 1.1 [0.3, 2.2] |
1.7 [0.9, 2.7] |
0.6 [0.4, 0.9] |
||||
| Бассейн р. Анадырь | 1.3 [0.7, 2.0] |
1.4 [0.8, 2.0] |
1.1 [0.5, 1.7] |
0.1 [–0.2, 0.4] |
|||
| Корякское нагорье | 0.4 [–0.01, 1.0] |
1.1 [0.5, 1.7] |
0.4 [0.2, 0.6] |
0.5 [0.2, 0.7] |
–0.2 [–0.3, 0.01] |
||
| p. Апука | 1 [–0.1, 2.5] |
1.7 [0.7, 2.8] |
0.5 [–0.1, 1.2] |
1.2 [0.8, 1.5] |
0.4 [0.1, 1.1] |
–0.8 [–3.3, 1.3] |
|
| Аляска (без ручья Беатроп) |
3.6 [1.0, 7.2] |
4.2 [0.6, 9.0] |
3.8 [1.5, 7.2] |
2.6 [1.2, 4.5] |
2.8 [0.7, 5.8] |
4.3 [1.3, 8.5] |
3.8 [1.6, 6.4] |
В северной части западной Пацифики однозначно выделяются такие крупные регионы как “Магаданская область”, “северная часть Камчатки”, р. Пенжина и “бассейн р. Анадырь” (табл. 3, рис. 3, 5). Общая оценка дифферециации 34 выборок северной кеты западной Пацифики составила 1.2% [0.8, 1.5]. Оценки дифференциации между выделенными группами колеблются от 1.1 до 1.7% (табл. 3), не превышая 2%.
Рис. 3.
UPGMA – дерево с бутстрэп-поддержкой узлов ветвления. Показаны только значения превышающие 50%.
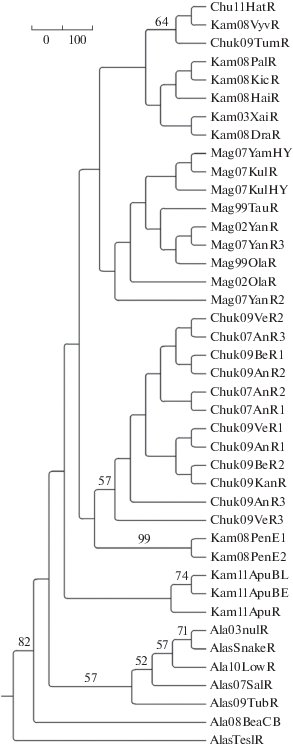
Все выборки кеты из рек Анадырь, Великая, Белая, Канчалан входят в одну речную систему. Дифференциация между данными выборками незначима, и выборки группируются в один кластер, который мы назвали “бассейн реки Анадырь” (табл. 3). Различия отсутствуют между выборками, взятыми в разное время в течение одного года, а также между выборками, собранными в разные годы. Оценки дифференциации между группой “бассейн реки Анадырь” и другими группами северной части западной Пацифики варьируют от 0.5 до 1.4% (табл. 3). Кета р. Пенжина является обособленной группировкой. Наибольшую генетическую близость она показывает с кетой чукотских стад (группы “бассейн реки Анадырь” и “Корякское нагорье” (рис. 3, 4, табл. 3).
Рис. 4.
а – генетическая сеть выборок, построенная по генетическим расстояниям Рейнолдса, б – центральная часть сети в увеличенном виде.
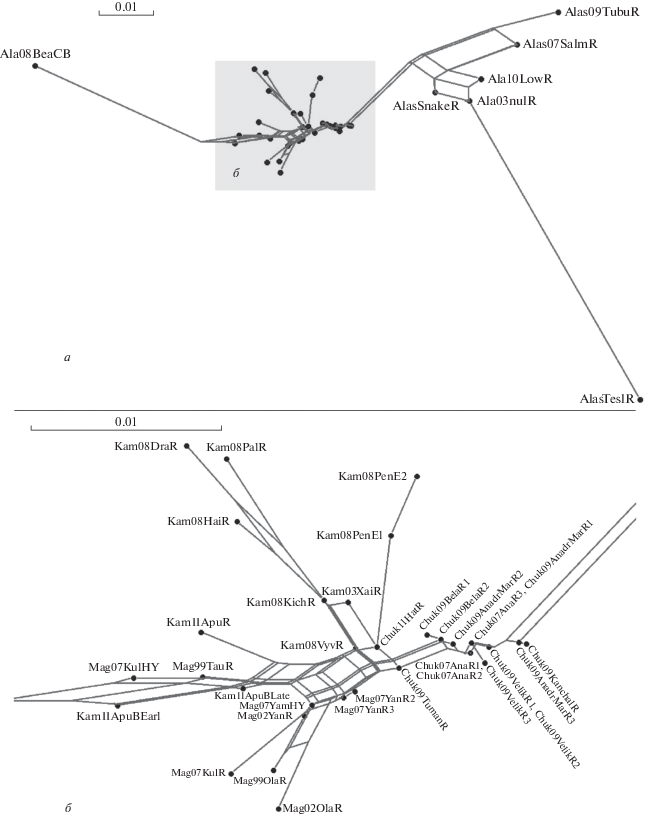
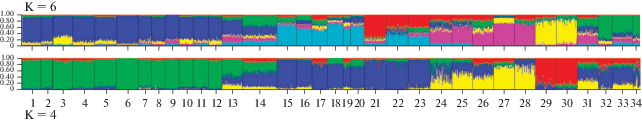
Рис. 5.
Результаты программы Structure, K = 4 и К = 6, номера выборок соответствуют данным в табл. 1.
ОБСУЖДЕНИЕ
Генетическое разнообразие
При анализе всех данных по географическому распределению показателей разнообразия выявили тенденцию к более высоким показателям генетического разнообразия у кеты из более северных точек сбора на азиатской территории. Учитывая этот факт рассчитали корреляцию между показателями разнообразия и широтно-долготными координатами. В расчетах были использованы 34 выборки азиатского побережья. Значимой оказалась прямая связь между средней ожидаемой гетерозиготностью и географической широтой (коэффициент аппроксимации R2 = 0.23 (F = 10.16, значимо при α = 0.01)); между значениями средней ожидаемой гетерозиготности и долготой, R2 = 0.05 (коэффициент не значим). Не выявили связь между значениями показателя μ и широтно-долготными координатами. Таким образом в выборках кеты из более северных точек сбора значения гетерозиготности зачастую выше, чем из более южных точек сбора.
На данном этапе исследований сложно как-либо объяснить обнаруженную связь, возможно, что данная связь неустойчива или актуальна только на данной части ареала, а в других частях ареала не будет обнаружена. Данный вопрос остается открытым.
Генетическая дифференциация
Общая оценка дифференциации кеты северной части Западной Пацифики составила 1.2%, что соответствует данным, полученным ранее. В работах К.И. Афанасьева с соавт. [15] и Л.А. Животовского с соавт. [14] было показано, что оценки дифференциации популяций кеты в северной части ареала гораздо ниже, чем в южной части (около 2 и 8% соответственно).
В настоящей работе при анализе 41 выборки кеты была изучена подробная региональная дифференциация северной части ареала. Были выделены шесть крупных группировок, таких как (1) “Аляска” (включает выборки из США и Канады, кроме кеты из ручья Беатрип), (2) “Магаданская область” (включает все выборки из Магаданской обл.), (3) “северная часть Камчатки” (все выборки из рек Хайлюля, Дранка, Кичига и Палана), (4) р. Пенжина, (5) “бассейн р. Анадырь” (включает все выборки из рек Анадырь, Великая, Канчалан и Белая) и три выборки под общим названием (6) “Корякское нагорье” (выборки из рек Туманская, Хатырка и Вывенка). Обособленное положение занимает кета р. Апука (Россия) и ручья Беатроп (США).
В северной части Восточной Пацифики дифференциация выборок достаточно хорошо выражена и оценки дифференциации немного больше, чем для территории на такой же широте в Западной Пацифике.
Ввиду особенностей кладистского подхода, на древовидной кладограмме (рис. 3) не всегда возможно наблюдать особенности сходства и различия групп выборок, генетическая сеть для таких сравнений подходит больше. Поэтому в данной работе мы визуализировали генетические расстояния как с помощью древовидной кладограммы, так и с помощью генетической сети (рис. 4).
При сравнении группы выборок “Аляска” с кетой северной части Западной Пацифики минимальные различия наблюдаются с группами выборок “басейн р. Анадырь” и “Корякское нагорье” (рис. 4 и табл. 3). Такое обстоятельство кажется нам вполне закономерным, если учитывать существование в прошлом берингийского моста и единой речной системы Юкон–Анадырь [25–27].
В северной части Западной Пацифики однозначно выделяются такие крупные регионы как “Магаданская область”, “северная часть Камчатки”, р. Пенжина и “бассейн р. Анадырь”. Похожие результаты были показаны также в работах Л.А. Животовского с соавт. и К.И. Афанасьева с соавт. [14, 15].
Отсутствие дифференциации между кетой из разных притоков р. Анадырь было отмечено в работах предшествующих исследователей на основе анализа аллозимных локусов [5, 10]. С другой стороны, в вышеперечисленных работах была отмечена межгодовая дифференциация единичных выборок из р. Анадырь. В настоящем исследовании, основываясь на анализе микросателлитных локусов, данный эффект обнаружен не был, между выборками, собранными в разные годы из одной реки, отсутствовали достоверные различия.
Генетическое сходство кеты “Анадырского бассейна” и кеты “р. Пенжина” уже было отмечено ранее в работе Н.В. Варнавской [5]. К тому же в работе Д.В. Политова с соавт. [27] высказывается гипотеза о проникновении ряпушки в бассейн Пенжины из бассейна Анадыря с формированием эндемичной формы – “пенжинского омуля”. И.А. Черешневым отмечалось сходство ихтиофаун этих бассейнов [28]. По-видимому такое сходство можно объяснить фактом существования в позднем плейстоцене сети сообщающихся озер между бассейнами рек Пенжина и Анадырь (около 20 000 лет назад [29]). Таким образом, в относительно недавнем прошлом, бассейны этих рек не были изолированы друг от друга, а учитывая современное состояние территории этих бассейнов и феномен меандрирующих русел северных рек, не исключены обмены мигрантами и по сей день между бассейнами рек Пенжина и Анадырь.
В целом одной из причин более низкого уровня дифференциации кеты в северной части ареала (наряду с более поздним заселением данной территории) может являться также и возможность периодического обмена мальками и нерестующими производителями между соседними притоками разных рек в периоды большой воды, а также за счет эффекта меандрирующих русел северных рек.
Особый интерес вызывают группы выборок “Корякское нагорье” и р. Апука. В группу “Корякское нагорье” входят выборки из рек Туманская, Хатырка и Вывенка. При попарной оценке дифференциации между выборками эти выборки не отличаются от выборок из бассейна р. Анадырь и некоторых северокамчатских выборок, а также от выборок р. Апука, но при использовании других методов анализа, например, при расчетах межрегиональной дифференциации (когда данные выборки группируются в соответствии с выделенными кластерами на дендрограмме), различия уже достоверны (табл. 3) (оценка дифференциации с северокамчатской группой выборок находится на грани значимости). Так например при построении генетического дерева с бутстрэп-поддержкой узлов ветвления (рис. 3), клада “Корякское нагорье” поддерживается в 64% деревьев, а на генетической сети обсуждаемые выборки расположены в центральной ее части (рис. 4). Анализ в программе Structure Harvester статистически не поддерживает существование этой группы. Мы специально поместили в работу результат анализа с использованием К = 6, тогда как Structure Harvester поддерживает только К = 4. На рис. 5 очень хорошо видно, что при увеличении числа K выборкам из группы “Корякское нагорье” (выборки под номерами 13, 14, 31) не присваивается один основной “цвет” (как это происходит с Магаданскими, Камчатскими, Пенжинскими и Анадырскими выборками), а для каждой особи сохраняется одинаковая вероятность принадлежности к любой из поддерживаемых группировок. Это свидетельствует о том, что выборки “Корякское нагорье” нельзя отнести ни к одной из четырех перечисленных групп, что в свою очередь свидетельствует в пользу слабой обособленности (на грани статистической значимости) этой группы выборок.
Такая же неоднозначная ситуация сложилась с кетой из р. Апука. Данная группа выборок показывает слабую, не всегда статистически поддерживаемую обособленность, по-видимому эти отличия очень небольшие и для статистически достоверных результатов необходимо увеличить объем выборки. Например, в анализе Structure Harvester при увеличении числа К кете из р. Апука присваивается “свой цвет”; при анализе кладистского дерева выборок (рис. 3) и генетической сети (рис. 4) наблюдается тенденция к обособленному положению кеты р. Апука; при анализе межрегиональных различий (табл. 3) данная группа выборок показывает достоверные отличия от групп “бассейн р. Анадырь”, р. Пенжина и “Корякское нагорье”, но не наблюдаются отличия от групп “Магаданская область” и “северная часть Камчатки”.
С учетом всех полученных фактов говорить о полном генетическом сходстве кеты р. Апука и группы выборок “Корякское нагорье” с какими-либо другими популяциями неправомерно. Данные стада могут находится на стадии формирования генетической обособленности, с такой же долей вероятности может происходить и обратный процесс – утери генетической обособленности. Для понимания реальной картины происходящего требуется более длительный мониторинг генетических характеристик обсуждаемых стад.
Особенность дифференциации кеты “Магаданской области” и “северная часть Камчатки” подробно была освещена в других работах [14, 15], в данном исследовании выборки из этих регионов были взяты исключительно для сравнительного анализа.
В заключении хотелось бы резюмировать результаты данного исследования:
1. В северной части ареала азиатской кеты однозначно выделяются такие группы выборок как “Магаданская область”, “северная часть Камчатки”, р. Пенжина", “бассейн р. Анадырь”.
2. Наблюдается положительная связь между географической широтой и средней ожидаемой гетерозиготностью на данной части ареала, то есть в выборках кеты из более северных точек сбора значения гетерозиготности зачастую выше, чем из более южных точек сбора (в пределах данной территории).
3. В северной части Восточной Пацифики (выборки Канады и США) общий уровень межпопуляционной дифференциации кеты немного выше, чем в северной части Западной Пацифики.
4. Кета северной части Восточной Пацифики показывает наименьшие различия с чукотскими стадами (группы выборок “бассейн р. Анадырь” и “Корякское нагорье”) среди всех выделенных групп, что вполне объяснимо, учитывая существование в прошлом единой речной системы Юкон–Анадырь.
5. Кета р. “Пенжина” показывает наименьшие различия с кетой из “бассейна р. Анадырь”. Данный факт по-видимому можно объяснить существованием связанной системы озер между этими бассейнами в позднем плейстоцене.
6. Популяции кеты из р. Апука и группы “Корякское нагорье” показывают слабую генетическую дифференциацию от остальных групп; априори, данные популяции могут находиться либо на стадии формирования генетической обособленности, либо напротив в процессе утери обособленности или же стагнации генетических характеристик.
Работа выполнена в рамках гостемы ГЗ 0112-2019-0002 (подтема “Эколого-генетическая структура вида”). Использование ДНК-маркеров для дифференциации популяций поддержано грантом РНФ 19-16-00101, выделение популяционных группировок, в том числе статистическими методами, поддержано грантом РФФИ 18-016-00033.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Коротаев Ю.А. Влияние гидрологических условий на воспроизводство анадырской кеты // Тез. докл. I конгресса ихтиологов России. 1997. С. 43.
Макоедов А.Н., Коротаев Ю.А., Антонов Н.П. Азиатская кета. Петропавловск-Камчатский: Издательство ФГУП Камчатский институт рыбного хозяйства и океанографии (КамчатНИРО), 2009. 355 с.
Путивкин С.В. Биология и динамика численности анадырской кеты: Афтореф. дис. … канд. биол. наук. Магадан: ТИНРО-Центр, 1999. 24 с.
Костарев В.Л. Влияние некоторых климатических факторов на эффективность естественного воспроизводства охотской кеты // Изв. ТИНРО. 1970. Т. 71. С. 109–121.
Варнавская Н.В. Генетическая дифференциация популяций тихоокеанских лососей. Петропавловск-Камчатский: Изд-во КамчатНИРО, 2006. 488 с.
Воронский Б.Б. Материалы по биологии и промысловому использованию чавычи (Oncorhynchus tschawytscha W.) Камчатки // Научный отчет КамчатНИРО. Петропавловск-Камчатский: Изд-во КамчатНИРО, 1970. 164 с.
Пустовойт С.П. Анализ структуры генетического разнообразия популяций кеты Oncorhynchus keta (Walbaum) рек Анадырь, Камчатка и Амур // Генетика. 1998. Т. 34. № 2. С. 278–284.
Викторовский Р.М., Бачевская Л.Т., Ермоленко Л.Н. и др. Генетическая структура популяций кеты Северо-востока СССР и проблемы рационального использования ее запасов // Резервы лососевого хозяйства Дальнего Востока. Сб. науч. тр. Владивосток. 1989. С. 66–74.
Салменкова Е.А., Алтухов Ю.П., Викторовский Р.М. и др. Генетическая структура популяций кеты, размножающихся в реках Дальнего Востока и северо-востока СССР // Журн. общей биол. 1986. Т. XLVII. № 4. С. 529–549.
Салменкова Е.А. Основные результаты и задачи популяционно-генетических исследований лососевых рыб // Генетика в аквакультуре. М.: Наука, 1989. С. 7–29.
Салменкова Е.А., Омельченко В.Т., Афанасьев К.И., Рубцова Г.А. Генетическое разнообразие азиатской кеты Oncorhynchus keta (Salmonidae, Salmoniformes) и динамика генофондов сахалинских популяций при искусственном воспроизводстве // Вопр. ихтиол. 2008. Т. 48. № 3. С. 361–373.
Sato S., Ando J., Ando H. et al. Genetic variation among Japanese populations of chum salmon inferred from nucleotide sequences of the mitochondrial DNA control region // Zool. Sci. 2001. 18. P. 99–106. https://doi.org/10.2108/zsj.18.99
Abe S., Sato S., Kojima H. et al. Development of molecular markers for genetic stock identification of chum salmon // Fisheries Sci. 2002. V. 68 (Suppl. 1). P. 353–356. https://doi.org/10.2331/fishsci.68.sup1_353
Животовский Л.А., Рубцова Г.И., Шитова М.В. и др. База микросателлитных ДНК-данных по кете Дальнего Востока России // Реализация “Концепции дальневосточной бассейновой программы изучения тихоокеанских лососей”. Владивосток: Изд-во ТИНРО-центр, 2010. Бюл. № 5. С. 53–63.
Афанасьев К.И., Рубцова Г.А., Шитова М.В. и др. Популяционная структура кеты Oncorhynchus keta российского Дальнего Востока, выявленная по микросателлитным маркерам // Биол. моря. 2011. Т. 37. № 1. С. 39–47.
Lewis P.O., Zaykin D. Genetic Data Analysis: Computer program for the analysis of allelic data. Version 1.0 (d16c). 2001. Free program distributed by the authors over the internet from http://lewis.eeb.uconn.edu/lewishome/software.html.
Вейр Б. Анализ генетических данных. М.: Мир, 1995. 400 с.
Животовский Л.А. Статистические методы анализа частот генов в природных популяциях // Итоги науки и техники. Общая генетика. М.: ВИНИТИ, 1983. Т. 8. С. 76–104.
Животовский Л.А. Популяционная биометрия. М.: Наука, 1991. 267 с.
Felsenstein J. PHYLIP Phylogeny Inference Package (Version 3.2) // Cladistics. 1989. V. 5. P. 164–166.
Stöver B.C., Müller K.F. TreeGraph 2: Combining and visualizing evidence from different phylogenetic analyses BMC // Bioinformatics. 2010. V. 11. P. 7. https://doi.org/10.1186/1471-2105-11-7
Huson D.H., Bryant D. Application of Phylogenetic Networks in Evolutionary Studies // Mol. Biol. Evol. 2006. V. 23. № 2. P. 254–267. https://doi.org/10.1093/molbev/msj030
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. P. 945–959.
Earl D.A., vonHoldt B.M. STRUCTURE HARVESTER: A website and program for visualizing STRUCTURE output and implementing the Evanno method // Conservation Genetics Resources. 2012. V. 4. № 2. P. 359–361. https://doi.org/10.1007/s12686-011-9548-7
Линдберг Г.У. Крупные колебания океана в четвертичное время и их влияние на бассейн Северного Ледовитого океана и его органический мир // Северный Ледовитый океан. Ленинград: Гидрометеоиздат, 1970. С. 101–112.
Линдберг Г.У. История “Берингии” в свете гипотезы крупных геогидрократических колебаний уровня океана // Берингийская суша и ее значение для развития голарктических флор и фаун в кайнозое. Хабаровск: [Б.И.], 1973. С. 43–45.
Politov D.V., Borovikova E.A., Gordon N.Y. Penzhina river cisco Coregonus subautumnalis Kaganovsky does not belong to the Arctic cisco species complex: First genetic evidence based on allozyme data // Advances in Limnology. 2007. V. 60. P. 69–81.
Черешнев И.А. Биологическое разнообразие пресноводной ихтиофауны Северо-Востока России. Владивосток: Дальнаука, 1996. 196 с.
Баранова Ю.П., Бискэ С.Ф., Гончаров В.Ф. и др. Кайнозой Северо-востока СССР. М.: Наука, 1968. 137 с.
Дополнительные материалы отсутствуют.