Генетика, 2020, T. 56, № 7, стр. 834-841
Полиморфные варианты гена бета-цепи цитохрома b-245 НАДФН-оксидазы: связь с показателями редокс-гомеостаза и риском развития сахарного диабета 2-го типа
Ю. Э. Азарова 1, *, Е. Ю. Клёсова 1, И. И. Коломоец 1, В. А. Азарова 2, В. Е. Ивакин 1, 2, А. И. Конопля 1, А. В. Полоников 1
1 Курский государственный медицинский университет
305041 Курск, Россия
2 Курская городская клиническая больница скорой медицинской помощи
305016 Курск, Россия
* E-mail: azzzzar@yandex.ru
Поступила в редакцию 25.07.2019
После доработки 26.09.2019
Принята к публикации 03.10.2019
Аннотация
Изучена ассоциация SNPs rs5917471, rs5963327 и rs6610650 гена, кодирующего бета-цепь цитохрома b-245 (CYBB) НАДН-оксидазы, с показателями редокс-гомеостаза плазмы крови и риском развития сахарного диабета 2-го типа (СД2). В исследование было включено 2086 неродственных индивидов славянского происхождения (1022 пациента с СД2 и 1064 здоровых добровольца). Генотипирование SNPs выполнено на геномном масс-спектрометре MassArray Analyzer 4. В связи с локализацией гена CYBB на Х-хромосоме анализ влияния его однонуклеотидных вариантов на предрасположенность к СД2 и показатели редокс-статуса плазмы крови проводили раздельно у мужчин и женщин методом линейного регрессионного анализа, с поправкой на возраст и индекс массы тела. У мужчин установлена ассоциация аллеля Т rs5963327 (OR 1.7, 95% CI 1.06–2.75, P = 0.028) и аллеля А rs6610650 (OR 1.71, 95% CI 1.05–2.78, P = 0.029) с повышенным риском развития СД2. Генотип Т/Т rs5963327 (OR 1.35, 95% CI 1.05–1.73, P = 0.017) и генотип A/A rs6610650 (OR 1.34, 95% CI 1.05–1.72, P = 0.020) были также ассоциированы с риском развития СД2 у женщин. Гаплотип Т-Т-А, включающий минорные аллели изучаемых вариантов rs5917471–rs5963327–rs6610650, ассоциировался с повышенным риском развития СД2 как у мужчин (OR 1.29, 95% CI 1.04–1.58, P = 0.022), так и у женщин (OR 1.27, 95% CI 1.02–1.58, P = 0.034). Больные СД2 имели значимо более высокое содержание перекиси водорода в плазме крови по сравнению с контрольной группой (Р < 0.05) вне зависимости от пола, однако взаимосвязь rs5963327 и rs6610650 с повышенным содержанием окисленного глутатиона GSSG была обнаружена только у женщин. Таким образом, нами впервые выявлены ассоциации rs5963327 и rs6610650 гена CYBB c развитием СД2 и редокс-статусом больных. Исследованные полиморфные варианты гена бета-цепи цитохрома b-245 НАДН-оксидазы могут способствовать смещению баланса в системе редокс-гомеостаза в сторону прооксидантного статуса – характерной черты СД2.
Сахарный диабет 2-го типа (СД2) представляет собой тяжелое хроническое заболевание, связанное с развитием гипергликемии вследствие нарушения секреции и/или действия инсулина [1]. За последние 10 лет число больных диабетом в мире увеличилось в 2 раза: с 200 млн в 2005 г. до 425 млн в 2017 г. [2]. Согласно Российскому диабетическому регистру, в нашей стране число больных СД2 превышает 4.24 млн человек и продолжает расти [3, 4].
Генетическая основа СД2 не вызывает сомнений и была подтверждена множеством крупных полногеномных и клинических исследований [5–9]. Важной составляющей патогенеза заболевания служит окислительный стресс, развивающийся в результате избыточного образования активных форм кислорода (АФК) и снижения антиоксидантной защиты. В отечественных и зарубежных работах последних лет показано, что гены оксидантных и антиоксидантных ферментов, обеспечивающих контроль клеточного редокс-гомеостаза, являются важными детерминантами развития СД2 и его осложнений [10–13]. Цитохром b-245, каталитическая субъединица НАДФН-оксидазы, непосредственно вовлечен в регуляцию продукции ${\text{О}}_{{\text{2}}}^{ - }$ в клетке и кодируется геном CYBB [14, 15]. В литературе описано участие CYBB в патогенезе сахарного диабета 1-го типа [16, 17], тогда как в отношении СД2 роль этого цитохрома в основном рассматривалась с позиций влияния уровня экспрессии гена на прогрессирование заболевания и эффективность лечения [18–20]. В этой связи целью настоящего исследования стало изучение ассоциаций однонуклеотидных вариантов rs5917471, rs5963327 и rs6610650 гена CYBB, кодирующего бета-цепь цитохрома b-245 НАДН-оксидазы, с показателями редокс-гомеостаза плазмы крови и риском развития сахарного диабета 2-го типа.
МАТЕРИАЛЫ И МЕТОДЫ
Протокол исследования одобрен Региональным этическим комитетом при Курском государственном медицинском университете. В исследование было включено 2086 неродственных индивидов славянского происхождения, в том числе 1022 пациента с подтвержденным диагнозом СД2 (358 мужчин и 664 женщины, средний возраст 61.6 ± 5.3 года) и 1064 относительно здоровых добровольца (392 мужчин и 672 женщины, средний возраст 60.9 ± 5.7 года). Группы больных СД2 и контроля были сопоставимы по полу (Р = 0.12) и возрасту (Р = 0.17). В исследование приглашали больных СД2, получавших стационарное лечение на базе эндокринологического отделения Курской городской клинической больницы скорой медицинской помощи в период с ноября 2015 г. по декабрь 2018 г. Критериями включения в группу больных служили: наличие верифицированного врачом диагноза болезни, подтвержденного клинически и лабораторно-инструментально, возраст старше 35 лет, наличие письменного информированного согласия на участие в исследовании. Критерии исключения больных из основной выборки: выраженная степень декомпенсации СД2 или кома, наличие иммуноопосредованного или идиопатического СД 1-го типа, наличие гестационного СД, наличие специфических типов СД, таких как MODY, заболевания экзокринной части поджелудочной железы – панкреатит, травма или панкреатэктомия, опухоли поджелудочной железы, муковисцидоз, гемохроматоз, фиброкалькулезная панкреатопатия, эндокринопатии (акромегалия, синдром Кушинга, глюкагонома, феохромоцитома, гипертиреоз, соматостатинома, альдостерома), генетические синдромы, сочетающиеся с СД (синдром Дауна, атаксия Фридрейха, хорея Гентингтона, синдром Клайнфельтера, синдром Лоренса–Муна–Бидля, миотоническая дистрофия, порфирия, синдром Прадера–Вилли, синдром Тернера), а также возраст младше 35 лет и отсутствие письменного информированного согласия на участие в проекте.
В группу здоровых индивидов приглашали доноров областной станции переливания крови, а также использовали материал наших предыдущих исследований [21]. Критериями включения лиц в группу контроля служили: возраст старше 35 лет, нормальные значения гликемии согласно ВОЗ, 1999–2013, отсутствие тяжелых хронических заболеваний, наличие письменного информированного согласия. Критерии исключения из группы контроля: возраст младше 35 лет, гипер-гликемии в анамнезе, наличие тяжелых хронических заболеваний, отсутствие письменного информированного согласия.
Для проведения генетических исследований у всех больных и здоровых проводили забор 5 мл венозной крови натощак в вакуумные пробирки Vacuette с ЭДТА. Геномную ДНК выделяли колоночным методом с помощью набора QIAamp DNA Blood Mini Kit (Qiagen) на автоматической станции для экстракции белков и нуклеиновых кислот QiaCube (Qiagen). Качество выделенной ДНК оценивали по степени чистоты и концентрации раствора на спектрофотометре NanoDrop (Thermo Fisher Scientific, США).
Для молекулярно-генетического анализа были отобраны три однонуклеотидных полиморфизма интронов гена CYBB с выраженным регуляторным потенциалом и частотой минорного аллеля не менее 5%, а именно rs5917471 (C>T), rs5963327 (G>T) и rs6610650 (G>A). Генотипирование вариантов гена CYBB проводили с использованием технологии iPLEX на геномном времяпролетном масс-спектрометре MassARRAY Analyzer 4 (Agena Bioscience). Дизайн мультиплекса SNPs и подбор праймеров для ПЦР и iPLEX реакций осуществляли с помощью онлайн программы MassARRAY Assay Design Suite (https://agenacx.com). Праймеры были синтезированы компанией Evrogen (Москва).
Для измерения содержания перекиси водорода и глутатиона проводили забор 5 мл венозной крови в вакуумные пробирки с гепарином лития, центрифугировали их 15 мин при 3500 об./мин и t = 4°C, полученную плазму для детекции Н2О2 аликвотировали и замораживали при –80°С. Образцы, предназначенные для измерения уровня GSH и GSSG, предварительно подвергали депротеинизации раствором трихлоруксусной кислоты, центрифугировали 5 мин при 12 000 об./мин, надосадочную жидкость аликвотировали и замораживали при –80°С. Концентрации Н2О2 и GSH/GSSG определяли флуориметрическим методом с помощью наборов OxiSelect ROS/RNS Assay kit (Cell Biolabs) и GSH/GSSG Assay kit (Abcam), соответственно, на микропланшетном ридере Varioscan Flash (Thermo Fisher Scientific).
Размер выборки рассчитывали с помощью онлайн калькулятора Genetic Association Study Power Calculator (http://csg.sph.umich.edu/abecasis/gas_power_calculator/) с учетом частоты минорных аллелей изучаемых SNPs и заболеваемости СД2 в Курской области. Для достижения статистической силы исследования 85% при пороговом уровне значимости ассоциаций Р = 0.05 минимальный размер выборки больных и здоровых должен составлять не менее 1000 человек. Статистическую обработку полученных данных проводили методом логистической регрессии с поправками на возраст и индекс массы тела, с помощью онлайн программы SNPStats (https://www.snpstats.net/). Тестировали пять генетических моделей: кодоминантную, доминантную, рецессивную, сверхдоминантную и log-аддитивную. Ассоциация считалась значимой при Р < 0.05. Для анализа соответствия распределения частот генотипов равновесию Харди–Вайнберга и сравнения частот аллелей и генотипов между группами применяли точный тест Фишера. Для проверки нормальности распределения количественных биохимических показателей использовали критерий Колмогорова–Смирнова. Переменные, имеющие нормальное распределение, были описаны с использованием среднего значения (Mean) и стандартного отклонения (St.Dv.) в виде Mean ± St.Dv. В качестве теста статистической значимости использовали тест Стьюдента. Показатели с ненормальным распределением описывали с использованием медианы (Мedian), первого (Q1) и третьего (Q3) квартилей, в виде: Мedian [Q1; Q3]. В качестве теста статистической значимости в таких случаях применяли критерий Манна–Уитни. Обнаруженные отличия групп принимались за статистически значимые при P < 0.05.
РЕЗУЛЬТАТЫ
Все исследованные SNPs находились в соответствии с равновесием Харди–Вайнберга (Р > 0.05). Частоты аллелей изучаемых вариантов гена CYBB были сопоставимы с европейскими популяциями согласно данным проекта “1000 Genomes”, депонированных в Ensembl (https://www.ensembl.org/). В связи с локализацией гена CYBB на Х-хромосоме анализ влияния его однонуклеотидных вариантов на предрасположенность к СД2 и показатели редокс-статуса плазмы крови проводили раздельно у мужчин и женщин. Результаты стратифицированного по полу анализа частот аллелей и генотипов изучаемых вариантов гена CYBB представлены в табл. 1.
Таблица 1.
Частоты аллелей и генотипов изучаемых вариантов CYBB у больных СД2 и здоровых лиц
| SNP | Аллель, генотип | Контроль, n (%) | Больные СД2, n (%) | OR (95% CI)* | P* |
|---|---|---|---|---|---|
| Мужчины | |||||
| rs5917471 | C | 202 (57.1) | 192 (54.5) | 1.00 | 0.51 |
| T | 152 (42.9) | 160 (45.5) | 1.12 (0.80–1.55) | ||
| rs5963327 | G | 338 (89.2) | 291 (82.7) | 1.00 | 0.028 |
| T | 41 (10.8) | 61 (17.3) | 1.70 (1.06–2.75) | ||
| rs6610650 | G | 337 (89.4) | 288 (82.8) | 1.00 | 0.029 |
| A | 40 (10.6) | 60 (17.2) | 1.71 (1.05–2.78) | ||
| Женщины | |||||
| rs5917471 | C/C | 207 (31.7) | 188 (28.2) | 1.00 | 0.13D |
| C/T | 297 (45.5) | 308 (46.2) | 1.20 (0.94–1.53)D | ||
| T/T | 149 (22.8) | 170 (25.5) | |||
| T | 45.6% | 48.6% | 1.13 (0.97–1.32) | 0.11 | |
| rs5963327 | 495 (75.5) | 467 (70) | 1.00 | 0.017D | |
| G/G | |||||
| 1.35 (1.05–1.73)D | |||||
| G/T | 144 (21.9) | 181 (27.1) | |||
| T/T | 17 (2.6) | 19 (2.8) | |||
| T | 13.6% | 16.4% | 1.25 (1.01–1.55) | 0.04 | |
| rs6610650 | G/G | 484 (75.4) | 467 (70) | 1.00 | 0.02D |
| G/A | 142 (22.1) | 181 (27.1) | 1.34 (1.05–1.72)D | ||
| A/A | 16 (2.5) | 19 (2.8) | |||
| A | 13.6% | 16.4% | 1.25 (1.01–1.55) | 0.04 | |
У мужчин установлена ассоциация аллеля Т rs5963327 (OR 1.7, 95% CI 1.06–2.75, P = 0.028) и аллеля А rs6610650 (OR 1.71, 95% CI 1.05–2.78, P = = 0.029) с повышенным риском развития СД2. Генотипы G/T–Т/Т rs5963327 (OR 1.35, 95% CI 1.05–1.73, P = 0.017) и генотипы G/A–A/A rs6610650 (OR 1.34, 95% CI 1.05–1.72, P = 0.020) были также ассоциированы с риском развития СД2 у женщин (доминантная модель). Статистически значимых различий в частотах генотипов rs5917471 между группами больных СД2 и здоровых не установлено (Р > 0.05).
Анализ гаметического неравновесия по сцеплению показал, что rs5917471, rs5963327 и rs6610650 сцеплены между собой (D' = 0.999, Р < 0.0001). Результаты анализа частот гаплотипов у больных и здоровых представлены в табл. 2. Гаплотип Т-Т-А, включающий минорные аллели изучаемых вариантов rs5917471–rs5963327–rs6610650, ассоциировался с повышенным риском развития СД2 как у мужчин (OR 1.29, 95% CI 1.04–1.58, P = 0.022), так и у женщин (OR 1.27, 95% CI 1.02–1.58, P = 0.034) независимо от возраста и индекса массы тела (ИМТ) пациентов.
Таблица 2.
Стратифицированный по полу анализ частот гаплотипов у больных СД2 и здоровых лиц
| Гаплотипы* CYBB |
Контроль | Больные СД2 | OR (95% CI)** | P** | ||
|---|---|---|---|---|---|---|
| rs5917471 | rs5963327 | rs6610650 | ||||
| Мужчины | ||||||
| C | G | G | 0.5769 | 0.5445 | 1.00 | – |
| T | G | G | 0.3125 | 0.2778 | 0.97 (0.82–1.15) | 0.73 |
| T | T | A | 0.1106 | 0.1748 | 1.29 (1.04–1.61) | 0.022 |
| Общий Р: 0.057 | ||||||
| Женщины | ||||||
| C | G | G | 0.5447 | 0.5147 | 1.00 | – |
| T | G | G | 0.319 | 0.3209 | 1.06 (0.89–1.25) | 0.52 |
| T | T | A | 0.1347 | 0.1637 | 1.27 (1.02–1.58) | 0.034 |
| Общий Р: 0.091 | ||||||
Оценка редокс-статуса 636 участников исследования (табл. 3) показала, что уровень перекиси водорода в плазме 128 больных СД2 мужчин (3.33 ± 1.31 мкмоль/л) был значительно выше такового в плазме 87 здоровых (2.78 ± 1.15 мкмоль/л, Р = 0.046). У 299 пациенток с СД2 концентрация H2O2 в плазме (3.72 ± 1.43 мкмоль/л) значимо превышала таковую 122 здоровых женщин (2.83 ± ± 1.16 мкмоль/л, Р = 0.02). Значимых различий по концентрации восстановленного, окисленного и общего глутатиона между больными и здоровыми установлено не было (Р > 0.05).
Таблица 3.
Показатели редокс-гомеостаза у больных СД2 и здоровых лиц
| Показатель | Больные СД2 | Контроль | |||
|---|---|---|---|---|---|
| концентрация метаболита, мкмоль/л | n | концентрация метаболита, мкмоль/л | n | P | |
| Мужчины | |||||
| Н2О2, Mean ± St.Dv. | 3.33 ± 1.31 | 128 | 2.78 ± 1.15 | 87 | 0.046 |
| GSSG, Me[Q1; Q3] | 10.22 [3.88; 11.46] | 42 | 8.65 [6.48; 10.91] | 32 | 0.81 |
| GSSG/GSH, Me[Q1; Q3] | 11.05 [4, 26, 12, 31 ] | 42 | 9.26 [7.04; 11.64] | 32 | 0.81 |
| Женщины | |||||
| Н2О2, Mean ± St.Dv. | 3.72 ± 1.61 | 299 | 2.83 ± 1.16 | 122 | 0.02 |
| GSSG, Me[Q1; Q3] | 5.09 [3.00; 9.25] | 33 | 10.18 [10.15; 10.21 ] | 30 | 0.11 |
| GSSG/GSH, Me[Q1; Q3] | 4.78 [2.43; 10.03] | 35 | 10.96 [10.93; 10.99] | 32 | 0.09 |
Однако при анализе взаимосвязей между генотипами CYBB и биохимическими показателями редокс-статуса больных СД2 было обнаружено, что генотипы G/Т–Т/Т rs5963327, а также генотипы G/A–A/A rs6610650 ассоциированы с повышением уровня окисленного глутатиона GSSG в плазме на 2.54 мкмоль/л (95% CI 0.12–4.97, P = 0.047) исключительно у больных СД2 женщин.
ОБСУЖДЕНИЕ
НАДФН-оксидаза – это главный фермент прооксидантной системы, основная функция которого заключается в генерации супероксид-аниона: НАДФН + 2О2 = ${\text{2О}}_{{\text{2}}}^{ - }$ + НАДФ+ + Н+. Далее, в ходе реакции дисмутации ${\text{О}}_{{\text{2}}}^{ - }$ превращается в Н2О2. В клетках фагоцитарного ряда активные формы кислорода используются для уничтожения интернализированных микроорганизмов, в то время как в клетках, не способных осуществлять фагоцитоз, АФК работают как важнейшие сигнальные молекулы, регулирующие процессы деления, регенерации, дифференцировки клеток, их апоптоз и организацию цитоскелета [22]. Мультибелковый комплекс НАДФН-оксидазы включает в себя два трансмембранных белка CYBA (легкая цепь цитохрома b-245), CYBB (тяжелая цепь b-245) и четыре цитозольных субъединицы NCF1 (нейтрофильный цитозольный фактор 1), NCF2 (нейтрофильный цитозольный фактор 2), NCF4 (нейтрофильный цитозольный фактор 4), RAC1/RAC2 (субстрат 1/2 родственный Ras ботулинового токсина). Каждый протомер при этом выполняет специфические функции. Так, цитозольные домены отвечают за ассоциацию с мембранным цитохромом b-245 и его переход из латентного в активное состояние [23], в то время как альфа- и бета-субъединицы цитохрома формируют так называемое каталитическое ядро комплекса [24]. Примечательно, что из всех субъединиц НАДФН-оксидазы только CYBB содержит домены для связывания кофакторов НАДФН, ФАД и двух молекул гема, а значит непосредственно вовлечен в перенос неспаренных электронов от молекулы НАДФН на молекулу кислорода с образованием супероксид-аниона на наружной поверхности цитоплазматической мембраны. Биоинформатический инструмент STRING (https://string-db.org/) позволил визуализировать белковую сеть, образуемую компонентами НАДФН-оксидазы (рис. 1).
Рис. 1.
Функциональные партнеры CYBB. CYBA – легкая цепь цитохрома b-245; CYBB – тяжелая цепь b-245; NCF1 – нейтрофильный цитозольный фактор 1; NCF2 – нейтрофильный цитозольный фактор 2; NCF4 – нейтрофильный цитозольный фактор 4; RAC1 – субстрат 1, родственный Ras ботулинового токсина; RAC2 – субстрат 2, родственный Ras ботулинового токсина; DECR1 – 2,4-диеноил-КоА-редуктаза; ITGB2 – интегрин бета-2; ITGAM – интегрин альфа-М; CD53 – лейкоцитарный поверхностный антиген. Синими линиями обозначено физическое взаимодействие между белками, черными – совместное участие в каталитических реакциях (данные STRING: https://string-db.org/).
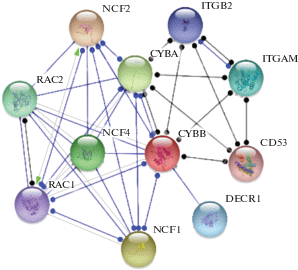
Как видно из рис. 1, функциональными партнерами CYBB также являются DECR1 (2,4-диеноил-КоА редуктаза), ITGB2 (интегрин бета-2), ITGAM (интегрин альфа-М) и CD53 (лейкоцитарный поверхностный антиген), которые по данным ресурса Gene Ontology (http://geneontology.org/) вместе с белками НАДФН-оксидазы участвуют в реализации иммунного ответа (FDR = 1.02 × 10–6) и регуляции метаболизма перекиси водорода (FDR = = 3.12 × 10–6).
Loss-of-function мутации в гене CYBB приводят к развитию Х-сцепленной хронической гранулематозной болезни [25–27] – первичного иммунодефицита, характеризующегося несостоятельностью реакций врожденного иммунитета. Полиморфные варианты, обладающие эффектом gain-of-function (в частности, rs5917471 и rs6610650), напротив, сопровождаются гиперпродукцией агрессивных свободнорадикальных частиц и снижают риск развития туберкулеза [28]. Данные о связи SNPs CYBB с предрасположенностью к СД2 в литературе отсутствуют. Выполненное нами исследование впервые выявило взаимосвязь rs5963327 и rs6610650 в интронах гена CYBB с повышенным риском развития СД2, тем самым демонстрируя потенциальную вовлеченность гена цитохрома b-245 в патогенез этого заболевания.
Проведенные в последние годы функциональные исследования свидетельствуют о том, что генетически детерминированная гиперактивность гена CYBB может являться важнейшим механизмом развития оксидантного стресса. Так, L. Qin и коллеги [29] установили, что нокаут CYBB предотвращает чрезмерную генерацию АФК и повреждение микроглии по сравнению с животными, экспрессирующими CYBB. Последствия гиперактивности CYBB имеют особое значение для поджелудочной железы, печени, скелетной мускулатуры, нервной, подкожной и висцеральной жировой ткани, в которых согласно экспериментальным данным GTEx портала (https://gtexportal.org/) аллель Т rs5963327 и аллель А rs6610650 активируют экспрессию CYBB. Прооксидантный статус способствует повреждению внутриклеточных сигнальных молекул, участвующих в реализации первичных эффектов инсулина в периферических тканях, а также регулирующих синтез и секрецию инсулина в бета-клетках поджелудочной железы [30–32], что в свою очередь приводит к прогрессированию инсулинорезистентности и уменьшению функционирующей массы бета-клеток – ключевых звеньев патогенеза СД2. Кроме того, в экспериментальной работе на мышах E. Pigna и соавт. [33] доказали, что дисбаланс в про- и антиоксидантной системе скорее является результатом избыточной продукции АФК на фоне гиперактивности гена CYBB, нежели следствием недостатка антиоксидантов. Действительно, настоящее исследование выявило увеличение содержания перекиси водорода в плазме больных СД2 мужчин и женщин, тогда как концентрация общего глутатиона и его подфракций существенно не отличалась в группе больных и здоровых индивидов. Тем не менее нами впервые была установлена связь локусов rs5963327 и rs6610650 с повышенным содержанием окисленного глутатиона, причем исключительно у женщин. Накопление GSSG само по себе является неблагоприятным фактором, запускающим S-глутатионилирование ферментов антиоксидантной системы, что, например, в случае NO синтазы приводит к переключению фермента с синтеза оксида азота(II) на продукцию супероксид-аниона и таким образом провоцирует новый виток генерации АФК (эффект инь–янь) [34].
Таким образом, в проведенном нами исследовании впервые установлена ассоциация вариантов гена бета-цепи цитохрома b-245 c повышенным риском развития СД2. Механизм взаимосвязи данных вариантов с заболеванием объясняется более выраженным синтезом CYBB у носителей минорных аллелей rs5963327 и rs6610650, что проявляется увеличением концентрации перекиси водорода в плазме крови. Хотя нами не были выявлены значимые изменения в содержании общего глутатиона и его подфракций у больных СД2, тем не менее была показана взаимосвязь rs5963327 и rs6610650 с более высоким уровнем окисленного глутатиона у женщин. Полученные данные открывают перспективы для дальнейшего изучения генетико-биохимических особенностей редокс-гомеостаза при СД2 и выяснения роли функциональных субъединиц НАДФН-оксидазы в развитии оксидантного стресса при этом заболевании.
Исследование выполнено при финансовой поддержке ФГБОУ ВО КГМУ Минздрава России.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 года и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Global Report on Diabetes: Executive Summary (no. WHO/NMH/NVI/16.3). World Health Organization, 2016.
Cho N., Shaw J.E., Karuranga S. et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045 // Diabetes Res. Clin. Practice. 2018. № 138. P. 271–281. https://doi.org/10.1016/j.diabres.2018.02.023
Dedov I.I., Shestakova M.V., Vikulova O.K. et al. Diabetes mellitus in Russian Federation: prevalence, morbidity, mortality, parameters of glycaemic control and structure of glucose lowering therapy according to the Federal Diabetes Register, status 2017 // Diabetes Mellitus. 2018. V. 21. № 3. P. 144–159. https://doi.org/10.14341/DM9686
Шестакова М.В., Сухарева О.Ю. Диагностика и выбор метода лечения сахарного диабета 2 типа // Клинич. фармакол. и терапия. 2018. Т. 27. № 2. С. 1–7.
Дедов И.И., Смирнова О.М., Кононенко И.В. Значение результатов полногеномных исследований для первичной профилактики сахарного диабета 2 типа и его осложнений. Персонализированный подход // Сахарный диабет. 2014. № 2. С. 10–19.
Flannick J., Florez J.C. Type 2 diabetes: genetic data sharing to advance complex disease research // Nat. Rev. Genet. 2016. V. 17. № 9. P. 535.
Fuchsberger C., Flannick J., Teslovich T.M. et al. The genetic architecture of type 2 diabetes // Nature. 2016. V. 536. № 7614. P. 41.
Schmidt A.F., Swerdlow D.I., Holmes M.V. et al. PCSK9 genetic variants and risk of type 2 diabetes: a mendelian randomisation study // The Lancet Diabetes Endocrinol. 2017. V. 5. № 2. P. 97–105. https://doi.org/10.1016/S2213-8587(16)30396-5
Grarup N., Moltke I., Andersen M.K. et al. Loss-of-function variants in ADCY3 increase risk of obesity and type 2 diabetes // Nat. Genet. 2018. V. 50. № 2. P. 172.
Бутаева С.Г., Аметов А.С., Бугров А.В., Долгов В.В. Вариабельность уровня глюкозы в крови и окислительный стресс у больных сахарным диабетом 2-го типа на фоне комбинированной сахароснижающей терапии // Терапевтич. Архив (архив до 2018 г.). 2017. Т. 89. № 10. С. 36–39.
Tangvarasittichai S. Oxidative stress, insulin resistance, dyslipidemia and type 2 diabetes mellitus // World J. Diabetes. 2015. V. 6. № 3. P. 456. https://doi.org/10.4239/wjd.v6.i3.456
Furukawa S., Fujita T., Shimabukuro M. et al. Increased oxidative stress in obesity and its impact on metabolic syndrome // J. Clin. Investigation. 2017. V. 114. № 12. P. 1752–1761. https://doi.org/10.1172/JCI21625
Okuno Y., Fukuhara A., Hashimoto E. et al. Oxidative stress inhibits healthy adipose expansion through suppression of SREBF1-mediated lipogenic pathway // Diabetes. 2018. V. 67. № 6. P. 1113–1127. https://doi.org/10.2337/db17-1032
Panday A., Sahoo M.K., Osorio D., Batra S. NADPH oxidases: an overview from structure to innate immunity-associated pathologies // Cell. Mol. Immunol. 2015. V. 12. № 1. P. 5.
Magnani F., Nenci S., Fananas E.M. et al. Crystal structures and atomic model of NADPH oxidase // Proc. Natl Acad. Sci. USA. 2017. V. 114. № 26. P. 6764–6769. https://doi.org/10.1073/pnas.1702293114
Monteiro M.B., Patente T.A., Mohammedi K. et al. Sex-specific associations of variants in regulatory regions of NADPH oxidase-2 (CYBB) and glutathione peroxidase 4 (GPX4) genes with kidney disease in type 1 diabetes // Free Radical Res. 2013. V. 47. № 10. P. 804–810. https://doi.org/10.3109/10715762.2013.828347
Hazra S., Jarajapu Y.P.R., Stepps V. et al. Long-term type 1 diabetes influences haematopoietic stem cells by reducing vascular repair potential and increasing inflammatory monocyte generation in a murine model // Diabetologia. 2013. V. 56. № 3. P. 644–653. https://doi.org/10.1007/s00125-012-2781-0
Dong Y.F., Liu L., Kataoka K. et al. Aliskiren prevents cardiovascular complications and pancreatic injury in a mouse model of obesity and type 2 diabetes // Diabetologia. 2010. V. 53. № 1. P. 180. https://doi.org/10.1007/s00125-009-1575-5
Yoshinari O., Takenake A., Igarashi K. Trigonelline ameliorates oxidative stress in type 2 diabetic Goto-Kakizaki rats // J. Med. Food. 2013. V. 16. № 1. P. 34–41. https://doi.org/10.1089/jmf.2012.2311
Takamura T., Misu H., Matsuzawa-Nagata N. et al. Obesity upregulates genes involved in oxidative phosphorylation in livers of diabetic patients // Obesity. 2008. V. 16. № 12. P. 2601–2609. https://doi.org/10.1038/oby.2008.419
Azarova I., Bushueva O., Konoplya A., Polonikov A. Glutathione S-transferase genes and the risk of type 2 diabetes mellitus: Role of sexual dimorphism, gene–gene and gene–smoking interactions in disease susceptibility // J. Diabetes. 2018. V. 10. № 5. P. 398–407. https://doi.org/10.1111/1753-0407.12623
Manea A. NADPH oxidase-derived reactive oxygen species: involvement in vascular physiology and pathology // Cell Tissue Res. 2010. V. 342. № 3. P. 325–339. https://doi.org/10.1007/s00441-010-1060-y
Vignais P.V. The superoxide-generating NADPH oxidase: structural aspects and activation mechanism // Cell. Mol. Life Sci. 2002. V. 59. № 9. P. 1428–1459. https://doi.org/10.1007/s00018-002-8520-9
Sahoo S., Meijles D.N., Pagano P.J. NADPH oxidases: key modulators in aging and age-related cardiovascular diseases? // Clin. Sci. 2016. V. 130. № 5. P. 317–335. https://doi.org/10.1042/CS20150087
Bingel S.A. Pathology of a mouse model of x-linked chronic granulomatous disease // J. Amer. Associat. Lab. Animal Sci. 2002. V. 41. № 5. P. 33–38.
Barese C.N., Copelli S.B., Matteo E.D. et al. Molecular characterization of a novel splice site mutation within the CYBB gene leading to X-linked chronic granulomatous disease // Pediatric Blood & Cancer. 2005. V. 44. № 4. P. 420–422. https://doi.org/10.1002/pbc.20204
de Boer M., van Leeuwen K., Geissler J. et al. Primary immunodeficiency caused by an exonized retroposed gene copy inserted in the CYBB gene // Hum. Mutat. 2014. V. 35. № 4. P. 486–496. https://doi.org/10.1002/humu.22519
Bustamante J., Arias A.A., Vogt G. et al. Germline CYBB mutations that selectively affect macrophages in kindreds with X-linked predisposition to tuberculous mycobacterial disease // Nat. Immunol. 2011. V. 12. № 3. P. 213.
Qin L., Liu Y., Hong J.S., Crews F.T. NADPH oxidase and aging drive microglial activation, oxidative stress, and dopaminergic neurodegeneration following systemic LPS administration // Glia. 2013. V. 61. № 6. P. 855–868. https://doi.org/10.1002/glia.22479
Drummond G.R., Selemidis S., Griendling K.K., Sobey C.G. Combating oxidative stress in vascular disease: NADPH oxidases as therapeutic targets // Nat. Rev. Drug Discovery. 2011. V. 10. № 6. P. 453.
Jones D.P. Radical-free biology of oxidative stress // Am. J. Physiol. Cell Physiol. 2008. V. 295. № 4. P. C849–C868. https://doi.org/10.1152/ajpcell.00283.2008
Santos C.X., Tanaka L.Y., Wosniak J., Laurindo F.R. Mechanisms and implications of reactive oxygen species generation during the unfolded protein response: roles of endoplasmic reticulum oxidoreductases, mitochondrial electron transport, and NADPH oxidase // Antioxid. Redox Signal. 2009. V. 11. № 10. P. 2409–2427. https://doi.org/10.1089/ars.2009.2625
Pigna E., Greco E., Morozzi G. et al. Denervation does not induce muscle atrophy through oxidative stress // Eur. J. Translat. Myology. 2017. V. 27. № 1. https://doi.org/10.4081/ejtm.2017.6406
Duan D.D., Kwan C.Y. A molecular switch of “Yin and Yang”: S-glutathionylation of eNOS turns off NO synthesis and turns on superoxide generation // Acta Pharmacol. Sinica. 2011. V. 32. № 4. P. 415. https://doi.org/10.1038/aps.2011.21
Дополнительные материалы отсутствуют.


