Генетика, 2020, T. 56, № 7, стр. 819-825
Экспрессия гена Са2+-АТФазы SERCA2a (ATP2A2) и гена рианодиновых рецепторов (RYR2) у больных хронической сердечной недостаточностью
Э. Ф. Муслимова 1, *, Т. Ю. Реброва 1, Д. С. Кондратьева 1, Ш. Д. Ахмедов 1, С. А. Афанасьев 1
1 Научно-исследовательский институт кардиологии, Томский национальный исследовательский медицинский центр Российской академии наук
634012 Томск, Россия
* E-mail: muslimovef@yandex.ru
Поступила в редакцию 24.06.2019
После доработки 17.07.2019
Принята к публикации 07.08.2019
Аннотация
Проведен анализ уровня относительной экспрессии гена Ca2+-АТФазы SERCA2a (ATP2A2) и гена рианодиновых рецепторов (RYR2) в миокарде 85 больных ишемической болезнью сердца, осложненной сердечной недостаточностью, в зависимости от клинической картины заболевания. Выявлено снижение уровня экспрессии генов ATP2A2 и RYR2 у пациентов с гипертрофией левого желудочка. Установлено, что уровень экспрессии гена RYR2 снижался с утяжелением функционального класса сердечной недостаточности. Обнаружена корреляция между уровнем экспрессии гена ATP2A2 и показателями эхокардиографии.
Хроническая сердечная недостаточность (ХСН) – это синдром, развивающийся в результате большинства заболеваний или поражений сердечно-сосудистой системы. Больных, имеющих ХСН, отличает высокий уровень смертности, который превышает популяционный в 10 раз [1]. Высокая частота ХСН требует углубленного изучения ее патогенетических механизмов и поиска факторов неблагоприятного течения основной патологии с целью замедления развития и снижения клинических проявлений этого синдрома [2].
Известно, что развитие ХСН сопряжено с нарушением адекватной работы внутриклеточных сигнальных путей, опосредующих, в том числе, и гомеостаз ионов кальция (Ca2+) [3]. Каждый цикл сокращения–расслабления кардиомиоцитов сопряжен с внутриклеточной осцилляцией Ca2+, сопровождающейся выбросом этих ионов из саркоплазматического ретикулума (СР) через рианодиновые рецепторы RyR2. Вероятность открытия RyR2 во время систолы должна быть высокой для максимально быстрого выделения Са2+ и, напротив, очень низкой во время диастолы для обратного захвата Ca2+ в СР, осуществляемого благодаря работе Ca2+-АТФазы SERCA2a. Отмечено, что и нарушение в работе RyR2, приводящее к “утечке” Ca2+ в цитоплазму во время диастолы, и снижение активности/содержания SERCA2a, приводящее к ухудшению обратного захвата Ca2+ в СР, имеют серьезные последствия для нормальной работы сердца и провоцируют развитие сердечной недостаточности [4, 5].
Воздействие на Ca2+-транспортирующие системы СР представляется перспективным, но пока в должной степени не реализованным подходом при лечении ХСН. Однако уже сейчас показано, что восстановление уровня SERCA2a у пациентов с ХСН со сниженной фракцией выброса левого желудочка с помощью рекомбинантного вектора AAV1/SERCA2a улучшало систолическую и диастолическую функции миокарда без увеличения потребности сердца в кислороде и уменьшало риск желудочковых аритмий [5].
Так как экспрессия гена рианодиновых рецепторов RYR2 и гена ATP2A2, кодирующего SERCA2a в кардиомиоцитах, определяет содержание/активность соответствующего белка, важно выявить клинические состояния, при которых изменения экспрессии этих генов будут наиболее выраженными. Такая информация в будущем может иметь значение и для практической медицины. Накопление данных, полученных в ходе молекулярно-генетических исследований, может стать основой для совершенствования терапии, направленной на улучшение качества жизни и повышение выживаемости у больных ХСН [2].
Цель исследования: оценить зависимость уровня относительной экспрессии гена Ca2+‑АТФазы SERCA2a (ATP2A2) и гена рианодиновых рецепторов (RYR2) в миокарде больных ХСН от клинической картины заболевания.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено в соответствии с принципами Хельсинкской декларации. Протокол исследования одобрен Комитетом по биомедицинской этике НИИ кардиологии Томского НИМЦ. До включения в исследование у всех пациентов получено письменное информированное согласие.
В исследование включено 85 больных ишемической болезнью сердца (ИБС), осложненной ХСН. Возраст пациентов составил 62 (57; 67) года. Сформированная выборка включала 67 (78.8%) мужчин и 18 (21.2%) женщин. По данным анамнеза, инфаркт миокарда (ИМ) был у 64 (75.3%) пациентов, возраст первичного ИМ составлял 58 (50.5; 63.5) лет. Пациенты были госпитализированы для выполнения плановых операций аортокоронарного шунтирования.
На этапе предоперационного обследования у пациентов определен функциональный класс (ФК) ХСН [1]. Для этого пациенты выполняли тест 6-минутной ходьбы, т.е. было измерено расстояние в метрах, которое пациенты могли пройти за 6 мин в максимально возможном темпе. В соответствии с классификацией Нью-Йоркской кардиологической ассоциации (NYHA) считается, что пройденное расстояние в 426–550 и 301–425 м соответствует I и II ФК, а расстояние в 151–300 и менее 150 м соответствует III и IV ФК.
Всем пациентам выполнено эхокардиографическое исследование сердца. Эхокардиографию проводили, используя аппарат Philips HD15 (Нидерланды) из стандартных позиций с оценкой размеров отделов сердца и фракцией выброса левого желудочка (ЛЖ) по методу Симпсона. Также диагностировалось наличие гипертрофии ЛЖ при увеличении индекса массы миокарда ЛЖ >115 у мужчин и >95 г/м2 у женщин [1]. Фракция выброса ЛЖ в выборке составила 58% (47; 65).
Для генетического исследования использовали интраоперационные биоптаты сердца (ушко правого предсердия), иссекаемые при подключении аппарата искусственного кровообращения. Сразу после иссечения биоптаты помещали в ледяной раствор Кребса–Хензеляйта следующего состава в мМ: NaCl – 120, KCl – 4.8, CaCl2 – 2.0, MgSO4 – 1.2, KH2PO4 – 1.2, NaHCO3 – 20.0, глюкоза – 10.0. Данный раствор позволяет поддерживать жизнеспособность кардиомиоцитов с сохранением их сократительной функции [6]. Образцы миокарда разрушали на гомогенизаторе TissueLyser LT (QIAGEN, США), и из гомогената выделяли тотальную РНК с помощью коммерческого набора RNeasy Fibrous Tissue Mini Kit (QIAGEN). Качество образцов РНК оценивали спектрофотометрическим методом по отношению A260/A280 (NanoVue, Heaithcare Bio-Science, Швеция), которое варьировало в пределах от 1.83 до 2.03. Для синтеза кДНК использовали реактивы RevertAid First Strand cDNA Synthesis Kit (Thermo Scientific, США).
Полимеразную цепную реакцию в режиме реального времени проводили на амплификаторе LightCycler 96 (Roche) с использованием праймеров, разработанных OOO “ДНК-Синтез” (Россия). Для оценки экспрессии гена ATP2A2 использовали прямой праймер 5'-CACTCCACTTCCTGATCCTCTATGT-3', обратный праймер 5'-GCAAGGAGATTTTCAGCACCAT-3' и зонд FAM-ACCCTTGCCACTCATCTTCCAGATCAC-BHQ1. Для оценки экспрессии гена RYR2 использовали прямой праймер 5'-CAGACTTTGTTTCTTGGAG-TCCACT-3', обратный праймер 5'-AGAGGGACTGCTCCAGCACA-3' и зонд FAM-CAATTCCAAGAATGTGCCCCCAGAC-BHQ1. Обработку результатов проводили с помощью программного обеспечения LightCycler 96 (Roche) с поправкой на эффективность реакции и применением стандартной кривой. В качестве референсных были использованы ген глицеральдегид-3-фосфатдегидрогеназы GAPDH и ген бета-актина ACTB.
Статистический анализ проводили с помощью стандартного пакета программ SPSS версии 13 (IBM, США). Для анализа количественных данных использовали тест Манна–Уитни или тест Краскела–Уоллиса для трех независимых групп с поправкой Бонферрони. Результаты представляли в виде медианы и интерквантильного размаха Me (Q1; Q3), где Me – медиана, Q1 и Q3 – 25-й и 75-й перцентили. Также оценивали силу линейной взаимосвязи между количественными показателями с помощью коэффициента ранговой корреляции Спирмена. Уровень значимости различий принимали p < 0.05.
РЕЗУЛЬТАТЫ
В обследованной выборке больных ИБС уровень экспрессии гена ATP2A2 относительно генов GAPDH и ACTB составил 0.905 (0.407; 1.323) и 1.600 (0.895; 2.896) у. е. соответственно. Для гена RYR2 при аналогичной оценке относительного уровня экспрессии были получены значения 0.560 (0.239; 1.070) и 0.939 (0.513; 1.489) у. е. соответственно. Относительная экспрессия генов ATP2A2 и RYR2 не зависела от гендерной принадлежности пациентов (p > 0.05).
Проведена оценка сопряженности между уровнем экспрессии гена ATP2A2 и гена RYR2. Оказалось, что коэффициент корреляции r между RYR/GAPDH и ATP2A2/GAPDH составил 0.637 (p < < 0.001), между RYR/GAPDH и ATP2A2/ACTB был 0.442 (p = 0.001), между RYR/ACTB и ATP2A2/GAPDH составил 0.502 (p < 0.001), а между RYR/ACTB и ATP2A2/ACTB – 0.620 (p < 0.001). Данные результаты показывают наличие в исследуемой выборке средней положительной линейной зависимости между уровнем экспрессии генов RYR2 и ATP2A2.
Проведен анализ силы линейной взаимосвязи между уровнем относительной экспрессии генов и показателями эхокардиографии. Результаты, представленные в табл. 1, свидетельствуют о том, что уровень относительной экспрессии ATP2A2/GAPDH имеет слабую положительную зависимость с такими показателями эхокардиографии, как фракция выброса ЛЖ и величина пика A. Для таких показателей, как конечный систолический объем (КСО), конечный систолический размер (КСР) и конечный диастолический размер (КДР), а также соотношение E/A, выявлена слабая отрицательная корреляция с уровнем относительной экспрессии ATP2A2/GAPDH. При этом оказалось, что для уровня относительной экспрессии ATP2A2/ACTB отсутствует какая-либо линейная зависимость с показателями эхокардиографии. Кроме того, показано, что между показателями эхокардиографии и уровнем как RYR2/GAPDH, так и RYR2/ACTB не было какой-либо значимой линейной зависимости (табл. 1).
Таблица 1.
Сила линейной взаимосвязи (коэффициент корреляции – r и уровень значимости – p) между показателями эхокардиографии и уровнем относительной экспрессии генов RYR2 и ATP2A2
| Показатели эхоКГ | Относительная экспрессия генов | |||
|---|---|---|---|---|
| RYR2/GAPDH | RYR2/ACTB | ATP2A2/GAPDH | ATP2A2/ACTB | |
| ФВ ЛЖ | 0.142; 0.266 | –0.120; 0.350 | 0.270; 0.020 | –0.096; 0.447 |
| КСО | –0.087; 0.505 | 0.162; 0.217 | –0.270; 0.026 | 0.056; 0.663 |
| КСР | –0.137; 0.293 | 0.020; 0.881 | –0.235; 0.047 | 0.105; 0.413 |
| КДО | –0.003; 0.984 | 0.117; 0.371 | –0.217; 0.067 | 0.075; 0.555 |
| КДР | –0.114; 0.382 | 0.015; 0.911 | –0.300; 0.011 | –0.039; 0.764 |
| Пик E | 0.108; 0.400 | –0.063; 0.627 | 0.018; 0.883 | –0.020; 0.877 |
| Пик A | 0.157; 0.230 | –0.133; 0.309 | 0.395; 0.001 | 0.192; 0.134 |
| E/A | –0.002; 0.987 | –0.001; 0.993 | –0.257; 0.030 | –0.154; 0.231 |
Примечание. ФВ ЛЖ – фракция выброса левого желудочка; КСО – конечный систолический объем; КСР – конечный систолический размер; КДО – конечный диастолический объем; КДР – конечный диастолический размер; пик E – пик раннего диастолического наполнения; пик A – пик позднего диастолического наполнения; соотношение Е/А – соотношение пиковых скоростей раннего и позднего диастолического наполнения; p – уровень значимости силы линейной взаимосвязи (полужирный шрифт при p < 0.05).
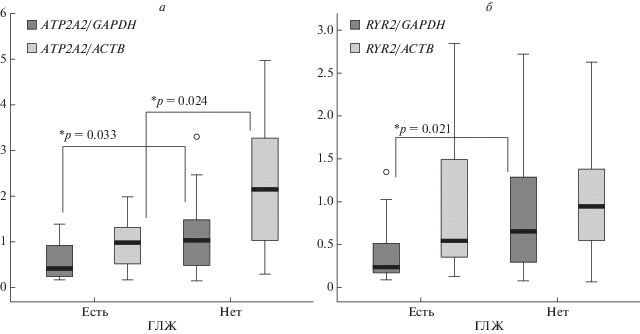
По результатам эхокардиографии у 23 (27.1%) пациентов, включенных в выборку, выявлена гипертрофия ЛЖ. На рис. 1 представлена зависимость уровня относительной экспрессии исследуемых генов от наличия или отсутствия гипертрофии ЛЖ. Показано, что в группе пациентов с гипертрофией ЛЖ имел место статистически значимо меньший уровень относительной экспрессии гена ATP2A2 (p = 0.033 для ATP2A2/GAPDH, p = 0.024 для ATP2A2/ACTB). Также у пациентов с гипертрофией ЛЖ выявлен более низкий уровень экспрессии RYR2/GAPDH (p = 0.021), однако отсутствовали различия в относительной экспрессии RYR2/ACTB (p = 0.149) между группами больных ИБС.
Рис. 1.
Уровень относительной экспрессии (в усл. ед.) генов ATP2A2 (а) и RYR2 (б) в зависимости от наличия гипертрофии левого желудочка.
Согласно результатам, полученным при выполнении теста 6-минутной ходьбы для оценки выраженности ХСН, рассматриваемая выборка включала четырех (4.7%) пациентов с ФК I, 50 (58.8%) пациентов с ФК II и 31 (36.5%) пациента с ФК III. Проведена оценка относительной экспрессии генов ATP2A2 и RYR2 в зависимости от ФК ХСН. Результаты этого исследования представлены на рис. 2 и 3.
Рис. 2.
Уровень относительной экспрессии (в усл. ед.) RYR2/GAPDH (а) и RYR2/ACTB (б) в зависимости от функционального класса сердечной недостаточности.
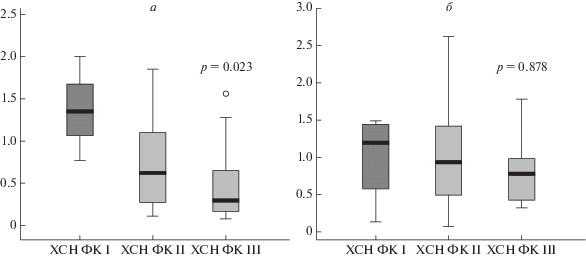
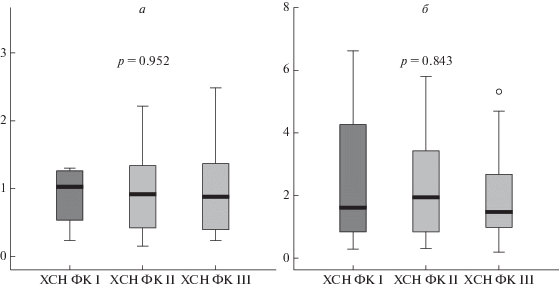
Рис. 3.
Уровень относительной экспрессии (в усл. ед.) ATP2A2/GAPDH (а) и ATP2A2/ACTB (б) в зависимости от функционального класса сердечной недостаточности.
Показано (рис. 2), что с утяжелением от ХСН ФК I к ХСН ФК II уровень экспрессии гена RYR2 снижался. Однако статистически значимые изменения были выявлены только при нормировании на GAPDH (p = 0.023). Относительная экспрессия RYR2/ACTB оказалась сопоставимой у пациентов с ФК I, II, III ХСН (p = 0.878).
Хотя относительная экспрессия гена ATP2A2 менялась в зависимости от наличия гипертрофии ЛЖ и коррелировала с показателями эхокардиографии, уровень экспрессии ATP2A2/GAPDH и ATP2A2/ACTB у пациентов, имеющих разные ФК ХСН (рис. 3), оказался сопоставимым (p = 0.933 и p = 0.680 соответственно).
ОБСУЖДЕНИЕ
Внутриклеточный гомеостаз Ca2+ и его осцилляции в кардиомиоцитах в значительной степени обеспечиваются согласованной работой Ca2+-транспортирующих систем СР, основу которых составляют белки SERCA2а и RyR2. Нарушение их функционирования способствует развитию сократительной дисфункции миокарда и нарушению его электрической стабильности [3]. При этом и содержание, и активность этих белков зависят, в том числе, от уровня экспрессии соответствующих генов.
Результаты оценки относительной экспрессии гена Ca2+-АТФазы SERCA2а (ATP2A2) и гена рианодиновых рецепторов (RYR2) в миокарде больных ХСН ишемического генеза показали прямую линейную зависимость между уровнями экспрессии этих генов. Изменение экспрессии одного гена в зависимости от клинической картины заболевания может повлечь изменения в работе всей Ca2+-транспортирующей системы СР.
Показано, что при воспалении и сердечной недостаточности изменяется экспрессия генов Ca2+-транспортирующих белков [7, 8]. Так, для пациентов с эпизодами отторжения после трансплантации сердца в анамнезе наблюдалось снижение уровня экспрессии генов ATP2A2/GAPDH и RYR2/GAPDH по сравнению с лицами без случаев отторжения [8].
Действительно, в нашем исследовании обнаружена зависимость между уровнем экспрессии ATP2A2/GAPDH и фракцией выброса ЛЖ. Уровень относительной экспрессии ATP2A2/GAPDH коррелировал и с другими показателями эхокардиографии, характеризующими сократительную функцию миокарда, а именно с величиной пика A, конечным систолическим объемом, конечным систолическим размером и конечным диастолическим размером. Кроме того, нами выявлено снижение экспрессии гена ATP2A2 при гипертрофии ЛЖ у больных ХСН. Полученные данные вполне определенно указывают на взаимосвязь уровня экспрессии гена ATP2A2, кодирующего SERCA2a, с клинической картиной ХСН.
Помимо SERCA2a в сократительной активности миокарда важную роль играют и рецепторы RyR2 [4]. Нарушение работы RyR2 может провоцировать возникновение “кальциевых вспышек” во время диастолы. Это приводит к активации соседних кластеров рецепторов RyR2 и дает начало волне высвобождения Ca2+ из СР. Как следствие, SERCA2a не может обеспечить необходимого снижения концентрации Ca2+ в миоплазме и аккумуляции ионов в СР. Это ведет к нарушению осцилляций Ca2+ в процессе электромеханического сопряжения, что проявляется в нарушении электрической стабильности и контрактильности сердечной мышцы.
Известно, что снижение экспрессии и активности RyR2 является фактором риска прогрессирования сердечной недостаточности и ишемической кардиомиопатии [9]. Нами обнаружено, что относительная экспрессия RYR2/GAPDH (но не RYR2/ACTB) снижалась с утяжелением ФК сердечной недостаточности. При этом наибольший уровень экспрессии наблюдался у пациентов с I ФК, а наименьший – у пациентов с III ФК. Кроме того, более низкий уровень экспрессии RYR2/GAPDH (но не RYR2/ACTB) показан для пациентов с гипертрофией ЛЖ по сравнению с больными без гипертрофии ЛЖ. Однако в нашей выборке отсутствовала корреляция между экспрессией гена RYR2 и показателями эхокардиографии.
Стоит отметить, что согласно результатам некоторых исследований под вопросом остается роль повышения экспрессии гена RYR2 при развитии сердечно-сосудистых заболеваний. Так, в экспериментальных работах показано, что у крыс со спонтанной гипертензией, приводящей к ХСН, уровень экспрессии гена RYR2 повышался по сравнению с животными без гипертензии. Такое изменение экспрессии совпадало с увеличением частоты случаев спонтанных “вспышек” Ca2+, что является фактором риска аритмий. Однако тренировки животных на выносливость приводили к повышению уровня экспрессии RYR2 в группе животных без гипертензии, а у животных с гипертензией, напротив, восстанавливали уровень экспрессии до значений, характерных для нормальных животных в интактном состоянии [10]. Результаты этого исследования свидетельствуют, что в зависимости от состояния миокарда одни и те же воздействия на Ca2+-транспортирующую систему СР кардиомиоцитов могут по-разному модифицировать ее состояние. Это делает востребованным дальнейшие исследования влияния различных факторов на экспрессию генов Ca2+-транспортирующих белков у человека, в том числе в условиях реальных патологий сердечно-сосудистой системы.
Таким образом, получены данные, показывающие наличие линейной связи между уровнем экспрессии гена ATP2A2 в миокарде больных ХСН ишемического генеза и фракцией выброса ЛЖ, а также с другими показателями эхокардиографии, характеризующими сократительную функцию миокарда. Установлено, что при гипертрофии ЛЖ относительная экспрессия генов ATP2A2 и RYR2 снижалась. Показано снижение уровня экспрессии гена рианодиновых рецепторов RYR2 при утяжелении ФК ХСН.
Работа выполнена при поддержке гранта РФФИ № 17-04-01450 “Исследование ассоциации полиморфизмов и экспрессии генов Са2+-транспортирующих белков саркоплазматического ретикулума с тяжестью течения сердечной недостаточности”.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Мареев В.Ю., Фомин И.В., Агеев Ф.Т. и др. Клинические рекомендации ОССН–РКО–РНМОТ. Сердечная недостаточность: хроническая (ХСН) и острая декомпенсированная (ОДСН). Диагностика, профилактика и лечение // Кардиология. 2018. Т. 58. S6. С. 3–164. https://doi.org/10.18087/cardio.2475
Тепляков А.Т., Березикова Е.Н., Шилов С.Н. и др. Оценка роли полиморфизма гена матриксной металлопротеиназы-3 в развитии хронической сердечной недостаточности // Терапевтический архив. 2015. Т. 87. № 4. С. 8–12. https://doi.org/10.17116/terarkh20158748-12
Реброва Т.Ю., Муслимова Э.Ф., Кондратьева Д.С. и др. Роль полиморфных вариантов генов Cа2+-АТФазы 2a (ATP2A2), рианодиновых рецепторов (RYR2) и кальсеквестрина (CASQ2) в развитии сердечной недостаточности // Генетика. 2018. Т. 54. № 6. С. 597–602. https://doi.org/10.7868/S0016675818060024
Dulhunty A.F., Beard N.A., Hanna A.D. Regulation and dysregulation of cardiac ryanodine receptor (RyR2) open probability during diastole in health and disease // J. Gen. Physiol. 2012. V. 140. № 2. P. 87–92. https://doi.org/10.1085/jgp.201210862
Greenberg B., Yaroshinsky A., Zsebo K.M. et al. Design of a phase 2b trial of intracoronary administration of AAV1/SERCA2a in patients with advanced heart failure: The CUPID 2 Trial (Calcium up-regulation by percutaneous administration of gene therapy in cardiac disease phase 2b) // JACC: Heart Failure. 2014. V. 2. № 1. P. 84–92. https://doi.org/10.1016/j.jchf.2013.09.008
Афанасьев С.А., Кондратьева Д.С., Егорова М.В. и др. Особенности сопряжения функционального и метаболического ремоделирования миокарда при коморбидном течении ишемической болезни сердца и сахарного диабета 2 типа // Сахарный диабет. 2019. Т. 22. № 1. С. 25–34. https://doi.org/10.14341/DM9735
Vanderheyden M., Mullens W., Delrue L. et al. Myocardial gene expression in heart failure patients treated with cardiac resynchronization therapy. Responders versus nonresponders // Am. Coll. Cardiol. 2008. V. 51. P. 129–136. https://doi.org/10.1016/j.jacc.2007.07.087
Kato T.S., Komamura K., Sata Y. et al. Cumulative episodes of rejection altered myocardial sarcoplasmic reticulum Ca2+-ATPase and ryanodine receptor-2 mRNA expression in heart transplant recipients // Int. Heart J. 2010. V. 51. № 4. P. 259–263. https://doi.org/10.1536/ihj.51.259
Bround M.J., Wambolt R., Luciani D.S. et al. Cardiomyocyte ATP production, metabolic flexibility, and survival require calcium flux through cardiac ryanodine receptors in vivo // The J. Biol. Chem. 2013. V. 288. P. 18975–18986.
Carneiro-Júnior M.A., Quintão-Júnior J.F., Drummond L.R. et al. Effect of exercise training on Ca2+ release units of left ventricular myocytes of spontaneously hypertensive rats // J. Med. Biol. Research. 2014. V. 47. № 11. P. 960–965. https://doi.org/10.1590/1414-431X20144063
Дополнительные материалы отсутствуют.


