Генетика, 2020, T. 56, № 7, стр. 741-761
Полногеномные ассоциативные исследования в суицидологии: анализ последних достижений
В. А. Розанов 1, *, Г. Э. Мазо 2, Н. А. Кулемин 3, 4
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
2 Национальный медицинский исследовательский центр психиатрии и неврологии
им. В.М. Бехтерева
192019 Санкт-Петербург, Россия
3 Zenom.io LTD
127220 Москва, Россия
4 Федеральный научно-клинический центр физико-химической медицины
Федерального медико-биологического агентства
119435 Москва, Россия
* E-mail: v.rozanov@spbu.ru
Поступила в редакцию 18.07.2019
После доработки 08.09.2019
Принята к публикации 17.10.2019
Аннотация
Современные биологические модели самоубийства, основанные на стресс-диатезе, рассматривают суицид как самостоятельную форму поведения, что является основанием для поиска его специфических генетических маркеров. В обзоре анализируются все имеющиеся на данный период времени исследования, в которых был осуществлен полногеномный поиск ассоциаций таких маркеров с суицидальными фенотипами (суицидальные мысли, попытки и завершенный суицид). В обзор вошли 15 работ, использующих данную стратегию и различные подходы к анализу данных, включая сопоставление с существующими базами данных по генетике психических расстройств, анализ метаболических путей, белок-белковых взаимодействий и обогащение по функциональному признаку. В отличие от работ предыдущих десятилетий, в которых в рамках поиска ассоциаций с генами-кандидатами фигурировали основные нейромедиаторные системы (система индол- и катехоламинов, ГАМК, возбуждающих аминокислот и др.), полногеномные исследования выдвигают на первые позиции другие факторы. В частности, обнаружено множество ассоциаций с генами, имеющими отношение к процессам развития и формирования нервной системы, нейропластичности, межклеточным взаимодействиям, клеточной адгезии и пролиферации, внутриклеточным сигнальным системам, а также к иммунным реакциям. Мы полагаем, что это является подтверждением релевантности моделей стресс-уязвимости, признающих ключевую роль ранних этапов развития и их влияния на нейропластичность и в целом важнейшую роль стресса как системной реакции организма в генезе суицидального поведения. Следует отметить, что данные различных исследований крайне редко подтверждают результаты друг друга, продуцируя весьма неоднородную картину, что может быть связано с различными биоинформатическими подходами, различиями в описании фенотипов и дизайне исследования. Дальнейшее накопление данных, особенно с учетом национально-этнического фактора, увеличение объема выборок и метаанализ данных позволят уточнить полигенную природу суицидального поведения и выявить маркеры, ценные не только с точки зрения понимания патогенеза суицидальности, но и с точки зрения предикции и превенции самоубийств.
Полногеномные ассоциативные исследования (ПАИ, полногеномный поиск ассоциаций, genome-wide association studies, GWAS) становятся все более распространенными в самых различных сферах деятельности и областях знаний. Они проводятся в интересах медицины, психологии, индустрии спортивных достижений и даже социологии. Стратегия этих исследований довольно проста – используя существующие и постоянно совершенствующиеся средства для генотипирования, искать и находить ассоциации выявляемых у отдельных индивидуумов генетических маркеров с теми или иными фенотипами (например, с наличием симптомов или диагноза соматического заболевания, психического расстройства, выраженностью психологической черты или свойства, со способностями к выдающимся спортивным достижениям). Отличительная особенность таких исследований – использование стратегии выявления любых ассоциаций, безотносительно патофизиологических или иных теоретических представлений о сущности того или иного фенотипа, после чего обычно следует попытка объяснения ассоциации с тем или иным маркером на основе представления о его функциональной роли и возможной вовлеченности в метаболические, психологические или поведенческие проявления [1]. Это порождает новые представления о глубинных механизмах различных фенотипов, позволяя формулировать новые гипотезы, которые потом подвергаются проверке независимыми средствами (например, по данным оценки транскрипции, аккумуляции белковых продуктов в тканях, метаболической активности или на основе функциональных тестов). Таким образом, накапливаются ценные сведения на стыке биологических процессов и любых иных явлений, включая здоровье, болезни, поведение и т.д. Учитывая различные технические детали, сложности биоинформатического анализа, на практике фактически все обстоит намного сложнее и сопровождается комбинированием различных подходов, например взаимодействием с уже накопленной генетической информацией в различных базах данных. Однако в стратегическом плане все ПАИ построены именно по этому принципу.
В рамках этой стратегии в последнее время проведено несколько исследований применительно к суицидальному поведению (СП), что было недавно обобщено в обзоре (который охватил данные восьми работ, опубликованных до 2014 г.) [2]. За последние годы их число увеличилось. ПАИ различных суицидальных фенотипов являются новым шагом на пути к пониманию генетики суицида, последовавшим вслед за многочисленными работами в рамках стратегии генов-кандидатов, которые очертили круг маркеров, связанных с медиаторными системами мозга, системой стресс-реагирования, регуляторами межклеточных взаимодействий, синаптогенеза и формирования клеточной архитектуры мозга, с некоторыми метаболическими процессами и внутриклеточными сигнальными системами [3–6].
Актуальность изучения генетических механизмов СП определяется тем, что самоубийства во всем мире продолжают расти почти линейно. Эта тенденция не прекращается, в нее вовлекаются все больше стран и регионов, которые ранее не отличались достоверной статистикой и вклад которых был недооценен (Юго-Восточная Азия, Индия, Китай). В последние десятилетия наиболее существенный рост суицидов наблюдается среди молодых людей и подростков [7–9], в отношении которых роль генетических факторов, оказывающих влияние на импульсивность, агрессивность, склонность к эмоциональным нарушениям и когнитивной ригидности, вероятно важнее, чем для лиц пожилого возраста, когда возрастает роль жизненного стресса, соматических заболеваний, ограниченных жизненных перспектив и сознательного выбора. Исследования в области генетики СП направлены в данном случае не только на дальнейшее изучение механизмов аутоагрессии, но и на получение более надежных предикторов суицидальности на уровне генетических маркеров, которые могли бы быть использованы в целях превенции суицида [10, 11].
В настоящем обзоре мы поставили перед собой задачу проанализировать имеющиеся на момент написания ПАИ в области СП, с учетом технических моментов – характеристик контингентов, дизайна исследований, основных методических приемов биоинформатики и анализа данных, а самое главное – конкретных генетических маркеров, которые выявлены в этих исследованиях. Анализ и сопоставление этих маркеров, выявление совпадений или расхождений с проведенными ранее исследованиями генов-кандидатов, объяснение роли генов, ассоциированных с этими маркерами, представляет собой процесс, интересный с эволюционно-психологических и патофизиологических позиций, а также важный в практическом отношении в связи с возможностями использования для целей предикции и превенции. Такой анализ целесообразно начать, кратко описав современные биологические модели СП.
БИОЛОГИЧЕСКИЕ МОДЕЛИ СУИЦИДАЛЬНОГО ПОВЕДЕНИЯ
Самоубийство – очень человеческое явление, в нем сходятся факторы риска и протективные факторы самого различного уровня – от биологических и функциональных особенностей системы стресс-реагирования организма и выраженности тех или иных нарушений психического здоровья до убеждений, ценностей, смыслов и антисуицидальных барьеров личности [12, 13]. В самом общем виде важнейшие факторы риска суицида представлены на рис. 1. Практически все факторы риска имеют под собой биологическую (генетическую) подоснову, разве что за исключением экзистенциальных переживаний. Весьма важно то, что самоубийство совершается чаще всего на фоне того или иного психического или поведенческого расстройства [14, 15]. В связи с этим выявление генетических маркеров собственно СП неминуемо наталкивается на значительное перекрывание с маркерами основных психических расстройств. По депрессии, в частности, генетическая корреляция выявлена по 18 общим генам, среди которых в основном гены серотониновой системы, метаболизма дофамина и норадреналина, ренин-ангиотензиновой системы, системы стресс-реагирования, обмена холестерола, рецептора к эстрогену и ген, связанный с циркадными ритмами [16].
Рис. 1.
Биологические детерминанты факторов риска суицида. Для всех перечисленных факторов могут существовать свои (хотя и скорее всего перекрывающиеся) генетические детерминанты. Двухсторонняя связь со стрессом подчеркивает его роль в усилении генетических влияний.
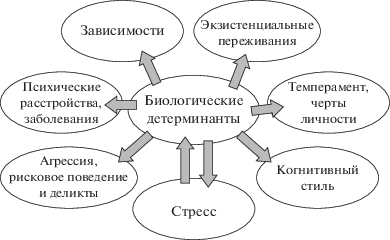
Более того, данные последних лет свидетельствуют о том, что психические нарушения, существенно различающиеся по симптоматике и концептуально оцениваемые психиатрами как самостоятельные нозологические формы, на самом деле зависят от одних и тех же генов. Так, по результатам ПАИ взаимное перекрывание по генетическим маркерам между шизофренией и биполярным аффективным расстройством составляет около 15%, между биполярным расстройством и депрессией – 10%, между шизофренией и депрессией – 9%, а между шизофренией и аутизмом – около 3% [17]. Для всех этих заболеваний просматривается влияние сотен генов, каждый из которых вносит крайне незначительный вклад в риск расстройства [18]. Все это может свидетельствовать о наличии некоей “центральной” уязвимости, которая проявляет себя вариативностью симптомов в силу индивидуально-личностных особенностей отдельных лиц. Это же отчасти объясняет такое явление, как высокая коморбидность многих психических расстройств.
С другой стороны, хотя самоубийство и происходит чаще всего на фоне психического расстройства, оно случается и при его отсутствии – либо как результат сознательного выбора, либо вследствие попадания в непереносимую жизненную ситуацию, когда смерть начинает выглядеть как самая благоприятная альтернатива переживаемому стрессу [12, 19]. Последнее является основанием для признания важнейшей роли стресса жизни как фактора самоубийства, что некоторыми авторами концептуализируется как “усталость от жизни” [20]. С другой стороны, стресс связан сложными взаимоотношениями с психическими расстройствами: произошедшее тяжелое событие в жизни может стать причиной дебюта заболевания и, наоборот, наличие расстройства и осознание этого само по себе является стрессом, усугубляя реагирование на другие события.
В связи с этим в суицидологии постоянно обсуждается вопрос о том, можно ли рассматривать суицидальность (понимаемую как многообразие суицидальных фенотипов – от мыслей и желаний умереть до более конкретных планов, попыток и, наконец, завершенного суицида) как некую самостоятельную форму поведения, а не только как осложнение психических расстройств. Наиболее последовательно отстаивают эти представления авторы, разрабатывающие биологические модели СП, основанные на концепции стресс-уязвимости. Это, прежде всего, модель стресс-диатеза Mann и модель стресс-уязвимости Wasserman [21, 22], а также модели, основанные на раннем эпигенетическом программировании биологических механизмов реагирования на стресс [23, 24].
Согласно модели Mann сущность диатеза заключается в том, что при относительно близких значениях стресса у носителей генетически обусловленной предрасположенности риск самоубийства выше, чем у лиц, не имеющих диатеза [21]. В числе возможных патофизиологических механизмов диатеза обсуждаются особенности метаболизма серотонина, состояние гипоталамо-гипофизарно-адреналовой системы (ГГАС), структурные особенности мозга и дисбалансы его клеточного состава, соотношение серого и белого вещества в префронтальной коре. Эти нарушения связаны с нейропластичностью и нейроанатомическими нарушениями в процессе формирования ЦНС под влиянием негативных стрессовых событий детства (ранней психотравмы). Выявляемые нарушения серотониновой медиации в префронтальной коре, гибель нейронов в гиппокампе, гипертрофия миндалины мозга и нарушения ГГАС являются факторами тревоги, депрессии, зависимостей и посттравматического стрессового расстройства (ПТСР), они также связаны с патопсихическими радикалами личности, непродуктивными когнитивными процессами, гиперреактивностью на негативные социальные стрессовые сигналы, пессимизмом, душевной болью и суицидальными мыслями. Подчеркивается, что очень многие черты стресс-диатеза схожим образом проявляют себя при завершенных самоубийствах и при попытках с тяжелыми медицинскими последствиями [21, 25].
В модели Wasserman стресс также занимает центральное место, однако основным рассматриваемым явлением выступает не факт самоубийства или попытки (событие, поступок), а суицидальный процесс, представляющий собой развертывание суицидальных событий во времени [22, 26]. Стресс-уязвимость в данной модели противопоставляется стресс-устойчивости, ведущими компонентами которой также являются биологические механизмы как следствие генетических предиспозиций и как качества, приобретенные в результате позитивного прохождения ранних периодов развития. Факторы риска включают в себя стрессовые события длительного действия (проблемы взаимоотношений, социальный стресс, соматические и психические расстройства) и триггеры суицидального поведения, играющие роль “последней капли” [22, 26].
В самом общем виде основные элементы модели стресс-уязвимости могут быть проиллюстрированы схемой, представленной на рис. 2. В настоящее время биологическое понимание стресс-уязвимости, обусловленное генетическими факторами, как исходно присущими индивиду, так и актуализированными под влиянием травматического опыта раннего детства (инкубированная травма), в той или иной форме входит в структуру практически всех концепций суицида – модели суицидального стиля Rudd [27], интерперсональной теории Joiner [28], теории импульсивной агрессии Brent и соавт. [29], трехкомпонентной теории боли Klonski и May [30]. Такого понимания суицида придерживаются даже наиболее психологически ориентированные авторы, утверждая, что лучше всего объясняют суицид “биологически ориентированные модели стресс-уязвимости с акцентом на когнитивные процессы” [31]. Эти теоретические построения наиболее логично объясняют суицид в юношеском и молодом возрасте [32].
Рис. 2.
Формирование уязвимого фенотипа (стресс-уязвимости, инкубированной травмы) является следствием нескольких факторов: носительства предрасполагающих генов, ранних травмирующих событий, а также взаимодействия генов и среды. При этом важно учитывать период такого взаимодействия (G × E × T) или стадию развития организма и мозговых структур (G × E × D). Взаимодействие генов и среды возможно как на уровне модерации генами эффектов среды (когда уязвимость проявляется только в высокострессовой среде), так и на уровне поведенческого выбора индивидом высокострессовой или психологически предпочитаемой среды на разных этапах взросления (ковариация генов и среды, rGE) [24].
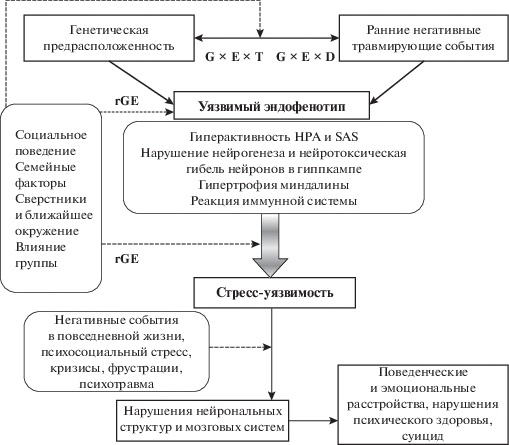
В последнее время появились работы, которые пытаются объяснить когнитивные нарушения, характерные для суицидентов (ошибки и ригидность мышления, оценка мнимых и реальных опасностей, проблемы при принятии решений, неспособность видеть варианты, оценка вероятности немедленного или отсроченного вознаграждения или наказания), также с биологических позиций. С этой целью используются данные нейровизуализации, позволяющие оценить нейроанатомические особенности жертв суицида. Так, результаты исследований говорят о снижении объема серого и изменениях плотности белого вещества, нарушениях нейрон-глиальных и синаптических соотношений, о нарушенной динамике синаптических процессов, что может свидетельствовать об изменениях интенсивности потоков импульсов между важнейшими мозговыми структурами [33]. Эти структурные изменения объясняются нейропластическими явлениями и их нарушениями в процессе развития под влиянием стрессовых событий, причем в механизмах фиксации этих изменений, по-видимому, большую роль играют эпигенетические явления, индуцированные стрессовыми гормонами [34, 35]. Эпигенетика, особенно с учетом наследуемости и закрепления поведенческих и психопатологических фенотипов под влиянием все усиливающегося стрессового давления среды, является наиболее приемлемым объяснением роста психопатологий и суицидов в последние десятилетия [24].
Краткий анализ основных биологических моделей суицида указывает на решающую роль стресса в патогенезе суицидального поведения, что, с одной стороны, привлекает внимание ко всем генетическим маркерам нейроэндокринных систем стресс-реагирования, а с другой, подразумевает возможность вовлечения самых разнообразных систем и процессов в организме, учитывая системный характер стресс-реакции.
АНАЛИЗ ГЕНЕТИЧЕСКИХ МАРКЕРОВ СУИЦИДАЛЬНОСТИ ПО ДАННЫМ ПАИ
Рассмотрим все опубликованные на настоящее время работы, использующие стратегию ПАИ, с точки зрения дизайна, методологии и полученных результатов. Нами в сетевом ресурсе https://www.ncbi.nlm.nih.gov/pubmed на момент написания данного обзора выявлено 15 отдельных исследований, соответствующих словосочетаниям Genome Wide Association Study, GWAS, suicide, suicidal behavior, suicidal ideation, suicide attempt, completed suicide. Приступая к этой работе, необходимо отметить, что согласно обзору [2] по способу биоинформационного анализа получаемой информации все ПАИ используют три основных приема: 1) классический вариант “однонуклеотидный полиморфизм (ОНП) один за одним” (“SNP by SNP”); 2) анализ с учетом гетерогенности ОНП в пределах отдельных генов (gene-wide); и 3) анализ с учетом полигенной природы сложных фенотипов на основе сетевых методов, например белок-белковых взаимодействий или путем группирования генов с использованием ранее накопленных представлений о патофизиологии фенотипа и его эндофенотипах [2]. Имеющиеся в литературе данные дают возможность оценить каждый из приемов анализа. Выявленные ассоциации сведены в табл. 1. Источником сведений о функциональной роли упоминаемых генов служили ресурсы https://www.genecards.or, https://www.ncbi.nlm.nih.gov/gene/, https://www.uniprot.org.
Таблица 1.
Ассоциации ОНП и близких к ним генов с различными суицидальными фенотипами по данным полногеномных ассоциативных исследований (ПАИ, GWAS)
| № | Авторы | Ассоциации (rs) | Ген | Функция | Примечание |
|---|---|---|---|---|---|
| 1 | Laje et al. [36] | rs11628713 | PALPN | Папилин, протеогликан-подобный сульфатированный гликопротеин, компонент внеклеточного матрикса | p < 0.05 |
| rs10903034 | IL28RA | Альфа-субъединица рецептора к интерлейкину 28, компонент иммунной системы | Предположительно | ||
| 2 | Perroud et al. [37] | rs11143230 | GDA | Гуаниндеаминаза, гидролизует гуанин до ксантина с выделением аммиака | Пиковая ассоциация |
| rs358592 | KCNIP4 | Са-связывающий белок из состава потенциал-зависимого калиевого канала, фактор регуляции нейрональной возбудимости | У пациентов, получающих эсциталопрам | ||
| rs4732812 | ELP3 | Гистон-ацетилтрансферазная субъединица РНК-полимеразы II, фактор нейрональных взаимодействий, мишень эпигенетического метилирования | То же | ||
| rs2707159 | APOO | Аполипопротеин О, член семейства аполипопротеинов, участвует в транспорте и метаболизме липидов | » | ||
| rs2846685 | RICS | Нейрон-специфический протеин, активирует GTPазу, фактор структурирования дендритов | » | ||
| rs1822420, rs10868235 |
NTRK2 | Тирозин-специфическая протеинкиназа 2, каталитический рецептор нейротрофинов, важнейший регулятор внутриклеточных сигнальных каскадов | Дополнительный анализ генов-кандидатов | ||
| rs4533619, rs747455 |
CCK | Холецистокинин, предшественник вариантов гормона, регулирует аппетит, кислотность желудка и нейрональную активность | То же | ||
| rs17625475 | YWHAE | Тирозин-3/триптофан-5-монооксигеназа-активирующий белок эпсилон, медиатор различных сигнальных систем, связанных с клеточным делением, апоптозом и др. | » | ||
| rs2240401 | CRHR2 | Рецептор к кортикотропин-релизинг-гормону 2, ключевой компонент системы стресс-реагирования | » | ||
| rs1905248, rs12424271 |
SCN8A | Субъединица потенциал-зависимого натриевого канала, ионная пора, ответственная за быструю деполяризацию мембран нейроцитов | » | ||
| 3 | Menke et al. [38] | rs1037448 | TMEM138 | Трансмембранный протеин 138, мутации в этом гене связаны с синдромом Жубера, который сопровождается нарушениями в процессе развития мозга | |
| 3 | Menke et al.[38] | rs10997044 | CTNNA3 | Белок семейства винкулина/альфа-катенина, участвует в регуляции межклеточных взаимодействий | |
| rs1109089, rs2074997, rs2299965, rs2299967, rs6948196, rs965118 |
RHEB | GTP-связывающий белок, член суперсемейства Ras, экспрессируется во всех тканях у позвоночных животных, участвует в регуляции клеточного цикла, усиленно экспрессируется во многих человеческих карциномах | |||
| rs4939517 | CYBASC3 | Член семейства цитохромов b561 – трансмембранный белок, обладает аскорбат-зависимой оксидоредуктазной активностью | |||
| rs9480684 | AIM1 | Бета-гамма кристаллин домен-содержащий белок, входит в состав хрусталика глаза | |||
| 4 | Schosser et al. [39] | rs4751955 | GFRA1 | Рецепторный белок, выступает в роли рецептора нескольких нейротрофинов (GDNF и NTN) | Не подтверждено |
| rs203136 | KIAA1244 | Брефелдин, А-ингибированный гуанин-нуклеотид-обмениваемый протеин-3, участвует в системной регуляции гомеостаза глюкозы, ингибирует биогенез инсулиновых гранул в бета-клетках поджелудочной железы | То же | ||
| rs12751302 | RGS18 | Регулятор G-белок-зависимой сигнальной системы 18, тормозит систему G-белков путем активации GTPазы | » | ||
| rs10868235 | NTRK2 | См. выше | |||
| 5 | Perlis et al. [40] | rs1466846 | Интергенный | – | Пиковая ассоциация |
| rs2576377 | ABI3BP | Член семейства ABI связывающий белок 3, обладает способностью связывать гепарин и глюкозамингликан | Не подтверждено | ||
| rs4918918 | SORBS1 | Сорбин и SH3-домен-содержащий протеин, член семейства белков-адаптеров, которые регулируют клеточную адгезию, эффекты нейротрофинов и формирование цитоскелета | Предположительно | ||
| rs10854398 | B3GALT5 | Бета-1,3-N-лактозилтрансфераза 5, член семейства мембранных гликопротеинов, участвует в гликозилировании мембранных белков нейроцитов | То же | ||
| rs1360550 | PRKCE | Протеинкиназа C, тип эпсилон, участвует в регуляции множества внутриклеточных процессов, связанных с цитоскелетом, включая клеточную адгезию, подвижность, миграцию, рост отростков, активность ионных каналов, иммунный ответ, канцерогенез и апоптоз | » | ||
| 6 | Willour et al. [41] | rs300774 | SH3YL1 | SH3 домен-содержащий YSC84-подобный протеин 1, участвует в регуляции складчатости клеточной мембраны | Предположительно. Указанный полиморфизм расположен в большом неравновесном блоке, содержащем три приведенных гена |
| ACP1 | Кислая фосфатаза, низкомолекулярный цитоплазматический фермент, участвует во множестве процессов, расщепляя фосфорные эфиры | То же | |||
| FAM150B | Лиганд рецепторных тирозинкиназ ALK (киназа анапластической лимфомы). Активация ALK-сигнальной системы связана с клеточной пролиферацией и трансформацией | » | |||
| 7 | Mullins et al. [43] | – | – | – | – |
| 8 | Zai et al. [46] | Ряд маркеров на 8q12 | PENK | Проэнкефалин, источник ряда энкефалинов, участвующих в блокировании боли и реагировании на стресс | Усиление суицидальных мыслей |
| Ряд маркеров на 10p11.2 | CCDC7 | Белок, содержащий два кольцевых домена, возможно участвует в работе кинетосом | То же | ||
| Ряд маркеров на 8q12-q21 | IL7 | Интерлейкин 7, лимфопоэтический фактор роста, регулятор лимфопоэза | Суицидальная попытка | ||
| Ряд маркеров на 18q22 | TMX3 | Относящийся к тиоредоксинам трансмембранный протеин-3, участвует в тиол-дисульфидном обмене и поддержании структуры клеточных белков | То же | ||
| 9 | Sokolowski et al. [47] | 750 генов по данным анализа 660 семей | BDNF | Нейротрофический фактор мозгового происхождения, важнейший фактор нейропластичности, участвует в созревании и росте нейроцитов, синаптогенезе | Ранее показана ассоциация с суицидальностью |
| 590 генов после сопоставления с базами PGC | CDH9, CDH10, CDH12, CDH13 |
Белки семейства кадгеринов, основные молекулы клеточной адгезии, участвуют в межклеточных взаимодействиях | То же | ||
| CREB1 | Транскрипционный фактор, связываясь с ДНК, стимулирует транскрипцию, реализуя эффекты гормонов, замыкающихся на сАМР | » | |||
| DLK1, DLK2 | Трансмембранные белки, принадлежащие к семейству эпидермального ростового фактора, регулируют клеточную дифференцировку и пролиферацию | » | |||
| 9 | 590 генов после сопоставления с базами PGC | EFEMP1 | Белок из семейства фибулинов, гликопротеин экстрацеллюлярного матрикса | » | |
| FOXN3 | Forkhead/winged helix transcription factor family, участвует в устранении ошибок при транскрипции (?) | » | |||
| IL2 | Интерлейкин 2, медиатор воспаления и иммунитета | » | |||
| LSAMP | Мембранный протеин, ассоциированный с лимбической системой, молекула адгезии, участвует в целеуказании для отростков нейронов при развитии ЦНС | » | |||
| NCAM1 | Молекула адгезии нейроцитов из семейства иммуноглобулинов, участвует в формировании нервных структур | » | |||
| NGF | Фактор роста нервов, поддерживает жизнеспособность, развитие и активность нейронов | » | |||
| NTRK2 | См. выше | » | |||
| TBC1D1 | Член семейства белков, содержащих ТВС-домен, участвует в регуляции клеточного роста и дифференцировки | » | |||
| 10 | Erlangsen et al. [50] | rs6880062 | Суицидальная попытка | ||
| rs6880461 | То же | ||||
| rs4809706 | Хромосома 20 | ||||
| rs4810824 | То же | ||||
| rs6019297 | » | ||||
| Нет данных | PDE4B | Фосфодиэстераза 4В, влияет на внутриклеточный сигнал, снижая концентрацию сАМР | По результатам анализа подгруппы с аффективными расстройствами | ||
| 11 | Bani-Fatemi et al. [51] | rs12895203 | FUT8 | Фукозилтрансфераза 8, участвует в гликозилировании белков | Ассоциация с суицидальной попыткой |
| Rs7897059 | CAMK1D | Кальций/кальмодулин-зависимая протеинкиназа, тип 1D, вариант 2, участвует в регуляции функций гранулоцитов хемокинами | Взаимодействие с ранней травмой | ||
| 12 | Stein et al. [54] | Множество СНП, пик – rs12524136-T | MRAP2 | Протеин, дополняющий рецептор к меланокортину 2, модулирует работу рецептора | Хромосома 6, европейцы |
| CEP162 | Центросомный протеин 162, во взаимодействии с микротрубочками участвует в работе ресничек | То же | |||
| 13 | Kimbrel et al. [55] | rs11762112, rs79324256 и еще 23 SNP |
KCNMB2 | Регуляторная бета-субъединица Са-зависимого калиевого канала, подсемейство М | |
| rs6441552, rs975536 |
ABI3BP | Связывающий протеин, член семейства ABI, мембранный экстрацеллюлярный белок, участвует в организации внеклеточного матрикса | По данным репликационного анализа | ||
| 14 | Galfalvy et al. [56] | rs1387381, rs8054845 |
CDH13 | Кадгерин 13, H-кадгерин, член семейства основных Са-зависимых гомофильных регуляторов клеточной адгезии, тормозит рост аксонов при дифференцировке | Всего 58 статистически значимых SNP, из них 22 локализованы в (или рядом) с 19 генами |
| rs3811966 | NPR3 | Натрийуретический пептидный рецептор С/гуанилатциклаза С, участвует в регуляции объема крови и артериального давления | |||
| rs10512596 | CD300LB | CD300 антиген-подобный белок, член семейства b, неклассический рецептор иммуноглобулинов | |||
| rs373655 | FOXN3 | См. выше | |||
| rs1073179 | DISC1 | “Нарушенный при шизофрении”, участвует в созревании мозга | |||
| rs936306 | CYP19A1 | Цитохром P450, семейство 19, подсемейство A, полипептид 1, связан с дефицитом ароматазы | |||
| rs1999240 | MYO3A | Миозин IIIA, сократительный белок с протеинкиназной активностью, необходим для нормального развития волосковых клеток слуховой системы и вестибулярного аппарата | |||
| rs3767206 | SFRS11 | Обогащенный серином/аргинином сплайсинг-фактор, участвует в трансформациях РНК | |||
| rs10511351 | LSAMP | См. выше | |||
| rs1790695 | DSC2 | Десмоколлин 2, Ca-зависимый гликопротеид, главный компонент десмосом, участвует в клеточной адгезии | |||
| rs1970121 | SPTLC1 | Сериновая пальмитоилтрансфераза, длинноцепочечная субьединица 1, ключевой фермент синтеза сфинголипидов | |||
| rs63953 | ACCN1 | Амилорид-чувствительный катионный канал 1, (дегенерин) | |||
| 14 | Galfalvy et al. [56] | rs10515470 | FLJ23312 | Гипотетический белок | |
| rs4771992, rs4441122 |
MBNL2 | Muscleblind-like 2, регулятор сплайсинга | |||
| rs1467558 | CD44 | Интегральный клеточный гликопротеин, играет важную роль в межклеточных взаимодействиях, клеточной адгезии и миграции, рецептор гиалуроновой кислоты | |||
| rs9324313 | TUBGCP3 | Комплекс 3, компонент гамма-тубулина, важнейшего элемента цитоскелета | |||
| rs6462430, rs2392147 |
KBTBD2 | Kelch-повторы и BTB-содержащий белок, возможно вовлечен в патогенез инсулиновой резистентности и диабета | |||
| rs6469916 | COL14A1 | Коллаген, тип XIV, альфа 1 (ундулин), участвует в построении коллагеновых пучков | |||
| rs1039959 | MARCH1 | Убиквитин-протеинлигаза, участвует в убиквитинировании белков, играет роль при формировании дендритов | |||
| 15 | Galfalvy et al. [57] | rs11852984 | Интергенный | Сравнение суицидов/попыток с несуицидами и умершими от др. причин | |
| rs6480463 | ADAMTS14 | Дезинтегрин, металлопротеиназа с тромбоспондиновым мотивом, участвует в синтезе коллагена | То же | ||
| rs4575 | PSME2/RNF31 | Протеасомный активатор, субъединица 2, участвует в иммунном ответе | » | ||
| rs336284 | TBX20 | Транскрипционный фактор, член T-Box семейства, участвует в морфогенезе сердца и ствола мозга | » | ||
| rs3019286 | STK3 | Серин/треониновая протеинкиназа, участвует в регуляции апоптоза, тормозит пролиферацию и рост опухолей | » | ||
| rs4308128, rs1374268 |
DPP10 | Дипептидилпептидаза 10, регулирует активность потенциал-зависимого К-канала (мутации в этом гене ассоциированы с астмой) | Сравнение пациентов с депрессией с попыткой и без | ||
| rs1865361 | LOC729911 | Гипотетический белок | То же | ||
| rs1530609 | STK32B | Серин/треониновая протеинкиназа 32В | » | ||
| rs10997260 | CTNNA3 | См. выше | » |
В работе Laje et al. (вышла в 2009 г.) ПАИ касалось суицидальных мыслей, возникающих в процессе лечения пациентов с депрессией селективным ингибитором обратного захвата серотонина циталопрамом [36]. Ранее авторы установили связь этого редкого, но крайне неблагоприятного для врача и пациента, осложнения с маркерами в генах GRIK2 и GRIA3, кодирующими субъединицы глутаматного рецептора. В продолжение этих исследований 90 пациентов, сообщивших о наличии суицидальных мыслей к концу 14-й нед. лечения, были сопоставлены с аналогичной группой пациентов без данного симптома, анализ был проведен по 109 365 ОНП по схеме “один ОНП за другим”. В качестве маркера суицидальных мыслей был использован ответ на единственный вопрос из опросника Quick Inventory of Depressive Symptomatology. В результате выявлены ассоциации с ОНП в гене PALPN, кодирующем клеточный гликопротеин, и на грани достоверности – с геном IL28RA, кодирующим субъединицу рецептора к интерлейкину 28, который участвует в реакции на вирусную инвазию [36].
Работа Perroud et al. (2012 г.) во многом напоминает предыдущую, объектом исследования выступали пациенты с депрессией, получающие эсциталопрам и нортриптилин, которые на 12-й нед. лечения отметили усиление суицидальных мыслей [37]. Степень депрессии в данном случае оценивали с помощью сразу нескольких шкал – Гамильтона, Бека и Монтгомери–Асберг, каждая из которых содержит вопрос о суицидальных мыслях [37]. В анализе использовано более чем 500 тыс. ОНП. Из 811 пациентов 244 сообщили об усилении суицидальных переживаний, с этим обстоятельством сильнее всего был ассоциирован полиморфизм, близкий к гену гуаниндеаминазы; кроме того, у пациентов, получающих эсциталопрам, было найдено взаимодействие с геном регуляторной субъединицы потенциал-зависимого калиевого канала и с геном, кодирующим белок, входящий в комплекс ДНК-зависимой РНК-полимеразы (KCNIP4 и ELP3), а также с генами, кодирующими аполипопротеин О и белок, участвующий в регуляции роста аксонов нейроцитов (APOO и RICS) [37]. После дополнительного анализа генов-кандидатов были выявлены ассоциации еще с рядом генов, а именно NTRK2, CCK, YWHAE, SCN8A и CRHR2 (табл. 1).
Третьим исследованием, в котором в качестве фенотипа также выступали суицидальные мысли, стала работа Menke et al., опубликованная в 2012 г. [38]. В исследовании приняли участие 394 пациента с депрессией, из которых 32 отметили актуализацию суицидальных мыслей (по результатам ответа на один вопрос шкалы депрессии Гамильтона), их сравнивали с теми, кто не имел этого симптома (329 человек), а также с подгруппой, у которой суицидальных мыслей не было никогда (79 человек). С целью подтверждения данных основной группы использовали независимую клиническую когорту (501 пациент) [38]. Анализ основной группы (по 371 335 SNP) не выявил никаких ассоциаций, однако проверка 79 ОНП на данных независимой группы выявила ассоциацию с генами TMEM138, CTNNA3, RHEB, CYBASC3 и AIMI; кроме того, ряд сильных ассоциаций был с ОНП из некодирующих межгенных участков [38]. Результаты работы Laje et al. [36] не были подтверждены, однако получили подтверждение ассоциации с GDA из работы [37], а также с SNPs в FKBP5 и ABCB1 из других исследований, посвященных нейропсихиатрическим расстройствам [38].
Таким образом, исследования, направленные на установление генетических предикторов актуализации суицидальных переживаний на фоне лечения антидепрессантами пациентов с аффективными расстройствами, не подтвердили находки друг друга и не привели к установлению надежных маркеров. В то же время они внесли свой вклад, как указав на уже известные гены, так и очертив круг новых. Следует отметить, что главные задачи всех этих исследований лежали в сфере фармакогеномики, суицидальность была в данном случае побочным фенотипом, соответственно оценка суицидальных мыслей была весьма упрощенной, а набор ОНП был ограничен. В связи с этим больший интерес представляют исследования, в которых фенотипом выступала суицидальная попытка, т.е. поведенческий компонент.
В этом отношении характерна работа Schosser et al. (2011 г.), в которой проведено генотипирование 2023 пациентов с биполярным расстройством. Суицидальные тенденции оценивали на основании отдельных вопросов из SCAN-интервью (Schedules for Clinical Assessment in Neuropsychiatry); кроме того, отдельно анализировали группу (251 пациент) с “серьезными суицидальными попытками в анамнезе”, для конфирматорного анализа использовали группы пациентов из аналогичных исследований. Общее число маркеров составило более 500 тыс., анализ осуществляли по схеме “один ОНП за другим”. На начальном этапе были выявлены ассоциации суицидальных мыслей с GFRA1 – рецептором к нейротрофину GDRA (табл. 1). Суицидальная попытка была связана с ОНП в KIAA1244 и RGS18, однако на конфирматорной стадии ассоциации не были подтверждены. Кроме того, на основании дополнительного анализа генов-кандидатов при сопоставлении различных когорт были найдены ассоциации с HTR1A, CCK, RGS18, NTRK2 и SCN8A, однако только в отношении rs10868235 из NTRK2 ассоциация подтвердилась при метаанализе (табл. 1). Авторы в заключение отмечают, что суицидальное поведение зависит от множества генов, каждый из которых оказывает слабое влияние на исследуемый признак, и высказывают мнение о необходимости увеличения объема выборок.
Работа Perlis et al. (исторически опубликованная одной из первых, еще в 2010 г.) построена по аналогичному принципу: авторы воспользовались данными нескольких крупных когорт пациентов с расстройствами аффективной сферы (всего 5815 лиц с биполярным расстройством и 2922 человека с большим депрессивным расстройством), учитываемым событием была суицидальная попытка в течение жизни, число ОНП составило около 2 млн, тип анализа – “один за другим” [40]. Наиболее сильный сигнал получен от полиморфизма rs1466846, не связанного ни с одним геном; кроме того, в одной из исследованных когорт (с биполярным расстройством) найдена ассоциация с геном ABI3BP, которая не была подтверждена на конфирматорном этапе, а также еще с рядом генов (табл. 1). Кроме того, дополнительный анализ 19 генов-кандидатов, ранее изученных в связи с суицидальным поведением, подтвердил ассоциации с FKBP5 и NGFR [40]. Авторы также подчеркивают, что суицидальное поведение определяется множеством генетических влияний с незначительным вкладом каждого из них.
В работе Willour et al. (опубликована в 2012 г.) объектом исследования также были пациенты с биполярным расстройством (использованы те же контингенты, что и в работе [40]), сравнивали генотипы 1201 пациента с историей суицидальной попытки с 1497 пациентами без попыток, анализу подвергали более чем 500 тыс. ОНП [41]. Изначально было выявлено 2507 ОНП на уровне p < < 0.001, однако на независимом контингенте они не были подтверждены. Тем не менее в метаанализе выявлена ассоциация с rs300774, который локализован в интергенном участке на коротком плече 2-й хромосомы, содержащем три гена – SH3YL1, ACP1 и FAM150B [41]. Sokolowsky et al. [2] в своем обзоре обращают внимание на то, что на этом участке по другим данным также наблюдается неравновесное сцепление при суицидальных попытках [42]. Сами авторы работы подчеркивают, что кислая фосфатаза, кодируемая геном ACP1, участвует в регуляции внутриклеточного сигнального Wnt-пути, который в том числе является мишенью для лития. Они также считают необходимым исследовать еще большие контингенты для подтверждения ключевой роли генов на коротком плече хромосомы 2 [41].
Работа Mullins et al. (вышла в 2014 г.) в значительной степени напоминает все предыдущие, однако представляет собой шаг вперед с точки зрения аналитического подхода [43]. В работе использованы данные нескольких когорт (в том числе использованных в ранее упомянутых публикациях [37, 39]), все они представлены пациентами, вошедшими в фармакогенетические исследования эффективности антидепрессантов, общим числом 3300 человек. Особенностью данного исследования является применение метода оценки полигенного риска (polygenic risk assessment) [44, 45]. Авторы получили эти оценки для каждой исследованной когорты и протестировали, насколько они способны предсказывать суицидальные мысли и попытки в проверочной когорте. Кроме того, были использованы данные Psychiatric Genomics Consortium (PGC) по большому депрессивному расстройству, биполярному расстройству и шизофрении с целью оценки взаимного перекрывания между этими расстройствами и суицидальными фенотипами. Полученные данные свидетельствуют в пользу плейотропии между психическими расстройствами и суицидальными мыслями, в то время как суицидальная попытка, судя по всему, является следствием независимого диатеза [43]. Самое показательное в данной работе то, что несмотря на прогрессивный статистический подход и проведенный метаанализ никаких ассоциаций с теми или иными генетическими маркерами выявлено не было [43].
Все вышеперечисленные исследования имеют один общий недостаток – они в качестве суицидального фенотипа фиксируют лишь факт наличия суицидальных мыслей без возможности учета их тяжести. То же касается суицидальных попыток – нет никаких сведений о давности этого события (как правило, это факт попытки в течение жизни), а также о степени тяжести полученных повреждений, что в определенной степени отражает намеренность суицидального акта. Все это означает слишком большую неопределенность в описании фенотипа, что, несомненно, вносит негативный вклад в возможность выявления ассоциаций. В этом отношении интересна работа Zai et al. [46]. В данной работе обследованы 212 семей с биполярным расстройством с использованием полуструктурированного интервью по DSM-IV, в рамках которого оценивали наличие суицидальных мыслей пассивного и активного характера, а также факт суицидальной попытки [46]. Кроме того, в работе использованы еще две когорты пациентов с биполярным расстройством из параллельных проектов. В качестве референтной базы были также использованы данные 1000 Genome Project. В ходе анализа не удалось подтвердить ни одной ассоциации, ранее выявленных для когорт с биполярным расстройством, однако были найдены маркеры, ассоциированные с нарастанием тяжести суицидальных проявлений. В частности, обнаружены ассоциации на малом плече 8-й хромосомы (8q12), вблизи гена проеэнкефалина PENK и на большом плече 10-й хромосомы (10p11.2), где локализован ген CCDC7. В отношении суицидальной попытки найдены две ассоциации – на 8-й хромосоме (8q12-q21), вблизи гена IL7 и на 18-й хромосоме (18q22) вблизи гена TMX3 [46].
Особый интерес в связи с предыдущими исследованиями представляет работа Sokolowski et al. (опубликована в 2016 г.) [47]. В данной работе, в отличие от всех предыдущих, выборка представляла собой специально собранную группу – полные семьи, в которых пробанд совершил попытку определенной степени тяжести (по медицинским последствиям), причем с оценкой намеренности данного акта и целого ряда психологических и психиатрических характеристик личности суицидента. Данное исследование, известно как GISS, ранее выявило ряд важных ассоциаций, в частности с SCN8A, VAMP4 и CRHR1 на уровне анализа генов-кандидатов [48, 49]. В настоящей работе 660 семей с суицидальным пробандом были впервые использованы для масштабного ПАИ на семейном уровне, причем производилась оценка полигенных рисков для исследуемых пациентов. На первом этапе было выявлено и подтверждено 750 (!) генов, преимущественно имеющих отношение к процессам развития и формирования ЦНС, причем это были ассоциации именно с суицидальной попыткой, но не с психиатрическими диагнозами (которые в данной когорте были представлены главным образом зависимостями, депрессией, расстройствами адаптации, ПТСР и шизофренией). Кроме того, были использованы два дополнительных источника информации, а именно данные PGC, посвященные шизофрении, пограничному расстройству личности и биполярному расстройству. Были охарактеризованы ассоциации, общие для шизофрении и субъектов с суицидальной попыткой, как с диагнозами, так и без таковых. По основному комплексу гистосовместимости взаимного перекрывания не было, но при этом было выявлено общих 590 генов, связанных с формированием ЦНС. Среди них, в том числе, присутствовали 16 ранее хорошо изученных при суицидальном поведении генов, задействованных в процессах клеточной адгезии и миграции, в работе малых GTPаз и сигнальных внутриклеточных систем с участием рецепторных тирозинкиназ (BDNF, CDH10, CDH12, CDH13, CDH9, CREB1, DLK1, DLK2, EFEMP1, FOXN3, IL2, LSAMP, NCAM1, NGF, NTRK2 и TBC1D1) [47]. Авторы на основании использованного подхода приходят к выводу, что суицидальное поведение обусловлено значительным числом генов, с широким участием факторов, ответственных за процессы развития нервной ткани, причем эти механизмы наследования проявляют себя в отсутствии психических расстройств [47]. Особенностью данного исследования является то, что в нем применены несколько биоинформатических приемов, в частности оценка полигенного риска, гармонизация с базами данных по психическим расстройствам, анализ “внутригенных” СНП с сопоставлением с набором генов, преимущественно важных для ЦНС из ресурса Allen Brain Atlas (http:// www.brain-map.org), анализ обогащения по функциональной принадлежности (рathway cluster enrichment analysis) и использование данных белок-белковых взаимодействий [47]. Благодаря этим приемам были впервые идентифицированы ряд генов и подтверждены ранее изученные при суицидальном поведении (табл. 1) и показано взаимное перекрывание по ряду факторов между СП без диагнозов и полигенами, выявляемыми при шизофрении и аффективных расстройствах. Авторы характеризуют свой подход как сочетание ассоциаций на основе оценки полигенного риска со стратегией формирования гипотез на основе патофизиологических представлений о суицидальном поведении [47].
Интересна также работа Erlangsen et al., опубликованная в 2018 г., она представляет собой пример наиболее крупного ПАИ, посвященного СП. Авторы использовали данные всех лиц, рожденных в Дании после 1981 г. и получивших серьезный психиатрический диагноз до 2013 г. (всего 57 377 человек), в качестве контроля использована группа из общей популяции. В анализ вошли 6024 пациента, совершавших суицидальные попытки, которые сравнивались с 44 240 контролями без попыток в анамнезе [50]. Были найдены ассоциации суицидальной попытки с SNPs rs6880062 и rs6880461. После учета наличия психического расстройства были выявлены еще три достоверные ассоциации, все на хромосоме 20 (табл. 1). Кроме того, в подгруппе с аффективными расстройствами и с суицидальной попыткой была обнаружена ассоциация с геном PDE4B. Все ОНП отвечают за 4.6% [CI-95: 2.9–6.3%] вариабельности суицидальной попытки. При учете психических расстройств наследуемость снижается до 1.9% [CI-95: 0.3–3.5%]. Аффективные расстройства и расстройства аутистического спектра демонстрировали ОНП-наследуемость соответственно в пределах 5.6% [CI-95: 1.9–9.3%] и 9.6% [CI-95: 1.1–18.1%]. Авторы заключают, что их масштабное (практически наиболее крупное на данный момент) исследование, выявившее ассоциации ОНП с суицидальной попыткой, свидетельствует в пользу наследуемости СП, которое не зависит от наследования психических расстройств [50].
Исследование Bani-Fatemi et al. (опубликовано в 2016 г.) посвящено изучению генетических маркеров суицидального поведения при шизофрении [51]. Следует отметить, что суицидальное поведение при этой патологии (с частотой 5–9%) имеет свою специфику, связанную как с факторами риска (синдром и тяжесть заболевания, обострение, побочные эффекты антипсихотиков), так и с самим характером попыток и смертельных случаев (своеобразие мотивов, порой вычурность методов и т.д.) [52]. Пациенты (121 человек) отвечали на вопросы Колумбийской шкалы тяжести суицидальных проявлений и Шкалы суицидальных мыслей Бека, для генотипирования использован чип на 1.205 тыс. зондов, 53 пациента с историей суицидальной попытки сравнивали с 68 пациентами, не имевших попытки. Оценивали также взаимодействие ОНП с выраженностью травмы в детском возрасте. Ни один из вариантов не достигал достоверности после поправки на множественное сравнение (multiple test correction). Тем не менее выявлены две значимые ассоциации с ОНП в основной модели (суицидальная попытка, OR = 3.91) и во взаимодействии с психотравмой детства (OR = 1.13) (табл. 1). Авторы считают, что полученные данные могут быть полезны для предсказания риска суицида у пациентов с шизофренией [51].
Два исследования [54, 55] касаются специфического контингента – военнослужащих, они выполнены в рамках масштабного изучения факторов риска суицида (ARMYSTARRS), которое было проведено после беспрецедентного роста суицидов в армии США, в результате чего впервые в истории вооруженных сил уровень самоубийств среди военнослужащих превысил таковой в общей популяции [54]. Это работа Stein et al. (опубликована в 2017 г.), в которой на контингенте обычных военнослужащих (473 человека) и 9778 контролей, с участием 135 военнослужащих и 6879 контролей в качестве контингента репликации, а также клинического контингента (51 случай суицидальных попыток и 112 контролей к нему) осуществлено ПАИ с суицидальной попыткой в качестве фенотипа. Особенностью исследования является дифференцированная оценка на основе логистической модели отдельно для трех этнических групп – европейцев, африканцев и латиноамериканцев [54]. В качестве инструмента оценки суицидального поведения использована Колумбийская шкала. Использованы чипы на 664 457 ОНП Illumina OmniExpress array и на 360 704 ОНП (PsychChip), применены классический полногеномный ассоциативный подход “SNP by SNP” и метод оценки полигенных рисков. В метаанализе всех представителей европеоидной расы найдена ассоциация суицидальной попытки с маркерами вблизи MRAP2 и CEP162 (табл. 1), в частности было выявлено 12 полногеномно значимых маркеров в регионе с центром на rs12524136-T. Эти находки не были подтверждены при анализе репликационных контингентов. Тем не менее ассоциация с пиковым ОНП оставалась значимой при метаанализе всех групп (OR = 2.18, 95% CI 1.70, 2.80). Расчет полигенного риска выявил взаимосвязь суицидальной попытки с биполярным расстройством. Авторы обращают особое внимание на ген MRAP2, экспрессируемый в мозге и коре надпочечников, как на возможный маркер суицидального поведения. Продукт данного гена, модулирующий работу рецептора к меланокортину, вовлечен в механизмы контроля энергетического обмена [54].
Работа Kimbrel et al. (опубликована в 2018 г.) посвящена ПАИ суицидальной попытки и суицидальных мыслей у ветеранов, побывавших в условиях боевых действий [55]. С суицидальной попыткой теснее всего оказался связан ген KCNMB2, продукт которого (субъединица Са-зависимого калиевого канала) участвует в механизмах нейрональной возбудимости. Кроме того, получены данные о вовлеченности гена АBI3BP, для которого обнаружены многочисленные ассоциации как с суицидальной попыткой, так и с суицидальными мыслями (табл. 1) [55].
Единственными работами, в которых осуществлено ПАИ применительно к завершенному самоубийству, являются на сегодняшний день исследования Galfalvy et al. (опубликовано в 2013 г. как пилотное исследование, в более полном варианте в 2015 г.) [56, 57]. В пилотном исследовании объектом были 68 жертв суицида и 31 контроль (погибшие внезапной смертью от других причин), использован GeneChip® Mapping 50K Xba. Источником клинических данных были родственники умерших. Кроме того, с использованием Illumina chip expression arrays был исследован транскриптом в префронтальной коре лиц, никогда не принимавших наркотики. ПАИ выявило 58 ассоциированных ОНП, 22 из них в (или в непосредственной близости от) 19 известных генов (табл. 1), с OR 2.7–6.9. Ассоциации не были обусловлены диагнозом аффективных расстройств. Авторы отмечают, что все найденные гены могут быть объединены в четыре группы согласно генной онтологии, в частности: MBNL2 – “Развитие ЦНС”; CD44, DSC2 и MARCH1 – “Гомофильная клеточная адгезия”; SFRS11 и TUBGCP3 – “Регуляция клеточной пролиферации”; LSAMP и SPTLC1 – “Передача нервных импульсов” [55]. Интересно, что оценка экспрессии в префронтальной коре (на отдельном, хотя и частично перекрывающемся, контингенте покончивших с собой) показала, что семь из указанных 19 генов продемонстрировали измененную экспрессию по сравнению с контролем, особенно это касалось генов иммунной системы [56].
В своей следующей работе [57] авторы генотипировали пациентов и жертв суицида из США, Канады и Германии с использованием чипа Illumina Omni1-Quad Beadchip (1.014.770 SNPs). В качестве суицидальных фенотипов выступали суицидальные мысли, попытка и завершенный суицид, наличие психического расстройства оценивали с использованием опросника SCID, в качестве контролей выступали случайно выбранные лица из тех же регионов, что и основная группа, их психическое здоровье также оценивали с помощью стандартизованных инструментов. В конечном итоге в исследование вошли 1810 человек, из них 577 – с суицидальным поведением (260 из них совершили попытки и 317 – покончили с собой), 1233 – контрольная группа (1096 человек, не имевших суицидальной попытки в анамнезе, и 137 случаев внезапной смерти от различных причин). На сопоставлении лиц с суицидальными проявлениями различной тяжести, с наличием или отсутствием биполярного расстройства, строилось все исследование. Биоинформационные подходы включали анализ метаболических путей (pathway analysis), использующий стандартную аннотацию генных продуктов [57]. Наиболее значимые ассоциации при сравнении жертв суицида с погибшими от других причин и совершивших попытки – со здоровыми контролями касались ОНП, локализованных в пределах генов STK3, ADAMTS14, PSME2 и TBX20 (табл. 1). При сравнении пациентов с биполярным расстройством с попыткой и без были выявлены иные связи – с генами DPP10, CTNNA3 (оба гена имеют отношение к астме) и STK32B. При использовании индекса суицидальных мыслей в качестве фенотипа ни один из пиковых ОНП не показал даже тенденции к ассоциации [57]. Авторы обсуждают полученные данные с позиций роли множественных факторов и подчеркивают значение генов, связанных с хроническим воспалением.
ЗАКЛЮЧЕНИЕ
Представленные данные дают возможность сделать некоторые выводы. Первое, на что можно обратить внимание, это то, что в отличие от многочисленных исследований с использованием стратегии генов-кандидатов, поиск полногеномных ассоциаций с суицидальными фенотипами реже выявляет ассоциации с генами нейромедиаторных систем, которые наиболее интенсивно исследовались в суицидологии в течение десятилетий. Это, прежде всего, серотонинергическая и дофаминергическая системы, система ГАМК, также система нейротрофинов [3–6, 58]. Так, например, по данным анализа большого числа работ, посвященных отдельным генам, авторы приходят к выводу, что важнейшими SNPs, предсказывающими суицидальное поведение, являются TPH1-rs1800532, SLC6A4-5-HTTLPR, COMT-rs4680 (все из системы моноаминов) и BDNF-rs6265 [58], однако по данным ПАИ эти гены не выходят на ведущие позиции. Заметно также, что среди ассоциаций нет генов, напрямую относящихся к системам стресс-реагирования, например рецепторных структур к кортизолу, норадреналину или вазопрессин-окситоцину, или факторов, ответственных за те или иные компоненты ГГАС. В то же время находки полны SNPs, имеющих отношение к процессам развития и формирования нервной системы, нейропластичности, к межклеточным взаимодействиям, клеточной адгезии и пролиферации, внутриклеточным сигнальным системам и также к иммунным реакциям. Мы полагаем, что это – подтверждение моделей стресс-уязвимости, которые рассматривают данное явление как результат раннего развития (рис. 2). Стресс как системная реакция охватывает весь организм и практически все его системы, включая иммунную. В этом смысле все находки данного типа выглядят вполне логичными – поскольку стресс-реагирование является функцией многих систем, вполне ожидаемо получить ассоциации с самыми разными генетическими маркерами, имеющими отношение к разным функциям организма, каждая из которых может вносить свой вклад в уязвимость – либо деформируя процессы нейрогенеза, либо создавая предпосылки суицидальности путем компрометации других систем, например метаболической и иммунной. Последнее может быть связано с особенностями внутриклеточных сигнальных систем, отвечающих за реакции на гормоны и цитокины, маркеры которых также широко представлены по данным ПАИ.
Роль раннего детского психологического стресса и травмы, столь часто выявляемая при суицидальном поведении по данным ретроспективных опросов, предусматривает вовлеченность процессов формирования нервной системы. В пользу этого свидетельствуют уже упомянутые нейроанатомические деформации у жертв суицида. С этой точки зрения выявление большого числа маркеров межклеточных взаимодействий и клеточной пролиферации также представляется вполне логичным. Именно эти генетические варианты могут оказаться критически важными в условиях раннего стресса, приводя к отклонениям от нормативного развития нервных структур, к клеточным дисбалансам в отделах мозга (которые на самом деле и являются причиной изменений медиаторных систем), нарушениям синаптогенеза, прунинга и апоптоза, со всеми вытекающими отсюда последствиями в виде анатомических и функциональных нарушений, которые проявляют себя в более позднем возрасте. В последнее время все больше исследований указывает на роль ранних этапов развития в генезе почти всех психических расстройств, являющихся важными факторами риска суицида, а генетическая корреляция объясняет их часто наблюдаемую коморбидность [19, 59]. На основе новых данных о роли эпигенетического программирования сформировалась концепция о том, что все проявления здоровья и болезней в зрелом (и даже пожилом) возрасте имеют раннее (педиатрическое) происхождение, коренящееся в процессах развития (developmental origin of health and disease, DOHaD) [60]. В этом смысле поиск широкогеномных ассоциаций при суицидальном поведении дал ценные результаты, которые укладываются в современное патофизиологическое понимание, и выявленные генетические маркеры служат сильным подкреплением этих взглядов.
В то же время анализ представленных работ свидетельствует о целом комплексе проблем, связанных с ПАИ при СП. Первое, что бросается в глаза, – это крайне низкая воспроизводимость результатов, даже при условии близости описываемых фенотипов. С одной стороны, однотипные исследования (даже использующие одни и те же выборки пациентов) не подтверждают находки друг друга. С другой стороны, все суицидальные фенотипы в принципе дают очень разнящиеся результаты (как видно из табл. 1 всего четыре гена повторялись в различных независимых исследованиях). Очень часто первоначальные находки в идентифицированной популяции не находят подтверждения на других популяциях. Поражают различия в числе выявляемых ассоциаций в разных работах – от нуля до сотен генов (табл. 1). Нам представляется, что это связано с различающимися биоинформатическими подходами, которые не имеют пока “золотого стандарта”. По мере усложнения статистических приемов (например, при оценке полигенного риска), а особенно при использовании дополнительных источников информации, отражающих функциональные взаимоотношения между генами и их продуктами (белок-белковые взаимодействия, анализ обогащения по функциональному признаку), число выявляемых маркеров растет. В настоящее время богатство накопленной информации геномного и функционального характера позволяет выстраивать схемы в рамках структурной геномики. В частности, такая разработка в отношении суицидального поведения, использующая список всех выявленных в связи с СП генов и различные теоретические и статистические приемы работы с существующими базами данных, привела авторов к выводу, что гены CCK (холецистокинин), INPP1 (инозитол-фосфатаза-1-фосфатаза), DDC (допамин-декарбоксилаза) и NPY (нейропептид Y) являются центральными “узлами”, с которыми наиболее плотно связаны 104 идентифицированных маркера [61]. В работах такого рода большую роль играют представления о ведущих эндофенотипах СП, к которым относят нейропсихологические характеристики, личностный профиль, нейрохимические и нейронатомические особенности, поскольку они определяют стратегию поиска функциональных характеристик генетических маркеров [62].
Многие авторы отмечают, что приверженность сложным статистическим методам (различным по своей математической природе и опирающимся на различные исходные концепции) может быть причиной недостаточной убедительности ПАИ и неоднородности продуцируемых ими результатов [2, 58]. Колоссальный объем статистических манипуляций, с математическими трансформациями исходных данных, наличие определенных условностей (например, консенсус относительно критериев достоверности, применяемых только в исследованиях данного типа) – все это может приводить к ложноположительным и ложноотрицательным результатам. В одной из последних работ Sokolowski et al., обрабатывая свой собственный материал с применением новых методических подходов, в частности используя тест на переобученность списка маркеров (excess of significant markers, ESM) и Multi-marker Analysis of GenoMic Annotation (MAGMA), обсуждают, какие находки “наиболее устойчивы к методическим вариациям” [63]. Новый анализ также выявил набор генов, связанных с синаптическими процессами и формированием нервных структур, но при этом были подтверждены только ~12% полигенных ассоциаций с суицидальной попыткой из числа ранее найденных [63].
ПАИ не свободны от множества других недостатков; так, в обзорах обсуждаются такие проблемные аспекты как следование стратегии “распространенные полиморфизмы – распространенные заболевания” (все rs на коммерческих чипах – это мутации, присущие большинству людей, и подразумевается, что наиболее распространенные заболевания, такие как инфаркт или диабет, вероятнее всего, обусловлены множественным вкладом таких наиболее часто встречающихся SNPs). В то же время суицид – это очень редкое явление в популяции (не более 0.014% в глобальном масштабе), в силу этого вполне вероятно, что искать нужно как раз редкие, а не распространенные мутации [1, 58]. Для идентификации таких вариантов нужны другие подходы, в частности секвенирование экзома. Интерес представляет также поиск вариаций копий генов (первые работы в суицидологии уже появились [64]). Другие сложности и неопределенности связаны с взаимодействием генов между собой и с факторами среды [58]. Несмотря на эти проблемные моменты, ПАИ не потеряли своей привлекательности, публикуются все новые протоколы будущих исследований для отдельных популяций [65].
Подводя итог, можно констатировать, что ПАИ в суицидологии внесли важный вклад в наше понимание сущности суицидального диатеза, указав, во-первых, на значительную множественность генетических факторов, оказывающих влияние; во-вторых, подчеркнув главенствующую роль процессов формирования и развития нервных структур, а также еще раз указав на ненервные механизмы, в частности на гены иммунной системы. Эти исследования, в отличие от работ по стратегии генов-кандидатов (которые отталкивались от ранних работ, показавших различные нарушения содержания метаболитов в мозге жертв суицида post mortem), позволили шире посмотреть на патогенез суицидальности не только в рамках нейрохимических процессов, но в большей степени с позиций процессов формирования и развития нервных структур. Несмотря на проблемные аспекты ПАИ, их резерв не исчерпан, и дальнейшее накопление данных необходимо, особенно с учетом этнической стратификации. В то же время очевидно возрастает роль метаанализов, поскольку увеличение размера выборок имеет свои пределы, а переход на популяционный уровень неминуемо сопровождается снижением качества описания фенотипа. Дальнейшее изучение роли генов на основе высокотехнологических приемов современной геномики и биоинформатики позволит приблизиться к задачам предикции и превенции суицидов.
Настоящее исследование не имело финансовой поддержки.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ikegawa S. A short history of the genome-wide association study: here we were and where we are going // Genomics Inform. 2012. V. 10. P. 220–225. https://doi.org/10.5808/GI.2012.10.4.220
Sokolowski M., Wasserman J., Wasserman D. Genome-wide association studies of suicidal behaviors: A review // Eur. Neuropsychopharmacol. 2014. V. 24. P. 1567–1577. https://doi.org/10.1016/j.euroneuro.2014.08.006
Bondy B., Buettner A., Zill P. Genetics of suicide // Mol. Psychiatry. 2006. V. 11. P. 336–351. https://doi.org/10.1038/sj.mp.4001803
Rujesku D., Thalmeier A., Moller H.-J. et al. Molecular genetics findings in suicidal behavior: what is beyond the serotoninegric system? // Arch. Suicide. Res. 2007. V. 11. P. 17–40. https://doi.org/10.1080/13811110600897317
Wasserman D., Sokolowski M., Wasserman J. et al. Neurobiology and the genetics of suicide // Oxford Textbook on Suicidology and Suicide Prevention / Eds Wasserman D., Wasserman C. N.Y.: Oxford Univ. Press, 2009. P. 165–182.
Tsai S.J., Hong C.J., Liou Y.J. Recent molecular genetic studies and methodological issues in suicide research // Prog. Neuropsychopharmacol. Biol. Psychiatry. 2011. V. 35. № 4. P. 809–817. https://doi.org/10.1016/j.pnpbp.2010.10.014
Wasserman D., Cheng Q., Jiang G.X. Global suicide rates among young people aged 15–19 // World Psychiatry. 2005. V. 4. P. 114–120.
McLouhhlin A.B., Gould M.S., Malone K.M. Global trends in teenage suicide: 2003–2014 // Q. J. Med. 2015. V. 108. P. 765–780. https://doi.org/10.1093/qjmed/hcv026
Розанов В.А. Самоубийства среди детей и подростков – что происходит, и в чем причина? // Суицидология. 2014. Т. 5. № 17. С. 16–31.
Zalsman G. Genetics of suicidal behavior in children and adolescents // The Neurobiological Basis of Suicide / Ed. Dwiwedi Y. Boca Raton (FL): Taylor & Francis, 2012. (available from: https://www.ncbi.nlm.nih.gov/books/NBK107209/)
Розанов В.А., Кибитов А.О., Гайнетдинов Р.Р. и др. Современное состояние молекулярно-генетических исследований в суицидологии и новые возможности оценки риска суицида // Суицидология. 2019. Т. 10. № 1. С. 3–20. https://doi.org/10.32878/suiciderus.19-10-01(34)-3-20
Wasserman D. The suicidal process // Suicide. An Unnecessary Death / Eds Wasserman D., Wasserman C. Oxford Univ. Press (2nd ed.). 2016. P. 28–37.
Руженков В.А., Руженкова В.В., Боева А.В. Концепции суицидального поведения // Суицидология. 2012. Т. 4. С. 52–60.
Shafii M., Steltz-Lenarsky J., Derrick A.M. et al. Comorbidity of mental disorders in the post-mortem diagnosis of completed suicide in children and adolescents // J. Affect. Disord. 1988. V. 15. P. 227–233.
Lonnqvist J. Major psychiatric disorders in suicide and suicide attempters // Oxford Textbook on Suicidology and Suicide Prevention / Eds Wasserman D., Wasserman C. Oxford Univ. Press, 2009. P. 275–286.
Mandelli L., Serretti A. Gene environment interaction studies in depression and suicidal behavior: An update // Neurosci. Biobehav. Rev. 2013. V. 37. Pt. 10. P. 2375–2397. https://doi.org/10.1016/j.neubiorev.2013.07.011
Lee H., Ripke S., Neale B. et al. Genetic relationship between five psychiatric disorders estimated from genome-wide SNPs // Nat. Genet. 2013. V. 45. № 9. P. 984–994. https://doi.org/10.1038/ng.2711
Rudan I. New technologies provide insights into genetic basis of psychiatric disorders and explain their co-morbidity // Psychiatr. Danub. 2010. V. 22. № 2. P. 190–192.
Henricsson M.H., Aro Y.A., Marttunen M.J. et al. Mental disorders and comorbidity in suicide // Am. J. Psychiatry. 1993.V. 150. P. 935–940.
Paykel E.S., Prusoff B.A., Myers J.K. Suicide attempts and recent life events. A controlled comparison // Arch. Gen. Psychiatry. 1975. V. 32. № 3. P. 327–333. https://doi.org/10.1001/archpsyc.1975.01760210061003
Heeringen van K., Mann J.J. The neurobiology of suicide // The Lancet Psychiatry. 2014. V. 1. № 1. P. 63–72. https://doi.org/10.1016/S2215-0366(14)70220-2
Wasserman D. A stress-vulnerability model and the development of the suicidal process // Suicide. An Unnecessary Death / Ed. Wasserman D. London: Martin Duniz, 2001. P. 13–27.
Turecki G., Ernst C., Jollant F. et al. The neurobehavioral origins of suicidal behavior // Trends Neurosci. 2012. V. 35. P. 14–23. https://doi.org/0.1016/j.tins.2011.11.008
Rozanov V.A. Stress and Epigenetics in Suicide. Acad. Press, 2017. 227 p.
Mann J.J. Neurobiology of suicidal behavior // Nat. Rev. Neurosci. 2003. V. 4. P. 819–828. https://doi.org/10.1038/nrn1220
Wasserman D., Sokolowski M. Stress-vulnerability model of suicidal behaviours // Suicide. An Unnecessary Death / Ed. Wasserman D. (2nd ed.) N.Y.: Oxford Univ. Press, 2016. P. 27–37.
Rudd M.D. The suicidal mode: a cognitive-behavioral model of suicidality // Suicide Life. Threat. Behav. 2000. V. 30. № 1. P. 18–33.
Joiner T.E., Van Orden K.A. The interpersonal psychological theory of suicidal behavior indicates specific and crucial psychotherapeutic targets // Int. J. Cogn. Ther. 2008. V. 1. P. 80–89. https://doi.org/10.1521/ijct.2008.1.1.80
Brent D.A., Mann J.J. Family genetic studies, suicide, and suicidal behavior // Am. J. Med. Genet. Part C. Seminars in Medical Genetics. 2005. V. 133C. P. 13–24. https://doi.org/10.1002/ajmg.c.30042
Klonsky D., May A.M. The Three-Step Theory (3ST): A new theory of suicide rooted in the “Ideation-to-Action” framework // Int. J. Cogn. Ther. 2015. V. 8. № 2. P. 114–129.
O’Connor R.C., Nock M.K. The psychology of suicidal behavior // Lancet Psychiatry. 2014. V. 1. № 1. P. 73–85. https://doi.org/10.1016/S2215-0366(14)70222-6
Bridge J.A., Goldstein T.R., Brent D.A. Adolescent suicide and suicidal behavior // J. Child. Psychol. Psychiatry. 2006. V. 47. № 3–4. P. 372–394.
Desmyter S., van Heeringen C., Audenaert K. Structural and functional neuroimaging studies of the suicidal brain // Progs. Neuropsychopharmacol. Biol. Psychiatry. 2011. V. 35. P. 796–808. https://doi.org/10.1016/j.pnpbp.2010.12.026
Turecki G. Epigenetics and suicidal behavior research pathways // AJPM. 2014. V. 47. P. 144–151. https://doi.org/0.1016/j.amepre.2014.06.011
Розанов В.А. Стресс-индуцированные эпигенетические феномены – еще один вероятный биологический фактор суицида // Суицидология. 2015. Т. 6. № 20. С. 3–19.
Laje G., Allen A.S., Akula N. et al. Genome-wide association study of suicidal ideation emerging during citalopram treatment of depressed outpatients // Pharmacogenet. Genomics. 2009. V. 19. P. 666–674. https://doi.org/10.1097/FPC.0b013e32832e4bcd
Perroud N., Uher R., Ng M.Y. et al. Genome-wide association study of increasing suicidal ideation during antidepressant treatment in the GENDEP project // Pharmacogenomics J. 2012. V. 12(1). P. 68–77. https://doi.org/10.1038/tpj.2010.70
Menke A., Domschke K., Czamara D. et al. Genome-wide association study of antidepressant treatment-emergent suicidal ideation // Neuropsychopharmacology. 2012. V. 37. P. 797–807. https://doi.org/10.1038/npp.2011.257
Schosser A., Butler A.W., Ising M. et al. Genome wide association scan of suicidal thoughts and behaviour in major depression // PLoS One. 2011. V. 6. e20690. https://doi.org/10.1371/journal.pone.0020690
Perlis R.H., Huang J., Purcell S. et al. Genome-wide association study of suicide attempts in mood disorder patients // Am. J. Psychiatry. 2010. V. 167. P. 1499–1507. https://doi.org/10.1176/appi.ajp.2010.10040541
Willour V.L., Seifuddin F., Mahon P.B. et al. A genome-wide association study of attempted suicide // Mol. Psychiatry. 2012. V. 17. P. 433–444. https://doi.org/10.1038/mp.2011.4
Butler A.W., Breen G., Tozzi F. et al. A genome wide linkage study on suicidality in major depressive disorder confirms evidence for linkage to2p1 // Am. J. Med. Genet. B: Neuropsychiatr. Genet. 2010. V. 153B. P. 1465–1473. https://doi.org/10.1002/ajmg.b.31127
Mullins N., Perroud N., Uher R. et al. Genetic relationships between suicide attempts, suicidal ideation and major psychiatric disorders: a genome-wide association and polygenic scoring study // Am. J. Med. Genet. B: Neuropsychiatr. Genet. 2014. V. 165B. P. 428–437. https://doi.org/10.1002/ajmg.b.32247
Purcell S., Cherny S.S., Sham P.C. Genetic Power Calculator: Design of linkage and association genetic mapping studies of complex traits // Bioinformatics. 2003. V. 19. P. 149–150. https://doi.org/10.1093/bioinformatics/19.1.149
Purcell S., Neale B., Todd-Brown K. et al. PLINK: A tool set for whole-genome association and population-based linkage analyses // Am. J. Hum. Genet. 2007. V. 81. P. 559–575. https://doi.org/10.1086/519795
Zai C.C., Gonçalves V.F., Tiwari A.K. et al. A genome-wide association study of suicide severity scores in bipolar disorder // J. Psychiatr. Res. 2015. V. 65. P. 23–29. https://doi.org/10.1016/j.jpsychires.2014.11.002
Sokolowski M., Wasserman J., Wasserman D. Polygenic associations of neurodevelopmental genes in suicide attempt // Mol. Psychiatry. 2016. V. 21. № 10. P. 1381–1390. https://doi.org/10.1038/mp.2015.187
Wasserman D., Geijer T., Rozanov V. et al. Suicide attempt and basic mechanisms in neural conduction: Relationships to the SCN8A and VAMP4 genes // Am. J. Med. Genet. B: Neuropsychiatr. Genet. 2005. V. 133B. № 1. P. 116–119.
Wasserman D., Wasserman J., Rozanov V., Sokolowski M. Depression in suicidal males: genetic risk variants in the CRHR1 gene // Genes, Brain and Behavior. 2008. V. 8. № 1. P. 72–79.
Erlangsen A., Appadurai V., Wang Y. et al. Genetics of suicide attempts in individuals with and without mental disorders: a population-based genome-wide association study // Mol. Psychiatry. 2018. Aug 16. https://doi.org/10.1038/s41380-018-0218-y
Bani-Fatemi A., Graff A., Zai C. et al. GWAS analysis of suicide attempt in schizophrenia: Main genetic effect and interaction with early life trauma // Neurosci. Lett. 2016. V. 622. P. 102–106. https://doi.org/10.1016/j.neulet.2016.04.043
Любов Е.Б., Цупрун В.Е. Суицидальное поведение при шизофрении. Часть I: эпидемиология и факторы риска // Суицидология. 2013. Т. 4. № 10. С. 15–27.
Nock M.K., Deming C.A., Fullerton C.S. et al. Suicide among soldiers: A review of psychosocial risk and protective factors // Psychiatry. 2013. V. 76. P. 97–125. https://doi.org/10.1521/psyc.2013.76.2.97
Stein M.B., Ware E.B., Mitchell C. et al. Genomewide association studies of suicide attempts in US soldiers // Am. J. Med. Genet. B: Neuropsychiatr. Genet. 2017. V. 174. № 8. P. 786–797. https://doi.org/10.1002/ajmg.b.32594
Kimbrel N.A., Garrett M.E., Dennis M.F. et al. A genome-wide association study of suicide attempts and suicidal ideation in U.S. military veterans // Psychiatry Res. 2018. V. 269. P. 64–69. https://doi.org/10.1016/j.psychres.2018.07.017
Galfalvy H., Zalsman G., Huang Y.-Y. et al. A pilot genome wide association and gene expression array study of suicide with and without major depression // World J. Biol. Psychiatry. 2013. V. 14. № 8. P. 574–582. https://doi.org/10.3109/15622975.2011.597875
Galfalvy H., Haghighi F., Hodgkinson C. et al. A genome-wide association study of suicidal behavior // Am. J. Med. Genet. B: Neuropsychiatr. Genet. 2015. V. 168. № 7. P. 557–563. https://doi.org/10.1002/ajmg.b.32330
Mirkovic B., Laurent C., Podlipski M.-A. et al. Genetic association studies of suicidal behavior: A review of the past 10 years, progress, limitations, and future directions // Front. Psychiatry. 2016. V. 7. P. 158. https://doi.org/10.3389/fpsyt.2016.00158
Schork A., Won H., Appadurai V. et al. A genome-wide association study of shared risk across psychiatric disorders implicates gene regulation during fetal neurodevelopment // Nat. Neurosci. 2019: 22. https://doi.org/10.1038/s41593-018-0320-0
Hochberg Z., Feil R., Constancia M. et al. Child health, developmental plasticity, and epigenetic programming // Endocrine Rev. 2011. V. 32. P. 159–224. https://doi.org/10.1210/er.2009-0039
Bozorgmehr A., Ghadirivasfi M., Tavakoli M. et al. Integrated analysis of the genetic basis of suicidal behavior: what has been shown by structural genetics studies so far // Psychiatr. Genet. 2018. V. 28. № 2. P. 31–37. https://doi.org/10.1097/YPG.0000000000000191
Jimenez-Treviño L., Blasco-Fontecilla H., Braquehais M.D. et al. Endophenotypes and suicide behaviour // Actas Esp. Psiquiatr. 2011. V. 39. № 1. P. 61–69.
Sokolowski M., Wasserman J., Wasserman D. Gene-level associations in suicide attempter families show overrepresentation of synaptic genes and genes differentially expressed in brain development // Am. J. Med. Genet. B: Neuropsychiatr. Genet. 2018. V. 177. № 8. P. 774–784. https://doi.org/10.1002/ajmg.b.32694
Sokolowski M., Wasserman J., Wasserman D. Rare CNVs in suicide attempt include schizophrenia-associated loci and neurodevelopmental genes: A pilot genome-wide and family-based study // PLoS One. 2016. V. 11. № 12: e0168531. https://doi.org/10.1371/journal.pone.0168531
González-Castro T.B., Genis-Mendoza A.D. et al. Genome-wide association study of suicide attempt in a Mexican population: a study protocol // BMJ Open. 2019. V. 9. № 4:e025335. https://doi.org/10.1136/bmjopen-2018-025335
Дополнительные материалы отсутствуют.


