Генетика, 2020, T. 56, № 8, стр. 974-980
Полиморфизм CAG-повторов в экзоне 1 гена андрогенового рецептора у российских мужчин с нормозооспермией и патозооспермией
Л. П. Меликян 1, Е. А. Близнец 1, А. В. Поляков 1, О. Л. Миронович 1, И. А. Кузнецова 1, Т. М. Сорокина 1, М. И. Штаут 1, А. О. Седова 1, Л. Ф. Курило 1, О. А. Соловова 1, В. Б. Черных 1, *
1 Медико-генетический научный центр им. академика Н.П. Бочкова
115522 Москва, Россия
* E-mail: chernykh@med-gen.ru
Поступила в редакцию 22.08.2019
После доработки 02.10.2019
Принята к публикации 17.02.2020
Аннотация
CAG-полиморфизм в экзоне 1 гена андрогенового рецептора (AR/HUMARA) ассоциирован с патозооспермией и мужским бесплодием, однако его влияние на сперматогенез и мужскую фертильность недостаточно изучено, а данные авторов противоречивы в связи с популяционными различиями. В статье представлены результаты исследования полиморфизма CAG-повторов гена AR у российских мужчин с бесплодием в браке, связанным с патозооспермией (n = 591), с доказанной фертильностью (n = 286) и с нормозооспермией (n = 131). При сравнительном анализе частоты “средних” (n = 19–25), “длинных” (n ≥ 26) и “коротких” (n ≤ 18) аллелей не обнаружено значимых различий между группами пациентов с различными формами патозооспермии. Выявлены статистически значимые (p < 0.01) различия между группой с олигозооспермией тяжелой степени и с контролем по частоте встречаемости “длинных” и “коротких” CAG-аллелей, а также по частоте аллеля (CAG)n = 25 между мужчинами с азооспермией (18.1%) и олигозооспермией тяжелой степени (2.6%).
Мужские половые гормоны играют важную роль в формировании органов половой системы по мужскому типу, половом созревании и развитии вторичных мужских половых признаков, а также в контроле репродуктивной функции у мужчин [1, 2]. Андрогены, главным образом тестостерон и дигидротестостерон, являются важными регуляторами сперматогенеза человека. Их действие опосредовано андрогеновым рецептором [3, 4]. Ген андрогенового рецептора (AR/HUMARA) у человека локализован на X-хромосоме (локус Xq12). В экзоне 1 гена AR расположен тринуклеотидный CAG-повтор, кодирующий полиглутаминовый тракт, количество повторов которого варьирует от 5 до 70. У здоровых индивидуумов число тринуклеотидных повторов как правило не превышает 39; у мужчин с количеством CAG-повторов более 40 развивается болезнь Кеннеди, или спинобульбарная амиотрофия, СБМА [2, 5 ].
Результаты многих исследований, изучавших предполагаемую взаимосвязь между количеством CAG-повторов в экзоне 1 гена AR и мужским бесплодием, противоречивы. Так, исследования, проведенные в Китае [6], Сингапуре [7], Японии [8], Австралии [9], Северной Америке [3], Греции [10] и Франции [11], показали, что наиболее часто число CAG-повторов составляет 20–23, а также их длина может быть связана с показателями спермограммы, в частности с концентрацией и количеством сперматозоидов. Однако исследования мужчин из Швеции [12], Финляндии [13], Германии [14], Индии [15], Италии [16], Македонии [1] и Ирландии [17] не выявили связи между числом CAG-повторов и нарушением сперматогенеза и мужской фертильности. Противоречивость этих данных может быть обусловлена различиями в этническом составе исследованных выборок, критериях отбора, в частности, показателей спермограммы и статусe фертильности пациентов и другими факторами [1, 3, 6–19].
Цель настоящего исследования – изучение полиморфизма CAG-повторов в гене AR у российских мужчин с нормозооспермией/фертильностью и пациентов с патозооспермией, выявление его взаимосвязи со сперматологическими показателями.
Выборку обследованных составил 591 неродственный российский пациент с бесплодием в браке, у которого выявлены различные формы патозооспермии. Контрольная группа включала 131 неродственный российский мужчина с нормозооспермией. Кроме того, обследована группа из 286 неродственных фертильных российских мужчин, у которых есть хотя бы один ребенок (отцовство доказано ДНК-тестированием, выполненным в лаборатории ДНК-диагностики ФГБНУ “МГНЦ им. академика Н.П. Бочкова”). Критериями включения в выборку мужчин с нарушением фертильности являлись бесплодие в браке и репродуктивный возраст, а также наличие патозооспермии неясного генеза. Обследованные мужчины были репродуктивного возраста, большинство – русские по национальности. Пациентов с установленными генетическими причинами, в том числе с аномалиями кариотипа, микроделециями Y-хромосомы, патогенными вариантами гена CFTR, или с негенетическими причинами бесплодия (вазэктомия, орхоэпидидимит, травмы половых органов и др.) не включали в исследование. По результатам спермиологического исследования сформированы четыре подгруппы пациентов с патозооспермией: азооспермия (n = 105), олигозооспермия тяжелой степени (n = 192), олигозооспермия умеренной степени (n = 136) и астено-/тератозооспермия (n = 158).
Геномную ДНК выделяли из лимфоцитов периферической венозной крови с помощью набора реактивов Wizard® Genomic DNA Purification Kit (Promega, США) по протоколу производителя. Анализ полиморфизма повтора (GAG)n в экзоне 1 гена AR проводили с помощью ПЦР методом ПДАФ (полиморфизм длин амплифицированных фрагментов) в соответствии с утвержденной и апробированной медицинской технологией ФГБНУ “МГНЦ им. академика Н.П. Бочкова” [20]. Всем мужчинам с патозооспермией и контрольной группы выполняли спермиологический анализ согласно рекомендациям Руководства ВОЗ по исследованию эякулята (ВОЗ, 2010 г.) [21]. Исследование одобрено этическим комитетом при ФГБНУ “МГНЦ им. академика Н.П. Бочкова”. От каждого пациента получено добровольное информированное согласие в письменной форме.
Так как распределение количества повторов у пациентов исследованной выборки не соответствовало нормальному, среднее значение для каждой группы представлено в виде медианы (Me), а стандартное отклонение – в виде квартилей (25–75%). CAG-повторы гена AR принято подразделять на “короткие” (n ≤ 18), “средние” (n = 19–25) и “длинные” (n ≥ 26) аллели [22, 23]. Частоту встречаемости “средних”, “коротких” и “длинных” CAG-аллелей в группах у мужчин с бесплодием и с доказанной фертильностью сравнивали с контрольной группой (мужчины с нормозооспермией), а также в подгруппах пациентов с патозооспермией. Наличие взаимосвязи между формой патозооспермии и количеством тринуклеотидных повторов определяли с помощью статистического показателя отношения шансов (ОШ) и критерия Фишера с использованием поправки на множественные сравнения и метода Бенджамини–Хохберга (FDR). Для статистического анализа применяли различные методы (критерии Манна–Уитни, Колмогорова–Смирнова, Фишера и Спирмена), используя компьютерные программы Statistica 10 (StatSoft, США) и (GraphPad Software, Inc., США). Наличие значимых различий между группами и подгруппами определяли при значении р < 0.05.
У обследованных нами мужчин количество CAG-повторов гена андрогенового рецептора варьировало от 7 до 37 (табл. 1). Среди пациентов с патозооспермией выявлено 23 аллельных варианта, в группе мужчин с доказанной фертильностью – 17 вариантов, а в группе контроля – 14 вариантов CAG-полиморфизма (рис. 1).
Таблица 1.
Количество CAG-повторов в экзоне 1 гена AR у российских мужчин с различными формами патозооспермии, с нормозооспермией и у фертильных мужчин
| Группа/подгуппа, количество пациентов | Количество повторов, (min–max) | Медиана, Me (квартили 25–75%) | Встречаемость CAG-аллелей гена AR, n (%) | |||
|---|---|---|---|---|---|---|
| “коротких” (n ≤ 18) | “средних” (n = 19–25) | “длинных” (n ≥ 26) | аллеля (CAG)n = 25 | |||
| Азооспермия, n = 105 | 15–31 | 23 (20–25) | 9 (8.6) | 84 (80.0) | 12 (11.4) | 19 (18.1) |
| Олигозооспермия тяжелой степени, n = 192 | 12–33 | 22 (20–24) | 18 (9.4) | 152 (79.2) | 22 (11.4) | 5 (2.6) |
| Олигозооспермия умеренной степени, n = 136 | 7–37 | 22 (20–24) | 13 (9.5) | 105 (77.2) | 18 (13.2) | 13 (9.5) |
| Астено-/тератозооспермия, n = 158 | 13–30 | 22 (21–24) | 10 (6.3) | 128 (81.0) | 20 (12.6) | 14 (8.8) |
| Нормозооспермия (контроль), n = 131 | 18–31 | 22 (21–24) | 3 (2.3) | 107 (81.7) | 21 (16.0) | 11 (8.4) |
| Фертильные мужчины (доказанные отцы), n = 286 | 13–31 | 21 (20–24) | 15 (5.2) | 247 (86.4) | 24 (8.4) | 34 (11.9) |
Рис. 1.
Распределение CAG-аллелей в экзоне 1 гена рецептора андрогенов (AR) по частоте встречаемости у российских мужчин: а – с патозооспермией (n = 591); б – с нормозооспермией (контроль, n = 131); в – с доказанной фертильностью (n = 286).
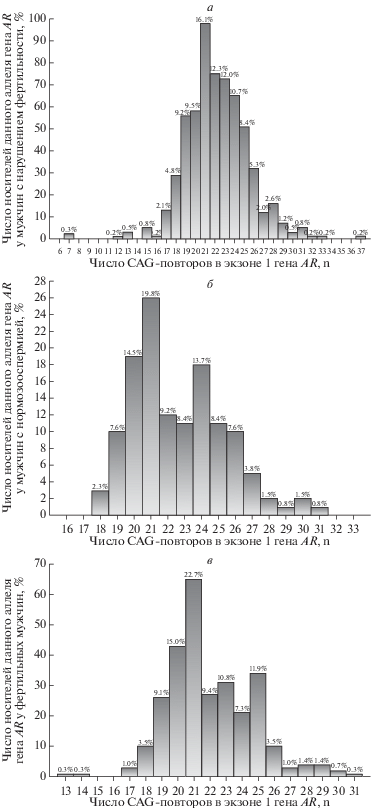
Медиана (Me), минимальное и максимальное значения числа CAG-повторов в исследованных группах мужчин приведены в табл. 1. Значение медианы статистически значимо не различалось между подгруппами мужчин с различными формами патозооспермии, а также при сравнении их с контролем и мужчинами с доказанной фертильностью. Статистический анализ с использованием U-критерия Манна–Уитни не обнаружил значимых различий между группами мужчин с различными формами патозооспермии, доказанной фертильностью и нормозооспермией (p < 0.05). Использование критерия Спирмена также не позволило выявить корреляции (r = 0.3) в группах с патозооспермией и нормозооспермией. Не достигнуто значимых различий при использовании поправки на множественные сравнения и метода Бенджамини–Хохберга (FDR), при р < 0.008.
В общей группе пациентов c патозооспермией варианты CAG-полиморфизма с количеством повторов от 19 до 25 представили 79% от всех аллелей, при этом их частота встречаемости в группах с различными формами патозооспермии составила 77–81% (табл. 1). Согласно числу CAG-повторов выделены три группы аллелей: “короткие” (n ≤ 18), “средние” (n = 19–25) и “длинные” (n ≥ 26). В подгруппе пациентов с азооспермией выявлена наиболее высокая (18%) частота аллеля (CAG)n = 25 по сравнению с другими формами патозооспермии (2–9%), а также мужчинами с доказанной фертильностью (11%) и с нормозооспермией (8%). Значимые различия (p = 0.0001) по частоте встречаемости данного аллеля обнаружены между группами мужчин с азооспермией и олигозооспермией тяжелой степени.
При рассмотрении отношения шансов (ОШ) между пациентами с различными формами патозооспермии, мужчинами с доказанной фертильностью и нормозооспермией (контроль) выявлено статистически значимое различие между мужчинами с олигозооспермией тяжелой степени и с нормозооспермией (контроль) по частоте встречаемости “коротких” (n ≤ 18, p = 0.01) и “длинных” (n ≥ 26, p = 0.01) CAG-аллелей, что свидетельствует о прямой положительной связи частоты встречаемости “коротких” и “длинных” повторов с мужским бесплодием, связанным со сниженным количеством сперматозоидов (табл. 2).
Таблица 2.
Анализ отношения шансов между группами пациентов с нормозооспермией, различными формами патозооспермии и доказанной фертильностью (доказанные отцы)
| Спермиологический диагноз | Отношение шансов, ОШ (CAG)n ≤ 18 (95%; p < 0.01) | Отношение шансов, ОШ (CAG)n ≥ 26 (95%; p < 0.01) | Отношение шансов, ОШ (CAG)n ≥ 26 и (CAG)n ≤ 18 (95%; p < 0.01) |
|---|---|---|---|
| Нормозооспермия и азооспермия | 4.0 (1.05–15.17; 0.03) | 0.68 (0.32–1.45; 0.35) | 0.19 (0.04–0.84; 0.04) |
| Нормозооспермия и олигозооспермия тяжелой степени | 4.41 (1.27–15.3; 0.01) | 0.68 (0.36–1.29; 0.25) | 0.17 (0.04–0.68; 0.01) |
| Нормозооспермия и олигозооспермия умеренной степени | 4.51 (1.25–16.21; 0.01) | 0.8 (0.4–1.58; 0.6) | 0.21 (0.05–0.81; 0.02) |
| Нормозооспермия и астено-/тератозооспермия | 2.88 (0.78–10.7; 0.15) | 0.76 (0.39–1.47; 0.49) | 0.29 (0.07–1.19; 0.11) |
| Нормозооспермия и доказанные отцы | 2.17 (0.61–7.64; 0.3) | 0.5 (0.26–0.93; 0.04) | 0.23 (0.06–0.9; 0.04) |
Другие исследования выявили различия CAG-полиморфизма гена рецептора андрогенов (AR) между пациентами с мужским бесплодием и фертильными мужчинами из различных популяций и этнических групп [3, 6–11, 18, 19, 22–26]. Метаанализ результатов 44 исследований, выполненных на выборках мужчин с нарушенной и сохраненной фертильностью, имеющих различное этническое происхождение (азиатских, европейских и смешанного происхождения популяций), позволил выявить ассоциацию повышенного числа (n ≥ 26) CAG-повторов с нарушением фертильности. Многие авторы указывают на повышенную частоту аллелей с количеством CAG-повторов более 26 у мужчин с бесплодием, связанным с патозооспермией [22, 23].
У украинских и российских мужчин, как и в других популяциях, наиболее распространенными являются аллели гена AR с 20–21 CAG-повторами [18, 19]. В исследованной нами выборке частые варианты содержали 20–23 тринуклеотидных повтора, составивших 50% от всех детектированных аллелей гена андрогенового рецептора в группе с патозооспермией. При этом самым частым являлся аллель (CAG)n = 21 как среди пациентов с патозооспермией (16%), так и у мужчин с нормозооспермией (20%) и с доказанной фертильностью (23%).
Ранее сообщалось о возможной связи между укороченным (16 повторов и менее) полиглутаминовым трактом в рецепторе андрогенов и повышенным риском снижения фертильности у мужчин [23–26]. Это подтверждают результаты нашего исследования, в котором наиболее значимое различие выявлено между группами мужчин с патозооспермией и контролем именно по частоте встречаемости “коротких” CAG-аллелей.
Ранее было показано, что у российских и украинских мужчин, имеющих ≥26 CAG-повторов в гене андрогенового рецептора, повышен риск нарушения сперматогенеза и мужского бесплодия [18, 19]. В исследовании Фесай и соавт. CAG-полиморфизма гена AR у фертильных мужчин (контроль) и пациентов с бесплодием, связанным с азооспермией и олигозооспермией, отмечено статистически значимое (р < 0.01) различие по частоте аллелей с количеством ≥28 CAG-повторов между группой пациентов с олигозооспермией (13.8%) и контролем (5.7%) [19]. В исследованной нами выборке с помощью показателя отношения шансов (ОШ) выявлено статистически значимое различие по частоте встречаемости “длинных” (≥26, p = 0.01) и “коротких” (≤18, p = 0.01) аллелей у мужчин с олигозооспермией тяжелой степени и с нормозооспермией. Это свидетельствует о наличии прямой связи “коротких” и “длинных” аллелей с мужским бесплодием, связанным с олигозооспермией.
Аллель (CAG)n = 25 гена AR встречается у украинских пациентов с азооспермией примерно в два раза чаще, чем при олигозооспермии (7% против 3% соответственно). При этом у фертильных мужчин данный вариант отмечен чаще (~10%), чем в общей группе пациентов с азооспермией и олигозооспермией (5%) [19]. Частота аллеля 25 в CAG-повторах у китайских пациентов с азооспермией составила 11%, с олигозооспермей – 9%, а с нормозооспермией – 3% [23]. В изученной выборке российских мужчин встречаемость данного аллеля в общей выборке пациентов с патозооспермией и в группе контроля равнялась 8%, у мужчин с доказанной фертильностью –11%. При азооспермии его частота являлась наибольшей (18%), а наименьшей – при олигозооспермии тяжелой степени (2%).
Согласно имеющимся у нас сведениям другие авторы, в том числе исследовавшие российские и украинские выборки [18, 19], не свидетельствовали о повышенной частоте данного аллеля у мужчин с патозооспермией в целом или при отдельных ее формах, а также его связи с нарушением сперматогенеза.
Следует отметить, что в исследованиях CAG-полиморфизма гена AR у мужчин с бесплодием в браке, описанных другими авторами, в качестве контроля использованы различные группы (мужчины с нормозооспермией, фертильные мужчины). Поэтому эти контрольные группы нельзя считать равнозначными. Так, нормозооспермия не исключает возможности проблем репродукции у супружеской пары, а также ее наличие необязательно соответствует мужской фертильности. И наоборот, мужчины с сохранной фертильностью могут иметь как нормозооспермию, так и различные формы патозооспермии (кроме тяжелых форм). Кроме того, при этом не учитываются состояние репродуктивного здоровья и фертильность супруги.
Таким образом, российские мужчины с патозооспермией, с нормозооспемией и фертильные имеют сходное распределение и частоту CAG-повторов гена AR. Наиболее высокая частота “коротких” и “длинных” повторов выявлена при олигозооспермии тяжелой степени, а аллеля (CAG)n = 25 при азооспермии. Требуются дальнейшие исследования влияния длинны полиглутаминового тракта на функцию андрогенового рецептора.
Работа выполнена в рамках государственного задания Министерства науки и высшего образования Российской Федерации.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Plaseski T., Noveski P., Dimitrovski C. et al. CAG repeat number in androgen receptor gene and male infertility // Balkan J. Med. Genet. 2007. V. 10. № 1. P. 19–24. https://doi.org/10.2478/v10034-007-0003-8
La Spada A.R., Wilson E.M., Lubahn D. et al. Androgen receptor gene mutations in X-linked spinal and bulbar muscular atrophy // Nature. 1991. V. 352. № 6330. P. 77–79. https://doi.org/10.1038/352077a0
Patrizio P., Leonard D.G., Chen K.L. et al. Larger trinucleotide repeat size in the androgen receptor gene of infertile men with extremely severe oligozoospermia // J. Androl. 2001. V. 22. № 3. P. 444–448. https://doi.org/10.1002/j.1939-4640.2001.tb02200.x
Lubahn D.B., Joseph D.R., Sullivan P.M. et al. Cloning of the human androgen receptor complementary DNA and localization to the X chromosome // Science. 1988. V. 240. P. 4850. № 327–330. https://doi.org/10.1126/science.3353727
Fratta P., Collins T., Pemble S. et al. Sequencing analysis of the spinal bulbar muscular atrophy CAG expansion reveals absence of repeat interruptions // Neurobiol. Aging. 2014. V. 35. № 2. P. 443.e1-e3. https://doi.org/10.1016/j.neurobiolaging.2013.07.015
Tse J.Y., Liu V.W., Yeung W.S. et al. Molecular analysis of the androgen receptor gene in Hong Kong Chinese infertile men // J. Assist. Reprod. Genet. 2003. V. 20. № 6. P. 227–233. https://doi.org/10.1023/A:1024107528283
Mifsud A., Sim C.K., Boettger-Tong H. et al. Trinucleotide (CAG) repeat polymorphisms in the androgen receptor gene: molecular markers of risk for male infertility // Fertil. Steril. 2001. V. 75. № 2. P. 275–281. https://doi.org/10.1016/S0015-0282(00)01693-9
Komori S., Kasumi H., Kanazawa R. et al. CAG repeat length in the androgen receptor gene of infertile japanese males with oligozoospermia // Mol. Hum. Reprod. 1999. V. 5. № 1. P. 14–16. https://doi.org/10.1093/molehr/5.1.14
Dowsing A.T., Yong E.L., Clark M. et al. Linkage between male infertility and trinucleotide repeat expansion in the androgen-receptor gene // Lancet. 1999. V. 354. № 9179. P. 640–643. https://doi.org/10.1016/S0140-6736(98)08413-X
Kukuvitis A., Georgiou I., Bouba I. et al. Association of oestrogen receptor α polymorphisms and androgen receptor CAG trinucleotide repeats with male infertility: a study in 109 Greek infertile men // Int. J. Androl. 2002. V. 25. № 3. P. 149–152. https://doi.org/10.1046/j.1365-2605.2002.00339.x
Wallerand H., Rémy-Martin A., Chabannes E. et al. Relationship between expansion of the CAG repeat in exon 1 of the androgen receptor gene and idiopathic male infertility // Fertil. Steril. 2001. V. 76. № 4. P. 769–774. https://doi.org/10.1016/S0015-0282(01)01987-2
Giwercman Y.L., Xu C., Arver S. et al. No association between the androgen receptor gene CAG repeat and impaired sperm production in Swedish men // Clin. Genet. 1998. V. 54. № 5. P. 435–436. https://doi.org/10.1111/j.1399-0004.1998.tb03759.x
Lund A., Tapanainen J.S., Lähdetie J. et al. Long CAG repeats in the AR gene are not associated with infertility in Finnish males // Acta. Obstet. Gynecol. Scand. 2003. V. 82. № 2. P. 162–166. https://doi.org/10.1034/j.1600-0412.2003.00068.x
Dadze S., Wieland C., Jakubiczka S. et al. The size of the CAG repeat in exon 1 of the androgen receptor gene shows no significant relationship to impaired spermatogenesis in an infertile Caucasoid sample of German origin // Mol. Hum. Reprod. 2000. V. 6. № 3. P. 207–214.
Thangaraj K., Joshi M.B., Reddy A.G. et al. CAG repeat expansion in the androgen receptor gene is not associated with male infertility in indian populations // J. Androl. 2002. V. 23. № 6. P. 815–818. https://doi.org/10.1002/j.1939-4640.2002.tb02338.x
Ferlin A., Bartoloni L., Rizzo G. et al. Androgen receptor gene CAG and GGC repeat lengths in idiopathic male infertility // Mol. Hum. Reprod. 2004. V. 10. № 6. P. 417–421. https://doi.org/10.1093/molehr/gah054
Lavery R., Houghton J.A., Nolan A. et al. CAG repeat length in an infertile male population of Irish origin // Genetica. 2005. V. 123. № 3. P. 295–302. https://doi.org/10.1007/s10709-004-5091-8
Михайленко Д.С., Бабенко О.В., Никифорова О.К. и др. Молекулярно-генетический анализ области AZF, гена CFTR и CAG-повтора гена AR у мужчин с бесплодием // Проблемы репродукции. 2005. № 6. С. 52–55.
Фесай О.А., Кравченко С.А., Тыркус М.Я. и др. CAG-полиморфизм гена андрогенового рецептора у мужчин с азооспермией и олигозооспермией из Украины // Цитология и генетика. 2009. Т. 43. № 6. С. 45–51.
Щагина О.А., Миронович О.Л., Забненкова В.В. и др. Экспансия CAG-повтора в экзоне 1 гена AR у больных спинальной амиотрофией // Мед. генетика. 2017. Т. 16. № 9. С. 31–36.
Руководство ВОЗ по исследованию и обработке эякулята человека. 5-е изд. М.: Капитал Принт, 2012. С. 291.
Pan B., Li R., Chen Y. et al. Androgen receptor (AR)-CAG trinucleotide repeat length and idiopathic male infertility: a case-control trial and a meta-analysis // Medicine (Baltimore). 2016. V. 95. № 10. P. e2878. https://doi.org/10.1097/MD.0000000000002878
Tse J.Y.M., Liu V.W.S., Yeung W.S.B. et al. Molecular analysis of the androgen receptor gene in Hong Kong Chinese infertile men // J. Assist. Reprod. Genet. 2003. V. 20. № 6. P. 227–233. https://doi.org/10.1023/a:1024107528283
O’Hara L., Smith L.B. Androgen receptor roles in spermatogenesis and infertility // Best. Pract. Res. Clin. Endocrinol. Metab. 2015. V. 29. № 4. P. 595–605. https://doi.org/10.1016/j.beem.2015.04.006
Batiha O., Haifawi S., Al-Smadi M. et al. Molecular analysis of CAG repeat length of the androgen receptor gene and Y chromosome microdeletions among Jordanian azoospermic infertile males // Andrologia. 2018. V. 50. № 4. P. e12979. https://doi.org/10.1111/and.12979
Nenonen H.A., Giwercman A., Hallengren E. et al. Non-linear association between androgen receptor CAG repeat length and risk of male subfertility a meta-analysis // Int. J. Androl. 2011. V. 34. № 4. P. 327–332. https://doi.org/10.1111/j.1365-2605.2010.01084.x
Дополнительные материалы отсутствуют.


