Генетика, 2020, T. 56, № 9, стр. 1075-1086
Анализ агрессивного поведения с помощью 250 SNP-маркеров у молодых русских мужчин
О. Е. Лазебный 1, А. М. Куликов 1, П. Р. Бутовская 2, П. А. Прошаков 1, *, А. В. Фокин 1, М. Л. Бутовская 3
1 Институт биологии развития им. Н.К. Кольцова Российской академии наук
119334 Москва, Россия
2 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
3 Институт этнологии и антропологии им. Н.Н. Миклухо-Маклая
Российской академии наук
119017 Москва, Россия
* E-mail: ub3dco@gmail.com
Поступила в редакцию 30.09.2019
После доработки 30.12.2019
Принята к публикации 29.01.2020
Аннотация
До недавнего прошлого основным направлением генетических исследований агрессивного поведения был ассоциативный анализ генов-кандидатов, которые выявлялись по данным о связи фенотипических проявлений агрессии с функционированием нейромедиаторных систем и половых гормонов. В последние годы развивается новое направление полногеномных ассоциативных исследований агрессии, которое позволяет обнаруживать новые гены, ранее не попадавшие в зону интересов специалистов. Представляемое исследование является попыткой расширить рамки традиционных гено-кандидатных исследований путем проведения анализа агрессивного поведения у представителей русского этноса, проживающих в московском мегаполисе, на основе увеличенного набора SNP-маркеров в количестве 250 локусов. Использованный набор содержал кроме SNP-маркеров известных генов-кандидатов также единичные замены оснований в генах, участвующих в развитии и функционировании головного мозга, в процессах нейронального развития и синаптической пластичности, формировании межнейронных связей, а также в генах, связанных с различными патологиями головного мозга. Кроме того, в наборе SNP-маркеров также были представлены контрольные гены, никак не связанные как с агрессивным поведением, так и с поведением вообще. Это в первую очередь гены домашнего хозяйства; кроме того, гены, кодирующие белки, связанные с укладкой хроматид, и др. Самооценки агрессивного поведения определялись с помощью опросников Басса–Перри и реактивной–проактивной агрессии. После применения ряда фильтров в итоговую выборку вошли 35 мужчин. Секвенирование фрагментов, содержащих интересующие нас 250 однонуклеотидных полиморфных сайтов, провели на аппарате Ion PGM System на чипе Ion 318™ Chip. Метод главных компонент и кластерный анализ на основе апостериорной вероятности Байеса показали отсутствие подразделенности анализируемой выборки русских мужчин. Для каждой шкалы агрессии была получена значимая ассоциация со специфическим набором SNP-маркеров, и только один полиморфный локус rs1047788 был связан как с физической, так и с реактивной агрессией. Биоинформатический анализ позволил определить, что большинство из выявленных маркеров ассоциированы с нейропептидами, участвующими в развитии и функционировании нервной системы в целом и ее регенерации, развитии отделов головного мозга, ответственных за стрессовые реакции, регуляцию гуморальной системы и межклеточный сигналинг. Для ряда маркеров из этого набора удалось выявить возможные механизмы взаимосвязи с поведенческими признаками. Список выявленных генов: кортикотропин-рилизинг гормона – CRH, белка семеногелина 1 – SEMG1, белков межклеточных взаимодействий – LAMC2 и ITGA2, эндонуклеазы системы репарации ДНК – ERCC5, белка когезинового комплекса, обеспечивающего конъюгацию сестринских хромосом, – ESCO1, трансмембранной сериновой протеазы – TMPRSS15, ингибитора апоптоза – BIRC5, интерферона бета-1 – IFNB1, скаффолдного белка – XRCC1, белка теплового шока – HSP90AA1.
Агрессивное поведение, агрессивность как черта личности, равно как и способность подавлять агрессивные импульсы зависят от генетических и средовых факторов, а также от их взаимодействия [1–5]. Целый ряд близнецовых исследований и исследований поведения близнецов в приемных семьях, в том числе и несколько метаанализов по этим данным, указывают на тот факт, что 50% изменчивости агрессивного поведения объясняется генетическими факторами, а вторые 50% – средовыми, не являющимися общими для членов семьи [6]. На значимость взаимодействия генетических и средовых факторов экспрессии агрессии и антисоциального поведения обращают внимание и авторы последних обобщающих публикаций [7–9].
Генетический вклад в разные формы агрессии (реактивная–проактивная, физическая/прямая–непрямая, гнев, враждебность) может сильно варьировать. Кроме того, существенную роль в экспрессии разных форм агрессии может играть фактор пола. Метаанализ, проведенный Буртом [10], показал, что роль генетических факторов в экспрессии агрессии повышается с возрастом (от 55% в возрасте от одного года до пяти лет до 63% к 11–18-летнему возрасту). Не подлежит сомнению, что вклад генетических факторов в агрессивный фенотип опосредован факторами среды, прежде всего семейным окружением, вовлеченностью в антисоциальные и противоправные действия в подростковом возрасте [11, 12].
К настоящему времени ассоциативные исследования, направленные на поиски генетических факторов агрессивного поведения, являются преобладающими. Они представлены двумя основными подходами: выявление кандидатных генов, ассоциированных с агрессией (в англоязычной литературе принято сокращение CGAS), и полногеномные ассоциативные исследования (GWAS). Подавляющее большинство исследований выполнено в рамках первого подхода, который базируется на существовавших прежде данных о связи фенотипических проявлений агрессии с функционированием нейромедиаторных систем, прежде всего серотониновой и дофаминовой, а также андрогеновой и эстрагеновой. Именно в этой парадигме были выполнены наши прежние исследования по генетике агрессии, включая анализ главных эффектов полиморфизма генов AR, HTR1A, HTR2A, HTR1B, DRD2, DRD4, а также их парных взаимодействий DAT1–COMT, 5-HTTLPR и 5HTR1A [13–18]. Метаанализ ассоциации 31 гена-кандидата с агрессией, проведенный с использованием результатов 185 исследований, не выявил значимой связи ни с одним из анализируемых генов [19], правда эти выводы могут быть связаны с влиянием других факторов, ассоциированных с различными психическими нарушениями, поскольку в анализ были включены как данные по поведению в норме, так и материалы по клиническим исследованиям. Метаанализ данных по генам-кандидатам, ограниченных нормой, дал более обнадеживающие результаты, свидетельствующие об устойчивом вкладе ряда генов серотониновой, дофаминовой, андрогеновой и эстрогеновой систем в проявление агрессивного фенотипа [20].
В последние годы, с развитием новых технологий молекулярно-генетического анализа, популярность набирают полногеномные ассоциативные исследования агрессии. Этот подход позволяет идентифицировать новые гены, ранее не попавшие в поле внимания специалистов, изучающих генетические факторы агрессии, а также выявить новые вероятные пути и функции ряда генов, потенциально ассоциированных с агрессивным поведением [20]. Особое внимание уделяется полиморфизму генов, связанных с сигнальными путями (гены axon repulsion signaling, кодирующие белки, участвующие в процессах нейронального развития и синаптической пластичности, межнейронных связей) [21–23].
С целью расширения перечня традиционно исследуемых генов-кандидатов за счет генов, потенциально участвующих в фенотипической экспрессии агрессивного поведения, а также подтверждения значимости некоторых известных генов-кандидатов, нами было проведено исследование агрессивного поведения на выборке русских мужчин, проживающих в московском мегаполисе, с применением панели из 250 SNP-маркеров.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования проводились в 2016 г. среди студентов московских вузов. Участие было добровольным и всем испытуемым гарантировалась полная анонимность. Протокол исследований был одобрен Комиссией по этике Московского государственного университета (экспертное заключение Комиссии МГУ по биоэтике, протокол № 55 от 26.03.2015).
Исходная выборка была представлена 125 мужчинами, при анкетировании отнесшими себя к русскому этносу, в возрасте от 17 до 36 лет. Все они являлись студентами московских вузов.
Все участники предоставили информацию, включая их возраст, социальное происхождение, пол, семейное положение, этническую принадлежность, а также указывали информацию о перенесенных и хронических заболеваниях, перенесенном стрессе. Все респонденты заполняли личностный опросник уровня агрессивного поведения (BPQ) [24], переведенный на русский язык и апробированный коллективом авторов ранее [25]. Опросник представлен четырьмя шкалами: физическая агрессия (9 вопросов), вербальная агрессия (5 вопросов), гнев (7 вопросов), враждебность (8 вопросов). Самооценка по каждому из 29 вопросов варьировала по шкале Лайкерта от 1 (не согласен) до 5 (согласен). Ранее опросник был использован нами в исследованиях на подростках и взрослых как в России, так и в Танзании [13–16, 25–27]. Использован также опросник реактивной–проактивной агрессии (RPQ), состоящий из 23 вопросов и представленный двумя шкалами – проактивная агрессия (12 вопросов) и реактивная агрессия (11 вопросов) [28, 29]. Самооценка по каждому вопросу в этом случае варьировала по шкале из трех баллов: от “0” – никогда до “2” – часто.
Наряду с информацией демографического характера и опросами у всех испытуемых были собраны образцы слюны для генетического анализа.
В качестве критерия отбора испытуемых для данного исследования мы руководствовались следующими показателями: сходство по социо-экономическому происхождению (все являлись представителями среднего класса). Все респонденты ранее никогда не обращались за психологической и психиатрической помощью, не подвергались жестокому обращению в детстве и не страдали посттравматическим синдромом. Это дает основание рассматривать нашу выборку как вариант нормы. Для данного исследования были отобраны 43 испытуемых (средний возраст составил 20.3 ± 2.3 лет), соответствующих указанным требованиям и ответивших полностью на все вопросы предложенных нами опросников.
После применения фильтра по качеству анализа геномных библиотек в итоговую анализируемую выборку вошло 35 образцов.
Выделение ДНК. Выделение ДНК из соскобов буккального эпителия проводили с помощью набора MagJET Genomic DNA Kit, #K2722 (Thermo Fisher Scientific Inc., США), по протоколу производителя. Перед началом работы провели измерение концентрации выделенной ДНК. Количественное определение ДНК осуществляли при помощи флуориметра Qubit 2.0 Fluorometer и набора Qubit® dsDNA HS Assay Kit (Thermo Fisher Scientific Inc.).
Подбор ДНК-маркеров. С целью популяционно-генетической характеристики исследуемых выборок и проведения ассоциативного анализа были выбраны 250 одиночных полиморфных маркеров (Single Nucleotide Polymorphism – SNP). Критериями выбора ДНК-маркеров были: связь продуктов генов с развитием и функционированием головного мозга, развитием нейронов и синаптической пластичностью, межнейронными связями; связь генов с патологиями ЦНС; экспрессия генов в мозге и органах эндокринной системы, наличие полиморфизма по каждому маркеру. Для решения первых двух задач использовалась база данных NCBI (National Center for Biotechnology Information, США) – https:// www.ncbi.nlm.nih.gov/genome/guide/human/, для решения третьей задачи – база данных IGSR: The International Genome Sample Resource (http:// www.internationalgenome.org/).
Создание олигонуклеотидов для амплификации ДНК. 250 пар олигонуклеотидов (праймеров) для амплификации фрагментов ДНК, содержащих маркерные SNP, были сконструированы с помощью инструмента Ion Ampliseq Designer (https:// www.ampliseq.com/; Thermo Fisher Scientific Inc.). Синтез праймеров был заказан в Thermo Fisher Scientific.
Создание NGS-библиотеки. В работе использовали метод target selection – выбор целей, суть которого состоит в амплификации определенных участков ДНК, содержащих целевые SNP. Для осуществления метода использовали набор Ion AmpliSeq™ Library Kit 2.0 для создания целевых (таргетных) ДНК-библиотек (Thermo Fisher Scientific Inc.). Работу с набором осуществляли согласно инструкции производителя. Целевые участки ДНК получали методом мультиплексной ПЦР. Для освобождения ампликонов от праймеров и присоединения баркодированных адаптеров, необходимых для связывания ампликона с зондом на поверхности микросферы (адаптер 1), и последующего секвенирования (адаптер 2) использовали Ion Xpress™ Barcode Adapters 1–96 Kit (Thermo Fisher Scientific Inc.). Для количественной оценки ДНК-библиотек использовался метод высокочувствительных флуоресцентных зондов. Измерения осуществляли на флуориметре Qubit 2.0 Fluorometer при помощи набора Qubit® dsDNA HS Assay Kit (Thermo Fisher Scientific Inc.).
Обогащение ДНК-библиотек. Для усиления сигнала от фрагментов ДНК-библиотеки проводили обогащение методом эмульсионной ПЦР на приборе OneTouch™ 2 (Thermo Fisher Scientific Inc.).
NGS-секвенирование. Подготовленной NGS-библиотекой заряжали Ion 318™ Chip, содержимое которого секвенировалось на аппарате Ion PGM System (Thermo Fisher Scientific).
Генотипирование образцов. Файлы с конечными результатами секвенирования загружались в геномный браузер IGV (Integrative Genomics Viewer, Broad Institute of the University of California, США), в котором производилось генотипирование образцов. Все этапы подготовки секвенирования и само секвенирование выполнены сотрудниками Агентства “Химэксперт”.
Статистический анализ. После применения фильтра на мультиколлинеарность векторов значений SNP у анализируемых образцов все коллинеарные переменные были удалены и в итоговый анализ вошли 188 маркеров. С целью оценки однородности исследованной выборки по частотам аллелей и генотипов SNP-маркеров были использованы два независимых метода определения латентной генетической структуры популяций: метод главных компонент (Principal Component Analysis – PCA) и кластерный анализ, реализованный через моделирование Марковскими цепями с вычислением апостериорной вероятности Байеса [30]. Выявление значимых вариантов полиморфизма, связанных с признаками агрессии, осуществляли с применением общей линейной модели (ANOVA) и методом χ2 при анализе таблиц сопряженности. Коррекцию на множественные применения теста (FDR) проводили с применением критерия Бенджамини–Хохберга (Benjamini Y., Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing // J. Royal Stat. Soc. Series B. 1995. V. 57(1). P. 289–300). Для уменьшения количества оцениваемых SNP-маркеров и снижения допустимых значений FDR применяли категориальную регрессию независимых переменных (SNP-маркеры) на оцениваемые признаки агрессии. Для дискретизации признаков во всех случаях использовали числовую шкалу значений признаков, метод группировки с выделением семи категорий (по умолчанию) и последующего снижения их количества при проверке эффективности дискретизации для признаков агрессии, и двух категорий для значений SNP. При проведении регрессионного анализа применяли метод эластичной сети, со штрафными функциями для гребневой регрессии “1” и для Лассо “0.6–1”. Все расчеты проведены в программе IBM SPSS версия 23.
РЕЗУЛЬТАТЫ
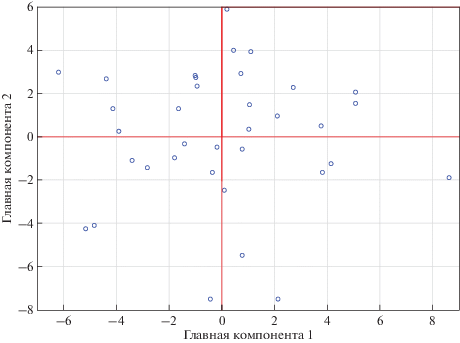
Проверка подразделенности исследованной выборки молодых русских мужчин по генотипам свидетельствует о ее однородности. Первые 11 факторов, выявленные методом PCA, определяют более 2/3 общей изменчивости вошедших в анализ SNP-маркеров. При этом первая главная компонента берет на себя более 39% общей изменчивости (табл. 1). Ни в одном из случаев проекции положения анализируемых образцов на плоскость главных компонент не показано заметной независимой кластеризации образцов в составе двух и более групп. В качестве примера приведена диаграмма распределения образцов в пространстве двух первых главных компонент (рис. 1). Все образцы формируют однородное облако изменчивости.
Таблица 1.
Нагрузки первых 11 главных компонент
| № | Собственные значения главных компонент | % общей изменчивости | Кумулятивные значения | |
|---|---|---|---|---|
| главных компонент | объясненной изменчивости, % | |||
| 1 | 10.70 | 5.69 | 10.70 | 5.69 |
| 2 | 9.73 | 5.18 | 20.43 | 10.87 |
| 3 | 9.08 | 4.83 | 29.51 | 15.70 |
| 4 | 8.66 | 4.61 | 38.17 | 20.30 |
| 5 | 8.30 | 4.42 | 46.48 | 24.72 |
| 6 | 8.02 | 4.27 | 54.50 | 28.99 |
| 7 | 7.87 | 4.19 | 62.37 | 33.17 |
| 8 | 7.55 | 4.02 | 69.92 | 37.19 |
| 9 | 7.08 | 3.76 | 76.99 | 40.95 |
| 10 | 6.99 | 3.72 | 83.98 | 44.67 |
| 11 | 6.88 | 3.65 | 90.86 | 48.33 |
Аналогичный результат был получен в программе STRUCTURE: оптимальное значение апостериорной вероятности Байеса по результатам моделирования пришлось на K = 1, т.е. все анализируемые образцы принадлежат одному кластеру, т.е. одной популяции.
Учитывая однородность анализируемой выборки, все образцы были включены в регрессионный анализ для выявления неслучайных ассоциаций SNP-маркеров с признаками агрессивного поведения. Критерием отбора было значение стандартизованного коэффициента beta большее 0.001 (табл. 2). Для шкал вербальной агрессии и враждебности, вне зависимости от количества анализируемых кластеров признака, было выявлено только по одному значимому фактору регрессии. В обоих случаях дисперсионный анализ подтвердил значимость их связи с соответствующими признаками агрессии. Для шкал “гнев” и “реактивная агрессия” число значимых независимых признаков зависело от числа кластеров, на которое была подразделена шкала изменчивости этих признаков. Уменьшение числа кластеров привело к росту числа значимых факторов регрессии, при этом для обоих признаков единственный значимый независимый фактор, полученный при выделении семи кластеров, также попал в группу значимых факторов регрессии при разбиении шкалы изменчивости на меньшее число кластеров. Дисперсионный анализ подтвердил значимость связи всех выявленных SNP-маркеров с соответствующими признаками. Три значимых фактора регрессии для признаков проактивной агрессии выявляются при подразделении значений признака на семь кластеров, и все проявляют неслучайную связь с агрессивным поведением в соответствии с результатами дисперсионного анализа. Сходный анализ, проведенный для признаков физической агрессии, выявил четыре значимых фактора регрессии, только два из которых подтвердили значимость в соответствии с результатами дисперсионного анализа и учетом уровня ложноположительных результатов (False Discovery Rate, FDR procedure).
Таблица 2.
Оценки значимых SNP-маркеров, полученные с применением категориальной регрессии и многомерного ANOVA
| Агрессивное поведение | Категории | Штрафные функции | ∑SNP | SNP | P (FDR < 0.05) |
||
|---|---|---|---|---|---|---|---|
| значений признака | значений маркеров | гребневая | лассо | ||||
| Физическая агрессия | 7 | 2 | 1 | 0.74 | 4 | rs1047768 | 0.0037 |
| rs6159 | 0.0053 | ||||||
| Вербальная агрессия | 7; 4 | 2 | 1 | 0.84; 0.74 | 1 | rs2824790 | 0.0048 |
| Гнев | 7; 6 | 2 | 1 | 0.88; 0.92 | 1; 2 | rs2274980 | 0.0012 |
| rs2301366 | 0.0129 | ||||||
| Враждебность | 6; 5; 4 | 2 | 1 | 0.90; 0.88; 0.82 | 1 | rs4947 | 0.0129 |
| Проактивная агрессия | 7 | 2 | 1 | 0.78 | 3 | rs1062535 | 0.0117 |
| rs13381941 | 0.0331 | ||||||
| rs1051922 | 0.0424 | ||||||
| Реактивная агрессия | 7; 3 | 2 | 1 | 0.80; 0.64 | 1; 3 | rs1047768 | 0.0092 |
| rs2071214 | 0.0111 | ||||||
| rs915927 | 0.0287 | ||||||
Примечание. ∑SNP – число выявленных маркеров (SNP) со значениями стандартизованных коэффициентов |Beta| ≥ 0.001. P (FDR < 0.05) – вероятность случайного распределения SNP в группах с различными показателями признаков агрессии, в соответствии с анализом ANOVA (приведены результаты для локусов, соответствующих ограничению FDR < 0.05).
В табл. 3 приведены названия генов, соответствующих выявленным SNP-маркерам, и значения χ2-теста, полученные при анализе таблиц сопряженности. При проведении анализа по первичным значениям признаков агрессивности, без предварительной категоризации, подтверждение значимости неслучайной сопряженности признаков агрессии и генотипа было получено только для двух SNP-маркеров: rs13381941 и rs915927. Категоризация переменных осуществлялась в двух режимах. Автоматический режим предусматривал разбиение значений признака агрессии на два класса, с границей, соответствующей среднему значению признака при равномерном распределении показателей признака вдоль шкалы (для показателей физической и вербальной агрессии). При использовании визуального режима введение границ осуществляли произвольно, на основе неравномерного распределения показателей вдоль шкалы. Практически все выявленные связи были подтверждены на высоком уровне значимости. Отметим, что SNP-маркер rs1047768, соответствующий гену ERCC5, оказался значимым для двух шкал агрессивного поведения – физической агрессии и реактивной агрессии.
Таблица 3.
Список выявленных вариантов одиночного полиморфизма, содержащих его гены и точные значения χ2-теста для выявленных SNP, полученные из таблиц сопряженности
| SNP | Ген | Полное название гена | d.f. | χ2 | p |
|---|---|---|---|---|---|
| rs1047768 | ERCC5 | Ген белка ДНК-репарации xeroderma pigmentosum, группа G | 2 | 6.814fiz | 0.0302 |
| 2 | 5.413react | 0.0631 | |||
| rs6159 | CRH | Ген кортикотропин-рилизинг-фактора | 2 | 10.202 | 0.0018 |
| rs2824790 | TMPRSS15 | Ген трансмембранной сериновой протеазы 15 | 2 | 6.438 | 0.0112 |
| rs2274980 | LAMC2 | Ген субъединицы гамма 2 ламинина | 11 | 21.56 | 0.000003 |
| rs2301366 | SEMG1 | Ген семеногелина I | 22 | 15.621 | 0.0004 |
| rs4947 | HSP90AA1 | Ген белка теплового шока 90 альфа А1 | 13 | 5.857 | 0.0155 |
| rs1062535 | ITGA2 | Ген белка интегрина альфа-2 | 24 | 13.586 | 0.0011 |
| rs13381941 | ESCO1 | Ген N-ацетилтрансферазы 1, участвующей в когезии сестринских хроматид | 39 24 |
69.344 15.698 |
0.0094 0.0004 |
| rs1051922 | IFNB1 | Ген регуляторного фактора интерферон 1 | 2 | 7.763 | 0.0147 |
| rs2071214 | BIRC5 | Ген сурвивина (бакуловирусный ингибитор мотива апоптозных повторов 5) | 25 | 16.670 | 0.0002 |
| rs915927 | XRCC1 | Ген белка эксцизионной репарации ДНК XRCC1, ДНК-лигаза, обусловливающая устойчивость клеток к ионизирующему излучению | 30 25 |
41.868 10.951 |
0.0218 0.0042 |
1 Дискретизация значений по шкале “Гнев” на два класса: “8–21” и “22–33”. 2 Дискретизация значений по шкале “Гнев” на два класса: “8–20” и “21–33”. 3 Дискретизация значений по шкале “Враждебность” на два класса: “8–23” и “24–33”. 4 Дискретизация значений по шкале “Проактивная агрессия” на два класса: “0–10” и “11–20”. 5 Дискретизация значений по шкале “Реактивная агрессия” на два класса: “3–13” и “14–22”.
ОБСУЖДЕНИЕ
На основании проведенного статистического анализа из использованных 188 маркеров были отобраны 11, показавших высокую вероятность неслучайной связи с изучаемыми признаками агрессивности. Ни один из этих полиморфных локусов не тестировался нами ранее. Для выявленных маркеров был произведен поиск гипотетически возможных механизмов такой взаимосвязи по данным научных публикаций. Как и в случае с результатами GWAS исследований, проведенных другими авторами [20–23], большинство из выявленных маркеров ассоциированы с нейропептидами, участвующими в развитии и функционировании нервной системы в целом и ее регенерации, развитии отделов головного мозга, ответственных за стрессовые реакции, регуляцию гуморальной системы и межклеточный сигналинг. Для ряда маркеров из этого набора удалось выявить возможные механизмы взаимосвязи с поведенческими признаками.
Так, например, кортикотропин-рилизинг-гормон (CRH) – продукт экспрессии гена CRH – активно участвует в гуморальной регуляции, определяя уровень экспрессии гормонов, производных проопиомеланокортина: β-эндорфина, липотропного гормона, меланоцитстимулирующего гормона. В качестве нейропептида CRH участвует в регуляции психических функций, связанных с ответом на стресс [31]. Его гиперэкспрессия приводит к развитию депрессивного состояния, хронической тревоги и бессонницы [32–34]. Поведенческие паттерны ответа на стресс прямо связаны с реакциями агрессии, и участие CRH в развитии этих реакций заслуживает особого внимания.
Опосредованный механизм связи с поведенческими реакциями был обнаружен для маркера SEMG1 – гена, кодирующего семеногелин 1, один из основных белков спермы [35]. Этот белок участвует в формировании гелевого матрикса, обеспечивающего необходимые свойства спермы, и является предшественником для многих пептидов, выполняющих различные функции. В числе образующихся при протеолизе семеногелина пептидов присутствуют альфа-ингибин-92 и альфа-ингибин-31, которые ингибируют секрецию гипофизом фолликул-стимулирующего гормона [36, 37]. В мужском организме фолликул-стимулирующий гормон стимулирует выработку клетками Сертоли андроген-связывающих белков. Таким образом, продукт экспрессии гена SEMG1 опосредованно влияет на уровень концентрации андрогенов в крови, роль которых в формировании агрессивного поведения доказана [27, 38].
Продукты экспрессии генов LAMC2 и ITGA2 – белки, обеспечивающие межклеточные взаимодействия и участвующие в регуляции процессов развития нервной системы. LAMC2 принадлежит к семейству белков-ламининов – гликопротеинов внеклеточного матрикса и работает во многих биологических процессах, включая межклеточную адгезию, клеточную дифференцировку, миграцию клеток, межклеточный сигналинг и рост дендритов нейронов. Экспрессия LAMC2 повышена в пирамидальных нейронах, основных возбудительных нейронах мозга [39], и характерна для нейронов при формировании патологий – при инвазиях метастаз в периневральную нишу и при формировании прионных заболеваний мозга [40, 41]. ITGA2 (интегрин альфа-2) – мембранный гликопротеин, представляющий альфа-субъединицу трансмембранного рецептора коллагенов, также участвует в процессах межклеточного взаимодействия и сигналинга. Связь ITGA2 с формированием и эффективностью работы нейронных ансамблей может быть прямой и опосредованной. Прямое действие этого гена на состояние нейронов подтверждается повышенной чувствительностью мотонейронов к ферроптозу – специфической форме некроза, связанной с железо-зависимым перекисным окислением липидов. Ферроптоз мотонейронов в экспериментах на мышиной модели и NSC-34 клеточной культуре сопровождается гиперэкспрессией ITGA2 [42], что предполагает существование специфических клеточных и/или тканевых механизмов спасения нейронов в условиях перекисного стресса. Об опосредованном влиянии ITGA2 на работу мозга свидетельствуют данные по связи генетического полиморфизма ITGA2 с риском формирования ишемического инсульта [43, 44]. У пациентов с нарушением мозгового кровообращения и генотипом, гомозиготным по C807T и G873A SNPs гена ITGA2, отмечена гиперлипедемия [45], что свидетельствует о нарушении функции поджелудочной железы. Ген ITGA2 также связан с формированием патологических изменений ткани поджелудочной железы, например при протоковой аденокарциноме [46].
В свою очередь, поджелудочная железа участвует в сложной сети эндокринных регуляций, секретируя в том числе соматостатин. Соматостатин подавляет секрецию соматотропин-рилизинг-гормона гипоталамуса, соматотропина и тиреотропина гипофиза, секрецию серотонина. Нарушения физиологических функций поджелудочной железы, таким образом, может приводить к обширному набору изменений гормональных регуляций, связанных, в том числе, и с психическими реакциями. Многочисленными исследованиями показана связь между уровнем серотонина у человека и агрессивным поведением [47, 48], а также ассоциация полиморфных вариантов генов транспортера серотонина и рецепторов серотонина с разными типами агрессии [49]. В нашем раннем исследовании было показано, что полиморфизм гена HTR2A значимо ассоциирован с самооценкой по физической агрессии и гневу [15]. Следует отметить, что в настоящем исследовании SNP по этому гену не проявил значимой ассоциации с каким-либо из тестируемых типов агрессии.
Белок, экспрессируемый геном ERCC5, представляет собой эндонуклеазу, участвующую в репарации ДНК. Мутации этого гена приводят к таким наследственным заболеваниям, как пигментная ксеродерма, синдром Коккейна, артрогрипоз и кахексия [50]. Показана связь больных пигментной ксеродермой, вызванной мутацией в данном гене, с неврологической дегенерацией, в том числе легкой умственной отсталостью [51]. Неврологические нарушения разной тяжести сопровождают также остальные заболевания, вызванные мутациями ERCC5 [52, 53].
Ген ESCO1, кодирующий когезин-ацил-трансферазу, участвующую в формировании когезинового комплекса, обеспечивающего конъюгацию сестринских хромосом (establishment of sister chromatid cohesion), гиперэкспрессирован при посттравматическом стрессовом расстройстве (PTSD) [54]. ESCO1 является одним из ключевых генов, регулирующих развитие нервной системы [55]. Нарушения формирования когезинового комплекса приводят к развитию Cornelia de Lange syndrome-1 (CDLS1), характеристики которого включают аутизм, задержку развития нервной системы и варьирующую умственную отсталость [56–58].
Ген TMPRSS15 кодирует трансмембранную сериновую протеазу, конвертирующую панкреотический трипсиноген в трипсин. Этот ген также гиперэкспрессирован при PTSD [59]. Показано, что сериновая протеаза TMPRSS15 принимает участие в модуляции объема прилежащего ядра вентральной части полосатого тела, участвующего в системе вознаграждений, формировании удовольствия, смеха, зависимости и агрессии [59]. Трипсин и родственные сериновые протеазы, в том числе и TMPRSS15, играют важную роль в развитии нервной системы, нейрорегенерации и синаптической пластичности, особенно в формировании памяти [60, 61].
Сурвивин, или BIRC5, является ингибитором апоптоза. Экспрессия гена этого белка в нейронах связана с интенсивностью роста аксонов и дендритов, и замедленный нейрональный процесс связан с гиперэкспрессией этого гена [62]. При регенерационных процессах, связанных с внутрицеребральным кровоизлиянием, экспрессия BIRC5 повышена в астроцитах, способствуя их пролиферации [63].
Интерферон бета-1, кодируемый геном IFNB1, является цитокином, оказывающим нормализующий эффект на экспрессию про- и противовоспалительных агентов в мозге, приводя в целом к подавлению воспалительной реакции [64]. Его экспрессия повышена при воспалительных реакциях, сопровождающих болезни накопления гликосфонголипидов (болезни Гоше и Краббе – Gaucher’s and Krabbe’s disease), выполняя роль защиты нейронов [65]. Инъекции интерферона бета-1 больным рассеянным склерозом с нарушением когнитивных функций приводят к восстановлению психических способностей, что предполагает восстановление пораженных участков мозга [66].
Скаффолдный белок XRCC1 обеспечивает формирование белковых комплексов, участвующих в восстановлении одноцепочечных разрывов ДНК. SNP-аллели, инактивирующие ген этого белка, приводят к гиперэкспрессии гена PARP1, кодирующего НАД+-АДФ-рибозилтрансферазу-1, что в конечном итоге вызывает мозжечковую атаксию, моторную атаксию глаз и аксональную нейропатию [67]. Можно предполагать, что изменения в экспрессионной активности гена XRCC1 будут оказывать слабые, но значимые влияния на жизнеспособность нейронов и нейрональные процессы, выражающиеся в формировании ансамблей нейронов, в разных отделах головного мозга.
Ген HSP90AA1 кодирует стресс-индуцибельный 90-кДа белок теплового шока альфа Hsp90A. При лобно-височной долевой дегенерации отмечено значимое снижение уровня фосфорилирования Hsp90A [68], что свидетельствует о значимой роли фосфорилированной формы данного белка для выживания нейронов лобно-височных долей мозга. Выступая в качестве шаперона, Hsp90A обеспечивает правильную посттрансляционную сборку белков-партнеров и напротив разборку и последующую деградацию комплексов промежуточных филаментов, образующихся при неправильной сборке белков в условиях клеточного стресса. Так, при гигантской аксональной нейропатии (Giant axonal neuropathy), вызванной мутацией гена GAN, кодирующего белок цитоскелета гигаксонин, и приводящей к его пониженной экспрессии, гибель нейронов обусловлена накоплением комплексов промежуточных филаментов. Hsp90A выполняет защитную роль, участвуя в процессе разборки и деградации этих комплексов [69].
Результаты настоящего исследования следует рассматривать с определенной долей осторожности в силу небольшого размера анализируемой выборки. Вместе с тем, как отмечалось выше, выборка была сформирована из представителей одной популяции, являлась однородной по полу, возрасту, социо-экономическому происхождению, и состояла только из лиц, ранее не страдающих психическими нарушениями, что позволяет рассматривать ее как вариант нормы. В дальнейших исследованиях планируется увеличить размеры выборки с использованием того же набора SNP-маркеров. Это поможет определить устойчивость выявленных ассоциаций между изучаемыми формами агрессии и генетическими составляющими.
Необходимо также отметить, что все SNP-маркеры, значимость полиморфизма которых для экспрессии агрессивного поведения продемонстрирована в данной работе, представляют гены, которые до сих пор не включались в исследования с использованием генов-кандидатов. С другой стороны, несколько традиционных используемых генов-кандидатов никак не проявили себя в плане контроля агрессивного поведения. Полученный результат подчеркивает важность расширения круга используемых генов-кандидатов в исследованиях генетических основ агрессивного поведения человека.
Авторы выражают благодарность за помощь в проведении молекулярного анализа и консультации сотрудникам Агентства “Химэксперт” к. б. н. А.Г. Плугову и И.А. Волкову.
Материалы для данной статьи, молекулярно-генетический и биоинформатический анализы проведены в рамках гранта ОФИ-М № 17-29-02203 и в соответствии с планом научно-исследовательских работ Института этнологии и антропологии им. Н.Н. Миклухо-Маклая РАН, Института биологии развития им. Н.К. Кольцова РАН и Института общей генетики им. Н.И. Вавилова РАН.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Waltes R., Chiocchetti A.G., Freitag C.M. The neurobiological basis of human aggression: a review on genetic and epigenetic mechanisms // Am. J. Med. Genet. Part B: Neuropsychiatr. Genet. 2016. V. 171. № 5. P. 650–675.
Veroude K., Zhang-James Y., Fernàndez-Castillo N. et al. Genetics of aggressive behavior: an overview // Am. J. Med. Genet. Part B: Neuropsychiatr. Genet. 2016. V. 171. № 1. P. 3–43.
Labella M.H., Masten A.S. Family influences on the development of aggression and violence // Current Opinion Psychol. 2018. V. 19. P. 11–16.
Tremblay R.E., Vitaro F., Côté S.M. Developmental origins of chronic physical aggression: A bio-psycho-social model for the next generation of preventive interventions // Annual Rev. Psychol. 2018. V. 69. P. 383–407.
Chistiakov D.A., Chekhonin V.P. Early-life adversity-induced long-term epigenetic programming associated with early onset of chronic physical aggression: Studies in humans and animals // The World J. Biol. Psychiatry. 2019. V. 20. № 4. P. 258–277.
Tuvblad C., Baker L.A. Human aggression across the lifespan: Genetic propensities and environmental moderators // Advances Genet. 2011. V. 75. P. 171–214.
Saltz J.B. Gene–environment correlation in humans: Lessons from psychology for quantitative genetics // J. Heredity. 2019. V. 110. № 4. P. 455–466.
Briley D.A., Livengood J., Derringer J. et al. Interpreting behavior genetic models: seven developmental processes to understand // Behavior Genet. 2019. V. 49. № 2. P. 196–210.
Gard A.M., Dotterer H.L., Hyde L.W. Genetic influences on antisocial behavior: Recent advances and future directions // Current Opinion Psychol. 2019. V. 27. P. 46–55.
Burt S.A. Are there meaningful etiological differences within antisocial behavior? Results of a meta-analysis // Clin. Psychol. Rev. 2009. V. 29. № 2. P. 163–178. https://doi.org/10.1016/j.cpr.2008.12.004
Craig I.W., Halton K.E. Genetics of human aggressive behavior // Hum. Genet. 2009. V. 126. № 1. P. 101–113.
Pavlov K.A., Chistiakov D.A., Chekhonin V.P. Genetic determinants of aggression and impulsivity in humans // J. Appl. Genet. 2012. V. 53. № 1. P. 61–82.
Butovskaya M.L., Vasilyev V.A., Lazebny O.E. et al. Aggression, digit ratio, and variation in the androgen receptor, serotonin transporter, and dopamine D4 receptor genes in african foragers: The Hadza // Behavior Genet. 2012. V. 42. P. 647–662. https://doi.org/10.1007/s10519-012-9533-2
Butovskaya M.L., Vasilyev V.A, Lazebny O.E. et al. Aggression and polymorphisms in AR, DAT1, DRD2, and COMT genes in Datoga pastoralists of Tanzania // Sci. Reports. 2013. V. 3. P. 3148. https://doi.org/10.1038/srep03148
Butovskaya M.L., Butovskaya P.R., Vasilyev V.A. et al. Serotonergic gene polymorphisms (5-HTTLPR, 5HTR1A, 5HTR2A), and population differences in aggression: traditional (Hadza and Datoga) and industrial (Russians) populations compared // J. Physiol. Anthropol. 2018. V. 37. № 1. P. 10. https://doi.org/10.1186/s40101-018-0171-0
Sukhodolskaya E.M., Vasilyev V.A., Shibalev D.V. et al. Comparative analysis of polymorphisms of the serotonin receptor genes HTR1A, HTR2A, and HTR1B in Hadza and Datoga males // Rus. J. Genetics. 2015. V. 51. № 11. P. 1129–1134. https://doi.org/10.1134/S1022795415110162
Sukhodolskaya E.M., Fehretdinova D.I., Shibalev D.V. et al. Polymorphisms of dopamine receptor genes DRD2 and DRD4 in African populations of Hadza and Datoga differing in the level of culturally permitted aggression // Ann. Hum. Genet. 2018. V. 82. № 6. P. 407–414. https://doi.org/10.1111/ahg.12263
Vasilyev V.A., Martirosyan I.A., Shibalev D.V. et al. Polymorphism of the dopamine D4 receptor (DRD4) and serotonin transporter (5-HTTL) gene promoter regions in African tribes of Hadza and Datoga // Rus. J. Genetics. 2011. V. 47. № 2. P. 226–229.
Vassos E., Collier D.A., Fazel S. Systematic meta-analyses and field synopsis of genetic association studies of violence and aggression // Mol. Psychiatry. 2014. V. 4. P. 471–477. https://doi.org/10.1038/mp.2013.31
Fernàndez-Castillo N., Cormand B. Aggressive behavior in humans: genes and pathways identified through association studies // Am. J. Med. Genet. B. Neuropsychiatr. Genet. 2016. V. 171. № 5. P. 676–696.
Anney R.J., Lasky-Su J., O’Dushlaine C. et al. Conduct disorder and ADHD: Evaluation of conduct problems as a categorical and quantitative trait in the international multicentre ADHD genetics study // Am. J. Med. Genet. Part B: Neuropsychiatr. Genet. 2008. V. 147B. № 8. P. 1369–1378.
Tielbeek J.J., Medland S.E., Benyamin B. et al. Unraveling the genetic etiology of adult antisocial behavior: A genome-wide association study // PLoS One. 2012. V. 7. № 10. P. e45086.
Merjonen P., Keltikangas-Jarvinen L., Jokela M. et al. Hostility in adolescents and adults: A genome-wide association study of the Young Finns // Transl. Psychiatry. 2011. V. 1. № 6. P. e11. https://doi.org/10.1038/tp.2011.13
Buss A.H., Perry M. The aggression questionnaire // J. Pers. Soc. Psychol. 1992. V. 63. № 3. P. 452–459.
Бутовская М.Л., Веселовская Е.В., Година Е.З. и др. Морфо-функциональные и личностные характеристики мужчин спортсменов как модель адаптивных комплексов в палеореконструкциях // Вестник МГУ. Серия XXIII. Антропология. 2011. № 2. С. 4–17.
Butovskaya M., Burkova V., Karelin D., Fink B. Digit ratio (2D:4D), aggression and dominance in the Hadza and the Datoga of Tanzania // Am. J. Hum. Biol. 2015. V. 27. P. 620–627. https://doi.org/10.1002/ajhb.22718
Butovskaya M.L., Lazebny O.E., Vasilyev V.A. et al. Androgen receptor gene polymorphism, aggression, and reproduction in Tanzanian foragers and pastoralists // PLoS One. 2015. V. 10. № 8. P. e0136208. https://doi.org/10.1371/journal.pone.0136208
Dodge K.A. The structure and function of reactive and proactive aggression // The Development and Treatment of Childhood Aggression // Eds Pepler D.J., Rubin K.H. Hillsdale, N.J. US: Lawrence Erlbaum Associates Inc., 1991. P. 201–218.
Fung A.L., Raine A., Gao Y. Cross-cultural generalizability of the Reactive–Proactive Aggression Questionnaire (RPQ) // J. Personality Assessment. 2009. V. 91. № 5. P. 473–479.
Hubisz M.J., Falush D., Stephens M., Pritchard J.K. Inferring weak population structure with the assistance of sample group information // Mol. Ecol. Res. 2009. V. 9. P. 1322–1332.
Dedic N., Chen A., Deussing J.M. The CRF family of neuropeptides and their receptors – mediators of the central stress response // Curr. Mol. Pharmacol. 2018. V. 11. № 1. P. 4–31. https://doi.org/10.2174/1874467210666170302104053
Raadsheer F.C., van Heerikhuize J.J., Lucassen P.J. et al. Corticotropin-releasing hormone mRNA levels in the paraventricular nucleus of patients with Alzheimer’s disease and depression // Am. J. Psychiatry. 1995. V. 152. № 9. P. 1372–1376. https://doi.org/10.1176/ajp.152.9.1372
Jokinen J., Boström A.E., Dadfar A. et al. Epigenetic changes in the CRH gene are related to severity of suicide attempt and a general psychiatric risk score in adolescents // EBioMedicine. 2018. V. 27. P. 123–133. https://doi.org/10.1016/j.ebiom.2017.12.018
Wang S.-C., Lin C.-C., Tzeng N.-S. et al. Effects of oxytocin on prosocial behavior and the associated profiles of oxytocinergic and corticotropin-releasing hormone receptors in a rodent model of posttraumatic stress disorder // J. Biomed. Sci. 2019. V. 26. № 1. https://doi.org/10.1186/s12929-019-0514-0
Lilja H., Abrahamsson P.A., Lundwall A. Semenogelin, the predominant protein in human semen. Primary structure and identification of closely related proteins in the male accessory sex glands and on the spermatozoa // J. Biol. Chem. 1989. V. 264. № 3. P. 1894–1900.
Yu W.H., McCann S.M., Li C.H. Synthetic human seminal a-inhibin-92 selectively suppresses follicle-stimulating hormone release in vivo // Proc. Natl Acad. Sci. USA. 1988. V. 85. P. 289–292.
Yu W.H., Riedel M., Yamashiro D. et al. Effects of alpha-inhibin-92 fragments and alpha-inhibin-92 antiserum on the control of follicle-stimulating hormone release in male rats // Life Sci. 1994. V. 55. № 2. P. 93–102.
Ribeiro E., Jr., Neave N., Morais R.N. et al. Digit ratio (2D: 4D), testosterone, cortisol, aggression, personality and hand-grip strength: Evidence for prenatal effects on strength // Early Hum. Development. 2016. V. 100. P. 21–25.
Ouwenga R., Lake A.M., Aryal S. et al. The differences in local translatome across distinct neuron types is mediated by both baseline cellular differences and post-transcriptional mechanisms // eNeuro. 2019. V. 5. № 6. https://doi.org/10.1523/ENEURO.0320-18.2018
Mitsunaga S., Fujii S., Ishii G. et al. Nerve invasion distance is dependent on laminin γ2 in tumors of pancreatic cancer // Intern. J. Cancer. 2010. V. 127. P. 805–819.
Majer A., Medina S.J., Niu Y. et al. Early mechanisms of pathobiology are revealed by transcriptional temporal dynamics in hippocampal CA1 neurons of prion infected mice // PLoS Pathog. 2012. V. 8. № 11. P. e1003002. https://doi.org/10.1371/journal.ppat.1003002
Martinez A.M., Mirkovic J., Stanisz Z.A. et al. NSC-34 motor neuron-like cells are sensitized to ferroptosis upon differentiation // FEBS Open Bio. 2019. V. 9. № 4. P. 582–593. https://doi.org/10.1002/2211-5463.12577
Matarin M., Brown W.M., Hardy J.A. et al. For the SWISS, ISGS, and MSGD study groups. Association of integrin α2 gene variants with ischemic stroke // J. Cerebral Blood Flow & Metabolism. 2008. V. 28. P. 81–89. https://doi.org/10.1038/sj.jcbfm.9600508
Wu G., Xi Y., Yao L. et al. Genetic polymorphism of ITGA2 C807T can increase the risk of ischemic stroke // Int. J. Neurosci. 2014. V. 124. № 11. P. 841–851. https://doi.org/10.3109/00207454.2013.879718
Al-Qaisi R.M., Al-Ani L., Al-Halbosiy M.M.F. Genetic polymorphism of ITGA2 gene and the risk of heart attack and stroke in Al-Anbar population // Iraq. J. Pharm. Sci. & Res. 2018. V. 10. № 9. P. 2305–2308.
Liu L., Wang S., Cen C. et al. Identification of differentially expressed genes in pancreatic ductal adenocarcinoma and normal pancreatic tissues based on microarray datasets // Mol. Med. Rep. 2019. V. 20. № 2. P. 1901–1914. https://doi.org/10.3892/mmr.2019.10414
Soubrié P. Reconciling the role of central serotonin neurons in human and animal behavior // Behavioral and Brain Sci. 1986. V. 9. P. 319–364.
Pihl R.O., Lemarquand D. Serotonin and aggression and the alcohol-aggression relationship // Alcohol and Alcoholism. 1998. V. 33. P. 55–65.
Olivier B. Serotonin and aggression // Ann. N.Y. Acad. Sci. 2004. V. 1036. P. 382–392.
Drury S., Boustred C., Tekman M. et al. A novel homozygous ERCC5 truncating mutation in a family with prenatal arthrogryposis – further evidence of genotype–phenotype correlation // Am. J. Med. Genet. A. 2014. V. 164A. № 7. P. 1777–1783. https://doi.org/10.1002/ajmg.a.36506
Chikhaoui A., Elouej S., Nabouli I. et al. Identification of a ERCC5 c.2333T>C (L778P) variant in two Tunisian siblings with mild xeroderma pigmentosum phenotype // Front. Genet. 2019. V. 10. P. 111. https://doi.org/10.3389/fgene.2019.00111
Bamshad M., Van Heest A.E., Pleasure D. Arthrogryposis: A review and update // J. Bone Joint Surg. Am. 2009. V. 91. Suppl. 4. P. 40–46. https://doi.org/10.2106/JBJS.I.00281
Javadzadeh M. Cockayne syndrome // Iran J. Child. Neurol. 2014. V. 8. № 4 (Suppl. 1) P. 18–19.
Rusch H.L., Robinson J., Yun S. et al. Gene expression differences in PTSD are uniquely related to the intrusion symptom cluster: A transcriptome-wide analysis in military service members // Brain Behav. Immun. 2019. V. 80. P. 904–908. https://doi.org/10.1016/j.bbi.2019.04.039
Cara L., Baitemirova M., Follis J. et al. The ATM- and ATR-related SCD domain is over-represented in proteins involved in nervous system development // Sci. Rep. 2016. V. 8. № 6. P. 19050. https://doi.org/10.1038/srep19050
Jackson L., Kline A.D., Barr M.A., Koch S. de Lange syndrome: a clinical review of 310 individuals // Am. J. Med. Genet. 1993. V. 47. № 7. P. 940–946.
Deardorff M.A., Kaur M., Yaeger D. et al. Mutations in cohesin complex members SMC3 and SMC1A cause a mild variant of cornelia de Lange syndrome with predominant mental retardation // Am. J. Hum. Genet. 2007. V. 80. № 3. P. 485–494.
Horsfield J.A., Print C.G., Mönnich M. Diverse developmental disorders from the one ring: distinct molecular pathways underlie the cohesinopathies // Frontiers Genet. 2012. V. 3. P. 171. https://doi.org/10.3389/fgene.2012.00171
Morey R.A., Davis S.L., Garrett M.E. et al. Genome-wide association study of subcortical brain volume in PTSD cases and trauma-exposed controls // Transl. Psychiatry. 2017. V. 7. Article Number: 1265. https://doi.org/10.1038/s41398-017-0021-6
Wang Y., Luo W., Reiser G. Trypsin and trypsin-like proteases in the brain: proteolysis and cellular functions // Cell. Mol. Life Sci. 2008. V. 65. P. 237–252. https://doi.org/10.1007/s00018-007-7288-3
Almonte A.G., Sweatt J.D. Serine proteases, serine protease inhibitors, and protease-activated receptors: roles in synaptic function and behavior // Brain Res. 2011. V. 1407. P. 107–122. https://doi.org/10.1016/j.brainres.2011.06.042
Oe T., Nagashima T., Muramoto M. et al. CyclinB2 and BIRC5 genes as surrogate biomarkers for neurite outgrowth in SH-SY5Y subclonal cells // Neuropharmacology. 2006. V. 50. № 8. P. 1041–1047.
Park H.J., Kim J.W., Kim H.S., Chung J.H. Association between missense SNP rs2071214 of BIRC5 gene and intracerebral hemorrhage in Korean population // J. Neurol. Sci. 2016. V. 367. P. 211–212. https://doi.org/10.1016/j.jns.2016.06.007
Kieseier B.C. The mechanism of action of interferon-β in relapsing multiple sclerosis // CNS Drugs. 2011. V. 25. № 6. P. 491–502. https://doi.org/10.2165/11591110-000000000-00000
Vitner E.B., Farfel-Becker T., Ferreira N.S. et al. Induction of the type I interferon response in neurological forms of Gaucher disease // J. Neuroinflammation. 2016. V. 13. № 1. P. 104. https://doi.org/10.1186/s12974-016-0570-2
Comi G., Patti F., Rocca M.A. et al. Efficacy of fingolimod and interferon beta-1b on cognitive, MRI, and clinical outcomes in relapsing-remitting multiple sclerosis: an 18-month, open-label, rater-blinded, randomised, multicentre study (the GOLDEN study) // J. Neurol. 2017. V. 264. № 12. P. 2436–2449. https://doi.org/10.1007/s00415-017-8642-5
Hoch N.C., Hanzlikova H., Rulten S.L. et al. XRCC1 mutation is associated with PARP1 hyperactivation and cerebellar ataxia // Nature. 2017. V. 541. № 7635. P. 87–91. https://doi.org/10.1038/nature20790
Herskowitz J.H., Seyfried N.T., Duong D.M. et al. Phosphoproteomic analysis reveals site-specific changes in GFAP and NDRG2 phosphorylation in frontotemporal lobar degeneration // J. Proteome Res. 2010. V. 9. № 12. P. 6368–6379. https://doi.org/10.1021/pr100666c
Johnson-Kerner B.L., Garcia Diaz A., Ekins S., Wichterle H. Kelch domain of gigaxonin interacts with intermediate filament proteins affected in giant axonal neuropathy // PLoS One. 2015 V. 10. № 10. P. e0140157. https://doi.org/10.1371/journal.pone.0140157
Дополнительные материалы отсутствуют.