Генетика, 2021, T. 57, № 10, стр. 1205-1210
Генетическая изменчивость древовидных можжевельников секции Sabina: данные из Дагестана, Армении и Крыма
Г. А. Садыкова 1, Е. В. Хантемирова 2, М. А. Полежаева 2, *, Х. У. Алиев 1
1 Горный ботанический сад – обособленное подразделение Дагестанского федерального исследовательского центра Российской академии наук
367000 Махачкала, Россия
2 Институт экологии растений и животных Уральского отделения
Российской академии наук
620144 Екатеринбург, Россия
* E-mail: polezhaevam@mail.ru
Поступила в редакцию 03.11.2020
После доработки 04.12.2020
Принята к публикации 23.12.2020
Аннотация
Проведен анализ изменчивости межгенных спейсеров petN–psbM, trnD–trnT, trnL–trnF и trnS–trnG хлоропластной ДНК у охраняемых близкородственных видов можжевельников Juniperus excelsa, J. polycarpos и J. foetidissima на территории Кавказа и Крыма – северных пределах своего распространения. Анализ молекулярной дисперсии показал высокую степень дифференциации трех таксонов (GCT = 0.9905, P < 0.0001). Всего выявлено семь гаплотипов. Высоким генетическим разнообразием характеризуется популяция J. foetidissima из Армении (Н = 0.442), меньшим – J. excelsa (Н = 0.200); популяции J. polycarpos оказались мономорфными. Изученные образцы, совместно с включенными в анализ образцами из Генбанка с основной части ареала, сформировали три клады, соответствующие трем таксонам с высокой статистической поддержкой.
Таксономическая идентификация вида сводится к его комплексной оценке по морфологии, анатомии, биологии развития, географии, экологии и др. признакам, на которых основывается фенотипическая систематика. В свою очередь дополнением к классической феносистематике служат данные геносистематики, позволяющие прояснить и упорядочить таксономическую структуру близкородственных видов.
Объекты исследования – можжевельник многоплодный Juniperus polycarpos C. Koch, можжевельник высокий J. excelsa Bieb. и можжевельник вонючий J. foetidissima Willd – виды со схожей морфологией, представители секции Sabina. Это редкие и охраняемые виды, реликты, занесенные в Красную книгу России [1] или региональные Красные книги [2–4]. Область их распространения – Черноморское побережье Кавказа (от Анапы до Геленджика), Крым, Дагестан; за пределами России встречаются на Балканах, в Юго-Западной Азии (Иран, Афганистан, Турция, Сирия, Ливан, Ирак).
Исследуемые виды – древовидные можжевельники, образующие разреженные леса и редколесья. Можжевеловые редколесья Кавказа и Крыма подразделяются на два географических варианта. Первый – восточносредиземноморский, распространен на Черноморском побережье Кавказа (в р-не г. Новороссийск) и в Южном Крыму и образован мезоксерофитами J. excelsa и J. foetidissima. Второй – западноиранский, распространен в Восточном и Южном Закавказье (Армения, Азербайджан) и в Дагестане; образован ксерофитом J. polycarpos [5]. Оба типа редколесий представляют собой уникальные растительные сообщества арчовников, включающие много редких и охраняемых видов, и, таким образом, выполняют важную экологическую функцию [6, 7].
В широком понимании J. excelsa s.l. включает J. polycarpos и J. excelsa, а также распространенные в Средней Азии J. seravschanica Kom и J. turcomanica B. Fedtsch., образуя комплекс морфологически сходных таксонов. Таксономический статус этих видов менялся неоднократно [8], но и сегодня систематическое положение J. polycarpos и J. excelsa, произрастающих на Кавказе, остается спорным. Так, например в “Конспекте флоры Кавказа” [9] J. polycarpos приводится в ранге подвида (J. excelsa subsp. polycarpos), но многими авторами рассматривается в качестве самостоятельного вида [10–13]. Видовой статус J. foetidissima не считается спорным, однако схожая экологическая приуроченность и совместное произрастание с J. polycarpos или J. excelsa (например в Краснодарском крае и Армении) часто затрудняет его видовую идентификацию по морфологическим признакам.
Молекулярно-генетические исследования всех трех видов и близкородственных им представлены в многочисленных работах [13–18] и наиболее подробно проанализированы в монографической сводке по роду Juniperus [19]. Анализ распространения видов проведен для территории Турции, Ливана, Греции, Болгарии, Азербайджана, Армении, Ирана, за рамками данных исследований оказались территории Западного и Восточного Кавказа (Краснодарский край, Дагестан), Крыма и Закавказья [12].
В настоящей работе проведена оценка параметров генетического разнообразия и структуры природных популяций J. excelsa, J. polycarpos и J. foetidissima на северных территориях (пределах) распространения, выявлены генетические связи с представителями из основной части ареала с использованием межгенных спейсеров хлоропластной ДНК (хпДНК). Данные о генетической изменчивости и уточнении таксономии этих видов дополнят информацию о видообразовании в секции Sabina, а также будут актуальны при разработке природоохранных мер.
Всего проанализировано 48 образцов можжевельника из шести природных популяций. J. excelsa – 17 особей, J. polycarpos– 15 особей, J. foetidissima – 16 (табл. 1). Тотальную ДНК выделяли СТАВ-методом [20] из высушенных в силикагеле листьев. Амплификацию некодирующих регионов petN–psbM, trnD–trnT, trnL–trnF и trnS–trnG проводили с использованием универсальных праймеров, температурных режимов и протоколов, рекомендованных для этих регионов в работе F. Hojjati с соавт. [13]. Нуклеотидные последовательности регионов хпДНК определяли на генетическом анализаторе ABI 3130 (Applied Biosystems, USA); выравнивание и объединение в единую матрицу проводили в программе BioEdit [21]. Расчет числа гаплотипов (Nh), показателя гаплотипического разнообразия (H), уровней дифференциации и распределения генетической изменчивости внутри и между популяциями (анализ молекулярной дисперсии, AMOVA) проводили в программе Arlequin v. 3.5.1.2 [22]. Дерево отношений гаплотипов хпДНК построено в программе Network v. 4.6.1.2 [23]. Филогенетическое дерево для всех образцов построено с использованием байесовского анализа в программе MrBayes v. 3.1.2 [24] на основе модели нуклеотидных замен GTR + G + + I. Каждая мутация (мононуклеотидная замена или индел, независимо от размера), кодировалось как единичное мутационное событие. Для построения деревьев включены данные из Генбанка по образцам из основной части ареала. Эти дополнительные образцы выбраны из работы F. Hojjati с соавт. [13]. Для J. polycarpos образцы под номерами 8761, 14162, 14164, 14166, 14167, 141171; для J. exсelsa – 8785, 8786, 9433, 13720, 13721, 14155, 14742; для J. foetidissima – 73845, 5645, 5646, 17035, 20431. Гаплотипы образцов составлены по последовательностям соответствующих фрагментов, взятых из Генбанка (по номерам, указанным в работе [13]). В качестве внешней группы выбран Juniperus sabina образец 14316 из Азербайджана [13], относящийся к той же секции Sabina (Mill.) Spach.
Таблица 1.
Географические координаты мест сбора и показатели генетического разнообразия хпДНК в изученных выборках можжевельника
| Популяции | Координаты, с.ш./в.д. | N | Nh | H |
|---|---|---|---|---|
| 1. J. excelsa – Крым, Судак | 44°52′/34°55′ | 7 | h6:7 | 0 |
| 2. J. excelsa – Краснодарский край, Геленджик | 44°39′/37°56′ | 10 | h6:(9); h7:(1) | 0.200 |
| 3. J. polycarpos – Дагестан, Талгинское ущелье | 42°52′/47°24′ | 5 | h5:(5) | 0 |
| 4. J. polycarpos – Дагестан, Анцух | 42°20′/46°27′ | 5 | h5:(5) | 0 |
| 5. J. polycarpos – Армения, Вайк | 39°41′27′′/45°32′31′′ | 5 | h5:5 | 0 |
| 6. J. foetidissima – Армения, Овк | 40°47′/45°03′ | 16 | h1:(12); h2:(1); h3:(1); h4:(2) | 0.442 |
Длина объединенной последовательности по четырем фрагментам составила 2916 пн (trnD–trnT: 679 пн, trnS–trnG: 690 пн, trnL–trnF: 712 пн, petN–psbM: 835 пн). Выявлено 45 вариабельных сайтов (табл. 2), из них во фрагменте trnD–trnT – семь мононуклеотидных замен и два индела; во фрагменте trnS–trnG – шесть монокуклеотидных замен; одна динуклеотидная замена и пять инделов; во фрагменте trnL–trnF – четыре мононуклеотидных замены и три индела; во фрагменте petN–psbM – девять мононуклеотидных замен, одна тринуклеотидная и семь инделов. Изменчивость сгруппировалась в семь гаплотипов (h1–h7). Последовательности набора фрагментов для каждого гаплотипа размещены в Генбанке под номерами доступа MW186935–MW186951.
Таблица 2.
Сегрегирующие сайты для семи гаплотипов хпДНК. Референсный гаплотип h1
| Гаплотип | Позиция нуклеотида | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| trnD-trnT | trnS-trnG | trnL-trnF | petN-psbM | ||||||||||||||||||||||||||||||||||||||||||
| 12 | 56 | 90 | 118 | 339 | 464 | 498 | 557 | 589 | 16 | 42 | 52 | 95 | 116 | 193 | 202 | 203 | 235 | 295 | 360 | 603 | 146 | 278 | 390 | 483 | 508 | 523 | 543 | 49 | 129 | 238 | 301 | 363 | 414 | 431 | 448 | 479 | 568 | 581 | 639 | 642 | 643 | 661 | 671 | 673 | |
| h1 | T | C | A | A | a | T | G | C | – | AC | A | – | T | T | C | – | G | – | G | – | e | T | A | C | C | TA | – | C | A | C | TAT | G | C | C | C | f | – | – | A | AAA | A | A | А | C | C |
| h2 | T | C | A | A | – | T | G | C | – | AC | A | – | T | T | C | – | G | – | G | – | e | T | A | C | C | TA | – | C | A | C | TAT | G | C | C | C | f | – | – | A | AAA | A | T | А | C | C |
| h3 | T | C | A | A | a | T | G | C | – | AC | A | – | T | T | C | – | G | – | G | – | e | T | – | C | C | TA | A | C | G | C | TAT | G | C | C | C | f | – | – | A | AAA | A | A | А | C | C |
| h4 | T | C | A | A | – | T | G | C | – | AC | A | – | T | T | C | – | G | – | G | – | e | T | A | C | C | TA | – | C | A | C | TAT | G | C | C | C | f | – | – | A | AAA | A | A | А | C | C |
| h5 | T | A | – | A | – | T | T | T | b | CТ | G | c | C | C | C | T | T | d | A | T | – | C | A | G | C | – | – | G | A | A | ATA | T | T | G | A | – | – | g | A | AAA | T | A | А | A | A |
| h6 | A | A | – | C | – | C | T | T | b | CT | A | – | C | C | A | T | T | d | A | T | – | C | A | G | A | – | – | G | A | A | CTA | T | T | G | A | f | T | – | C | – | – | – | – | C | A |
| h7 | A | A | – | C | – | C | G | T | b | CT | A | – | C | C | A | T | T | d | A | T | – | C | A | G | A | – | – | G | A | A | CTA | T | T | G | A | f | T | – | C | – | – | – | – | C | A |
Распределение гаплотипов в популяциях и их частоты отображены на рис. 1,а. Для родственных реконструкций изученные образцы можжевельника были сгруппированы с образцами из Генбанка. Медианная сеть генеалогических связей между гаплотипами выявила три гаплогруппы, соответствующие трем видам (рис. 1,б). На филогенетическом дереве (рис. 1,в) образцы разных популяций сгруппированы в соответствии с таксономической принадлежностью с высокой статистической поддержкой (PPvalue 0.96–1.00). По результатам AMOVA генетическая дифференциация между тремя группами довольно высока: FCT = = 0.8287 (P < 0.0001), еще выше с учетом родства гаплотипов: GCT = 0.9905 (P < 0.0001).
Рис. 1.
а – местоположение изученных выборок, распределение обнаруженных гаплотипов хпДНК. б – дерево гаплотипов хпДНК (h1–h7). Поперечные тонкие штрихи на ветвях дерева – мутационные события. Дополнительные гаплотипы f1–f3, e1–e3, p1–p2 составлены по последовательностям соответствующих межгенных спейсеров, взятых из Генбанка. в – филогенетическое дерево изученных образцов J. excelsa, J. polycarpos и J. foetidissima. (*) отмечены образцы, последовательности для которых взяты из Генбанка.
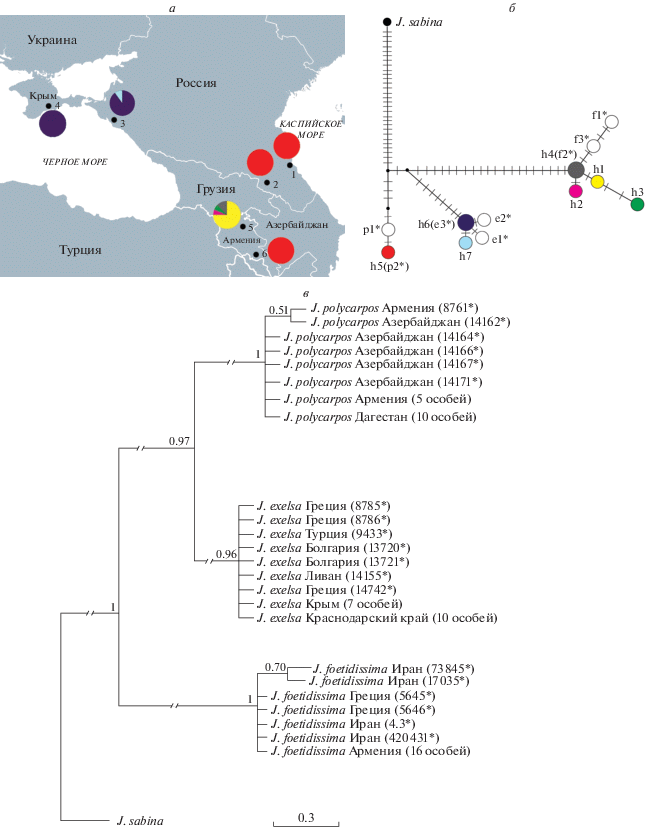
Популяция J. foetidissima из Армении оказалась наиболее полиморфной, в ней встретилось четыре гаплотипа h1–h4 (Н = 0.422, табл. 1). У этих образцов выявлена большая вставка (45 пн) во фрагменте trnD-trnT в случае гаплотпов h1 и h3, характерная также для образцов этого вида из Ирана, взятых из Генбанка (гаплотипы f1 и f3, рис. 1,б; табл. 2). Для гаплотипа h2 характерна замена нуклеотида A на T во фрагменте petN–psbM. Эта мутация не встречается у образцов из Генбанка и видимо характерна только для этой популяции. Гаплотип h4 соответствует гаплотипу, также встречающемуся у этого вида на территории Греции и Ирана (f2 рис. 1,б; табл. 2).
В изученных популяциях J. excelsa преобладает гаплотип h6 (рис. 1,а), также широко распространенный на основной части ареала (гаплотип e3, рис. 1,б). В популяции из Краснодарского края встретился гаплотип h7, отличающийся от h6 точковой заменой во фрагменте trnD–trnT (замена T на G, табл. 2). Изученные западнокавказские и крымские образцы формируют совместную кладу с образцами из Генбанка с территории Греции, Турции, Болгарии и Ливана, в которых кроме основного встречаются близкородственные гаплотипы (гаплотипы e1 и е2, рис. 1,б).
Изученные популяции J. polycarpos из Армении и Дагестана мономорфны, в них доминирует гаплотип h5, распространенный (по данным Генбанка) в Азербайджане (гаплотип р2 на рис. 1,б) и отличающийся на одну мутацию от гаплотипа еще двух образцов из Генбанка с территории Азербайджана и Армении (рис. 1,в).
Таким образом, географическое распределение гаплотипов и дифференциация по данным изменчивости хпДНК соответствует трем описанным таксонам.
Между популяциями видов Крыма и Краснодарского края (J. exelsa), а также Дагестана и Армении (J. polycarpos), для которых и была поставлена основная задача по определению таксономического статуса, выявлен целый ряд мутаций, поддерживающих самостоятельность каждого из таксонов, несмотря на схожую морфологию. Морфологические различия видов J. polycarpos и J. excelsa сводятся к следующему: у J. polycarpos более толстые побеги с плотно прижатыми, слегка килеватыми притупленными листьями, с овальной вздутой железкой; побеги J. excelsa более тонкие, листья сильно сизые, на верхушке с длинным остроконечием, со спинки (ниже середины) вогнутые, с овальной или почти круглой железкой. J. polycarpos двудомные деревья, J. excelsa – однодомные [10, 25–28]. Общий план анатомического строения схож у одно-, двух-, трехлетних побегов J. polycarpos и J. excelsa c родо- и видоспецифичными признаками. Родоспецифичные: одно- и двулетние побеги в поперечном сечении двулопастные и трехлопастные, а трехлетние побеги – трехлопастные. Видоспецифичные признаки для J. excelsa – отсутствие каменистых клеток и слабо выраженные маслянистые клетки в паренхиме листовых подушек. У J. polycarpos каменистые клетки расположены группами или по одному, маслянистые – собраны в группы. Диаметр побегов в поперечном сечении у однолетних побегов у J. excelsa в 1.5 раза меньше, чем J. polycarpos, однако с возрастом различия в диаметре поперечного сечения нивелируются [29].
Juniperus foetidissima имеет более заметные морфологические отличия от J. excelsa. Конечные веточки у J. foetidissima толще (1.1 мм), чем у J. excelsa (0.75 мм). Побеги у растения толстые четрыехгранные, листья чешуевидные, слабокилеватые, в отличие от J. excelsa, листья не очень плотно прилегают к побегу, их кончики как правило заостренные [33, 34 ] . Тем не менее, из-за варьирования признаков в зависимости от возраста особей, данные виды часто трудно отличить друг от друга, особенно при их совместном произрастании. Следует отметить, что согласно недавним исследованиям, для J. seravschanica (одного из видов комплекса J. excelsa s.l.) предполагается происхождение в результате древней интрогрессивной гибридизации между J. foetidissima и J. polycarpos [20], что указывает на их близкое родство и отсутствие репродуктивной изоляции в прошлом. Однако данные о современной гибридизации между этими видами отсутствуют.
Таким образом, полученные нами данные по изменчивости хпДНК образцов из Крыма и Кавказа поддерживают тезис о самостоятельности двух таксонов J. excelsa и J. polycarpos. Наблюдаемая дифференциация отражает существование двух генетических линий – западной и восточной – возникшей в некогда предковом виде в ходе истории формирования его ареала. Такой паттерн генетической структуры согласуется с принадлежностью к разным типам растительности с определенной экологической приуроченностью. В изученных нами популяциях наблюдается снижение генетической изменчивости (по сравнению с основным ареалом видов), что характерно для краевых популяций и объясняется расположением на северных пределах их распространения.
Полученные молекулярно-генетические данные могут быть использованы для разработки программ мониторинга и сохранения этих редких видов, а также для разработки мероприятий по рациональному природопользованию. Набор из четырех маркерных фрагментов подходит для идентификации видов, если это затруднительно сделать по морфологическим признакам.
Авторы выражают благодарность зав. лабораторией д. б. н. В.Л. Семерикову за возможность проведения исследований в лаборатории молекулярной экологии растений ИЭРИЖ УрО РАН, а также зам. директора по научной работе ФГБУ “Сочинский национальный парк” д. б. н. Б.С. Туниеву за помощь в организации сбора полевого материала.
Работа выполнена в рамках плановой темы Горного ботанического сада ДФИЦ РАН, в рамках государственного задания Института экологии растений и животных УрО РАН.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Красная книга Российской Федерации (растения и грибы). М.: Товарищество научных изданий КМК, 2008. 855 с.
Красная книга Республики Дагестан. Махачкала: Дагестанское книжное издательство, 2009. С. 53–250.
Красная книга Краснодарского края. Растения и грибы. III издание / Отв. ред. Литвинская С.А. Краснодар: Адм. Краснодар. края, 2017. 850 с.
Красная книга Республики Крым: растения, водоросли, грибы. Симферополь: ООО “ИТ АРИАЛ”, 2015. 480 с.
Кецховели Н.Н. Ксерофитные (аридные) редколесья // Растительность Европейской части СССР. Л.: Наука, 1980. С. 273–276.
Литвинская С.А. Созологическая значимость основных флороценокомплексов Западного Кавказа и Западного Предкавказья // Новости науки в АПК. 2019. № 1(12). С. 24–31. https://doi.org/10.25930/8ghb-qw97
Нешатаева В.Ю., Садыкова Г.А. Ботанико-географические особенности сообществ можжевеловых редколесий Кавказа и Крыма. Материалы международной конференции: Флора и заповедное дело на Кавказе: история и современное состояние изученности. Пятигорск: 2019. С. 66–67.
Hojjati F., Zarre Sh., Assadi M. Isoenzyme diversity and cryptic speciation in Juniperus excelsa (Cupressaceae) complex in Iran // Biochem. Syst. and Ecology. 2009. V. 37. P. 193–200.
Конспект флоры Кавказа. Т. 1 / Под ред. Тахтаджяна А.Л. СПб.: Наука, 2003. 204 с.
Галушко А.И. Флора Северного Кавказа. Определитель: в 3-х т. Ростов-на Дону: Изд-во Ростовского университета, 1978. Т. 1. 320 с.
Муртазалиев Р.А. Конспект флоры Дагестана. Т. 1. (Lycopodiaceae – Urticaceae). Махачкала: Эпоха, 2009. 252 с.
Adams R.P., Armagan M., Douaihy B. et al. Evidence of relictual introgression or incomplete lineage sorting in nrDNA of Juniperus excelsa and J. polycarpos in Asia Minor // Phytologia. 2016. V. 98(2). P. 146–155.
Hojjati F., Kazempour-Osaloo S.H., Adams R.P., Assadi M. Molecular phylogeny of Juniperus in Iran with special reference to the J. excelsa complex, focusing on J. seravschanica // Phytotaxa. 2018. V. 375(2). P. 135–157. https://doi.org/10.11646/phytotaxa.375.2.1
Farjon A. The taxonomy of multiseed junipers (Juniperus sect. Sabina) in Southwest Asia and East Africa (Taxonomic notes on Cupressaceae I) // Edinburgh J. Botany. 1992. V. 49. P. 251–283. https://doi.org/10.1017/S0960428600000524
Mao K., Hao G., Liu J. et al. Diversification and biogeography of Juniperus (Cupressaceae): Variable diversification rates and multiple intercontinental dispersals // New Phytologist. 2010. V. 188. 254–272.
Kassian J., Behravan J., Hassani M. et al. Molecular characterization and RAPD analysis of Juniperus species from Iran // Genet. and Mol. Res. 2011. V. 10(2). P. 1069–1074.
Adams R.P., Hojjati F., Schwarzbach A.E. Taxonomy of Juniperus in Iran: DNA sequences of nrDNA plus three cpDNAs reveal Juniperus polycarpos var. turcomanica and J. seravschanica in southern Iran // Phytologia. 2014. V. 96 (1). P. 19–25.
Hojjati F., Adams R.P., Randall G. Terry. Discovery of chloroplast capture in Juniperus excelsa complex by multi-locus phylogeny // Phytotaxa. 2019. V. 413(1). P. 11–26.
Adams R.P. Juniperus of the World: the genus Juniperus. 4th ed. Bloomington: Trafford Publishing Co., 2014. 415 p.
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92(6). P. 673–679. https://doi.org/10.1007/BF00226088
Hall T.A. Bioedit: A user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids Symp. Ser. 1999. V. 41. P. 95–98. https://doi.org/10.1111/jbi.12867
Excoffier L., Lischer H. Arlequin suite ver. 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Res. 2010. V. 10. P. 564–567. https://doi.org/10.1111/j.1755-0998.2010.02847
Bandelt H.J., Forster P., Rцhl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. P. 37–48.https://doi.org/10.1093/oxfor/djournals.molbe.v.a026036
Ronquist F., Huelsenbeck J.P. MrBAYES 3: Bayesian phylogenetic inference under mixed models // Bioinformatics. 2003. V. 19. № 12. P. 1572–1574. https://doi.org/10.1093/bioinformatics/btg180
Флора СССР / Под ред. Комарова В.Л. Л.: Изд. АН СССР, 1934. Т. І. С. 173–191.
Гроссгейм А.А. Флора Кавказа. Баку: Азфан, 1939. Т. 1. 554 с.
Деревья и кустарники СССР. Голосеменные. Москва–Ленинград: Изд-во Академии наук СССР, 1949. Т. 1. 463 с.
Гроссгейм А.А. Определитель растений Кавказа. Москва: “Советская наука”, 1949. 747 с.
Асадулаев З.М., Садыкова Г.А., Рамазанова З.Р. Анатомическое строение побега Juniperus excelsa Bieb. subsp. polycarpos (С. Koch) Takht. в Предгорном Дагестане // Вестник Пермского унив. Сер. биология. 2020. Вып. 3. С. 157–164. https://doi.org/10.17072/1994-9952-2020-3-157-164
Дополнительные материалы отсутствуют.


