Генетика, 2021, T. 57, № 10, стр. 1211-1214
Роль сайтов связывания белка CLAMP в поддержании дистанционных взаимодействий в трансгенных линиях дрозофилы
Е. А. Тихонова 1, В. А. Могила 1, П. Г. Георгиев 1, О. Г. Максименко 1, *
1 Институт биологии гена Российской академии наук
119334 Москва, Россия
* E-mail: maksog@mail.ru
Поступила в редакцию 05.12.2020
После доработки 21.01.2021
Принята к публикации 15.02.2021
Аннотация
Механизм специфичного привлечения комплекса дозовой компенсации (КДК) на Х-хромосому самцов дрозофилы остается нерешенной проблемой. Недавно в качестве фактора, участвующего в привлечении КДК, был описан ДНК-связывающий белок CLAMP, который связывается с сайтами первичной посадки (СПП) КДК. Показано, что СПП могут рекрутировать КДК на аутосомы. В представленной работе проведено исследование способности хорошо описанного СПП поддерживать дистанционные взаимодействия в модельных трансгенных линиях дрозофилы. В результате получены отрицательные результаты, показывающие, что СПП, с которым связывается белок CLAMP, не поддерживает дистанционные взаимодействия.
Механизм дозовой компенсации у дрозофилы осуществляется посредством увеличения уровня экспрессии генов Х-хромосомы самца (Х/Y) в два раза по сравнению с самками (X/X). За увеличение уровня экспрессии генов Х-хромосомы самцов отвечает мультисубъединичный комплекс дозовой компенсации (КДК), который специфично связывается с Х-хромосомой самцов. В состав комплекса дозовой компенсации (КДК) входят пять белков (MSL1, MSL2, MSL3, MLE, MOF) и некодирующая РНК (roX1, roX2) [1]. Исходно КДК привлекается на специфичные последовательности, распределенные по Х-хромосоме – сайты первичного посадки (СПП), с которых происходит распространение КДК преимущественно на кодирующие части генов [2].
Наиболее вероятным механизмом привлечения КДК на Х-хромосому является присутствие в составе СПП сайтов для транскрипционных факторов (ТФ), которые участвуют в специфичном связывании с КДК. Однако сравнение последовательностей СПП друг с другом выявило только обогащение GA-повторами, которые также повсеместно распределены на аутосомах [3]. Недавно в скрининге ТФ, определяющих способность СПП-элемента стимулировать транскрипцию в культуре клеток дрозофилы S2, был найден белок CLAMP, который содержит семь доменов “цинковые пальцы” С2Н2-типа [4]. In vitro было показано, что часть белка, содержащая С2Н2-домены (с четвертого по седьмой), специфично связывается с GA-повторами [5], которые достаточно часто находятся в СПП.
Согласно одной из моделей [6], СПП взаимодействуют между собой и другими регуляторными элементами, что способствует специфическому распространению комплекса вдоль Х-хромосомы. Для проверки этого предположения в работе было исследовано взаимодействие между двумя копиями ранее охарактеризованного СПП [3] – с помощью модельной GAL4/white-системы [7] в трансгенных линиях дрозофилы. Для исследования был взят участок в 200 пн ранее описанного СПП, CES5C2 [3], который содержит GA-богатые мотивы (MRE – Msl Recognition Element), и искусственный ДНК-фрагмент, содержащий GA-повторы (рис. 1,а).
Рис. 1.
а – используемые в работе ДНК-фрагменты: участок CES5C2, содержащий три GA-богатых мотива (MRE1, MRE2 и MRE3), и искусственно синтезированная последовательность, содержащая десять GAGA-повторов. б – модельная система для исследования дистанционных взаимодействий содержит два репортерных гена (yellow, white), десять сайтов посадки дрожжевого активатора GAL4 (10 × GAL4) и уникальную последовательность для количественного анализа при иммунопреципитации хроматина (U). Контрольные конструкции (1, 2) содержат один ДНК-фрагмент (GAGA или CES5C2) перед геном yellow, а конструкции для изучения дистанционных взаимодействий (3, 4, 5) – два фрагмента (два CES5C2-элемента, две GAGA-последовательности или их комбинацию) перед генами yellow и white. в – сборка КДК на аутосомном трансгене в цитогенетическом локусе 86F. Иммуноокрашивание политенных хромосом самцов трансгенной линии (CES5C2)Y(CES5C2)W проводилось антителами против MSL1. г – связывание белка CLAMP с CES5C2-элементом и GAGA-последовательностью в цитогенетическом локусе 86F на стадии куколки в трансгенных линиях (CES5C2)Y(CES5C2)W и (GAGA)Y(GAGA)W. В качестве положительного контроля использовался эндогенный СПП (roX2). Иммунопреципитация хроматина выполнялась с использованием антител к белку CLAMP (Clamp_АТ) и преиммунной сыворотки (rabbit_γ).
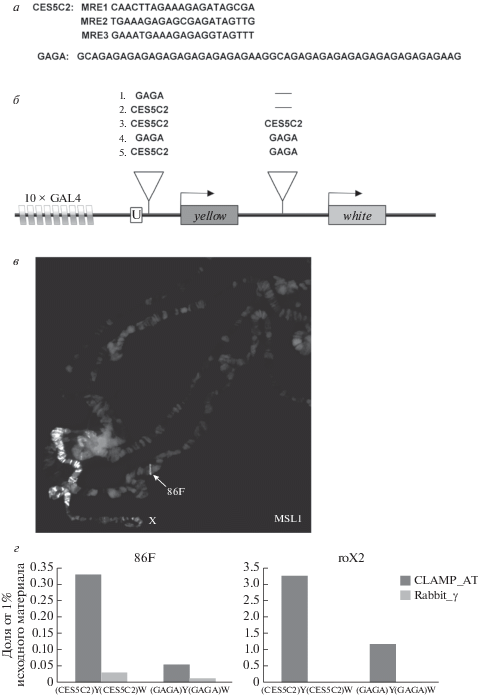
Для исследования дистанционных взаимодействий между тестируемыми ДНК-фрагментами была использована ранее разработанная модельная система, основанная на неспособности дрожжевого транскрипционного фактора GAL4 активировать промотор гена white, когда между GAL4-сайтами и промотором находится ген yellow [7]. Ген white определяет окраску глаз дрозофилы. Уровень его экспрессии тестировали по степени пигментации глаз с помощью визуального анализа. Тестирумые ДНК-фрагменты (СES5C2 и GAGA-повторы) встраивали перед генами yellow и white в конструкцию (рис. 1,б), в которой десять сайтов связывания дрожжевого активатора GAL4 были встроены в положении –893 пн относительно промотора гена yellow, и ген white находился с 3'-стороны от гена yellow. Для исследования взаимодействия между СПП-элементами и GA-повторами были созданы конструкции, содержащие два CES5C2-фрагмента ((CES5C2)Y(CES5C2)W), два ДНК-фрагмента с GAGA-повторами ((GAGA)Y(GAGA)W), а также комбинацию CES5C2 и GA-повтора ((CES5C2) Y(GAGA)W). В двух контрольных конструкциях CES5C2 ((CES5C2)YW) или GAGA-последовательность ((GAGA)YW) были встроены только рядом с GAL4-cайтами, перед промотором гена yellow (рис. 1,б).
Для интеграции конструкций в геном был использован метод, основанный на сайт-специфичной рекомбинации для интегразы фага ϕC31 [8]. Все конструкции были встроены в одно место генома на 3-й хромосоме в положение 86F. Трансгенная линия y[1] M{vas-int.Dm}ZH-2A w[*]; M{3xP3-RFP.attP}ZH-86Fb) (#24749), содержащая attP-сайт в цитогенетическом локусе 86F и трансген, экспрессирующий интегразу ϕC31, была получена из коллекции Блумингтона (США). Ранее было показано, что сайты связывания архитектурных белков в трансгене, встроенном в цитогенетический локус 86F, способны за счет дистанционных взаимодействий поддерживать стимуляцию промотора гена white за счет GAL4-активации [9].
Трансгенные линии были получены в результате микроинъекции ДНК, содержащей одну из конструкций, в эмбрионы дрозофилы. В полученных трансгенных линиях самки имели желтые глаза, а самцы – немного более интенсивную пигментацию – темно-желтую окраску. Для активации GAL4 проводили скрещивание трансгенной линии с линией, в которой белок GAL4 экспрессировался под контролем тубулинового промотора. При скрещивании с любой из двух трансгенных линий, содержащих контрольную конструкцию, активация GAL4 незначительно меняла пигментацию глаз до оранжевой окраски, но приводила к резкому усилению пигментации тела и крыльев, что связано со стимуляцией промотора гена yellow, расположенного рядом с GAL4-сайтами в трансгенных линиях. Таким образом, было подтверждено, что GAL4 может стимулировать только рядом расположенный промотор гена yellow. При индукции экспрессии GAL4 в трансгенных линиях, содержащих тестируемые на поддержание дистанционных взаимодействий сайты, происходила также только активация гена yellow (табл. 1).
Таблица 1.
Экспрессия гена white в исследуемых трансгенных линиях. Степень экспрессии гена white определялась по интенсивности окраски глаз: Ж – желтый, ТЖ – темно-желтый, О – оранжевый
| Трансгенные линии | Пигментация глаз | |
|---|---|---|
| исходный фенотип | GAL4-активация | |
| (GAGA)YW | Ж–ТЖ | Ж–ТЖ |
| (CES5C2)YW | Ж–ТЖ | ТЖ–О |
| (CES5C2)Y(CES5C2)W | Ж–ТЖ | Ж–О |
| (GAGA)Y(GAGA)W | Ж–ТЖ | ТЖ–О |
| (CES5C2)Y(GAGA)W | Ж–ТЖ | ТЖ–О |
Полученный отрицательный результат может объясняться неспособностью белка CLAMP связываться с ДНК-элементами, встроенными на аутосому, и привлекать к ним белки КДК. Поэтому для проверки такой возможности на аутосоме в трансгенных линиях было исследовано связывание белка MSL1 c политенными хромосомами, выделенными из слюнных желез (рис. 1,в). У самцов антитела к MSL1 окрашивают только Х-хромосому в политенных хромосомах. Однако в трансгенной линии (CES5C2)Y(CES5C2) наблюдается связывание MSL1 также с сайтом 86F. Таким образом, полученные данные подтверждают специфичное привлечение КДК на элемент CES5C2.
С помощью иммунопреципитации хроматина с последующей количественной ПЦР было также проанализировано связывание белка CLAMP c CES5C2 и GAGA-последовательностями в куколках трансгенных линий. В результате было обнаружено, что белок CLAMP связывается с последовательностью CES5C2 в составе трансгенной конструкции намного более эффективно, чем с GA-повторами (рис. 1,г). Вероятно, слабое связывание с GA-повторами объясняется конкуренцией между CLAMP и транскрипционным фактором GAF, для которого известно эффективное кооперативное связывание с GA-повторами.
Отсутствие активации репортерного гена white GAL4-активатором предполагает отсутствие взаимодействия между тестируемыми ДНК-фрагментами, расположенными на большом расстоянии друг относительно друга. Таким образом, комплексы белков, которые связываются с элементами CES5C2, не взаимодействуют между собой. Также не найдено взаимодействий между комплексами белков, включающих GAF и CLAMP, которые взаимодействуют с GA-повторами. Таким образом, полученные нами результаты не подтверждают модель, согласно которой взаимодействие между СПП-элементами определяет архитектуру Х-хромосомы дрозофилы и распространение КДК. В поддержку данного результата недавно было показано, что белки КДК не участвуют в формировании архитектуры Х-хромосомы [10]. С другой стороны, СПП-элементы часто располагаются рядом с границами топологических ассоциированных доменов. Согласно доминирующей в настоящее время модели, внутри топологических доменов могут происходить множественные локальные взаимодействия между промоторами, энхансерами и сайленсерами, что определяет регуляцию экспрессии генов. Вероятно, границы топологических доменов могут участвовать в распространении КДК по Х-хромосоме. Поэтому необходимы дальнейшие исследования для выяснения механизмов, которые определяют распространение КДК с СПП-элементов по Х-хромосоме.
Работа выполнена при поддержке Российского научного фонда (№ 17-74-20155).
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Kuroda M.I., Hilfiker A., Lucchesi J.C. Dosage compensation in Drosophila–a model for the coordinate regulation of transcription // Genetics. 2016. V. 204. № 2. P. 435–450. https://doi.org/10.1534/genetics.115.185108
Straub T., Grimaud C., Gilfillan G.D. et al. The chromosomal high-affinity binding sites for the Drosophila dosage compensation complex // PLoS Genetics. 2008. V. 4. № 12. P. e1000302. https://doi.org/10.1371/journal.pgen.1000302
Alekseyenko A.A., Peng S., Larschan E. et al. A sequence motif within chromatin entry sites directs MSL establishment on the Drosophila X chromosome // Cell. 2008. V. 134. № 4. P. 599–609. https://doi.org/10.1016/j.cell.2008.06.033
Larschan E., Soruco M.M., Lee O.K. et al. Identification of chromatin-associated regulators of MSL complex targeting in Drosophila dosage compensation // PLoS Genetics. 2012. V. 8. № 7. P. e1002830. https://doi.org/10.1371/journal.pgen.1002830
Marcela M., Soruco M.M., Chery J. et al. The CLAMP protein links the MSL complex to the X chromosome during Drosophila dosage compensation // Genes & Development. 2013. V. 27. № 14. P. 1551–1556. https://doi.org/10.1101/gad.214585.113
Alekseyenko A.A., Ho J.W., Peng S. et al. Sequence-specific targeting of dosage compensation in Drosophila favors an active chromatin context // PLoS Genetics. 2012. V. 8. № 4. P. e1002646. https://doi.org/10.1371/journal.pgen.1002646
Kyrchanova O., Chetverina D., Maksimenko O. et al. Orientation-dependent interaction between Drosophila insulators is a property of this class of regulatory elements // Nucl. Ac. Res. 2008. V. 36. № 22. P. 7019–7028. https://doi.org/10.1093/nar/gkn781
Bischof J., Maeda R.K., Hediger M. et al. An optimized transgenesis system for Drosophila using germ-line-specific C31 integrases // Proc. Natl Acad. Sci. USA. 2007. V. 104. № 9. P. 3312–3317. https://doi.org/10.1073/pnas.0611511104
Zolotarev N., Fedotova A., Kyrchanova O. et al. Architectural proteins Pita, Zw5, and ZIPIC contain homodimerization domain and support specific long-range interactions in Drosophila // Nucl. Ac. Res. 2016. V. 44. № 15. P. 7228–7241. https://doi.org/10.1093/nar/gkw371
Ramírez F., Lingg T., Toscano S. et al. High-affinity sites form an interaction network to facilitate spreading of the MSL complex across the X chromosome in Drosophila // Mol. Cell. 2015. V. 60. № 1. P. 146–162. https://doi.org/10.1016/j.molcel.2015.08.024
Дополнительные материалы отсутствуют.


