Генетика, 2021, T. 57, № 10, стр. 1141-1157
Влияние добавок карнитина, ресвератрола и ароматических аминокислот к рациону с избытком жира и фруктозы на экспрессию генов в печени крыс: полнотранскриптомное исследование
Н. В. Трусов 1, *, С. А. Апрятин 1, В. А. Шипелин 1, 2, А. А. Шумакова 1, И. В. Гмошинский 1, **, Д. Б. Никитюк 1, 3, В. А. Тутельян 1, 3
1 Федеральный исследовательский центр питания, биотехнологии и безопасности пищи
109240 Москва, Россия
2 Российский экономический университет им. Г.В. Плеханова
117997 Москва, Россия
3 Первый Московский государственный медицинский университет
им. И.М. Сеченова (Сеченовский университет)
119991 Москва, Россия
* E-mail: nikkitosu@yandex.ru
** E-mail: gmosh@ion.ru
Поступила в редакцию 30.12.2020
После доработки 16.02.2021
Принята к публикации 02.03.2021
Аннотация
В печени крыс-самцов линии Wistar, получавших в течение 63 сут рационы c избытком жира и фруктозы и добавками l-карнитина, ресвератрола, тирозина или триптофана, изучали дифференциальную экспрессию 30 584 генов, представленных на микрочипе, методом полнотранскриптомного профилирования по протоколу Agilent One-Color Microarray-Based Gene Expression Analysis Low Input Quick Amp Labeling (version 6.8). Для выявления метаболических путей (KEGGS), являющихся мишенями применявшихся диетических воздействий, транскриптомные данные анализировали методами биоинформатики в среде “R”. Полученные данные позволяют предположить, что поступление в организм биологически активных веществ – модуляторов липидного обмена, включая l-Кар, Рес и ароматические аминокислоты Тир и Трп, несмотря на явные различия в первичных мишенях их воздействия и фенотипических последствиях для организма на тканевом и органном уровне, задействует на промежуточных стадиях комплекс во многом сходных и взаимосвязанных по своей функции генов, участвующих в регуляции клеточного цикла, пролиферации, апоптоза, межклеточных взаимодействий, иммунной реакции и воспаления, причем знак ДЭ каждого из этих генов, взятых по отдельности, не позволяет однозначно прогнозировать направленность процессов, проявляющихся в усилении или, напротив, ослаблении липогенеза и наблюдаемого накопления жировых включений в клетках печени. Новым не описанным в доступной литературе стал дифференцированный эффект между l-Кар, Рес и Тир, с одной стороны, и Трп, с другой, на метаболический путь арахидоновой кислоты, включая процессы образования из нее оксилипинов (липоксинов), простагландинов и тромбоксанов.
Использование минорных биологически активных веществ (БАВ), способных активно влиять на процессы липидного и углеводно-энергетического обмена, модулировать пищевое поведение, создавать условия для повышения физической активности в сценариях повседневной деятельности, рассматривается как одно из магистральных направлений развития диетотерапии ожирения и связанных с ним алиментарно-зависимых заболеваний (метаболического синдрома, сахарного диабета 2-го типа, артериальной гипертонии, атеросклероза и др.) [1–3]. Диетическое применение различных групп таких веществ в персонифицированной терапии затруднено без понимания природы и механизмов их воздействия на обменные процессы у больных, различающихся как по своему генотипу, так и по тяжести и развитию патологического процесса. В роли наиболее популярных БАВ, потенциальных модуляторов жирового и углеводно-энергетического обмена, выступают: 1) l-карнитин (l-Кар), витаминоподобное вещество с функцией транспорта жирных кислот через двойную мембрану митохондрий, действие которого механистически трактуется в качестве “сжигателя жира” [4, 5]; 2) полифенольные соединения, традиционно рассматриваемые по характеру своего действия как антиоксиданты, в том числе кверцетин и ресвератрол (Рес) [6, 7]; 3) большие нейтральные аминокислоты, роль которых сводится к модуляции транспорта через гематоэнцефалический барьер тирозина (Тир) и триптофана (Трп) − предшественников нейротрансмиттеров дофамина и серотонина, играющих ключевую роль в центральной регуляции систем вознаграждения, пищевого поведения и направленности метаболических реакций [8]. Вместе с тем исследования последних лет позволяют предположить, что природа действия указанных БАВ на организм больного не исчерпывается приведенными простыми механистическими объяснениями, а связана со сложной группой факторов, включая экспрессию целого комплекса генов. Этим может объясняться неоднозначность результатов клинического применения БАВ в диетическом и специализированном питании [9, 10].
Цель настоящего исследования – выявление новых нутригеномных механизмов воздействия БАВ (l-Кар, Рес, Тир, Трп) на организм крыс, получающих избыточный по удельной энергетической ценности рацион, с использованием метода полнотранскриптомного профилирования ткани печени.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использованы 48 самцов крыс (возраст 8 нед., исходная масса тела 200 ± 10 г) аутбредной линии Wistar, полученных из питомника “Столбовая”. Работу с животными выполняли в соответствии с международными рекомендациями [11]. Дизайн эксперимента был одобрен Комитетом по этике ФГБУН “ФИЦ питания и биотехнологии” (протокол № 4 от 20.04.2017 г.).
Крысы были разделены на шесть групп равной численностью по восемь особей. Средняя масса тела в сформированных группах изначально достоверно не различалась (p > 0.1; ANOVA). Животные 1-й (контрольной) группы получали сбалансированный полусинтетический рацион по AIN93М с некоторыми модификациями [12] и очищенную обратным осмосом питьевую воду, 2-й группы – высокоуглеводный, высокожировой рацион, в котором по сравнению с контрольным рационом было повышено до 30% по массе сухих веществ содержание жира (в форме смеси 1 : 1 подсолнечного масла и свиного лярда) и питьевая вода заменена на 20%-ный раствор фруктозы (ВУВЖР), 3-й группы − ВУВЖР с добавлением l-Кар (производства фирмы Wirud (Германия), 98% чистоты по данным ВЭЖХ) в расчетной дозе 300 мг/кг массы тела (м.т.), 4-й группы − ВУВЖР с добавлением Рес (производства фирмы DSM, Голландия, торговая марка resVida®, 98% чистоты по данным ВЭЖХ) в расчетной дозе 25 мг/кг м.т., 5‑й и 6-й групп − ВУВЖР с добавлением соответственно Тир в расчетной дозе 1250 мг/кг м.т. и Трп в расчетной дозе 250 мг/кг м.т. Аминокислоты Тир и Трп производства компании Wirud имели показатели чистоты 99.5% по данным ВЭЖХ.
Крыс содержали по две особи в клетках из поликарбоната при температуре 21 ± 1°С и режиме освещения 12/12 ч. Общая продолжительность кормления рационами составила 63 сут. На протяжении эксперимента ежедневно определяли количество потребленного корма и выпитой жидкости, еженедельно − м.т. животных с точностью ±0.1 г, наблюдали за внешним видом, активностью, состоянием шерстного покрова, особенностями поведения.
Выведение животных из эксперимента осуществляли на 64-е сут путем декапитации под эфирной анестезией. Отбирали две пробы ткани печени, первую из которых фиксировали в растворе 3.7%-ного формальдегида в 0.1 М натрий-фосфатном буфере рН 7.00 ± 0.05, дегидратировали в спиртах восходящей концентрации, пропитывали ксилолом и заливали гомогенизированной парафиновой средой Histomix. Парафиновые срезы толщиной 3–4 мкм изготавливали на микротоме Microm HM355s (Leica, Германия), окрашивали гематоксилином и эозином по стандартной методике и исследовали в микроскопе AxioImager Zl (Zeiss, Германия) с цифровой фотокамерой при ув. ×200.
Из второй пробы печени выделяли тотальную РНК с помощью набора Agilent Total RNA Isolation Mini Kit (Agilent Technologies, США). Навеску 20 мг печени гомогенизировали в стеклянном гомогенизаторе Поттера-Эдельвейма в 500 мкл лизирующего буфера (с добавлением 5 мкл β‑меркаптоэтанола на 500 мкл буфера) при температуре 0–2°С. Дальнейшие процедуры проводили в соответствии со стандартным протоколом [13]. Полученную тотальную РНК дополнительно обрабатывали ДНКазой I для удаления следов геномной ДНК. Концентрацию РНК определяли на спектрофотометре NanoDrop 1000, после чего разбавляли ее водой без нуклеаз до концентрации 200 нг/мкл и проводили анализ степени фрагментации на Agilent Bioanalyzer 2100 с определением показателя RIN (RNA Integrity Number). РНК хранили в воде, свободной от нуклеаз, или в виде изопропанольных осадков при –80°С.
Полнотранскриптомное профилирование печени на микрочипах, входящих в состав Gene Expression Hybridization Kit (Agilent Technologies), проводили по протоколу Agilent One-Color Microarray-Based Gene Expression Analysis Low Input Quick Amp Labeling, version 6.8 [14]. В работе использовали микрочипы SurePrint G3 Rat Gene Expression v2 8x60K Microarray Kit (каталожный номер G4852A-074036). Согласно информации производителя на микрочипе представлены олигонуклеотидные зонды длиной 60 нуклеотидов для покрытия 30 584 генов крысы. На трех микрочипах представлены 24 независимых образца РНК печени по четыре образца из каждой группы. Сканирование микрочипов выполняли на приборе SureScan Microarray Scaner производства Agilent Technologies. Величину дифференциальной экспрессии (ДЭ) выражали в виде логарифма по основанию 2 (log2FC) возрастания или убывания флуоресценции по сравнению с контрольной группой или по сравнению с внутренними контролями микрочипа (Spike-In). Достоверность изменения экспрессии оценивали путем анализа логарифмов интенсивности флуоресценции, нормализованных по внутренним контролям (Spike-In) с использованием Т-теста с множественной коррекцией Benjamini–Hochberg [15].
РЕЗУЛЬТАТЫ
Интегральные показатели животных
В ходе эксперимента крысы всех групп постоянно прибавляли в массе тела, были активными, имели нормальный внешний вид, нормальное состояние шерстного покрова и слизистых оболочек; заболеваемость и летальность отсутствовали. Животные всех групп, получавших ВУВЖР, потребляли на 35–45% больше энергии рациона в расчете на единицу массы тела в сравнении с контрольной группой на протяжении всего эксперимента (p < 0.05, t-тест Стьюдента для попарно связанных среднегрупповых значений). Энергетическая ценность рациона, потребляемого крысами групп ВУВЖР и ВУВЖР со всеми добавками, различалась в пределах ±10–15%. Крысы, получавшие только ВУВЖР, характеризовались наибольшими прибавками массы тела, а добавка к этому рациону Трп и l-Кар приводила к достоверному снижению скорости прибавки массы тела (p < 0.05, t-тест Стьюдента). При выведении из эксперимента (см. ниже) крысы всех групп, получавших ВУВЖР, характеризовались увеличенной относительной массой печени и забрюшинного белого жира по сравнению с контрольной группой, независимо от применявшихся добавок (p < 0.05, ANOVA, по фактору “рацион”).
Морфологическое исследование печени
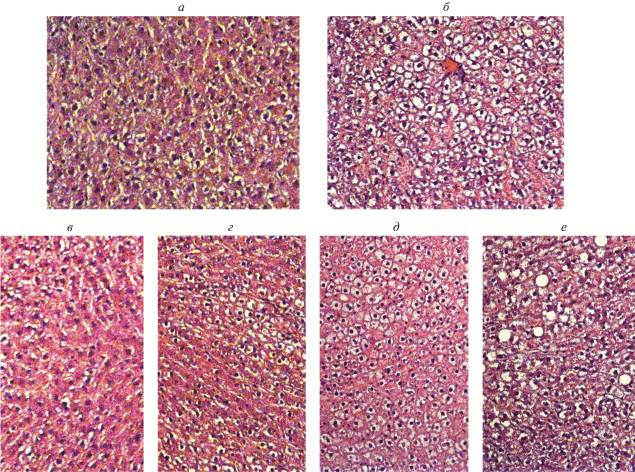
Светооптическое морфологическое исследование печени (рис. 1) показало в целом нормальную структуру ткани органа у крыс контрольной группы с небольшим количеством жирозапасающих клеток, свойственным животным данного возраста (рис. 1,а). У крыс, получавших ВУВЖР, отмечается выраженная картина жировой дистрофии печени с резким возрастанием объема вакуолей в жирозапасающих клетках (рис. 1,б). Добавка l-Кар приводила к значительному сокращению проявлений жирового гепатоза, однако сопровождалась усиленной пролиферацией эозинофилов (рис. 1,в). При потреблении добавки Рес признаки жировой дистрофии печени изменялись (рис. 1,г), а именно жирозапасающие клетки распределялись неравномерно, концентрируясь в основном в периваскулярной области печеночных долек. Введение в рацион добавки Тир приводило (рис. 1,д) к небольшому ослаблению выраженности жировой дистрофии, судя по количеству и объему жирозапасающих клеток, что согласуется с данными, полученными нами ранее на крысах линий Wistar и DAT-KO [12], свидетельствующими о влиянии дофамина (предшественником которого является Тир) как на метаболические процессы в печени, так и липидный и углеводный обмен в целом. Наконец, в условиях потребления Трп (рис. 1,е) признаки жирового гепатоза (c признаками стеатоза) значительно усиливались с появлением крупных жировых вакуолей, не имеющих хорошо различимых ядер и другой внутриклеточной структуры.
Рис. 1.
Репрезентативные микрофотографии срезов печени крыс: а – контрольная группа (1-я); б – группа, получавшая ВУВЖР (2-я); в – группа, получавшая добавку l-Кар (3-я); г – группа, получавшая добавку Рес (4-я); д – группа, получавшая добавку Тир (5-я); е – группа, получавшая добавку Трп (6-я). Окраска гематоксилин-эозином. Микроскоп AxioImager Zl (Zeiss), ув. ×200.
Полнотранскриптомное профилирование печени
Из числа проанализированных генов дифференциальная экспрессия по сравнению с контролем на уровне |log2FC| ≥ 0.5 (в сторону как усиления, так и ослабления, по сравнению с показателями для контрольной группы 1), вызванная потреблением экспериментальных рационов в группах 2–6, получавших ВУВЖР и соответствующие добавки БАВ, установлена в общей сложности для 213 (0.7% от общего количества), 179 (0.6%), 415 (1.4%), 355 (1.2%) и 357 (1.2%) генов соответственно. По сравнению с группой 2, получавшей ВУВЖР, в группах крыс с 3-й по 6-ю, получавших добавки БАВ, выявлена ДЭ для 26, 12, 19 и 19 генов (0.085, 0.039, 0.062 и 0.062% от общего количества). Таким образом, общая величина ответа транскриптома печени (по числу ответивших генов) оказывается многократно большей на потребление собственно ВУВЖР, чем на потребление любой из изученных добавок по сравнению с ВУВЖР без добавки.
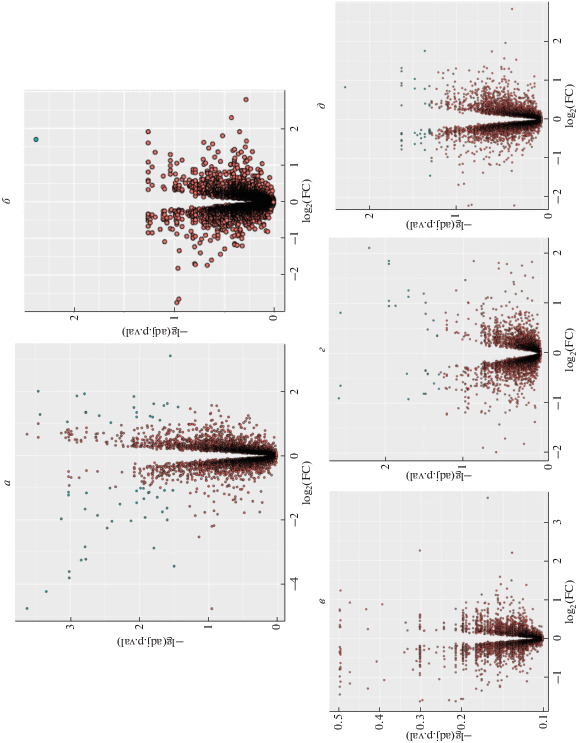
Двумерное распределение изученных генов по величине их ДЭ, в зависимости от статистической достоверности (pvalue) результата в виде т.н. “Volcano plots” приведено на рис. 2. Эти данные показывают, что степень выраженности ответа транскриптома, определяемая количеством генов в верхних левом и правом квадрантах диаграмм, намного выше на потребление ВУВЖР, чем на потребление всех применявшихся добавок.
Рис. 2.
Диаграммы Volkano plots распределения ДЭ генов в зависимости от статистической достоверности ее определения: а – группа 2 по сравнению с группой 1; б–д – группы 3–6 по сравнению с группой 2. Ось абсцисс – ДЭ (log2FC); ось ординат – достоверность различия с поправкой Benjamini–Hochberg, –lg(adj. P value). Обозначения групп – см. подпись к рис. 1.
Общее число генов с ДЭ большей 0.5 по модулю, по группам животных, получавших четыре вида БАВ, по сравнению с группой 2, получавшей ВУВЖР (с учетом дублирования генов в ряде групп), составило 39 генов. Их теоретико-множественное распределение (диаграмма Венна) представлено на рис. 3.
Рис. 3.
Диаграмма Венна распределения числа генов, ответивших достоверной ДЭ на применяемые диетические воздействия (добавки l-Кар, Рес, Тир, Трп), по сравнению с группой крыс, получавших ВУВЖР.
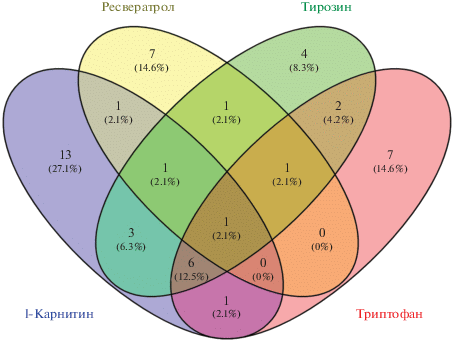
Как показывает диаграмма, в группе 3 (l-Кар), выявлено 11 генов, уникально ответивших на потребление этой добавки, в группе 4 (Рес) − пять генов, в группе 5 (Тир) − четыре гена и в группе 6 (Трп) − пять генов. Общими ответившими только для групп 3 и 5, групп 5 и 6 были по два гена, для групп 3 и 4; 3 и 6; 4 и 5; 3, 4 и 5; 4, 5 и 6 – по одному гену, 3, 5 и 6 – четыре гена. Общим ответившим во всех группах, получавших БАВ, был только один ген – Proser2, функция которого в печени недостаточно изучена. Перечень дифференциально ответивших генов, с указаниями их ДЭ, приведен в табл. 1.
Таблица 1.
Список генов крыс с дифференциальной экспрессией в печени в ответ на применяемые диетические воздействия
| Группа | Гены | ||
|---|---|---|---|
| обозначение | функция** | ДЭ (lgFC)**** | |
| Гены с дифференциальной экспрессией по сравнению с контролем (группой 1) | |||
| Группа 2* | Oat | Ornithine aminotransferase | 2.00 |
| Abcg8 | ATP binding cassette subfamily G member 8 | 1.92 | |
| Cyp7b1 | Cytochrome P450 family 7 subfamily B member 1 | 1.86 | |
| Inmt | Indolethylamine N-methyltransferase | 1.62 | |
| Dhrs7l1 | Dehydrogenase/reductase (SDR family) member 7-like 1 | 1.51 | |
| Nrep | Neuronal regeneration related protein | 1.50 | |
| Akr1c3 | Aldo-keto reductase family 1, member C3 | 1.35 | |
| Gpt | Glutamic-pyruvic transaminase | 1.34 | |
| Cyp3a9 | Cytochrome P450, family 3, subfamily a, polypeptide 9 | 1.28 | |
| Obp3 | Alpha-2u globulin PGCL4 | 1.24 | |
| Apof | Apolipoprotein F | –2.00 | |
| Tnfrsf9 | TNF receptor superfamily member 9 | –2.03 | |
| Mthfd2 | Methylenetetrahydrofolate dehydrogenase 2 | –2.04 | |
| Psat1 | Phosphoserine aminotransferase 1 | –2.25 | |
| Adm2 | Adrenomedullin 2 | –2.84 | |
| Pla2g2a | Phospholipase A2 group IIA | –2.88 | |
| Asns | Asparagine synthetase (glutamine-hydrolyzing) | –3.25 | |
| Cib2 | Calcium and integrin binding family member 2 | –3.44 | |
| Asns | Asparagine synthetase (glutamine-hydrolyzing) | –3.80 | |
| Phgdh | Phosphoglycerate dehydrogenase | –4.75 | |
| Гены с дифференциальной экспрессией по сравнению с группой 2 (ВУВЖР) | |||
| Только группа 3 (l-Кар) | Insig1 | Insulin-induced gene 1 | 1.34 |
| Sez6 | Seizure-related 6 | 0.856 | |
| Btg1 | b-Cell translocation gene 1 | 0.586 | |
| Car5a | Carbonic anhydrase va | –0.847 | |
| Pheta1 | Family with sequence similarity 109, member a | –0.521 | |
| Hist1h1d | h1 histone family, member d | –0.537 | |
| Zkscan7 | Zinc finger protein with krab and scan domains 1 | –0.576 | |
| Nedd4l | Ubiquitin protein ligase nedd4-like | –0.579 | |
| Ajuba | Ajuba lim protein | –0.732 | |
| Tnfaip2 | Tumor necrosis factor-alpha-induced protein 2 | –0.753 | |
| Ablim3 | Actin-binding lim protein family, member 3 | –1.088 | |
| Только группа 4 (ресвератрол)*** | Trappc3l | Trafficking protein particle complex 3-like | –0.734 |
| Tns1 | Tensin 1 | –0.783 | |
| Plk2 | Polo-like kinase 2 | –0.797 | |
| Evc2 | Evc ciliary complex subunit 2 | –0.975 | |
| Только группа 5 (тирозин) | Mfsd2a | Major facilitator superfamily domain containing 2A | 1.851 |
| Ankrd37 | Ankyrin repeat domain 37 | 0.658 | |
| Hba1 | Hemoglobin, alpha 1 | –0.713 | |
| Только группа 6 (триптофан) | Exosc5 | Exosome component 5 | –0.530 |
| Nlrp12 | NLR family, pyrin domain containing 12 | –0.556 | |
| Gata4 | GATA binding protein 4 | –0.614 | |
| Dhcr24 | 24-Dehydrocholesterol reductase | –0.784 | |
| Abcg8 | ATP binding cassette subfamily G member 8 | –1.446 | |
| Общие только для групп 3 и 4 | Defb43 | Defensin beta 43 | –0.847/–0.775 |
| Общие только для групп 3 и 5*** | Per1 | Period circadian regulator 1 | 1.602/2.112 |
| Car2 | Carbonic anhydrase 2 | –0.846/–0.971 | |
| Общие только для групп 3 и 6 | Lpin1 | Lipin 1 | 1.908/1.757 |
| Общие только для групп 5 и 6 | Calr | Calreticulin | 0.811/0.823 |
| Baiap2 | BAI1-associated protein 2 | –0.605/–0.603 | |
| Общие для групп 3–5 | Rasgef1b | RasGEF domain family, member 1B | 1.285/1.226/1.792 |
| Общие для групп 3, 5, 6 | Irf2bp2 | Interferon regulatory factor 2 binding protein 2 | 1.697/1.261/1.316 |
| Gadd45b | Growth arrest and DNA-damage-inducible, beta | 0.983/1.120/1.234 | |
| Jdp2 | Jun dimerization protein 2 | 0.699/0.792/0.790 | |
| Lpar6 | Lysophosphatidic acid receptor 6 | –0.670/–0.902/–0.676 | |
| Общие для групп 4–6 | Cebpd | CCAAT/enhancer binding protein delta | 0.740/0.945/0.868 |
| Общие для всех групп 3–6 | Proser2 | Proline and serine rich 2 | 0.810/0.707/0.950/0.783 |
* По 10 генов с наибольшей по модулю положительной и отрицательной ДЭ. ** Согласно OMIM® (Online Mendelian Inheritance in Man) [https://www.omim.org/about]. *** Без указания неидентифицированных транскриптов. **** Данные через слэш (/) для указанных групп соответственно.
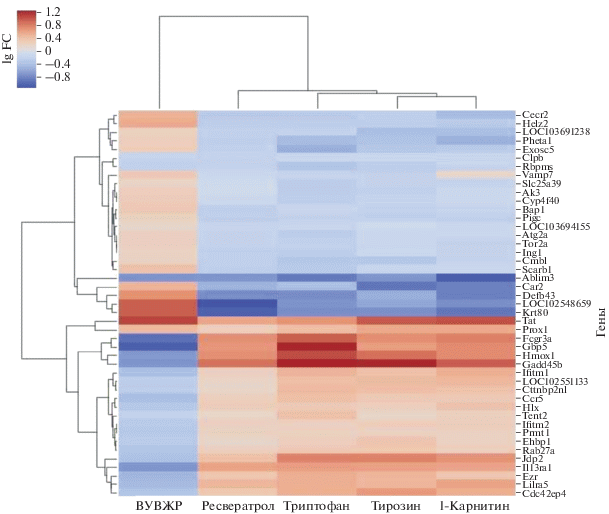
Как следует из полученных данных, имеется только очень ограниченное соответствие между генами крыс, ответившими достоверной ДЭ (adj.p.value < 0.05) на потребление ВУВЖР (по сравнению с контрольным рационом) и на потребление всех тестируемых БАВ. Так, в случае l-Кар (группа 3) выявлен только один такой ген (Defb43), для Рес (группа 4) – два (Defb43 и один неидентифицированный транскрипт), для Трп (группа 6) – один (Abcg8). Для Тир такие гены не выявлены. На рис. 4 представлена “тепловая” карта (heat map) экспрессии генов во всех экспериментальных группах животных по отношению к внутренним контролям (Spike-In), которая демонстрирует степень сходства либо различия вызванных диетическими факторами изменений в генной экспрессии, произошедших во всех экспериментальных группах. Видно, что по данному показателю группы животных 3 и 5, получавшие l-Кар и Тир, входят в один тесный кластер, к ним примыкает группа 6, получавшая Трп, и в меньшей степени группа 4 (Рес). Сходство в ДЭ генов на всех видах добавок с таковым в группе, получавшей только ВУВЖР, практически отсутствует.
Рис. 4.
“Тепловая” карта экспрессии генов во всех экспериментальных группах животных по отношению к внутренним контролям (Spike-In).
Анализ профилей ДЭ генов по группам животных в среде “R” позволил выявить 28 метаболических путей (KEGGs), являющихся мишенями воздействия применяемых экспериментальных условий (табл. 2). Из числа затронутых под воздействием БАВ метаболических путей наибольшее число (9) относится к путям липидного метаболизма, шесть – пищеварения (полостного и внутриклеточного), четыре – иммунного ответа и распознавания, по три – обмена стеринов, клеточной пролиферации и дифференцировки, два – метаболизма ксенобиотиков, один – мембранного транспорта.
Таблица 2.
Список метаболических путей (KEGGs), идентифицированных как мишени воздействия применяемых БАВ у крыс, получавших ВУВЖР
| Группа | Метаболические пути | ||
|---|---|---|---|
| обозначение | функция | pvalue | |
| Только группа 3 (l-Кар) | rno03320 | PPAR signaling pathway | 0.010 |
| rno04973 | Carbohydrate digestion and absorption | 0.040 | |
| Только группа 4 (ресвератрол) | rno04630 | Jak-STAT signaling pathway | 0.033 |
| rno02010 | ABC transporters | 0.033 | |
| Только группа 5 (тирозин) | rno00982 | Drug metabolism – cytochrome P450 | 0.004 |
| rno00830 | Retinol metabolism | 0.007 | |
| rno01040 | Biosynthesis of unsaturated fatty acids | 0.018 | |
| rno04974 | Protein digestion and absorption | 0.018 | |
| rno00980 | Metabolism of xenobiotics by cytochrome P450 | 0.022 | |
| rno00140 | Steroid hormone biosynthesis | 0.028 | |
| rno04972 | Pancreatic secretion | 0.031 | |
| rno04146 | Peroxisome | 0.042 | |
| Только группы 4 и 5 | rno00900 | Terpenoid backbone biosynthesis | 0.005/0.015 |
| Только группы 4 и 5 | rno04380 | Osteoclast differentiation | 0.025/0.050 |
| Только группы 5 и 6 | rno00591 | Linoleic acid metabolism | 0.011/0.034 |
| rno00565 | Ether lipid metabolism | 0.047/0.044 | |
| Группы 3, 4 и 5 | rno00071 | Fatty acid metabolism | 0.008/0.015/0.005 |
| rno04976 | Bile secretion | 0.020/0.004/0.16 | |
| rno04920 | Adipocytokine signaling pathway | 0.030/0.032/0.017 | |
| Группы 3, 5 и 6 | rno04975 | Fat digestion and absorption | 0.040/0.042/0.040 |
| Группы 3, 4 и 6 | rno04062 | Chemokine signaling pathway | 0.040/0.040/0.012 |
| Группы 4, 5 и 6 | rno00100 | Steroid biosynthesis | 0.005/0.012/0.022 |
| Все группы | rno04145 | Phagosome | 0.003/0.001/0.010/0.001 |
| rno04514 | Cell adhesion molecules (CAMs) | 0.003/0.0002/0.013/0.007 | |
| rno04612 | Antigen processing and presentation | 0.005/0.0003/0.003/0.001 | |
| rno04640 | Hematopoietic cell lineage | 0.007/0.019/0.028/0.0132 | |
| rno04672 | Intestinal immune network for IgA production | 0.003/0.011/0.017/0.006 | |
| rno00590 | Arachidonic acid metabolism | 0.004/0.041/0.006/0.027 | |
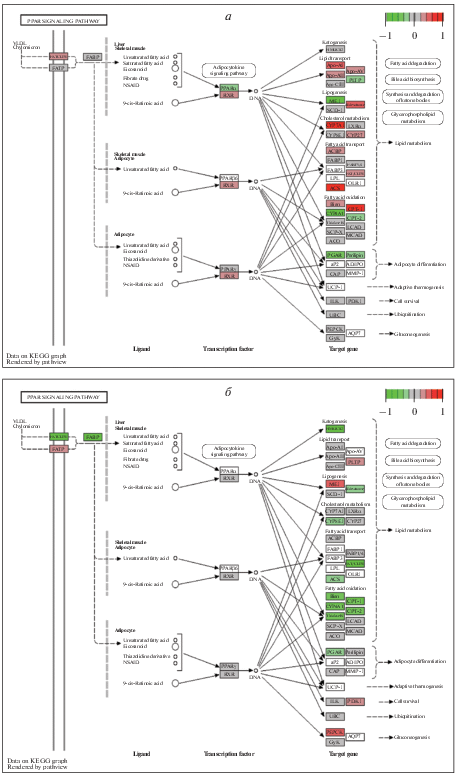
Обращает на себя внимание, что PPAR- и JAK-STAT-сигнальные пути, являющиеся согласно ранее полученным данным [16, 17] объектами воздействия избытка жира, фруктозы и холестерина рациона, в условиях данного эксперимента модифицируются только под действием l-Кар и Рес соответственно. Для добавки Тир характерным является влияние на метаболизм ксенобиотиков и лекарственных препаратов (системы цитохромов Р450 (CYP450)) и сопряженный с ним метаболизм стероидных гормонов в печени, а также на метаболизм ретиноидов, являющийся, по данным [18], также мишенью воздействия избытка жира и углеводов в рационе. Метаболический путь биосинтеза стероидных гормонов (rno00100) оказывается затронутым у крыс, получавших добавки Рес и обеих аминокислот, а метаболизм арахидоновой кислоты и ее производных (rno00590) – под влиянием всех диетических воздействий. Метаболических путей, являющихся специфическими мишенями воздействия Трп (но не других БАВ), выявлено не было.
Анализ влияний, оказываемых различными БАВ на идентифицированные метаболические пути, показывает, что направленность этих изменений является в большом числе случаев противоположной той, которая наблюдается под влиянием ВУВЖР по сравнению с контрольным рационом. В качестве примера можно привести метаболический путь окисления арахидоновой кислоты (rno00590), продуктами которого являются различные липоксины (оксилипины), представляющие собой гидроксиэйкозатриеновые и гидроксиэйкозатетраеновые кислоты, простагландины и тромбоксаны. Как следует из данных, представленных на рис. 5, при потреблении ВУВЖР наблюдается метаболический блок в образовании простациклина, 6-keto-PGF1α и 6-keto-PGE1 из PGH2. Под действием Рес, Тир и в относительно меньшей степени l-Кар, но не Трп, данный метаболический блок преодолевается. Помимо этого, у крыс, получающих ВУВЖР, снижена экспрессия фосфолипазы А2 (лецитиназа, код фермента (КФ) 3.1.1.4), осуществляющей мобилизацию арахидоновой кислоты из фосфолипидов мембран. Все четыре вида изученных БАВ (в наименьшей степени – Трп) способствуют снятию данного метаболического блока. С другой стороны, в условиях потребления ВУВЖР наблюдается положительная ДЭ ряда оксидоредуктаз, принадлежащих к семейству CYP450 и отвечающих за образование оксилипинов 11,14,15- и 11,12,15-THETA; 5,6-, 8,9-, 11,12- и 14,15-DHETA. Введение в рацион добавок l-Кар, Рес, Тир и в меньшей степени Трп приводит к отмене этих эффектов, что может, предположительно, привести к подавлению синтеза указанных оксилипинов.
Рис. 5.
Сопоставление изменений в метаболическом пути “rno00590 Arachidonic acid metabolism”, вызываемом добавками: а – ВУВЖР, б – l-Кар, в – Рес, г – Тир, д – Трп. Диаграммы здесь и на рис. 6 получены с использованием данных ресурса https://www.genome.jp/kegg/pathway.html.
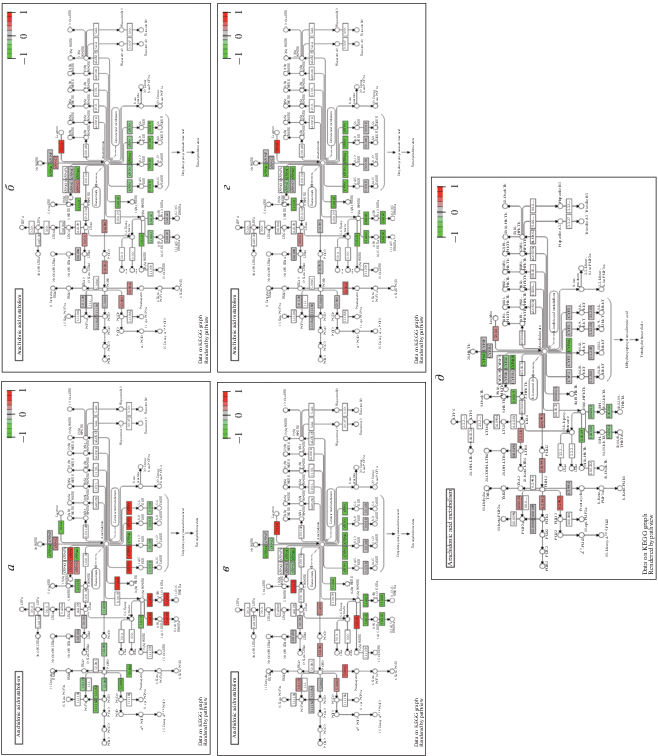
Аналогичным образом добавки l-Кар, Рес и Тир (но не Трп) приводили к обращению ДЭ, вызванной потреблением ВУВЖР, для ряда метаболических звеньев PPAR-сигналинга (rno03320) (рис. 6) и β-окисления жирных кислот (rno00071). При этом для l-Кар было характерно обращение или отмена ряда эффектов ВУВЖР в отношении связывания и транспорта липидов и жирных кислот факторами CD36, FATP и FABP, липогенеза (D6-десатураза, малик-энзим, ацил-КоА-синтаза), системы трансмембранного переноса жирных кислот в митохондрии (l-Кар-пальмитоилтрансфераза 1-го, но не 2-го типа) (рис. 6). В метаболическом пути β-окисления жирных кислот добавки l-Кар, Рес и Тир (но не Трп) приводили к обращению эффекта, оказываемого ВУВЖР на экспрессию еноил-КоА гидратазы (КФ 4.2.1.17). Для метаболического пути процессинга и презентации антигенов (rno04612) было характерно подавление экспрессии белков главного комплекса гистосовместимости MHCI и II, тогда как при использовании всех четырех видов добавок их ДЭ меняла знак на положительный.
ОБСУЖДЕНИЕ
Полученные результаты позволяют сделать ряд выводов о специфическом для каждого из исследованных БАВ характере влияния на обменные процессы, приводящие на фенотипическом уровне к различному влиянию на картину жирового перерождения печени, вызванного потреблением ВУВЖР. Ранее в работе [18] нами было показано, что полифенольное соединение кверцетин при введении в рацион крыс линии ZuckerFa способно модулировать экспрессию большого числа генов, включая участвующие в процессах липогенеза и β-окисления жирных кислот, метаболизме ретиноидов, стероидов, арахидоновой и линолевой кислот. На модели крыс Wistar, являющихся относительно более резистентными к развитию ожирения в сравнении с вышеуказанной линией, для примененных БАВ выявлен ряд как сходных, так и принципиально различных эффектов.
Особенностью действия l-Кар на транскриптомном уровне стало повышение экспрессии ряда генов, включая Insig1. По данным [19] продукт данного гена представляет собой белок эндоплазматического ретикулума (ЭР), который связывает чувствительный к стеролам домен SREBP, активирующий расщепление белка SCAP, и стабилизирующий комплекс SCAP/SREBP. Ввиду этого Insig1 играет центральную роль в гомеостазе холестерина. Согласно Li et al. [20] белок INSIG1 ограничивает липогенез в зрелых адипоцитах и блокирует дифференцировку в преадипоцитах в жировой ткани нормальных мышей при ожирении, вызванном высокожировым рационом.
Другим геном, активируемым под действием добавки l-Кар, является Lpin1 (липин), подавление продукции которого наблюдается при развитии метаболического синдрома [21]. Отмечается совместная экспрессия Lpin1 с генами Per1, Rasgef1b [22], также ответившими положительной ДЭ на потребление l-Кар. Per1 − это один из основных белков циркадного ритма, экспрессия которого подавляется при избытке углеводов [23]. Продукция PER1 по данным [24] может повышаться под действием полифенольных соединений пищи при посредстве транскрипционного фактора Bmal1. Rasgef1b играет, по-видимому, важную роль в регуляции клеточной адгезии и пролиферации [25].
В числе генов, ответивших выраженной отрицательной ДЭ на потребление l-Кар, следует указать на Ablim3, участвующий в формировании аномальных “стрессорных” филаментов F-актина в немышечных клетках [26], и TNFAIP2, необходимый для реализации функции провоспалительных цитокинов TNFα и IL-1β. Последнее указывает на роль иммунного компонента в резорбции жирозапасающих клеток в печени под действием l-Кар.
Экспрессия гена Defb43 подавляется под влиянием как l-Кар, так и Рес. Кодируемый им белок дефензин участвует в обеспечении неспецифического иммунитета на слизистых оболочках [27]. Пониженная экспрессия данного белка может рассматриваться как маркер ослабления воспалительного процесса [28].
Ген Cebpd, экспрессия которого специфически повышается под действием Рес, функционально связан с протоонкогенами Fos, JunB, Spi1 и Myc [29]. По данным [30] образование его транскрипта контролируется деацетилазами гистонов (сиртуинами). Мишенями действия CEBPD являются гены инсулиноподобного фактора роста (IGF) и рецепторов эстрогенов.
В числе генов, характеризуемых достоверно пониженной экспрессией при воздействии добавки Рес, идентифицированы Tns1 (тензин 1) и Plk2. Первый из них кодирует актин-связывающий белок, влияющий на функцию JNK, TNFα и инсулинового рецептора IRS2 [31]. Продуктом экспрессии второго из этих генов является протеинкиназа SNK, отвечающая за удвоение центросом в G1/S-фазе клеточного цикла [32], а также являющаяся негативным регулятором белков семейства Rap [33], к которым принадлежит рассмотренный выше продукт экспрессии Rasgef1b.
К генам, ответившим ДЭ исключительно на добавку Тир, относятся Mfsd2a, Ankrd37 и Hba1. Mfsd2a кодирует мембранный транспортер лизофосфатидов. Его повышенная экспрессия маркирует повышение активности CD8+ (Treg) лимфоцитов и может свидетельствовать о противовоспалительном действии [34]. По данным [35] MFSD2A, отвечающий за перенос через мембраны длинноцепочечных ПНЖК семейства ω3, способствует усилению синтеза их противовоспалительных производных из группы оксилипинов. Понижение эктопической экспрессии Hba1 (α-цепь гемоглобина) может быть связано с модуляцией сигнального пути, опосредуемого оксидом азота [36].
Все специфические только для добавки Трп гены (Exosc5, Gata4, Dhcr24, Abcg8 и Nlrp12) ответили на его потребление отрицательной ДЭ. Из них Dhcr24 (3-beta-hydroxysterol delta-24-reductase) кодирует один из ключевых ферментов метаболизма холестерина, обладающий также плейотропным действием благодаря способности связывать про-апоптотический фактор p53 [37]. Abcg8 отвечает за синтез АТФ-зависимого транспортера стероидов, нарушение синтеза которого приводит к аномальному накоплению холестерина в тканях [38]. Продукт экспрессии Gata4 является фактором, повышающим мембранный потенциал митохондрий и способствующим защите клеток от гипоксии и окислительного стресса [39]. Nlrp12 кодирует белок, который ингибирует альтернативный (опосредуемый Toll-рецепторами) сигнальный путь NF-κB, приводящий к усилению воспаления [40]. Функция в печени остальных генов, являющихся мишенями воздействия Тир и Трп, недостаточно изучена.
Обобщая полученные данные, можно предположить, что потребление дополнительных количеств Тир приводит к активации в ткани печени группы генов, оказывающих противовоспалительное действие, в то время как под влиянием Трп экспрессия ряда противовоспалительных факторов подавляется, отражением чего возможно является противоположный характер влияния этих добавок на развитие жирового гепатоза, вызванного ВУВЖР.
Биоинформатический анализ позволил получить информацию о влиянии ВУВЖР и применяемых биологически активных веществ на ряд метаболических путей (KEGGs). Полученные данные согласуются с исследованиями [41–46], в которых при индуцированном диетой ожирении у мышей и крыс происходит изменение метаболических путей метаболизма липидов, защитных реакций на стресс, функции цитоскелета и клеточной адгезии, инсулинового и PPAR-сигналинга, метаболизма стероидов и аминокислот. Большинство этих метаболических путей явились мишенями воздействия биологически активных веществ (l-Кар, Рес, Тир и Трп). При этом для l-Кар, характеризуемого наиболее благоприятным влиянием на накопление жира в печени при условии потребления ВУВЖР, было также в наибольшей степени характерно влияние на метаболические пути PPAR-сигналинга, а для Рес, оказывающего по ряду показателей выраженное иммунотропное действие [47], – на JAK-STAT-сигнальный путь. Наиболее характерными мишенями действия добавки Тир явились метаболические пути, связанные с экспрессией различных генов семейства CYP450 и с метаболизмом ретиноидов.
Новым не описанным в доступной литературе стал дифференцированный эффект между l-Кар, Рес и Тир, с одной стороны, и Трп – с другой, на метаболический путь арахидоновой кислоты, включая процессы образования из нее оксилипинов (липоксинов) [48, 49], простагландинов и тромбоксанов. Дисбаланс различных оксилипинов рассматривается как причина хронического системного воспаления при ожирении, диабете 2-го типа, гипертензии, коронарной болезни сердца, аутоиммунных и других алиментарно-зависимых заболеваниях [50, 51]. Такой представитель класса эйкозаноидов как простациклин выступает в роли ведущего регулятора разрастания жировой ткани [52]. Модуляция синтеза различных классов оксилипинов и эйкозаноидов рассматривается и в качестве универсального механизма биологического действия Рес [7].
Таким образом, проведенные исследования показали, что действие на организм таких нутрицевтиков как l-Кар, Рес и ароматические аминокислоты характеризуется специфическим для каждого из этих БАВ изменением экспрессии сложного комплекса генов. Критическими “точками приложения” действующих веществ являются метаболические пути, охватывающие процессы биосинтеза и деградации жирных кислот, стеринов и ретиноидов, внутриклеточного транспорта, рецепции, межклеточного распознавания, программируемой клеточной гибели (апоптоза), иммунного ответа. Выявленные эффекты далеко не исчерпываются постулируемыми для изученных БАВ механизмами, такими как интенсификация окисления жира для l-Кар, антиоксидантный эффект Рес, влияние Тир и Трп на обмен биогенных аминов. Дифференцированный учет разнообразных эффектов воздействия БАВ на генную экспрессию необходим при их персонифицированном назначении в составе специализированных продуктов и диет в диетотерапии ожирения, с учетом генотипа больного, тяжести и причин развития заболевания.
Работа выполнена при поддержке гранта Российского научного фонда № 17-16-01043 “Поиск эффекторных звеньев метаболизма, регулируемых алиментарными факторами при ожирении, для разработки инновационных специализированных пищевых продуктов”.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Тутельян В.А., Киселева Т.Л., Кочеткова А.А. и др. Перспективные источники фитонутриентов для специализированных пищевых продуктов с модифицированным углеводным профилем: опыт традиционной медицины // Вопр. питания. 2016. Т. 85. № 4. С. 46–60.
Тутельян В.А., Кочеткова А.А., Саркисян В.А. Специализированные пищевые продукты в современной парадигме алиментарной коррекции нарушений метаболома // FOODLIFE 2018. Генетические ресурсы растений и здоровое питание: потенциал зерновых культур: Материалы конф. 2018. С. 22. [Электронный ресурс: https://docplayer.ru/77452959-I-mezhdisciplinarnaya-konferenciya.html, дата обращения 22.05.2020]
Bojanowska E., Ciosek J. Can we selectively reduce appetite for energy-dense foods? An overview of pharmacological strategies for modification of food preference behavior // Curr. Neuropharmacol. 2016. V. 14. № 22. P. 118–142. https://doi.org/10.2174/1570159x14666151109103147
Раджабкадиев Р.М., Коростелева М.М., Евстратова В.С. и др. L-карнитин: свойства и перспективы применения в спортивной практике // Вопр. питания. 2015. Т. 84. № 3. С. 4–12.
Brass E.P. Carnitine and sports medicine: use or abuse? // Ann. N.Y. Acad. Sci. 2004. V. 1033. № 1. P. 67–78. https://doi.org/10.1196/annals.1320.006
Rauf A., Imran M., Suleria H.A.R. et al. A comprehensive review of the health perspectives of resveratrol // Food Funct. 2017. V. 8. № 12. P. 4284–4305. https://doi.org/10.1039/c7fo01300k
Repossi G., Das U., Eynard A.R. Molecular basis of the beneficial actions of resveratrol // Arch. Med. Res. 2020. V. 51. № 2. P. 105–114. https://doi.org/10.1016/j.arcmed.2020.01.010
Herrera C.P., Smith K., Atkinson F. et al. High-glycaemic index and -glycaemic load meals increase the availability of tryptophan in healthy volunteers // Br. J. Nutr. 2011. V. 105. № 11. P. 1601–1606. https://doi.org/10.1017/S0007114510005192
Christenson J., Whitby S.J., Mellor D. et al. The effects of resveratrol supplementation in overweight and obese humans: A systematic review of randomized trials // Metab. Syndr. Relat. Disord. 2016. V. 14. № 7. P. 323–333. https://doi.org/10.1089/met.2016.0035
Pooyandjoo M., Nouhi M., Shab-Bidar S. et al. The effect of (L-)carnitine on weight loss in adults: A systematic review and meta-analysis of randomized controlled trials // Obes. Rev. 2016. V. 17. № 10. P. 970–976. https://doi.org/10.1111/obr.12436
Guide for the care and use of laboratory animals. Eighth Edition / Committee for the Update of the Guide for the Care and Use of Laboratory Animals; Institute for Laboratory Animal Research (ILAR); Division on Earth and Life Studies (DELS); National Research Council of the national academies. Washington: The National Academies Press. 2011.
Apryatin S.A., Shipelin V.A., Trusov N.V. et al. Comparative analysis of the influence of a high-fat/high-carbohydrate diet on the level of anxiety and neuromotor and cognitive functions in Wistar and DAT-KO rats // Physiol. Rep. 2019. V. 7. № 4. P. e13987. https://doi.org/10.14814/phy2.13987
Agilent Total RNA Isolation Mini Kit Protocol. Электронный ресурс: http://www.agilent.com/cs/library/usermanuals/Public/5188_2710_A1.pdf
Agilent One-Color Microarray-Based Gene Expression Analysis Low Input Quick Amp Labeling, version 6.8. Электронный ресурс: http://www.agilent.com/cs/library/usermanuals/Public/G4140-900-40_GeneExpression_OneColor_6.9.pdf
Benjamini Y., Hochberg Y. Controlling the false discovery rate: A practical and powerful approach to multiple testing // J. Royal Statist. Soc. Series B. 1995. V. 57. № 1. P. 289–300.
Апрятин С.А., Трусов Н.В., Горбачев А.Ю. и др. Полнотранскриптомное профилирование печени мышей C57Black/6J, получавших рационы с избытком жира, фруктозы и холестерина // Генетика. 2019. Т. 55. № 4. С. 369–382. https://doi.org/10.1134/S0016675819040027
Apryatin S.A., Trusov N.V., Gorbachev A.Yu. et al. Comparative whole transcriptome profiling of liver tissue from Wistar rats fed with diets containing different amounts of fat, fructose, and cholesterol // Biochemistry (Moscow). 2019. V. 84. № 9. P. 1093–1106. https://doi.org/10.1134/S0006297919090128
Трусов Н.В., Апрятин С.А., Горбачев А.Ю. и др. Влияние гиперкалорийного рациона и кверцетина на полно-транскриптомный профиль ткани печени крыс линии Zucker- LEPRfa // Пробл. эндокринологии. 2018. Т. 64. № 6. С. 371–382. https://doi.org/10.14341/probl9936
Yang T., Espenshade P.J., Wrigh M.E. et al. Crucial step in cholesterol homeostasis: Sterols promote binding of SCAP to INSIG-1, a membrane protein that facilitates retention of SREBPs in ER // Cell. 2002. V. 110. № 4. P. 489–500. https://doi.org/10.1016/s0092-8674(02)00872-3
Li J., Takaishi K., Cook W. et al. Insig-1 brakes lipogenesis in adipocytes and inhibits differentiation of preadipocytes // Proc. Natl Acad. Sci. USA. 2003. V. 100. № 16. P. 9476–9481. https://doi.org/10.1073/pnas.1133426100
Chen S.H., Zhuang X.H., Liu Y.T. et al. Expression and significance of lipin1 and AMPKα in hepatic insulin resistance in diet-induced insulin resistance rats // Exp. Clin. Endocrinol. Diabetes. 2012. V. 120. № 2. P. 84–88. https://doi.org/10.1055/s-0031-1298013
Römer M., Eichner J., Metzger U. et al. Cross-platform toxicogenomics for the prediction of non-genotoxic hepatocarcinogenesis in rat // PLoS One. 2014. V. 9. № 5. P. e97640. https://doi.org/10.1371/journal.pone.0097640
Hirota T., Okano T., Kokame K. et al. Glucose down-regulates Per1 and Per2 mRNA levels and induces circadian gene expression in cultured Rat-1 fibroblasts // J. Biol. Chem. 2002. V. 277. № 46. P. 44244–44251. https://doi.org/10.1074/jbc.M206233200
Qi G., Wu W., Mi Y. et al. Tea polyphenols direct Bmal1-driven ameliorating of the redox imbalance and mitochondrial dysfunction in hepatocytes // Food. Chem. Toxicol. 2018. V. 122. P. 181–193. https://doi.org/10.1016/j.fct.2018.10.031
Yaman E., Gasper R., Koerner C. et al. RasGEF1A and RasGEF1B are guanine nucleotide exchange factors that discriminate between Rap GTP-binding proteins and mediate Rap2-specific nucleotide exchange // FEBS J. 2009. V. 276. № 16. P. 4607–4616. https://doi.org/10.1111/j.1742-4658.2009.07166.x
Barrientos T., Frank D., Kuwahara K. et al. Two novel members of the ABLIM protein family, ABLIM-2 and -3, associate with STARS and directly bind F-actin // J. Biol. Chem. 2007. V. 282. № 11. P. 8393–8403. https://doi.org/10.1074/jbc.M607549200
Biragyn A., Ruffini P.A., Leifer C.A. et al. Toll-like receptor 4–dependent activation of dendritic cells by defensin 2 // Science. 2002. V. 298. № 5595. P. 1025–1029. https://doi.org/10.1126/science.1075565
Yang D., Chertov O., Bykovskaia S.N. et al. β-Defensins: linking innate and adaptive immunity through dendritic and T cell CCR6 // Science. 1999. V. 286. № 5439. P. 525–528. https://doi.org/10.1126/science.286.5439.525
Chang W., Parra M., Centrella M., McCarthy T.L. Interactions between CCAAT enhancer binding protein delta and estrogen receptor alpha control insulin-like growth factor I (igf1) and estrogen receptor-dependent gene expression in osteoblasts // Gene. 2005. V. 345. № 2. P. 225–235. https://doi.org/10.1016/j.gene.2004.11.017
Turgeon N., Valiquette C., Blais M. et al. Regulation of C/EBPdelta-dependent transactivation by histone deacetylases in intestinal epithelial cells // J. Cell. Biochem. 2008. V. 103. № 5. P. 1573–1583. https://doi.org/10.1002/jcb.21544
Katz B.Z., Zohar M., Teramoto H. et al. Tensin can induce JNK and p38 activation // Biochem. Biophys. Res. Commun. 2000. V. 272. № 3. P. 717–720. https://doi.org/10.1006/bbrc.2000.2853
Chang J., Cizmecioglu O., Hoffmann I., Rhee K. PLK2 phosphorylation is critical for CPAP function in procentriole formation during the centrosome cycle // EMBO J. 2010. V. 29. № 14. P. 2395–2406. https://doi.org/10.1038/emboj.2010.118
Lee K.J., Lee Y., Rozeboom A. et al. Requirement for Plk2 in orchestrated ras and rap signaling, homeostatic structural plasticity, and memory // Neuron. 2011. V. 69. № 5. P. 957–973. https://doi.org/10.1016/j.neuron.2011.02.004
Piccirillo A.R., Hyzny E.J., Beppu L.Y. et al. The lysophosphatidylcholine transporter MFSD2A is essential for CD8+ memory T cell maintenance and secondary response to infection // J. Immunol. 2019. V. 203. № 1. P. 117–126. https://doi.org/10.4049/jimmunol.1801585
Ungaro F., Tacconi C., Massimino L. et al. MFSD2A Promotes endothelial generation of inflammation-resolving lipid mediators and reduces colitis in mice // Gastroenterology. 2017. V. 153. № 5. P. 1363–1377. e6. https://doi.org/10.1053/j.gastro.2017.07.048
Straub A.C., Lohman A.W., Billaud M. et al. Endothelial cell expression of haemoglobin alpha regulates nitric oxide signaling // Nature. 2012. V. 491. № 7424. P. 473–477. https://doi.org/10.1038/nature11626
Wu C., Miloslavskaya I., Demontis S. et al. Regulation of cellular response to oncogenic and oxidative stress by Seladin-1 // Nature. 2004. V. 432. № 7017. P. 640–645. https://doi.org/10.1038/nature03173
Berge K.E., Tian H., Graf G.A. et al. Accumulation of dietary cholesterol in sitosterolemia caused by mutations in adjacent ABC transporters // Science. 2000. V. 290. № 5497. P. 1771–1775. https://doi.org/10.1126/science.290.5497.1771
Li H.-X., Zhou Y.-F., Zhao X. et al. GATA-4 Protects against hypoxia-induced cardiomyocyte injury: Effects on mitochondrial membrane potential // Can. J. Physiol. Pharmacol. 2014. V. 92. № 8. P. 669–678. https://doi.org/10.1139/cjpp-2014-0009
Allen I.C., Wilson J.E., Schneider M. et al. NLRP12 suppresses colon inflammation and tumorigenesis through the negative regulation of noncanonical NF-κB signaling // Immunity. 2012. V. 36. № 5. P. 742–754. https://doi.org/10.1016/j.immuni.2012.03.012
Ferrante A.W., Thearle M., Liao T., Leibel R.L. Effects of leptin deficiency and short-term repletion on hepatic gene expression in genetically obese mice // Diabetes. 2001. V. 50. № 10. P. 2268–2278. https://doi.org/10.2337/diabetes.50.10.2268
Liang C.P., Tall A.R. Transcriptional profiling reveals global defects in energy metabolism, lipo-protein, and bile acid synthesis and transport with reversal by leptin treatment in ob/ob mouse liver // J. Biol. Chem. 2001. V. 276. № 52. P. 49066–49076. https://doi.org/10.1074/jbc.M107250200
Kim S., Sohn I., Ahn J.I. et al. Hepatic gene expression profiles in a long-term high-fat diet-induced obesity mouse model // Gene. 2004. V. 340. № 1. P. 99–109. https://doi.org/10.1016/j.gene.2004.06.015
Inoue M., Ohtake T., Motomura W. et al. Increased expression of PPARgamma in high fat diet-induced liver steatosis in mice // Biochem. Biophys. Res. Commun. 2005. V. 336. № 1. P. 215–222. https://doi.org/10.1016/j.bbrc.2005.08.070
Patsouris D., Reddy J.K., Muller M., Kersten S. Peroxisome proliferator-activated receptor alpha mediates the effects of high-fat diet on hepatic gene expression // Endocrinology. 2006. V. 147. № 3. P. 1508–1516. https://doi.org/10.1210/en.2005-1132
Yang R.-L., Li W., Shi Y.-H., Le G.-W. Lipoic acid prevents high-fat diet-induced dyslipidemia and oxidative stress: a microarray analysis // Nutrition. 2008. V. 24. № 6. P. 582–588. https://doi.org/10.1016/j.nut.2008.02.002
Palacz-Wrobel M., Borkowska P., Paul-Samojedny M. et al. Effect of apigenin, kaempferol and resveratrol on the gene expression and protein secretion of tumor necrosis factor alpha (TNF-α) and interleukin-10 (IL-10) in RAW-264.7 macrophages // Biomed. Pharmacother. 2017. V. 93. P. 1205–1212. https://doi.org/10.1016/j.biopha.2017.07.054
Судьина Г.Ф., Мирзоева О.К., Щукин И.А. и др. Липоксины. Исследование различных путей биосинтеза // Биохимия. 1991. Т. 56. № 6. С. 1113–1122.
Гесслер Н.Н., Белозерская Т.А., Гроза Н.В. и др. Оксилипины и пути их синтеза у грибов // Прикладная биохимия и микробиология. 2017. Т. 53. № 6. С. 568–579.
Pickens C.A., Sordillo L.M., Zhang C., Fenton J.I. Obesity is positively associated with arachidonic acid-derived 5- and 11-hydroxyeicosatetraenoic acid (HETE) // Metabolism. 2017. V. 70. P. 177–191. https://doi.org/10.1016/j.metabol.2017.01.034
Das U.N. Bioactive lipids in age-related disorders // Adv. Exp. Med. Biol. 2020. V. 1260. P. 33–83. https://doi.org/10.1007/978-3-030-42667-5_3
Rahman M.S. Prostacyclin: A major prostaglandin in the regulation of adipose tissue development // J. Cell Physiol. 2019. V. 234. № 4. P. 3254–3262. https://doi.org/10.1002/jcp.26932
Дополнительные материалы отсутствуют.