Генетика, 2021, T. 57, № 2, стр. 155-164
Фосфатаза Pph3 вовлечена в регуляцию безошибочной ветви пострепликативной репарации в дрожжах Saccharomyces cerevisiae
Д. В. Федоров 1, Т. А. Евстюхина 1, В. Т. Пешехонов 1, В. Г. Королев 1, *
1 Петербургский институт ядерной физики им. Б.П. Константинова Национального исследовательского центра “Курчатовский институт”
188300 Гатчина, Россия
* E-mail: korolev_vg@pnpi.nrcki.ru
Поступила в редакцию 18.02.2020
После доработки 03.04.2020
Принята к публикации 08.07.2020
Аннотация
Фосфатазный комплекс PPH3 состоит из трех субъединиц: каталитической Рph3 и вспомогательных Pph2 и Psy4. Pph3 также образует двойной комплекс с субъединицей Psy2, который связывается с киназой Rad53 и дефосфорилирует ее без привлечения третьей субъединицы. Тройной комплекс дефосфорилирует γН2А. Ранее мы показали, что ген HSM6 соответствует гену PSY4 на генетической карте Saccharomyces cerevisiae. Мутация hsm6-1 повышает скорость спонтанного и частоту УФ-индуцированного мутагенеза. В настоящей работе мы показали, что мутации в гене PPH3 увеличивают скорость спонтанного репаративного мутагенеза в 7 раз, при этом мутации pph3Δ и hsm6-1 эпистатируют. При высоких дозах частота УФ-индуцированных мутаций у мутантов pph3Δ, psy4Δ и hsm6-1 одинакова и превышает уровень мутагенеза в штамме дикого типа приблизительно двукратно. Все мутанты показывают более высокую (примерно 10-кратную) частоту γ-индуцированных мутаций по сравнению со штаммом дикого типа. Объединение мутаций в генах, кодирующих субъединицы PPH3, и мутаций в MMS2 и XRS2, контролирующих безошибочный путь пострепликативной репарации, приводит к блокированию PPH3-специфического УФ-индуцированного мутагенеза. Таким образом, мы идентифицировали комплекс PPH3 в качестве нового фактора, вовлеченного в регуляцию безошибочной ветви пострепликативной репарации. Двойной мутант по генам PTC2 и PTC3, кодирующим две другие фосфатазы, дефосфорилирующие Rad53, не отличается от штамма дикого типа в отношении УФ-индуцированного мутагенеза и выживаемости. Это означает, что гиперфосфорилирование только Pph3-специфических сайтов белка Rad53 и гистона Н2А увеличивает уровень УФ-мутагенеза.
Стабильность геномной ДНК поддерживается в течение всего жизненного цикла клетки. Однако различные нарушения ее первичной структуры, индуцированные как в процессе нормального клеточного метаболизма, так и в ответ на факторы окружающей среды, возникают непрерывно. Повреждения структуры ДНК могут приводить к смерти клетки (летальные повреждения) или к генерации мутаций. Мутации являются первичной причиной наследственных болезней и рака, а также вносят вклад в процесс старения [1].
Хотя клетки содержат множество очень сложных систем для точного восстановления ДНК до ее первоначальной последовательности и структуры, иногда требуются механизмы, способные временно обеспечивать переносимость повреждения ДНК без посредничества репарации. Эти механизмы толерантности способствуют выживанию после повреждения ДНК, а в некоторых ситуациях также активно способствуют возникновению мутаций. Толерантность к повреждению ДНК (tolerance to DNA damage – TDD) исторически называли пострепликативной репарацией (ПРР) из-за наблюдения, что обработка почкующихся дрожжевых клеток УФ-излучением вызывала однонитевые (ОН) бреши в реплицирующейся ДНК [1]. УФ-индуцированные димеры пиримидинов, вызывающие ОН бреши в ДНК, часто сохранялись после “репарации”, что указывает на то, что ПРР просто обходит повреждение без его удаления [2]. Два различных пути TDD, ошибочный и безошибочный, действуют во всех эукариотических организмах [3]. Ошибочный путь TDD опосредуется синтезом через повреждения (TLS), в то время как в безошибочном TDD одна вновь синтезированная нить служит матрицей для репликации другой блокированной нити [4, 5]. Выбор между этими путями TDD имеет серьезные последствия для стабильности генома.
Клетки, дефектные в безошибочном пути TDD, характеризуются более выраженной зависимостью от TLS, демонстрируя более высокие уровни спонтанного мутагенеза и повышенную чувствительность к повреждениям после инактивации компонентов ошибочной TDD [6]. Примечательно, что мутации в безошибочном пути придают большую чувствительность к ДНК-повреждающим агентам, чем мутации в пути TLS [7].
Эукариотические клетки имеют специализированный ответ на повреждение ДНК, называемый “чекпойнтом”, который задерживает развитие клеточного цикла и способствует репарации поврежденной ДНК. Активация чекпойнта осуществляется каскадом фосфорилирования белков и инициируется в клетках дрожжей двумя протеинкиназами, Mec1 и Tel1 [8]. Эти киназы фосфорилируют белки медиаторы чекпойнта, Rad53 и Rad9, а также гистон H2A [9, 10]. В настоящее время достигнут значительный прогресс в понимании инициирования и хода процесса чекпойнта. Однако о механизмах его прекращения известно мало. Поскольку Ser/Thr киназы (STK) играют центральную роль в инициации чекпойнта, вполне вероятно, что Ser/Thr фосфатазы (STP) должны быть вовлечены в его завершение. Процесс прекращения действия чекпойнта важен для повторной инициации репликации ДНК и выживания клеток. Этот процесс требует дефосфорилирования Rad53 и γН2А. Было показано, что некоторые фосфатазы специфически продуцируют различные формы модификаций Rad53, которые необходимы для адекватного ответа на определенные повреждения ДНК [11].
В клетках дрожжей фосфатаза Pph3 участвует в дефосфорилировании ключевой чекпойнтной киназы Rad53 [12]. Pph3 образует комплекс с субъединицей Psy2, который связывается с киназой Rad53 и дефосфорилирует ее без участия третьей субъединицы. Другой комплекс, состоящий из трех субъединиц Pph3–Psy2–Psy4, дефосфорилирует γН2А [13].
Ранее было обнаружено, что STP Pph3, Ptc2 и Ptc3 S. cerevisiae важны для дефосфорилирования Rad53 и, следовательно, для его дезактивации во время восстановления от воздействия MMS [14, 15]. FHA1-домен Rad53 взаимодействует со специфическим треонином Ptc2 [16]. Сверхэкспрессия Ptc2 индуцирует чувствительность к УФ и оксимочевине (HU) и летальна для мутантов rad53, mec1 и dun1 с низкой активностью рибонуклеотид-редуктазы. С другой стороны, делеция PTC2 специфически подавляет гиперчувствительность mec1 к HU [17]. Предполагается, что Ptc2 и Ptc3 дефосфорилируют Rad53 конститутивно, и инактивация этого белка происходит после завершения репарации, что сопровождается снижением активности Mec1 [18].
Ранее нами был выделен мутантный штамм S. cerevisiae hsm6-1, характеризующийся повышенной скоростью спонтанного мутагенеза [19]. Эпистатический анализ показал, что мутация hsm6-1 представляет собой аллель гена PSY4. Секвенирование мутантного аллеля hsm6-1 выявило мутацию сдвига рамки считывания, которая вызвала замену Lys218Glu и генерацию стоп-кодона в следующей позиции. Точечная мутация hsm6-1 имеет более выраженный фенотип по сравнению с делеционной мутацией psy4Δ. На основании полученных данных было сделано заключение, что ген PSY4 играет ключевую роль в регуляции выхода клеток из чекпойнта, вызванного повреждением ДНК [20]. Полученные в настоящей работе результаты подтверждают это заключение.
МАТЕРИАЛЫ И МЕТОДЫ
Штаммы дрожжей и питательные среды
Штаммы дрожжей S. cerevisiae, использованные в настоящем исследовании, перечислены в табл. 1. Для роста культуры и регистрации выживания использовали полную среду [21]. Спиртосодержащую среду использовали в исследованиях УФ-индуцированного мутагенеза [22]. Спонтанные мутации устойчивости к канаванину (CanS → CanR) регистрировали с использованием минимальной среды со стандартными добавками и 50 мг/мл канаванина.
Таблица 1.
Штаммы дрожжей, используемые в работе
| Штамм | Генотип | Происхождение |
|---|---|---|
| 11D-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 | [26] |
| 6B-SVK-312 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 hsm6-1 | [20] |
| KFY-1073 | MATα ura3Δ leu2-his3-1 met15Δ pph3Δ::KanMX | Настоящая работа |
| 60-TAE-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 psy4::NAT | [20] |
| 62-TAE-3032 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 pph3::KanMX | Настоящая работа |
| 63-TAE-3033 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 hsm6-1 pph3::KanMX | » |
| 23-DVF-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 ptc2::NAT ptc3::KanMX | » |
| 24-DVF-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 mms2::KanMX | » |
| 25-DVF-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 pph3::KanMX mms2::KanMX | Настоящая работа |
| 26-DVF-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 xrs2::URA3 | [27] |
| 27-DVF-3031 | MATα ade2Δ-248 ura3-160,188 leu2-3,112 trp1 hsm6-1 xrs2::URA3 | Настоящая работа |
Мутагены
Источником ультрафиолетового света была лампа БУВ-30Е с мощностью дозы 1.4 Дж/м2 с. Аппарат “Исследователь” с мощностью дозы 180 Гр/мин служил источником γ-лучей. Обработку дрожжей УФ-лучами и γ-лучами проводили как описано ранее [22].
Методы определения частоты мутаций
Чувствительность к летальному воздействию ультрафиолетового излучения и γ-лучей определяли, используя кривые выживаемости. Чувствительность к мутагенному действию ультрафиолетового и γ-лучей была зарегистрирована индукцией прямых мутаций в пяти локусах, контролирующих синтез аденина, ADE4–ADE8 [23]. Спонтанный мутагенез определяли с использованием стандартного метода медиан (флуктуационный тест), который регистрирует в основном ошибки репликации [24]. В других экспериментах скорость спонтанных мутаций устойчивости к канаванину оценивали по методу упорядоченного посева Хромова-Борисова [25]. Этот метод позволяет измерять скорость репаративного мутагенеза. В этих экспериментах тестируемые дрожжевые культуры выращивали на чашках с полной средой в течение суток. Затем готовили 5 мл суспензии (106 клеток/мл). Специальный репликатор на 150 штырей был погружен в эту суспензию и перенесен на чашку Петри со средой, содержащей канаванин. Репликатор переносил 150 равных капель дрожжевой суспензии (около 2 мкл каждая) на равных расстояниях друг от друга, каждая капля содержала приблизительно 2000 клеток. Концентрация канаванина для оценки скорости мутаций устойчивости к антибиотику была определена в специальных предварительных экспериментах для всех штаммов и составила 50 мг/л. Мутанты имеют более быстрый рост, который проявляется в виде “бородавок” на пятнах с ограниченным ростом исследуемой культуры. После 14–15 дней инкубации подсчитывали бородавки мутантов, устойчивых к канаванину, и общее количество клеток. Последнее было сделано после смыва клеток с ряда реплик капель, лишенных бородавок. Частоты мутаций на одно деление клеток определяли путем деления числа бородавок на общее количество клеток на чашке. Результаты представлены как средние значения 3–5 независимых экспериментов с 95%-ным доверительными интервалами.
Конструирование штаммов
Для разрушения открытой рамки считывания гена PPH3 (YDR075W) клетки штамма дрожжей дикого типа (11D-3031) (табл. 1) трансформировали фрагментом ДНК, содержащим маркер KanMX, с фланкирующими 22-нуклеотидными последовательностями, гомологичными флангам гена PPH3. Фрагмент генерировали путем ПЦР-амплификации с праймерами Pph3-1 и Pph3-2 и ДНК, выделенной из штамма KFY-1073 в качестве матрицы. Последовательности ДНК всех использованных в настоящей работе праймеров приведены в табл. 2. Трансформанты с делецией гена PPH3 отбирали по их устойчивости к G418 с использованием полной среды, содержащей G418 в концентрации 200 мкг/мл. Разрушение гена PPH3 было подтверждено с помощью ПЦР.
Таблица 2.
Праймеры, использованные в работе
| Название | Последовательность |
|---|---|
| Pph3-1 | 5'-GTCAATATGTGGTGTTGCGACG-3' |
| Pph3-2 | 5'-CTAATCCTGTGATGCCGCTACT-3' |
| MMS2_L | 5'-TCGATGTCGTGGTGAAATTCTTATTCTGTATATGCAACGTAGAAGAAAGCAGCGTTTACACAA AAATGTCGCTTCGTACGCTGCAGGTCG-3' |
| MMS2_R | 5'-TTGGAATGCTGCAAATACTGTTTAGGAAAAAGTAGATAACTAAAAGGTTTCTCCTTCCTTCGG TTGACGCGCATAGGCCACTAGTGGATC-3' |
| PTC2_L | 5'-CCTCCCCACGGAATAAAACTACAACAAGTTCTGTTATCAAGGACAATTAGTGT ATATTAGTTGTTGTAACGCTTCGTACGCTGCAGGTCG-3' |
| PTC2_R | 5'-GGTAGTGGTGTATGCTCTTGGTTCTGGTGGTGTCTTGCGTCTTCTCTTCTCTTTCTGT TCGTTCGGTTCGGCATAGGCCACTAGTGGATC-3' |
Для получения одиночного mms2Δ и двойного hsm6-1 mms2Δ мутантов клетки штамма дикого типа 11D-3031 (табл. 1) и мутанта hsm6-1 6B-SVK-312 (табл. 1) трансформировали фрагментом ДНК, содержащим кассету KanMX4 с фланкирующими 70-нуклеотидными последовательностями, гомологичными флангам гена MMS2. Фрагмент получали посредством ПЦР-амплификации плазмиды pFLA6A-KanMX4 c праймерами MMS2_L и MMS2_R. Трансформанты также отбирали по их устойчивости к G418 описанным выше способом. Полное замещение гена MMS2 в полученных штаммах было подтверждено с помощью ПЦР.
Для получения двойного мутанта ptc2Δ ptc3Δ клетки штамма дикого типа трансформировали фрагментом ДНК, содержащим кассету natMX6 с фланкирующими 70-нуклеотидными последовательностями, гомологичными флангам гена PTC2. Фрагмент получали путем ПЦР-амплификации плазмиды PFLA6A-natMX6 с праймерами PTC2_L и PTC2_R. Трансформантов отбирали по их устойчивости к нурсеотрицину на полной среде, содержащей clonNAT в концентрации 30 мг/л. Далее клетки полученного штамма трансформировали фрагментом ДНК, содержащим кассету kanMX4 с фланкирующими 70-нуклеотидными последовательностями, гомологичными флангам гена PTC3. Фрагмент получали с помощью ПЦР-амплификации плазмиды PFLA6A-kanMX4 с праймерами PTC3_L и PTC3_R. Трансформантов отбирали по их устойчивости к генитицину на полной среде, содержащей G418 в концентрации 300 мг/л. Разрушение генов PTC2 и PTC3 в полученном штамме было подтверждено при помощи ПЦР.
Двойной мутант hsm6-1 xrs2Δ был получен путем трансформации клеток штамма hsm6-1 6B-SVK-312 (табл. 1) фрагментом ДНК, полученным в результате рестрикции плазмиды pEI39 по сайтам BamHI и HindIII. Трансформантов отбирали на селективной среде без урацила.
РЕЗУЛЬТАТЫ
Влияние мутации pph3Δ на спонтанный мутагенез
Известно, что клетки pph3Δ показывают гиперчувствительность к репликативному стрессу, индуцированному ДНК-алкилирующим агентом MMS. Более того, при воздействии MMS клетки мутанта pph3Δ показывают гиперактивацию белка Rad53, задержку входа в S-фазу клеточного цикла и проявляют ухудшение процессинга объединенных хромосомных структур [28]. Эти результаты показывают, что наблюдаемые дефекты являются следствием ухудшения регуляции активации белка Rad53.
Для лучшего понимания функции субъединиц комплекса PPH3 мы проанализировали генетические свойства клеток, мутантных по гену PPH3. Флуктуационный тест медиан [24] и метод упорядоченного посева [25] были использованы для определения скорости спонтанных мутаций устойчивости к канаванину у мутанта pph3Δ. Ранее мы показали, что скорость спонтанных мутаций, измеренная флуктуационным тестом, в одиночном psy4Δ не отличалась от скорости в клетках дикого типа: (3.8 ± 1.1) × 10–7 и (3.2 ± 0.6) × 10–7 соответственно. В то же время мутация hsm6-1 увеличивает скорость спонтанного мутагенеза более чем в 5 раз [20]. Измеренная нами скорость репликативных мутаций в мутанте pph3Δ не отличалась от скорости в клетках дикого типа – (3.8 ± ± 1.14) × 10–7. С другой стороны, метод упорядоченного посева показывает значительные различия между мутантами и штаммом дикого типа: wt – (3.2 ± 0.62) × 10–7, psy4Δ – (10.2 ± 2.64) × 10–7, hsm6-1 – (34.4 ± 4.2) × 10–7 [20], pph3Δ – (52.7 ± ± 6.04) × 10–7, hsm6-1 pph3Δ – (58.5 ± 7.04) × 10–7. Эти результаты показывают, что мутации psy4Δ и pph3Δ не изменяют скорости репликативного мутагенеза, но они значительно увеличивают скорость репаративного мутагенеза. К тому же инактивация гена PSY4 увеличивает скорость репаративного мутагенеза в значительно меньшей степени, чем инактивация гена PPH3, что подтверждает разное влияние этих мутаций на репарационные процессы.
Эффект мутаций pph3Δ и hsm6 pph3Δ на УФ-индуцированный мутагенез и выживаемость
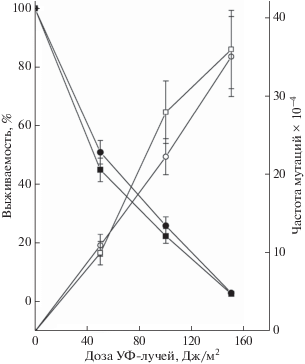
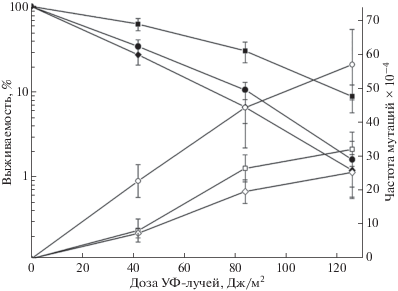
Мутации ряда генов, контролирующих репарацию предмутационных повреждений ДНК, показывают спонтанный мутаторный фенотип и в то же время такие мутанты могут быть чувствительными к летальному и мутагенному действию различных мутагенов. Ранее мы показали, что мутация psy4Δ не влияет на УФ-чувствительность клеток дрожжей и слабо повышает уровень УФ-индуцированного мутагенеза [20]. В связи с этим мы измерили выживаемость и частоту мутаций ade4–ade8 в изучаемых штаммах при УФ-облучении. Одиночный мутант psy4Δ не отличается по УФ-чувствительности от штамма дикого типа. В то же время мутант hsm6-1 показал заметно большую УФ-чувствительность по сравнению со штаммом дикого типа [20]. Мутанты hsm6-1, pph3Δ и двойной pph3Δ hsm6-1 показали примерно одинаковую УФ-чувствительность (рис. 1,а).
Рис. 1.
Выживаемость (а) и частота мутаций по пяти локусам ADE4–ADE8 (б) при действии разных доз УФ на клетки дрожжей: штамм дикого типа (◼, ◻), мутант pph3::KanMX (⚫, ⚪), мутант hsm6-1 (▲, △), двойной мутант hsm6-1 pph3::KanMX (◆, ◇).
Так как генетические эффекты мутации pph3 не были изучены в деталях, мы определили влияние делеции гена PPH3 на УФ-индуцированный мутагенез. Частота прямых мутаций в генах ADE4–ADE8 при УФ-облучении была оценена в клетках дикого типа и мутантах hsm6-1, pph3Δ и pph3Δ hsm6-1 (рис. 1,б). Представленные кривые индуцированного мутагенеза показывают, что при низких дозах облучения частота мутаций в клетках дикого типа, мутантах pph3Δ и pph3Δ hsm6-1 была одинакова и значительно ниже (~в 3 раза) по сравнению с одиночным мутантом hsm6-1. При высоких дозах частота мутаций во всех трех мутантных штаммах была одинакова и превышала уровень мутагенеза в клетках дикого типа примерно двукратно. Таким образом, мутация hsm6-1 проявляет значительно более выраженный эффект по сравнению с делецией всего гена, в то же время мутация pph3Δ полностью эпистатирует к мутации hsm6-1.
Выживаемость и мутагенез у мутантов hsm6-1, psy4, pph3Δ и pph3Δ hsm6-1 при γ-облучении
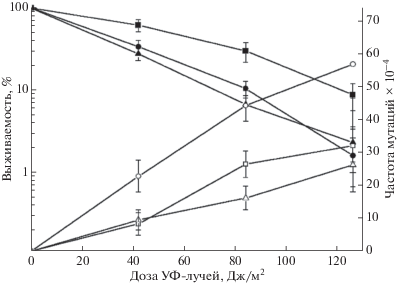
Для индукции двунитевых разрывов (ДНР) ДНК мы использовали γ-лучи. Данные по сравнению выживаемости штамма дикого типа и мутантов hsm6-1, psy4, pph3Δ и pph3Δ hsm6-1, полученные в количественном тесте, представлены на рис. 2,а. Из этого рисунка видно, что существенных различий в γ-чувствительности штамма дикого типа и мутантов не наблюдается. Более того, почкующиеся клетки всех штаммов, инактивация которых характеризуется пологим участком кривой инактивации, показали одинаковую чувствительность. Возможно, небольшие различия в первоначальном наклоне кривых выживаемости объясняются различным соотношением доли почкующихся клеток в облучаемых культурах.
Рис. 2.
Выживаемость (а) и частота мутаций по пяти локусам ADE4–ADE8 (б) при действии разных доз гамма-лучей на клетки дрожжей: штамм дикого типа (◼, ◻), мутант hsm6-1 (⚫, ⚪), мутант psy4::NAT (★, ☆), мутант pph3::KanMX (◆, ◇), двойной мутант hsm6-1 pph3::KamMX (▲, △).
Частота прямых мутаций в генах ADE4–ADE8 была оценена после γ-облучения в штамме дикого типа и мутантах hsm6-1, psy4Δ, pph3Δ и pph3Δ hsm6-1 (рис. 2,б). Все мутанты проявили более высокую частоту γ-индуцированного мутагенеза по сравнению со штаммом дикого типа. Следует отметить, что различие в частоте мутаций между штаммом дикого типа и мутантами было значительно больше, чем при УФ-облучении.
Эффект УФ-облучения на выживаемость и мутагенез у двойного мутанта ptc2Δ ptc3Δ
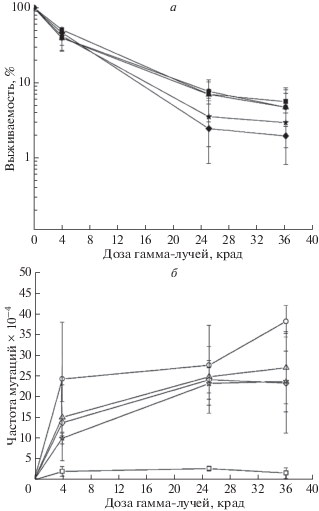
Ptc2 и Ptc3 были первыми протеинфосфатазами, для которых показано влияние на дезактивацию чекпойнта, индуцированного повреждениями ДНК [14]. Клетки, потерявшие все три фосфатазы Pph3, Ptc2 и Ptc3, проявляют синергическую чувствительность к ДНК-повреждающим агентам камптотецину, HU и MMS, но не к УФ-лучам [29]. Для изучения вовлеченности фосфатаз Ptc2 и Ptc3 в УФ-индуцированный мутагенез мы создали мутантные клетки, потерявшие гены PTC2 и PTC3. Вначале мы тестировали выживаемость мутанта ptc2 ptc3 после УФ-облучения. Как видно из рис. 3, клетки двойного мутанта не показали повышенной чувствительности по сравнению с клетками дикого типа. УФ-индуцированный мутагенез в этих штаммах также оказался одинаковым (рис. 3). Таким образом, гиперфосфорилирование Ptc2/3-зависимых сайтов белка Rad53 не влияет на УФ-индуцированный мутагенез и выживаемость клеток дрожжей.
Белковый комплекс PPH3 вовлечен в регуляцию безошибочной ветви ПРР
Ранее мы сообщали, что мутация hsm6-1 увеличивает частоту УФ-индуцированного мутагенеза и снижает уровень УФ-индуцированного митотического кроссинговера в области между центромером и геном ADE2. Мутант hsm6 показывает увеличенную скорость спонтанного и УФ-индуцированного мутагенеза, при этом увеличение сильно зависит от гена REV3, кодирующего специфическую ДНК-полимеразу [20, 30]. Эти результаты показывают, что HSM6 может участвовать в одной из ветвей ПРР.
Белок Rad5 вовлечен в безошибочную ветвь ПРР [31]. Белок Mms2, обладающий в комплексе с Ubc13p убиквитинтрансферазной активностью, является субъединицей тройного комплекса Rad5–Mms2–Ubc13, который осуществляет полиубиквитинирование PCNA и таким образом стимулирует рекомбинационно-подобный процесс. Отсюда следует, что ген MMS2 контролирует первую стадию безошибочной ветви ПРР.
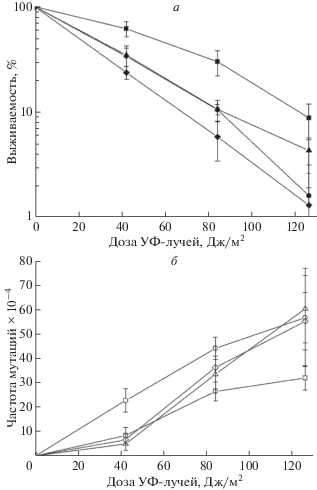
Для проверки предположения, что ген PPH3 может быть вовлечен в контроль безошибочной ветви ПРР, мы разрушили ген MMS2 в мутанте pph3 и штамме дикого типа. Как видно из рис. 4, УФ-индуцированный мутагенез в мутанте mms2 значительно ниже, чем в одиночном мутанте pph3, и близок к уровню штамма дикого типа. Двойной мутант mms2 pph3 показывает уровень УФ-индуцированного мутагенеза такой же, как у одиночного mms2. Следовательно, мутации mms2 и pph3 находятся на одном пути репарации и mms2 эпистатирует к pph3.
Рис. 4.
Выживаемость (темные символы) и частота мутаций по пяти локусам ADE4–ADE8 (светлые символы): штамм дикого типа (◼, ◻), мутант pph3 (⚫, ⚪), мутант mms2 (▲, △), двойной мутант pph3 mms2 (◆, ◇).
Показано, что ОН бреши ДНК за остановленными репликационными вилками обусловлены Mre11-зависимой деградацией реплицированной ДНК. Это событие определяет вторую стадию безошибочной ветви ПРР. Образование ОН брешей со свободным 3'-концом стимулирует инвазию вновь синтезированной ДНК в дуплексную ДНК сестринской хроматиды, таким образом инициируя смену матриц. Мы исследовали потенциальные эпистатические отношения между мутациями генов XRS2 и PPH3. Xrs2 является субъединицей комплекса MRE11. Штамм дикого типа был слабо чувствителен к УФ-облучению и не оказывал заметного влияния на УФ-индуцированный мутагенез (рис. 5). Двойной мутант xrs2 pph3 был также чувствителен к УФ-индукционному летальному действию и мутагенезу, как и одиночный мутант xrs2 (рис. 5). Таким образом, эти результаты согласуются с ролью PPH3 в безошибочном пути обхода повреждений.
ОБСУЖДЕНИЕ
При благоприятных условиях роста основной причиной спонтанного мутагенеза являются ошибки репликации. Именно поэтому флуктуационный тест учитывает спонтанные мутации, возникшие в основном в результате ошибок репликации. Мутации, возникающие как ошибки репликации, так и ошибки репарации, регистрируются методом упорядоченного посева, когда клетки выращиваются в течение длительных периодов на селективной среде, и многие спонтанные повреждения накапливаются в ДНК в течение одного поколения [26]. Если клетки имеют дефект в репарационных системах, это может значительно увеличить уровень спонтанного мутагенеза.
Частота спонтанных мутаций устойчивости к канаванину, измеренная с помощью флуктуационного теста для мутанта pph3Δ, не отличалась от штамма дикого типа. Однако в тесте Хромова-Борисова мутация pph3 проявляет очень высокий уровень спонтанного мутагенеза, который аналогичен двойному мутанту pph3Δ hsm6-1. На основании этих данных мы можем предположить, что мутации pph3Δ, psy4Δ и hsm6-1 стимулируют подверженный ошибкам процесс репарации ДНК.
При воздействии MMS клетки pph3Δ проявляют гиперактивацию Rad53 и задержку внутри-S-фазного чекпойнта [12, 28]. Однако Pph3-Psy2 не является единственной фосфатазой, необходимой для дефосфорилирования Rad53. Фосфатазы Pp2C, Ptc2 и, в меньшей степени, Ptc3 необходимы для дефосфорилирования Rad53 после ДНР ДНК [13]. Учитывая, что Pph3-Psy2, по-видимому, регулирует некоторые чекпойнтные функции Rad53, но не все, можно предположить, что Pph3 и Ptc2/Ptc3 не являются избыточными, поскольку они распознают разные формы фосфорилирования Rad53, и что эти разные формы фосфорилирования независимо регулируют различные аспекты чекпойнт ответа [13]. Чтобы лучше понять функциональное взаимодействие между фосфатазами Pph3-Psy2 и Ptc2/Ptc3, мы проанализировали индуцированный ультрафиолетом мутагенез в клетках, лишенных Ptc2/Ptc3. Как показано на рис. 3, двойной мутант ptc2 ptc3 не проявляет какой-либо чувствительности к ультрафиолетовому излучению и не увеличивает уровня индуцированного ультрафиолетом мутагенеза. Взятые вместе эти результаты согласуются с моделью, в которой основной причиной более высокого уровня мутаций, индуцированных ультрафиолетом в мутанте pph3, является замедление дефосфорилирования PPH3-специфических сайтов Rad53 и γН2А.
Фосфатаза Pph3-Psy2-Psy4 образует стабильный комплекс с γН2А, т.е. реакция дефосфорилирования гистона является медленным процессом [32]. γН2А теряется из хроматина независимо от PPH3, что указывает на то, что фосфатаза нацеливается на γН2А после его вытеснения из ДНК. Дефосфорилирование γН2А с помощью PPH3 необходимо для эффективного выхода из чекпойнта, индуцированного повреждениями ДНК [13]. Ранее мы предполагали, что чувствительность мутанта hsm6-1 к ультрафиолетовому излучению и его высокая спонтанная и зависимая от ультрафиолетового излучения изменчивость обусловлены задержанным выходом клетки из чекпойнта [20]. После облучения УФ-лучами в процессе репликации на поврежденной ДНК образуются односторонние ДНР. У мутантов psy4Δ и pph3Δ значительное увеличение уровня мутагенеза наблюдалось только при высоких дозах УФ-облучения (рис. 1,б), поскольку в этом случае вероятность появления ДНР ДНК и индукции чекпойнта заметно возрастает. Количество выделяющегося γН2А будет высоким, что повлияет на уровень индуцированного мутагенеза.
Репарация одностороннего ДНР отличается от репарации двустороннего ДНР. Когда индуцируется двусторонний ДНР, гистон H2A фосфорилируется на большем расстоянии с обеих сторон ДНР, что приводит к индукции множества γН2А [33]. Мы предполагаем, что увеличение количества γН2А может привести к более высокому уровню индуцированного мутагенеза. Чтобы проверить это предположение, мы использовали γ-лучи, которые индуцируют ДНР ДНК с двумя концами с высокой частотой. Действительно, частота мутаций, индуцированных γ-лучами, у всех исследованных мутантов была чрезвычайно высокой по сравнению со штаммом дикого типа (рис. 2,б). Белок Pph3 является каталитической субъединицей фосфатазного комплекса Phy3–Psy2–Psy4, биохимическая функция которого – дефосфорилирование гистонов γН2А [13]. Мутации hsm6-1 и psy4Δ инактивируют тройной комплекс фосфатазы. С другой стороны, мутация pph3Δ инактивирует обе функции фосфатазного комплекса PPH3, при этом мы фиксируем при высоких дозах одинаково высокие уровни УФ- и γ-индуцированного мутагенеза у всех трех мутантов (рис. 1,б и 2,б). Следовательно, замедление дефосфорилирования γН2А является основной причиной увеличения скорости индуцированного мутагенеза у мутантов pph3Δ, hsm6-1 и psy4Δ. Этот вывод подтверждается, во-первых, данными по УФ-индуцированному мутагенезу в клетках, потерявших фосфатазу Ptc2/Ptc3, которая не имеет отношения к дефосфорилированию γН2А, но дефосфорилирует белок Rad53. Во-вторых, полным совпадением кривых УФ-мутагенеза у мутантов pph3Δ и psy4Δ (рис. 1,б).
В дрожжах открыта еще одна фосфатаза Glc7, которая способна дефосфорилировать гистон γН2А [34]. Наличие в клетке одновременно двух фосфатаз, способных дефосфорилировать гистон γН2А, должно приводить к конкуренции за субстрат. Когда в клетке присутствуют оба фермента, количество свободного γН2А будет быстро уменьшаться и освобождать комплекс Pph3–Psy2–Psy4 от связывания с гистоном. Это, в свою очередь, сместит равновесие между комплексами Pph3–Psy2–Psy4 и Pph3–Psy2 в сторону последнего. В отсутствие Glc7 (мутант glc7) дефосфорилирование гистона γН2А значительно замедлится, что приведет к его повторному включению в хроматин. Однако отсутствие Glc7 лишь замедляет процесс выхода из чекпойнта, но не блокирует его, из-за активности второго фермента Pph3–Psy2–Psy4. Делеция гена PSY4 также замедлит дефосфорилирование гистона γН2А. Таким образом, при низких дозах УФ-лучей отсутствие одного из белков Psy4 или Glc7 не будет заметно сказываться на скорости дефосфорилирования γН2А. Однако при высокой концентрации этого гистона в ядре (высокие дозы УФ-лучей или при γ-облучении) отсутствие одного из партнеров окажет заметное влияние на эффективность дефосфорилирования γН2А. Мутация hsm6-1 относится к типу сдвиг рамки считывания. В результате образуется укороченный белок, который сохранил консервативную последовательность на N-конце. Можно предполагать, что такой укороченный белок способен формировать тройной комплекс PPH3, но не способен выполнять в полном объеме свою ферментативную функцию. Это приведет к замедлению дефосфорилирования гистона γН2А, значительному увеличению времени существования нефункционального тройного комплекса, связанного с γН2А, и, как следствие, снижению эффективности дефосфорилирования Rad53. Эти свойства аллеля hsm6-1 будут отличать его от делеционного мутанта.
В совокупности мы интерпретируем эти результаты как указание на то, что высокий спонтанный мутагенез у мутантов hsm6-1 и pph3Δ и высокая чувствительность к мутагенному действию ультрафиолетовых и γ-лучей обусловлены задержкой выхода клетки из чекпойнта.
Ранее мы предполагали, что ген HSM6 участвует в контроле ПРР [19, 20]. Проведенный нами генетический анализ подтверждает это предположение. Прежде всего мы показываем, что мутации mms2 и xrs2 способны полностью подавлять более высокий УФ-индуцированный мутагенез мутанта pph3 (рис. 4, 5). Этот фенотип самым строгим образом определяет гены, контролирующие субъединицы белкового комплекса PPH3, в качестве участников в регуляции безошибочной ветви ПРР.
Исследование выполнено при финансовой поддержке гранта РФФИ № 18-34-005540 мол_а и в рамках государственного задания по теме “Мультикомпонентные биологические системы: структурно-динамическая и функциональная организация” (регистрационный номер АААА-А19-119091890069-7).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Prakash L. Characterization of postreplication repair in Saccharmyces cerevisiae and effects of rad6, rad18, rev3 and rad52 mutations // Mol. Gen. Genet. 1981. V. 184. P. 471–478.
Ganesan A.K. Persistence of pyrimidine dimmers during post-replication repair in ultraviolet light-irradiated Escherichia coli K12 // J. Mol. Biol. 1974. V. 87. P. 103–119.
Sale J.E. Competition, collaboration and coordination-determining how cells bypass DNA damage // J. Cell Sci. 2012. V. 125. P. 1633–1643.
Branzei D., Vanoli F., Foiani M. SUMOylation regulates Rad18-mediated template switch // Nature. 2008. V. 456. P. 915–920.
Giannattasio M., Zwicky K., Follonier C. et al. Visualization of recombination-mediated damage bypass by temple switching // Nat. Struct. Mol. Biol. 2014. V. 21. P. 884–892.
Cejka P., Vondrejs V., Storchova Z. Dissection of the functions of the Saccharomyces cerevisiae RAD6 postreplicative repair group in mutagenesis and UV sensitivity // Genetics. 2001. V. 159. P. 953–963.
Brusky J., Zhu Y., Xiao W. UBC13, a DNA-damage-inducible gene, is a member of the error-free postreplication repair pathway in Saccharomyces cerevisiae // Curr. Genet. 2000. V. 37. P. 168–174.
Paciotti V., Clerici M., Lucchini G., Longhese M.P. The checkpoint protein Ddc2, functionally related to S. pombe Rad26, interacts with Mec1 and is regulated by Mec1-dependent phosphorylation in budding yeast // Genes Dev. 2000. V.14. P. 2046–2059.
Redon C., Pilch D.R., Rogakou E.P. et al. Yeast histone 2A serine 129 is essential for efficient repair of checkpoint-blind DNA damage // EMBO Rep. 2003. V. 4. P. 678–684.
Sanchez Y., Desany B.A., Jones W.J. et al. Regulation of RAD53 by the ATM-like kinases Mec1 and Tel1 in yeast cell cycle checkpoint pathways // Science. 1996. V. 271. P. 357–360.
Travesa A., Duch A., Quintana D.G. Distinct phosphatases mediate the deactivation of the DNA damage checkpoint kinase Rad53 // J. Biol. Chem. 2008. V. 283. P. 17123–17130.
O’Neill B.M., Szyjka S.J., Lis E.T. et al. Pph3–Psy2 is a phosphatase complex required for Rad53 dephosphorylation and replication fork restart during recovery from DNA damage // Proc. Natl Acad. Sci. USA. 2007. V. 104. P. 9290–9295.
Keogh M.C., Kim J.A., Downey M. et al. A phosphatase complex that dephosphorylates γH2AX regulates DNA damage checkpoint recovery // Nature. 2006. V. 439. P. 497–501.
Leroy C., Lee S.E., Vaze M.B. et al. PP2C phosphatases Ptc2 and Ptc3 are required for DNA checkpoint inactivation after a double-strand break // Mol. Cell. 2003. V. 11. P. 827–835.
Szyika S.J., Aparicio J.G., Viggiani C.J. et al. Rad53 regulates replication fork restart after DNA damage in Saccharomyces cerevisiae // Genes Dev. 2008. V. 22. P. 1906–1920.
Guillemain G., Ma E., Mauger S. et al. Mechanisms of checkpoint kinase Rad53 inactivation after a double-strand break in Saccharomyces cerevisiae // Mol. Cel. Biol. 2007. V. 27. P. 3378–3389.
Marsolier M.C., Roussel P., Leroy C., Mann C. Involvement of the PP2C-like phosphatase Ptc2 in the DNA checkpoint pathways of Saccharomyces cerevisiae // Genetics. 2000. V. 154. P. 1523–1532.
Heideker J., Lis E.T., Romesberg F.E. Phosphatase, DNA damage checkpoints and checkpoint deactivation // Cell Cycle. 2007. V. 6. P. 3058–3064.
Иванов Е.Л., Федорова И.В., Ковальцова С.В. Изоляция и характеристика новых мутантов Saccharomyces cerevisiae с увеличенной спонтанной мутабильностью // Генетика. 1992. Т. 28(5). С. 47–55.
Федоров Д.В., Ковальцова С.В., Евстюхина Т.А. и др. Ген HSM6 идентичен гену PSY4 у дрожжей Saccharomyces cerevisiae // Генетика. 2013. Т. 49. № 3. С. 328–336.
Захаров И.А., Кожин С.А., Кожина Т.Н., Федорова И.В. Сборник методик по генетике дрожжей-сахаромицетов. Л.: Наука, 1984. 112 с.
Ковальцова С.В., Королев В.Г. Штамм дрожжей Saccharomyces cerevisiae для тестирования мутагенов среды, основанный на взаимодействии мутаций rad2 и him1 // Генетика. 1996. Т. 32. № 3. С. 366–372.
Roman H. A system selective for mutations affecting the synthesis of adenine in yeast // Compt. Rend. Trav. Lab. Carlsberg. Ser. Physiol. 1956. V. 26. P. 299–314.
Lea D.E., Coulson C.A. The distribution of the number of mutants in bacterial populations // J. Genet. 1949. V. 49. P. 264–285.
Khromov-Borisov N.N., Saffi J., Henriques J.A.P. Perfect order plating: principal and applications // TTO. 2002. V. 1. P. TO2638.
Fedorova I.V., Kovaltzova S.V., Gracheva L.M. et al. Requirement of HSM3 gene for spontaneous mutagenesis in Saccharomyces cerevisiae // Mutat. Res. 2004. V. 554. P. 65–75.
Черненков А.Ю., Грачева Л.М., Евстюхина T.A. и др. Взаимодействие гена HSM3 с генами эпистатической группы RAD6 дрожжей Saccharomyces cerevisiae // Генетика. 2012. Т. 48. № 2. С. 160–167.
Jablonowski C.M., Cussiol J.R., Oberly S. et al. Termination of replication stress signaling via concerted action of the Slx4 scaffold and the PP4 phosphatase // Genetics. 2015. V. 115.https://doi.org/10.1534/genetics.181479
Kim J.-A., Hicks W.M., Li J. et al. Orotein phosphatases Pph3, Ptc2, and Ptc3 play redundant roles in DNA double-strand break repair by homologous recombination // Mol. Cell. Biol. 2011. V. 31. P. 507–516.
Ковальцова С.В., Грачева Л.М., Евстюхина T.A. и др. Гены-мутаторы дрожжей Saccharomyces cerevisiae. Взаимодействие мутаций him и hsm с мутациями, блокирующих три основных пути репарации индуцированных повреждений ДНК // Генетика. 1996. Т. 32. № 8. С. 1061–1067.
Johnson R.E., Henderson S.T., Petes T.D. et al. Saccharomyces cerevisiae RAD5-encoded DNA repair protein contains DNA helicase and zinc-binding sequence motifs and affects on stability of simple repetitive sequences in the genome // Mol. Cell. Biol. 1992. V. 12. P. 3807–3818.
Vazquez-Martin C., Rouse J., Cohen P.T.W. Characterization of the role of a trimeric protein phosphatase complex in recovery from cisplatin-induced versus noncrosslinking DNA damage // FEBS J. 2008. V. 275. P. 4211–4221.
Shroff R., Arbel-Eden A., Pilch D. et al. Distribution and dynamics of chromatin modification induced by a defined DNA double-strand break // Curr. Biol. 2004. V. 14. P. 1703–1711.
Bazzi M., Mantiero D., Trovesi C. et al. Dephosphorylation of γH2A by Glc7/protein phosphatase 1 promotes recovery from inhibition of DNA replication // Mol. Cell. Biol. 2010. V. 30. P. 131–145.
Дополнительные материалы отсутствуют.