Генетика, 2021, T. 57, № 2, стр. 214-222
Анализ транскриптов генов протаминов 1 и 2 типов и фрагментация ДНК в сперматозоидах у пациентов клиник ВРТ
М. А. Ищук 1, 2, *, О. В. Малышева 1, Е. М. Комарова 1, И. Д. Мекина 1, Е. А. Лесик 1, А. М. Гзгзян 1, 2, И. Ю. Коган 1, В. С. Баранов 1, 2
1 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: mashamazilina@gmail.com
Поступила в редакцию 20.03.2020
После доработки 28.07.2020
Принята к публикации 10.09.2020
Аннотация
Изучение кодирующих и некодирующих РНК сперматозоидов перспективно для поиска новых клинических маркеров мужской фертильности и разработки оптимального алгоритма преодоления бесплодия. Целью данной работы был поиск взаимосвязи между количеством мРНК протаминов 1 и 2 типов в эякулированных сперматозоидах и фрагментацией их ДНК, а также результатами спермиологического анализа пациентов. Работа выполнена на 33 образцах эякулята мужчин, проходивших обследование и лечение по поводу бесплодия. Для всех пациентов был проведен стандартный спермиологический анализ, оценка одно- и двунитевых разрывов ДНК сперматозоидов методом TUNEL, выделение РНК из сперматозоидов и количественный анализ транскриптов генов протаминов методом ОТ-ПЦР в реальном времени. Согласно полученным данным изменение соотношения между мРНК протаминов 1 и 2 типов связано с нарушением параметров спермограммы; в группе пациентов с патозооспермией (n = 14) данное соотношение достоверно выше, чем в группе пациентов с нормозооспермией (n = 19) (3.43 ± 0.22 против 2.86 ± 0.16, p < 0.05). Выявлена статистически значимая корреляция (r = 0.33, p < 0.05) между долей сперматозоидов с фрагментированной ДНК и соотношением количества мРНК генов PRM2 и PRM1. В группе пациентов с долей сперматозоидов с фрагментированной ДНК выше референсного значения (n = 14) соотношение протаминов статистически значимо выше, чем в группе пациентов с аналогичным показателем в пределах нормы (n = 19) (3.26 ± 0.19 против 2.74 ± 0.18, p < 0.05). Установлено, что нарушение параметров спермограммы (патозооспермия) и повышение фрагментации ДНК сперматозоидов ассоциируется с уменьшением экспрессии гена PRM2 по сравнению с PRM1.
При оплодотворении ооцита сперматозоид привносит половину диплоидного генома будущего эмбриона. Считается, что геном зрелых сперматозоидов у млекопитающих транскрипционно и трансляционно неактивен. Между тем, период спермиогенеза (когда происходит формирование зрелых сперматозоидов из гаплоидных сперматид) включает глобальную реорганизацию и конденсацию хроматина, удаление большей части цитоплазмы и формирование функционально активного сперматозоида [1].
Известно, что основные транкрипционные и трансляционные процессы, контролирующие формирование зрелого сперматозоида, происходят непосредственно после завершения второго мейотического деления. При этом большая часть синтезированной РНК удаляется вместе с редуцируемой цитоплазмой, а зрелый сперматозоид содержит специфические белки и целый комплекс различных кодирующих и некодирующих РНК, которые могут влиять на развитие будущего эмбриона [2–5]. Некоторые из этих РНК вероятно представляют собой остаточные транскрипты, другие же могут быть непосредственно вовлечены в регуляцию экспрессии генов зиготы или потенциально могут транслироваться с помощью аппарата ооцита [6–10].
В ходе спермиогенеза млекопитающих структура хроматина претерпевает выраженные изменения. Вначале гистоновые белки хроматина округлых сперматид замещаются на транзиторные белки (TNP1, TNP2), которые уже на следующей стадии (элонгированные сперматиды) замещаются основными аргинин-богатыми белками (протамины 1 и 2 типов). Ядерные белки-протамины обеспечивают более плотную упаковку ДНК в сперматозоидах. Аминокислотная последовательность обоих протаминов установлена в 1986 г. [11], гены, определяющие их синтез (PRM1 и PRM2), локализованы на хромосоме 16 в локусе 16p13.3. Оба гена протамина PRM1 и PRM2 транскрибируются в ходе ранних этапов спермиогенеза [12]. мРНК протаминов PRM1 и PRM2, в отличие от их белковых продуктов, обнаруживается в округлых сперматидах [13]. После завершения связывания протаминов с хроматином сперматозоида транскрипция генов PRM1 и PRM2 полностью прекращается [14]. Трансляция PRM1- и PRM2-транскриптов начинается и завершается к стадии элонгированных сперматид [15]. Протамин PRM1 синтезируется как зрелый белковый продукт, который состоит из 50 аминокислотных остатков. мРНК протамина PRM2 транслируется до белкового предшественника, состоящего из 103 аминокислот, который подвергается протеолитическому расщеплению до зрелой формы, содержащей 50 аминокислотных остатков [16].
Известно, что эмбриональное развитие напрямую зависит от состояния генома сперматозоида, участвовавшего в оплодотворении [17]. В ходе созревания сперматозоид теряет большую часть цитоплазмы, что делает его ядро более уязвимым для внешних факторов. Конденсация хроматина за счет замещения гистонов на протамины в определенной мере имеет для генома протективное значение. Показано, что аномальное соотношение протаминов 1 и 2 типов связано с нарушением конденсации хроматина в сперматозоидах [14, 18], что делает их более уязвимыми к мутагенному действию внешних факторов, в том числе активных форм кислорода [19].
Матричные РНК протаминов в зрелых сперматозоидах человека вероятно являются остаточными транскриптами, которые после конденсации ядра сохраняются в эякулированных сперматозоидах [20, 21]. Считается, что содержание этих транскриптов связано с экспрессией генов в ходе сперматогенеза [22] и отражает качество компактизации ДНК в зрелом сперматозоиде.
Нарушение компактизации хроматина в сперматозоидах делает ДНК более чувствительной к воздействию свободных радикалов, что в свою очередь приводит к появлению в ней разрывов. Однако неустановлено, какой уровень фрагментации ДНК в сперматозоиде является критичным. Показано, что после оплодотворения, часть разрывов в ДНК сперматозоида может репарироваться за счет ооцита [23]. Не существует общепринятого порогового значения количества (%) сперматозоидов с фрагментированной ДНК в эякуляте, совместимой с нормальным оплодотворением и развитием эмбриона. Вопрос остается открытым также из-за того, что невозможно предсказать, какой именно сперматозоид будет участвовать в оплодотворении при естественном зачатии или при использовании вспомогательных репродуктивных технологий. Различные методы детекции повреждений ДНК сперматозоидов, отсутствие стандартизированных методик и разнообразие критериев включения пациентов в группы исследования также приводят к противоречивым результатам.
В настоящее время рутинные методы оценки мужской фертильности, используемые в клинической практике, имеют определенные ограничения и не позволяют оценить оплодотворяющий потенциал сперматозоида. В этой связи перспективным является изучение многочисленных кодирующих и некодирующих РНК сперматозоида для поиска новых клинических маркеров мужской фертильности и разработки оптимального алгоритма преодоления бесплодия. Целью данной работы был поиск взаимосвязи между количеством мРНК протаминов 1 и 2 типа в эякулированных сперматозоидах и фрагментацией их ДНК, а также результатами спермиологического анализа.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено в отделе репродуктологии НИИ акушерства, гинекологии и репродуктологии им. Д.О. Отта (Санкт-Петербург) с разрешения этического комитета. Материалом для исследования послужили образцы эякулята 33 пациентов, проходивших обследование в отделении вспомогательных репродуктивных технологий.
Подготовка и оценка эякулята
Для всех пациентов был проведен стандартный спермиологический анализ, который включал в себя оценку объема эякулята, концентрации, подвижности и морфологии сперматозоидов согласно руководству Всемирной организации здравоохранения (ВОЗ) [24]. После этого эякулят отмывали с помощью центрифугирования в градиенте плотности силиконовых частиц Supra-Sperm (Origio, Denmark) (80 : 55%, об/об) в течение 20 мин при 300g. После центрифугирования удаляли супернатант и осадок промывали культуральной средой для подготовки сперматозоидов к оплодотворению Sperm Preparation Medium (Origio, Denmark). Проводили повторное центрифугирование 10 мин при 300g, удаляли супернатант и выделяли фракцию живых подвижных сперматозоидов методом флотации. Обработанный эякулят был разделен на две части, одна из которых использовалась для оценки доли сперматозоидов с фрагментированной ДНК методом флуоресцентного мечения одно- и двунитевых разрывов ДНК (TUNEL), а другая – для анализа мРНК протаминов PRM1 и PRM2 с помощью ПЦР в реальном времени.
Флуоресцентное мечение одно- и двунитевых разрывов в ДНК методом TUNEL
Выявление в сперматозоидах фрагментированной ДНК методом TUNEL проводили согласно описанной ранее методике с модификациями [25]. Часть предобработанного эякулята обрабатывали гипотоническим раствором 0.33%-ного цитрата натрия. После центрифугирования 15 мин при 600g суспензию со сперматозоидами фиксировали с помощью этанол-уксусного фиксатора (3 : 1) и хранили до приготовления препаратов при температуре –20°С. Исследование фрагментации ДНК сперматозоидов проводили методом TUNEL (Terminal deoxynucleotidil transferase (TdT)-mediated dUTP Nickand Labelling). Согласно инструкции фирмы-производителя, суховоздушные препараты сперматозоидов отмывали в фосфатно-солевом буфере (1× PBS). После дополнительной фиксации в 4%-ном растворе парафольмальдегида (ПФА) препараты инкубировали в пермобилизирующем растворе 0.1% Triton X-100, растворенном в 0.1%-ном цитрате натрия, в течение 15 мин при температуре –20°С (Sigma, Germany). Далее под покровное стекло добавляли реакционную смесь: 4.5 мкл 1× TdT буфера и 0.5 мкл фермента (Roche, Germany). Позитивный и негативный контроли проводили согласно инструкции фирмы-производителя. Препараты инкубировали 1 ч при температуре 37°С. После двухкратной отмывки в буфере реакцию останавливали дистиллированной водой, препараты проводили по серии спиртов возрастающей концентрации (70°, 80°, 96°) и заключали в фотозащитный раствор, содержащий краситель DAPI (4,6-diamino-2-phenylidole) в концентрации 1 мкг/мл (Sigma, Германия). Флуоресцентный сигнал оценивали с помощью микроскопа Leica DM 2500 с камерой Leica DFC 345 FX (Leica Microsystems GmbH, Германия). Для получения фотоизображения использовали программное обеспечение Leica Application Suite версия 3.8.0 (Leica Microsystems GmbH, Германия). Для каждого образца оценивали не менее 2000 сперматозоидов.
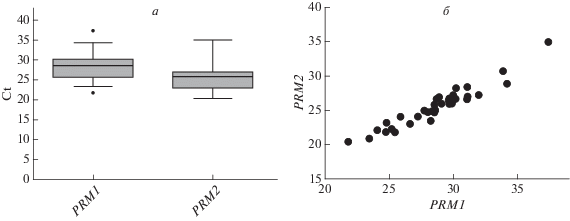
Флуоресцентный сигнал детектировали при микроскопическом анализе с помощью флуоресцентного микроскопа. Производили подсчет сперматозоидов, в которых присутствует/отсутствует флуоресцентный сигнал, что позволяет оценить общую долю сперматозоидов с наличием разрывов в ДНК – показатель доли сперматозоидов с “частично фрагментированной ДНК”. Также производили подсчет сперматозоидов, в которых флуоресценция занимает всю площадь головки, что говорит о тотальной фрагментации ДНК в клетке – показатель доли сперматозоидов с “полной” фрагментацией ДНК. Пороговое значение сперматозоидов с частично фрагментированной ДНК – 15% [26, 27], с полной фрагментацией ДНК – 0.35% (рис. 1). Референсное значение по доле клеток с полной фрагментацией ДНК было установлено по результатам собственных исследований спермы доноров (неопубликованные данные).
Выделение РНК, обратная транскрипция, RT PCR (ОТ-ПЦР)
Для свежих образцов эякулята с помощью оптического микроскопа, оборудованного 100× объективом, производили оценку чистоты отмывки сперматозоидов от соматических и круглых клеток. Все образцы были выравнены по концентрации, выделение РНК производили из 1 млн клеток на колонках с силикагелевой мембраной Pure- Link RNA Mini Kit (Thermo Fisher Scientific, США) согласно протоколу фирмы-производителя. Элюцию проводили в 30 мкл буфера ТЕ. Для проведения обратной транскрипции использовали набор High Capacity Reverse Transcription Kit (Thermo Fisher Scientific, США) в соответствии с инструкциями производителя, в объеме 20 мкл, в присутствии случайных гексануклеотидных праймеров (random primers) (3 мг/мл) с добавлением 10 мкл полученного раствора тотальной РНК.
ПЦР в реальном времени проводили на приборе Real-Time PCR System 7500 (Applied Biosystems, США) с использованием расходных материалов производства Thermo Fisher Scientific, США – TaqMan Gene Expression Assays: Hs00358158_g1 для гена PRM1, Hs04187294_g1 для гена PRM2. Для анализа общего содержания транскриптов генов PRM1 иPRM2 оценивали значение порогового цикла Ct для каждого образца (выделение РНК из 1 млн клеток). Для определения соотношения мРНК протаминов 1 и 2 использовали значение ΔСtPRM для мРНК генов PRM1 и PRM2 (CtPRM2– CtPRM1). Результаты экспериментов анализировали с использованием программы ExpressionSuit, версия 1.0.3 (Thermo Fisher Scientific, США).
Статистический анализ
Статистический анализ данных проводили с помощью программы GraphPad6 (GraphPad Software, США).
Нормальность распределения оценивали согласно критерию Шапиро–Уилка. В случае нормального распределения, средние сравнивали с помощью t-критерия Стьюдента. Для данных, не подчиняющихся нормальному распределению, применяли непараметрические критерии. Для сравнения медиан использован U-критерий Манна–Уитни. Различия считали статистически значимыми при значении p ≤ 0.05.
Для оценки взаимосвязи между Ct (PRM1) и Ct (PRM2) рассчитывали коэффициент корреляции Пирсона. Для определения связи между ΔСtPRM и параметрами спермограммы, а также взаимосвязи с долей сперматозоидов с фрагментированной ДНК рассчитывали коэффициент корреляции Спирмена (r).
РЕЗУЛЬТАТЫ
На основе результатов стандартного спермиологического анализа выделены две группы пациентов. Первую группу составили пациенты с нормозооспермией, n = 19 (т.е. с нормальными показателями спермограммы), вторую – пациенты с различными формами патозооспермии (n = 14), а именно: со снижением подвижности сперматозоидов – с астенозооспермией (n = 1), с нарушением морфологии сперматозоидов – тератозооспермией (n = 11), а также с сочетанными отклонениями – с олиготератозооспермией (n = 1) и олигоастенотератозооспермией (n = 1) (табл. 1).
Таблица 1.
Показатели параметров спермиологического анализа в группах пациентов с нормозооспермией и патозооспермией
| Результат спермограммы | Возраст (лет) | Объем эякулята, мл | Концентрация сперматозоидов, млн/мл | Подвижность сперматозоидов (% прогрессивно подвижных сперматозоидов) | Морфология сперматозоидов (% морфологически нормальных сперматозоидов) |
|---|---|---|---|---|---|
| Нормозооспермия (n = 19) | 36.0 ± 6.6 | 3.3 ± 1.0 | 85.6 ± 40.7 | 48.9 ± 14.7 | 8.8 ± 3.0 |
| Патозооспермия (n = 14) | 35.9 ± 5.6 | 3.5 ± 1.0 | 48.9 ± 39.9 | 49.1 ± 20.1 | 3.9 ± 2.6 |
| p-value | 0.99 | 0.53 | 0.05* | 0.61 | 0. 0001* |
Для всех пациентов проведена оценка доли сперматозоидов с фрагментированной ДНК методом флуоресцентного мечения одно- и двунитевых разрывов ДНК (TUNEL), которая варьировала от 0.8 до 20.5% по показателю частичной фрагментации и от 0 до 3.3% по показателю полной фрагментации. В группах сравнения среднее количество сперматозоидов с частично фрагментированной ДНК среди пациентов с нормозооспермией составило 5.8 ± 5.1%, для пациентов с патозооспермией – 6.5 ± 5.0%; с полной фрагментацией ДНК – 0.65 ± 0.86% и 0.67 ± 0.73% соответственно. Таким образом, исследуемые группы по доле сперматозоидов с фрагментированной ДНК между собой статистически значимо не отличались (p > 0.05) (t-критерий Стьюдента).
С помощью ПЦР в реальном времени проведена количественная оценка мРНК в исследуемых образцах по генам протаминов 1 и 2 типов. Оценены пороговые циклы (Ct) для мРНК протаминов PRM1 иPRM2, которые варьировали для PRM1 от 21.8 и до 34.2 (28.5 ± 3.3), а для PRM2 – от 20.4 до 28.9 (25.5 ± 2.9) (рис. 1,а). Коэффициент корреляции по количеству мРНК протамина 1 типа к протамину 2 типа составил r = 0.96 (p < 0.0001; коэффициент корреляции Пирсона) (рис. 1,б).
В исследуемой выборке общее количество мРНК генов PRM1 и PRM2 (значение Ct) у пациентов с нормозооспермией (n = 19) и патозооспермией (n = 14), а также у пациентов с разной долей сперматозоидов с фрагментированной ДНК статистически значимо не отличалось (U-критерий Манна–Уитни; p > 0.05). Не обнаружено значимой корреляции между соотношением мРНК протаминов PRM1 и PRM2 (показатель ΔСtPRM) и такими параметрами спермограммы, как концентрация, подвижность и морфология сперматозоидов (коэффициент корреляции Спирмена) (табл. 2).
Таблица 2.
Показатели коэффициента корреляции Спирмена между ΔCt PRM1/PRM2 и различными показателями параметров спермиологического анализа
| Параметр спермограммы | Коэффициент корреляции (r) между ΔCt PRM2/PRM1 и параметром спермограммы | p-value |
|---|---|---|
| Концентрация сперматозоидов | 0.13 | 0.46 |
| Подвижность сперматозоидов | 0.21 | 0.25 |
| Морфология сперматозоидов | –0.12 | 0.49 |
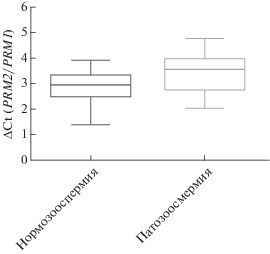
Однако при сравнении соотношений количества мРНК генов PRM1 иPRM2 (ΔСtPRM) между пациентами с нормозооспермией и патозооспермией обнаружено статистически значимое различие: 2.86 ± 0.16 против 3.43 ± 0.22 (p < 0.05) (U-критерий Манна–Уитни) (рис. 2). Более высокие значения показателя ΔСtPRM свидетельствуют о снижении уровня мРНК гена PRM2 относительно мРНК гена PRM1.
Рис. 2.
ΔСtPRM в группах пациентов с нормозооспермией и патозооспермией (U-критерий Манна–Уитни), p < 0.05.
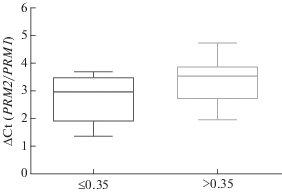
Также статистически значимые различия выявлены при анализе взаимосвязи между фрагментацией ДНК сперматозоидов и соотношением мРНК протаминов PRM1 и PRM2. В группе с повышенной долей сперматозоидов с полной фрагментацией ДНК (>0.35%; n = 14) значение ΔСtPRM значимо выше, чем в группе пациентов с показателями полной фрагментации в пределах референсного значения (≤0.35%; n = 19): 3.26 ± 0.19 и 2.74 ± 0.18 соответственно (p < 0.05) (t-критерий) (рис. 3). Между долей сперматозоидов с полной фрагментацией ДНК и ΔСtPRM показана статистически значимая корреляция (r = 0.33; p < 0.05) (коэффициент корреляции Спирмена).
Рис. 3.
ΔСtPRM в группах пациентов с долей сперматозоидов с полной фрагментацией ДНК ≤0.35% и >0.35% (t‑критерий Стьюдента), p < 0.05.
Доля сперматозоидов с частичной фрагментацией ДНК в исследуемой выборке у пациентов варьировала в пределах от 1 до 20.5%, среднее значение составило 6.28 ± 5.01%. У большинства пациентов данный показатель был в пределах референсных значений, в связи с этим не было проведено сравнения между группами (≤15% (n = 30) и >15% (n = 3)), выделенными по доле сперматозоидов с частичной фрагментацией ДНК, из-за малого количества пациентов в группах.
ОБСУЖДЕНИЕ
В ходе сперматогенеза гаплоидные сперматиды проходят фазу элонгации, утрачивают большую часть цитоплазмы (цитоплазматическая капля) и дифференцируются в зрелые сперматозоиды [28]. Показано, что в зрелых сперматозоидах человека не происходит синтеза РНК de novo [29], однако в них содержатся разнообразные типы (более 3000 транскриптов) как кодирующих, так и некодирующих РНК [4, 30].
В последние годы научные исследования в области мужского бесплодия и сперматогенеза сосредоточены на поисках информативных маркеров качества мужских половых клеток. Экспрессия протаминов имеет важное значение для нормального процесса сперматогенеза и, следовательно, мужской фертильности, поэтому изучение мРНК протаминов 1 и 2 типов является перспективным направлением в исследовании причин мужского бесплодия. А. Ахмади с соавт. показали на ооцитах хомячка, что деструкция протаминов, вызванная дисульфид-восстанавливающим агентом дитиотреитолом, приводит к снижению связывания сперматозоидов с ооцитами и их способности к пенетрации яйцеклетки [31].
Одним из возможных прогностических показателей качества сперматогенеза может быть соотношение белков протаминов в сперматозоидах. Согласно имеющимся данным, количественное соотношение белков PRM1/PRM2 у фертильных мужчин приближается к единице [14, 32]. Более поздние исследования показали сходные соотношения матричной РНК протаминов PRM1/PRM2. Установлено, что количество белков протаминов коррелирует с количеством протаминовых транскриптов [33, 34].
Используя количественную ПЦР в реальном времени, мы оценили количество транскриптов генов PRM1 и PRM2, выделенных из сперматозоидов, изолированных из эякулята с помощью градиента силиконовых частиц. Обнаружено, что увеличение значения ΔСtPRM (снижение уровня мРНК гена PRM2 относительно уровня мРНК гена PRM1), связано с нарушением параметров спермограммы, и у пациентов с патозооспермией этот показатель статистически значимо выше, чем у пациентов с нормозооспермией.
Наши результаты согласуются с данными других исследователей. А.Е. Платс с соавт. продемонстрировали различия в содержании тотальной РНК у мужчин с тератозооспермией и с нормозооспермией [35]. Позднее было продемонстрировано снижение уровня мРНК генов PRM1 и PRM2 у мужчин с астенозооспермией по сравнению с контрольной группой фертильных мужчин [22]. Существуют данные о связи между количеством транскриптов генов PRM1, PRM2 и TNP2 в зрелых сперматозоидах и их морфологией [36].
В нашей выборке не найдено различий по общему количеству мРНК генов PRM1 и PRM2 у мужчин с нормозооспермией и патозооспермией, а также у мужчин с различным уровнем фрагментации ДНК в сперматозоидах. Однако полученные результаты подтверждают исследования других авторов, свидетельствующих о важной роли соотношения протаминов для поддержания нормальной морфологии сперматозоидов и целостности их ДНК. Согласно данным литературы соотношение мРНК протаминов 1 и 2 типов в эякулированных сперматозоидах различается у фертильных мужчин и у мужчин с бесплодием, а у мужчин с нормозооспермией данный показатель приближается к единице [33, 34]. В настоящем исследовании группа пациентов с нарушением фертильности, связанным с патозооспермией, статистически значимо отличалась от группы пациентов с нормальной фертильностью по соотношению мРНК PRM2/PRM1, при этом у пациентов с патозооспермией данный показатель выше единицы почти в 3.5 раза.
Очевидно, что нормальное эмбриональное развитие напрямую зависит от сохранности генома сперматозоида, оплодотворившего яйцеклетку [17]. В ходе созревания сперматозоид теряет большую часть цитоплазмы, что делает его ядро более уязвимым для внешних факторов. Кроме того, в зрелом сперматозоиде не происходят процессы репарации. Чтобы защитить ДНК сперматозоида во время его прохождения из мужского репродуктивного тракта в женский, ДНК мужских гамет упаковывается отличным от соматических клеток образом: бóльшая часть гистонов заменяется на протамины, архитектура хроматина состоит из тороидальных структур [1]. Белки протаминов необходимы для правильной компактизации хроматина сперматозоида, а нарушение этого процесса предрасполагает к патоморфологическим аномалиями функциональной неполноценности сперматозоидов [37].
Согласно данным настоящего исследования нарушение в соотношении мРНК протаминов связано с повышением уровня фрагментации ДНК сперматозоидов: между долей сперматозоидов с полной фрагментацией ДНК и соотношением мРНК PRM2/PRM1 показана статистически значимая корреляция. Кроме того, в группе пациентов с долей сперматозоидов с фрагментированной ДНК выше референсного значения соотношение PRM1/PRM2 значимо выше, чем в группе пациентов с аналогичным показателем в пределах нормы. Вероятно, это является отражением эффективности компактизации ДНК в ходе спермиогенеза. Нарушение этого процесса приводит к тому, что ядерная ДНК сперматозоида менее стабильна и становится мишенью для мутагенного эффекта активных форм кислорода [38]. Согласно данным литературы повреждение ДНК сперматозоидов влияет на первые деления дробления зиготы, формирование бластоциты, эффективность имплантации и вынашивание беременности [19, 38–43]. Нарушения репарации разрывов ДНК как в сперматогенезе, так и после оплодотворения могут также приводить к возникновению хромосомных перестроек, в том числе хромотрипсиса, и наследованию их эмбрионами [45, 46].
На сегодняшний день очевидно, что стандартные методы оценки мужской фертильности имеют свои ограничения и недостаточны в случаях супружеских пар с идиопатическим бесплодием. Более того, по оценкам ВОЗ около 15% бесплодных мужчин имеют нормальные показатели спермиологического анализа [47], что указывает на присутствие других факторов, которые играют важную роль в мужской фертильности и не могут быть оценены с помощью анализа спермограммы. В этой связи изучение экспрессии протаминов и их связи с целостностью ДНК сперматозоидов является перспективным направлением для дальнейших исследований причин мужского бесплодия.
Работа выполнена при финансовой поддержке Российского научного фонда, грант № 18-75-10046.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Oliva R. Protamines and male infertility // Hum. Reprod. Update. 2006. V. 12. № 4. P. 417–435. https://doi.org/10.1093/humupd/dml009
Jodar M., Selvaraju S., Sendler E. et al. The presence, role and clinical use of spermatozoal RNAs // Hum. Reprod. Update. 2013. V. 19. № 6. P. 604–624. https://doi.org/10.1093/humupd/dmt031
Sendler E., Johnson G.D., Mao S. et al. Stability, delivery and functions of human sperm RNAs at fertilization // Nucl. Ac. Res. 2013. V. 41. № 7. P. 4104–4117. https://doi.org/10.1093/nar/gkt132
Jodar M., Sendler E., Moskovtsev S.I. et al. Absence of sperm RNA elements correlates with idiopathic male infertility // Sci. Transl. Med. 2015. V. 7. P. 295. https://doi.org/10.1126/scitranslmed.aab1287
Godia M., Swanson G., Krawetz S.A. A history of why fathers’ RNA matters // Biol. Reprod. 2018. V. 99. № 1. P. 147–159. https://doi.org/10.1093/biolre/ioy007
Krawetz S.A. Paternal contribution: new insights and future challenges // Nat. Rev. Genet. 2005. V. 6. № 8. P. 633–642. https://doi.org/10.1038/nrg1654
Carrell D.T. Epigenetics of the male gamete // Fertil. Steril. 2012. V. 97. № 2. P. 267–274. https://doi.org/10.1016/j.fertnstert.2011.12.036
Rando O.J. Daddy issues: Paternal effects on phenotype // Cell. 2012. V. 151. № 4. P. 702–708. https://doi.org/10.1016/j.cell.2012.10.020
Castillo J., Estanyol J.M., Ballescà J.L., Oliva R. Human sperm chromatin epigenetic potential: Genomics, proteomics, and male infertility // Asian J. Andrology. 2015. V. 17. P. 601–609. https://doi.org/10.4103/1008-682X.153302
Chen Q., Yan W., Duan E. Epigenetic inheritance of acquired traits through sperm RNAs and sperm RNA modifications // Nat. Rev. Genet. 2016. V. 17. № 12. P. 733–743. https://doi.org/10.1038/nrg.2016.106
Ammer H., Henschen A., Lee C.H. Isolation and amino-acid sequence analysis of human sperm protamines P1 and P2. Occurrence of two forms of protamine P2 // Biol. Chem. Hoppe Seyler. 1986. V. 367. № 1. P. 515–522. https://doi.org/10.1515/bchm3.1986.367.1.515
Steger K., Klonisch. T, Gavenis K. et al. Expression of mRNA and protein of nucleoproteins during human spermiogenesis // Mol. Hum. Reprod. 1998. V. 4. № 10. P. 939–945. https://doi.org/10.1093/molehr/4.10.939
Steger K., Pauls K., Klonisch T. et al. Expression of protamine-1 and -2 mRNA during human spermiogenesis // Mol. Hum. Reprod. 2000. V. 6. № 3. P. 219–225. https://doi.org/10.1093/molehr/6.3.219
Aoki V.W., Emery B.R., Liu L., Carrell D.T. Protamine levels vary between individual sperm cells of infertile human males and correlate with viability and DNA integrity // J. Androl. 2006. V. 27. № 6. P. 890–898. https://doi.org/10.2164/jandrol.106.000703
Morales C.R, Kwon Y.K., Hecht N.B. Cytoplasmic localization during storage and translation of the mRNAs of transition protein 1 and protamine 1, two translationally regulated transcripts of the mammalian testis // J. Cell Sci. 1991. V. 100. № 1. P. 119–131. http://www.ncbi.nlm.nih.gov/pubmed/1795020.
Balhorn R., Cosman M., Thornton K. et al. Protamine mediated condensation of DNA in mammalian sperm // The Male Gamete: From Basic Science to Clinical Applications. Salt Lake City, Utah: American Society of Andrology, 1999. P. 707–907.
Simon L., Murphy K., Shamsi M.B. et al. Paternal influence of sperm DNA integrity on early embryonic development // Hum. Reprod. 2014. V. 29. № 11. P. 2402–2412. https://doi.org/10.1093/humrep/deu228
Mengual L., Ballescà J.L., Ascaso C., Oliva R. Marked differences in protamine content and P1/P2 ratios in sperm cells from percoll fractions between patients and controls // J. Androl. 2003. V. 24. № 3. P. 438–447. https://doi.org/10.1002/j.1939-4640.2003.tb02692.x
Wright C., Milne S., Leeson H. Sperm DNA damage caused by oxidative stress: Modifiable clinical, lifestyle and nutritional factors in male infertility // Reprod. Biomed. Online. 2014. V. 28. № 6. P. 684–703. https://doi.org/10.1016/j.rbmo.2014.02.004
Miller D., Briggs D., Snowden H. et al. A complex population of RNAs exists in human ejaculate spermatozoa: Implications for understanding molecular aspects of spermiogenesis // Gene. 1999. V. 237. № 2. P. 385–392. https://doi.org/10.1016/s0378-1119(99)00324-8
Ostermeier G.C., Dix D.J., Miller D. et al. Spermatozoal RNA profiles of normal fertile men // Lancet. 2002. V. 360. № 9335. P. 772–777. https://doi.org/10.1016/S0140-6736(02)09899-9
Kempisty B., Depa-Martynow M., Lianeri M. et al. Evaluation of protamines 1 and 2 transcript contents in spermatozoa from asthenozoospermic men // Folia Histochem. Cytobiol. 2007. V. 45. № 1. P. 109–113. http://www.ncbi.nlm.nih.gov/pubmed/18292846
González-Marín C., Gosálvez J., Roy R. Types, causes, detection and repair of DNA fragmentation in animal and human sperm cells // Int. J. Mol. Sci. 2012. V. 13. № 11. P. 14026–14052. https://doi.org/10.3390/ijms131114026
WHO laboratory manual for the Examination and processing of human semen. М.: Капитал, 2010. 287 c.
Efimova O.A., Pendina AA., Tikhonov A.V. et al. Genome-wide 5-hydroxymethylcytosine patterns in human spermatogenesis are associated with semen quality // Oncotarget. 2017. V. 8. № 51. P. 88294–88307. https://doi.org/10.18632/oncotarget.18331
Virro M.R., Larson-Cook K.L., Evenson D.P. et al. Sperm chromatin structure assay (scsa®) parameters are related to fertilization, blastocyst development, and ongoing pregnancy in in vitro fertilization and intracytoplasmic sperm injection cycles // Fertil. Steril. 2004. V. 81. № 5. P. 1289–1295. https://doi.org/10.1016/j.fertnstert.2003.09.063
Evenson D., Wixon R. Meta-analysis of sperm DNA fragmentation using the sperm chromatin structure assay // Rep. BioMed Online. 2006. V. 12. № 4. P. 466–472. https://doi.org/10.1016/S1472-6483(10)62000-7
Hecht N.B. Regulation of “haploid expressed genes” in male germ cells // J. of Reprod. and Fertility. 1990. V. 88. P. 679–693. https://doi.org/10.1530/jrf.0.0880679
Grunewald S., Paasch U., Glander H.J., Anderegg U. Mature human spermatozoa do not transcribe novel RNA // Andrologia. 2005. V. 37. № 2. P. 69–71. https://doi.org/10.1111/j.1439-0272.2005.00656.x
Steger K. Transcriptional and translational regulation of gene expression in haploid spermatids // Anat. Embryol. (Berl). 1999. V. 199. № 6. P. 471–487. https://doi.org/10.1007/s004290050245
Ahmadi A., Ng S.C. Destruction of protamine in human sperm inhibits sperm binding and penetration in the zona-free hamster penetration test but increases sperm head decondensation and male pronuclear formation in the hamster-ICSI assay // J. Assist. Reprod. Genet. 1999. V. 16. № 3. P. 128–132. https://doi.org/10.1023/a:1022527714175
Nanassy L., Liu L., Griffin J.T., Carrell D. The clinical utility of the protamine 1/protamine 2 ratio in sperm // Protein Pept. Lett. 2012. V. 18. № 8. P. 772–777. https://doi.org/10.2174/092986611795713934
Depa-Martynow M., Kempisty B., Jagodziński P.P. et al. Impact of protamine transcripts and their proteins on the quality and fertilization ability of sperm and the development of preimplantation embryos // Reprod. Biol. 2012. V. 12. № 1. P. 57–72. https://doi.org/10.1016/s1642-431x(12)60077-1
Rogenhofer N., Dansranjavin T., Schorsch M. et al. The sperm protamine mRNA ratio as a clinical parameter to estimate the fertilizing potential of men taking part in an ART programme // Hum. Reprod. 2013. V. 28. № 4. P. 969–978. https://doi.org/10.1093/humrep/des471
Platts A.E., Dix D.J., Chemes H.E. et al. Success and failure in human spermatogenesis as revealed by teratozoospermic RNAs // Hum. Mol. Genet. 2007. V. 16. № 7. P. 763–773. https://doi.org/10.1093/hmg/ddm012
Savadi-Shiraz E., Edalatkhah H., Talebi S. et al. Quantification of sperm specific mRNA transcripts (PRM1, PRM2, and TNP2) in teratozoospermia and normozoospermia: New correlations between mRNA content and morphology of sperm // Mol. Reprod. Dev. 2015. V. 82. № 1. P. 26–35. https://doi.org/10.1002/mrd.22440
Miyagawa Y., Nishimura H., Tsujimura A. et al. Single-nucleotide polymorphisms and mutation analyses of the TNP1 and TNP2 genes of fertile and infertile human male populations // J. Androl. 2005. V. 26. № 6. P. 779–786. https://doi.org/10.2164/jandrol.05069
Evenson D.P., Larson K.L., Jost L.K. Sperm chromatin structure assay: Its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques // J. Androl. 2002. V. 23. № 1. P. 25–43. http://www.ncbi.nlm.nih.gov/pubmed/11780920
Seli E. Spermatozoal nuclear determinants of reproductive outcome: implications for ART // Hum. Reprod. Update. 2005. V. 11. № 4. P. 337–349. https://doi.org/10.1093/humupd/dmi011
Shamsi M.B., Kumar R., Dada R. Evaluation of nuclear DNA damage in human spermatozoa in men opting for assisted reproduction // Indian J. Med. Res. 2008. V. 127. № 2. P. 115–123. http://www.ncbi.nlm.nih.gov/pubmed/18403788
Simon L., Castillo J., Oliva R., Lewis S.E. Relationships between human sperm protamines, DNA damage and assisted reproduction outcomes // Reprod. Biomed. Online. 2011. V. 23. № 6. P. 724–734. https://doi.org/10.1016/j.rbmo.2011.08.010
Hosen M.B., Islam M.R., Begum F. et al. Oxidative stress induced sperm DNA damage, a possible reason for male infertility // Iran J. Reprod. Med. 2015. V. 13. № 9. P. 525–532. http://www.ncbi.nlm.nih.gov/pubmed/26568756
Simon L., Zini A., Dyachenko A. et al. A systematic review and meta-analysis to determine the effect of sperm DNA damage on in vitro fertilization and intracytoplasmic sperm injection outcome // Asian J. Androl. 2017. V. 19. № 1. P. 80–90. https://doi.org/10.4103/1008-682X.182822
Zheng W.W., Song G., Wang Q.L. et al. Sperm DNA damage has a negative effect on early embryonic development following in vitro fertilization // Asian J. Androl. 2018. V. 20. № 1. P. 75–79. https://doi.org/10.4103/aja.aja_19_17
Pellestor F., Gatinois V., Puechberty J. et al. Chromothripsis: Potential origin in gametogenesis and preimplantation cell divisions. A review // Fertil. Steril. 2014. V. 102. № 6. P. 1785–1796. https://doi.org/10.1016/j.fertnstert.2014.09.006
Koltsova A.S., Pendina A.A., Efimova O.A. et al. On the complexity of mechanisms and consequences of chromothripsis: An update // Frontiers in Genetics. 2019. V. 10. № 4. Frontiers Media S.A.P. 393. https://doi.org/10.3389/fgene.2019.00393
Agarwal A., Allamaneni S.R. Sperm DNA damage assessment: A test whose time has come // Fertil. Steril. 2005. V. 84. № 4. P. 850–853. https://doi.org/10.1016/j.fertnstert.2005.03.080
Дополнительные материалы отсутствуют.