Генетика, 2021, T. 57, № 2, стр. 127-139
Разнообразие и фенотипический эффект аллельных вариантов генов короткостебельности Rht у пшениц
И. С. Сухих 1, *, В. Ю. Вавилова 1, А. Г. Блинов 1, Н. П. Гончаров 1
1 Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения
Российской академии наук
630090 Новосибирск, Россия
* E-mail: igor3419@gmail.com
Поступила в редакцию 27.03.2020
После доработки 18.05.2020
Принята к публикации 17.06.2020
Аннотация
Обзор посвящен описанию аллельных вариантов генов Rht и их влияния на признаки, связанные с ростом, развитием и урожайностью растений пшеницы. Рассмотрено влияние генов Rht на рост и развитие растений пшеницы через посредство DELLA-белков. Предлагается новая классификация растений пшениц по высоте (длине стебля), основанная на наличии/отсутствии в их генотипах конкретных аллелей генов Rht, определяемых молекулярно-генетическими методами.
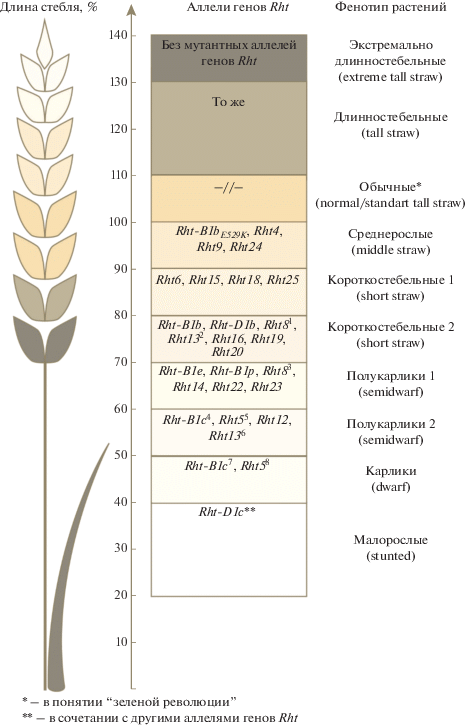
В 1950–1960 гг. в мировом аграрном секторе произошла “зеленая революция”, обусловившая значительное увеличение валового сбора зерна мягкой пшеницы (Triticum aestivum L.) в развивающихся странах (Мексика, Колумбия, Индия, Пакистан и ряд других стран Южной и Юго-Восточной Азии). Для увеличения урожайности селекционерами были успешно использованы растения пшеницы, нечувствительные к длине дня (фотопериоду), устойчивые к полеганию и обладающие высокой продуктивностью, обусловленной отзывчивостью интенсивных сортов пшеницы на высокие дозы минеральных удобрений [1–6]. Считается, что широкое использование в сельскохозяйственном производстве короткостебельных растений мягкой пшеницы являлось ключевым моментом успеха всех программ селекции пшениц в ходе “зеленой революции” и обусловливало повсеместное увеличение урожайности [7], связанное в первую очередь с устойчивостью растений новых сортов к полеганию (tolerance to lodging) при использовании высоких доз минеральных удобрений [8]. В свою очередь, в таком повышении устойчивости пшеницы к полеганию за счет короткостебельности главенствующую роль сыграли гены Rht (от англ. reduced height), контролирующие выраженность признака “высота растения” [9]. Мутантные аллели этих генов обусловливают существенное уменьшение высоты растения за счет укорочения длины их стебля. Это позволяет растению удерживать более тяжелый колос и не полегать, несмотря на то что механическая устойчивость стебля короткостебельных сортов пшеницы не выше, чем у обычных (~100–120 см) и даже высокорослых (~120–140 см) сортов [10]. При полегании растений резко снижается эффективность механизированной уборки; более того, качество зерна падает из-за повышенной влажности, так как колос полегших растений оказывается покрыт другими растениями или лежит на влажной почве. При интенсивных технологиях возделывания существенное увеличение урожайности дают растения только с полукарликовыми короткостебельным фенотипами [11]. Такие растения характеризуются уменьшением длины стебля соответственно на 24–30 и 40–50% от нормы (стандарта), в то время как значительно менее урожайные карликовые – на 50–60% (рис. 1). Для описания фенотипов растений пшениц по признаку “высота растения (длина стебля)” мы сочли целесообразным подвести под “гибридную” классификацию, основанную на работах S. Boroevic [12] и М.М. Якубцинера с соавт. [13] и сложившуюся к настоящему времени в русскоязычной традиции перевода английских терминов, касающихся фенотипов [14], молекулярно-генетическую основу (см. рис. 1). При этом предпочтение отдано первому автору (S. Boroevic [12]). Мы приняли перевод “stunted” как “малорослые”, “dwarf” – как “карлики”, “semidwarf” – как “полукарлики”, “short straw” – короткостебельные, “middle straw” – как среднерослые, “tall straw” – как длинностебельные (высокорослые). В англоязычной литературе отсутствует термин “extreme tall straw”, так как такие сорта встречаются только в стародавнем сортименте России и Польши [13] и не представлены в западных публикациях. Несмотря на несовершенство и противоречивость классификаций сортообразцов пшеницы S. Boroevic [12] и М.М. Якубцинера с сотр. [13] по высоте растений, к настоящему времени ничего лучше не предложено. В классификацию нами внесено еще одно новшество: нами дополнительно разделены полукарлики и короткостебельные растения на два класса – соответственно полукарлики 1 и полукарлики 2, а также короткостебельные 1 и короткостебельные 2, в соответствии с наличием у них генов Rht или их аллелей. Мы учли ранее высказанную критику этих классификаций [9, 15]. Неоднократно отмечалась зависимость выраженности признака “высота растений” от условий внешней среды [9, 15, 16] и, как следствие, условность деления сортообразцов пшеницы на классы [9, 15]. В случае использования не маркерных сортов (стандартов), а информации о конкретных аллелях мутантных генов Rht (см. рис. 1), т.е. стабильных при любых внешних условиях ДНК-маркеров, такая классификация становится на надежную основу и перестает быть подверженной модифицирующему действию окружающей среды.
Рис. 1.
Схема влияния мутантных аллелей Rht-генов на выраженность признака “длина стебля” пшениц по сравнению с обычной длиной (усредненные данные). Нормальная длина (standard) принята за 100%. Цифрами над генами обозначены источники литературы, в которых для представленных на рисунке мутантных аллелей генов Rht указана различная длина стебля. 1, 2, 5, 6, 8 – [78, 94, 96]; 3 – [97]; 4 – [52]; 7 – [77].
ПРОИСХОЖДЕНИЕ МУТАНТНЫХ АЛЛЕЛЕЙ ГЕНОВ Rht
Неудивительно, что после первых успешных экспериментов по возделыванию короткостебельных сортов пшениц исследователи со всего мира занялись поиском генов, приводящих к уменьшению высоты растений за счет уменьшения длины их стебля, и изучением механизмов действия таких генов. Всего на сегодняшний день описано 19 генов Rht, в том числе семь мутантных аллелей гена Rht-1, а также ряд аллелей гена Rht8 (табл. 1), всестороннее изучение которых позволило в значительной степени расширить генофонд короткостебельных пшениц для использования в селекционных программах как мягкой [17], так и твердой пшениц [15]. Первыми из генов, влияющих на выраженность признака “длина стебля” у пшеницы, были описаны гены Rht-1 (табл. 1), изначально обозначенные как Sd1 и Sd2 [18]. Символика Sd1 и Sd2 была признана неудачной и R.A. McIntosh заменил ее на более удачную с его точки зрения, Rht [19]. Показано, что мутантные аллели данных генов, обусловливающие разную выраженность признаков “карликовость” и “короткостебельность” у пшеницы, широко использовались [17] и до сих пор используются в селекционных программах по всему миру. Мутантные аллели генов-гомологов Rht-1 выявлены только в геномах B и D полиплоидных пшениц. Эти аллели, приводящие к укорочению длины стебля, были идентифицированы более чем у 70% “карликовых” (в отечественной литературе “короткостебельных”) сортов пшеницы в мире [20]. При этом аллельные варианты Rht-B1b и Rht-D1b были выявлены у изученных сортов в 90% случаев [21]. Оба мутантных аллеля происходят от полукарликового японского сорта мягкой пшеницы Norin 10. В Международном центре по улучшению пшеницы и кукурузы (СИММИТ, Мексика) при селекции на короткостебельность был использован его низкорослый гибрид с высокорослым сортом Brevor (линия Norin 10-Brevor 14, =синоним Sel. 14 (CI 13253)) [22].
Таблица 1.
Список генов Rht и их доноров
| Ген/аллель | Тип наследования | Локализация в хромосоме | Донор | Источник литературы |
|---|---|---|---|---|
| rht-В1/Rht-B1b (Rht1) | Рецессивный | 4BS | Norin 10 | [40, 54, 92] |
| Rht-В1/Rht-B1c (Rht3) | Полудоминантный | 4BS | Tom Thumb | [54, 76] |
| rht-В1/Rht-B1e (Rht11) | Рецессивный | 4BS | Karlik 1 | [54, 79] |
| rht-В1/Rht-B1p (Rht17) | » | 4BS | Chris M1 | [33, 54] |
| rht-В1/Rht-B1bE529K | » | 4BS | Kronos | [27] |
| rht-D1/Rht-D1b (Rht2) | » | 4DS | Norin 10 | [54, 92] |
| Rht-D1/Rht-D1c (Rht10) | Доминантный | 4DS | Ai-Bian | [54, 93] |
| Rht4 | » | 2BL | Burt M937 | [54, 94] |
| Rht5 | » | 3BS | Marfed M1 | [54, 94] |
| Rht6 | » | Нет данных | Magnif 41 | [54, 78] |
| Rht7 | » | 2AS | BerséeMult | [54, 79] |
| Rht8/Rht8a (WMS261-165)* | ? | 2DS | Mara, Sava | [54, 94] |
| Rht8/Rht8b (WMS261-174) | ? | 2DS | Odom | [88] |
| Rht8/Rht8c (WMS261-192) | Доминантный | 2DS | Краснодарский карлик | [87] |
| Rht9* | » | 7BL | Mara | [54, 95] |
| Rht12 | » | 5AL | Karcagi 522M7K | [54, 94] |
| Rht13 | » | 7BS | Magnifi 41M1 | [54, 64, 96] |
| Rht14 | » | Нет данных | Castelporziano | [54, 78] |
| Rht15 | » | » | Durox | [54, 77] |
| Rht16 | » | » | Edmore M1 | [54, 78] |
| Rht18 | » | 6A | Icaro | [54, 90] |
| Rht19 | » | Нет данных | Vic M1 | [54, 78] |
| Rht20 | » | » | Burt M860 | [54, 78] |
| Rht22 | » | 7AS | Aiganfanmai | [89] |
| Rht23 | » | 5DL | Sumai 3 | [91] |
| Rht24 | » | 6AL | Aikang 58 × Jingdong 8 | [26] |
| Rht25 | » | 6AS | UC1110 × PI610750 | [28] |
* Ранее обозначенные Э.Б. Алиевым [47] теми же символами гены Rht8 и Rht 9 и локализованные автором в хромосомах 2В и 2D сортов Sharbati Sonora и Скороспелка 35 не идентифицированы. Возможно, снижение высоты у этих сортов – результат плейотропного эффекта доминантных генов Ppd2 и Ppd1, контролирующих в них нечувствительность к длине дня [9]. Также до сих пор не идентифицированы гены у мутантов сорта Мироновская 808, полученных Л.А. Писаревой [48], названных Карлик, Полукарлик и Л-39.
Интерпретация молекулярными биологами понятий “доминантности”/“рецессивности” генов Rht
“Доминантность” и “рецессивность” – очень важные характеристики генов. Они важны как при изучении характера наследования признаков, так и в селекционных работах для планирования схем скрещивания и выбора стратегии отбора. В мировой литературе и в “Каталоге символов генов пшеницы” [19] сложилась необъяснимая традиция обозначать рецессивные гены rht1 и rht2 символами доминантных генов Rht1 и Rht2. В последних изданиях “Каталога…”, выпускаемых при активном участии молекулярных биологов, данные гены приводятся как аллели генов-ортологов (гомологов) Rht-1 [23]. Доминантные аллели получили, наконец, адекватные символы Rht-В1а и Rht-D1а, но при этом аллели Rht-В1b и Rht-D1b, несмотря на то что они обозначены как доминантные (с заглавной буквы), описаны авторами “Каталога…” как рецессивные. Однако и в этом случае мутантный полудоминантный ген Rht3 получил символ Rht-В1c, т.е. рецессивного аллеля. Информация о типе наследования признака “короткостебельность” (доминантности/рецессивности генов) дана в табл. 1. В “Каталоге…” также сложилась неопределенная ситуация и с доминантностью–рецессивностью аллелей гена Rht8. Если в молекулярной биологии понятие “аллели” – это варианты неких последовательностей генов, то для генетики и селекции необходима конкретная информация об аллельных вариантах генов и, что не менее важно, о межаллельном взаимодействии. Информация о доминантности/рецессивности других генов, например Ppd [24] или ген Q [25], в “Каталоге…” также представлена неудовлетворительно.
Источники мутантных генов Rht
Естественные (природные) мутации, обусловливающие укорочение длины стебля у пшеницы, за исключением аллелей Rht-B1b, Rht-D1b, Rht4 и Rht8, описаны крайне редко. Например, доминантный ген Rht24 был обнаружен среди рекомбинантов в инбредных линиях, полученных от скрещивания линий Jingdong 8 и Aikang 58 [26]. В популяции рекомбинантных инбредных линий, полученных от скрещивания двух короткостебельных форм UC1110 (генотип Rht-D1b) и PI 610750 (генотип Rht-B1b), недавно был выявлен доминантный ген Rht25 [27]. Мутантный аллель Rht25b, вызывающий короткостебельность (semidwarf), по-видимому, происходит от родителя-синтетика, у которого либо сорт твердой пшеницы (Triticum durum Desf.) Croc 1, либо образец дикого вида Aegilops tauschii Coss. (syn. Ae. squarrosa L.) был источником нового аллеля гена, детерминирующего короткостебельный фенотип [28]. Стоит отметить, что образцы донора генома D полиплоидных пшениц Aegilops tauschii могут оказаться перспективными источниками новых генов Rht [29].
В 1970-е гг. посредством использования методов мутагенеза удалось получить значительное число новых эффективных аллелей генов Rht. А именно гены Rht12, Rht14 и Rht18 были выделены из потомств гибридов Ningchun 45, Karcagi 12 и селекционных линий Castelporziano (PI347731) и Icaro (PI503555), происходящих из радиационных мутантов сортов Karcagi, Capelli и Anhinga, полученных в результате обработки их зерен гамма-лучами, медленными или быстрыми нейтронами соответственно [30–32]. Химический мутагенез, а именно использование этилметансульфоната (EMS) и метилнитромочевины (MNM), был применен для обработки зерен сортов Marfed, Chris и Edmor. В результате были выделены мутантные короткостебельные формы Marfed М, Mutant Chris (MN6616M) и Edmore M1 (PI499362), у которых были обнаружены новые гены и аллели генов Rht, а именно Rht5, Rht16, Rht-B1e и Rht-B1p, обусловливающие уменьшение длины стебля [30, 33, 34]. В еще одном эксперименте мутантные растения пшеницы с различной степенью выраженности признака “длина стебля” (всего 366 мутантов) были получены как химическим (в результате обработки EMS), так и радиационным (гамма-облучение) мутагенезом при обработке зерен китайского сорта мягкой пшеницы Jing 411. В поколении М6 этого мутанта были выделены перспективные низкорослые (короткостебельные) линии [35], но их генетический анализ для идентификации мутантных генов и их аллелей авторы не проводили.
В настоящее время различные мутантные гены Rht активно изучаются с целью увеличения урожайности сортов мягкой пшеницы [36–46]. Ряд таких генов до сих пор не идентифицирован [47, 48].
ВАРИАНТЫ ГЕНОВ Rht
Все гены Rht можно условно разделить на две группы: чувствительные к гиббереллиновой кислоте (ГК3) и нечувствительные к ней. ГК3 является гормоном растений, влияющим на многочисленные процессы их вегетативного и генеративного развития, в том числе на прорастание зерновок и удлинение стебля [49].
Гены Rht, нечувствительные к гиббереллину
Все мутантные аллели гена Rht-1 являются нечувствительными к экзогенному гиббереллину, тогда как почти все остальные мутантные аллели других генов Rht, описанные к данному моменту времени, являются чувствительными к нему (рис. 1, 2). Кроме того, разные аллели гена Rht-1 приводят к неодинаковому уменьшению длины стебля. Так, наиболее широко используемые в селекции аллели гена Rht-1 (Rht-B1b и Rht-D1b) обусловливают короткостебельный фенотип по нашей классификации (рис. 1). Тогда как аллель Rht-B1с обусловливает более выраженное снижение длины стебля растения, давая карликовый фенотип (рис. 1).
Рис. 2.
Распределение генов Rht на чувствительные, нечувствительные к гиббереллину, а также с неопределенным характером реакции (?).

Объединение в одном растении аллелей Rht-B1b и Rht-D1b является нежелательным, поскольку приводит к образованию излишне выраженного низкорослого фенотипа и вследствие этого обусловливает низкую зерновую продуктивность таких растений [3]. Наличие же у растений пшеницы только одного из двух аллелей Rht-B1b или Rht-D1b в значительной степени увеличивало их продуктивность [50]. По этой же причине аллели, приводящие к карликовому фенотипу, такие как Rht-B1c и Rht-D1c, не используются в селекции культуры [51, 52]. Более того, в условиях засухи для низкорослых (короткостебельных) растений пшеницы с аллельными вариантами Rht-B1b или Rht-D1b было установлено достоверное снижение как числа зерен в колосе, так и массы 1000 зерен и, следовательно, общее снижение урожая по сравнению с высокорослыми сортами с аллелями Rht-B1a и Rht-D1a [53]. В ряде исследований было показано, что аллели Rht-B1b или Rht-D1b вызывают не только укорочение длины стебля, но и уменьшение длины колеоптиля и корней, что в конечном счете приводит к снижению эффективности использования воды из почвы и устойчивости к засухе [53–57].
Молекулярные механизмы гиббереллин-зависимого роста растения пшеницы
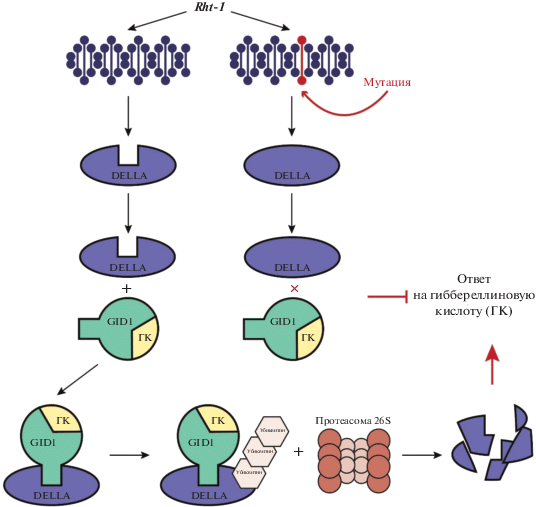
Влияние мутантных генов Rht-1 на высоту растения (длину стебля) пшеницы опосредуется тем, что они кодируют DELLA-белки, которые являются основными регуляторами сигнального пути ГК3 и супрессорами роста растений. Данные белки входят в состав семейства транскрипционных регуляторов GRAS и содержат в своей последовательности два отдельных домена: N-концевой регуляторный домен, который служит для распознавания и связывания ГК3, и C-концевой функциональный домен GRAS [58].
Различные участки домена GRAS DELLA-белков могут связываться с ДНК-связывающими доменами некоторых транскрипционных факторов, блокируя их функцию. Более того, DELLA-белки влияют на рост и развитие растений путем связывания с другими белками, не являющимися транскрипционными факторами, контролируя и изменяя их функции в клетке. Однако DELLA-белки не всегда действуют в качестве супрессоров роста: было показано, что они оказывают позитивное действие на высоту растения при неблагоприятных условиях, например таких как холод [59], засоленность почвы [60, 61] и деэтиолирование [62–64]. Таким образом, DELLA-белки способствуют адаптации растений к неблагоприятным условиям окружающей среды, осуществляя баланс между ростом и ответом на стресс в неблагоприятных условиях.
Наличие большого количества DELLA-белков в клетках растения уменьшает длину стебля за счет замедления роста растений путем связывания с транскрипционными факторами и другими компонентами сигнального пути ГК3 [58, 65–67]. Процесс деградации DELLA-белков с помощью ГК3, в результате которого уменьшается их влияние на увеличение длины стебля, подробно описан для резуховидки Таля (Arabidops isthaliana (L.) Heynh.) [68, 69]. Однако было высказано предположение, что аналогичный механизм присутствует и у других видов цветковых растений [69]. У Arabidopsis thaliana ГК3 узнается и связывается рецепторным белком GID1, в результате чего его N‑концевой район изменяет конфигурацию и закрепляет ГК3 в молекуле белка GID1 [70]. Таким образом, образуется комплекс GA–GID1, который впоследствии связывается с DELLA-белком с помощью мотива TVHYNP, образуя комплекс GA–GID1–DELLA [70]. В свою очередь GA–GID1–DELLA увеличивает способность DELLA распознаваться белками F-box (SLY1 в случае с Arabidopsis), которые отвечают за образование SCF (SKP1, CULLIN, F-box) E3 убиквитин-лигазного комплекса, его убиквитинацию и далее деградацию DELLA в протеасоме 26S [71] (рис. 3). Таким образом, ГК3 способствует уменьшению количества DELLA-белков в клетке и соответственно уменьшению их негативного влияния на рост растения [68, 72].
Было показано, что мутантные аллели гена Rht-1 снижают чувствительность растения к ГК3, так как эти мутации уменьшают способность DELLA-белков связываться с комплексом GA–GID1 [28, 51, 73]. Таким образом, обработка растения экзогенной ГК3 не вызывает у них увеличения длины стебля [22]. Наличие у растений данных аллелей гена Rht-1 можно выявить по отсутствию их ответа на обработку экзогенной ГК3 [53]. Однако данный способ не позволяет выявить различия между аллельными вариантами Rht-B1b и Rht-D1b, так как они оба дают схожий фенотип при обработке экзогенной ГК3. В этом случае для определения конкретного аллельного варианта гена Rht-1 используются методы молекулярной биологии [74].
Аллели Rht-B1b и Rht-D1b. Мутации Rht-B1b и Rht-D1b приводят к образованию преждевременных стоп-кодонов [51, 73] (рис. 4). Оба данных мутантных варианта аллелей обусловливают сопоставимый эффект уменьшения длины стебля: примерно на 24% по сравнению с его нормальной длиной (табл. 1, рис. 1), что хорошо объясняется схожим механизмом действия мутации. Так как аллели Rht-B1b и Rht-D1b образуют активные продукты, то в обоих случаях мутантный фенотип может образовываться двумя путями. Первый вариант: мутантный фенотип опосредован коротким N-концевым пептидом, который образуется в результате альтернативного стоп-кодона. DELLA-домен данного укороченного N-концевого пептида гипотетически может связываться с GID1 и таким образом подавлять сигнал ГК3 [73]. При втором варианте возможна реинициация трансляции после стоп-кодона, что приводит к образованию укороченного с N-конца продукта (C-концевой пептид). Данный продукт не может связываться с рецептором GID1, таким образом препятствуя деградации DELLA-белков и подавляя ГК-зависимый рост и развитие. Реинициация трансляции возможна в случае, если рибосома продолжит сканирование цепи после стоп-кодона и обнаружит метионин [51]. У аллелей Rht-B1b и Rht-D1b после мутантных стоп-кодонов следуют несколько метионинов, что согласуется с гипотезой реинициации трансляции. Второй вариант подтверждается фактом, что аналогичный аллель гена короткостебельности кукурузы D8-Mpl также кодирует продукт, укороченный с N-конца [73]. В целом вторая гипотеза имеет большее число подтверждений, чем первая [51, 73, 75]. Таким образом, вероятнее всего аллели Rht-B1b и Rht-D1b гена Rht-1 пшеницы, как и аллель гена D8-Mpl кукурузы, кодируют белок, у которого отсутствует С-концевая последовательность.
Рис. 4.
Выравнивание аминокислотных последовательностей различных аллельных вариантов генов Rht-B1 и Rht-D1. “-” – вставка размером в 30 аминокислот в аллельном варианте Rht-B1c. “X” – преждевременный стоп-кодон. Числами над выравниванием показаны позиции аминокислот согласно последовательности аллельного варианта Rht-Ala JF930277.

Аллель Rht-B1c. У аллеля Rht-B1c, обусловливающего сильное уменьшение длины стебля (рис. 1), обнаружено нарушение на N-концевом кодирующем участке [51]. Предполагается, что белковый продукт данного мутантного аллеля, не связывается с ГК3. Мутацией является участок размером 2026 пн, встроившийся в GA–GID1 связывающий домен, а не замена нуклеотида, приводящая к образованию нового стоп-кодона. Большая часть данной инсерции удаляется в результате сплайсинга, что приводит к образованию дополнительной 30-аминокислотной последовательности (рис. 4) [51, 76]. Растения с аллелем Rht-B1b или Rht-D1b имеют более длинный стебель, чем растения с аллелем Rht-B1c, так как имеющаяся у него инсерция в DELLA-домен нарушает его связь с GA–GID1 комплексом [52], что является основой сигнального пути ГК3. Наличие аллеля Rht-B1c вызывает уменьшение длины стебля, сопоставимое с таковым у мутантного растения, имеющего два мутантных аллеля Rht-B1b и Rht-D1b одновременно (~60%), а растения с двумя аллелями одновременно Rht-B1c и Rht-D1b формируют самый короткий стебель – более 70% уменьшения его длины по сравнению с нормальным фенотипом.
Аллели Rht-B1e и Rht-B1p. Изначально в работе C.F. Konzak [77] были описаны два гена Rht11 и Rht17. В работах M.H. Ellis с соавт. [74, 78] данные гены были определены как ГК-нечувствительные, что показало их сходство с геном Rht-1. Однако в работах М. Баженова и М.Г. Дивашука была установлена идентичность аллелей Rht-B1e, Rht-B1p гена Rht-1 и генов Rht11, Rht17 соответственно [33, 79]. Таким образом, было показано, что Rht11 и Rht17 являются не самостоятельными генами, а аллелями гена Rht-1. Мутации Rht-B1p и Rht-B1e гена Rht-1 вызваны заменами в нуклеотидных позициях, находящимися по соседству с нуклеотидной позицией мутации Rht-B1b (рис. 4). Эти мутации приводят к образованию стоп-кодонов. Данный факт позволяет предположить, что изменение длины стебля при наличии мутаций Rht-B1p и Rht-B1e происходит схожим образом с мутацией Rht-B1b. В то же время растения как с аллелем Rht-B1e, так и с аллелем Rht-B1p имеют несколько меньшую длину стебля, чем растения с аллелем Rht-B1b (табл. 1) [51, 79]. Такое отличие в экспрессии аллелей может быть объяснено разным уровнем эффективности реинициации трансляции, в результате чего образуются разные концентрации белков, снижающих длину стебля [33, 79].
Стоит отметить, что Rht11 и Rht17 – не единственные случаи неверного определения новых генов. Ранее описанный ген Rht21, согласно A. Börner и A.J. Worland [80], также является аллелем гена Rht-1.
Чувствительные к гиббереллину гены Rht
В настоящее время у пшеницы, кроме гена Rht-1, описаны еще 18 генов Rht (табл. 1). Наиболее хорошо изученными из них являются гены Rht4 и Rht8, которые уменьшают высоту растений в среднем на 12 и 16 см соответственно (рис. 1). При этом длина колеоптилей и число зерен в колосе у них остаются неизменными [56, 81, 82]. Кроме того, для растений с мутантными аллелями гена Rht8 характерно наличие более крупных зерен и достоверное увеличение массы 1000 зерен [83, 84]. Растения пшеницы с геном Rht4 дают более высокий урожай зерна только в сочетании с аллелем Rht-B1b. При этом преимущества данного аллеля отмечены в различных условиях – как при достаточном, так и при недостаточном уровне увлажнения [85]. Среди российских и украинских короткостебельных сортов наибольшее распространение получили аллели гена Rht8. На настоящий момент описано 14 аллелей гена Rht8 [86]. Данный ген тесно связан с локусом WMS261, что позволяет проводить его молекулярный анализ и различать аллели Rht8 по длине последовательностей. Наиболее часто встречаются аллели длиной 165, 174 и 192 пн, обозначаемые Rht8a (WMS261-165), Rht8b (WMS261-174) и Rht8с (WMS261-192) соответственно (табл. 1) [81, 86, 87]. Однако среди этих трех аллелей только аллель Rht8с уменьшает длину стебля (в среднем на 14%). Тогда как аллель Rht8b не вызывает изменения длины стебля, а аллель Rht8a, наоборот, увеличивает его длину на 5% [86, 87]. Аллели гена Rht8 часто используются вместе с аллелями гена Rht-1, так как ген Rht8 сам по себе не вызывает уменьшения длины стебля, достаточного для формирования устойчивости растений пшеницы к полеганию [81, 88].
Стоит отметить, что некоторые Rht-гены негативно влияют на урожайность [84]. Однако их негативное влияние можно нейтрализовать, используя аллели других генов, отвечающих за признаки, на которые отрицательно действовали Rht-гены. Например, ген Rht12 приводит к более позднему формированию колоса и цветению растений пшеницы, в то время как колос растений пшеницы с аллелем Ppd-D1a, снижающим чувствительность к длине дня, начинает закладываться быстрее. Таким образом, растения пшеницы с геном Rht12 будут развиваться без негативных эффектов, если в их геноме будет присутствовать доминантный аллель Ppd-D1a [30].
Доминантный ген Rht13 вызывает значительное уменьшение длины стебля растений (до 30 см), но при этом длина колеоптиля существенно не меняется. В условиях недостатка влаги у таких растений существенно (до 18%) снижается число зерен в колосе, хотя масса 1000 зерен остается неизменной [83]. Несмотря на то что для большинства чувствительных к гиббереллину генов Rht известна хромосомная локализация (табл. 1), в настоящий момент времени молекулярные механизмы действия данных генов все еще изучены слабо [26, 28, 32, 39, 54, 74, 78, 89–91]. Их дальнейшее изучение может помочь в создании новых эффективных доноров короткостебельности (табл. 1).
ПРЕДПОЧТИТЕЛЬНЫЕ ВАРИАНТЫ ГЕНОВ Rht ДЛЯ ПОВЫШЕНИЯ УРОЖАЙНОСТИ
Многочисленные экспериментальные данные показывают, что значительное увеличение урожайности с использованием минеральных удобрений достигается при высоте растения пшеницы от 70 до 100 см [55], в то время как длина стебля растений без нарушений в генах Rht составляет около 100–140 см [11]. Показано, что для гарантированного увеличения урожайности сортов мягкой пшеницы целесообразно использовать растения со следующими аллелями: Rht-B1b, Rht-D1b, Rht-B1e, Rht-B1p и Rht8, а для твердой – Rht-B1b, Rht-B1e и Rht-B1p [51, 73]. В то же время наличие в растениях пшеницы комбинации этих аллелей, а также аллелей Rht-B1c и Rht-D1c, приводит к существенному уменьшению длины стебля и значительному снижению урожайности. Гены Rht13, Rht16, Rht19, Rht20, Rht22 и Rht23 являются потенциальными кандидатами для эффективного использования в селекции сортов нового поколения с целью повышения урожайности пшениц, так как они приводят к примерно такому же уменьшению длины стебля, что и аллели Rht-B1b, Rht-D1b, Rht-B1e, Rht-B1p и Rht8 (рис. 1). Станут ли данные гены Rht основой для новой “зеленой революции” – вопрос открытый [44]. Однако использовать эти гены стоит с осторожностью, так как некоторые из них могут приводить к нежелательным эффектам (таким как более позднее цветение растений пшеницы и более медленный рост и развитие их стебля), приводящим в конечном итоге к снижению урожайности [30, 84]. Кроме того, использование растений пшеницы с мутантными аллелями всех генов Rht ограничено условиями внешней среды [53] и используемых систем возделывания. Например, засуха в значительной степени влияет на развитие растений пшеницы и может негативно влиять на действие генов Rht на длину стебля и в конечном итоге на урожай [57].
Работа поддержана Российским научным фондом (проект № 16-16-10021).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Allan R.E. Agronomic comparisons between Rht1 and Rht2 semidwarf genes in winter wheat // Crop Sci. 1989. V. 29. № 5. P. 1103–1108. https://doi.org/10.2135/cropsci1989.0011183X0029000-50001x
Brooking I.R., Jamieson P.D., Porter J.R. The influence of daylength on final leaf number in spring wheat // F. Crop. Res. 1995. V. 41. P. 155–165. https://doi.org/10.1016/0378-4290(95)00014-H
Gent M.P.N., Kiyomoto R.K. Physiological and agronomic consequences of Rht genes in wheat // J. Crop Prod. 1997. V. 1. № 1. P. 27–46. https://doi.org/10.1300/J144v01n01_02
Hedden P. The genes of the green revolution // TRENDS Genet. 2003. V. 19. № 1. P. 5–9. https://doi.org/10.1016/s0168-9525(02)00009-4
Jamieson P.D., Brooking I.R., Porter J.R. How temperature and daylength determine flowering time in spring wheat – a discussion // Proc. Agronomy Society. 1995. V. 25. P. 23–27.
Kamran A., Iqbal M., Spaner D. Flowering time in wheat (Triticum aestivum L.): A key factor for global adaptability // Euphytica. 2014. V. 197. № 1. P. 1–26. https://doi.org/10.1007/s10681-014-1075-7
Borlaug N.E. Wheat breeding and its impact on world food supply // Third Int. Wheat Genet. Symp. Kanberra, 1968. P. 1–36.
Verma A., Worland A.J., Sayers E.W. et al. Identification and characterization of quantitative trait loci related to lodging resistance and associated traits in bread wheat // Plant Breed. 2005. V. 124. P. 234–241. https://doi.org/10.1111/j.1439-0523.2005.01070.x
Мережко А.Ф., Писарева Л.А., Прилюк Л.В. Генетический контроль высоты растения у пшеницы // Генетика. 1986. Т. 22. № 5. С. 725–732.
Paollilo D.J., Niklas K.J. Effects of Rht-dosage on the breaking strength of wheat seedling leaves // Am. J. Botany. 1996. V. 83. № 5. P. 567–572. https://doi.org/10.1002/j.1537-2197.1996.tb12740.x
Flintham J.E., Borner A., Worland A.J., Gale M.D. Optimizing wheat grain yield: Effects of Rht (gibberellininsensitive) dwarfing genes // J. Agric. Sci. 1997. V. 128. № 1. P. 11–25. https://doi.org/10.1017/S0021859696003942
Boroević S. Characteristics of some new dwarf and semidwarf wheat lines // Euphytica. 1968. V. 17. № 1. P. 143.
Якубцинер М.М., Филатенко А.А., Корнейчук В.А. Классификатор рода Triticum L. Л., 1973. 25 с.
Лоскутова Н.П. Гены короткостебельности пшеницы // Аграрная Россия. 2002. Т. 1. С. 25–30. https://doi.org/10.30906/1999-5636-2002-1-25-30
Альдеров А.А. Генетика короткостебельности тетраплоидных пшениц. СПб.: ВИР, 2001. 165 с.
Звейнек И.А. Выбор тестеров для генетической оценки сортов яровой мягкой пшеницы по высоте растений // Бюл. ВНИИР им. Н.И. Вавилова. 1984. С. 9–10.
Gill K.S. Research On Dwarf Wheats. New Delhi: Indi. Council Agricultural Res. (ICAR), 1979. 184 p.
Allan R.E. Differentiating between two Norin 10/Brevor 14 semidwarf genes in a common genetic background // Seiken Ziho. 1970. № 22. P. 83–90.
McIntosh R.A. Catalogue of gene symbols for wheat // Proc. 4th Intern. Wheat Genet. Symp. Missouri, 1973. P. 893–937.
Thomas S.G. Novel Rht-1 dwarfing genes: Tools for wheat breeding and dissecting the function of DELLA proteins // J. Exp. Bot. 2017. V. 68. № 3. P. 354–358. https://doi.org/10.1093/jxb/erw509
Sourdille P., Cadalen T., Charmet G. et al. Molecular markers linked to genes affecting plant height in wheat using a doubled-haploid population // Theor. Appl. Genet. 1998. V. 96. P. 933–940. https://doi.org/10.1007/s001220050823
Gale M.D., Marshall G.A. The chromosomal location of gaI1 and rht1, genes for gibberellin insensitivity and semidwarfism, in a derivative of Norin 10 wheat // Heredity. 1976. V. 37. № 2. P. 283–289. https://doi.org/10.1038/hdy.1976.88
McIntosh R.A., Yamazaki Y., Dubcovsky J. et al. Catalogue of gene symbols for wheat [Электронный ресурс]. URL: http://www.shigen.nig.ac.jp/wheat/komugi/genes/ symbolClassList.jsp
Киселёва А.А., Салина Е.А. Генетические механизмы формирования времени колошения мягкой пшеницы // Генетика. 2018. V. 54. № 4. P. 381–396. https://doi.org/10.7868/S001667581804001X
Sormacheva I., Golovnina K., Vavilova V. et al. Q gene variability in wheat species with different spike morphology // Genet. Resour. Crop Evol. 2015. V. 62. № 6. P. 837–852. https://doi.org/10.1007/s10722-014-0195-1
Tian X., Wen W., Xie L. et al. Molecular mapping of reduced plant height gene Rht24 in bread wheat // Front. Plant Sci. 2017. V. 8. P. 1–9. https://doi.org/10.3389/fpls.2017.01379
Mo Y., Vanzetti L.S., Hale I. et al. Identification and characterization of Rht25, a locus on chromosome arm 6AS affecting wheat plant height, heading time, and spike development // Theor. Appl. Genet. 2018. V. 131. № 10. P. 2021–2035. https://doi.org/10.1007/s00122-018-3130-6
Mo Y., Pearce S., Dubcovsky J. Phenotypic and transcriptomic characterization of a wheat tall mutant carrying an induced mutation in the C-terminal PFYRE motif of RHT-B1b // BMC Plant Biol. 2018. V. 18. № 253. https://doi.org/10.1186/s12870-018-1465-4
Krupin P.Yu., Chernook A.G., Bazhenov M.S. et al. Allele mining of TaGRF-2D gene 5'-UTR in Triticum aestivum and Aegilops tauschii // PLoSOne. 2020. V. 15. № 4: e0231704. https://doi.org/10.1371/journal.pone.0231704
Chen L., Du Y., Lu Q. et al. The photoperiod-insensitive allele Ppd-D1a promotes earlier flowering in Rht12 dwarf plants of bread wheat // Front. Plant Sci. 2018. V. 9. № 1312. P. 1–13. https://dx.doi.org/10.3389%2Ffpls.2018.01312
Grant N.P., Mohan A., Sandhu D. Inheritance and genetic mapping of the reduced height (Rht18) gene in wheat // Plants. 2018. V. 7. № 58. P. 1–9. https://dx.doi.org/10.3390%2Fplants7030058
Vikhe P., Venkatesan S., Chavan A. et al. Mapping of dwarfing gene Rht14 in durum wheat and its effect on seedling vigor, internode length and plant height // Crop J. 2018. V. 7. № 2. P. 87–197. https://doi.org/10.1016/j.cj.2018.11.004
Bazhenov M., Divashuk M.G., Amagai Y. et al. Isolation of the dwarfing Rht-B1p (Rht17) gene from wheat and the development of an allele-specific PCR marker // Mol. Breed. 2015. V. 35. № 213. https://doi.org/10.1007/s11032-015-0407-1
Daoura B.G., Chen L., Hu Y. Agronomic traits affected by dwarfing gene Rht-5 in common wheat (Triticum aestivum L.) // Aust. J. Crop Sci. 2013.V. 7. № 9. P. 1270–1276.
Xiong H., Guo H., Xie Y. et al. Enhancement of dwarf wheat germplasm with high-yield potential derived from induced mutagenesis // Plant Genet. Resour. Charact. Util. 2019. V. 16. № 1. P. 74–81. https://doi.org/10.1017/S1479262116000459
Cho E.J., Kang C., Jung J. et al. Allelic variation of Rht-1, Vrn-1 and Ppd-1 in Korean wheats and its effect on agronomic traits // Plant Breed. Biotech. 2015. V. 3. № 2. P. 129–138. https://doi.org/10.14829/jcsproc.240.0_76
Duan J., Wu J., Liu Y. et al. New cis-regulatory elements in the Rht-D1b locus region of wheat // Funct. Integr. Genomics. 2012. V. 12. P. 489–500. https://doi.org/10.1007/s10142-012-0283-2
Ford B.A., Foo E., Sharwood R. et al. Rht18 semidwarfism in wheat is due to increased GA 2-oxidaseA9 expression and reduced GA content // Plant Physiol. 2018. V. 177. P. 168–180. https://doi.org/10.1104/pp.18.00023
French B., Zaicou-kunesch C., Rebetzke G. et al. Alternative dwarfing genes improve wheat emergence from deep sowing // GRDC Research Updates. 2012. P. 40–43.
Jobson E.M., Johnston R.E., Oiestad A.J. et al. The impact of the wheat Rht-B1b semi-dwarfing allele on photosynthesis and seed development under field conditions // Front. PlantSci. 2019.V. 10. № 51. https://doi.org/10.3389/fpls.2019.00051
Кичигина А.К., Чеботарь Г.А., Чеботарь С.В. Биоинформатический анализ нуклеотидных последовательностей аллелей генов короткостебельности пшеницы Rht-B1 и Rht-D1. Одесский национальный ун-т им. И.И. Мечникова, 2016. Т. 21. № 2. С. 79–87. https://doi.org/10.18524/2077-1746.2016.2(39).82752
Li A., Yang W., Lou X. et al. Novel natural allelic variations at the Rht-1 loci in wheat // J. Integr. Plant Biol. 2013. V. 55. № 11. P. 1026–1037. https://doi.org/10.1111/jipb.12103
Motsnyi I.I., Chebotar G.O., Chebotar S. Effects of the Ppd-D1a/Ppd-D1b alleles on agronomical traits of winter wheat in south Ukraine steppe region // EWAC Proc. 17th Intern. EWAC Conf. Bucharest, Romania, 2019.
Würschum T., Langer S.M., Longin C.F.H. et al. A modern green revolution gene for reduced height in wheat // Plant J. 2017. V. 92. P. 892–903. https://doi.org/10.1111/tpj.13726
Würschum T., Liu G., Boeven P.H.G. et al. Exploiting the Rht portfolio for hybrid wheat breeding // Theor. Appl. Genet. 2018. V. 131. P. 1433–1442. https://doi.org/10.1007/s00122-018-3088-4
Zhang X., Yang S., Zhou Y. et al.Distribution of the Rht-B1b, Rht-D1b and Rht8 reduced height genes in autumn‑sown Chinese wheats detected by molecular markers // Euphytica. 2006. V. 152. P. 109–116. https://doi.org/10.1007/s10681-006-9184-6
Алиев Э.Б. Цитогенетическое изучение фотопериодической реакции у мягкой пшеницы: Дис. Новосибирск, 1982. 226 с.
Тимоха С.И., Писарева Л.А. Аллельные взаимодействия у индуцированных короткостебельных мутантов озимой пшеницы Мироновская 808 // Бюл. ВИР. 1982. № 122. С. 23.
Sponsel V.M. Signal achievements in gibberellin research: The second half-century // Annual Plant Reviews. 2016. V. 49: The Gibberellins / Eds Hedden P., Thomas S. G. John Wiley and Sons. Ltd, 2016. P. 1–36. https://doi.org/10.1002/9781119210436.ch1
Sakamoto T., Matsuoka M. Generating high-yielding varieties by genetic manipulation of plant architecture // Curr. Opin. Biotechnol. 2004. V. 15. № 2. P. 144–147. https://doi.org/10.1016/j.copbio.2004.02.003
Pearce S., Saville R., Vaughan S.P. et al. Molecular characterization of Rht-1 dwarfing genes in hexaploid wheat // Plant Physiol. 2011. V. 157. P. 1820–1831. https://doi.org/10.1104/pp.111.183657
Wen W., Deng Q., Jia H. et al. Sequence variations of the partially dominant DELLA gene Rht-B1c in wheat and their functional impacts // J. Exp. Bot. 2013. V. 64. № 11. P. 3299–3312. https://doi.org/10.1093/jxb/ert183
Richards R.A. The effect of dwarfing genes in spring wheat in dry environments. I. Agronomic characteristics // Aust. J. Agric. Res. 1992. V. 43. № 3. P. 517–527. https://doi.org/10.1071/AR9920517
Yan J., Zhang S. Effects of dwarfing genes on water use efficiency of bread wheat // Front. Agr. Sci. Eng. 2017. V. 4. № 2. P. 126–134. https://doi.org/10.15302/J-FASE-2017134
Nazim Ud Dowla M.A.N., Edwards I., O’Hara G. et al. Developing wheat for improved yeld and adaptation under a changing climate: Optimization of a few key genes // Engineering. 2018. V. 4. № 4. P. 514–522. https://doi.org/10.1016/j.eng.2018.06.005
Гончарова А.І., Моцний І.І., Чеботар С.В. Вплив алелів генів короткостебловості на довжину колеоптиля пшениці м’якої в умовах осмотичного стресса // Вісник Одеського націон. ун-ту. 2016. Т. 21. № 1. С. 89–99. https://doi.org/10.18524/2077-1746.2016.1(38).68107
Jatayev S., Sukhikh I., Vavilova V. et al. Green revolution ‘stumbles’ in a dry environment: Dwarf wheat plants with Rht genes fail to produce higher grain yield than taller genotypes under early and severe drought // Plant, Cell & Environment. 2020. P. 1–10.
Thomas S.G., Blázquez M.A., Alabadí D. DELLA proteins: Master regulators of gibberellin-responsive growth and development // Annual Plant Reviews. V. 49: The Gibberellins / Eds Hedden P., Thomas S.G. John Wiley and Sons. Ltd, 2016. P. 189–228. https://doi.org/10.1002/9781119210436.ch7
Achard P., Gong F., Cheminant S. et al. The cold-inducible CBF1 factor-dependent signaling pathway modulates the accumulation of the growth-repressing DELLA proteins via its effect on gibberellin metabolism // Plant Cell. 2008. V. 20. № 8. P. 2117–2129. https://doi.org/10.1105/tpc.108.058941
Achard P., Cheng H., Grauwe L. De et al. Integration of plant responses to environmentally activated phytohormonal signals // Science. 2006. V. 311. № 5757. P. 91–94. https://doi.org/10.1126/science.1118642
Achard P., Renou J.P., Berthomé R. et al. Plant DELLAs restrain growth and promote survival of adversity by reducing the levels of reactive oxygen species // Curr. Biol. 2008. V. 18. № 9. P. 656–660. https://doi.org/10.1016/j.cub.2008.04.034
Cheminant S., Wild M., Bouvier F. et al. DELLAs regulate chlorophyll and carotenoid biosynthesis to prevent photooxidative damage during seedling deetiolation in Arabidopsis // Plant Cell. 2011.V. 23. № 5. P. 1849–1860. https://doi.org/10.1105/tpc.111.085233
deLucas M., Davière J.M., Rodríguez-Falcón M.et al. A molecular framework for light and gibberellin control of cell elongation // Nature. 2008. V. 451. № 7177. P. 480–484. https://doi.org/10.1038/nature06520
Feng S., Martinez C., Gusmaroli G. et al. Coordinated regulation of Arabidopsis thaliana development by light and gibberellins // Nature. 2008. V. 451. № 7177. P. 475–479. https://doi.org/10.1038/nature06448
Annunziata M.G. The long and the short of it: GA 2-oxidaseA9 regulates plant height in wheat // Plant Physiol. 2018. V. 177. P. 3–4. https://doi.org/10.1104/pp.18.00235
Bilova T.E., Ryabova D., Anisimova I.N. Molecular basis of the dwarfism character in cultivated plants. I. Growth distortions due to mutations of gibberellin metabolism and signaling // Agric. Biol. 2016. V. 51. № 1. P. 3–16. https://doi.org/10.15389/agrobiology.2016.1.3eng
Чеботарь Г.О., Чеботарь С.В. Сигнальные пути гиббереллина в растениях // Цитология и генетика. 2011. Т. 45. № 4. С. 259–268. https://doi.org/10.3103/S0095452711040037
Sun T. Gibberellin-GID1-DELLA: A pivotal regulatory module for plant growth and development 1 // Plant Physiol. 2010. V. 154. P. 567–570. https://doi.org/10.1104/pp.110.161554
Vera-Sirera F., Gomez M.D., Perez-Amador M.A. DELLA proteins, a group of GRAS transcription regulators that mediate gibberellin signaling // Elsevier Inc. 2016. P. 313–328. https://doi.org/10.1016/B978-0-12-800854-6.00020-8
Murase K., Hirano Y., Sun T.P. et al. Gibberellin-induced DELLA recognition by the gibberellin receptor GID1 // Nature. 2008. V. 456. № 7221. P. 459–463. https://doi.org/10.1038/nature07519
Lechner E., Achard P., Vansiri A. et al. F-box proteins everywhere // Curr. Opin. Plant Biol. 2006. V. 9. № 6. P. 631–638. https://doi.org/10.1016/j.pbi.2006.09.003
Yamaguchi S. Gibberellin metabolism and its regulation // Annual Rev. Plant Biol. 2008. V. 59. P. 225–251. https://doi.org/10.1146/annurev.arplant.59.032607.092804
Peng J., Richards D.E., Hartley N.M. et al. “Green revolution” genes encode mutant gibberellin response modulators // Nature. 1999. V. 400. P. 256–261. https://doi.org/10.1038/22307
Ellis M.H., Spielmeyer A.W., Gale K.R. et al. “Perfect” markers for the Rht-B1b and Rht-D1b dwarfing genes in wheat // Theor. Appl. Genet. 2002. V. 105. P. 1038–1042. https://doi.org/10.1007/s00122-002-1048-4
Li A. Isolation of a gibberellin-insensitive dwarfing gene, Rht-B1e, and development of an allele-specific PCR marker // Mol. Breed. 2012. V. 30. P. 1443–1451. https://doi.org/10.1007/s11032-012-9730-y
Wu J., Kong X., Wan J. et al. Dominant and pleiotropic effects of a GAI gene in wheat results from a lack of interaction between DELLA and GID1 // Plant Physiol. 2011. V. 157. № 4. P. 2120–2130. https://doi.org/10.1104/pp.111.185272
Konzak C.F. Mutations and mutation breeding // Wheat and Wheat Improvement / Ed. Heyne E.C. Madison: Am. Soc. Agronomy, 1987. P. 428–443.
Ellis M.H., Rebetzke J.G., Chandler P.M. et al. The effect of different height reducing genes on the early growth of wheat // Funct. Plant Biol. 2004. V. 31. P. 583–589. https://doi.org/10.1071/FP03207
Дивашук М.Г., Васильев А.В., Беспалова Л.А., Карлов Г.И. Идентичность генов короткостебельности Rht-11 и Rht-Ble // Генетика. 2012. Т. 48. № 7. С. 897–900. https://doi.org/10.1134/S1022795412050055
Börner A., Worland A.J. Does the Chinese dwarf wheat variety “XN0004” carry Rht21? // Cereal Res. Communications. 2002. V. 30. № 1. P. 25–29. https://doi.org/10.1007/BF03543385
Asplund L., Leino M.W., Hagenblad J. Allelic variation at the Rht8 locus in a 19th century wheat collection // The Sci. World J. 2012. https://doi.org/10.1100/2012/385610
Grover G., Sharma A., Gill H.S. et al. Rht8 gene as an alternate dwarfing gene in elite Indian spring wheat cultivars // PLoS One. 2018. V. 13. № 6. https://doi.org/10.1371/journal.pone.0199330
Wang Y., Du Y., Yang Z. et al. Comparing the effects of GA-responsive dwarfing genes Rht13 and Rht8 on plant height and some agronomic traits in common wheat // F. Crop. Res. 2015. V. 179. P. 35–43. https://doi.org/10.1016/j.fcr.2015.04.010
Casebow R., Hadley C., Uppal R. et al. Reduced height (Rht) alleles affect wheat grain quality // PLoS One. 2016. V. 11. № 5. https://doi.org/10.1371/journal.pone.0156056
Liu Y., Zhang J., Hu Y.-G. et al. Dwarfing genes Rht4 and Rht-B1b affect plant height and key agronomic traits in common wheat under two water regimes // F. Crop. Res. 2017. V. 204. P. 242–248. https://doi.org/10.1016/j.fcr.2017.01.020
Чеботарь С.В., Корзун В.Н., Сиволап Ю.М. Распространение локуса WMS261, маркирующего ген короткостебельности Rht8, у сортов мягкой пшеницы Южной Украины // Генетика. 2001. Т. 37. № 8. С. 1075–1080. https://doi.org/10.1023/A:1016773515628
Чеботарь Г.А., Моцный И.И., Чеботарь С.В. и др. Прямые эффекты генов короткостебельности на генетическом фоне известных сортов пшеницы юга Украины // Цитология и генетика. 2012. Т. 46. № 6. С. 44–52. https://doi.org/10.3103/S0095452712060023
Файт В.И., Чеботарь С.В., Мокану Н.В. и др. Эффекты аллелей гена Rht8 по агрономическим признакам у озимой мягкой пшеницы в условиях степи юга Украины // Цитология и генетика 2007. Т. 41. № 2. С. 30–36. https://doi.org/10.3103/S0095452707020053
Peng Z.S., Li X., Yang Z.J. et al. A new reduced height gene found in the tetraploid semi-dwarf wheat landrace Aiganfanmai // Genet. Mol. Res. 2011. V. 10. № 4. P. 2349–2357. https://doi.org/10.4238/2011.October.5.5
Yang Z.Y., Liu C.Y., Du Y.Y. et al. Dwarfing gene Rht18 from tetraploid wheat responds to exogenous GA 3 in hexaploid wheat // Cereal Res. Communications. 2007. V. 45. P. 1–12. https://doi.org/10.1556/0806.44.2016.050
Zhao K., Xiao J., Liu Y. et al. Rht23 (5Dq') likely encodes a Q homeologue with pleiotropic effects on plant height and spike compactness // Theor. Appl. Genet. 2018. V. 131. P. 1825–1834. https://doi.org/10.1007/s00122-018-3115-5
Manske G.G.B., Ortiz-Monasterio J.I., van Ginkel R.M. et al. Phosphorus use efficiency in tall, semi-dwarf and dwarf near-isogenic lines of spring wheat // Euphytica. 2002. V. 125. P. 113–119. https://doi.org/10.1023/A:1015760600750
Куркиев К.У. Интрогрессия гена короткостебельности Rht10 от пшеницы сорта Ai-Bian 1 в генотип тритикале // Генетика. 2007. Т. 43. № 9. С. 1269–1272. https://doi.org/10.1134/S102279540709013X
Rebetzke G.J., Ellis M.H., Bonnett D.G. et al. Height reduction and agronomic performance for selected gibberellin-responsive dwarfing genes in bread wheat (Triticum aestivum L.) // F. Crop. Res. 2012. V. 126. P. 87–96. https://doi.org/10.1016/j.fcr.2011.09.022
Ellis M.H., Rebetzke G.J., Azanza F. et al. Molecular mapping of gibberellin-responsive dwarfing genes in bread wheat // Theor. Appl. Genet. 2005. V. 111. P. 423–430. https://doi.org/10.1007/s00122-005-2008-6
Rebetzke G.J., Ellis M.H., Bonnett D.G. et al. The Rht13 dwarfing gene reduces peduncle length and plant height to increase grain number and yield of wheat // F. Crop. Res. 2011. V. 124. № 3. P. 323–331. https://doi.org/10.1016/j.fcr.2011.06.022
Botwright T.L., Rebetzke G.J., Condon A.G. et al. Influence of the gibberellin-sensitive Rht8 dwarfing gene on leaf epidermal cell dimensions and early vigour in wheat (Triticum aestivum L.) // Ann. Bot. 2005. V. 95. № 4. P. 631–639. https://doi.org/10.1093%2Faob%2Fmci069
Дополнительные материалы отсутствуют.