Генетика, 2021, T. 57, № 3, стр. 311-320
Идентификация и полиморфизм гена ГДФ-L-галактозофосфорилазы (ApGGP1) у сортов лука-порея
О. К. Анисимова 1, А. В. Щенникова 1, Е. З. Кочиева 1, М. А. Филюшин 1, *
1 Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: michel7753@mail.ru
Поступила в редакцию 01.05.2020
После доработки 02.06.2020
Принята к публикации 25.08.2020
Аннотация
У широкой выборки сортов лука-порея Allium porrum L., различающихся содержанием витамина С, идентифицированы и охарактеризованы кодирующие последовательности гена ApGGP1, продукт которого – ГДФ-L-галактозофосфорилаза – является ключевым ферментом L-галактозного пути биосинтеза витамина С. Определен аллельный полиморфизм кДНК гена ApGGP1 у 35 сортов лука-порея, выявлено 29 аллельных вариантов, соответствующих 11 вариантам белка ApGGP1. В последовательностях ApGGP1 у лука-порея и других видов Allium выявлен родоспецифичный С-концевой мотив (50 а. о.). Определен профиль экспрессии гена ApGGP1 в различных органах и тканях (корень, донце, отбеленная часть ложного стебля и зеленый лист (молодой и зрелый)) лука-порея. Транскрипты ApGGP1 присутствуют во всех анализируемых тканях. Максимальный уровень экспрессии гена наблюдается в листьях, минимальный – в донце. При этом в корнях (нефотосинтезирующая ткань) уровень экспрессии гена достаточно высок и сопоставим с таковым в молодых листьях.
L-аскорбиновая кислота (АК, аскорбат, витамин С) является важным элементом неферментативной антиоксидантной системы эукариот – растений и животных [1, 2]. Также АК вовлечена в процессы клеточного роста и деления и является субстратом для синтеза других соединений и кофактором некоторых ферментов [1, 3]. При этом ряд животных, включая приматов, не способны синтезировать АК, так как потеряли функциональный ген, кодирующий последний фермент в пути биосинтеза АК, и получают необходимые количества витамина С с пищей [1].
В растениях витамин С был обнаружен во всех клеточных структурах, включая митохондрии, где происходит последняя стадия биосинтеза АК [1]. Содержание АК значительно варьируется в разных тканях и наибольшее количество характерно для фотосинтезирующих листьев, меристем, цветков и незрелых плодов, а наименьшее – для стеблей и корней [1, 4].
К настоящему времени описаны четыре основных пути биосинтеза АК – L-галактозный, L‑гулозный, галактуроновый и мио-инозитоловый [1, 5]. Основным в растениях считается L-галактозный путь Смирнова–Уилера (Smirnoff-Wheeler), который начинается с образования ГДФ-D-маннозы, поэтапно преобразуемой в производные L‑галактозы вплоть до синтеза конечного продукта – L-аскорбиновой кислоты [1, 6]. Ключевым ферментом L-галактозного пути является ГДФ-L-галактозофосфорилаза (GDP-L-galactose phosphorylase, GGP; EC 2.7.7.69), катализирующая второй этап биосинтеза – превращение ГДФ-L-галактозы в L-галактозу-1-P [1, 7].
ГДФ-L-галактозофосфорилаза кодируется геном GGP, последовательности которого идентифицированы у многих видов растений [5, 6, 8, 9]. При этом геном растений может содержать несколько паралогичных генов, кодирующих изоформы данного фермента. Например, у Arabidopsis thaliana идентифицировано два гена ГДФ-L-галактозофосфорилазы – VITAMIN C (VTC) 2 и VTC5, однако вклад этих генов в процесс биосинтеза АК значительно различается: VTC2 играет преобладающую роль, а VTC5 – дополняющую [8, 9]. У Triticum aestivum в каждом из трех субгеномов найдено по два гена ГДФ-L-галактозофосфорилазы (TaGGP1-A/B/D и TaGGP2-A/B/D), профили экспрессии которых сильно различаются, что может означать участие отдельных изоформ (с преобладающим влиянием TaGGP1) в биосинтезе АК в конкретных тканях и органах мягкой пшеницы [6].
Лук-порей (Allium porrum L.) является популярной овощной культурой в Западной Европе и Азии, а в последнее время и в РФ. В пищу пригодно практически все растение – отбеленный ложный стебель и зеленые листья. Аскорбиновая кислота вносит значительный вклад в антиоксидантную активность лука-порея, причем в зеленых листьях содержание АК значительно больше, чем в отбеленной части, и может достигать 8.5 мг/г сухой массы [10]. На видах и сортах Allium регулярно проводятся сравнительные исследования, касающиеся анализа антиоксидантной активности и содержания АК [10]. Несмотря на это, ни генные сети, ни отдельные гены пути биосинтеза АК до сих пор не охарактеризованы ни у лука-порея, ни у других представителей рода Allium.
Целью данной работы стала идентификация у лука-порея кодирующей последовательности, гомологичной гену GGP1, исследование ее межсортовой вариабельности и аллельного полиморфизма и определение профиля экспрессии.
МАТЕРИАЛЫ И МЕТОДЫ
Для работы были отобраны 35 сортов лука-порея зарубежной и отечественной селекции из коллекции Федерального научного центра овощеводства (ФНЦО) (табл. в Приложении). Из зеленых листьев этих сортов была выделена суммарная РНК с очисткой от примесей ДНК (наборы RNeasy Plant Mini Kit и RNase free DNasy set; QIAGEN), синтезированы препараты кДНК (набор GoScriptтм Reverse Transcription System, Promega).
С целью амплификации GGP1-последовательностей у анализируемых образцов лука-порея были разработаны специфичные праймеры. В базе транскриптомных данных (NCBI TSA) у представителей рода Allium был проведен поиск последовательностей, гомологичных кДНК гена GGP1 Asparagus officinalis (XM_020388507.1). Были найдены гомологичные транскрипты у A. ampeloprasum (GFAR01020967.1), A. cepa (GBGJ01076064.1) и A. sativum (GFAP01091649.1), на основе которых разработаны праймеры (ApVTC2F 5'-GTTCTCCTTCCGATTTGCT-3' и ApVTC2R 5'-ATTCCATARATACTGACTTCAG-3') для амплификации полноразмерной кодирующей последовательности (включая 70–100 пн 5'- и 3'-UTR) гомолога гена GGP1 у образцов A. porrum.
С помощью разработанных праймеров на препаратах кДНК амплифицировали последовательности гомолога гена GGP1. ПЦР-продукты ожидаемой длины были очищены с помощью QIAEX® II Gel Extraction kit (QIAGEN, Германия) и секвенированы с использованием тех же праймеров на ABI Prism 3700 DNA Analyzer (ЦКП Биоинженерия, ФИЦ Биотехнологии РАН). Выравнивание и анализ нуклеотидных и аминокислотных последовательностей был проведен с помощью программы MEGA 7.0 (https://www.megasoftware.net/). Консервативные домены и мотивы в белках были определены с помощью NCBI-CDD (http:// www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) и MEME 5.1.1 (http://meme-suite.org/tools/meme). Влияние аминокислотных замен на структуру и функции белков было предсказано с помощью программы PROVEAN (http://provean.jcvi.org/index.php).
Профиль экспрессии гена GGP1 был определен методом ПЦР в реальном времени (РВ-ПЦР) в корнях, донце, зеленых листьях (молодой и зрелый) и отбеленной части ложного стебля (поперечный срез шириной 0.5 см в 2 см от донца) растений лука-порея сорта Премьер (собраны в августе 2019 г. на стадии активного формирования отбеленного ложного стебля). Для РВ-ПЦР были разработаны специфичные праймеры rtVTC2F 5'-GGTGTCAAGCGTGTGTATCTG-3' и rtVTC2R 5'-TTCCCAAACAGCGGGATTGAC-3'. Относительный уровень экспрессии GGP1 был определен по референсным генам GAPDH [11] и UBQ [12]. Для РВ-ПЦР был использован набор “Реакционная смесь для проведения РВ-ПЦР в присутствии SYBR GreenI и ROX” (ООО “Синтол”, Россия) и термоциклер CFX96 Real-Time PCR Detection System (Bio-Rad Laboratories, США). Реакции проводили в двух биологических и трех технических повторах в следующих условиях: 95°C – 5 мин; 40 циклов (95°C – 15 с, 62°C – 50 с). Для статистической обработки результатов использовали программу GraphPad Prism v. 8 (https://www.graphpad.com).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Кодирующие последовательности гомолога гена GGP1 были амплифицированы и секвенированы у 35 сортов лука-порея. Полученные последовательности были депонированы в NCBI (MT479049–MT479083).
Размер кДНК ApGGP1 у всех образцов A. porrum был инвариантен и составил 1275 пн, как и у других видов Allium (A. ampeloprasum, A. sativum и A. cepa). В сравнении с GGP1 A. sativum и A. cepa в последовательностях ApGGP1 образцов лука-порея было выявлено 23 и 57 SNPs соответственно. Последовательности GGP1 A. ampeloprasum и образцов A. porrum различались всего одной нуклеотидной заменой (А675Т), что было ожидаемо, так как A. porrum согласно ряду таксономических классификаций считается подвидом A. ampeloprasum [13].
Размер кДНК GGP1 аспарагуса A. officinalis (1320 пн) оказался больше размера кодирующей последовательности GGP1 A. porrum, а гомология составила 79.8%. Поскольку структурное сходство высоко, то вероятно, что подобно GGP1 A. officinalis полногеномная последовательность GGP1 A. porrum также содержит шесть экзонов.
В идентифицированных последовательностях кДНК GGP1 сортов лука-порея было выявлено 25 вариабельных сайтов (1.96% от общей длины кДНК). Почти половина SNPs (12) находятся на 3'-конце кДНК (предположительно экзон VI). Для анализируемой выборки 11 SNPs – образец-специфичны: С109G, C213T и T597C (сорт Otina), C234A (Musselburgh), C648A и A807G (Itation gent), C774T (Olifant-Exelsior), C858A (Премьер), C1077T (Добрый молодец), C1110T (XXL), G1243T (Porree dicker). Остальные нуклеотидные замены встречаются у двух и более сортов лука-порея (табл. 1).
Таблица 1.
Аллельный полиморфизм кодирующих последовательностей гена GGP1 у анализируемых сортов лука-порея. Положение SNP на кДНК определено от старт-кодона
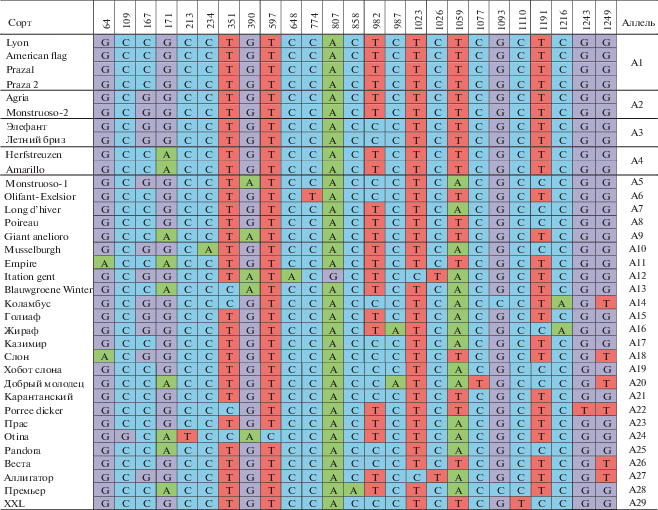
Проведенный анализ позволил выявить 29 аллельных вариантов GGP1, различающихся комбинациями SNPs у анализируемых сортов лука-порея (табл. 1). Аллельный вариант А1 идентифицирован у четырех сортов лука-порея, аллели A2, A3 и A4 встречаются у пар сортов – Agria/Monstruoso-2, Элефант/Летний бриз и Herfstreuzen/Amarillo соответственно (табл. 1). Остальные аллельные варианты сортоспецифичны для данной выборки. Наибольшее количество нуклеотидных замен по сравнению с аллелем А1 обнаружено у вариантов А12 (сорт Itation gent), A20 (Добрый молодец) и А24 (Otina).
Так как взятые в анализ сорта лука-порея различались содержанием витамина С (табл. в Приложении), была проведена оценка возможных ассоциаций между содержанием АК и выявленными нуклеотидными заменами. Для этого сравнивали SNPs, общие для групп сортов с высоким (>35 мг/100 г) или низким (<30 мг/100 г) содержанием витамина С. Однако каких-либо корреляций выявлено не было.
Полученные нуклеотидные последовательности были транслированы. Размер белка GGP1 был инвариантным (424 а. о.) у всех исследуемых сортов лука-порея. Идентифицированные в кДНК несинонимичные замены приводят к семи замещениям а. о. (E22K, P37А, S56C, A365P, R406S, A415S и A417S), анализ которых в программе PROVEAN предсказал их нейтральный характер. Замещение S56C присутствует у 12 сортов выборки, а замещения E22K, A365P, R406S и A417S характерны для меньшего числа сортов (табл. 2). Два замещения были сортоспецифичными: P37A (сорт Otina) и A415S (Porree dicker). Всего у анализируемых сортов лука-порея было выявлено 11 вариантов белка ApGGP1, характеризующихся различными комбинациями замещений а. о. (табл. 2). Вариант белка P1 присутствует у 17 сортов лука-порея (48.5%), P2 – у восьми (22.8%), P3 – у двух (5.7%), а P4–P11 – у отдельных сортов.
Таблица 2.
Вариабельность аминокислотных последовательностей GGP1 у анализируемых 35 сортов лука-порея
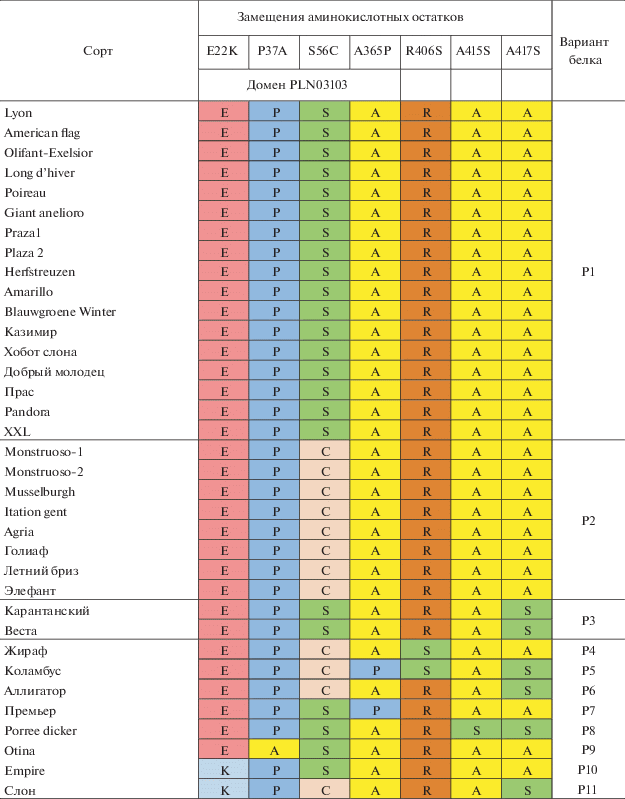
Анализ последовательностей с помощью NCBI‑CDD показал, что все они содержат консервативный домен ГДФ-L-галактозогексозо-1-фосфат-гуанилтрансферазы (PLN03103) в положении 1–393 а. о. Последовательности домена у GGP1 лука-порея оказались высоко гомологичны таковым у других видов растений, например аспарагуса A. officinalis (идентичность 80%) или томата Solanum lycopersicum (73%). В домене PLN03103 GGP1 анализируемых образцов A. porrum было выявлено четыре нейтральных замещения а. о. (E22K, P37A, S56C и A365P) (табл. 2).
ГДФ-L-галактозофосфорилаза относится к суперсемейству белков HINT (histidine triad nucleotide protein), которые характеризуются схожей структурой и наличием гистидиновой триады His-X-His-X-His-X-X, являющейся каталитическим центром фермента [14]. Как было показано ранее, у растений в белках ГДФ-L-галактозофосфорилазы отсутствует третий остаток гистидина [8, 15]. В анализируемых последовательностях белков ApGGP1 был выявлен мотив HLHFQ (233–237 а. о.). Такой же мотив содержат белки GGPs A. thaliana, томата S. lycopersicum, пшеницы T. aestivum и других видов растений [6, 15, 16]. Ранее было показано, что у A. thaliana и томата S. lycopersicum белки GGP локализуются в цитоплазме и ядре и предположительно имеют двойную функцию, ферментативную и регуляторную [17, 18]. Сигнал ядерной локализации KKRP, найденный в белках GGP других видов растений [6], также был обнаружен и в последовательностях белков GGP1 анализируемых образцов лука-порея. Это позволяет предположить, что GGP1 у лука-порея также может иметь двойную функцию.
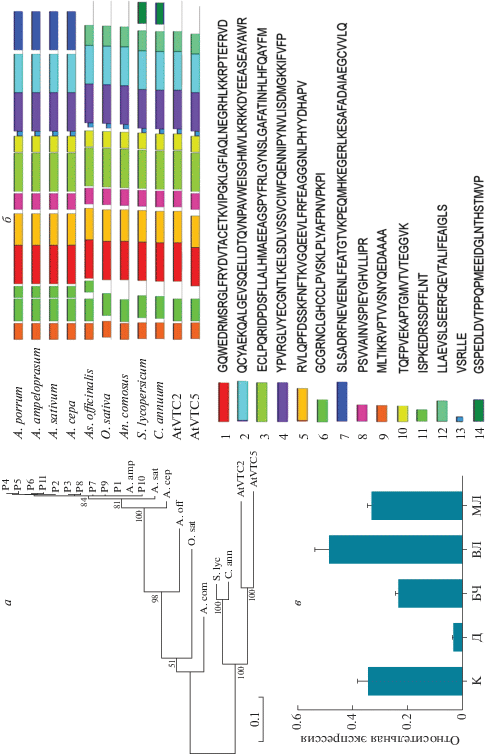
Идентифицированные варианты аминокислотных последовательностей ApGGP1 анализируемых сортов лука-порея были использованы для кластерного анализа. На построенной дендрограмме все выявленные варианты белка P1–P11 формируют единую группу с A. ampeloprasum (бутстреп-поддержка 89%). Базальные ветви образуют другие виды Allium (A. cepa и A. sativum) и спаржа A. officinalis. Таким образом, все взятые в анализ виды порядка Asparagales формируют общий субкластер (бутстреп-поддержка 99%). Другие виды однодольных растений, рис Oryza sativa и ананас Ananas comosus (порядок Poales) формируют ветви к субкластеру видов Asparagales. Виды двудольных растений ожидаемо образуют субкластеры, генетически отдаленные (p-distance 0.30–0.35) от группы видов Asparagales (рис. 1,а).
Рис. 1.
а – дендрограмма, построенная на основе аминокислотных последовательностей ГДФ-L-галактозофосфорилазы 1 лука-порея (P1–P11) и других видов однодольных и двудольных растений: A. off – Asparagus officinalis (XM_020388507.1), A. cep – Allium cepa (GBGJ01076064.1), A. sat – Allium sativum (GFAP01091649.1), A. amp – Allium ampeloprasum (GFAR01020967.1), A. com – Ananas comosus (XM_020251146.1), O. sat – Oryza sativa (XM_015764404.2), S. lyc – Solanum lycopersicum (NM_001279216.2), C. ann – Capsicum annuum (XM_016722577.1), AtVTC2 – Arabidopsis thaliana (NM_118819.3), AtVTC5 – Arabidopsis thaliana (NM_124894.5); б – выявленные у анализируемых однодольных и двудольных видов растений консервативные мотивы и их последовательности в белках ГДФ-L-галактозофосфорилазы 1; в – профиль экспрессии гена ApGGP1 в различных органах растения лука-порея (сорт Премьер). К – корни, Д – донце, БЧ – белая часть, ВЛ – взрослый лист, МЛ – молодой лист. Уровни экспрессии между всеми анализируемыми органами достоверно различаются (p-value < 0.05).
ПРИЛОЖЕНИЕ Использованные в работе сорта лука-порея A. porrum
| Сорт | Номер по кат. ФНЦО/ВИР/Госсортреестр (при наличии) | Происхождение | Содержание витамина С в белой части, мг/100 г сырой массы* |
|---|---|---|---|
| Monstruoso-1 | К-1/2114 | Аргентина | 40 |
| Lyon | К-2/2159 | Великобритания | 33 |
| American flag | К-3/2191 | Дания | 36 |
| Olifant-Exelsior | К-4/2196 | Нидерланды | 26 |
| Long d’hiver | К-5/2212 | Франция | 37 |
| Poireau | К-6/2231 | Франция | 25 |
| Giant anelioro | К-7/2238 | Нидерланды | 27 |
| Praza1 | К-8/2244 | Турция | 33 |
| Praza 2 | К-9/2245 | Италия | 40 |
| Monstruoso-2 | К-10/2248 | Великобритания | 27 |
| Musselburgh | К-11/2253 | Нидерланды | 24 |
| Herfstreuzen | К-12/2270 | Нидерланды | 36 |
| Amarillo | К-13/2307 | Франция | 29 |
| Empire | К-14/2350 | Дания | 35 |
| Itation gent | К-15/2353 | Дания | 34 |
| Agria | К-16/2398 | Нидерланды | 35 |
| Blauwgroene Winter | К-17/2403 | Германия | 44 |
| Коламбус | К-26 | Нидерланды | 24 |
| Голиаф | K-28 | Россия | 26 |
| Жираф | К-29 | Россия | н/а |
| Казимир | К-31 | Германия | 35 |
| Летний бриз | К-33 | Россия | 26 |
| Слон | К-36 | Россия | 30 |
| Хобот слона | К-37 | Россия | 32 |
| Добрый молодец | К-39 | Россия | 32 |
| Карантанский | К-40/2001 | Россия | 26 |
| Porree dicker | К-41/2017 | Германия | 26 |
| Прас | К-42/2038 | Россия | 24 |
| Otina | К-89 | Нидерланды | н/а |
| Pandora | К-101 | Нидерланды | н/а |
| Веста | 9102094 | Россия | 36 |
| Аллигатор | 9154083 | Россия | н/а |
| Премьер | 9705521 | Россия | н/а |
| Элефант МС | 9550224 | Чехия | 33 |
| XXL | Россия | н/а |
C помощью программы MEME 5.1.1 в последовательностях ApGGP1 были достоверно идентифицированы 14 консервативных мотивов, десять из которых присутствовали в белках GGP1 всех взятых в анализ видов растений (рис. 1,б). Мотив 11 был выявлен в последовательностях белков GGP1 только у представителей порядка Asparagales: лука-порея A. porrum (55–69 а. о.), других видов Allium (55–69 а. о.) и аспарагуса A. officinalis (62–76 а. о.). С-концевой мотив 7 (375–424 а. о.) был специфичным только для GGP1 видов Allium (рис. 1,б). Интересно, что все три С-концевых замещения а. о., обнаруженных в ApGGP1 анализируемых сортов лука-порея, локализованы именно в мотиве 7. Другие замещения а. о., находящиеся в функциональном домене PLN03103, локализованы в мотивах 2 (A365P), 6 (P37A) и 11 (S56C), а замещение E22K – между мотивами 9 и 6.
С учетом того, что гены изоформ GGP могут обладать органо- и тканеспецифичной транскрипцией [5, 6], был проведен анализ профиля экспрессии гена ApGGP1 в различных органах (корень, донце, зеленый лист (молодой и зрелый) и отбеленная часть ложного стебля) лука-порея отечественного сорта Премьер (рис. 1,в). Транскрипты ApGGP1 присутствовали во всех анализируемых тканях. Максимальный уровень экспрессии ApGGP1 наблюдается в зрелых зеленых листьях лука-порея, тогда как в молодых листьях уровень транскрипции данного гена ниже в 1.5 раза (рис. 1,в). Полученные данные согласуются с результатами других исследований, где наиболее высокая экспрессия GGP1 также детектируется в фотосинтезирующих тканях [17, 19]. Считается, что это может быть связано с наличием в промоторе гена GGP1, как и в промоторах некоторых других генов L-галактозного пути биосинтеза АК, светочувствительных cis-элементов [20, 21].
Что касается нефотосинтезирующих тканей лука-порея, то в донце (уплощенный стебель видоизмененного побега) был выявлен минимальный уровень транскрипции ApGGP1, в 14.6 раз ниже, чем в зрелых зеленых листьях, а в отбеленной части ложного стебля – в 1.5 и 2 раза ниже, чем в молодых и зрелых листьях соответственно. Можно предположить, что транскрипция гена GGP1 в нефотосинтезирующих тканях связана с необходимостью синтеза в них витамина С для инактивации возникающих в процессе метаболизма активных форм кислорода [2]. Ранее считалось, что транскрипция гена GGP1 активируется наличием света, поэтому максимальные уровни экспрессии наблюдаются в активно фотосинтезирующих органах [20]. Полученные данные соответствуют результатам других исследований, где, как и в случае анализируемых нами сортов лука-порея, нефотосинтезирующим тканям соответствуют минимальные уровни экспрессии GGP1 [6, 17]. Например, в корнях A. thaliana уровень экспрессии гена VTC2 (гомолог GGP1) в 18 раз ниже, чем в листьях [17]. У баклажана (Solanum melongena) в корнях уровень транскрипции GGP1 также минимальный [22].
Интересно, однако, что в нашем исследовании в корнях лука-порея уровень транскрипции ApGGP1 сопоставим с таковым в молодом зеленом листе (рис. 1,в). Это подтверждает возможность участия АК в ответе корней растений на различные абиотические стрессы. Так, ранее было показано, что в ответ на солевой стресс в корнях O. sativa индуцируется биосинтез АК, что сопровождается ростом экспрессии одного из ключевых генов биосинтеза АК (OsVTC1-3), а подавление экспрессии этого гена значительно нарушает устойчивость риса к солевому стрессу [23].
Выявленный у сортов лука-порея высокий нуклеотидный полиморфизм гена ApGGP1 может быть следствием высокого уровня внутривидового геномного полиморфизма, характерного для A. porrum [24, 25]. Однако значительное структурное сходство белковых последовательностей ApGGP1 у сортов лука-порея и отсутствие радикальных замен, в особенности в домене PLN03103 и каталитическом центре, позволяют предположить, что гомологи GGP1 сохраняют функцию и уровень ферментативной активности в биосинтезе АК у анализируемых образцов A. porrum, косвенно подтверждая значимость витамина С для развития растения и реакции на стрессы [7].
Поскольку исследуемый ген GGP1 кодирует ключевой фермент L-галактозного пути биосинтеза АК, мы предполагали возможность существования корреляций между вариабельностью ApGGP1 и содержанием витамина С в тканях лука-порея. Однако таких корреляций обнаружено не было. По всей видимости, при оценке подобных зависимостей, кроме скорости катаболизма АК, растущей под влиянием окислительного стресса, следует учитывать также возможность транспортировки АК по флоэме из фотосинтезирующих тканей в запасающие [1], в нашем случае в отбеленную часть ложного стебля. Таким образом, регуляция метаболизма аскорбиновой кислоты у вида A. porrum зависит не только от уровня экспрессии считающегося ключевым гена ГДФ-L-галактозофосфорилазы, но является более сложным процессом и требует дальнейших исследований.
Работа выполнена при финансовой поддержке гранта РФФИ (№ 19-016-00054) и частично Министерства науки и высшего образования РФ (А.В. Щенникова, Е.З. Кочиева), с использованием экспериментальной установки искусственного климата (ЭУИК, ФИЦ Биотехнологии РАН).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Smirnoff N. Ascorbic acid metabolism and functions: A comparison of plants and mammals // Free Radical Biol. Med. 2018. V. 22. P. 116–129. https://doi.org/10.1016/j.freeradbiomed.2018.03.033
Bilska K., Wojciechowska N., Alipour S., Kalemba E.M. Ascorbic acid-the little-known antioxidant in woody plants // Antioxidants (Basel). 2019. V. 8. Article 645. https://doi.org/10.3390/antiox8120645
Conklin P.L., Barth C. Ascorbic acid, a familiar small molecule intertwined in the response of plants to ozone, pathogens, and the onset of senescence // Plant Cell Environ. 2004. V. 27. P. 959–970.
Gest N., Gautier H., Stevens R. Ascorbate as seen through plant evolution: The rise of a successful molecule? // J. Exp. Bot. 2013. V. 64. P. 33–53.
Broad R.C., Bonneau J.P., Hellens R.P., Johnson A.A.T. Manipulation of ascorbate biosynthetic, recycling, and regulatory pathways for improved abiotic stress tolerance in plants // Intern. J. Mol. Sci. 2020. V. 21. Article 1790. https://doi.org/10.3390/ijms21051790
Broad R.C., Bonneau J.P., Beasley J.T. et al. Genome-wide identification and characterization of the GDP-L-galactose phosphorylase gene family in bread wheat // BMC Plant Biol. 2019. V. 19. № 1. Article 515. https://doi.org/10.1186/s12870-019-2123-1
Linster C.L., Clarke S.G. L-Ascorbate biosynthesis in higher plants: The role of VTC2 // Trends Plant Sci. 2008. V. 13. P. 567–573. https://doi.org/10.1016/j.tplants.2008.08.005
Dowdle J., Ishikawa T., Gatzek S. et al. Two genes in Arabidopsis thaliana encoding GDP-L-galactose phosphorylase are required for ascorbate biosynthesis and seedling // Plant J. 2007. V. 52. P. 673–689.
Gao Y., Badejo A.A., Shibata H. et al. Expression analysis of the VTC2 and VTC5 genes encoding GDP-l-galactose phosphorylase, an enzyme involved in ascorbate biosynthesis, in Arabidopsis thaliana // Bioscience, Biotechnology, and Biochemistry. 2011. V. 75. P. 1783–1788.
Bernaert N., De Paepe D., Bouten C. et al. Antioxidant capacity, total phenolic and ascorbate content as a function of the genetic diversity of leek (Allium ampeloprasum var. porrum) // Food Chem. 2012. V. 134. P. 669–677. https://doi.org/10.1016/j.foodchem.2012.02.159
Liu M., Wu Z., Jiang F. Selection and validation of garlic reference genes for quantitative real-time PCR normalization // Plant Cell Tiss Organ Cult. 2015. V. 122. P. 435–444. https://doi.org/10.1007/s11240-015-0780-9
Schwinn K.E., Ngo H., Kenel F. et al. The onion (Allium cepa L.) R2R3-MYB gene MYB1 regulates anthocyanin biosynthesis // Front Plant Sci. 2016. V. 7. Article 1865. https://doi.org/10.3389/fpls.2016.01865
Hirschegger P., Jakse J., Trontelj P., Bohanec B. Origins of Allium ampeloprasum horticultural groups and a molecular phylogeny of the section Allium (Allium: Alliaceae) // Mol. Phylogenet. Evol. 2010. V. 54. № 2. P. 488–497. https://doi.org/10.1016/j.ympev.2009.08.030
Brenner C. Hint, Fhit, and GalT: function, structure, evolution, and mechanism of three branches of the histidine triad superfamily of nucleotide hydrolases and transferases // Biochemistry. 2002. V. 41. № 29. P. 9003–9014.
Hou H.M., Li H.E., Gao M. et al. Expression of a GDP-L-galactose phosphorylase-like gene in a chinese wild Vitis species induces responses to erysiphe necator and defense signaling molecules // Genet. Mol. Res. 2013. V. 12. №3. P. 3830–3844. https://doi.org/10.4238/2013.September.23.1
Тяпкина Д.Ю., Кочиева Е.З., Слугина М.А. Идентификация и анализ вариабельности генов-гомологов биосинтеза L-аскорбиновой кислоты VТC2 у видов томата (Solanum секция Lycopersicon) // ДАН. 2018. Т. 483. С. 682–686. https://doi.org/10.31857/S086956520003457-5
Müller-Moulé P. An expression analysis of the ascorbate biosynthesis enzyme VTC2 // Plant Mol. Biol. 2008. V. 68. P. 31–41. https://doi.org/10.1007/s11103-008-9350-4
Wang L., Meng X., Yang D. et al. Overexpression of tomato GDP-L-galactose phosphorylase gene in tobacco improves tolerance to chilling stress // Plant Cell Rep. 2014. V. 33. P. 1441–1451.
Huang M., Xu Q., Deng X.-X. L-Ascorbic acid metabolism during fruit development in an ascorbate-rich fruit crop chestnut rose (Rosa roxburghii Tratt) // J. Plant Physiol. 2014. V. 171. P. 1205–1216. https://doi.org/10.1016/j.jplph.2014.03.010
Fukunaga K., Fujikawa Y., Esaka M. Light regulation of ascorbic acid biosynthesis in rice via light responsive cis-elements in genes encoding ascorbic acid biosynthetic enzymes // Bioscience, Biotechnology, and Biochemistry. 2010. V. 74. P. 888–891. https://doi.org/10.1271/bbb.90929
Li J., Liang D., Li M., Ma F. Light and abiotic stresses regulate the expression of GDP-L-galactose phosphorylase and levels of ascorbic acid in two kiwifruit genotypes via light-responsive and stress-inducible cis-elements in their promoters // Planta. 2013. V. 238. P. 535–547. https://doi.org/10.1007/s00425-013-1915-z
Jiang M., Liu Y., Ren L. et al. Light regulates ascorbic acid accumulation and ascorbic acid-related genes expression in the peel of eggplant // South African J. Bot. 2018. V. 114. P. 20–28. https://doi.org/10.1016/j.sajb.2017.10.012
Wang Y., Zhao H., Qin H. et al. The synthesis of ascorbic acid in rice roots plays an important role in the salt tolerance of rice by scavenging ROS // Intern. J. Mol. Sci. 2018. V. 19. № 11. Article E3347. https://doi.org/10.3390/ijms19113347
Дьяченко Е.А., Середин Т.М., Филюшин М.А. Сравнительная оценка вариабельности ядерного и хлоропластного генома лука-порея (Allium porrum L.) // Вавиловский журн. генетики и селекции. 2019. Т. 23. № 7. С. 902–909. https://doi.org/10.18699/VJ19.565
Филюшин М.А., Холда О.А., Кочиева Е.З., Рыжова Н.Н. AFLP маркирование генотипов сортов лука-порея (Allium porrum) // Генетика. 2011. Т. 47. № 4. С. 560–565.
Дополнительные материалы отсутствуют.


