Генетика, 2021, T. 57, № 3, стр. 270-279
Роль генетических факторов в организации и регуляции развития эндокринных тканей in vivo и in vitro
Д. В. Голиусова 1, *, Н. В. Клементьева 2, А. В. Панова 1, 2, Н. Г. Мокрышева 2, С. Л. Киселев 1, **
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Национальный медицинский исследовательский центр эндокринологии
117036 Москва, Россия
* E-mail: daria.goliusova@mail.ru
** E-mail: sl_kiselev@yahoo.com
Поступила в редакцию 30.04.2020
После доработки 13.06.2020
Принята к публикации 16.06.2020
Аннотация
Эндокринные клетки могут успешно функционировать при гетеротопической трансплантации в организм млекопитающего, что делает их перспективным инструментом регенеративной медицины. Однако на сегодняшний день клеточная терапия эндокринных заболеваний ограничена невозможностью эффективно и стабильно получать эндокринные клетки в лабораторных условиях. В данном обзоре рассматриваются современные представления о молекулярно-генетических механизмах эмбрионального развития эндокринных тканей мыши и человека, а также ключевые генетические факторы, регулирующие дифференцировку плюрипотентных стволовых клеток (ПСК) в эндокринном направлении in vitro, на примере паратиреоидных клеток. Приведенные данные позволяют предложить альтернативный подход к дифференцировке ПСК в паратиреоидном направлении, основанный на генетическом программировании клеток путем индукции эндогенной экспрессии ключевых факторов дифференцировки.
Ежегодно доля пациентов с эндокринными патологиями, вызванными нарушением секреции и метаболизма различных гормонов, увеличивается во всем мире. Одним из перспективных подходов к лечению гормональных заболеваний является применение регенеративной медицины. Это обусловлено рядом особенностей секреторных клеток эндокринной системы, позволяющих использовать их как контролируемые биореакторы гормонов in vivo. В первую очередь в связи с тем, что в организме существует как гландулярная, так и диффузная эндокринная система, экскреция гормонов в зрелых эндокринных клетках в основном не зависит от их местоположения в организме. Кроме того, для функционирования трансплантата из эндокринных клеток не требуется его иннервация. По этим причинам эндокринные клетки могут быть трансплантированы гетеротопически в легко доступные в организме человека места, например подкожно или в мышцу, независимо от расположения самой железы. Такой подход успешно используется уже несколько десятилетий для изучения эндокринных заболеваний у мышей, когда гормон-продуцирующие клетки трансплантируют животным под капсулу почки. В случае других типов клеток (кардиомиоцитов, гепатоцитов, нейронов и др.) гетеротопическая трансплантация затруднена или невозможна.
В настоящее время большой интерес представляет разработка способов in vitro дифференцировки плюрипотентных стволовых клеток (ПСК) человека, таких как эмбриональные стволовые клетки (ЭСК) и индуцированные плюрипотентные стволовые клетки (ИПСК), в гормон-продуцирующие клетки эндокринного ряда для заместительной клеточной терапии различных эндокринных патологий и длительной коррекции гормонального дисбаланса у пациентов с эндокринными нарушениями. Применение аутологичных эндокринных клеток, полученных из ПСК пациентов in vitro, является перспективным подходом, поскольку трансплантация таких клеток, во-первых, освобождает пациентов от постоянных инъекций дорогостоящих лекарственных препаратов, особенно с учетом длительности течения эндокринных заболеваний и значительного снижения общего качества жизни, и, во-вторых, безопасна ввиду отсутствия реакции хозяина против трансплантата и отторжения ткани. Однако до сих пор не существует эффективных и хорошо воспроизводимых протоколов дифференцировки ПСК человека в эндокринном направлении, в частности в зрелые островковые клетки поджелудочной железы и клетки паращитовидных желез. Во многом это обусловлено ограничениями эмпирического подбора условий дифференцировки с помощью ростовых факторов и/или химических молекул, активирующих и/или ингибирующих требуемые сигнальные пути в соответствии с данными о формировании эндокринных желез in vivo. Действие подобранных факторов in vitro в большинстве случаев плейотропно, а использование реагентов от различных производителей или животного происхождения приводит к слабой воспроизводимости результатов. Поскольку основной задачей дифференцировки клеток in vitro является повторение и реализация генетической программы эмбрионального развития, возможен и альтернативный подход к дифференцировке путем прямого генетического программирования ПСК на основе имеющихся знаний по эмбриологии эндокринных желез. Генетическое программирование ПСК позволяет специфически активировать работу конкретных генов, а не целых регуляторных сетей. Целевые гены могут быть индуцированы с помощью таких методов, как оверэкспрессия или CRISPR/Cas9 Synergistic Activation Mediator (SAM). Технология CRISPR/Cas9 SAM позволяет целенаправленно активировать промотор интересующего гена, инициируя таким образом его транскрипцию [1]. В 2018 г. с помощью повышенной экспрессии транскрипционных факторов поджелудочной железы удалось трансдифференцировать α-клетки в β-клетки in vivo [2]. Разработка подхода, который позволит программировать дифференцировку ПСК в требуемом направлении, предполагает использование знаний о транскрипционных факторах, регулирующих эмбриональное развитие каждой из тканей. В связи с этим понимание генетических аспектов организации и регуляции раннего развития эндокринных тканей необходимо для разработки протоколов генетически программируемой дифференцировки ПСК в эндокринном направлении.
МОРФОГЕНЕЗ ЭНДОКРИННЫХ ЖЕЛЕЗ ЭНТОДЕРМАЛЬНОГО ПРОИСХОЖДЕНИЯ
Эндокринные железы закладываются в первые месяцы эмбрионального развития из клеток дефинитивной (зародышевой) энтодермы (ДЭ). Дефинитивная энтодерма формируется из клеток эпибласта на 3-й нед. развития и дает начало кишечной трубке зародыша, от которой отпочковываются все органы энтодермального происхождения [3]. В начале 3-й нед. развития в заднем отделе зародыша на поверхности эпибласта появляется так называемая первичная полоска, или борозда, вдоль которой начинают мигрировать клетки эпибласта. Двигаясь вперед, клетки претерпевают эпителиально-мезенхимальный переход, теряют плюрипотентность, приобретают вытянутую форму и проскальзывают под первичную полоску. Такие клеточные движения называют ингрессией, а миграцию клеток в подлежащие слои – инвагинацией. Часть инвагинирующих клеток замещает клетки подлежащего слоя (гипобласта) и дает начало ДЭ зародыша. Клетки, мигрирующие в область между эпибластом и сформированной ДЭ, образуют мезодерму. Клетки, остающиеся в эпибласте, формируют эктодерму. К концу 3-й нед. развития в трехслойном зародышевом диске одновременно начинаются процессы формирования нервной трубки из эктодермы и кишечной трубки из ДЭ путем сворачивания клеточных пластов по передне-задней оси зародыша. К концу 4-й нед. кишечная трубка представляет собой замкнутую первичную кишку, разделенную градиентами морфогенов на четыре части вдоль антерио-постериорной (передне-задней) оси: 1) переднюю (антериорную) часть передней кишки, 2) заднюю (постериорную) часть передней кишки, 3) среднюю кишку и 4) заднюю кишку. Энтодерма первичной кишки образует эпителиальную выстилку кишечного тракта и дает начало секреторным клеткам различных желез. Клетки среднего и заднего отделов первичной кишки формируют клетки-предшественники всех отделов кишечного тракта. Клетки заднего отдела передней кишки дают начало поджелудочной железе и печени. Клетки переднего отдела передней кишки формируют глоточный аппарат, состоящий из четырех пар глоточных мешков, разделенных четырьмя парами глоточных дуг. В результате сегментации и дальнейшего развития глоточного аппарата формируются структуры головы и шеи, в частности щитовидная, паращитовидные железы и тимус [4]. В область глоточных дуг активно мигрируют эктодермальные клетки нервного гребня, которые участвуют в формировании мезенхимы и сегментации энтодермы глоточных мешков, а также в развитии тимуса, паращитовидных желез и дифференцировке парафолликулярных клеток (С-клеток) щитовидной железы [5].
Раньше всех среди эндокринных желез человека начинает формироваться щитовидная железа. Она закладывается примерно на 24-й день эмбрионального развития в виде выпячивания из энтодермальных и мезодермальных клеток на дне глотки [6]. Клетки начинают мигрировать в заднем направлении, и к концу 7-й нед. зачаток щитовидной железы достигает своего окончательного положения в глотке. Клетки нижней части четвертой пары глоточных мешков дают начало предшественникам С-клеток щитовидной железы, секретирующих кальцитонин. К концу 3-го мес. в щитовидной железе обнаруживаются первые фолликулы, содержащие коллоид – источник тироксина и трийодтиронина, синтезируемый фолликулярными клетками [7]. Паращитовидные железы формируются в период с 5-й по 15-ю нед. эмбрионального развития из эпителия третьей и четвертой пары глоточных мешков. Нижняя пара паращитовидных желез формируется из общего зачатка с тимусом, верхняя пара – из общего зачатка с щитовидной железой. На 7-й нед. развития оба зачатка теряют связь со стенкой глотки и мигрируют вниз в заднем направлении, при этом зачатки паращитовидных желез занимают свое окончательное положение на дорсальной поверхности щитовидной железы [8]. Поджелудочная железа закладывается в конце 1-го мес. развития примерно на 26-й день в виде двух отростков зачатка двенадцатиперстной кишки, сформированных клетками заднего отдела передней кишки [9]. Эндокринная часть поджелудочной железы формируется на 3-м мес. развития из паренхиматозной панкреатической ткани, рассеянной по железе. Секреция инсулина начинается примерно на 5-м мес. развития [10].
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ ДЕФИНИТИВНОЙ ЭНТОДЕРМЫ in vivo
Формирование и дифференцировка клеток ДЭ обеспечиваются взаимодействием компонентов регуляторной сети, контролирующей пространственно-временную регуляцию экспрессии ключевых энтодермальных генов в развивающемся зародыше. С началом гаструляции в клетках эпибласта детектируется экспрессия эволюционно консервативных транскрипционных факторов BRACHYURY, SOX17 и FOXA2. Среди них BRACHYURY играет важную роль в спецификации клеток мезодермы, SOX17 и FOXA2 – в спецификации клеток ДЭ [11, 12]. Эволюционно формирование энтодермы и мезодермы взаимосвязано, тем не менее вопрос о существовании бипотентных “мезендодермальных” предшественников в эмбриональном развитии млекопитающих до сих пор остается спорным [13, 14]. Экспрессия факторов BRACHYURY, SOX17 и FOXA2 регулируется концентрацией цитокина NODAL, который является ключевым участником TGFβ/Activin/Nodal-опосредованного сигнального пути, определяющего судьбу энтодермальных и мезодермальных предшественников [15, 16]. Фактор NODAL секретируется клетками наружной внезародышевой энтодермы и обеспечивает индукцию “мезендодермальных” генов через фосфорилирование цитоплазматических белков семейства SMAD (SMAD2, SMAD3, SMAD4), которые активируют работу различных транскрипционных факторов, в частности фактор FOXH1 [17, 18]. Судьба “мезендодермальных” предшественников определяется градиентом концентрации NODAL, формируемым взаимным антагонизмом регуляторных сетей NODAL и FGF/BMP [19, 20]. Высокий уровень NODAL вызывает индукцию фактора SOX17 и дифференцировку клеток в энтодермальном направлении, а ингибирование NODAL факторами семейств FGF и BMP приводит к индукции мезодермальной дифференцировки [21]. Спецификацию и дифференцировку энтодермальных предшественников поддерживает также ауторегуляторная петля экспрессии фактора NODAL [22, 23]. В настоящее время считается, что преобладающая роль в индукции клеток ДЭ принадлежит фактору SOX17. На моделях нокаутных мышей было показано, что при нарушении гена Sox17 у эмбрионов не формируется ДЭ, поскольку клетки эпибласта теряют способность к миграции во время гаструляции. Возникающие дефекты приводят к остановке развития и внутриутробной гибели на стадии Е10.5 [24]. Нарушения Foxa2 не приводят к эмбриональной летали, однако наблюдаются дефекты передней части первичной кишки, общая задержка роста и неспособность формировать срединные структуры [25, 26].
Вслед за гаструляцией из плоского клеточного пласта ДЭ формируется объемная, слепо замкнутая кишечная трубка, в которой происходит установление передне-задней и спинно-брюшной полярностей. На данном этапе клетки ДЭ еще не коммитированы и обладают высокой степенью пластичности [27]. Ключевую роль в специализации энтодермы играют реципрокные эпителиально-мезенхимальные взаимодействия между клеткам ДЭ и мезодермы по всей длине кишечной трубки. Спецификация ДЭ вдоль передне-задней оси зародыша обеспечивается градиентом концентрации морфогенов семейств WNT, BMP, FGF, а также их антагонистов: SFRP-1, -2, -3, -5, CRESCENT, DKK1 (антагонисты WNT) и CHORDIN, NOGGIN (антагонисты BMP). В области высоких концентраций WNT, BMP и FGF формируется задний отдел кишки зародыша, в области низких концентраций – передний [28, 29]. Основным маркером передней кишки является экспрессия транскрипционного фактора SOX2, задней кишки – экспрессия транскрипционного фактора CDX2 [30]. В регионализации экспрессии различных транскрипционных факторов по длине первичной кишки важную роль играет ретиноевая кислота (РК) – производное витамина А, синтезируемое клетками мезодермы [31]. Градиент концентраций РК распределяется вдоль передне-задней оси всего зародыша, от будущей глотки, в которой практически или полностью отсутствует РК, до области средней и задней кишки, в которой детектируется высокая концентрация РК [32]. У мышей с нарушением синтеза РК не происходит компартментализации передней кишки [33]. На более поздних стадиях развития при закладке зачатков органов в области глоточного аппарата концентрация РК контролирует положение границ формирующихся органов. Так, повышение концентрации РК в передней части глоточных дуг индуцирует закладку более отдаленных структур [34]. Значительную роль в реципрокных эпителиально-мезенхимальных взаимодействиях играет высококонсервативный морфоген SHH, секретируемый клетками энтодермы по всей длине кишечной трубки [35]. SHH активирует в мезенхимальных клетках экспрессию фактора BMP-4 и гомеобокс-содержащих транскрипционных факторов, кодируемых консервативными Hox-генами, которые контролируют регионализацию первичной кишки. В частности, Hoxa3 и Hoxb4 специфически экспрессируются в передней кишке, Hoxc5 и Hoxa13 – в области средней и задней кишки [36].
Установление дорсо-вентральной (спинно-брюшной) полярности передней кишки предшествует формированию глоточного аппарата и сегрегации легочных почек, пищевода и трахеи из клеток вентральной ДЭ первичной кишки. Дорсо-вентральная полярность передней кишки устанавливается в ответ на действие сигналов WNT, BMP и FGF от клеток подлежащей мезодермы. Факторы WNT2, WNT2B активируют экспрессию транскрипционных факторов NKX2.1, NKX2.5 и PAX1 в вентральной части передней кишки [37]. Экспрессия Nkx2.1 в вентральной области поддерживается в результате BMP4-опосредованного ингибирования экспрессии транскрипционного фактора Sox2, маркирующего дорсальные структуры передней кишки. Также клетки мезодермы экспрессируют фактор NOGGIN, являющийся антагонистом BMP4, в результате чего в подлежащих энтодермальных клетках не блокируется экспрессия Sox2 и происходит дальнейшее разделение структур на спинные и брюшные отделы. Кроме того, секреция WNT клетками дорсальной мезодермы ингибирует экспрессию транскрипционного фактора Nkx2.1 в спинной части передней кишки. Дифференциальная экспрессия и взаимное ингибирование NKX2.1 и SOX2 также участвуют в формировании спинно-брюшной полярности кишки [38–40].
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ФОРМИРОВАНИЯ ПАРАЩИТОВИДНЫХ ЖЕЛЕЗ in vivo
Паращитовидные железы формируются из энтодермы глоточных мешков зародыша. Наиболее важным фактором в формировании всего глоточного аппарата является консервативный транскрипционный фактор TBX1. Нарушения гена Tbx1 могут приводить к развитию синдрома делеции 22-й хромосомы (синдром Ди Джорджи) [41]. Нокаутные по Tbx1 мыши не имеют тимуса и паращитовидных желез и погибают после рождения в результате дефектов развития сердца, скелета и мускулатуры лица [42, 43]. Показано, что экспрессия Tbx1 в глоточном аппарате регулируется фактором SHH, однако механизм такой регуляции остается неизвестным [44]. Экспрессия Tbx1 в энтодерме активирует экспрессию факторов WNT11R и FGF8A в подлежащих клетках мезодермы, которые, в свою очередь, способствуют морфогенезу энтодермы глоточных мешков [45]. Закладка зачатков паращитовидных желез контролируется факторами семейства FGF (FGF8, FRS2α), BMP (BMP4), SHH, а также Hox-генами [46, 47]. Клетки переднего дорсального эпителия 3-го глоточного мешка, экспрессирующие факторы FGF8 и PAX1, дают начало общему зачатку тимуса и нижней пары паращитовидных желез, который подразделяется на паратиреоидный и тимусный домены. Такое разделение обеспечивается реципрокным взаимодействием сигнальных путей SHH, BMP2/4 и FGF8/10, индуцирующих формирование паращитовидных желез и тимуса [48]. Основным маркером тимусного домена является транскрипционный фактор FOXN1. В паратиреоидном домене экспрессируется транскрипционный фактор GCM2, который является исключительным маркером как предшественников, так и зрелых паратиреоидных клеток и необходим для их дифференцировки и выживания [49, 50]. Потеря GCM2 приводит к апоптозу паратиреоидных предшественников [51]. Мутации Gcm2 являются одной из причин развития семейных форм изолированного гипопаратиреоза и гиперпаратиреоза [52, 53]. В некоторых работах продемонстрировано изменение уровня экспрессии Gcm2 в аденомах паращитовидных желез [54].
Раннюю дифференцировку паратиреоидных клеток направляет SHH. У Shh–/Shh– мышей не формируется зачаток паращитовидных желез и полностью отсутствует экспрессия Gcm2 [55]. Кандидатным фактором, опосредующим влияние SHH на органогенез третьего и четвертого глоточных мешков, является TBX1 [56, 57]. Предполагается, что регуляторный путь Shh-Tbx1-Gcm2 отвечает за первичную детерминацию паратиреоидной судьбы клеток. Кроме того, TBX1 взаимодействует с транскрипционным фактором FOXI3, участвующим в развитии глоточного аппарата и формировании тимуса и паращитовидных желез из энтодермы третьей пары глоточных мешков. Foxi3 экспрессируется в энтодерме глоточных мешков и эктодерме глоточного аппарата мыши примерно в то же время, что и Tbx1 [58]. Инактивация Foxi3 в TBX1-домене глоточных мешков приводит к аплазии тимуса и паращитовидных желез [59]. Foxi3–/Foxi3– мыши нежизнеспособны и погибают внутриутробно или вскоре после рождения в результате нарушения формирования и сегментации глоточного аппарата и, как следствие, развития тяжелых дефектов строения черепа и лица [60]. Формирование общего зачатка тимуса и нижней пары паращитовидных желез контролируется регуляторной сетью консервативных транскрипционных факторов HOXA3, PBX1, EYA1, SIX1/SIX4, PAX1/PAX9, нарушение которых приводит к гипоплазии или аплазии тимуса и паращитовидных желез. У Hoxa3–/Hoxa3– мышей полностью отсутствует зачаток паращитовидных желез и тимуса [61]. У Pbx1–/Pbx1– мышей наблюдается гипоплазия паращитовидных желез и тимуса и снижение экспрессии Tbx1 и Gcm2 [62]. У Eya1–/Eya1– мышей нет тимуса и паращитовидных желез. У гомозиготных мышей с нокаутом гена Six1 отсутствует только тимус, поскольку экспрессия Gcm2 инициируется, но при этом не поддерживается далее в ходе развития [63]. Экспрессия транскрипционного фактора PAX1 в третьем глоточном мешке зависит от экспрессии Eya1 и Six1. У Pax1–/Pax1– мышей снижен уровень экспрессии Gcm2 и наблюдается гипоплазия паращитовидных желез [61]. Отделение общего зачатка паращитовидных желез и тимуса от стенок глоточного мешка происходит в результате апоптоза клеток под действием FGF, BMP4 и других сигналов, поступающих из подлежащей мезенхимы [64–66].
Важную роль в сегрегации и миграции паратиреоидных предшественников играет транскрипционный фактор MAFB. У гетерозиготных по MafB мышей паращитовидные железы ошибочно располагаются между тимусом и щитовидной железой, а у гомозигот по MafB паратиреоидные клетки не мигрируют и остаются связанными с тимусом [67]. Экспрессия MafB и дальнейшая дифференцировка и созревание паратиреоидных клеток регулируются взаимосвязанным каскадом факторов GATA3 и GCM2 [68]. Наиболее ранним фактором является GATA3, за ним следует GCM2 и после MAFB. Нокаут Gata3 у мышей приводит к нарушению формирования паращитовидных желез и значительным дефектам развития; у гетерозиготных по Gata3 мышей паращитовидные железы формируются, но наблюдается их частичная дисфункция [69]. GCM2 инициирует экспрессию основных маркеров зрелых паратиреоидных клеток, таких как паратиреоидный гормон (ПТГ, PTH) PTH и кальций-чувствительный рецептор (CАSR) [70]. Показано, что мутации генов Gcm2, Gata3 и Tbx1 у мыши и человека приводят к развитию гипопаратиреоидизма [71, 72]. Экспрессия Gata3, Gcm2 и MafB в паратиреоидных клетках наблюдается и после завершения морфогенеза [67, 73]. В постнатальном периоде данные факторы физически взаимодействуют друг с другом, вызывая синергичную активацию промотора гена Pth в зрелых паратиреоидных клетках [74].
ДИФФЕРЕНЦИРОВКА ПСК В ПАРАТИРЕОИДНОМ НАПРАВЛЕНИИ in vitro
Дифференцировка ПСК в паратиреоидном направлении in vitro, в соответствии с развитием in vivo, предполагает поэтапное получение клеток ДЭ, их дифференцировку в клетки антериорной части передней кишки, далее в клетки вентрального отдела и затем в предшественники паратиреоидных клеток (пре-ПТК) с последующим размножением и созреванием.
Протоколы получения клеток ДЭ в настоящее время хорошо отработаны. Большинство из них основаны на активации сигнальных путей WNT и TGFβ c помощью Activin A, выполняющего роль эмбрионального фактора NODAL, и ингибиторов GSK3β (CHIR99021 и др.) соответственно [75]. Уже доступны коммерческие наборы для эффективной дифференцировки ПСК в клетки ДЭ, такие как STEMdiff Definitive Endoderm Kit (StemCell Technologies), PSC Definitive Endoderm Induction Kit (Thermo Fisher Scientific), StemXVivo Endoderm Kit (R&D Systems) и др. В качестве основных маркеров дифференцировки в полученных клетках ДЭ оценивают экспрессию генов Sox17, Foxa2, Cxcr4, c-Kit, EpCAM, Mixl1 (рис. 1). В настоящее время существуют стратегии по отбору ИПСК с наибольшим энтодермальным дифференцировочным потенциалом в связи с клональными различиями ИПСК человека в предрасположенности к дифференцировке in vitro [76, 77]. Кроме того, недавно с помощью полногеномного CRISPR-скрининга было обнаружено, что ингибирование сигнального пути JNK-JUN, опосредованно влияющего на выход ПСК из плюрипотентного состояния, значительно повышает эффективность получения ДЭ и ее производных [78]. На сегодняшний день также разработан ряд протоколов по получению клеток вентрального отдела энтодермы передней кишки [79–81]. Тем не менее эффективность такой дифференцировки варьирует среди линий ИПСК в зависимости от генетических и эпигенетических особенностей, а также способа репрограммирования [82].
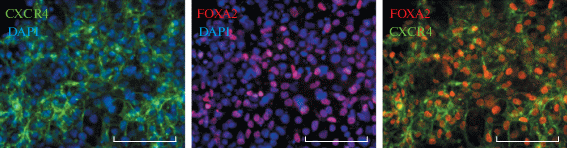
Рис. 1.
Пример успешной дифференцировки ИПСК человека в клетки ДЭ. Иммуноцитохимическое окрашивание клеток ДЭ на энтодермальные маркеры CXCR4 (зеленый канал) и FOXA2 (красный канал). Визуализация ядер с помощью красителя DAPI (синий канал). Масштабная линейка – 100 мкм.
Что касается дальнейшей дифференцировки коммитированных энтодермальных клеток в паратиреоидном направлении, в настоящее время отсутствуют эффективные и воспроизводимые способы получения паратгормон-продуцирующих клеток из ПСК человека. Опубликовано несколько протоколов получения паратиреоидных клеток, основанных на индукции экспрессии генов Gcm2, Casr и Pth в коммитированных энтодермальных клетках с помощью факторов Activin A, FGF8 и SHH. Первый опубликованный протокол паратиреоидной дифференцировки основан на получении ПТГ-секретирующих клеток через стадию ДЭ из ЭСК человека c помощью одного фактора Activin A в присутствии низких концентраций эмбриональной телячьей сыворотки [83]. В дальнейшем протокол был модифицирован той же группой авторов путем добавления фактора SHH, и оценена индукция экспрессии Pth в дифференцированных клетках [84]. Основными недостатками предложенного подхода являются плохая воспроизводимость протокола и использование ЭСК, культивируемых на фидере. В 2011 г. другая группа показала, что ингибирование BMP и TGF-β-сигнальных путей при дифференцировке ПСК в энтодермальном направлении увеличивает эффективность дифференцировки в клетки антериорной энтодермы передней кишки, которые могут служить источником клеток паратиреоидного ряда. Однако предложенная схема с использованием дополнительных факторов SHH и/или FGF8 для индукции паратиреоидной дифференцировки обеспечивала лишь незначительное повышение экспрессии Gcm2 по сравнению с контролем [85].
Таким образом, на сегодняшний день актуальной задачей является разработка воспроизводимых и эффективных методов получения ПТГ-секретирующих клеток из ПСК in vitro. Для получения клеток паратиреоидного ряда может быть применен подход с использованием технологии CRISPR/Cas9 SAM, предполагающий специфическую контролируемую активацию ключевых регуляторных генов паратиреоидной дифференцировки в коммитированных энтодермальных клетках-предшественниках (рис. 2). Поскольку получение клеток ДЭ и более поздних стадий развития переднего отдела первичной кишки в настоящее время не представляет значительных трудностей, основными мишенями генетически программируемой паратиреоидной дифференцировки могут стать гены Gata3, Shh, Tbx1 и Gcm2, являющиеся ключевыми индукторами паратиреоидной дифференцировки in vivo.
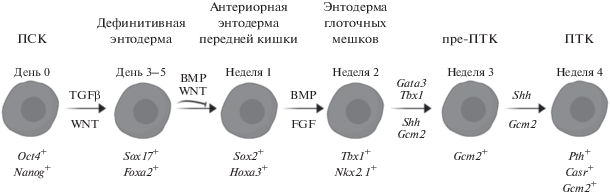
Рис. 2.
Основные этапы дифференцировки ПСК человека в паратиреоидном направлении путем индукции экспрессии генов Gata3, Tbx1, Shh и Gcm2 в коммитированных энтодермальных клетках. Внизу указаны основные гены-маркеры соответствующих стадий дифференцировки. ПСК – плюрипотентные стволовые клетки, пре-ПТК – предшественники паратиреоидных клеток, ПТК – паратиреоидные клетки.
Работа выполнена в рамках научного проекта РФФИ № 19-015-00209-A.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Zhang Y., Yin C., Zhang T. et al. CRISPR/gRNA-directed synergistic activation mediator (SAM) induces specific, persistent and robust reactivation of the HIV-1 latent reservoirs // Sci. Reports. 2015. V. 5. № 1. Article number 16277. https://doi.org/10.1038/srep16277
Xiao X., Guo P., Shiota C. et al. Endogenous reprogramming of alpha cells into beta cells, induced by viral gene therapy, reverses autoimmune diabetes // Cell Stem Cell. 2018. V. 22. № 1. P. 78–90. https://doi.org/10.1016/j.stem.2017.11.020
Nowotschin S., Hadjantonakis A.-K., Campbell K. The endoderm: a divergent cell lineage with many commonalities // Development. 2019. V. 146. № 11. dev150920. https://doi.org/10.1242/dev.150920
Barresi M.G.F., Gilbert S.F. Developmental Biology. 12th ed. Oxford: Univ. Press, 2019. 888 p.
Adams M.S., Bronner-Fraser M. Review: The role of neural crest cells in the endocrine system // Endocrine Pathol. 2009. V. 20. № 2. P. 92–100. https://doi.org/10.1007/s12022-009-9070-6
De Felice M., Di Lauro R. Thyroid development and its disorders: genetics and molecular mechanisms // Endocrine Rev. 2004. V. 25. № 5. P. 722–746. https://doi.org/10.1210/er.2003-0028
Nilsson M., Fagman H. Development of the thyroid gland // Development. 2017. V. 144. № 12. P. 2123–2140. https://doi.org/10.1242/dev.145615
Sadler T.W. Langman’s Medical Embryology. 14th ed. Lippincott Williams & Wilkins, 2018. 456 p.
Pan F.C., Brissova M. Pancreas development in humans // Current Opinion in Endocrinology, Diabetes, and Obesity. 2014. V. 21. № 2. P. 77–82. https://doi.org/10.1097/MED.0000000000000047
Jennings R.E., Berry A.A., Strutt J.P. et al. Human pancreas development // Development. 2015. V. 142. № 18. P. 3126–3137. https://doi.org/10.1242/dev.120063
Wilkinson D.G., Bhatt S., Herrmann B.G. Expression pattern of the mouse T gene and its role in mesoderm formation // Nature. 1990. V. 343. № 6259. P. 657–659. https://doi.org/10.1038/343657a0
Viotti M., Nowotschin S., Hadjantonakis A.-K. SOX17 links gut endoderm morphogenesis and germ layer segregation // Nat. Cell Biol. 2014. V. 16. № 12. P. 1146–1156. https://doi.org/10.1038/ncb3070
Lickert H., Kutsch S., Kanzler B. et al. Formation of multiple hearts in mice following deletion of beta-catenin in the embryonic endoderm // Developmental Cell. 2002. V. 3. № 2. P. 171–181. https://doi.org/10.1016/s1534-5807(02)00206-x
Tada S., Era T., Furusawa C. et al. Characterization of mesendoderm: a diverging point of the definitive endoderm and mesoderm in embryonic stem cell differentiation culture // Development. 2005. V. 132. № 19. P. 4363–4374. https://doi.org/10.1242/dev.02005
David N.B., Rosa F.M. Cell autonomous commitment to an endodermal fate and behaviour by activation of Nodal signaling // Development. 2001. V. 128. № 20. P. 3937–3947.
Lowe L.A., Yamada S., Kuehn M.R. Genetic dissection of nodal function in patterning the mouse embryo // Development. 2001. V. 128. № 10. P. 1831–1843.
Shen M.M. Nodal signaling: developmental roles and regulation // Development. 2007. V. 134. № 6. P. 1023–1034. https://doi.org/10.1242/dev.000166
Charney R.M., Forouzmand E., Cho J.S. et al. Foxh1 occupies cis-regulatory modules prior to dynamic transcription factor interactions controlling the mesendoderm gene program // Developmental Cell. 2017. V. 40. № 6. P. 595–607. E4. https://doi.org/10.1016/j.devcel.2017.02.017
Yang Y.-P., Anderson R.M., Klingensmith J. BMP antagonism protects Nodal signaling in the gastrula to promote the tissue interactions underlying mammalian forebrain and craniofacial patterning // Hum. Mol. Genet. 2010. V. 19. № 15. P. 3030–3042. https://doi.org/10.1093/hmg/ddq208
Loh K.M., Ang L.T., Zhang J. et al. Efficient endoderm induction from human pluripotent stem cells by logically directing signals controlling lineage bifurcations // Cell Stem Cell. 2014. V. 14. № 2. P. 237–252. https://doi.org/10.1016/j.stem.2013.12.007
Vincent S.D., Dunn N.R., Hayashi S. et al. Cell fate decisions within the mouse organizer are governed by graded Nodal signals // Genes & Development. 2003. V. 17. № 13. P. 1646–1662. https://doi.org/10.1101/gad.1100503
Lenhart K.F., Holtzman N.G., Williams J.R. et al. Integration of nodal and BMP signals in the heart requires FoxH1 to create left-right differences in cell migration rates that direct cardiac asymmetry // PLoS Genet. 2013. V. 9. № 1. P. e1003109. https://doi.org/10.1371/journal.pgen.1003109
Kiecker C., Bates T., Bell E. Molecular specification of germ layers in vertebrate embryos // Cell. Mol. Life Sci.: CMLS. 2016. V. 73. № 5. P. 923–947. https://doi.org/10.1007/s00018-015-2092-y
Kanai-Azuma M., Kanai Y., Gad J.M. et al. Depletion of definitive gut endoderm in Sox17-null mutant mice // Development. 2002. V. 129. № 10. P. 2367–2379.
Viotti M., Niu L., Shi S.-H. et al. Role of the gut endoderm in relaying left-right patterning in mice // PLoS Biol. 2012. V. 10. № 3. P. e1001276. https://doi.org/10.1371/journal.pbio.1001276
McKnight K.D., Hou J., Hoodless P.A. Foxh1 and Foxa2 are not required for formation of the midgut and hindgut definitive endoderm // Developmental Biol. 2010. V. 337. № 2. P. 471–481. https://doi.org/10.1016/j.ydbio.2009.10.040
Davenport C., Diekmann U., Budde I. et al. Anterior-posterior patterning of definitive endoderm generated from human embryonic stem cells depends on the differential signaling of retinoic acid, Wnt-, and BMP-signaling // Stem Cells. 2016. V. 34. № 11. P. 2635–2647. https://doi.org/10.1002/stem.2428
Zorn A.M., Wells J.M. Vertebrate endoderm development and organ formation // Annual Rev. Cell and Developmental Biol. 2009. V. 25. P. 221–251. https://doi.org/10.1146/annurev.cellbio.042308.113344
Gordillo M., Evans T., Gouon-Evans V. Orchestrating liver development // Development. 2015. V. 142. № 12. P. 2094–2108. https://doi.org/10.1242/dev.114215
Sherwood R.I., Chen T.-Y.A., Melton D.A. Transcriptional dynamics of endodermal organ formation // Developmental Dynamics: An Official Publ. Am. Association of Anatomists. 2009. V. 238. № 1. P. 29–42. https://doi.org/10.1002/dvdy.21810
Mark M., Ghyselinck N.B., Chambon P. Function of retinoic acid receptors during embryonic development // Nucl. Receptor Signaling. 2009. V. 7. P. e002. https://doi.org/10.1621/nrs.07002
Bayha E., Jørgensen M.C., Serup P. et al. Retinoic acid signaling organizes endodermal organ specification along the entire antero-posterior axis // PLoS One. 2009. V. 4. № 6. P. e5845. https://doi.org/10.1371/journal.pone.0005845
Wang Z., Dollé P., Cardoso W.V. et al. Retinoic acid regulates morphogenesis and patterning of posterior foregut derivatives // Developmental Biol. 2006. V. 297. № 2. P. 433–445. https://doi.org/10.1016/j.ydbio.2006.05.019
Wendling O., Dennefeld C., Chambon P. et al. Retinoid signaling is essential for patterning the endoderm of the third and fourth pharyngeal arches // Development. 2000. V. 127. № 8. P. 1553–1562.
Roberts D.J., Johnson R.L., Burke A.C. et al. Sonic hedgehog is an endodermal signal inducing Bmp-4 and Hox genes during induction and regionalization of the chick hindgut // Development. 1995. V. 121. № 10. P. 3163–3174.
Faure S., de Santa Barbara P. Molecular embryology of the foregut // J. Pediatric Gastroenterol. and Nutrition. 2011. V. 52. P. S2–S3. https://doi.org/10.1097/MPG.0b013e3182105a1a
Goss A.M., Tian Y., Tsukiyama T. et al. Wnt2/2b and beta-catenin signaling are necessary and sufficient to specify lung progenitors in the foregut // Developmental Cell. 2009. V. 17. № 2. P. 290–298. https://doi.org/10.1016/j.devcel.2009.06.005
Domyan E.T., Ferretti E., Throckmorton K. et al. Signaling through BMP receptors promotes respiratory identity in the foregut via repression of Sox2 // Development. 2011. V. 138. № 5. P. 971–981. https://doi.org/10.1242/dev.053694
Billmyre K.K., Hutson M., Klingensmith J. One shall become two: separation of the esophagus and trachea from the common foregut tube // Developmental Dynamics: An Official Publ. Am. Association of Anatomists. 2015. V. 244. № 3. P. 277–288. https://doi.org/10.1002/dvdy.24219
Minoo P., Su G., Drum H. et al. Defects in tracheoesophageal and lung morphogenesis in Nkx2.1(–/–) mouse embryos // Developmental Biol. 1999. V. 209. № 1. P. 60–71. https://doi.org/10.1006/dbio.1999.9234
Lindsay E.A., Vitelli F., Su H. et al. Tbx1 haploinsufficiency in the DiGeorge syndrome region causes aortic arch defects in mice // Nature. 2001. V. 410. № 6824. P. 97–101. https://doi.org/10.1038/35065105
Kelly R.G., Jerome-Majewska L.A., Papaioannou V.E. The del22q11.2 candidate gene Tbx1 regulates branchiomeric myogenesis // Hum. Mol. Genet. 2004. V. 13. № 22. P. 2829–2840. https://doi.org/10.1093/hmg/ddh304
Zhang Z., Huynh T., Baldini A. Mesodermal expression of Tbx1 is necessary and sufficient for pharyngeal arch and cardiac outflow tract development // Development. 2006. V. 133. № 18. P. 3587–3595. https://doi.org/10.1242/dev.02539
Garg V., Yamagishi C., Hu T. et al. Tbx1, a DiGeorge syndrome candidate gene, is regulated by Sonic Hedgehog during pharyngeal arch development // Developmental Biol. 2001. V. 235. № 1. P. 62–73. https://doi.org/10.1006/dbio.2001.0283
Choe C.P., Crump J.G. Tbx1 controls the morphogenesis of pharyngeal pouch epithelia through mesodermal Wnt11r and Fgf8a // Development. 2014. V. 141. № 18. P. 3583–3593. https://doi.org/10.1242/dev.111740
Kameda Y., Ito M., Nishimaki T. et al. FRS2alpha is required for the separation, migration, and survival of pharyngeal-endoderm derived organs including thyroid, ultimobranchial body, parathyroid, and thymus // Developmental Dynamics: An Official Publ. Am. Association of Anatomists. 2009. V. 238. № 3. P. 503–513. https://doi.org/10.1002/dvdy.21867
Grevellec A., Tucker A.S. The pharyngeal pouches and clefts: development, evolution, structure and derivatives // Seminars in Cell & Developmental Biol. 2010. V. 21. № 3. P. 325–332. https://doi.org/10.1016/j.semcdb.2010.01.022
Gordon J., Manley N.R. Mechanisms of thymus organogenesis and morphogenesis // Development. 2011. V. 138. № 18. P. 3865–3878. https://doi.org/10.1242/dev.059998
Gordon J., Bennett A.R., Blackburn C.C. et al. Gcm2 and Foxn1 mark early parathyroid- and thymus-specific domains in the developing third pharyngeal pouch // Mechanisms of Development. 2001. V. 103. № 1–2. P. 141–143. https://doi.org/10.1016/s0925-4773(01)00333-1
Kebebew E., Peng M., Wong M.G. et al. GCMB gene, a master regulator of parathyroid gland development, expression, and regulation in hyperparathyroidism // Surgery. 2004. V. 136. № 6. P. 1261–1266. https://doi.org/10.1016/j.surg.2004.06.056
Manley N.R. Embryology of the parathyroid glands // Hypoparathyroidism. Springer-Verlag Italia, 2015. P. 11–18. https://doi.org/10.1007/978-88-470-5376-2_2
Maret A., Ding C., Kornfield S.L. et al. Analysis of the GCM2 gene in isolated hypoparathyroidism: a molecular and biochemical study // The J. Clin. Endocrinol. and Metabolism. 2008. V. 93. № 4. P. 1426–1432. https://doi.org/10.1210/jc.2007-1783
Guan B., Welch J.M., Sapp J.C. et al. GCM2-activating mutations in familial isolated hyperparathyroidism // The Am. J. Hum. Genet. 2016. V. 99. № 5. P. 1034–1044. https://doi.org/10.1016/j.ajhg.2016.08.018
Correa P., Akerström G., Westin G. Underexpression of Gcm2, a master regulatory gene of parathyroid gland development, in adenomas of primary hyperparathyroidism // Clin. Endocrinol. 2002. V. 57. № 4. P. 501–505. https://doi.org/10.1046/j.1365-2265.2002.01627.x
Grevellec A., Graham A., Tucker A.S. Shh signalling restricts the expression of Gcm2 and controls the position of the developing parathyroids // Developmental Biol. 2011. V. 353. № 2. P. 194–205. https://doi.org/10.1016/j.ydbio.2011.02.012
Yamagishi H. Tbx1 is regulated by tissue-specific forkhead proteins through a common Sonic hedgehog-responsive enhancer // Genes & Development. 2003. V. 17. № 2. P. 269–281. https://doi.org/10.1101/gad.1048903
Bain V.E., Gordon J., O’Neil J.D. et al. Tissue-specific roles for sonic hedgehog signaling in establishing thymus and parathyroid organ fate // Development. 2016. V. 143. № 21. P. 4027–4037. https://doi.org/10.1242/dev.141903
Ohyama T., Groves A.K. Expression of mouse Foxi class genes in early craniofacial development // Developmental Dynamics. 2004. V. 231. № 3. P. 640–646. https://doi.org/10.1002/dvdy.20160
Hasten E., Morrow B.E. Tbx1 and Foxi3 genetically interact in the pharyngeal pouch endoderm in a mouse model for 22q11.2 deletion syndrome // PLoS Genet. 2019. V. 15. № 8. P. e1008301. https://doi.org/10.1371/journal.pgen.1008301
Edlund R.K., Ohyama T., Kantarci H. et al. Foxi transcription factors promote pharyngeal arch development by regulating formation of FGF signaling centers // Developmental Biol. 2014. V. 390. № 1. P. 1–13. https://doi.org/10.1016/j.ydbio.2014.03.004
Su D., Ellis S., Napier A. et al. Hoxa3 and Pax1 regulate epithelial cell death and proliferation during thymus and parathyroid organogenesis // Developmental Biol. 2001. V. 236. № 2. P. 316–329. https://doi.org/10.1006/dbio.2001.0342
Manley N.R., Selleri L., Brendolan A. et al. Abnormalities of caudal pharyngeal pouch development in Pbx1 knockout mice mimic loss of Hox3 paralogs // Developmental Biol. 2004. V. 276. № 2. P. 301–312. https://doi.org/10.1016/j.ydbio.2004.08.030
Zou D., Silvius D., Davenport J. et al. Patterning of the third pharyngeal pouch into thymus/parathyroid by Six and Eya1 // Developmental Biol. 2006. V. 293. № 2. P. 499–512. https://doi.org/10.1016/j.ydbio.2005.12.015
Gordon J., Wilson V.A., Blair N.F. et al. Functional evidence for a single endodermal origin for the thymic epithelium // Nat. Immunology. 2004. V. 5. № 5. P. 546–553. https://doi.org/10.1038/ni1064
Gardiner J.R., Jackson A.L., Gordon J. et al. Localised inhibition of FGF signalling in the third pharyngeal pouch is required for normal thymus and parathyroid organogenesis // Development. 2012. V. 139. № 18. P. 3456–3466. https://doi.org/10.1242/dev.079400
Gordon J., Patel S.R., Mishina Y. et al. Evidence for an early role for BMP4 signaling in thymus and parathyroid morphogenesis // Developmental Biol. 2010. V. 339. № 1. P. 141–154. https://doi.org/10.1016/j.ydbio.2009.12.026
Kamitani-Kawamoto A., Hamada M., Moriguchi T. et al. MafB interacts with Gcm2 and regulates parathyroid hormone expression and parathyroid development // J. Bone and Mineral Research: The Official J. Am. Society for Bone and Mineral Research. 2011. V. 10. № 26. P. 2463–2472. https://doi.org/10.1002/jbmr.458
Naveh-Many T., Silver J. Transcription factors that determine parathyroid development power PTH expression // Kidney Internat. 2018. V. 93. № 1. P. 7–9. https://doi.org/10.1016/j.kint.2017.08.026
Grigorieva I.V., Mirczuk S., Gaynor K.U. et al. Gata3-deficient mice develop parathyroid abnormalities due to dysregulation of the parathyroid-specific transcription factor Gcm2 // J. Clin. Investigation. 2010. V. 120. № 6. P. 2144–2155. https://doi.org/10.1172/JCI42021
Peissig K., Condie B.G., Manley N.R. Embryology of the parathyroid glands // Endocrinology and Metabolism Clinics of North America. 2018. V. 47. № 4. P. 733–742. https://doi.org/10.1016/j.ecl.2018.07.002
Van Esch H., Groenen P., Nesbit M.A. et al. GATA3 haplo-insufficiency causes human HDR syndrome // Nature. 2000. V. 406. № 6794. P. 419–422. https://doi.org/10.1038/35019088
Grigorieva I.V., Thakker R.V. Transcription factors in parathyroid development: lessons from hypoparathyroid disorders // Annals N.Y. Acad. Sci. 2011. V. 1237. № 1. P. 24–38. https://doi.org/10.1111/j.1749-6632.2011.06221.x
Ordóñez N.G. Value of GATA3 immunostaining in tumor diagnosis: a review // Adv. Anatomic Pathol. 2013. V. 20. № 5. P. 352–360. https://doi.org/10.1097/PAP.0b013e3182a28a68
Han S.-I., Tsunekage Y., Kataoka K. Gata3 cooperates with Gcm2 and MafB to activate parathyroid hormone gene expression by interacting with SP1 // Mol. Cell. Endocrinol. 2015. V. 411. P. 113–120. https://doi.org/10.1016/j.mce.2015.04.018
Yiangou L., Ross A.D.B., Goh K.J. et al. Human pluripotent stem cell-derived endoderm for modeling development and clinical applications // Cell Stem Cell. 2018. V. 22. № 4. P. 485–499. https://doi.org/10.1016/j.stem.2018.03.016
Cahan P., Daley G.Q. Origins and implications of pluripotent stem cell variability and heterogeneity // Nat. Rev. Mol. Cell Biol. 2013. V. 14. № 6. P. 357–368. https://doi.org/10.1038/nrm3584
Siller R., Naumovska E., Mathapati S. et al. Development of a rapid screen for the endodermal differentiation potential of human pluripotent stem cell lines // Sci. Reports. 2016. V. 6. Article number 37178. https://doi.org/10.1038/srep37178
Li Q.V., Dixon G., Verma N. et al. Genome-scale screens identify JNK-JUN signaling as a barrier for pluripotency exit and endoderm differentiation // Nat. Genet. 2019. V. 51. P. 999–1010. https://doi.org/10.1038/s41588-019-0408-9
Mou H., Zhao R., Sherwood R. et al. Generation of multipotent lung and airway progenitors from mouse ESCs and patient-specific cystic fibrosis iPSCs // Cell Stem Cell. 2012. V. 10. № 5. P. 385–397. https://doi.org/10.1016/j.stem.2012.01.018
Wong A.P., Bear C.E., Chin S. et al. Directed differentiation of human pluripotent stem cells into mature airway epithelia expressing functional CFTR protein // Nat. Biotechnol. 2012. V. 30. № 9. P. 876–882. https://doi.org/10.1038/nbt.2328
Kearns N.A., Genga R.M., Ziller M. et al. Generation of organized anterior foregut epithelia from pluripotent stem cells using small molecules // Stem Cell Res. 2013. V. 11. № 3. P. 1003–1012. https://doi.org/10.1016/j.scr.2013.06.007
Huang S.X., Islam M.N., O’Neill J. et al. Efficient generation of lung and airway epithelial cells from human pluripotent stem cells // Nat. Biotechnol. 2014. V. 32. № 1. P. 84–91. https://doi.org/10.1038/nbt.2754
Bingham E.L., Cheng S.-P., Woods Ignatoski K.M. et al. Differentiation of human embryonic stem cells to a parathyroid-like phenotype // Stem Cells and Development. 2009. V. 18. № 7. P. 1071–1080. https://doi.org/10.1089/scd.2008.0337
Woods Ignatoski K.M., Bingham E.L., Frome L.K. et al. Differentiation of precursors into parathyroid-like cells for treatment of hypoparathyroidism // Surgery. 2010. V. 148. № 6. P. 1186–1189. Discussion 1189–1190. https://doi.org/10.1016/j.surg.2010.09.021
Green M.D., Chen A., Nostro M.-C. et al. Generation of anterior foregut endoderm from human embryonic and induced pluripotent stem cells // Nat. Biotechnol. 2011. V. 29. № 3. P. 267–272. https://doi.org/10.1038/nbt.1788
Дополнительные материалы отсутствуют.


