Генетика, 2021, T. 57, № 3, стр. 247-254
Ген Clock, мелатонин и цикл “сон–бодрствование”
Н. В. Семёнова 1, *, И. М. Мадаева 1, Л. И. Колесникова 1
1 Научный центр проблем здоровья семьи и репродукции человека
664003 Иркутск, Россия
* E-mail: natkor_84@mail.ru
Поступила в редакцию 24.04.2020
После доработки 07.08.2020
Принята к публикации 25.08.2020
Аннотация
В обзоре рассмотрена роль гена Clock и мелатонина как участников циркадных ритмов человека. Представлены результаты исследований по ассоциации полиморфных вариантов гена Clock и цикла “сон–бодрствование”, а также циркадных ритмов секреции мелатонина при разных хронотипах и наличии инсомнических нарушений. Рассмотрена гипотеза о роли полиморфного маркера 3111Т/С гена Clock в формировании инсомнии у женщин европеоидной расы, проживающих на территории Восточной Сибири.
В настоящее время распространенность нарушений цикла “сон–бодрствование” варьирует от 5.6 до 73.8% и зависит от возраста, гендерной и этнической принадлежности [1]. Коморбидность данных нарушений с другими патологическими состояниями и медико-социальные последствия, к которым они приводят [2], требуют разработки эффективных методов их диагностики и коррекции, платформой для чего являются результаты фундаментальных исследований, изучающих молекулярные механизмы циркадных ритмов.
ГЕН CLOCK КАК УЧАСТНИК ЦИРКАДНЫХ РИТМОВ У МЛЕКОПИТАЮЩИХ
Первыми научными исследованиями, показавшими существование генетического механизма циркадных ритмов, стали работы американских ученых, проведенные в 60–70-х гг. XX в. [3]. До настоящего времени интерес к изучению данного вопроса не угасает, а наоборот – возрастает с каждым годом, свидетельством чего является огромное количество исследований. Накопленные к настоящему времени данные свидетельствуют о том, что одним из циркадных генов, управляющих значительным рядом метаболических и физиологических функций в организме, в том числе циклом “сон–бодрствование”, является ген Clock (Сircadian locomoter output cycles protein kaput), впервые идентифицированный в 1997 г. J. Takahashi. Участие этого гена в регуляции циркадных ритмов млекопитающих отмечено в петлях обратной связи транскрипции–трансляции и происходит посредством димеризации его белкового продукта с белком BMAL1 (Brain muscle arnt-like) в клеточном ядре [4].
В настоящее время у млекопитающих выявлены три петли обратной связи транскрипции–трансляции. В первой петле белковый гетеродимер CLOCK:BMAL1 активирует транскрипцию генов Cryptochrome (Cry1, Cry2) и Period (Per1, Per2, Per3) через связывание с последовательностью E-box генов-мишеней. Результатом этого является постепенная аккумуляция в цитоплазме белков CRY и PER, и при достижении критического уровня последнего к концу дня происходит его димеризация с образованием гетеродимеров PER:PER или PER:CRY. Фосфорилирование белка PER происходит с помощью киназы СК1 (Casein kinase 1 family of kinases) с последующим образованием комплекса CRY:PER:CK1 с максимальным уровнем в ночное время, предотвращающего дальнейшее фосфорилирование и деградацию в цитоплазме белка PER. В данном комплексе фосфорилирование белков PER и CRY осуществляется другими киназами, позволяя комплексу транслоцироваться в ядро и ингибировать эффект позитивных транскрипционных факторов.
Участие гетеродимера CLOCK:BMAL1 во второй петле заключается в его связывании с E-box промоторов генов Rorα и Rev-erbα, продукты которых независимо транслоцируются в ядро с последующей конкуренцией за связывание с последовательностью RORE в промоторной области Bmal1. Результатом связывания с данной последовательностью RORA, максимальные уровни которого отмечаются на рассвете, является активация гена Bmal1; при связывании REV-ERBα, пики которого выявлены в сумерках, с последовательностью RORE происходит подавление транскрипции гена.
В третьей петле белковые продукты генов Dec1 (Differentiated embryonic chondrocyte) и Dec2 ингибируют транскрипцию гетеродимера CLOCK:BMAL1, усиливая ингибирующее действие комплекса CRY:PER:CK1 [5].
Большинство клеток в организме обладают молекулярными часами и синхронизируются с помощью главного водителя ритма, расположенного в супрахиазматических ядрах гипоталамуса. В настоящее время исследования генетических механизмов циркадных ритмов продолжаются в связи с неясной природой циркадной регуляции генов, не имеющих последовательности E-box, а также в связи с определением роли дополнительных часовых компонентов [6].
ПОЛИМОРФНЫЕ ВАРИАНТЫ ГЕНА CLOCK И ЦИКЛ “СОН–БОДРСТВОВАНИЕ”
К настоящему времени ассоциации полиморфных вариантов гена Clock и цикла “сон–бодрствование” рассмотрены по большей части при изучении однонуклеотидной замены в его 3'-нетранслируемой области (3111Т/С, rs1801260). В научных исследованиях по взаимосвязи полиморфизма 3111T/C гена Clock с хронотипом показана большая распространенность аллеля 3111С и ассоциация генотипа 3111С/С у здоровых людей с вечерней активностью в японской популяции [7] и у представителей североамериканской популяции [8, 9]. Однако исследованием на британской популяции эти данные не подтверждены [10, 11]. Более того, не обнаружено данной ассоциации и с синдромом отстающей фазы сна в бразильской популяции [12], а также выявлена более низкая частота аллеля 3111С при данном синдроме в японской популяции [13].
Результаты проведенного исследования в итальянской популяции показали факт ассоциации аллеля 3111С с инсомнией только у пациентов с биполярными расстройствами [14, 15], хотя исследованиями в североамериканской [16, 17], румынской [18], австрийской [19], смешанной европейской [20], греческой [21] и корейской [22] популяциях не обнаружено ассоциации полиморфизма 3111Т/С гена Clock с когнитивными расстройствами. Результаты исследования N. Antypa с соавт. [21] показали, что генотип 3111С/С в комбинации со стрессом увеличивает уязвимость к нарушению суточного ритма у женщин. Проведенное в американской популяции с участием женщин менопаузального возраста исследование по поиску ассоциации генотипов и аллелей данного полиморфизма с инсомнией показало, что носительство хотя бы одного из аллелей 3111С снижает шансы инсомнии в сравнении с носителями, гомозиготными по 3111Т-аллелю, при этом не выявлено ассоциации полиморфизма с ранними пробуждениями. Следует отметить, что группы женщин в данном исследовании не были разделены по этнической принадлежности и включали как белых американцев (более 80%), так и черных [23]. Данная научная проблема с учетом этнической принадлежности была рассмотрена в популяциях европеоидов и монголоидов Восточной Сибири. По результатам исследования оказалось, что только у представительниц европеоидной расы инсомния ассоциирована с генотипом 3111Т/Т и аллелем 3111Т. Расчет показателя относительного риска развития инсомнии у носителей аллеля 3111Т гена Clock позволил определить его как прогностический в формировании сомнологической патологии у представительниц европеоидной расы [24]. Наравне с этим не было выявлено взаимосвязи между генотипами и аллелями и отдельными жалобами, такими как трудности засыпания, частые ночные пробуждения, трудности ранних утренних пробуждений [25].
В исследовании на большой выборке афроамериканцев были проанализированы связи между продолжительностью и качеством сна на 12 полиморфных маркерах гена Clock: rs6820119, rs3792603, rs11932595, rs17085763, rs17085780, rs2070062, rs7684048, rs7657206, rs11726609, rs6853192, rs6820823, rs17721497. Одним из основных результатов была значительная связь между более короткой продолжительностью сна и Т-аллелем rs2070062 и номинально значимая связь с Т-аллелем rs6853192 [26].
В исследовании на двух независимых европейских популяциях из Эстонии и Южного Тироля была продемонстрирована номинальная связь rs12649507 и rs11932595 с продолжительностью сна [27]. Повторение этих результатов в большой выборке европейских участников не подтвердило ассоциаций между анализируемыми вариантами гена Clock и продолжительностью сна, в том числе и по результатам полисомнографического исследования [28], что свидетельствует о необходимости проведения дополнительных исследований по изучению данного вопроса.
ЦИКЛ “СОН–БОДРСТВОВАНИЕ” И МЕЛАТОНИН
Одним из ключевых элементов циркадного механизма является гормон мелатонин, ритм секреции которого носит четко выраженный циркадный характер с повышением уровня в вечернее время, максимумом в середине ночи и прогрессивным уменьшением к утру [29]. Благодаря результатам огромного массива проведенных научных работ по выявлению взаимосвязей цикла “сон–бодрствование” и уровня мелатонина существование данных ассоциаций не вызывает сомнений [30]. Через два часа после начала синтеза эндогенного мелатонина появляется вечерняя сонливость и наступает сон [31]. Предполагается, что мелатонин не столько оказывает прямое воздействие на сомногенные структуры, сколько способствует открытию так называемых “ворот сна”, создает “предрасположенность ко сну”, тормозит механизмы бодрствования. При достижении концентрации мелатонина в крови, соответствующей примерно половине максимального “ночного” уровня, происходит резкий подъем “давления сна”, что способствует переходу состояния бодрствования ко сну [32]. Действие ряда факторов, таких как полная слепота, удаление или функциональное разрушение эпифиза, изменение светового режима при сменной работе или трансмеридианных перелетах, приводит к десинхронизации между периодом сна и секрецией мелатонина [33].
В супрахиазматических ядрах гипоталамуса, в гиппокампе, мозжечке, коре больших полушарий и других тканях находятся МТ1 и МТ2 рецепторы, на которые воздействует мелатонин. Это активирует различные сигнальные системы клетки и приводит к синтезу вторичных посредников: циклического аденозинмонофосфата и изменению концентрации ионов кальция. При связывании мелатонина с цитозольным кальмодулином возможно влияние гормона на кальциевые сигналы посредством взаимодействия с такими энзимами, как аденилатциклаза и фосфодиэстераза, и структурными белками цитоскелета [34]. Экспериментами на мышах было показано увеличение продолжительности медленного сна при нокаутировании рецептора МТ1 и, наоборот, ее сокращение при нокаутировании рецептора МТ2, что свидетельствует о разнонаправленных ролях рецепторов в процессе сна [35]. В ядрах гипоталамуса, в сетчатке глаза и других тканях обнаружены ядерные рецепторы RZR/RORα и RZR/RORβ, относящиеся к подклассу семейства орфановых ядерных ретиноидных рецепторов с меньшим сродством к мелатонину. Кроме того, рецепторы мелатонина обнаружены в желудочно-кишечном тракте, однако их функция до сих пор не ясна [36]. Предполагается, что рецепторы, расположенные в супрахиазматических ядрах гипоталамуса, принимают участие в регуляции циркадного ритма, в том числе возможно влияние на экспрессию часовых генов в мозжечке. Результаты недавнего исследования на приматах по оценке экспрессии МТ1, МТ2 рецепторов, а также PER1, PER2 и кальцийсвязывающих белков в мозжечке показали не только локализацию PER1, PER2 иммунореактивных клеток в клетках Пуркинье мозжечка, а рецепторов МТ1 и МТ2 – в клетках Бергмана, но и высокую экспрессию PER и рецепторов мелатонина в дневное время. Вместе с тем были обнаружены дневные/ночные морфологические изменения кальретинина и кальбиндина, обладающих функцией высвобождения нейротрансмиттеров, и изменение их плотности в коре мозжечка [37].
Результаты проведенных исследований по сравнительной оценке ритмов мелатонина у представителей разных хронотипов показали отсутствие значимых различий между группами людей с вечерней и утренней активностью в период от 0.00 ч до 7.00 ч [38] и повышение в 9.00 ч уровня сывороточного гормона в 2 раза у представителей с вечерней активностью, на основании чего утренний мелатонин предложено рассматривать как биологический маркер для определения хронотипа [39]. Результаты исследования с участием детей в возрасте 30–36 мес., у которых проводили измерение уровня мелатонина в слюне каждый час в период с 18.00 до 21.00 ч, продемонстрировали более раннее начало подъема уровня гормона у детей с утренней активностью [40]. Аналогичные результаты были получены в исследовании на мужчинах 18–45 лет [41]. Исследование взаимосвязи хронотипа и уровня мелатонина у пременопаузальных женщин показало более высокие его значения в суточной моче у представительниц хронотипа “жаворонки” по отношению к группе “сов” [42].
Циркадные ритмы мелатонина были изучены при таких нарушениях цикла “сон–бодрствование” как синдром отсроченного наступления фазы сна и инсомнические расстройства. При синдроме отсроченного наступления фазы сна показано смещение пика секреции гормона на 3–5 ч по сравнению с контролем [43]. Более того, результаты 80-часового эксперимента показали удлинение циркадных ритмов мелатонина при данном нарушении [44].
Инсомнические расстройства сопровождаются не только более низкими уровнями мелатонина [45–48], но и смещением пика секреции гормона, что было продемонстрировано в исследованиях с участием женщин климактерического периода разной этнической принадлежности [45, 47]. Показано, что смещение пика секреции мелатонина на утренние часы происходит у женщин европеоидной расы как в перименопаузе, так и в постменопаузальном периоде [45]. Задержка пика секреции гормона до утреннего времени может быть связана с наличием менопаузальной депрессии, являющейся причиной более длительной продолжительности сна в качестве компенсации инсомнии [48]. В то же время постменопаузальные женщины без инсомнических расстройств также имели пик мелатонина рано утром [46]. Аналогичные результаты были получены в исследовании по взаимосвязи циркадных ритмов мелатонина с продолжительностью сна у людей как молодого, так и пожилого возраста с отсутствием жалоб на нарушения сна. Было показано, что засыпание у пожилых участников исследования наступало раньше, чем у них был зарегистрирован пик плазменного мелатонина, а пробуждение происходило во время более высоких уровней гормона [49].
К настоящему времени на разных когортах больных проведено достаточное количество клинических испытаний по эффективности применения экзогенного мелатонина в лечении инсомнии, результаты которых являются подтверждением несомненного влияния гормона на цикл “сон–бодрствование” [50–52].
ЦИРКАДНЫЕ РИТМЫ МЕЛАТОНИНА И ГЕН CLOCK
Известно, что синтез мелатонина контролируется ферментом арилалкиламин-N-ацетилтрансферазой (AANAT), транскрипция которого активируется гетеродимером CLOCK:BMAL1 через связывание с E-box в промоторной области гена Aanat [53]. Результаты недавних исследований in vivo предположили критическую роль как CLOCK, так и BMAL1 в индуцированной монохроматическим зеленым светом ритмической секреции мелатонина [54, 55]. Другими экспериментальными работами показано, что нокдаун и сверхэкспрессия Clock не влияют на циркадные ритмы и уровни секреции гормона [56]. При этом AANAT также поддерживает очевидный циркадный ритм, но его амплитуда меняется в результате нокдауна и избыточной экспрессии Clock [57].
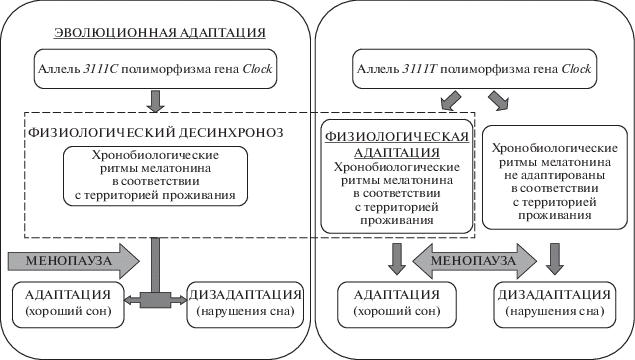
Недавнее исследование по вопросу функциональной роли полиморфизма 3111Т/С гена Clock показало, что 3111C-аллель приводит к более высоким уровням мРНК Clock и высокой экспрессии Per2, являющейся транскрипционной мишенью CLOCK, по сравнению с аллелем 3111T. Предполагается, что эти изменения могут быть обусловлены рядом различных механизмов, включая сайты связывания микроРНК-182 в 3'-нетранслируемой области гена Clock [58]. Данные результаты являются свидетельством возможного влияния данного полиморфизма на циркадные ритмы мелатонина, что было изучено в ходе проведения исследований в ФГБНУ “НЦ проблем здоровья семьи и репродукции человека” на выборке женщин климактерического периода европеоидной и монголоидной рас. Проведенное исследование не показало ассоциации циркадных ритмов мелатонина и изученного полиморфизма у женщин монголоидной расы, что позволило сделать вывод об отсутствии влияния 3111Т/С гена Clock на формирование у них нарушений сна. В группе женщин-европеоидов 3111Т/Т-генотип был ассоциирован со смещением пика секреции мелатонина на ранние утренние часы. Исследование было проведено на территории Восточной Сибири (Иркутская область, Прибайкалье), и полученные результаты трактовались с учетом принадлежности монголоидов к коренному населению, а европеоидов – к пришлому. Исследователями выдвинута гипотеза о процессах дизадаптации европеоидов во время смены часовых поясов при изменении территории проживания, проявляющихся сохранением циркадных ритмов, характерных для проживания в западной части, что рассматривается как смещение ритмов мелатонина в условиях настоящего проживания. Учитывая два типа эффектов воздействия окружающей среды на структуру и функции генотипов [59] было высказано предположение о развитии физиологического десинхроноза с достижением качественной адаптации с нормальными значениями мезоров ритма у европеоидов – носителей 3111Т-аллеля, у которых признаки нарушения цикла “сон–бодрствование” отсутствуют [60]. В данном случае возможна реализация первого эффекта, проявляющегося на уровне индивида в виде патологических реакций, а на популяционном уровне в виде адаптации [59].
Наравне с этим большая частота встречаемости минорного аллеля у европеоидов без нарушения цикла “сон–бодрствование” и отсутствие различий по ритмам мелатонина при носительстве данного аллеля позволили выдвинуть предположение о появлении защитной функции у 3111С-аллеля в ходе эволюционного процесса, учитывая исторические данные о заселении территории Восточной Сибири представителями европеоидной расы [60]. В этом случае можно предположить изменения на генетическом уровне в процессе адаптации к смене часовых поясов, т.е. реализацию второго типа эффектов воздействия факторов окружающей среды на структуру и функцию генотипов [61]. Однако среди носителей минорного аллеля с предполагаемой защитной ролью от развития нарушений цикла “сон–бодрствование” встречаются женщины с нарушениями сна, что может быть рассмотрено как дизадаптационный процесс при наступлении критического периода жизни, а именно климактерия, и не связанного с циркадными ритмами мелатонина (рис. 1). Данная гипотеза представляет значимый интерес, однако для ее подтверждения необходимо проведение дополнительных крупномасштабных исследований в других популяциях мира.
Рис. 1.
Гипотетическая схема о роли полиморфного маркера 3111Т/С гена Clock в формировании нарушений сна у женщин-европеоидов в климактерическом периоде [59].
Анализ литературных данных, представленных в данном обзоре, свидетельствует об актуальности дальнейшего изучения молекулярных механизмов циркадных ритмов в связи с имеющимися пробелами в вопросах их генетической регуляции. Наравне с этим большая часть работ по изучению ассоциации хронобиологических ритмов мелатонина и гена Clock – это эксперименты на животных с неоднозначными результатами и наличие единичных исследований по данному вопросу на человеке. Дополнительные исследования в данной области открывают новые горизонты в изучении цикла “сон–бодрствование” и его нарушений.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Zhang Y., Ren R., Lei F. et al. Worldwide and regional prevalence rates of co-occurrence of insomnia and insomnia symptoms with obstructive sleep apnea: a systematic review and meta-analysis // Sleep Med. Rev. 2019. V. 45. P. 1–17. https://doi.org/10.1016/j.smrv.2019.01.004
Сомнология и медицина сна. Национальное руководство памяти А.М. Вейна и Я.И. Левина / Под ред. Полуэктова М.Г. М.: Медфорум, 2016. 664 с.
Konopka R.J., Benzer S. Clock mutants of Drosophila melanogaster // PNAS USA. 1971. V. 68. № 9. P. 2112–2116.
Takahashi J.S. Molecular architecture of the circadian clock in mammals // A Time for Metabolism and Hormones. Cham (CH): Springer, 2016. P. 13–24.
Jagannath A., Taylor L., Wakaf Z. et al. The genetics of circadian rhythms, sleep and health // Hum. Mol. Gene. 2017. V. 26. № R2. P. R128–R138. https://doi.org/10.1093/hmg/ddx240
Zhang S., Dai M., Wang X. et al. Signalling entrains the peripheral circadian clock // Cell Signal. 2020. V. 69. P. 109433. https://doi.org/10.1016/j.cellsig.2019.109433
Mishima K., Tozawa T., Satoh K. et al. The 3111T/C polymorphism of hClock is associated with evening preference and delayed sleep timing in a Japanese population sample // Am. J. Med. Genet. B Neuropsychiatr. Genet. 2005. V. 133B. P. 101–104. https://doi.org/10.1002/ajmg.b.30110
Katzenberg D., Young T., Finn L. et al. A CLOCK polymorphism associated with human diurnal preference // Sleep. 1998. V. 21. № 6. P. 569–576.
Friedman L., Zeitzer J.M., Kushida C. et al. Scheduled bright light for treatment of insomnia in older adults // J. Am. Geriatr. Soc. 2009. V. 57. № 3. P. 441–452. https://doi.org/10.1111/j.1532-5415.2008.02164.x
Robilliard D.L., Archer S.N., Arendt J. et al. The 3111 Clock gene polymorphism is not associated with sleep and circadian rhythmicity in phenotypically characterized human subjects // J. Sleep Res. 2002. V. 11. P. 305–312.
Barclay N.L., Eley T.C., Mill J. et al. Sleep quality and diurnal preference in a sample of young adults: associations with 5HTTLPR, PER3, and CLOCK 3111 // Am. J. Med. Genet. B Neuropsychiatr. Genet. 2011. V. 156B. № 6. P. 681–690. https://doi.org/10.1002/ajmg.b.31210
Pedrazzoli M., Louzada F.M., Pereira D.S. et al. Clock polymorphisms and circadian rhythms phenotypes in a sample of the Brazilian population // Chronobiol. Int. 2007. V. 24. P. 1–8.
Iwase T., Kajimura N., Uchiyama M. et al. Mutation screening of the human Clock gene in circadian rhythm sleep disorders // Psychiatry Res. 2002. V. 109. P. 121–128.
Serretti A., Benedetti F., Mandelli L. et al. Genetic dissection of psychopathological symptoms: insomnia in mood disorders and CLOCK gene polymorphism // Am. J. Med. Genet. B Neuropsychiatr. Genet. 2003. V. 121B. P. 35–38. https://doi.org/10.1002/ajmg.b.20053
Benedetti F., Dallaspezia S., Fulgosi M.C. Actimetric evidence that CLOCK 3111T/C SNP influence sleep and activity patterns in patients affected by bipolar depression // Am. J. Med. Genet. B Neuropsychiatr. Genet. 2007. V. 144B. P. 631–635.
Desan P.H., Oren D.A., Malison R. et al. Genetic polymorphism at the CLOCK gene locus and major depression // Am. J. Med. Genet. 2000. V. 96. P. 418–421.
Shi J., Wittke-Thompson J.K., Badner J.A. et al. Clock genes may influence bipolar disorder susceptibility and dysfunctional circadian rhythm // Am. J. Med. Genet. B Neuropsychiatr. Genet. 2008. V. 147B. P. 1047–1055. https://doi.org/10.1002/ajmg.b.30714
Voinescu B., Thome J., Orasan R. The rs 1801260 CLOCK polymorphism, links to depression, insomnia and diurnal preference-preliminary findings from a Romanian sample // HVM Bioflux. 2009. V. 1. № 2. P. 67–73.
Bailer U., Wiesegger G., Leisch F. et al. No association of clock gene T3111C polymorphism and affective disorders // Eur. Neuropsychopharmacol. 2005. V. 15. № 1. P. 51–55. https://doi.org/10.1016/j.euroneuro.2004.05.004
Johansson C., Willeit M., Smedh C. et al. Circadian clock-related polymorphisms in seasonal affective disorder and their relevance to diurnal preference // Neuropsychopharmacology. 2003. V. 28. P. 734–739. https://doi.org/10.1038/sj.npp.1300121
Antypa N., Mandelli L., Nearchou F.A. et al. The 3111T/C polymorphism interacts with stressful life events to influence patterns of sleep in females // Chronobiol. Int. 2012. V. 29. № 7. P. 891–897. https://doi.org/10.3109/07420528.2012.699380
Paik J.W., Lee H.J., Kang S.G. et al. CLOCK gene 3111C/T polymorphism is not associated with seasonal variations in mood and behavior in Korean college students // Psychiatry Clin. Neurosci. 2007. V. 61. P. 124–126. https://doi.org/10.1111/j.1440-1819.2007.01621.x
Ziv-Gal A., Flaws J.A., Mahoney M.M. et al. Genetic polymorphisms in the aryl hydrocarbon receptor–signaling pathway and sleep disturbances in middle-aged women // Sleep Med. 2013. V. 14. № 9. P. 883–887. https://doi.org/10.1016/j.sleep.2013.04.007
Semenova N.V., Madaeva I.M., Bairova T.A. et al. Association of the melatonin circadian rhythms with clock 3111T/C gene polymorphism in Caucasian and Asian menopausal women with insomnia // Chronobiol. Int. 2018. V. 35. № 8. P. 1066–1076. https://doi.org/10.1080/07420528.2018.1456447
Semenova N.V., Madaeva I.M., Bairova T.I. et al. 3111T/C Clock gene polymorphism in women with insomnia // Bull. Exp. Biol. Med. 2017. V. 163. № 4. P. 461–464. https://doi.org/10.1007/s10517-017-3828-5
Riestra P., Gebreab S.Y., Xu R. et al. Circadian CLOCK gene polymorphisms in relation to sleep patterns and obesity in African Americans: findings from the Jackson heart study // BMC Genet. 2017. V. 18. P. 58. https://doi.org/10.1186/s12863-017-0522-6
Allebrandt K.V., Teder-Laving M., Akyol M. et al. CLOCK gene variants associate with sleep duration in two independent populations // Biol. Psychiatry. 2010. V. 67. № 11. P. 1040–1047. https://doi.org/10.1016/j.biopsych.2009.12.026
Lane J.M., Tare A., Cade B.E. et al. Common variants in CLOCK are not associated with measures of sleep duration in people of european ancestry from the sleep heart health study // Biol. Psychiatry. 2013. V. 74. № 12. P. e33–e35. https://doi.org/10.1016/j.biopsych.2013.06.006
Zhao D., Yu Y., Shen Y. et al. Melatonin synthesis and function: evolutionary history in animals and plants // Front. Endocrinol. (Lausanne). 2019. V. 10. P. 249. https://doi.org/10.3389/fendo.2019.00249
Pandi-Perumal S.R., Srinivasan V., Spence D.W. et al. Role of the melatonin system in the control of sleep: therapeutic implications // CNS Drugs. 2007. V. 21. № 12. P. 995–1018.
Zhdanova I.V., Tucci V. Melatonin, circadian rhythms, and sleep // Curr. Treat. Options Neurol. 2003. V. 5. № 3. P. 225–229.
Lavie P. Melatonin: Role in gating nocturnal rise in sleep property // J. Biol. Rhythms. 1997. V. 12. P. 657–665.
Ковальзон В.М., Вейн А.М. Мелатонин и сон // Мелатонин в норме и патологии. М.: Медпрактика-М, 2004. С. 182–197.
Каладзе Н.Н., Соболева Е.М., Скоромная Н.Н. Итоги и перспективы изучения физиологических, патогенетических и фармакологических эффектов мелатонина // Здоровье ребенка. 2010. № 2(23). С. 156–166.
Comai S., Ochoa-Sanchez R., Gobbi G. Sleep-wake characterization of double MT(1)/MT(2) receptor knockout mice and comparison with MT(1) and MT(2) receptor knockout mice // Behavior. Brain Research. 2013. V. 243. P. 231–238. https://doi.org/10.1016/j.bbr.2013.01.008
Мичурина С.В., Васендин Д.В., Ищенко И.Ю. Физиологические и биологические эффекты мелатонина: некоторые итоги и перспективы изучения // Рос. физиол. журн. им. И.М. Сеченова. 2018. Т. 104. № 3. С. 257–271.
Guissoni Campos L.M., Hataka A., Vieira I.Z. et al. Circadian Clock proteins and melatonin receptors in neurons and glia of the Sapajus apella cerebellum // Front. Physiol. 2018. V. 9. P. 5. https://doi.org/10.3389/fphys.2018.00005
Gibertini M., Graham C., Cook M.R. Self-report of circadian type reflects the phase of the melatonin rhythm // Biol. Psychol. 1999. V. 50. P. 19–33.
Morera-Fumero A.L., Abreu-Gonzalez P., Henry-Benitez M. et al. Chronotype as modulator of morning serum melatonin levels // Actas Esp. Psychiatr. 2013. V. 41. № 3. P. 149–153.
Simpkin C.T., Jenni O.G., Carskadon M.A. et al. Chronotype is associated with the timing of the circadian clock and sleep in toddlers // J. Sleep Res. 2014. V. 23. № 4. P. 397–405. https://doi.org/10.1111/jsr.12142
Burgess H.J., Fogg L.F. Individual differences in the amount and timing of salivary melatonin secretion // PLoS One. 2008. V. 3. P. e3055.
Заводнов О.П., Закружная М.А., Боташева Т.Л., Авруцкая В.В. Особенности мелатонинового обмена у женщин с различной хронофизиологической и стереофункциональной организацией репродуктивной системы и световая депривация в профилактике климактерического синдрома // Соврем. пробл. науки и образования: электронный науч. журн. 2012. № 2. [Электронный ресурс]. URL: http://www.science-education.ru/102-5487 (дата обращения 08.11.2012).
Micic G., Lovato N., Gradisar M. et al. Nocturnal melatonin profiles in patients with delayed sleep-wake phase disorder and control sleepers // J. Biol. Rhythms. 2015. V. 30. № 5. P. 437–448.
Micic G., Lovato N., Gradisar M. et al. Circadian melatonin and temperature taus in delayed sleep-wake phase disorder and non-24-hour sleep-wake rhythm disorder patients: an ultradian constant routine study // J. Biol. Rhythms. 2016. V. 31. № 4. P. 387–405. https://doi.org/10.1177/0748730416650069
Madaeva I.M., Semenova N.V., Solodova E.I. et al. Circadian rhythms of melatonin secretion in peri and postmenopausal women with insomnia // Intern. J. Biomedicine. 2017. V. 7. № 2. P. 126–130. https://doi.org/10.21103/Article7(2)_OA8
Meliska C.J., Martinez L.F., Lopez A.M. et al. Relationship of morningness-eveningness questionnaire score to melatonin and sleep timing, body mass index and atypical depressive symptoms in peri- and post-menopausal women // Psychiatry Res. 2011. V. 188. № 1. P. 88–95.
Parry B.L., Meliska C.J., Sorenson D.L. et al. Increased melatonin and delayed offset in menopausal depression: role of years past menopause, follicle-stimulating hormone, sleep end time, and body mass index // J. Clin. Endocrinol. Metab. 2008. V. 93. № 1. P. 54–60.
Xie Z., Chen F., Li W.A. et al. A review of sleep disorders and melatonin // Neurol. Res. 2017. V. 39(6). P. 559–565. https://doi.org/10.1080/01616412.2017.1315864
Duffy J.F., Zeitzer J.M., Rimmer D.W. et al. Peak of circadian melatonin rhythm occurs later within the sleep of older subjects // Am. J. Physiol. Endocrinol. Metab. 2002. V. 282. № 2. P. E297–E303.
Goldman S.E., Adkins K.W., Calcutt M.W. et al. Melatonin in children with autism spectrum disorders: endogenous and pharmacokinetic profiles in relation to sleep // J. Autism Dev. Disord. 2014. V. 44. P. 2525–2535. https://doi.org/10.1007/s10803-014-2123-9
Holvoet E., Gabriels L. Disturbed sleep in children with ADHD: is there a place for melatonin as a treatment option? // Tijdschr. Psychiatr. 2013. V. 55. P. 349–357.
Мадаева И.М., Данусевич И.Н., Жамбалова Р.М., Колесникова Л.И. Мелатонин в терапии нарушений сна при возрастном эстрогендефицитном состоянии // Журн. неврологии и психиатрии им. C.C. Корсакова. 2017. Т. 117. № 5. С. 81–84. https://doi.org/10.17116/jnevro20171175181-84
Bell-Pedersen D., Cassone V.M., Earnest D.J. et al. Circadian rhythms from multiple oscillators: lessons from diverse organisms // Nat. Rev. Genetics. 2005. V. 6. P. 544–556.
Jiang N., Wang Z., Cao J. et al. Effect of monochromatic light on circadian rhythmic expression of clock genes in the hypothalamus of chick // J. Photochem. Photobiol. B. 2017. V. 173. P. 476–484. https://doi.org/10.1016/j.jphotobiol.2017.06.027
Cao J., Bian J., Wang Z. et al. Effect of monochromatic light on circadian rhythmic expression of clock genes and arylalkylamine N-acetyltransferase in chick retina // Chronobiol. Int. 2017. V. 34. P. 1149–1157. https://doi.org/10.1080/07420528.2017.1354013
Ma S., Wang Z., Cao J. et al. BMAL1 but not CLOCK is associated with monochromatic green light-induced circadian rhythm of melatonin in chick pinealocytes // Endocr. Connect. 2019. V. 8(1). P. 57–68. https://doi.org/10.1530/EC-18-0377
DeBruyne J.P., Noton E., Lambert C.M. et al. A clock shock: mouse CLOCK is not required for circadian oscillator function // Neuron. 2006. V. 50. P. 465–477. https://doi.org/10.1016/j.neuron.2006.03.041
Ozburn A.R., Purohit K., Parekh P.K. et al. Functional implications of the CLOCK 3111T/C single-nucleotide polymorphism // Front. Psychiatry. 2016. V. 7. P. 67. https://doi.org/10.3389/fpsyt.2016.00067
Бочков Н.П., Пузырев В.П., Смирнихина С.А. Клиническая генетика. М.: ГЭОТАР-Медиа, 2015. 592 с.
Колесникова Л.И., Колесников С.И., Мадаева И.М., Семёнова Н.В. Этногенетические и молекулярно-метаболические аспекты нарушений сна в климактерическом периоде. М.: РАН, 2019. 139 с.
Боринская С.А., Янковский Н.К. Генетика и геномика человека. Популяции и этносы в пространстве и времени: эволюционные и медицинские аспекты // Вавиловский журн. генетики и селекции. 2013. Т. 17. № 4-2. С. 930–942.
Дополнительные материалы отсутствуют.


