Генетика, 2021, T. 57, № 4, стр. 464-477
Y-гаплогруппы костных останков из курганных погребений хазарского времени на территории юга России
И. В. Корниенко 1, 2, *, Т. Г. Фалеева 1, 2, 3, 4, Т. Г. Шурр 5, О. Ю. Арамова 1, 3, М. А. Очир-Горяева 1, Е. Ф. Батиева 6, Е. В. Вдовченков 3, Н. Е. Мошков 7, 8, 9, В. В. Куканова 1, И. Н. Иванов 10, Ю. С. Сидоренко 2, 11, Т. В. Татаринова 12, 13, 14, 15
1 Калмыцкий научный центр Российской академии наук
358000 Элиста, Россия
10 Северо-Западный государственный медицинский университет
им. И.И. Мечникова
191015 Санкт-Петербург, Россия
11 Национальный медицинский исследовательский центр онкологии
344037 Ростов-на-Дону, Россия
12 Department of Biology, University of La Verne
91750 California, La, Verne, USA
13 Сибирский федеральный университет
660041 Красноярск, Россия
14 Институт проблем передачи информации им. А.А. Харкевича Российской академии наук
127051 Москва, Россия
15 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Федеральный исследовательский центр Южный научный центр Российской академии наук
344006 Ростов-на-Дону, Россия
3 Южный федеральный университет
344090 Ростов-на-Дону, Россия
4 111 Главный государственный центр судебно-медицинских и криминалистических экспертиз
344000 Ростов-на-Дону, филиал № 2, Россия
5 The University of Pennsylvania Museum of Archeology and Anthropology
19104 Philadelphia, USA
6 Азовский историко-археологический и палеонтологический музей-заповедник
346780 Азов, Россия
7 Synthetic and Systems Biology Unit, Biological Research Centre
6726 Szeged, Hungary
8 Doctoral School of Interdisciplinary Medicine, University of Szeged
6720 Szeged, Hungary
9 Национальный исследовательский университет “Высшая школа экономики”
101000 Москва, Россия
* E-mail: ikornienko@yandex.ru
Поступила в редакцию 16.05.2020
После доработки 12.07.2020
Принята к публикации 25.08.2020
Аннотация
Генетические исследования костных останков человека из археологических комплексов открывают новые возможности для изучения культурно-исторического развития древних популяций, предоставляя объективные данные, которые могут быть использованы для исследования наиболее спорных проблем археологии. В настоящей работе мы проанализировали Y-хромосомы скелетных останков девяти индивидуумов, погребенных в элитных курганах Хазарского каганата на территории современной Ростовской области, относящихся к VII–IX вв. Генотипирование полиморфных Y-STR и Y-SNP локусов позволило установить, что среди девяти исследованных скелетов три из них имели Y-гаплогруппу R1a, два – C2b и по одному – G2a, N1a, Q и R1b Y-гаплогруппы. Такие результаты характерны для смеси западно-евразийских и восточно-азиатских отцовских линий. Результаты типирования Y-хромосомы согласуются с результатами краниологического исследования и полногеномного анализа одних и тех же костных останков, демонстрируя смешанное генетическое происхождение раннесредневековой хазарской знати. Результаты настоящего исследования неудивительны, поскольку Хазарский каганат образовался путем отделения от Западного Тюркского каганата и окончательно сформировался в регионах Северного Кавказа и восточноевропейских степей.
Для эпохи раннего средневековья восточноевропейских степей сложная и многогранная история Хазарского каганата играет ключевую роль [1–4]. Она отражена в целом комплексе письменных источников: арабских, византийских и собственно хазарских [5, 6]. Хазарский каганат контролировал в разные периоды своей истории степи от Черного до Аральского моря, пространства от гор Кавказа на юге до лесов среднего течения рек Волга и Днепр на севере. Степи Нижнего Поволжья и Нижнего Дона были основной (доменной) территорией хазар. В волго-донских степях наблюдается наибольшее скопление разнообразных археологических памятников: необычные по конструкции и размерам культовые сооружения, такие как Цимлянский квадрат, пирамида Синий Мамай и курган Большая Орловка [7]; агломерация городищ-крепостей с мощными оборонительными стенами из кирпича и камня: Саркел, Правобережное Цимлянское, Камышовское, открытые недавно Башанта-I-II [8–11].
В этом регионе наблюдается наибольшая плотность подкурганных захоронений VII–IX вв. (более 300 погребальных памятников). Среди погребального инвентаря здесь чаще были обнаружены византийские монеты, позволяющие датировать погребения с максимальной точностью. Расположение данных подкурганных захоронений на территории домена Хазарского каганата, включая захоронения знатных воинов, которые исследователи уверенно относят к хазарским, дает основание идентифицировать данные погребения как собственно хазарские [9, 12].
Из отобранной выборки погребение 1 из кургана 3 из группы Вербовый Лог-IX датируется с опорой на разработанную классификацию серебряных поясных пряжек, а также по византийской монете – солиду императора Юстиниана II (705–711 гг.). По форме и конструкции более ранней формы серебряной пряжки датируется погребение 1 из кургана 2 группы Кутейников-II (вторая половина VII–начало VIII в.). Типологическая классификация массовых серийных предметов является основным методом выявления относительной хронологии их бытования в археологии как преисторической, так и классической. Для эпохи средневековья имеется возможность обеспечивать типологические цепочки предметов материальной культуры абсолютными датами благодаря наличию монет и обилию письменных источников. Поэтому именно благодаря разработанной типологии удил и стремян установлена датировка кургана 37 из группы Новый второй половиной VIII–началом IX в.
Элитные воинские захоронения исследуемой выборки были устроены под собственным курганом, с ритуальными ровиками вокруг широтно ориентированной могильной ямы с подбоем. Умершие были расположены вытянуто на спине, головой на запад, сопровождались символическим захоронением взнузданной верховой лошади в виде чучела из снятой целиком шкуры с головой и оставленными путовой костью и копытами. Чучела положены в могильной яме так, что имитировали положение лежащей лошади. Показателем высокого социального ранга является разнообразный инвентарь из этих погребений, прежде всего предметы роскоши и престижа, такие как металлические наборные пояса, серебряные и позолоченные сосуды, ювелирные изделия, золотые византийские монеты. Последние использовались не по прямому назначению, а в качестве статусных атрибутов [13–19].
Проведенные рядом специалистов краниологические анализы черепов из курганов VII–IX вв. с территории Нижнего Дона и Нижнего Поволжья с использованием различных серий выявили преобладание смешанного монголоидно-европеоидного типа [20–23]. Е.Ф. Батиева на основе изучения серии из 86 взрослых и четырех детских индивидов установила преобладание черепов с монголоидными признаками (70%). Европеоидный компонент мужской выборки имеет сходство с представителями синхронной салтово-маяцкой и, предшествующей по времени, сарматской культур Нижнего Подонья и Нижнего Поволжья. Монголоидные мужские и женские черепа проявляют наибольшее сходство с гуннами Забайкалья и тюркоязычными кочевниками Южной Сибири, Алтая и Казахстана [23].
Генетические исследования древних костных останков открывают новые возможности для изучения проблемы происхождения и этнической консолидации хазар эпохи раннего средневековья [24]. Полученные в настоящей работе результаты должны существенно дополнить отрывочные сведения письменных свидетельств и единичных образцов изобразительного искусства. Но самое главное они обеспечат объективной базой исследованную группу элитных воинских погребений со степной доменной территории Хазарского каганата, выделенных на основе признаков погребального обряда, интерпретация которых не всегда однозначна и создает почву для сомнений и дискуссий в археологической литературе. Описать полный генетический профиль населения всего Каганата – непростая и, вероятно, невозможная задача. На данном этапе проведен анализ гаплогрупп Y-хромосомы населения определенного региона и конкретного времени, а именно скелетов из богатых подкурганных погребений конца VII–начала IX в. Хазарского каганата (современная Ростовская область).
МАТЕРИАЛЫ И МЕТОДЫ
Для генетического анализа были отобраны костные останки из курганных погребений по хронологическому признаку (датирующиеся VII–IX вв.), по географическому признаку (доменная территория Хазарского каганата), по половой принадлежности (мужские) и по степени сохранности костного материала (табл. 1).
Таблица 1.
Местонахождение, датировка и расовая принадлежность исследованных скелетов
| Инв. № скелета
(шифр антропологической коллекции) |
Местонахождение, датировка | Расовый тип |
|---|---|---|
| 67 | Мг. Криволиманский I, курган № 52, погребение 1, IX в. н.э. [25]. Мартыновский р-н, х. Кривой Лиман | Монголоидный |
| 457 | Мг. Кировский V, курган № 2, погребение 1, хазарское время [26]. Мартыновский р-н, х. Новосадковка | Монголоидный? |
| 531 | Мг. Подгорненский IV, курган № 22, погребение 1, VIII– IX вв. н.э. [27]. Дубовский р-н, между х. Харсеев и х. Подгорненский | Европеоидный |
| 619 | Мг. Подгорненский V, курган № 5, погребение 1, VII–VIII вв. н.э. [14]. Дубовский р-н, х. Подгорненский | Монголоидный |
| 656 | Мг. Вербовый лог IX, курган № 3, погребение 1, VII–VIII вв. н.э. [14]. Дубовский р-н, х. Вербовый Лог | Европеоидный |
| 1251 | Мг. Кутейников II, курган № 2, погребение 1, конец VII– начало VIII в. н.э. [28]. Зимовниковский р-н, ст. Кутейниковская | Н/д |
| 1564 | Мг. Частые курганы, курган № 3, погребение 1, первая половина VIII в. н.э. [29]. Белокалитвенский р-н, к СВ от ст. Краснодонецкая | Европеоидный |
| 1566 | Мг. Частые курганы, курган № 9, погребение 1, первая половина VIII в. н.э. [29]. Белокалитвенский р-н, ст. Краснодонецкая | Н/д |
| 1986 | Мг. Таловый, курган № 3, погребение 1, вторая половина VIII– начало IX в. н.э. [13, 30]. Орловский р-н, х. Камышовка | Монголоидный/ европеоидный |
Объекты исследования
Объектами исследования послужили отдельные длинные трубчатые кости девяти мужских скелетов из элитных воинских погребений, расположенных в нижнем течении р. Дон на территории современной Ростовской области (рис. 1, табл. 1).
Рис. 1.
Карта мест расположения погребений, из которых происходит исследованный антропологический материал: 1 – № 67, 2 – № 457, 3 – № 531, 4 – № 619, 5 – № 656, 6 – № 1251, 7 – № 1564, 8 – № 1566, 9 – № 1986.
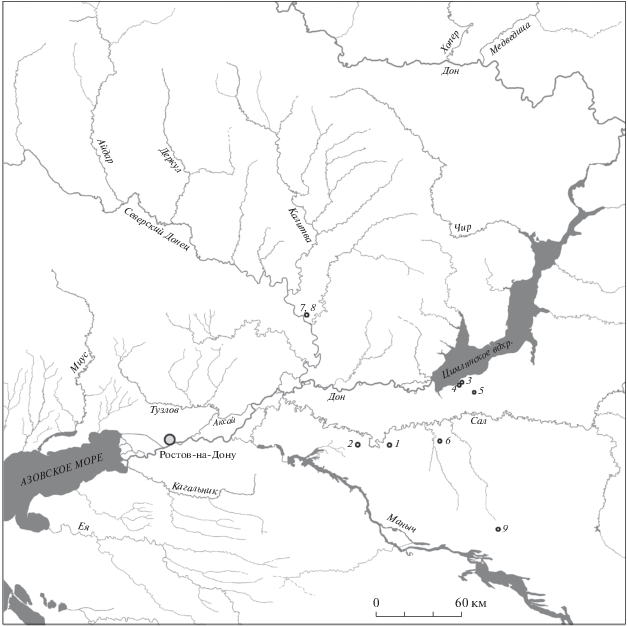
Для проведения молекулярно-генетического анализа использованы следующие объекты: левая плечевая кость (скелет № 67), левая локтевая кость (скелет № 457), правая большеберцовая и левая локтевая кости (скелет № 531), левая бедренная кость (скелет № 619), правая большеберцовая кость (скелет № 656), левая плечевая кость (скелет № 1251), левая большеберцовая кость (скелет № 1564), правая плечевая кость (скелет № 1566), правая плечевая и левая большеберцовая кости (скелет № 1986).
Краниологические исследования по общепринятой методике [31] были проведены на скелетах № 67, 531, 619, 656, 1564 и 1986 [23, 32]. Черепа скелетов № 531, 656 и 1564 обладали комплексом краниометрических признаков преимущественно европеоидного расового типа, а № 67 и 619 – преимущественно монголоидного расового типа. Ввиду плохой сохранности черепа от скелета № 457 проводилась его визуальная оценка, которая показала, что объект обладал предположительно монголоидными чертами. Череп от скелета № 1986 по краниологическим характеристикам был отнесен к смешанному европеоидно-монголоидному типу [32]. У скелетов № 1251, 1566 черепа отсутствовали.
Подготовка помещения для работы с костными объектами
Пробоподготовку костных объектов проводили в помещении, которое в течение двух дней непрерывно подвергали облучению с помощью пятилампового облучателя-рециркулятора закрытого типа “Дезар-7” (суммарная мощность излучения составляла 100 Вт). Далее полы и стены помещения обрабатывали 10%-ным коммерческим раствором “Белизна”, содержащим активный хлор в виде гипохлорита натрия, и оставляли еще на одни сутки с включенным облучателем-рециркулятором “Дезар-7”.
Пробоподготовка костных объектов
Пробоподготовку к экстракции ДНК из полученного костного порошка проводили в отдельной комнате с использованием персональных стерильных средств защиты (халатов, одноразовых масок, шапочек и перчаток).
Для минимизации потерь аутентичной древней ДНК обработку костной поверхности растворами, содержащими активный хлор, не проводили. Вместо этого последующую обработку костного порошка осуществляли с помощью собственно разработанного лизирующего раствора “Cell lysis buffer” (CLB), позволяющего минимизировать потери активной ДНК-матрицы в процессе исследования и устранить возможность контаминации образцов. В основе разработанного метода лежит уникальная методика дифференциального лизиса древнего костного материала с одновременным избирательным лизисом современной контаминирующей ДНК [33].
Поверхность костей очищали при помощи портативной бормашины ПБ-01 с использованием отдельных для каждой кости стерильных фрез. Полученный из поверхностного компактного слоя костный порошок удаляли. Затем заменяли фрезу и получали от 1 до 2 грамм костного порошка из компактного слоя каждой кости. Порошок переносили в отдельные стерильные пробирки объемом 50 мл. Далее проводили дифференциальное устранение возможной контаминации современной ДНК с помощью лизирующего раствора CLB [33]. Последующую процедуру декальцинирования костных порошков проводили однократной обработкой раствором 1%-ного додецилсульфата натрия в 0.5 М ЭДТА, а затем двукратной обработкой раствором 0.5 М ЭДТА.
Выделение ДНК из костного порошка методом органической экстракции
Выделение ДНК из костных порошков проводили методом фенол-органической экстракции [34]. В пробирки, содержащие очищенный костный порошок, добавляли по 4 мл лизирующего раствора (10 мМ трис-HCL, pH 8.3; 50 мМ KCl; 2.5 мМ MgCl2; 0.45% Tween 20), 200 мкл протеиназы К (10 мг/мл) и 100 мкл 2 М раствора дитиотреитола. Для контроля чистоты реагентов в процессе выделения ДНК проводили экстракцию пробы, содержащей реактивы, используемые в процессе выделения (холостая проба). Тщательно перемешивали. Инкубировали при температуре 56°С в течение двух часов, затем при температуре 40°С в течение 16 ч в шейкере-инкубаторе SI-300 (JEIOTECH). Далее добавляли равный содержимому пробирки объем смеси фенол–хлороформ–изоамилол (25 : 24 : 1) и в течение 40 с встряхивали на вортексе на максимальных оборотах. Центрифугировали содержимое пробирок в течение 10 мин при 5000 g. Верхнюю водную фазу осторожно, не затрагивая интерфазу, переносили в стерильные пробирки объемом 15 мл. Процедуру экстракции смесью фенол–хлороформ–изоамилол повторяли еще один раз. К водному раствору, содержащему ДНК, добавляли равный объем смеси хлороформ–изоамилол (24 : 1), встряхивали на вортексе 30 с, центрифугировали содержимое пробирок 10 мин при 5000 g. Верхнюю водную фазу с ДНК дополнительно очищали и концентрировали с помощью колонок “Amicon Ultra-4, ultracel30k”. Процедуру концентрирования проводили следующим образом. После двукратной промывки стерильной деионизованной водой (по 4 мл) еще один раз промывали стерильным ТЕ-буфером (по 4 мл). Конечный объем очищенных препаратов ДНК составлял около 100 мкл. Выделение ДНК из образцов № 67, 457, 531, 619, 656, 1251, 1564, 1566 и 1986 проводили в трех независимых параллелях.
Аутентичность препаратов ДНК, полученных из костных останков № 67, 531, 619, 656, 1251, 1564, 1566 и 1986, доказана ранее [24] с помощью биоинформационного анализа геномных библиотек.
Типирование STR-локусов Y-хромосомы по системе Yfiler (DYS456, DYS389I, DYS390, DYS389II, DYS458, DYS19, DYS385a, DYS385b, DYS393, DYS391, DYS439, DYS635, DYS392, YGATA H4, DYS437, DYS438, DYS448)
Амплификацию участков Y-хромосомы осуществляли с использованием набора “AmpFlSTR Yfiler PCR Reagents” (Applied Biosystems). При постановке полимеразной цепной реакции (ПЦР) в коммерческую реакционную смесь дополнительно добавляли ДНК-полимеразу AmpliTaq Gold DNA-Polymerase (Applied Biosystems) в количестве 1 ед. на каждые 10 мкл ПЦР-смеси.
Энзиматическую амплификацию локусов ДНК осуществляли с помощью термоциклера GeneAmp PCR System 9700 (Applied Biosystems) в режиме эмуляции 1°С/с в течение 30 циклов. Электрофорез образцов проводили с помощью ДНК-анализатора ABI PRISM 3130xl (Applied Biosystems). Инжекция образцов осуществлялась при напряжении 2.0 кВ в течение 13 с. Обработку результатов электрофореза и идентификацию аллелей проводили с помощью программы GeneMapper ID (версия 3.2). Типирование препаратов ДНК образцов № 67, 619, 1564 и 1566 проводили в шести параллелях; образцов № 457, 531 – в семи параллелях; образца № 1251 – в четырех параллелях; образца 656 – в пяти параллелях; образца № 1986 – в девяти параллелях.
Типирование STR-локусов Y-хромосомы по системе CordYs (DYS19, DYS389I, DYS389II, DYS390, DYS391, DYS392, DYS393, DYS385a, DYS385b, DYS438, DYS439, DYS437, DYS447, DYS576, DYS449, DYS456, DYS448 и DYS635)
Амплификацию участков Y-хромосомы осуществляли с использованием набора CordYs (Гордиз). При постановке ПЦР в коммерческую реакционную смесь дополнительно добавляли ДНК-полимеразу SynTaq (Синтол) в количестве 1 ед. на каждые 10 мкл ПЦР-смеси.
Энзиматическую амплификацию локусов ДНК осуществляли с помощью термоциклера GeneAmp PCR System 9700 (Applied Biosystems) в режиме эмуляции 1°С/с (при этом скорость нагрева с 60 до 72°С устанавливали как 0.3°С/с) в течение 30 циклов. Электрофорез образцов проводили с помощью ДНК-анализатора ABI PRISM 3130xl (Applied Biosystems). Инжекция образцов осуществлялась при напряжении 3.0 кВ в течение 8 с. Обработку результатов электрофореза и идентификацию аллелей проводили с помощью программы GeneMapper ID (версия 3.2). Типирование препаратов ДНК образцов № 531, 656, 1251 и 1986 проводили в трех параллелях; образцов № 67, 619 и 1566 – в четырех параллелях; образца № 1564 – в шести параллелях; образца № 457 – в семи параллелях.
Статистический анализ
Статистический анализ Y-гаплотипов проводили с использованием базы данных “Y chromosome haplotype reference database” (“YHRD”) [35, 36]. Принадлежность гаплотипов к той или иной гаплогруппе оценивали с помощью онлайн-программы “Haplogroup Predictor” [37–39] и онлайн программы “Y-DNA Haplogroup Predictor – NEVGEN” [40].
Определение Y-гаплогрупп с помощью SNaPshot типирования
Для подтверждения наличия у исследуемых костных останков той или иной гаплогруппы, предсказанной с помощью онлайн-программы “Haplogroup Predictor” [39], были проведены дополнительные исследования снипов с помощью подобранных пар праймеров, приведенных в табл. 2.
Таблица 2.
Определение Y-гаплогрупп скелетов хазар с помощью SNaPshot типирования
| № п/п | Проверяемая Y-гаплогруппа | Снип | Использованная пара праймеров | Размер ампликонов, пн |
|---|---|---|---|---|
| 1 | R | M207 Позиция на Y-хромосоме – 13 470 103, замена A на G |
F13 470 073 5'-GGG GCA AAT GTA AGT CAA GC-3' R13 470 176 5'-TGA CTT CTT TTG CCA ATT AGG T-3' |
104 |
| 2 | R1b | M343 Позиция на Y-хромосоме – 3 019 783, замена С на A |
F3 019 714 5'-CGT AGC CCG AGA GAA AAC TG-3' R3 019 831 5'-CCC AAC ACG TGC CTG GCA GC-3' |
118 |
| 3 | R1a | M420 Позиция на Y-хромосоме – 21 311 315, замена T на A |
F21 311 266 5'-AAA TGG TGG AAG CAG ATT GG-3' R21 311 338 5'-AGC ATC TTT TCA TTG GTT TC-3' |
73 |
| 4 | Q | M242 Позиция на Y-хромосоме – 12 906 671, замена C на T |
F12 906 644 5'-TTT GTG CAA AAA GGT GAC CA-3' R12 906 717 5'-CGT TAA AAT AGA TTT TTT TCA A-3' |
74 |
| 5 | N | M231 Позиция на Y-хромосоме – 13 357 844, замена G на A |
F13 357 744 5'-CTG GAA AAT GTG GGC TCG T-3' R13 357 871 5'-AAT TCT TTG ACG ATC TTT CC-3' |
128 |
Энзиматическую амплификацию проводили при помощи термоциклера GeneAmp PCR System 9700 (Applied Biosystems) при Ramp = max в течение 40 циклов с использованием следующей программы: предварительная инкубация при 95°С в течение 4 мин; этап денатурации при 95°С в течение 15 с, этап отжига праймеров при 60°С (для всех, кроме пары праймеров F12 906 644/R12 906 717, для которых температуру отжига устанавливали 56°С) в течение 35 с, этап элонгации при 72°С в течение 40 с; этап последующей инкубации при 72°С в течение 10 мин.
Продукты амплификации очищали от избытка дезоксинуклеотидтрифосфатов и праймеров с помощью набора реактивов на магнитных частицах CleanMag DNA (Евроген).
SNP-типирование проводили с помощью набора ABI PRISM SNaPshot Multiplex Kit (Thermo Scientific).
Реакционную смесь готовили, как показано в табл. 3.
Таблица 3.
Состав реакционной смеси, используемой для постановки SNaPshot реакции
| Компоненты | Объем, мкл |
|---|---|
| SNaPshot Multiplex Ready Reaction Mix | 2.0 |
| BigDye Terminator v1.1 & v3.1 5× Sequencing Buffer (Applied Biosystems™) | 2.0 |
| Tail-primer M207 (5 мкМ) F 5'-GTA AGT CAA GCA AGA AAT TTA-3', либо tail-primer M420 (5 мкМ) F 5'-GCA AAC TTT TCA TTG CTG GCC TCC A-3', либо tail-primer M343 (5 мкМ) R 5'-CAG CAT AGC CAC CCC CAC ATA TCT CCA GGT GT-3', либо tail-primer M231 (5 мкМ) (T)38 CATTTACTGTTTCTACTGCTTTC, либо tail-primer M242 (5 мкМ) (T)53 GTGCAAAAAGGTGACCAAGGTGCT |
1.0 |
| Деионизованная вода | 3.0 |
| Очищенные ампликоны | 2.0 |
Амплификацию проводили при помощи термоциклера GeneAmp PCR System 9700 (Applied Biosystems) в режиме эмуляции 1°С/с в течение 25 циклов по стандартной программе: предварительная инкубация при 95°С в течение 1 мин; этап денатурации при 95°С в течение 10 с, этап отжига праймера при 50°С в течение 5 с, этап элонгации при 60°С в течение 30 с.
Продукты амплификации очищали от избытка флуоресцентно меченных дидезоксинуклеотидтрифосфатов путем инкубации при 37°С в течение 80 мин (с последующей финальной инкубацией при 80°С в течение 15 мин) с ферментом щелочной фосфатазой креветки (Shrimp Alkaline Phosphatase, SAP) из расчета 1 ед. SAP на 10 мкл смеси.
Последующую идентификацию продуктов амплификации проводили с помощью ДНК-анализатора ABI PRISM 3130xl (Applied Biosystems). В качестве размерного стандарта использовали LIZ120.
РЕЗУЛЬТАТЫ
Результаты типирования полиморфных микросателлитных локусов Y-хромосомы, а также Y‑SNP девяти скелетов из курганных погребений хазарского времени, расположенных на территории Ростовской области, приведены в табл. 4.
Таблица 4.
Результаты типирования Y-STR локусов (DYS389I, DYS390, DYS389II, DYS458, DYS19, DYS385a, DYS358b, DYS393, DYS391, DYS439, DYS635, DYS392, YGATA H4, DYS437, DYS438, DYS448, DYS447, DYS576, DYS449) исследованных объектов
| Локус | 67 | 457 | 531 | 619 | 656 | 1251 | 1564 | 1566 | 1986 |
|---|---|---|---|---|---|---|---|---|---|
| DYS456 | 15 | 16 | 16 | 16 | 17 | 15 | 16 | 15 | 15 |
| DYS389I | 14 | 12 | 13 | 13 | 13 | 13 | 13 | 14,15 | 13 |
| DYS390 | 19 | 23 | 24 | 23 | 24 | 25 | – | 23 | 25 |
| DYS389II | 30 | 31 | 30 | 28 | 29 | 31 | – | 31 | 32 |
| DYS458 | 17 | 17 | 16 | 16 | 17 | 15 | 17 | 17 | 16 |
| DYS19 | 14 | – | 16 | 13 | 15 | 16 | – | 14 | 16 |
| DYS385a | 13 | 13 | 11 | 13 | 12 | 10 | 12 | 11 | 11 |
| DYS385b | 13 | 14 | 14 | 18 | 15 | 14 | 15 | 13 | 15 |
| DYS393 | 13 | 14 | 13 | 13 | 13 | 14 | 13 | 14 | 13 |
| DYS391 | 11 | 10 | 11 | 10 | 10 | 11 | 10 | 11 | 11 |
| DYS439 | 14 | 11 | 10 | 12 | 12 | 10 | 12 | 10 | 10 |
| DYS635 | 24 | 21 | 23 | 23 | 21 | 23 | – | 22 | 23 |
| DYS392 | 13 | 11 | 11 | 16 | 11 | 11 | 11 | 16 | 11 |
| YGATA H4 | 11 | – | 12 | 9 | 11 | 11 | 12 | 11 | 13 |
| DYS437 | 15 | 14 | 14 | 14 | 14 | 14 | 14 | 14 | 14 |
| DYS438 | 10 | 11 | 11 | 11 | 11 | 11 | 11 | 11 | 11 |
| DYS448 | 19 | 20 | 20 | 22 | NA | 20 | 19 | 19 | 20 |
| DYS447 | 23 | 23 | 24 | 28 | 30 | 24 | 30 | 26 | 24 |
| DYS576 | 16 | – | 18 | 18 | 18 | 19 | – | – | 18 |
| DYS449 | 33 | 31 | 32 | 27 | 29 | 33 | – | 28 | 32 |
| YHRD Y Haplogroup Prediction | R1b | G2a | R1a | Q | C3 | R1a | C3 | N | R1a |
| Fitness score | 17 | 38 | 87 | 39 | 61 | 54 | 48 | 57 | 65 |
| Probability, % | 78.5 | 67.8 | 100 | 100 | 100 | 100 | 99.8 | 100 | 100 |
| NEVGEN Y Haplogroup | R1b | G2a2 | R1a | Q | C2b1a1b1 | R1a | C2b1a1b1 | N1a1 | R1a |
| Fitness score | 58.4 | 34.3 | 56.4 | 18.7 | 43.1 | 40.2 | 31 | 43.7 | 40.2 |
| Probability, % | 99.1 | 16.5 | 100 | 3.6 | 100 | 100 | 99.8 | 87.4 | 100 |
| Подтверждение SNaPshot | R1b | * | R1a | Q | * | R1a | * | N | R1a |
Примечание. Полужирным шрифтом с подчеркиванием выделены локусы, относящиеся к так называемому минимальному гаплотипу (Minimal “YHRD” Core Loci); “–” – получить устойчивые результаты типирования данного локуса не представилось возможным; NA – сокращенное от Null Allele; “*” – Y-гаплогруппа с использованием метода SNaPshot не установлена; С3 – устаревшая классификация (в новом дереве нет гаплогруппы C3) [41].
Как видно из табл. 4, останки трех скелетов имели Y-гаплогруппы R1a (531, 1251, 1986), двух других – Y-гаплогруппы C2b (656, 1564), остальные – G2a (457), N1a (1566), Q (619) и R1b (67). Такое разнообразие характерно для смеси как западноевразийских (G2a, R1a, R1b), так и восточноазиатских (C2b, N1a, Q) гаплогрупп, что указывает на значительные различия патрилиний хазар.
С точки зрения происхождения данных отцовских линий гаплогруппы R1a и R1b распространены в Евразии [42], где R1a достигает своей самой высокой частоты в Восточной Европе [43] и Индии [44], а R1b является самой распространенной гаплогруппой в Западной Европе [45], достигая наибольшей частоты на Британских островах [46] и среди басков [47], а наименьшей частоты – в Восточной Европе и Западной Азии. Гаплогруппа C2b в основном распространена в Восточной Евразии [48], а также встречается во всей Азии, Восточной Сибири, на Кавказе и на Ближнем Востоке. Скорее всего, это связано с распространением тюркских и монгольских народов. N1a распространена в Северной Европе (финны, балты), а также в Западной Сибири (якуты, нганасаны, буряты и ненцы), откуда она, вероятно, и берет свое начало [49]. Гаплогруппа G2a встречается в Турции [50], на Кавказе и на Ближнем Востоке [51]. Гаплогруппа Q преобладает в Центральной и Восточной Азии, откуда она распространилась в Америку [52].
Сравнительный краниологический и генетический анализ хазарских останков не показал полного соответствия между географическим происхождением Y-гаплогрупп и предполагаемым биологическим происхождением исследуемых скелетов (табл. 5).
Таблица 5.
Выявленные совпадения в базе “YHRD” на 20.04.2020 г.
| “YHRD” | № 67 | № 531 | № 1251 | № 1986 | |||||
|---|---|---|---|---|---|---|---|---|---|
| Yfiler-гаплотип | Количество совпадений в базе | 7/246 821 | 3/246 821 | 0/24 6 821 | 0/246 821 | ||||
| Страна/частота совпадений | Китай | 7/103 994 | Афганистан | 3/743 | – | – | |||
| Минимальный гаплотип | Количество совпадений в базе | 88/307 169 | 255/307169 | 0/307 169 43/307 169* |
14/307 169 | ||||
| Страна/частота совпадений | Казахстан | 15/741 | Афганистан | 48/743 | Литва* | 3/634 | Индия | 3/6121 | |
| Узбекистан | 3/176 | Эстония | 3/186 | Венгрия* | 3/1641 | Испания | 2/8369 | ||
| Афганистан | 3/743 | Пакистан | 32/3136 | Словакия* | 2/1201 | Китай | 3/106 194 | ||
| Россия | 7/3954 | Латвия | 2/197 | Бельгия* | 2/1628 | – | – | ||
| Китай | 55/106 194 | Словакия | 7/1201 | Швейцария* | 2/1698 | – | – | ||
| – | – | Норвегия | 11/1574 | Индия* | 5/6121 | – | – | ||
| – | – | Великобритания | 16/4351 | Россия* | 2/3954 | – | – | ||
| – | – | Польша | 19/7974 | Польша* | 3/7974 | – | – | ||
| – | – | Россия | 10/3954 | – | – | – | – | ||
| – | – | Индия | 23/6121 | – | – | – | – | ||
| – | – | Иран | 6/2565 | – | – | – | – | ||
| – | – | Китай | 19/106 194 | – | – | – | – | ||
В результате проведенного анализа результатов типирования Y-STR и Y-SNP были получены гаплотипы для каждого хазарского индивидуума (табл. 4). Результаты сравнительного анализа хазарских Y-гаплотипов с современными популяциями будут описаны ниже.
В ДНК из костных останков № 1566 зафиксирована редкая мутация (одновременное присутствие аллелей 14 и 15), являющаяся следствием дупликации локуса DYS389I. Эта мутация была подтверждена результатами генотипирования как с помощью тест-системы Yfiler (в трех параллельных экспериментах из пяти), так и при помощи тест-системы CordYs (во всех параллельных экспериментах). В базе данных Y-гаплотипов “YHRD” [35, 36] данная дупликация встречается только дважды (в Италии и Китае), соответственно частота данной дупликации составляет 8.1 × × 10–6 (95% CI: 1/1 019 039–1/34 164).
У скелетов № 656 и 1564, при типировании локуса DYS447 выявлен редкий аллель 30. Хотя краниологическое исследование показало, что у этих скелетов были европеоидные типы, этот аллель почти никогда не встречается в европейских популяциях [53]. Вместо этого он наблюдается с низкой частотой в азиатских популяциях, таких как монголы и таджики (где его частота составляет 0.0188 и 0.007 соответственно) [54]. Используя алгоритмы онлайн-ресурса “Haplogroup Predictor” [39], было установлено, что Y-хромосомы обоих скелетов (№ 656, 1564) принадлежат к гаплогруппе C3 (устаревшая классификация), которая в основном встречается среди жителей Восточной Азии [55].
Также стоит отметить, что несмотря на высокую активность ДНК-матриц, выделенных из костных фрагментов скелета № 656, в ходе проведения мультилокусных ПЦР с помощью тест-систем Yfiler и CordYs не удалось получить ампликоны локуса DYS448, что, вероятно, связано с мутацией (или мутациями) в месте (местах) специфического отжига праймеров. Согласно базе данных Y-гаплотипов “YHRD” нулевой аллель (Null allele) локуса DYS448 встречается довольно часто – зарегистрировано 729 случаев, что на 1–2 порядка превышает аналогичные показатели для остальных исследованных Y-STR-локусов.
С помощью онлайн-ресурса “Haplogroup Predictor” [39] по результатам типирования 20 микросателлитных локусов Y-хромосомы было предсказано наличие гаплогруппы R у четырех скелетов из девяти. Дальнейшие исследования снипов M207, M420 и M343 подтвердили результаты “Haplogroup Predictor”, что Y-хромосомы четырех из исследованных скелетов принадлежат к гаплогруппе R. Скелет № 67 имеет R1b гаплогруппу, а ДНК остальных трех скелетов, № 531, 1251 и 1986, относятся к гаплогруппе R1a.
В результате типирования Y-STR скелета № 67 был выявлен редкий аллель 19 локуса DYS390, частота которого по данным базы “YHRD” составляет 1.09 × 10–3. Этот аллель в основном встречается в азиатских популяциях, таких как казахи (с частотой 0.0283), узбеки (с частотой 0.0227) и полинезийцы Французской Полинезии (с частотой 0.0167) [35, 36]. Кроме того, у скелета № 67 в локусе DYS439 был выявлен редкий аллель 14, присущий в основном полинезийцам Французской Полинезии и лаосцам с частотами 0.2778 и 0.1111 соответственно.
Согласно ресурсу “YHRD” [35, 36] 17-локусный гаплотип системы Yfiler, характерный для скелета № 67, обнаружен в Китае, тогда как минимальный 9-локусный Y-гаплотип (DYS19, DYS389I, DYS389II, DYS390, DYS391, DYS392, DYS393, DYS385a, DYS385b) распространен по всей Азии: в Китае, а также в Казахстане, Узбекистане, Афганистане (табл. 5).
17-Локусный гаплотип системы Yfiler скелета № 531 с Y-гаплогруппой R1a обнаружен только в Афганистане (табл. 5). Его минимальный Y-гаплотип также наиболее распространен в Афганистане, где его частота достигает 6.5%. В противоположность этому 17-локусные Y-гаплотипы для двух других скелетов, принадлежащих к гаплогруппе R1a (№ 1251, 1986), были уникальными для базы Y-HRD. Для скелета № 1251 его минимальный 9-локусный гаплотип уникален, тогда как гаплотип скелета № 1986 встречается с крайне низкой частотой в различных популяциях (индейцы, испанцы и китайцы (0.049, 0.039 и 0.003% соответственно).
Дальнейшее сравнение было сделано с открытыми базами данных FamilyTreeDNA.com, а именно с проектами “R1b and Subclades Project for R1b” [56], “R1b Basal Subclades” [57], “R-U152 and Subclades Research Project” [58] для образца № 67. Для образцов № 531, 1251, 1986 было проведено сравнение с базой FamilyTreeDNA.com “R1a1a and Subclades Y-DNA Project” [59]. Сравнение проводилось по минимальному гаплотипу (DYS389I, DYS390, DYS389II, DYS19, DYS385a, DYS385b, DYS393, DYS391, DYS392). Для образца № 67 было найдено 22 совпадения в популяциях по всей Евразии; для № 531 было выявлено 56 совпадений, в основном из европейских стран; а для образцов № 1251, 1986 обнаружено всего несколько совпадений в европейских странах.
ОБСУЖДЕНИЕ
В настоящем исследовании проанализирована вариация Y-хромосомы девяти хазарских скелетов, датируемых концом VII–началом IX в. нашей эры. Путем генотипирования Y-STR и Y-SNP были определены Y-гаплогруппы и охарактеризованы Y-гаплотипы исследованных останков. Обнаружены как западноевразийские (G2a, R1a, R1b), так и восточноазиатские (C2, N1a, Q) Y-гаплогруппы.
При сравнении результатов молекулярно-генетического анализа с данными антропологических типов, определенных с помощью краниологического анализа, были выявлены некоторые несоответствия в отношении географического происхождения Y-гаплогрупп и биологического происхождения, предсказанного из краниологических исследований. Эти результаты свидетельствуют о сложном генетическом происхождении изучаемых объектов.
Сравнение полученных результатов с данными предыдущих генетических исследований этих же останков [24] показало, что ни один из скелетов не имеет 100%-ного западноевразийского генетического происхождения. Процент восточноазиатских предков варьировался от 10 (№ 1251) до 75 (№ 1566).
Установлено соответствие Y-гаплогруппы скелета № 619 (Q) с прогнозируемым краниологическим типом, в то время как у скелетов № 457 (G2a) и 1566 (N1a) такое соответствие не обнаружено. Кроме того, люди с восточноазиатской гаплогруппой C2b1a1b1 имели европеоидный (№ 656) и смешанный европеоидно-монголоидный (№ 1564) краниологические типы.
Наблюдаемый сложный паттерн генетического сродства также наблюдался в данных полногеномного анализа исследованных останков. Скелет № 656 демонстрирует генетическое сходство с башкирами и киргизами, а № 1564 генетически сходен с лезгинами [24]. При этом все популяции имеют смешанное генетическое происхождение. Кроме того, для скелета № 619 выявлено генетическое сходство с популяциями Ближнего Востока, а для скелета № 1566 – с популяциями Восточной Азии.
С точки зрения происхождения исследованных костных останков хазар по материнской линии ранее было установлено, что скелеты № 619, 1564 имели гаплогруппы митохондриальной ДНК (мтДНК), свойственные населению Западной Евразии (H1a3 и H13c1 соответственно), а скелеты № 656, 1566 – гаплогруппы мтДНК Восточной Евразии (C4a1 и D4b1a1a соответственно) [24].
Этот паттерн соответствовал индивидуумам, имеющим Y-хромосомы, принадлежащие к гаплогруппе R (скелеты № 67, 531, 1251, 1986). Среди принадлежащих к гаплогруппе R1a скелеты № 531 и 1251 имеют европеоидный антропологический тип, а скелет № 1986 классифицируется как смешанный европеоидно-монголоидный тип. Напротив, скелет № 67 принадлежит к гаплогруппе R1b, наиболее распространенной в Европе, и имеет монголоидный краниологический тип [24].
Данные результаты исследования Y-хромосомы согласуются с данными полногеномного анализа исследованных останков. Скелет № 67 имеет тесную генетическую связь с казахами, бурятами и ханьцами [24]. Кроме того, скелеты № 531, 1251 генетически сходны с популяциями Ближнего Востока, а скелет № 1986 – сходен с популяциями Восточной Азии.
Скелеты № 1251, 531 относятся к митогруппе, распространенной в Европе, на Кавказе, в Турции и на Ближнем Востоке (H5b и X2e соответственно). В отличие от этого скелет № 1986 имеет митогруппу C4a1c, которая обычно наблюдается в Восточной Азии [24], а скелет № 67 с гаплогруппой Y-хромосомы R1b имеет типичную для Восточной Азии митогруппу D4e5. Таким образом, независимо от части анализируемого генома, образцы хазар показали смешанную генетическую родословную [24].
Подводя итог, можно сказать, что анализ древней ДНК костных останков человека из хазарских археологических комплексов, представленный в настоящем и предыдущем исследованиях, выявил среди них значительное генетическое разнообразие. Результаты генетического исследования не полностью соответствуют биологическому происхождению, предсказанному из антропологических исследований или их общей этнокультурной принадлежности. Это разнообразие, вероятно, произошло в результате этнической консолидации, возникшей в результате военных и политических конфедераций изначально разнообразных племен во время образования Хазарского каганата. Фактически сочетание биологического разнообразия в этнических и социальных группах наблюдается с раннего железного века в Восточной Евразии (Сибирь и Центральная Азия) и с первых веков Общей эпохи в восточноевропейских степях [60]. Смешанные антропологические типы также типичны для современных народов, как это видно из недавних широкомасштабных генетических исследований современных татар [61]. Таким образом, мы приходим к выводу, что хазарская знать раннего средневековья имела смешанную географическую родословную, отражающую тысячелетний процесс этногенеза и формирования населения.
Исследование выполнено при финансовой поддержке гранта Правительства Российской Федерации № 075-15-2019-1879 “От палеогенетики до культурной антропологии: комплексное интердисциплинарное исследование традиций народов трансграничных регионов: миграции, межкультурное взаимодействие и картина мира”. Пробоподготовка биологических образцов выполнена в рамках реализации госзадания ЮНЦ РАН, № гр. проекта 01201363186.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Артамонов М.И. История хазар. Л.: Изд-во гос. Эрмитажа, 1962. 523 с.
Плетнева С.А. Хазары. М.: Наука, 1976. 96 с.
Новосельцев А.П. Хазарское государство и его роль в истории Восточной Европы и Кавказа. М.: Наука, 1990. 264 с.
Калинина Т.М. Хазарский каганат // Кочевые империи Евразии: особенности исторической динамики / Под ред. Базарова Б.В., Крадина Н.Н. М.: Наука-Вост. лит., 2019. С. 214–232.
Шорохов В.А. Хазарский каганат и сфера его влияния в IX в. (по данным “Анонимной записки” и “Книги путей и стран” Ибн Хордадбеха) // Труды исторического факультета Санкт-Петербургского ун-та. 2010. С. 88–98.
Ludwig D. Struktur und gesellschaft des Chazaren-Reiches im Licht der schriftlichen Quellen. Berlin, 1982. P. 127–156.
Флёров В.С. Цимлянский комплекс хазарского времени на Нижнем Дону // Поволжская археология. 2015. Т. 11. № 1. С. 4–40. https://doi.org/10.24852/pa2015.1.11.4.39
Флёров В.С. “Города” и “замки” Хазарского каганата: Археологическая реальность. М.: Мосты культуры/Гешарим, 2011. 264 с.
Афанасьев Г.Е. О территории Хазарского каганата и хазарского “домена” в IX веке // Дивногорский сборник. Воронеж, 2016. Вып. 6. С. 41–72.
Очир-Горяева М.А., Ситдиков А.Г., Кияшко Я.А., Нага Т. К изучению памятника эпохи раннего средневековья Башанта-II // Поволжская археология. 2016. Т. 18. № 4. С. 23–36.https://doi.org/10.24852/pa2016.4.18.23.36
Очир-Горяева М.А., Ситдиков А.Г., Кекеев Э.А., Буратаев Е.Г. Первые результаты археологических раскопок на поселении эпохи раннего средневековья Башанта-II // Бюл. Калмыцкого науч. Центра РАН. 2017. № 3(3). С. 12–55. https://doi.org/10.22162/2587-6503-2017-3-3-12-55
Афанасьев Г.Е., Атавин А.Г. Что же такое хазарский погребальный обряд? (Проблемы материала, археологического анализа и интерпретации) // Хазары: Тез. Второго Междунар. коллоквиума. М., 2002. С. 11–14.
Глебов В.П., Иванов А.А. Кочевническое погребение хазарского времени из курганного могильника Таловый II Дону // Средневековые древности Дона: Материалы и исследования по археологии Дона / Под ред. Гугуева Ю.К. М.: Мосты культуры/Гешарим, 2007. С. 154–176.
Иванов А.А., Копылов В.П. Xазарские серебряные поясные наборы из курганов междуречья Дона и Сала // Донская археология. 2000. № 1. С. 81–90.
Иванов А.А. Раннесредневековые подкурганные кочевнические захоронения второй половины VII–первой половины IX в. Нижнего Дона и Волго-Донского междуречья: Дис. … канд. ист. наук. Волгоград: Волгоград. гос. ун-т, 2000. 252 с.
Иванов А.А., Копылов В.П., Науменко С.А. Поясные наборы из курганов хазарского времени междуречья Дона и Сала // Донская археология. 2000. № 1. С. 84–85.
Копылов В.П., Иванов А.А. Погребение знатного воина хазарского времени из могильника Саловский // Средневековые давности Дона: Сб. статей. М.: Мосты культуры/Гешарим, 2007. С. 119–153.
Науменко В.Е. К вопросу об образовании Хазарского каганата // Хазарский альманах. Харьков, 2004. Т. 2. С. 64–70.
Науменко С.А. Отчет об исследованиях в зоне строительства Цимлянской оросительной системы в 1989 году // Архив археол. лаб. РГУ. 1990. Ф-12, д. 5.
Гинзбург В.В. Антропологические данные по этногенезу хазар // Сов. этнография. 1946. № 2. С. 81–86.
Балабанова М.А. Особенности антропологического состава погребальных комплексов хазарского времени // Некоторые актуальные проблемы современной антропологии. СПб.: МАЭ РАН, 2006. С. 59–61.
Балабанова М.А. Антропологическая структура населения хазарского времени восточноевропейских степей // Население Юга России с древнейших времен до наших дней (Донские антропологические чтения). Ростов-на-Дону, 2013. С. 76–79.
Батиева Е.Ф. Антропология населения Нижнего Подонья в хазарское время // Донская археология. Ростов-на-Дону. 2002. № 3–4. С. 71–101.
Mikheyev A.S., Qiu L., Zarubin A. et al. Diverse genetic origins of medieval steppe nomad conquerors // Biorxiv, December 16. 2019.https://doi.org/10.1101/2019.12.15.876912
Савченко Е.И. Отчет об исследованиях археологических памятников в зоне строительства Мартыновской оросительной системы в 1981 г. // Архив археол. лаб. РГУ. 1981. Ф-10, д. 2/1.
Ильюков Л.С. Отчет об исследовании курганного могильника у х. Нового Мартыновского района Ростовской области в 1982 году // Археол. лаб. РГУ. 1983. Ф-10, д-1.
Науменко С.А. Отчет об исследованиях в зоне строительства Цимлянской оросительной системы в 1986 г. // Археол. лаб. РГУ. 1987. Ф-12, д-2.
Парусимов И.Н. Раскопки курганов в Зимовниковском районе. Могильник Кутейникова И.И. // Тр. Новочеркасской археол. экспедиции. 1998. № 3. С. 15–16.
Ильюков Л.С., Максименко В.Е., Ключников В.В., Гуркин С.В. Исследование нижнедонских Частых курганов в 2001 году // Историко-археологические исследования в г. Азове и на Нижнем Дону в 2001 году. Вып. 18. Азов, 2002. С. 162–163.
Глебов В.П. Раннесредневековое погребение из курганного могильника Таловый II // Историко-археологические исследования в г. Азове и на Нижнем Дону в 2001 году. Вып. 21. Азов, 2006. С. 86–89.
Алексеев В.П., Дебец Г.Ф. Краниометрия // Методика антропологических исследований. М.: Наука, 1964. 128 с.
Батиева Е.Ф. Антропология погребения хазарского времени из могильника Таловый II // Средневековые древности Дона: Материалы и исследования по археологии Дона. Вып. II. М.: Мосты культуры/Гешарим, 2007. С. 177–181.
Корниенко И.В., Фалеева Т.Г., Махоткин М.А. и др. Инновационный метод выделения древней ДНК // Материалы Междунар. науч. конф. “Азак и мир вокруг него” (Азов, 14–18 октября 2019 г.). Азов, 2019. С. 268–271.
Корниенко И.В., Харламов С.Г. Методы исследования ДНК человека. Выделение ДНК и ее количественная оценка в аспекте судебно-медицинского исследования вещественных доказательств биологического происхождения: учебно-методическое пособие. Ростов-на-Дону: ЮФУ, 2012. 216 с.
Willuweit S., Roewer L. Y chromosome haplotype reference database (YHRD): update // Forensic Sci. Intern.: Genetics. 2007. V. 1. № 2. P. 83–87. https://doi.org/10.1016/j.fsigen.2007.01.017
Y chromosome haplotype reference database (YHRD) https://yhrd.org (дата обращения: 20.04.2020).
Athey T.W. Haplogroup prediction from Y-STR values using an allele frequency approach // J. Genet. Geneal. 2005. V. 1. P. 1–7.
Emmerova B., Ehler E., Comas D. et al. Comparison of Y-chromosomal haplogroup predictors // Forensic Sci. Intern.: Genetics Suppl. Series. 2017. V. 6. P. 145–147.https://doi.org/10.1016/j.fsigss.2017.09.025
Онлайн-программа “Haplogroup Predictor” http://www.hprg.com/hapest5/index.html (дата обращения: 20.04.2020).
Онлайн программа Y-DNA Haplogroup Predictor – NEVGEN https://www.nevgen.org/ (дата обращения: 20.04.2020).
International society of genetic genealogy. Y-DNA haplogroup C and its subclades – 2019–2020. https://docs.google.com/spreadsheets/d/1XTMjVnybYEfj4mL1UwzDACTy9fZdCbENwdfvKWETO/edit#gid=928240711 (дата обращения: 20.04.2020).
Underhill P., Poznik G., Rootsi S. et al. The phylogenetic and geographic structure of Y-chromosome haplogroup R1a // Eur. J. Hum. Genet. 2015. V. 23. P. 124–131. https://doi.org/10.1038/ejhg.2014.50
Luccote G. The major Y-chromosome haplotype XI – haplogroup R1a in Eurasia // Hered. Genet. 2015. V. 4. № 2. P. 1000150. https://doi.org/10.4172/2161-1041.1000150
Sharma S., Rai E., Sharma P. et al. The Indian origin of paternal haplogroup R1a1* substantiates the autochthonous origin of Brahmins and the caste system // J. Hum. Genet. 2009. V. 54. P. 47–55.https://doi.org/10.1038/jhg.2008.2
Adams S.M., King T.E., Bosch E., Jobling M.A. The case of the unreliable SNP: recurrent back-mutation of Y-chromosomal marker P25 through gene conversion // Forensic Sci. Intern. 2005. V. 159. № 1. P. 14–20.https://doi.org/10.1016/j.forsciint.2005.06.003
Helgason A., Sigurðardóttir S., Nicholson J. et al. Estimating scandinavian and gaelic ancestry in the male settlers of Iceland // Am. J. Hum. Genet. 2000. V. 67. № 3. P. 697–717.https://doi.org/10.1086/303046
Semino O., Passarino G., Oefner P.J. et al. The genetic legacy of paleolithic Homo sapiens sapiens in extant Europeans: A Y chromosome perspective // Science. 2000. V. 290. № 5494. P. 1155–1159.https://doi.org/10.1126/science.290.5494.1155
Wu Q., Cheng H., Sun N. et al. Phylogenetic analysis of the Y-chromosome haplogroup C2b-F1067, a dominant paternal lineage in Eastern Eurasia // J. Hum. Genet. 2020. V. 65. P. 823–829.https://doi.org/10.1038/s10038-020-0775-1
Shi H., Qi X., Zhong H. et al. Genetic evidence of an East Asian origin and paleolithic Northward migration of Y-chromosome haplogroup N // PLoS One. 2013. V. 8. № 6. P. 66102. https://doi.org/10.1371/journal.pone.0066102
Cinnioğlu C., King R., Kivisild T. et al. Excavating Y-chromosome haplotype strata in Anatolia // Hum. Genet. 2004. V. 114. № 2. P. 127–148. https://doi.org/10.1007/s00439-003-1031-4
Rootsi S., Myres N.M., Lin A.A. et al. Distinguishing the co-ancestries of haplogroup G Y-chromosomes in the populations of Europe and the Caucasus // Eur. J. Hum. Genet. 2012. V. 20. № 12. P. 1275–1282.https://doi.org/10.1038/ejhg.2012.86
Zegura S.L., Karafet T.M., Zhivotovsky L.A., Hammer M.F. High-resolution SNPs and microsatellite haplotypes point to a single, recent entry of native American Y chromosomes into the Americas // Mol. Biol. Evol. 2004. V. 21. № 1. P. 164–175.https://doi.org/10.1093/molbev/msh009
Seman A., Abu Bakar Z., Isa M.N. First Y-short tandem repeat categorical dataset for clustering applications // Dataset Papers in Biology. 2013. V. 2013. Article ID 364725. P. 1–9. https://doi.org/10.7167/2013/364725
Di Cristofaro J., Pennarun E., Mazières S. et al. Afghan hindu kush: Where Eurasian sub-continent gene flows converge // PLoS One. 2013. V. 8. № 10. P. 76748. https://doi.org/10.1371/journal.pone.0076748
Malyarchuk B., Derenko M., Denisova G. et al. Phylogeography of the Y-chromosome haplogroup C in Northern Eurasia // Ann. Hum. Genet. 2010. V. 74. № 6. P. 539–546. https://doi.org/10.1111/j.1469-1809.2010.00601.x
База данных FamilyTreeDNA.com, проект “R1b and Subclades Project for R1b”. https://www.familytreedna.com/public/r1b?iframe=yresults (дата обращения: 20.04.2020).
База данных FamilyTreeDNA.com, проект “R1b Basal Subclades”. Https://www.familytreedna.com/ public/R1bBasalSubclades?iframe=yresults (дата обращения: 20.04.2020).
База данных FamilyTreeDNA.com, проект “R-U152 and Subclades Research Project”. https://www.familytreedna.com/public/r1b?iframe=yresults (дата обращения: 20.04.2020).
База данных FamilyTreeDNA.com, проект “R1a1a and Subclades Y-DNA Project”. https://www.familytreedna.com/public/R1a?iframe=yresults (дата обращения: 20.04.2020).
Чикишева Т.А. Динамика антропологической дифференциации населения юга Западной Сибири в эпохи неолита – раннего железа. Новосибирск: ИАЭТ СО РАН, 2012. 468 с.
Балановская Е.В., Агджоян А.Т., Жабагин М.К. и др. Татары Евразии: своеобразие генофондов крымских, поволжских и сибирских татар // Вестник МГУ. Серия XXIII. Антропология. 2016. № 2. С. 75–85.
Дополнительные материалы отсутствуют.


