Генетика, 2021, T. 57, № 5, стр. 528-535
Генетический полиморфизм ядер штаммов Pyrenophora tritici-repentis по генам-эффекторам ToxA и ToxB
Н. В. Мироненко 1, *, А. С. Орина 1, Н. М. Коваленко 1
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Пушкин, Россия
* E-mail: nina2601mir@mail.ru
Поступила в редакцию 14.05.2020
После доработки 23.07.2020
Принята к публикации 25.08.2020
Аннотация
Фитопатогенный гриб Pyrenophora tritici-repentis образует специфичные фитотоксины, кодируемые генами ToxA и ToxB. Цель исследования – выявление генетического полиморфизма ядер по генам-эффекторам ToxA и ToxB как свидетельства гетерокариотичного состояния штаммов P. tritici-repentis. Новизна исследования заключается в использовании оригинального подхода для доказательства гетерокариотичной природы штаммов P. tritici-repentis, заключающегося в оценке доли ядер, несущих гены-эффекторы ToxA и ToxB, относительно общего пула ядер с референтным геном Act1 методом количественной ПЦР. Материалом исследования являлись 21 штамм из трех популяций гриба, а также митотическое (конидиальное) и мейотическое потомство отдельных штаммов (103 субклонов). У 70% ToxA+-штаммов казахстанской популяции P. tritici-repentis доля ядер с геном ToxA оказалась в диапазоне 0.24–0.65, что указывает на их гетерокариотичное состояние. В греческой популяции гриба было выявлено 20% штаммов, у которых доля ядер, несущих ген ToxB, оказалась существенно больше единицы, что указывает на дупликацию этого гена по крайней мере в части ядер. При этом минимум 40% штаммов также оказались гетерокариотичными по гену ToxB. Среди митотического потомства штаммов ToxA+ и ToxB+ выявлен незначительный полиморфизм ядер по наличию в них генов-эффекторов. Доля ядер с определенным геном-эффектором, предположительно, представляет собой генетически наследуемый признак. Выявлена более широкая вариабельность признака “доля ядер с геном ToxA” среди мейотического поотомства, чем среди митотического. Функциональная роль полиморфизма ядер для жизнедеятельности изолятов P. tritici-repentis в составе популяции требует дальнейшего изучения.
Аскомицетный гомоталличный гриб Pyrenophora tritici-repentis (Died.) Drechsler является возбудителем желтой пятнистости листьев пшеницы. Его патогенные свойства определяются продуцированием хозяин-специфичных фитотоксинов [1], из которых наиболее изучены два белковых токсина Ptr ToxA и Ptr ToxB, индуцирующие соответственно некроз и хлороз на листьях сортов пшеницы с комплементарными генами восприимчивости Tsn1 и Tsc2 [2]. Ранее с помощью молекулярно-генетических методов было показано, что ToxA P. tritici-repentis практически идентичен гомологичному гену ToxA другого патогена пшеницы – гриба Parastagonospora nodorum (Berk.) Quaedvl., Verkley & Crous [3, 4]. Также установлено, что ToxA попал в геном Pyrenophora tritici-repentis путем горизонтального переноса генов (ГПГ) от Parastagonospora nodorum [5], в результате чего Pyrenophora tritici-repentis приобрел свойство поражать сорта пшеницы с геном Tsn1. Ген ToxA широко распространен в популяциях гриба: доля изолятов ToxA+ в популяциях может составлять от 50% в Северо-Западном регионе России и Тунисе [6, 7] до 90–100% в Краснодарском крае, а также в Юго-Восточном Казахстане, США и Канаде [8–10]. В отличие от однокопийного гена ToxA [3, 11], ген ToxB является многокопийным [12, 13] и может быть представлен в некоторых изолятах расы 5 девятью копиями [14]. Ген ToxB, очевидно, является эволюционно более “старым” в геноме P. tritici-repentis. Отсутствие полиморфизма между копиями ToxB свидетельствует о том, что амплификация гена произошла относительно недавно [14]. Многими исследователями отмечалась крайне низкая встречаемость или полное отсутствие в популяциях P. tritici-repentis ToxB+ изолятов [9, 10, 15–17], что также подтверждено нашими исследованиями российских популяций гриба [6, 8, 18]. В Греции нами обнаружена уникальная локальная популяция P. tritici-repentis, состоящая только из штаммов ToxB+, что дало возможность использовать ген ToxB, наряду с ToxA, для характеристики гетерокариотичности штаммов P. tritici-repentis.
Гриб P. tritici-repentis характеризуется высокой изменчивостью морфологических признаков [19, 20] и патогенных свойств, что выражается в изменениях расового состава популяций [21–23]. С помощью методов молекулярного фингерпринтинга, таких как RAPD [24], AFLP [25] и SSR [18, 26], была изучена внутри- и межпопуляционная изменчивость патогена по молекулярным маркерам. Высокие показатели генного и генотипического разнообразия изолятов P. tritici-repentis связывают преимущественно с нестабильностью генома гриба, а не с комбинативной изменчивостью при половом процессе, поскольку гриб является гомоталличным [27, 28]. В литературе отсутствуют сведения о существенном вкладе бесполого размножения, а именно гетерокариоза и парасексуального процесса, в изменчивость P. tritici-repentis.
Парасексуальный процесс у фитопатогенных грибов хорошо изучен в лабораторных условиях [29]. Мы не имеем информации о доказательстве существования гетерокариоза у P. tritici-repentis в природе. Значительную вариабельность изолятов P. tritici-repentis по морфологическим признакам и патогенным свойствам [20, 23] некоторые авторы объясняют хромосомным полиморфизмом [12] и наличием значительной доли повторяющихся последовательностей ДНК и транспозабельных элементов (ТЭ) в геноме гриба [30, 31]. Полногеномное секвенирование штаммов P. tritici-repentis позволило выявить многочисленные перестройки хромосом [28] и обосновать роль ТЭ в создании новых генов, подтвердить гипотезу о горизонтальном переносе ToxA и впервые открыть у грибов явление трансдупликации [27]. Таким образом, влияние мобильных элементов и хромосомного полиморфизма играет значительную роль в изменчивости грибов [8], в то же время реальный потенциал гетерокариоза и парасексуального процесса у фитопатогенных грибов в природе остается малоизученным. Наблюдаемую изменчивость P. tritici-repentis можно объяснить гетерокариотичным состоянием мицелия и переносом ядер как между сливающимися гифами мицелия, так и в результате образования анастомозов между конидиями, которые наблюдали у изолятов этого вида [27]. На наш взгляд, доказательство существования генетического полиморфизма ядер в мицелии и конидиях грибов является весомым аргументом для утверждения о существовании в природе гетерокариоза.
Цель данного исследования – доказать гетерокариотичную природу штаммов гриба P. tritici-repentis по генам-эффекторам ToxA и ToxB.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом исследования служили 20 штаммов P. tritici-repentis, которые были выделены из листьев пшеницы с симптомами желтой пятнистости, собранных в Казахстане (Алматинская обл.; 10 штаммов) и Греции (регион Халкидики; 10 штаммов) в 2019 г.
Все штаммы были отобраны по наличию генов-эффекторов ToxA и ToxB методом ПЦР с геноспецифичными праймерами [32]. Штаммы ToxA+ из казахстанской популяции обозначены Каз, ToxB+ штаммы из греческой популяции – Гр. Кроме того, в исследование был включен штамм БЛ-6, выделенный из листьев пшеницы, выращенной в Ленинградской обл. в 2017 г.
Субклоны (конидиальное = митотическое потомство), полученные из штаммов Гр-2, Гр-3 и Гр-5 (13, 11 и 10 шт. соответственно), Каз-3 и Каз-5 (по 12 шт.), БЛ-6 (24 шт.) путем пересева отдельных конидий, также были включены в исследование. Кроме того, для штамма БЛ-6 было получено мейотическое потомство (21 аскоспоровый клон) по методике, описанной ранее [33].
Штаммы P. tritici-repentis выращивали в течение семи суток по ранее описанной методике [34]. Выделение геномной ДНК из мицелия грибов проводили СТАВ-методом [35].
Долю ядер, несущих генетический локус (R), у штаммов из казахстанской и греческой популяций, а также в полученном митотическом и мейотическом потомствах, определяли методом количественной ПЦР, который заключается в одновременной амплификации гена-мишени (ToxA или ToxB) и референтного однокопийного гена, в качестве которого был выбран ген актина Act1 [36]. Ранее этот подход был использован для анализа копийности отдельных генов грибов [37]. Реакции проводили в объеме 20 мкл, содержащем 4 мкл 5×qPCRmix‑HS SYBR мастер-микса (Евроген, Россия), 500 нМ каждого праймера и 2 мкл раствора ДНК с использованием следующего протокола амплификации: 50°C – 2 мин; 95°C – 15 мин; [95°C – 15 с; 62°C – 60 с] × 40 на термоциклере CFX96 Real-Time System (BioRad, США) в трехкратной повторности. Обработку первичных данных осуществляли с помощью программного обеспечения Bio-Rad CFX Manager 1.6. Усредненные данные по каждому гену-мишени нормировали по усредненному показателю референтного гена Act1 для получения величины ΔCt (ΔCt = Ct (ToxA/ToxB) – Ct (Act1)). Долю ядер, несущих генетический локус, рассчитывали по формуле R = 2–ΔΔCt [38]. Полученная величина отражает соотношение количеств копий гена-эффектора (ToxA или ToxB) относительно однокопийного гена “домашнего хозяйства” Act1, в каждом ядре. Значение R < 1, предполагающее наличие гена-эффектора не в каждом ядре, также как и значение R > 1, которое свидетельствует о дупликации генов-эффекторов по крайней мере в части ядер, указывают на гетерокариотичное состояние мицелия штамма гриба.
Статистическую обработку результатов проводили с использованием программ MS Excel 2010 и STATISTICA 10.0. Средние значения показателей сравнивали помощью t-критерия для независимых переменных, различия считали достоверными при р < 0.05.
РЕЗУЛЬТАТЫ
Анализ доли ядер, несущих гены ToxA и ToxB, у штаммов из природных популяций P. tritici-repentis
Штаммы P. tritici-repentis из казахстанской популяции, выделенные в 2019 г., различались по доле ядер (R), несущих ген ToxA, которая варьировала от 0.24 до 1.02, и в среднем оказалась равна 0.70 (рис. 1). У шести штаммов из казахстанской популяции показатель R оказался существенно меньше 1, что указывает на их гетерокариотичное состояние и наличие в мицелии как ToxA+, так и ToxA– ядер.
Рис. 1.
Доля ядер с генами-эффекторами ToxA и ToxВ у изолятов P. tritici-repentis разного географического происхождения.
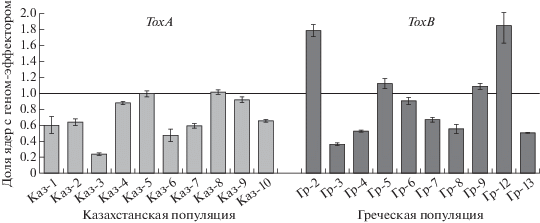
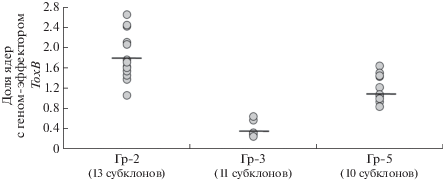
Доля ядер, несущих ген ToxB, у штаммов из греческой популяции в среднем составляла 0.93. У двух штаммов количество копий гена ToxB значительно превышало общее количество ядер, выраженное через референтный ген Act1 (R равно 1.78 и 1.84 соответственно). Количество копий ToxB у четырех других штаммов, наоборот, было существенно меньше общего числа ядер с геном Act1: величина R = 0.36–0.55. Таким образом, в греческой популяции P. tritici-repentis присутствуют гетерокариотичные штаммы с разным соотношением ToxB+ и ToxB– ядер. Число копий гена ToxB в ядре гриба остается неизвестным, но судя по результатам оценки доли ядер ToxB+ у штаммов Гр-2 и Гр-12 (R = 1.78 и 1.84), оно должно быть не менее двух (рис. 1).
Анализ доли ядер, несущих ген ToxA, в митотическом и мейотическом потомствах штаммов P. tritici-repentis
Для изучения стабильности ядерного состава штаммов ToxA+ при бесполом размножении конидиями выбрали два штамма из казахстанской популяции Каз-3 и Каз-5, а также штамм БЛ-6 из северо-западной популяции, и оценили долю ядер с геном ToxA в их митотическом потомстве (рис. 2).
Рис. 2.
Доля ядер с геном-эффектором ToxA у митотических и мейотических потомков штаммов P. tritici-repentis разного географического происхождения. Линией показана доля ядер с ToxA у “материнского” штамма.
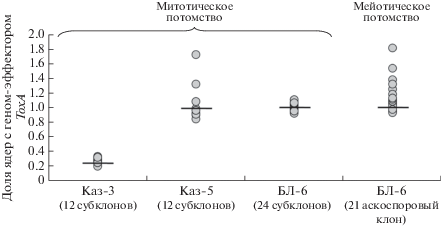
Доля ядер с геном ToxA у субклонов Каз-3 составляла от 0.20 до 0.34 и не имела достоверных отличий от “материнского” штамма (R = 0.24). У 10 из 12 субклонов Каз-5 доля ядер с геном ToxA оказалась в диапазоне 0.85–1.08, близком к уровню “материнского” штамма Каз-5 (R = 0.99). Однако для двух субклонов Каз-5 этот показатель существенно отличался и составил 1.32 и 1.73 соответственно.
Доля ядер с геном ToxA у субклонов штамма БЛ-6 из северо-западной популяции варьировала в узком диапазоне 0.93–1.11 и в среднем оказалась 1.01, что не имеет достоверных отличий от показателя “материнского” штамма (R = 1.02).
Установлено достоверное отличие между митотическими потомствами штаммов Каз-3 и Каз-5 по доле ядер, несущих ген ToxA.
В мейотическом потомстве БЛ-6 доля ядер с геном ToxA у 20 аскоспоровых клонов составила от 0.94 до 1.82. Существенное увеличение доли ядер с геном-эффектором в сравнении с “материнским” штаммом было выявлено у четырех аскоспоровых потомков, у которых эта величина оказалась 1.33–1.82.
Анализ доли ядер, несущих ген ToxВ, в митотическом потомстве штаммов P. tritici-repentis
Из греческой популяции P. tritici-repentis были выбраны три штамма Гр-2, Гр-3 и Гр-5, характеризующиеся наибольшим, наименьшим и средним числом ядер с геном ToxB. У штамма Гр-2 R = 1.78, тогда как у его субклонов этот показатель варьировал от 1.06 до 2.65 и в среднем оказалась 1.83 (рис. 3). У 9 из 11 субклонов штамма Гр-3 значение R для ToxB оказалось в диапазоне 0.25–0.33, что соответствовало показателю “материнского” штамма (R = 0.36), однако у двух субклонов наблюдалось увеличение значения R до 0.57 и 0.65 соответственно (рис. 3). Субклоны штамма Гр-5, в котором отмечали примерно равное количество копий генов ToxB и Act1 (R = 1.12), характеризовались величиной R для гена ToxB в диапазоне 0.84–1.64. Установлено достоверное отличие между митотическими потомствами штаммов Гр-2, Гр-3 и Гр-5 по доле ядер, несущих ToxВ.
ОБСУЖДЕНИЕ
Для доказательства гетерокариотичной природы штаммов P. tritici-repentis мы использовали оригинальный подход – оценку доли ядер, несущих гены-эффекторы, методом количественной ПЦР. С помощью предложенной методики оценили долю ядер с генами ToxA и ToxB относительно референтного гена Act1 в 20 природных штаммах, выделенных в 2019 г. Ранее этот подход был использован для анализа копийности отдельных генов грибов [37].
Полученные результаты свидетельствуют о существовании значительных различий между штаммами в природных популяциях по составу ядер различного генотипа, несущих или не несущих ген-эффектор ToxA или ToxB. У ряда ToxA+-штаммов, так же как и у части ToxВ+-штаммов, не все ядра, имеющие референтный ген Act1, несут ген-эффектор, что позволяет считать их гетерокарионами. Полиморфизм штаммов P. tritici-repentis из природных популяций по соотношению ядер с генами-эффекторами и без них оказался значительно выше, чем полиморфизм конидиального потомства отдельных штаммов. Это обстоятельство позволяет предположить, что соотношение ядер определенного генотипа является специфичным для штамма. Возможно такой значительный полиморфизм среди природных штаммов по соотношению ядер с генами-эффекторами можно объяснить селекцией ядер в результате взаимодействия с растением-хозяином в процессе развития болезни.
Ранее при анализе генетического полиморфизма между штаммами микоризного гриба Rhizophagus irregularis было установлено, что по крайней мере часть изолятов в составе популяции являются гетерокарионами [39]. Авторами также было показано, что генетический полиморфизм ядер каждого штамма сохранялся в популяции с течением времени. Был выявлен разный уровень полиморфизма ядер у отдельных штаммов R. irregularis, причем выявленные различия между ядрами заключались в разной копийности отдельных участков ДНК.
Средний уровень величины R по гену ToxA сохранялся в митотическом потомстве, полученном из трех штаммов (Каз-3, Каз-5 и БЛ-6) разного происхождения, и не имел достоверных отличий от значения R “материнского” штамма. Однако в митотическом потомстве штамма Каз-5 были выявлены субклоны, у которых доля ядер с геном ToxA увеличилась на 40% и более по сравнению с “материнским” штаммом. Ранее в казахстанской популяции нами были выявлены ToxA+-изоляты, дававшие в ПЦР со специфичными к гену ToxA праймерами продукт амплификации гораздо большего размера (около 2000 пн), чем ожидаемый (573 пн) [8]. Подобные случаи также отмечались другими исследователями [40]. Можно предположить, что продукты амплификации большого размера представляют собой дупликации гена ToxA у P. tritici-repentis посредством механизма трансдупликации [27].
Факт многокопийности гена ToxB усложняет выявление гетерокариоза у ToxВ+-штаммов P. tritici-repentis и интерпретацию полученных данных по доле ToxB+-ядер. Среднее значение R по гену ToxВ в митотическом потомстве штаммов P. tritici-repentis греческой популяции не имело достоверных отличий от значения R соответствующего “материнского” штамма. Тем не менее в митотическом потомстве Гр-2 выявлен самый широкий диапазон варьирования величины R по гену ToxВ – от 1.06 до 2.65, при самом высоком среди штаммов греческой популяции значении R “материнского” штамма – 1.78. Подобную вариабельность можно объяснить параллельным существованием двух генетических процессов: дупликации ToxВ в отдельных ядрах при постоянном элиминировании ToxB+-ядер за счет селективного преимущества ToxB–-ядер. Можно предположить, что в мицелии гриба присутствуют ядра с разным количеством копий ToxB, соотношение которых в новых сформированных конидиях и выросших из них культурах будут разным вследствие различий в скорости деления ядер и других неизвестных причин.
Анализ митотического и мейотического потомств одного штамма P. tritici-repentis из северо-западной популяции продемонстрировал более широкую вариабельность признака R для гена ToxA среди моноаскоспоровых потомков (от 0.94 до 1.26), чем среди субклонов (от 0.93 до 1.11) при сходных средних значениях R.
Как мы отмечали в предыдущем нашем исследовании, гомоталличный способ размножения P. tritici-repentis способствует сохранению гена ToxA как чужеродной транслокации [33]. Однако выявленный полиморфизм ядер по гену ToxA среди аскоспоровых клонов штамма БЛ-6 логично объяснить происхождением данных аскоспор в результате гетероталличного скрещивания. Гипотеза о псевдогомоталличной природе изолятов P. tritici-repentis была высказана нами ранее [33]. Другими исследователями также отмечается, что скрещивания между изолятами P. tritici-repentis происходят с низкой частотой [41]. Остается неизвестным, насколько широко распространены “гетероталличные” скрещивания P. tritici-repentis в природе. С другой стороны, между конидиями часто наблюдали анастомозы в период их прорастания и проникновения в растение, т. е. через 17–24 ч после инокуляции; среди 22-х проанализированных изолятов в 19 обнаружили анастомозы [27]. Логично предположить, что в результате анастомозов происходит перемещение ядер, что ведет к образованию гетерокариотичного мицелия. В нашей работе мы доказали, что мицелий гриба включает генетически неоднородные ядра, которые размножаются с разной скоростью, конкурируют между собой, в результате чего штаммы отличаются друг от друга по соотношению генетически различных ядер в мицелии.
Полученные результаты позволяют по-новому взглянуть на проблемы в изучении изменчивости грибов – селекцию ядер в гетерокарионах и проблему индивидуальности у грибов [42]. В данной работе нам удалось на молекулярном уровне продемонстрировать появление митотических и мейотических потомков с различным соотношением разнокачественных ядер у гетерокариотичного гриба P. tritici-repentis. Интересно, что на материале штаммов из природных популяций мы не наблюдали преимущества в размножении для ядер, несущих гены-эффекторы, скорее наоборот, они составляли меньшую часть от общего пула ядер. Анализ субклонов отдельных штаммов, различающихся по копийности генов-эффекторов, подтвердил предположение, что уровень полиморфизма гаплоидных ядер является специфичным для каждого штамма.
При исследовании гетерокариотичности у гриба Rhizophagus irregularis была обнаружена более высокая вариабельность между ядрами в кодирующих участках ДНК, по сравнению с некодирующими, что, по мнению авторов, указывает на “функциональную важность” генетического полиморфизма ядер у штаммов R. irregularis [39]. В этом контексте, функциональная роль полиморфизма ядер для жизнедеятельности штаммов P. tritici-repentis в составе популяции требует дальнейшего изучения. Выявленные нами ранее различия между штаммами P. tritici-repentis по экспрессии генов ToxA и фактора транскрипции PtrPf2 как in vitro, так и in planta [43, 44] могут быть связаны с долей ядер, несущих эти гены, в общем пуле ядер у отдельных изолятов.
В заключение считаем нужным подчеркнуть значимость гетерокариоза для фитопатогенных грибов в процессах адаптации, освоения новых растений-хозяев и обмена генетической информацией посредством ГПГ. Именно конкуренция ядер в процессе размножения мицелия и образования конидий приводит к формированию конидий с отличающимся соотношением ядер, несущих разные генетические детерминанты. Этот механизм может влиять на экспрессию генов и иметь фенотипическое выражение в агрессивности и патогенности изолятов. Вопрос о конкуренции ядер в гетерокарионе в процессе заражения растения остается открытым и требует дальнейших исследований.
Исследование выполнено при поддержке РФФИ (грант № 18-04-00128а).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ciuffetti L.M., Manning V.A., Pandelova I. et al. Host-selective toxins, Ptr ToxA and Ptr ToxB, as necrotrophic effectors in the Pyrenophora tritici-repentis-wheat interaction // New Phytologist. 2010. V. 187. № 4. P. 911–919. https://doi.org/10.1111/j.1469-8137.2010.03362.x
Faris J.D., Liu Z., Xu S.S. Genetics of tan spot resistance in wheat // Theor. Appl. Genet. 2013. V. 126. P. 2197–2217. https://doi.org/10.1007/s00122-013-2157-y
Ciuffetti L.M., Tuori R.P., Gaventa J.M. A single gene encodes a selective toxin causal to the development of tan spot of wheat // The Plant Cell. 1997. V. 9. P. 135–144. https://doi.org/10.1105/tpc.9.2.135
Friesen T.L., Stukenbrock E.H., Liu Z. et al. Emergence of a new disease as a result of interspecific virulence gene transfer // Nature Genetics. 2006. V. 38. № 8. P. 953–956. https://doi.org/doi.org/10.1038/ng1839
Faris J.D., Zhang Z., Lu H.J. et al. A unique wheat disease resistance-like gene governs effector-triggered susceptibility to necrotrophic pathogens // PNAS USA. 2010. V. 107. P. 13544–13549. https://doi.org/10.1073/pnas.1004090107
Мироненко Н.В., Баранова О.А., Коваленко Н.М. Михайлова Л.А. Частота гена ToxА в популяциях Pyrenophora tritici-repentis на Северном Кавказе и северо-западе России // Микол. и фитопатол. 2015. Т. 49. № 5. С. 325–329.
Kamel S., Cherif M., Hafez M. et al. Pyrenophora tritici-repentis in Tunisia: Race structure and effector genes // Front. Plant Sci. 2019. V. 10. Article 1562. https://doi.org/10.3389/fpls.2019.01562
Мироненко Н.В., Баранова О.А., Коваленко Н.М. Характеристика географически отдаленных популяций Pyrenophora tritici-repentis по вирулентности и генам токсинообразования ToxA и ToxB // Вестник защиты растений. 2019. Т. 1. С. 24–29. https://doi.org/10.31993/2308-6459-2019-1(99)-24-29
Abdullah S., Sehgal S.K., Ali S. Race diversity of Pyrenophora tritici-repentis in South Dakota and response of predominant wheat cultivars to tan spot // J. Plant Pathol. Microbiol. 2017. V. 8. № 5. P. 1–7. https://doi.org/10.4172/2157-7471.1000409
Aboukhaddour R., Turkington T.K., Strelkov S.E. Race structure of Pyrenophora triciti-repentis (tan spot of wheat) in Alberta, Canada // Can. J. Plant Pathol. 2013. V. 35. № 2. P. 256–268. https://doi.org/10.1080/07060661.2013.782470
Ballance G.M., Lamari L., Kowatsch R., Bernier C.C. Cloning expression and occurrence of the gene encoding the Ptr necrosis toxin from Pyrenophora tritici-repentis // Mol. Plant Pathol. 1996. On-line: www.bspp.org.uk/mppol/1996/1209ballance.
Aboukhaddour R., Cloutier S., Balance G.M., Lamari L. Genome characterization of Pyrenophora tritici-repentis isolates reveals high plasticity and independent chromosomal location of ToxA and ToxB // Mol. Plant Pathol. 2009. V. 10. P. 201–212. https://doi.org/10.1111/j.1364-3703.2008.00520.x
Strelkov S.E., Lamari L. Host-parasite interaction in tan spot Pyrenophora tritici-repentis of wheat // Can. J. Plant Pathol. 2003. V. 25. P. 339–349. https://doi.org/10.1080/07060660309507089
Martinez J.P., Oesch N.W., Ciuffetti L.M. Characterization of the multiple-copy host-selective toxin gene, ToxB, in pathogenic and nonpathogenic isolates of Pyrenophora tritici-repentis // MPMI. 2004. V. 17. № 5. P. 467–474. https://doi.org/10.1094/MPMI.2004.17.5.467
Momeni H., Aboukhaddour R., Javan-Nikkhah M. et al. Race identification of Pyrenophora tritici-repentis in Iran // J. Plant Pathol. 2014. V. 96. P. 287–294. https://doi.org/10.4454/JPP.V96I2.036
Antoni E.A., Rybak K., Tucker M.P. et al. Ubiquity of ToxA and absence of ToxB in Australian populations of Pyrenophora tritici-repentis // Australas. Plant Pathol. 2010. V. 39. P. 63–68. https://doi.org/10.1071/AP09056
Ali S., Gurung S., Adhikari T.B. Identification and characterization of novel isolates of Pyrenophora tritici-repentis from Arkansas // Plant Dis. 2010. V. 94. P. 229–235. https://doi.org/10.1094/PDIS-94-2-0229
Мироненко Н.В., Баранова О.А., Коваленко Н.М. и др. Генетическая структура популяций Pyrenophora tritici-repentis, существующих на территории России, по микросателлитным маркерам // Генетика. 2016. Т. 52. № 8. С. 885–894. https://doi.org/10.7868/S0016675816080099
Hunger R.M., Brown D.A. Colony color, growth, fungicide sensitivity, and pathogenicity of Pyrenophora tritici-repentis // Plant Dis. 1987. V. 71. P. 907–910. https://doi.org/10.1094/PD-71-0907
Benslimane H., Aouali S., Khalfi A. et al. In vitro morphological characteristics of Pyrenophora tritici-repentis isolates from several Algerian agro-ecological zones // Plant Pathol. J. 2017. V. 33. P. 109–117. https://doi.org/10.5423/PPJ.OA.09.2015.0189
Михайлова Л.А., Тернюк И.Г., Мироненко Н.В. Структура популяций Pyrenophora tritici-repentis из европейской части России по признаку вирулентности // Микол. и фитопатол. 2007. Т. 41. № 3. С. 269–275.
Михайлова Л.А., Тернюк И.Г., Мироненко Н.В. Характеристика популяций Pyrenophora tritici-repentis по признаку вирулентности // Микол. и фитопатол. 2010. Т. 44. № 3. С. 263–272.
Михайлова Л.А., Мироненко Н.В., Коваленко Н.М. Популяции Pyrenophora tritici-repentis на северном Кавказе и северо-западе России: расовый состав и динамика вирулентности // Микол. и фитопатол. 2014. Т. 48. № 6. С. 393–400.
Mironenko N.V., Timopheeva E.N., Mikhailova L.A. et al. Intraspecific genetic diversity of Pyrenophora tritici-repentis (Died.) Drechs. (Drechslera tritici-repentis [Died.] Shoem.) detected by random amplified polymorphic DNA assays // Arch. Phytopathol. Pflanzenschutz. 2007. V. 40. № 6. P. 431–440. https://doi.org/10.1080/03235400600627965
Leisová L., Hanzalová A., Kucera L. Genetic diversity of Pyrenophora tritici-repentis isolates as revealed by AFLP analysis // J. Plant Pathol. 2008. V. 90. P. 233–245. https://doi.org/10.4454/jpp.v90i2.658
Gurung S., Short D.P.G., Adhikari T.B. Global population structure and migration patterns suggest significant population differentiation among isolates of Pyrenophora tritici-repentis // Fungal. Genet. Biol. 2013. V. 52. P. 32–41. https://doi.org/10.1016/j.fgb.2013.01003
Manning V.A., Pandelova I., Dhillon B. et al. Comparative genomics of a plant-pathogenic fungus, Pyrenophora tritici-repentis, reveals transduplication and the impact of repeat elements on pathogenicity and population divergence // G3 (Bethesda). 2013. V. 3. P. 41–63. https://doi.org/10.1534/g3.112.004044
Moolhuijzen P., See P.T., Hane J.K. et al. Comparative genomics of the wheat fungal pathogen Pyrenophora tritici-repentis reveals chromosomal variations and genome plasticity // BMC Genomics. 2018. V. 19. P. 279. https://doi.org/10.1186/s12864-018-4680-3
Левитин М.М. Генетические основы изменчивости фитопатогенных грибов. Л.: Агропромиздат, 1986. 208 с.
Daboussi M.J. Fungal transposable elements and genome evolution // Evolution and Impact of Transposable Elements. Contemporary Issues in Genetics and Evolution. Volume 6 / Ed. Capy P., Dordrecht: Springer, 1997. P. 253–260. https://doi.org/10.1007/978-94-011-4898-6_25
Tsushima A., Gan P., Kumakura N. Genomic plasticity mediated by transposable elements in the plant pathogenic fungus Colletotrichum higginsianum // Genome Biol. Evol. 2019. V. 11. P. 1487–1500. https://doi.org/10.1093/gbe/evz087
Andrie R.M., Pandelova I., Ciuffetti L.M. A combination of phenotypic and genotypic characterization strengthens Pyrenophora tritici-repentis race identification // Phytopathol. 2007. V. 97. P. 694–701. https://doi.org/10.1094/PHYTO-97-6-0694
Мироненко Н.В., Баранова О.А., Коваленко Н.М. Роль полового процесса в сохранении чужеродной транслокации гена ToxA в геноме Pyrenophora tritici-repentis // Микол. и фитопатол. 2019. Т 53. № 2. С. 115–123. https://doi.org/10.1134/S0026364819020077
Михайлова Л.А., Гультяева Е.И., Кокорина Н.М. Лабораторные методы культивирования возбудителя желтой пятнистости пшеницы Pyrenophora tritici-repentis // Микол. и фитопатол. 2002. Т. 36. № 1. С. 63–67.
Murray H.G., Thompson W.F. Rapid isolation of high molecular weight DNA // Nucl. Ac. Res. 1980. V. 8. P. 4321–4325. https://doi.org/10.1093/nar/8.19.4321
Rybak K., See P.T., Phan H.T. et al. A functionally conserved Zn2Cys6 binuclear cluster transcription factor class regulates necrotrophic effector gene expression and hostspecific virulence of two major Pleosporales fungal pathogens of wheat // Mol. Plant Pathol. 2017. V. 18. P. 420–434. https://doi.org/10.1111/mpp.12511
Solomon P.S., Ipcho S.V., Hane J.K. et al. A quantitative PCR approach to determine gene copy number // Fungal Genet. Rep. 2008. V. 55. Article 2. https://doi.org/10.4148/1941-4765.1082
Livak K., Schmittgen T.D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method // Methods. 2001. V. 25. P. 402–408. https://doi.org/10.1006/meth.2001.1262
Wyss T., Masclaux F.G., Rosikiewicz P. et al. Population genomics reveals that within-fungus polymorphism is common and maintained in populations of the mycorrhizal fungus Rhizophagus irregularis // ISME J. 2016. V. 10. P. 2514–2526. https://doi.org/10.1038/ismej.2016.29
Lepoint P., Renard M.E., Legreve A. et al. Genetic diversity of the mating type and toxin production genes in Pyrenophora tritici-repentis // Phytopathol. 2010. V. 100. P. 474–483. https://doi.org/10.1094/PHYTO-100-5-0474
McCallum B.D., Bernier C.C., Lamari L. Generation and utilization of chemical-resistant mutants in Pyrenophora tritici-repentis, the causal agent of tan spot of wheat // Can. J. Bot. 1994. V. 72. P. 100–105. https://doi.org/10.1139/b94-014
Захаров И.А., Мироненко Н.В. Гетерокариоз и проблемы структуры популяций грибов // Микол. и фитопатол. 1983. Т. 17. № 5. С. 414–424.
Мироненко Н.В., Орина А.С., Коваленко Н.М. Межштаммовые различия Pyrenophora tritici-repentis по экспрессии генов ToxA и PtrPf2 в культуре // Генетика. 2020. Т. 56. № 4. С. 488–492. https://doi.org/10.31857/S0016675820040086
Мироненко Н.В., Орина А.С., Коваленко Н.М. Экспрессия генов ToxA и PtrPf2 фитопатогенного гриба Pyrenophora tritici-repentis в начале инфекционного процесса // Экол. генетика. 2020. Т. 18. № 2. С. 19–25. https://doi.org/10.17816/ecogen16362
Дополнительные материалы отсутствуют.