Генетика, 2021, T. 57, № 6, стр. 653-660
Транскрипция гена hlyIIR Bacillus cereus
А. С. Нагель 1, Ж. И. Андреева-Ковалевская 1, А. В. Сиунов 1, М. О. Нагорных 1, М. В. Захарова 1, А. С. Солонин 1, *
1 Пущинский научный центр биологических исследований, Институт биохимии и физиологии микроорганизмов
им. Г.К. Скрябина Российской академии наук
142290 Пущино, Московская область, Россия
* E-mail: solonin.a.s@yandex.ru
Поступила в редакцию 24.06.2020
После доработки 07.09.2020
Принята к публикации 10.09.2020
Аннотация
Изучена транскрипция гена hlyIIR Bacillus cereus, который является негативным транскрипционным регулятором гена гемолизина II (hlyII) – фактора патогенности B. cereus. Выявлена последовательность промотора перед геном hlyIIR и определена стартовая точка транскрипции. В экспериментах in vitro и in vivo проведен анализ влияния белка-регулятора на транскрипцию c собственного промотора. В клетках B. cereus выявлен конститутивный характер синтеза конечного продукта. Полученные результаты могут указывать на отсутствие авторегуляции гена hlyIIR и участия промотора гена гемолизина II в регуляции экспрессии гена hlyIIR.
Bacillus cereus sensu lato – видовой комплекс спорообразующих грамположительных бактерий, которые распространены повсеместно [1]. B. cereus sensu stricto является условным патогеном человека, вызывающим желудочно-кишечные инфекции [2]; B. thuringiensis – энтомопатогенный микроорганизм, широко использующийся в сельском хозяйстве [3]; B. anthracis – возбудитель смертельно опасного для млекопитающих заболевания – сибирской язвы [4]. В то же время анализ геномных последовательностей бактерий этой группы выявляет высокую степень подобия. Классификация этих бактерий основана на фенотипических отличиях, кодируемых в ряде случаев генами, локализованными на плазмидах, наличие которых и определяет существование этих микроорганизмов в различных условиях окружающей среды. Продукция факторов патогенности этими бактериями может быть связана не только с наличием или отсутствием генов самих токсинов, но также с регуляцией их экспрессии [5].
Одним из факторов патогенности B. cereus является гемолизин II (HlyII). Он принадлежит к обширному семейству β-складчатых каналообразующих цитолизинов, которые встраиваются в мембрану с образованием пор [6]. Гемолизин II широко распространен как среди штаммов B. cereus, так и B. thuringiensis [7].
Ген гемолизина II был впервые изолирован из библиотеки хромосомной ДНК B. cereus. EcoRI-фрагмент хромосомной ДНК размером 2.9 тпн при введении в E. coli в составе плазмидного вектора приводит к возникновению у трансформантов гемолитического фенотипа [8]. На том же участке ДНК за геном hlyII обнаружен ген транскрипционного регулятора (hlyIIR), продукт которого осуществляет регуляцию экспрессии гена гемолизина II [9]. HlyIIR принадлежит к TetR/AcrR-группе транскрипционных регуляторов [10].
Регуляция экспрессии гена может осуществляться как путем прямого контроля его экспрессии, так и опосредованно, путем регуляции экспрессии генов самих регуляторов или путем модуляции функции этих регуляторов.
Настоящая статья посвящена описанию промотора и транскрипции гена hlyIIR B. cereus.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы
Для большинства операций использовался штамм Escherichia coli Z85 (thi, Δ(lac-proAB), Δ(srl-recA), hsdR, supE, Tn10(Tcr), (F',-traD, proAB, LacI ΔM15)) [11], для экспрессии белка HlyIIR – E. coli M15pRep4 (pHR) (Kmr, lac, ara, gal, mtl, F–) [9]; в экспериментах in vivo использовался штамм B. cereus 771, аналогичный B. cereus AH820 (NC_011773.1) и штамм B. cereus 4342-N-HlyIIR (аналогичный B. cereus ATCC 4342 (NZ_CM000721.1), нокаутированный по гену hlyIIR); для анализа флуоресценции TurboGFP – штамм B. subtilis BD170 с плазмидой pPhlyIIR-tGFP, описанный в [12]. Выращивание бактерий E. coli проводили в жидких и на агаризованных средах LB. Для культивирования B. cereus использовалась 3.7%-ная сердечно-мозговая среда (BHI) фирмы “Difco”.
Плазмиды
Плазмиды, использованные в работе, перечислены и описаны в табл. 1.
Таблица 1.
Плазмиды
| Название | Описание | Источник |
|---|---|---|
| pUJ1 | 2.9 тпн EcoRI-фрагмент хромосомной ДНК B. cereus VKM-B771, содержащий гены hlyII, hlyIIR в pUC19 | [15] |
| р15KS- | Ap, Cm | Stratagene |
| pRH2 | Ген hlyIIR в векторе р15KS | [9] |
| pF | Ген lacZ, клонированный в pUC19 по сайтам рестрикции BamHI–HindIII | [16] |
| pFHR217 | Промотор hlyII, ген hlyII, межгенный участок и промотор hlyIIR в EcoRI–BssSI-фрагменте pUJI, липкие концы застроены фрагментом Кленова, фрагмент затем встраивали по тупым концам в линеаризованную по сайту SmaI pF | Данная работа |
| pFHR217∆KS | Делеция регуляторной области hlyII в pFHR217, чтобы оценить влияние промотора гена гемолизина II на транскрипцию hlyIIR. pFHR217 была гидролизована по сайтам KpnI–SpeI и циклизована | Данная работа |
Выделение белка
Выделение белка HlyIIR-6HIS осуществлялось как описано ранее из клеток E. coli M15pRep4 (pHR) [9]. Выделение РНК-полимеразы из B. cereus 771 описано в [9]. Выделение РНК-полимеразы из E. coli описано в [13].
Анализ гемолитической активности
Тестирование гемолитической активности проводили на эритроцитах человека с помощью методики, основанной на спектрофотометрической регистрации гемоглобина, высвобождающегося при лизисе эритроцитов [8]. За единицу гемолитической активности (ГЕ) принято количество гемолизина, вызывающее лизис половины клеток 1 мл 0.5%-ной суспензии эритроцитов в ФСБ (74 мМ Na-фосфат, 77 мМ NaCl pH 6.8) за 30 мин при 37°С. Гемолитическую активность в присутствии холестерина измеряли как описано ранее [14].
Иммунохимическое определение белка
Вестерн-блоттинг проводили по методу, разработанному в лаборатории Харлоу [6] с помощью антител кролика, полученных к очищенному препарату HlyIIR.
Транскрипция in vitro, KMnO4-футпринтинг
Эксперименты по транскрипции in vitro и KMnO4-футпринтингу были выполнены как описано ранее [13]. Очищенные фрагменты ДНК с промоторными областями генов инкубировали с РНК-полимеразами E. coli и B. cereus (100 нМ) в буфере, содержащем 20 мМ трис-HCl pH 8.0, 100 мМ MgCl2, 0.1 мМ EDTA, 1 мМ DTT, 50 мкг БСА, 5% глицерина в объеме 10 мкл, в течение 7 мин при 37°С. При добавлении HlyIIR реакционная смесь инкубировалась дополнительные 10 мин при 37°С. Затем добавляли 5 мкл смеси из четырех рибонуклеотидтрифосфатов (конечная концентрация 50 мкМ UТP и по 0.2 мМ АТP, GТР, СТР каждого), содержащей 0.5 μCi [α-32P]-UТP и 20 мкг гепарина, и инкубировали еще в течение 10 мин. Реакцию останавливали добавлением 15 мкл охлажденного стоп-буфера (95%-ный формамид, 0.05%-ный бромфеноловый синий). Полученные РНК-фрагменты анализировали методом электрофореза в 7%-ном ПААГ в денатурирующих условиях с добавлением 8 М мочевины. После электрофореза гель экспонировали с рентгеновской пленкой.
Анализ образования открытого комплекса РНКП с промоторной областью ДНК выполняли с использованием метода KMnO4 (перманганатного) футпринтинга. Метод позволяет обнаружить тимины, которые становятся чувствительными к KMnO4 в одноцепочечной ДНК. Фрагменты ДНК с промоторными областями амплифицировали посредством ПЦР. Один из двух используемых праймеров метили [γ-32P]ATP с помощью полинуклеотидкиназы фага Т4. Реакционную смесь, содержащую ДНК, транскрипционный буфер и 1 мкл (100 нМ) РНК-полимеразы, инкубировали 7 мин при 37°С. После обрабатывали 20 мМ KMnO4 в течение 10–20 с при 37°С, реакцию останавливали добавлением 1 мкл β-меркаптоэтанола. ДНК переосаждали тремя объемами этанола, после чего обрабатывали пиперидином при 90°С. Образцы ДНК в стоп-буфере инкубировали в течение двух минут при 95°С и анализировали в 7%-ном денатурирующем ПААГ. После электрофореза гель экспонировали с рентгеновской пленкой.
Определение ДНК-связывающей активности HlyIIR
ДНК-связывающую активность определяли, используя метод задержки в геле. ДНК-зонды (20 нг ДНК) инкубировали 20 мин при 37°С с различными концентрациями белка в 20 мкл буфера (10 мМ трис-HCl pH 7.5, 10 мМ NaCl, 1 мМ MgCl2 и 1 мкг БСА и 1 мкг ДНК цыпленка).
Определение β-галактозидазной активности
β-Галактозидазную активность тестировали как описано ранее [17].
Анализ флуоресценции TurboGFP
Клетки B. subtilis выращивали в 0.5 мл среды LB в 48-луночных планшетах при 37°С. Уровень флуоресценции измеряли в течение 24 ч каждые 10 мин при значениях A485 нм (возбуждение) и A535 нм (эмиссия). Выращивание культуры и все измерения проводили в мультирежимном планшетном ридере (Multi-functional plate reader) Filter Max F5 (Molecular Devices).
РЕЗУЛЬТАТЫ
HlyIIR накапливается в клетках в процессе роста
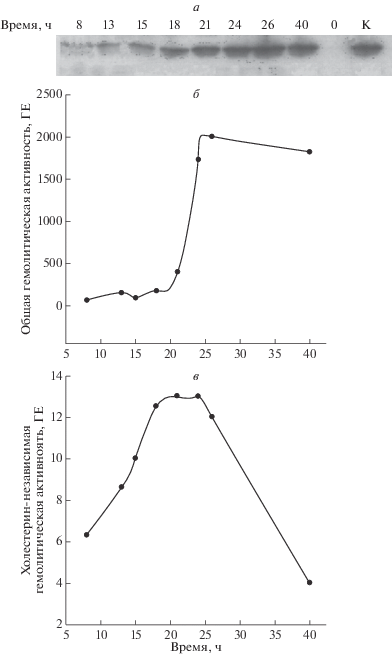
Анализ синтеза белка HlyIIR с помощью иммуноблоттинга поликлональными антителами против HlyIIR показал, что его максимальный уровень достигается в начале стационарной фазы роста B. cereus. Как можно видеть на рис. 1,а, в клетках штамма B. cereus 4342-N-HlyIIR, с нокаутом по гену hlyIIR, использованного в качестве отрицательного контроля (дорожка 0), поликлональные антитела не выявили присутствия HlyIIR. Для того чтобы исследовать связь между содержанием в клетке белка-регулятора и гемолитической активностью в культуральной среде, измеряли общую и холестерин-независимую гемолитическую активность. Увеличение содержания белка HlyIIR на определенном этапе приводит к снижению как общей, так и холестерин-независимой гемолитической активности в культуральной среде (рис. 1). Данные, представленные на рис. 1,а, демонстрируют, что ген hlyIIR экспрессируется конститутивно и участвует в подавлении гемолитической активности.
Рис. 1.
Изменение содержания белка HlyIIR в клетках и уровня гемолитической активности в культуральной среде в процессе роста штамма B. cereus 771. а – уровень HlyIIR в клетках B. cereus, отобранных в разных точках роста, показанный с помощью иммунноблота; б – общая гемолитическая активность; в – холестерин-независимая гемолитическая активность.
Картирование промотора гена hlyIIR
Тандемное расположение генов hlyII и hlyIIR и их функциональная связь позволяют предположить, что эти гены могут образовывать оперон и регулироваться совместно. В то же время после гена гемолизина II расположен транскрипционный терминатор, а перед геном hlyIIR обнаружена нуклеотидная последовательность, гомологичная консенсусным последовательностям большинства промоторов прокариот. Таким образом, транскрипция гена hlyIIR возможна как с промотора гена hlyII, так и с собственного промотора и невозможно исключить влияние обоих промоторов на эффективность экспрессии гена hlyIIR. Чтобы прояснить ситуацию, было решено определить способна ли РНК-полимераза B. сereus связывать предполагаемый промотор hlyIIR in vitro. Для этого фрагменты ДНК, соответствующие предполагаемому промотору и началу гена hlyIIR, были использованы как матрицы для транскрипции. Длина образуемых транскриптов была одинакова в случае использования как РНК-полимеразы E. coli, так и РНК-полимеразы B. cereus. Обе полимеразы узнают промотор hlyIIR, поэтому было решено в последующих экспериментах использовать РНК-полимеразу из E. coli, поскольку в этом случае сигнал намного сильнее (данные не показаны). Для картирования промотора использовали методику перманганатного футпринтинга [13]. Участки одноцепочечной ДНК могут образовываться в результате формирования открытого комплекса ДНК–РНК-полимераза и плавления ДНК в этом месте. Результаты представлены на рис. 2,а. На изучаемом участке ДНК обнаружен один открытый комплекс ДНК с РНК-полимеразой E. coli. Определена точка начала транскрипции. Участки –10 и –35 промотора гена hlyIIR картированы (рис. 2,а, ж) и определено направление синтеза РНК.
Рис. 2.
Промотор hlyIIR. а – картирование промотора hlyIIR. Представлены результаты перманганатного футпринтинга. Дорожка 1 – A + G реакция, дорожка 2 – реакция с KMnO4. Стрелками отмечено местоположение открытого промоторного комплекса ДНК–РНК-полимераза; б – влияние белка-регулятора HlyIIR на транскрипцию гена hlyII; в – влияние белка-регулятора HlyIIR на транскрипцию собственного гена; г – последовательности участка, расположенного перед геном hlyIIR, и центральной части оператора hlyII; д – связывание HlyIIR с операторным участком гена hlyII; е – связывание HlyIIR с участком, перекрывающимся с промотором hlyIIR (рис. 2,г); ж – последовательность ДНК в области промотора hlyIIR (GenBank: AY212780).
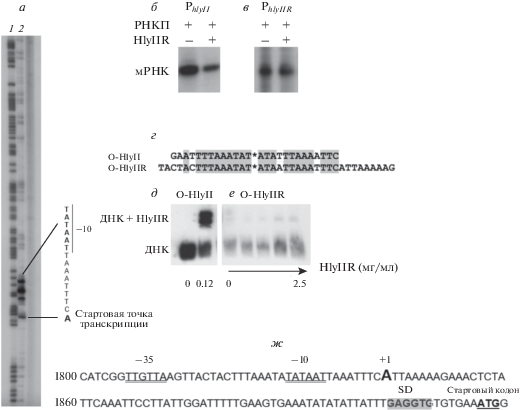
HlyIIR не связывается со своим промоторным участком в условиях in vitro
Перед геном hlyIIR обнаружен участок ДНК (рис. 2,г, О-HlyIIR), имеющий высокую гомологию с центральной частью операторной области гена hlyII (рис. 2,г, O-HlyII). Так как HlyIIR связывается с оператором гена hlyII [9], было решено проверить связывается ли HlyIIR с этим участком гена hlyIIR в условиях in vitro. Для этого радиоактивно меченные двухцепочечные ДНК, соответствующие последовательностям, показанным на рис. 2,г, были использованы в экспериментах по изменению подвижности ДНК в гелях. Несмотря на то, что HlyIIR связывается с оператором гена hlyII (рис. 2,д), связывания с частично гомологичным участком гена hlyIIR не обнаружили (рис. 2,е). Димеры HlyIIR эффективно связываются по флангам оператора гена hlyII, но не с его центральной частью [18]. Обнаруженный нами район гомологии участка, расположенного перед hlyIIR с центром оператора hlyII, не обеспечивает взаимодействия этого участка с HlyIIR.
Транскрипция гена hlyII подавляется в присутствии HlyIIR (рис. 2,б), что соответствует опубликованным ранее данным [9], в то время как транскрипция гена hlyIIR в присутствии белка HlyIIR не подавлялась (рис. 2,в). Следовательно, в условиях in vitro транскрипционный регулятор HlyIIR участвует в регуляции экспрессии гена hlyII, но не влияет на экспрессию собственного гена.
HlyIIR не регулирует экспрессию своего гена в условиях in vivo
Как следует из рис. 1,а, белок HlyIIR накапливается в процессе роста клеток, что может означать, что его экспрессия осуществляется конститутивно, не регулируемо. Для проверки этого предположения были созданы генетические конструкции, в которых репортерный ген β-галактозидазы находится под контролем как PhlyIIR, так и участка генома B. cereus, содержащего оба промотора PhlyII и PhlyIIR. Результаты этих экспериментов приведены в табл. 2. Показано, что введение в клетку на совместимых плазмидах гена-репортера под контролем промотора hlyIIR и гена самого hlyIIR не выявило существенной разницы между экспрессией репортерного гена в присутствии или отсутствии промотора hlyII. Можно заключить, что по крайней мере в клетках E. coli ген регулятора экспрессируется только со своего собственного промотора. Гибридизация РНК бактериальных клеток с радиоактивно меченным ДНК-зондом также свидетельствует о том, что мРНК hlyII и hlyIIR синтезируются в клетке независимо друг от друга (рис. 2,б, в). Следовательно, HlyIIR в E. coli не может контролировать свою экспрессию через регуляцию синтеза би-цистронной РНК. Конститутивный синтез HlyIIR в клетках B. cereus обеспечивается транскрипцией с собственного промотора, не регулируемого HlyIIR.
Таблица 2.
Регуляция HlyIIR в системе in vivo
| Плазмидная конструкция | β-Галактозидазная активность (ед./мл) | |
|---|---|---|
| р15KS- | pRH2 | |
| pFHR217 (PhlyII, PhlyIIR) | 373 ± 62 | 224 ± 56 |
| pFHR217∆KS (PhlyIIR) | 420 ± 65 | 234 ± 55 |
Таким образом, транскрипция гена hlyIIR происходит только с собственного промотора и не контролируется конечным продуктом.
ОБСУЖДЕНИЕ
Экспрессия белка прямо или опосредованно может контролироваться несколькими транскрипционными регуляторами. Важнейшей задачей становится получение количественной информации, так как далеко не все процессы, которые мы можем наблюдать в пробирке, могут быть осуществлены в клетке.
Гемолизин II – один из факторов, определяющих приспособление условно-патогенных бацилл к окружающей среде. Продукция гемолизина II одной клеткой может оказаться недостаточной, поэтому необходима согласованная экспрессия этого гена во всей бактериальной популяции. Ранее нами было показано, что HlyIIR, ген которого расположен вслед за геном гемолизина II, является негативным регулятором экспрессии гена гемолизина II [9]. Он связывается с инвертированным повтором в операторном участке гена hlyII [18] и способен уменьшать эффективность инициации РНК синтеза. Экспрессия hlyII зависит от состояния окружающей среды. Чрезмерное накопление гемолизина II может быть потенциально опасным для бактериальной клетки. Эффективность транскрипции этого гена определяется присутствием индуктора, который обнаруживается в плазме крови [19]. В сапрофитном состоянии необходим негативный контроль экспрессии hlyII. Белок регулятора накапливается в процессе роста бактерий и его накопление пропорционально плотности бактериальной культуры и общей гемолитической активности в окружающей среде.
Перед геном hlyIIR картирован промотор, содержащий –10 и –35 последовательности, и определена точка инициации транскрипции. Промотор перекрывается с участком, который имеет гомологию с центральной областью оператора hlyII. Постепенное накопление белка регулятора в клетках может указывать на отсутствие автоингибирования. Синтез РНК в условиях in vitro происходит с обнаруженной точки начала транскрипции. Cинтез полноразмерного транскрипта с промотора PhlyIIR не ингибировался присутствием HlyIIR. Эксперименты по ко-экспрессии гена hlyIIR с репортерным геном β-галактозидазы под контролем PhlyIIR подтверждают, что ген hlyIIR экспрессируется в клетке с собственного промотора и его влияние на транскрипцию не обнаружено. Анализ эффективности транскрипции с PhlyIIR в клетках B. subtilis с помощью репортерного гена turbogfp также не выявил зависимости эффективности транскрипции с промотора PhlyIIR от присутствия белка HlyIIR [12]. В ходе настоящей работы описан промотор PhlyIIR и определена его локализация. Транскрипция гена hlyIIR происходит только с собственного промотора и не контролируется конечным продуктом.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 18-34-01017.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Patiño-Navarrete R., Sanchis V. Evolutionary processes and environmental factors underlying the genetic diversity and lifestyles of Bacillus cereus group bacteria // Res. Microbiol. 2017. V. 168. № 4. P. 309–318. https://doi.org/10.1016/j.resmic.2016.07.002
Ehling-Schulz M., Lereclus D., Koehler T.M. The Bacillus cereus group: Bacillus species with pathogenic potential // Microbiol. Spectr. 2019. V. 7. № 3. https://doi.org/10.1128/microbiolspec.GPP3-0032-2018
Chattopadhyay A., Bhatnagar N.B., Bhatnagar R. Bacterial insecticidal toxins // Crit. Rev. Microbiol. 2004. V. 30. № 1. P. 33–54. https://doi.org/10.1080/10408410490270712
Pilo P., Frey J. Pathogenicity, population genetics and dissemination of Bacillus anthracis // Infect. Genet. Evol. 2018. V. 64. P. 115–125. https://doi.org/10.1016/j.meegid.2018.06.024
Ceuppens S., Rajkovic A., Heyndrickx M. et al. Regulation of toxin production by Bacillus cereus and its food safety implications // Crit. Rev. Microbiol. 2011. V. 37. № 3. P. 188–213. https://doi.org/10.3109/1040841X.2011.558832
Miles G., Bayley H., Cheley S. Properties of Bacillus cereus hemolysin II: A heptameric transmembrane pore // Protein Sci. 2002. V. 11. № 7. P. 1813–1824. https://doi.org/10.1110/ps.0204002
Budarina Z.I., Sinev M.A., Mayorov S.G. et al. Hemolysin II is more characteristic of Bacillus thuringiensis than Bacillus cereus // Arch. Microbiol. 1994. V. 161. № 3. P. 252–257. https://doi.org/10.1007/BF00248701
Синев М.А., Бударина Ж.И., Гавриленко И.В. и др. Доказательство существования гемолизина II Bacillus cereus: клонирование генетической детерминанты гемолизина II // Мол. биология. 1993. Т. 27. № 6. С. 1218–1229.
Budarina Z.I., Nikitin D.V., Zenkin N. et al. A new Bacillus cereus DNA-binding protein, HlyIIR, negatively regulates expression of B. cereus haemolysin II // Microbiology (Reading, Engl.). 2004. V. 150. № 11. P. 3691–3701. https://doi.org/10.1099/mic.0.27142-0
Kovalevskiy O.V., Lebedev A.A., Surin A.K. et al. Crystal structure of Bacillus cereus HlyIIR, a transcriptional regulator of the gene for pore-forming toxin hemolysin II // J. Mol. Biol. 2007. V. 365. № 3. P. 825–834. https://doi.org/10.1016/j.jmb.2006.10.074
Зайцев Е.Н., Зайцева Е.М., Бакланова И.В. и др. Клонирование и секвенирование гена recA из штамма Pseudomonas aeruginosa // Генетика. 1986, Т. 22. № 11. С. 2721–2727.
Нагель А.С., Андреева-Ковалевская Ж.И., Сиунов А.В., Солонин А.С. Челночная векторная плазмида с turbogfp в качестве репортерного гена для анализа промоторной активности в клетках E. coli и B. subtilis // Технология живых систем. 2020. Т. 17. № 4. С. 18–30.
Zakharova M., Minakhin L., Solonin A., Severinov K. Regulation of RNA polymerase promoter selectivity by covalent modification of DNA // J. Mol. Biol. 2004. V. 335. № 1. P. 103–111. https://doi.org/10.1016/j.jmb.2003.09.081
Bernheimer A.W., Grushoff P. Extracellular hemolysins of aerobic sporogenic bacilli // J. Bacteriol. 1967. V. 93. № 5. P. 1541–1543.
Baida G., Budarina Z.I., Kuzmin N.P., Solonin A.S. Complete nucleotide sequence and molecular characterization of hemolysin II gene from Bacillus cereus // FEMS Microbiol. Lett. 1999. V. 180. № 1. P. 7–14. https://doi.org/10.1111/j.1574-6968.1999.tb08771.x
Бударина Ж.И. Ген гемолизина II Bacillus cereus: клонирование, регуляция экспрессии, идентификация продукта: Дис. … канд. биол. наук. Пущино: Институт биохимии и физиологии микроорганизмов им. Г. К. Скрябина РАН, 2005. 141 с.
Николаев И.В., Епишин С.М., Захарова Е.С. и др. Молекулярное клонирование гена секретируемой бета-галактозидазы мицелиального гриба Penicillium canescens // Мол. биология. 1992. Т. 26. С. 869–875.
Rodikova E.A., Kovalevskiy O.V., Mayorov S.G. et al. Two HlyIIR dimers bind to a long perfect inverted repeat in the operator of the hemolysin II gene from Bacillus cereus // FEBS Lett. 2007. V. 581. № 6. P. 1190–1196. https://doi.org/10.1016/j.febslet.2007.02.035
Андреева-Ковалевская Ж.И., Сиунов А.В., Бударина Ж.И. и др. Зависимость эффективности транскрипции гена гемолизина II Bacillus cereus от источника плазмы крови // Вестник биотехнологии и физико-хим. биологии им. Ю.А. Овчинникова. 2017. Т. 13. № 1. С. 5–12.
Дополнительные материалы отсутствуют.


