Генетика, 2021, T. 57, № 6, стр. 728-732
Генетическое разнообразие Kalopanax septemlobus (Thunb.) Koidz. на северной границе ареала по данным секвенирования регионов хлоропластной ДНК
Е. А. Васюткина 1, *, И. Ю. Адрианова 1
1 Федеральный научный центр биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения Российской академии наук
690022 Владивосток, Россия
* E-mail: levina@biosoil.ru
Поступила в редакцию 30.07.2020
После доработки 04.09.2020
Принята к публикации 23.09.2020
Аннотация
Проведен анализ нуклеотидного полиморфизма межгенных спейсеров psbA–trnH, rpl32–trnL и trnS–trnfM хлоропластной ДНК у представителей умеренно-теплолюбивого вида Kalopanax septemlobus на северной границе ареала. Нуклеотидные замены и индельные вариации выявили три гаплотипа (H1–H3), из них гаплотип H3 обнаружен только на о. Сахалин. В Приморском крае широко распространен гаплотип Н1, частота встречаемости которого составила 92.4%. Генетическое разнообразие суммарной выборки Приморского края оказалось очень низким – гаплотипическое (h) 0.142, нуклеотидное (π) 0.0001, а суммарной выборки о. Сахалин – средним (h = 0.600, π = 0.0018). Анализ молекулярной дисперсии показал, что около 86% всей генетической изменчивости приходится на различия между двумя регионами (ΦST = 0.857, P < 0.0001). Наблюдаемая изменчивость K. septemlobus на российском Дальнем Востоке отражает его биогеографическую историю.
Kalopanax septemlobus (Thunb.) Koidz., калопанакс семилопастной, или диморфант (синоним Kalopanax pictus) – листопадное, умеренно-теплолюбивое дерево, представитель монотипного реликтового рода Kalopanax Miq. семейства Araliaceae Juss. [1, 2]. Распространен в Северо-Восточной Азии, куда входят Центральный и Восточный Китай, п-ов Корея, острова Японского архипелага и южная часть российского Дальнего Востока (РДВ) [3–5]. Юг РДВ является северной границей распространения K. septemlobus; вид встречается на юге Приморского края, в юго-западной части о-ва Сахалин и на южных о-вах (Кунашир, Итуруп, Шикотан) Курильского архипелага [3, 6 ]. Вид занесен в федеральную и региональные Красные книги [6, 7 ], статус 3 (R) – редкий вид, представленный небольшими популяциями, которые в настоящее время не находятся под угрозой исчезновения и не являются уязвимыми, но рискуют оказаться таковыми. K. septemlobus является ценным медоносом и имеет декоративный внешний вид [8], содержит множество биологически активных веществ, что делает его потенциальным источником пищевых и лекарственных соединений [3, 9]. В настоящее время многие местообитания K. septemlobus на РДВ уничтожаются или деградируют из-за строительства, высокой рекреационной нагрузки и пожаров [10].
В целях сохранения этого уникального вида становится актуальным его искусственное разведение, но при культивировании растений, как правило, происходит обеднение генофонда. Так, популяционно-генетические исследования с использованием разных методов анализа (аллозимный, RAPD, ISSR, nrSSRs) выявили относительно высокий уровень генетического разнообразия в природных популяциях K. septemlobus Южной Кореи и Японии [11–13] и сравнительно низкий у культивируемых форм [14]. Огромный интерес представляет собой комплексное исследование образцов K. septemlobus из Центрального, Восточного и Западного Китая, Корейского п-ова и Японского архипелага с использованием SSR-маркеров ядерной ДНК, межгенных спейсеров psbA–trnH, rpl32–trnL и trnS–trnfM хлоропластной ДНК (хпДНК) и моделирования палеораспределения для восстановления биогеографической истории этого вида [15]. Полученные результаты являются доказательством существования множества ледниковых рефугиумов в Китае, Южной Японии и самой южной части Корейского п-ва; самые северные популяции K. septemlobus на о-ве Хоккайдо и на севере Корейского п-ва имеют постледниковое происхождение; общая генетическая структура широкоареального K. septemlobus в Восточной Азии сформировалась под воздействием колебаний четвертичного климата в условиях неоднородного ландшафта [15]. Популяционно-генетические исследования K. septemlobus на территории РДВ ранее не проводились.
Цель настоящей работы – изучение генетического разнообразия и структуры краевых популяций умеренно-теплолюбивого вида K. septemlobus на северной границе его распространения (юг РДВ), а также выявление генетических связей с представителями из основного ареала вида по данным полиморфизма хпДНК.
Индивидуальные препараты тотальной ДНК выделены CTAB-методом [16] с небольшими модификациями из листовой ткани 59 образцов K. septemlobus, собранных из 15 природных мест произрастания в Приморском крае и на о. Сахалин (табл. 1). Амплификацию некодирующих регионов psbA–trnH, rpl32–trnL и trnS–trnfM хпДНК проводили с использованием универсальных праймеров и реакционных условий, рекомендованных для этих участков с использованием “медленной и холодной” ПЦР-программы [17, 18]. Нуклеотидные последовательности цепей регионов хпДНК определяли на генетическом анализаторе ABI 3500 (Applied Biosystems, USA), затем редактировали в Chromas 2.4.4 (http://technelysium.com.au/wp/chromas), выравнивали и объединяли в одну матрицу, используя пакет программ MEGA ver. X [19]. Число гаплотипов, нуклеотидное (π) и гаплотипическое (h) разнообразие (для популяций с числом образцов пять и более), распределение генетической изменчивости внутри и между популяциями (ΦST, анализ молекулярной дисперсии, AMOVA) рассчитывали с помощью программы Arlequin v. 3.5 [20]. Генеалогические связи гаплотипов анализировали методом медианного связывания (Median-Joining, MJ) в программе Network 10.1 [21].
Таблица 1.
Места сбора Kalopanax septemlobus на РДВ, гаплотипы и параметры генетического разнообразия по данным хпДНК
| Место сбора (количество образцов) |
Гаплотип | Разнообразие (стандартное отклонение) |
|
|---|---|---|---|
| гаплотипическое | нуклеотидное | ||
| Приморский край | |||
| Окр. г. Владивосток, 11 км (8) | H1 | 0.000 (0.000) | 0.0000 (0.0000) |
| Окр. г. Владивосток, Океанский хребет (4) | H1 | – | – |
| О. Русский, зал. Петра Великого Японского моря (10) | H1 | 0.000 (0.000) | 0.0000 (0.0000) |
| О. Стенина, зал. Петра Великого Японского моря (3) | H1 | – | – |
| О. Фуругельма, зал. Петра Великого Японского моря (1) | Н1 | – | – |
| П-ов Гамова, окр. бух. Теляковского (1) | H1 | – | – |
| Окр. пос. Каменушка, правобережье р. Волхушка (2) | H1 | – | – |
| Окр. с. Васильковка (2) | H1 | – | – |
| Окр. пос. Реттиховка (1) | H1 | – | – |
| Заповедник Кедровая падь (2) | H1 | – | – |
| 137 км автодороги 05Н-100, перевал Еловый (1) | H1 | – | – |
| Мыс Пещурова, зал. Восток (1) | H1 | – | – |
| П-ов Гамова, окр. бух. Витязь (17) | H1, H2 | 0.382 (0.113) | 0.0002 (0.0002) |
| Общая выборка Приморского края (53) | H1, H2 | 0.142 (0.062) | 0.0001 (0.0001) |
| Сахалин | |||
| Перевал Невельский (5) | H1, H3 | 0.400 (0.237) | 0.0012 (0.0009) |
| Бассейн р. Китосия (1) | H2 | – | – |
| Общая выборка о. Сахалин (6) | H1, H2, H3 | 0.600 (0.215) | 0.0018 (0.0012) |
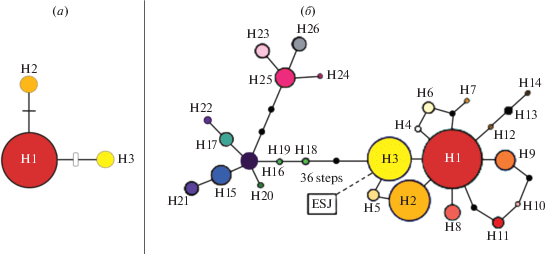
Для 59 растений K. septemlobus определены нуклеотидные последовательности трех межгенных спейсеров хпДНК. Длина региона psbA–trnH у всех образцов составила 448 пн, нуклеотидных замен нет. Спейсер rpl32–trnL у всех растений имел длину 840 пн и одну замену С→А в позиции 321 в пяти образцах. У trnS–trnfM выявлено два варианта длины – 726 и 720 пн, – вследствие присутствия вставки/делеции (индель), замен нет. У всех образцов из Приморского края спейсер trnS-trnfM длиной 726 пн, а образцы с о. Сахалин имели оба варианта. Длина объединенных последовательностей трех регионов хпДНК составила 2014 пн, из них 2007 – мономорфные сайты, один сайт вариабельный и информативный согласно методу максимальной экономии, индель длиной 6 пн. Нуклеотидные замены и индельные вариации позволили выявить три гаплотипа у K. septemlobus на юге РДВ (табл. 1). Последовательности регионов psbA–trnH, rpl32–trnL и trnS–trnfM хпДНК каждого гаплотипа депонированы в ENA/EMBL-EBI (номера для H1 – LR860506, LR860509 и LR860512; H2 – LR860508, LR860510 и LR860513; H3 – LR860507, LR860511 и LR860514 соответственно). Гаплотипы H1 и H2 обнаружены в Приморском крае и на о. Сахалин, а гаплотип H3 – только на о. Сахалин. В Приморском крае широко распространен гаплотип Н1, частота встречаемости которого составила 92.4%, и только в популяции из бухты Витязь четыре образца имели гаплотип Н2. На о. Сахалин в выборке с перевала Невельский у пяти деревьев обнаружен гаплотип H3, а у одного – гаплотип Н1; у образца из бассейна р. Китосия, расположенного в 40 км южнее, обнаружен гаплотип Н2. На рис. 1,а приведена медианная сеть генеалогических связей гаплотипов K. septemlobus РДВ. Одна нуклеотидная замена разделяет гаплотипы Н1 и Н2, индель разделяет гаплотипы Н1 и Н3.
Рис. 1.
Медианные сети гаплотипов хпДНК Kalopanax septemlobus: а – российский Дальний Восток. Размер окружностей отражает примерную частоту встречаемости гаплотипов, черная пересекающая линия – точечная мутация, белый пересекающий блок – делеция нуклеотидов; б – Восточная Азия по [15].
Из 13 выборок K. septemlobus в Приморском крае только три выборки были с числом образцов пять и более (табл. 1), для которых и были рассчитаны показатели генетического разнообразия. Популяции из окрестностей Владивостока и о. Русский оказались мономорфными, а популяция из окрестностей бухты Витязь характеризовалась низким уровнем как гаплотипического (h = 0.382), так и нуклеотидного разнообразия (π = 0.0002). Параметры генетического разнообразия общей выборки, включающей все исследуемые образцы из Приморского края, оказались еще более низкими (табл. 1).
Сахалинская популяция K. septemlobus с перевала Невельский имела практически такой же уровень гаплотипического (h = 0.400), но более высокий уровень нуклеотидного (π = 0.0012) разнообразия по сравнению с выборкой из бухты Витязь Приморского края. Общая выборка с о. Сахалин характеризовалась средними параметрами (h = 0.600, π = 0.0018) генетического разнообразия (табл. 1). Полученные данные о нуклеотидном разнообразии в суммарных выборках Приморского края и о. Сахалин (0.0001 и 0.0018 соответственно) согласуются с таковыми для основного ареала. Так, для группы популяций Юго-Западного Китая нуклеотидное разнообразие составило 0.00064, для группы Северо-Западный Китай–Окинава – 0.00019, для группы Восточный Китай–п-ов Корея–Японский архипелаг – 0.00021 [15]. Низкое генетическое разнообразие или отсутствие такового у хлоропластного генома в популяциях Приморского края может указывать на относительно недавнее происхождение от малого числа основателей.
По результатам AMOVA генетическая дифференциация между общими выборками из двух географических регионов РДВ составила 86% (ΦST = 0.857, P < 0.0001) и является следствием экстремально низкого потока генов между ними, что обусловлено изоляцией расстоянием. Такая же высокая генетическая дифференциация была выявлена между тремя географическими группами популяций K. septemlobus из основного ареала (FCT = 0.84) [15].
Нуклеотидные последовательности гаплотипов H1–H3 у K. septemlobus, произрастающего на территории Приморского края и о. Сахалин, оказались идентичны последовательностям гаплотипов H1–H3 основного ареала вида [15]. Генеалогические связи гаплотипов K. septemlobus в Восточной Азии представлены на рис. 1,б. Гаплотип Н1 является анцестральным и широко распространенным как на основном ареале (fig. 3b по [15]), так и на его северной границе (рис. 1). Гаплотип Н2, обнаруженный в популяции бухты Витязь Приморского края, распространен также на японских о-вах Хоккайдо и Хонсю и на горе Цзыцзинь (Нанкин) в Восточном Китае [15]. На территории между материковыми популяциями бухты Витязь и горы Цзыцзинь, расположенных друг от друга на расстоянии около 1600 км, выявлен только гаплотип Н1. Мы предполагаем, что возможны несколько вариантов возникновения гаплотипа Н2 в популяции бухты Витязь: во-первых, деревья с гаплотипом Н2 в ближайших популяциях-донорах могли исчезнуть под воздействием природных или антропогенных факторов; во-вторых, гаплотип мог возникнуть в результате случайной мутации при расселении особей с гаплотипом Н1; в-третьих, нельзя исключить возможность заноса семян с гаплотипом Н2 птицами с северных японских островов [22, 23]. Гаплотип Н3, выявленный на о. Сахалин, также присутствует на о-вах Хоккайдо и Хонсю [15].
Известно, что на юге Приморского края представители K. septemlobus произрастали еще в нижнем миоцене [24], когда шло формирование Японского моря и дифференциация о. Сахалин и Японских о-вов от континента [25]. Климатические флуктуации, особенно в последний плейстоценовый ледниковый период, способствовали смещению северной границы ареала K. septemlobus к югу, в то время как большинство популяций в Центральном Китае и на южных островах Японского архипелага, вероятно, сохранили свою локализацию [15]. Таким образом, выявленная нами низкая вариабельность хлоропластного генома K. septemlobus обусловлена реколонизацией территории Приморского края более южными популяциями. Более высокая генетическая изменчивость K. septemlobus на о. Сахалин, чем в Приморском крае, связана с его распространением в послеледниковый период из нескольких рефугиумов, существовавших на Японских островах, через мосты суши [15, 25]. Полученные молекулярно-генетические данные могут быть использованы для разработки программ по сохранению этого редкого и ценного вида дальневосточной флоры, а также для разработки мероприятий по рациональному природопользованию.
Исследование выполнено при финансовой поддержке программы Президиума РАН “Дальний Восток” (проекты № 18-4-011).
Авторы выражают благодарность В.Ю. Баркалову, А.С. Майоровой (ННЦМБ ДВО РАН), Е.М. Булах, Т.Ю. Горпенченко за помощь в сборе материала.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Ohashi H. Nomenclature of Kalopanax septemlobus (Thunb. ex Murray) Koidzumi and classification of its infraspecific taxa (Araliaceae) // J. Jap. Bot. 1994. V. 69. P. 28–31.
Chang C.S., Kim H., Kang H.S., Lee D.K. A morphometric analysis of the eastern Asian Kalopanax septemlobus (Thunb.) Koidz. (Araliaceae) // Bot. Bull. Acad. Sinica. 2003. V. 44. P. 337–344.
Журавлев Ю.Н., Коляда А.С. Araliaceae: женьшень и другие. Владивосток: Дальнаука, 1996. 280 с.
Lee D.K., Kang H.-S. Distribution of Kalopanax septemlobus and its growth in Northeast Asia // Eurasian J. For. Res. 2002. V. 2. № 5. P. 85–94.
Sakaguchi S., Sakurai S., Yamasaki M., Isagi Y. How did the exposed seafloor function in postglacial northward range expansion of Kalopanax septemlobus? Evidence from ecological niche modelling // Ecol. Res. 2010. V. 25. P. 1183–1195.
Красная книга Сахалинской области: Растения / Отв. ред. Еремин В.М. Южно-Сахалинск: Сахалинское книж. изд-во, 2005. 348 с.
Красная книга Российской Федерации (растения и грибы). М.: Т-во науч. изд. КМК, 2008. 855 с.
Недолужко В.А. Диморфант семилопастный Kalopanax septemlobus (Thunb.) Koidz. // Биол. редких сосудистых раст. совет. Дальнего Востока. Владивосток: ДВО АН СССР, 1990. С. 132–138.
Hyun T.K., Kim J.-S. The pharmacology and clinical properties of Kalopanax pictus // J. of Med. Plants Res. 2009. V. 3. № 9. P. 613–620.
Гладкова Г.А., Сибирина Л.А., Бутовец Г.Н. Редкие растительные сообщества с калопанаксом семилопастным на острове Русский (Южное Приморье) // Вестник ДВО РАН. 2015. № 1. С. 34–44.
Huh M.K., Jung S.D., Moon H.K. et al. Comparison of genetic diversity and population structure of Kalopanax pictus (Araliaceae) and its thornless variant using RAPD // Korean J. Med. Crop Sci. 2005. V. 13. № 2. P. 69–74.
Huh M.K. Comparison of genetic diversity and relationships of genus Kalopanax using ISSR markers // J. Life Sci. 2006. V. 16. № 5. P. 740–745.
Sakaguchi S., Takeuchi Y., Yamasaki M. et al. Lineage admixture during postglacial range expansion is responsible for the increased gene diversity of Kalopanax septemlobus in a recently colonised territory // Heredity. 2011. V. 107. P. 338–348.
Jung S.D., Huh H.W., Hong J.H. et al. Genetic diversity and population structure of Kalopanax pictus (Araliaceae) // J. Plant Biol. 2003. V. 46. № 4. P. 255–262.
Sakaguchi S., Qiu Y.-X., Liu Y.-H. et al. Climate oscillation during the Quaternary associated with landscape heterogeneity promoted allopatric lineage divergence of a temperate tree Kalopanax septemlobus (Araliaceae) in East Asia // Mol. Ecol. 2012. V. 21. P. 3823–3838. https://doi.org/10.1111/j.1365-294X.2012.05652.x
Isabel N., Tremblay L., Michaud M. et al. RAPDs as an aid to evaluate the genetic integrity of somatic embryogenesis derived populations of Picea mariana (Mill.) B.S.P. // Theor. Appl. Genet. 1993. V. 86. P. 81–87.
Shaw J., Lickey E.B., Beck J.T. et al. The tortoise and the hare II: Relative utility of 21 noncoding chloroplast DNA sequences for phylogenetic analysis // Am. J. Bot. 2005. V. 92. P. 142–166. https://doi.org/10.3732/ajb.92.1.142
Shaw J., Lickey E.B., Schilling E.E., Small R.L. Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: The tortoise and the hare III // Am. J. Bot. 2007. V. 94. P. 275–288.
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: Molecular evolutionary genetics analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547–1549.
Excoffier L., Lischer H.E.L. Arlequin suite ver 3.5: A new series of programs to perform population genetics analyses under Linux and Windows // Mol. Ecol. Resources. 2010. V. 10. P. 564–567.
Bandelt H.-J., Forster P., Rohl A. Median-joining networks for inferring intraspecific phylogenies // Mol. Biol. Evol. 1999. V. 16. № 1. P. 37–48.
Нечаев В.А., Гамова Т.В. Птицы Дальнего Востока России (аннотированный каталог). Владивосток: Дальнаука, 2009. 564 с.
Нечаев В.А., Нечаев А.А. Семейство Аралиевые и птицы-карпофаги на юге Дальнего Востока // Вестник ДВО РАН. 2015. № 1. С. 63–71.
Павлюткин Б.И., Чекрыжов И.Ю., Петренко Т.И. Геология и флора нижнего миоцена юга Приморья. Владивосток: Дальнаука, 2012. 194 с.
Крестов П.В., Баркалов В.Ю., Омелько А.М. и др. Реликтовые комплексы растительности современных рефугиумов Северо-Восточной Азии // Комаровские чтения. 2009. Вып. 56. С. 5–63.
Дополнительные материалы отсутствуют.


