Генетика, 2021, T. 57, № 8, стр. 916-924
Генетическая структура и дифференциация реликтовых популяций липы на основе анализа изменчивости ядерных микросателлитных локусов
А. К. Экарт 1, *, А. Я. Ларионова 1, А. Н. Кравченко 1, С. А. Семерикова 2, М. И. Седаева 1
1 Институт леса им. В.Н. Сукачева Сибирского отделения
Российской академии наук
660036 Красноярск, Россия
2 Институт экологии растений и животных Уральского отделения
Российской академии наук
620144 Екатеринбург, Россия
* E-mail: aekart@yandex.ru
Поступила в редакцию 28.08.2020
После доработки 24.09.2020
Принята к публикации 10.10.2020
Аннотация
Впервые на основании анализа изменчивости 12 микросателлитных маркеров ядерного генома изучено генетическое разнообразие, структура и дифференциация реликтовых насаждений липы в Красноярском крае, рассматриваемых в качестве отдельного вида Tilia nasczokinii Stepanov. Кроме того, в исследование были включены шесть популяций T. cordata Mill. из европейской и западно-сибирской частей ее ареала и популяция T. sibirica Bayer из Кемеровской области. Обнаружено, что насаждения липы в окрестностях г. Красноярска (Манское займище и Каштак) имеют сходную генетическую структуру и находятся в состоянии, близком к равновесному. Уровень генетической изменчивости T. nasczokinii сопоставим с таковым в популяции T. sibirica, но оказался значительно ниже, чем в популяциях T. cordata. Оценка степени генетической дифференциации популяций липы по межпопуляционным парным значениям Fst и генетическим дистанциям Нея (DN72) выявила значительные различия популяций T. nasczokinii от популяций T. cordata и T. sibirica. Анализ генетической дифференциации методом PCoA парных значений Fst и индивидуальных генетических дистанций (D), а также кластеризация в STRUCTURE показали разделение изученных популяций на три группы согласно их видовой принадлежности. При этом популяции T. nasczokinii генетически удалены от популяций T. sibirica в большей степени, чем от T. cordata.
На территории России наибольшее распространение имеют два вида липы: липа мелколистная (Tilia cordata Mill.) и липа амурская (Tilia amurensis Rupr.). В Сибири, помимо T. cordata, крайне восточная часть ареала которой достигает р. Иртыш, липа встречается в Кемеровской области. Самое крупное из известных насаждений липы находится в предгорьях Кузнецкого Алатау вблизи села Кузедеево (Государственный памятник природы “Липовый остров”). Оно достаточно хорошо исследовано несколькими поколениями ботаников [1–6]. Кроме того, в Кемеровской области выявлено и описано несколько десятков более мелких изолированных насаждений липы [6], предположительно сохранившихся на территории области с третичного доледникового периода. Впервые гипотеза о реликтовом происхождении липы в Южной Сибири была выдвинута П.Н. Крыловым [1] и в дальнейшем поддержана другими исследователями [7–9]. Ряд авторов [10–12], указывая на значительные морфологические различия между произрастающей в Кемеровской области липы и T. cordata, рассматривают ее в качестве отдельного вида Tilia sibirica Bayer. Некоторые исследователи [13] считают, что южно-сибирские популяции липы являются подвидом T. cordata subsp. sibirica (Fischer ex Bayer) Pigott или формой T. cordata var. sibirica (Fischer ex Bayer) Maximowicz. Согласно современной международной классификации T. sibirica до сих пор остается неопределенным видом [14].
Следует однако отметить, что в последние годы в связи с разработкой ДНК-маркеров ядерного генома, пригодных для популяционно-генетических исследований различных видов липы [15], появились новые данные, подтверждающие видовой статус T. sibirica. Сравнительное исследование T. sibirica из окрестностей села Кузедеево, где наблюдается самая высокая в Южной Сибири концентрация липы этого вида, и T. cordata из Австрии, Польши и России (Тюменская область) по 12 ядерным микросателлитным локусам [16] показало значительную генетическую дифференциацию между ними (Fst варьировал от 0.151 до 0.303). Обнаружено, что популяции T. sibirica имеют более низкое генетическое разнообразие и более высокую частоту вегетативного (клонального) размножения по сравнению с изученными популяциями T. cordata. На основании полученных данных [16] о генетических различиях между популяциями T. sibirica и T. сordata и выявленных ранее другими исследователями различий по морфологическим признакам [12, 13], экологической и географической изоляции T. sibirica авторы делают заключение о том, что T. sibirica и T. сordata являются разными видами.
Небольшие изолированные насаждения липы существуют также в окрестностях г. Красноярска. Впервые сведения о реликтовых насаждениях липы на территории Красноярского края появились еще в XIX в. [17–19]. Большинство исследователей описывали ее как T. sibirica [20–22]. Т.Н. Буторина и В.Д. Нащокин [23] отмечая своеобразие липы, произрастающей вблизи Красноярска, предложили для нее ранг подвида T. sibirica ssp. jenisseensis Butor. На особенности морфологии цветков и плодов красноярской липы указывал в своей работе и Л.М. Черепнин [24]. Он активно поддержал выделение нового таксона. Однако данный таксон так и остался “nomen nudum” – необнародованным. В качестве нового вида Tilia nasczokinii Stepanov sp. nov. = T. sibirica ssp. jenisseensis красноярскую липу описал Н.В. Степанов [25], основываясь на существенных морфологических отличиях ее от T. cordata, T. amurensis и T. sibirica по признакам завязи, зубцов по краю листа и почечных чешуй. Наиболее значительные различия по морфологическим признакам наблюдаются между красноярской липой и липами мелколистной и сибирской. По отдельным признакам (зубчатость листовой пластинки) красноярская липа имеет сходство с T. amurensis, однако для установления степени их родства требуются дополнительные исследования [25]. Достоверные различия между липой из окрестностей Красноярска и липой мелколистной из восточных районов ее ареала (Омская область) были получены также по ряду морфометрических характеристик листовых пластин [26]. По мнению авторов этого исследования T. nasczokinii и T. cordata являются близкими, но экологически довольно обособленными видами.
Несмотря на географическую удаленность и существенные отличия липы из Красноярского края от T. cordata и T. sibirica по экологическим условиям обитания, фенологии, морфологическим признакам, видовой статус T. nasczokinii до настоящего времени не получил международного признания и остается неопределенным [14].
На сегодняшний день достоверно известно о двух изолированных местообитаниях липы, расположенных в окрестностях г. Красноярска. Одно из них, впервые описанное Я. Прейном [19], расположено на левом берегу Енисея, в 18 км выше г. Красноярска, на склонах хребта у так называемого Манского займища. Второе, обнаруженное сотрудниками государственного заповедника “Столбы” в 1951 г., находится на правом берегу Енисея у северной границы заповедника, на склоне невысокой гривы, в долине ручья Каштак [23, 25, 27].
Произрастающая вблизи Красноярска липа является единственным представителем широколиственных древесных растений, сохранившихся на территории Красноярского края с третичного доледникового периода, и является ценным объектом для генетических исследований. Однако ни одно из обнаруженных местообитаний липы до настоящего времени в этом отношении не изучалось. Нет данных о состоянии генофонда и репродуктивных возможностях насаждений красноярской липы, о филогенетических связях с популяциями липы из других регионов Сибири. Использование для ее изучения методов молекулярной генетики, основанных на анализе изменчивости ДНК-маркеров, даст возможность получить информацию о генетическом разнообразии, структуре и степени дифференциации реликтовых насаждений красноярской липы от популяций других близких видов, необходимую как для обоснования правомерности выделения липы из окрестностей Красноярска в качестве отдельного вида, так и для выполнения работ по сохранению и воспроизводству этих уникальных реликтовых насаждений.
Цель настоящего исследования – изучение генетического разнообразия, структуры и степени генетической дифференциации T. nasczokinii от популяций T. sibirica и T. cordata на основе анализа изменчивости ядерных микросателлитных локусов (nSSR).
МАТЕРИАЛЫ И МЕТОДЫ
Изучены две известные в окрестностях г. Красноярска популяции T. nasczokinii (Манское займище и Каштак), популяция T. sibirica из Кемеровской области (Кузедеево) и шесть популяций T. cordata из европейской и западно-сибирской частей ареала этого вида (Калининград, Луга, Плющань, Малиновка, Екатеринбург, Тобольск). Объем выборок варьировал от 19 до 29, составляя в среднем 23.8. Всего было проанализировано 214 особей. Географические координаты включенных в исследование популяций липы приведены в табл. 1.
Таблица 1.
Местоположение и основные параметры изменчивости исследованных популяций T. nasczokinii, T. sibirica и T. cordata
| Популяция | Координаты с.ш./в.д. |
n | P, % | Na | Ne | Ho | He | F |
|---|---|---|---|---|---|---|---|---|
| T. nasczokinii | ||||||||
| Манское займище | 55°57′51′′/92°29′57′′ | 24 | 75.0 | 2.92 | 1.59 | 0.285 | 0.312 | 0.080 |
| Каштак | 55°57′26′′/92°46′41′′ | 19 | 91.7 | 2.50 | 1.45 | 0.263 | 0.253 | –0.003 |
| T. sibirica | ||||||||
| Кузедеево | 53°19′54′′/87°13′59′′ | 23 | 58.3 | 2.25 | 1.41 | 0.228 | 0.197 | –0.117 |
| T. cordata | ||||||||
| Екатеринбург | 56°53′31′′/60°19′34′′ | 29 | 91.7 | 5.83 | 2.78 | 0.500 | 0.548 | 0.104 |
| Тобольск | 58°18′42′′/68°26′54′′ | 25 | 91.7 | 4.67 | 2.50 | 0.403 | 0.493 | 0.204 |
| Малиновка | 51°46′45′′/56°50′17′′ | 24 | 91.7 | 3.92 | 2.35 | 0.449 | 0.485 | 0.062 |
| Плющань | 52°49′00′′/38°59′00′′ | 24 | 91.7 | 4.92 | 2.58 | 0.462 | 0.532 | 0.131 |
| Луга | 58°52′16′′/29°50′56′′ | 26 | 83.3 | 4.58 | 2.63 | 0.452 | 0.502 | 0.095 |
| Калининград | 54°56′43′′/20°05′15′′ | 20 | 91.7 | 4.83 | 2.92 | 0.400 | 0.567 | 0.316 |
Выделение геномной ДНК проводили по стандартному протоколу для растительных тканей с применением СТАВ-метода из высушенных листьев [28]. Выделенную ДНК использовали для проведения ПЦР с 12 парами праймеров для микросателлитных последовательностей, разработанных и апробированных для 23 видов липы [15]. Для ПЦР-амплификации использовали универсальный беспраймерный набор УБП 1–4 ООО “НПФ “Генлаб” (Россия) согласно рекомендациям производителя. Амплификацию отобранных ядерных микросателлитных локусов (Tc4, Tc5, Tc6, Tc7, Tc8, Tc11, Tc915, Tc920, Tc927, Tc937, Tc943, Tc951) проводили при следующем режиме: предварительная денатурация ДНК при 95°С – 5 мин; далее 30 циклов, включающих денатурацию – 30 с при 94°С; отжиг праймеров – 40 c при 60°С и элонгация – 40 c при 72°С. Завершающий цикл элонгации проходил при 72°С в течение 5 мин.
Электрофоретическое разделение амплифицированных фрагментов ДНК проводили в 6%-ном полиакриламидном геле с использованием Трис-ЭДТА-боратной буферной системы, pH 8.3 при напряжении 15 В/1 см геля в течение 2–3 ч c последующей окраской нитратом серебра. Длину фрагментов определяли путем сопоставления со стандартным маркером O’Range Ruler 20 bp DAN Ladder (Thermo Scientific, Литва). Варианты размера фрагмента рассматривали в качестве аллелей данного локуса.
Популяционно-генетический анализ проводили на основании общепринятых в популяционной генетике статистических параметров, описывающих уровень изменчивости и дифференциации популяций. Расчет параметров проводился в GenAlЕx 6.502 [29]. Уровень генетической изменчивости в популяциях липы по 12 микросателлитным локусам определяли по следующим показателям: Р – процент полиморфных локусов, Na – число выявленных аллелей, Ne – эффективное число аллелей, Ho – наблюдаемая гетерозиготность, He – ожидаемая гетерозиготность, F – индекс фиксации. Для определения популяционной структуры и дифференциации популяций использовались коэффициенты F-статистики [30]. Количественная оценка степени генетических различий (DN72) между популяциями проводилась по методу, предложенному М. Неи [31]. Соответствие наблюдаемых в популяциях соотношений генотипов ожидаемым по закону Харди–Вайнберга определялось с помощью критерия χ2. Кроме того, с помощью программы GenAlЕx 6.502 проведен анализ иерархического распределения генетической изменчивости внутри популяций, между популяциями внутри видов, между видами (AMOVA), а также проведена ординация популяций на плоскости главных координат (Principal Coordinates Analysis, PCoA) на основе матриц межпопуляционных парных значений Fst и индивидуальных генетических дистанций D [32].
Принадлежность особей общей выборки к той или иной группе популяций определяли методом Байесовской кластеризации, реализованным в программе STRUCRURE v2.3.4 [33]. Количество кластеров (K) оценивалось в диапазоне от двух до четырех с числом повторов 1000 раз (burnin 104, MCMC 104). Оптимальное число кластеров устанавливалось методом Evanno ΔK [34] в STRUCTURE HARVESTER [35]. Усреднение значений Q-матрицы проводилось по алгоритму LargeKGreedy (104 повторов) в CLUMPP v1.1.2 [36]. Визуализация данных осуществлялась в DISTRUCT v1.1 [37].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из 12 включенных в исследование ядерных микросателлитных локусов лишь один локус (Тс8) оказался мономорфным в изученных популяциях липы. Остальные локусы обнаруживают изменчивость. Наиболее высокий уровень полиморфизма наблюдается в локусах Тс5 (17 аллелей), Тс915 (16 аллелей) и Тс6 (14 аллелей). В других полиморфных локусах число выявленных аллелей варьирует от четырех (Тс7, Тс927, Тс943, Тс951) до 10 (Тс920). Всего при анализе 214 индивидов липы из девяти популяций идентифицировано 96 аллелей, 15 из которых являются общими в популяциях трех видов липы (табл. 2). Самое большое аллельное разнообразие обнаружено у T. cordata. В разных популяциях этого вида общее число выявленных аллелей колеблется в пределах от 47 (Малиновка) до 70 (Екатеринбург), составляя в среднем 57.5. В популяциях T. nasczokinii число выявленных аллелей ниже, чем у T. cordata: 35 (Манское займище) и 29 (Каштак). В популяции T. sibirica (Кузедеево) обнаружено минимальное среди изученных популяций число аллельных вариантов (27). Большая часть выявленных в локусах аллелей встречается в популяциях с частотой менее 5%. В отдельных популяциях число редких аллелей варьирует от восьми (Каштак, Кузедеево) до 25 (Екатеринбург). Больше всего редких аллелей обнаружено в популяциях T. cordata.
Таблица 2.
Общее число аллелей и число аллелей, выявленных в популяциях T. nasczokinii, T. sibirica и T. cordata, размеры амплифицируемых фрагментов
| Локус | Общее число выявленных аллелей | Размер фрагмента, пн | Число выявленных аллелей | ||
|---|---|---|---|---|---|
| T. nasczokinii | T. sibirica | T. cordata | |||
| Тс4 | 8 | 228–244 | 6 | 2 | 8 |
| Тс5 | 17 | 150–190 | 4 | 3 | 16 |
| Тс6 | 14 | 131–163 | 5 | 4 | 12 |
| Тс7 | 4 | 222–240 | 2 | 1 | 4 |
| Тс8 | 1 | 144 | 1 | 1 | 1 |
| Тс11 | 5 | 136–156 | 2 | 1 | 5 |
| Тс915 | 16 | 159–189 | 4 | 5 | 16 |
| Тс920 | 10 | 226–244 | 4 | 1 | 10 |
| Тс927 | 4 | 147–157 | 3 | 1 | 2 |
| Тс937 | 9 | 152–172 | 4 | 4 | 9 |
| Тс943 | 4 | 147–159 | 2 | 2 | 4 |
| Тс951 | 4 | 159–165 | 4 | 2 | 4 |
| Всего | 96 | 41 | 27 | 91 | |
Рассчитанные значения основных показателей генетического разнообразия в изученных популяциях трех видов липы приведены в табл. 1. Из представленных данных видно, что произрастающая в окрестностях г. Красноярска липа (T. nasczokinii) имеет более низкие по сравнению с T. cordata показатели генетической изменчивости. Доля полиморфных локусов в исследованных популяциях T. nasczokinii составляет 75.0 и 91.7%, среднее число аллелей на локус 2.50 и 2.92, эффективное число аллелей 1.45 и 1.59, наблюдаемая гетерозиготность 0.263 и 0.285, ожидаемая гетерозиготность 0.253 и 0.312. В популяциях T. cordata значения этих показателей значительно выше и варьируют в диапазонах: 83.3–91.7%, 3.92–5.83, 2.35–2.92, 0.400–0.500 и 0.493–0.567 соответственно. Самый низкий уровень генетического разнообразия среди изученных популяций наблюдается у T. sibirica (табл. 1). В проведенном ранее сравнительном исследовании популяций T. sibirica и T. cordata по аналогичному набору микросателлитных локусов [16] также отмечается низкое генетическое разнообразие T. sibirica. В двух популяциях обнаружен избыток (F равен –0.003 и –0.117), а в остальных – недостаток гетерозиготных генотипов (F варьирует от 0.080 до 0.316). Самый большой дефицит гетерозигот по изученным микросателлитным локусам установлен в одной из популяций T. cordata (Калининград). В этой популяции достоверные различия между наблюдаемой и ожидаемой в соответствии с законом Харди–Вайнберга гетерозиготностью, установленные по χ2-тестам, выявлены у шести из 12 микросателлитных локусов. В популяциях T. nasczokinii (Манское займище, Каштак) существенные отклонения наблюдаемых частот генотипов от ожидаемых обнаружены лишь у одного–двух локусов. В целом, по совокупности проанализированных локусов, популяции красноярской липы находятся в состоянии близком к равновесному.
Исследование популяционной структуры с помощью F-статистик показало, что 19.1% (Fst = 0.191) выявленной генетической изменчивости приходится на межпопуляционную составляющую. Остальная изменчивость распределяется внутри популяций. Самый большой вклад в дифференциацию популяций вносят четыре локуса: Тс920, Тс937, Тс943 и Тс951 (Fst варьирует от 0.246 до 0.357). Значения Fis и Fit, отражающие соответственно инбридинг особи относительно популяции и инбридинг особи относительно совокупности изученных популяций, равны в среднем 0.129 и 0.306 (табл. 3). Полученные оценки этих показателей указывают на недостаток гетерозиготных генотипов. Как видно из приведенных в таблице данных, наиболее значительный дефицит гетерозигот наблюдается в локусе Тс927 (Fis = 0.430).
Таблица 3.
Значения индексов фиксации для проанализированных локусов
| Локус | Fis | Fit | Fst |
|---|---|---|---|
| Тс4 | 0.285 | 0.400 | 0.161 |
| Тс5 | –0.052 | 0.058 | 0.105 |
| Тс6 | 0.158 | 0.303 | 0.172 |
| Тс7 | 0.293 | 0.381 | 0.124 |
| Тс11 | 0.184 | 0.306 | 0.149 |
| Тс915 | 0.235 | 0.314 | 0.103 |
| Тс920 | 0.002 | 0.253 | 0.251 |
| Тс927 | 0.430 | 0.480 | 0.088 |
| Тс937 | –0.037 | 0.218 | 0.246 |
| Тс943 | –0.038 | 0.315 | 0.339 |
| Тс951 | –0.037 | 0.333 | 0.357 |
| В cреднем | 0.129 ± 0.049 | 0.306 ± 0.031 | 0.191 ± 0.027 |
Достаточно высокий уровень генетической дифференциации изученных популяций липы подтверждается результатами анализа иерархической структуры молекулярной изменчивости AMOVA (табл. 4). Доля изменчивости, обеспечивающая дифференциацию между тремя видами липы, составила 21% от общего генетического разнообразия. Это более чем в 3 раза больше доли изменчивости, распределяемой среди популяций внутри видов (6%). Внутрипопуляционная генетическая изменчивость составляет 73%.
Таблица 4.
Анализ молекулярной изменчивости (AMOVA) изученных популяций T. nasczokinii, T. sibirica и T. cordata
| Источник изменчивости | d.f. | Сумма квадратов отклонений |
Компоненты изменчивости | Доля (%) изменчивости | Значение p |
|---|---|---|---|---|---|
| Между видами | 2 | 179.86 | 89.93 | 0.776 (21) | 0.001 |
| Между популяциями внутри видов | 6 | 74.21 | 12.37 | 0.201 (6) | 0.001 |
| Внутри популяций | 419 | 1134.4 | 2.71 | 2.707 (73) | 0.001 |
| Всего | 427 | 1388.5 | 3.685 (100) |
Для оценки степени генетической дифференциации популяций липы использовали межпопуляционные парные значения Fst и генетические расстояния DN72 (табл. 5). Наиболее высокие значения Fst обнаружены между популяциями T. nasczokinii и популяцией T. sibirica. Значения Fst между популяциями этих видов равны 0.514 и 0.586. В меньшей степени популяции T. nasczokinii дифференцированы от популяций T. cordata. Парные значения Fst варьируют от 0.194 до 0.320, составляя в среднем 0.248. Немного выше степень дифференциации популяций T. cordata и T. sibirica. Fst варьирует от 0.280 до 0.386 (среднее значение Fst равно 0.313). Сопоставимые значения Fst между популяциями T. sibirica и T. cordata получены ранее [16]. Авторами отмечена высокая генетическая дифференциация между этими таксонами, произошедшая в результате экологической и географической изоляции T. sibirica в Южной Сибири в среднем плейстоцене (примерно 447 тыс. лет назад). Самый низкий уровень различий наблюдается между популяциями внутри видов. Fst колеблется в пределах от 0.018 до 0.092 со средним значением 0.061 (табл. 5).
Таблица 5.
Межпопуляционные парные значения Fst (ниже диагонали) и генетические дистанции DN72 (выше диагонали) между популяциями Т. nasczokinii, T. sibirica и T. cordata
| Вид | T. nasczokinii | T. sibirica | T. cordata | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Популяции | МЗ | КШ | КЗ | ЕК | ТБ | МЛ | ПЛ | ЛГ | КЛ |
| МЗ | – | 0.048 | 0.473 | 0.208 | 0.261 | 0.297 | 0.218 | 0.202 | 0.212 |
| КШ | 0.085 | – | 0.549 | 0.285 | 0.330 | 0.361 | 0.309 | 0.287 | 0.222 |
| КЗ | 0.514 | 0.586 | – | 0.272 | 0.257 | 0.407 | 0.292 | 0.290 | 0.244 |
| ЕК | 0.194 | 0.257 | 0.286 | – | 0.057 | 0.126 | 0.052 | 0.105 | 0.120 |
| ТБ | 0.245 | 0.305 | 0.301 | 0.031 | – | 0.113 | 0.079 | 0.090 | 0.119 |
| МЛ | 0.265 | 0.320 | 0.386 | 0.082 | 0.082 | – | 0.090 | 0.106 | 0.152 |
| ПЛ | 0.206 | 0.279 | 0.309 | 0.023 | 0.048 | 0.057 | – | 0.042 | 0.109 |
| ЛГ | 0.202 | 0.276 | 0.317 | 0.066 | 0.061 | 0.074 | 0.018 | – | 0.108 |
| КЛ | 0.200 | 0.224 | 0.280 | 0.064 | 0.073 | 0.092 | 0.058 | 0.066 | – |
Сходные результаты получены при использовании в качестве меры дифференциации генетических расстояний DN72. Среднее генетическое расстояние между популяциями разных видов (DN72 = 0.357) в несколько раз больше расстояния между популяциями внутри видов (DN72 = 0.073). Как и в случае с Fst, максимальный уровень генетических различий наблюдается между популяциями T. nasczokinii и T. sibirica (DN72 = 0.511).
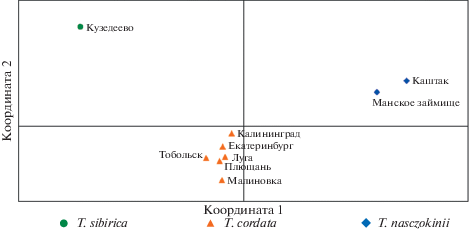
Для визуализации генетических различий между изученными видами липы на основе индивидуальных парных генетических расстояний D [33] был выполнен PCoA. На рис. 1 видно, что исследованные популяции T. nasczokinii, T. sibirica и T. cordata образуют три пространственно разобщенные группы, что свидетельствует о значительной дифференциации этих видов. Аналогичные результаты получены при PCoA парных значений Fst (рис. 2). Наиболее удалены друг от друга популяции T. nasczokinii и T. sibirica, обнаруживающие самый высокий уровень генетической дифференциации среди всех изученных популяций.
Рис. 1.
Дифференциация 214 особей липы на основе РСоA матрицы индивидуальных генетических дистанций (D). Координаты 1 и 2 суммарно представляют 27% генетической изменчивости.
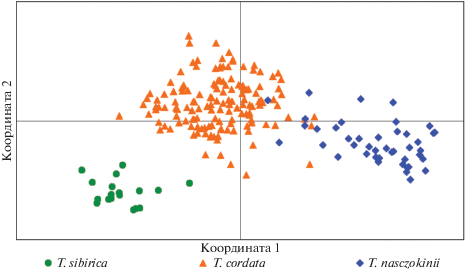
Рис. 2.
Дифференциация изученных популяций липы на основе РСоA матрицы парных значений Fst. Координаты 1 и 2 суммарно представляют 77% генетической изменчивости.
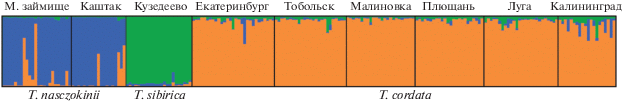
Кластеризация проанализированных особей в STRUCTURE подтверждает результаты, полученные при анализе парных значений Fst и индивидуальных генетических дистанций. При использовании метода Evanno ΔK изученные деревья липы распределились в трех кластерах в соответствии с их видовой принадлежностью (рис. 3).
Рис. 3.
Распределение 214 изученных особей липы на основе Байесовского кластерного анализа, выполненного в STRUCTURE.
Таким образом, в результате исследования, проведенного с помощью 12 ядерных микросателлитных локусов, получены данные о генетическом разнообразии, структуре и дифференциации реликтовых популяций липы из окрестностей г. Красноярска, рассматриваемых Н.В. Степановым [25] в качестве нового вида T. nasczokinii. Установлено, что изученные популяции T. nasczokinii: Манское займище и Каштак имеют более низкие параметры генетической изменчивости по сравнению с популяциями T. cordata из европейской и западно-сибирской частей ареала этого вида. Самый низкий уровень генетического разнообразия среди изученных популяций наблюдается у T. sibirica из Кемеровской области. Включенные в исследование популяции T. nasczokinii имеют сходную генетическую структуру и по совокупности проанализированных локусов ни одна из них не обнаруживает существенных отклонений от равновесного состояния по Харди–Вайнбергу.
Анализ генетической дифференциации различными методами показал разделение популяций на три группы. При этом популяции T. nasczokinii генетически удалены от популяций T. sibirica в большей степени, чем от T. cordata. Таким образом, принадлежность красноярских популяций липы к виду T. sibirica или к подвиду T. sibirica ssp. jenisseensis является генетически необоснованной.
Для подтверждения видового статуса красноярской липы необходимы дальнейшие более обширные исследования с привлечением большего числа популяций липы из сибирских регионов, а также популяций дальневосточного вида T. amurensis, которая по ряду морфологических признаков обнаруживает сходство с T. nasczokinii [25]. Кроме того, представляется целесообразным использование других генетических маркеров, в частности маркеров цитоплазматических геномов.
Исследование выполнено при финансовой поддержке Российского фонда фундаментальных исследований, Правительства Красноярского края и Красноярского краевого фонда науки в рамках научного проекта № 19-44-240006 p_a, а также при финансовой поддержке Российского фонда фундаментальных исследований, проект № 18-04-01061а.
Авторы выражают искреннюю благодарность профессору Сибирского федерального университета Н.В. Степанову, сотрудникам Национального парка “Красноярские Столбы” А.А. Кнорре и Д.Ю. Полянской за предоставленную информацию о местонахождении популяций липы в окрестностях Красноярска, а также сотрудникам Института экологии растений и животных УрО РАН В.Л. Семерикову, Е.В. Хантемировой и сотруднику Ботанического сада УрО РАН Е.Г. Филиппову за участие в сборе образцов T. cordata и T. sibirica.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Крылов П.Н. Леса в прегорьях Кузнецкого Алатау // Изв. Импер. Томского ун-та. Отдел 2. 1891. С. 1–40.
Ревердатто Л.Ф. К вопросу о судьбе липового острова в Кузнецком Алатау // Изв. Томского ун-та. 1925. Т. 75. С. 277–282.
Крылов П.Н. Семейство Tiliaceae – Липовые // Флора Западной Сибири: руководство к определению западносибирских растений. Вып. 8: Geraniaceae – Cornaceae. Томск: Наука, 1934. С. 1891–1894.
Грубов В.И. О современном состоянии липового острова в предгорьях Кузнецкого Алатау // Сов. ботаника. 1940. № 1. С. 84–85.
Хлонов Ю.П. Леса и липники Западной Сибири. Новосибирск: Наука, 1965. 154 с.
Амелин И.И., Бляхарчук Т.А. Распространение липы сибирской (Tilia sibirica Bayer) в Кемеровской области // Вестник Томского гос. ун-та. Биология. 2016. № 2(34). С. 30–52. https://doi.org/10.17223/19988591/34/3
Положий А.В., Крапивкина Э.Д. Реликты третичных широколиственных лесов во флоре Сибири. Томск: Изд-во ТГУ, 1985. 156 с.
Крапивкина Э.Д. Неморальные реликты во флоре черневой тайги Горной Шории. Новосибирск: Изд-во СО РАН, 2009. 229 с.
Novák J., Trotsiuk V., Sýkora O. et al. Ecology of Tilia sibirica in a continental hemiboreal forest, southern Siberia: An analogue of a glacial refugium of broad-leaved temperate trees? // The Holocene. 2014. V. 24(8). P. 908–918. https://doi.org/10.1177/0959683614534744
Васильев И.В. Сем. 58. Липовые – Tiliaceae Juss. // Деревья и кустарники СССР. М.; Л: Изд-во АН СССР, 1958. Т. 4. С. 659–726.
Хлонов Ю.П. Липа сибирская – Tilia sibirica Bayer // Биологические основы охраны редких и исчезающих растений Сибири. Новосибирск: Наука, 1990. С. 58–80.
Власова Н.В. Семейство Tiliaceae // Флора Сибири. Новосибирск: Наука, 1996. Т. 10. С. 65–66.
Pigott C.D. Lime-trees and Basswoods: A Biological Monograph of the Genus Tilia. N.Y.: Cambr. Univ. Press, 2012. 395 p.
http://www.theplantlist.org/1.1/browse/A/Malvaceae/Tilia/
Phuekvilai P., Wolff K. Characterization of microsatellite locus in Tilia platyphyllos (Malvaceae) and cross-amplification in related species // Appl. Plant Sci. 2013. V. 1(4). https://doi.org/10.3732/apps.1200386
Logan S., Chytry M., Wolff K. Genetic diversity and demographic history of the Siberian lime (Tilia sibirica) // Perspectives in Plant Ecol., Evol. and Systematics. 2018. V. 33. P. 9–17. https://doi.org/10.1016/j.ppees.2018.04.005
Пестов И.С. Записки об Енисейской губернии Восточной Сибири. М.: Унив. типография, 1833. С. 245.
Степанов А.П. Енисейская губерния. Т. 1. СПб., 1835. 276 с.
Прейн Я. Предварительный отчет об исследованиях липы в окрестностях г. Красноярска // Изв. Восточно-Сиб. отделения РГО. Иркутск, 1895. Т. 25. № 4–5. С. 95–127.
Ильин М.М. О липе в окрестностях Красноярска // Бот. журн. 1934. Т. 19. № 4. С. 34.
Васильев И.В. Новые данные о липе в окрестностях Красноярска // Бот. журн. 1953. Т. 38. № 5. С. 737–742.
Положий A.B. Сем. Тiliaсеае–Липовые // Флора Красноярского края. Томск: Изд-во Томск. гос. ун-та, 1977. Вып. 7. С. 18.
Буторина Т.Н., Нащокин В.Д. Липа сибирская в заповеднике “Столбы” // Тр. гос. заповедника “Столбы”. Вып. II. Красноярское кн. изд-во, 1958. С. 152.
Черепнин Л.М. Флора южной части Красноярского края. Вып. 4 // Уч. зап. Красноярского пед. ин-та. 1963. Т. 24. № 4. С. 3–270.
Степанов Н.В. Tilia nasczokinii (Tiliaceae) – новый вид из окрестностей Красноярска // Бот. журн. 1993. Т. 78. № 3. С. 137–144.
Сорокин А.Д., Григорьев А.И. Особенности строения листовой пластины Tilia cordata Mill. и Tilia nasczokinii // Омский науч. вестник. Биологические, сельскохозяйственные и ветеринарные науки. 2006. № 7(43). С. 144–147.
Полянская Д.Ю., Андреева Е.Б., Гончарова Н.В. Мониторинг Tilia nasczokinii Stepanov в заповеднике Столбы // Научные исследования в заповедниках и национальных парках Южной Сибири. Новосибирск: Изд-во СО РАН, 2016. С. 46–49.
Devey M.E., Bell J.C., Smith D.N. et al. A genetic linkage map for Pinus radiata based on RFLP, RAPD and microsatellite markers // Theor. Appl. Genet. 1996. V. 92. № 6. P. 673–679. https://doi.org/10.1007/BF00226088
Peakall R., Smouse P.E. GENALEX 6.5: genetic analysis in Excel. Population genetic software for teaching and research-an update // Bioinformatics (Oxf., Engl.). 2012. V. 28. P. 2537–2539. https://doi.org/10.1093/bioinformatics/bts460
Weir B.S., Cockerham C.C. Estimating F-statistic for the analysis of population structure // Evolution. 1984. V. 38. P. 1358–1370.
Nei M. Genetic distance between populations // Am. Naturalist. 1972. V. 106. P. 283–292.
Smouse P.E., Peakall R. Spatial autocorrelation analysis of individual multiallele and multilocus genetic structure // Heredity. 1999. V. 82. P. 561–573. https://doi.org/10.1038/sj.hdy.6885180
Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data // Genetics. 2000. V. 155. № 2. P. 945–959.
Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the soffware STRUCTURE: a simulation study // Mol. Ecol. 2005. V. 14. № 8. P. 2611–2620. https://doi.org/10.1111/j.1365-294X.2005.02553.x
Earl D., vonHoldt B. STRUCTURE HARVESTER: A website and program for visualizing STRUCTURE output and implementing the Evanno method // Conserv. Genet. Resour. 2012. V. 4. P. 359–361. https://doi.org/10.1007/s12686-011-9548-7
Jakobsson M., Rosenberg N.A. CLUMPP: A cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure // Bioinformatics. 2007. V. 23. № 14. P. 1801–1806. https://doi.org/10.1093/bioinformatics/btm233
Rosenberg N.A. Distruct: A program for the graphical display of population structure // Mol. Ecol. Notes. 2004. V. 4. P. 137–138. https://doi.org/10.1046/j.1471-8286.2003.005
Дополнительные материалы отсутствуют.


