Генетика, 2021, T. 57, № 8, стр. 887-906
Молекулярные механизмы и генная регуляция меланиновой окраски оперения у птиц
И. В. Куликова *
Федеральный научный центр биоразнообразия наземной биоты Восточной Азии Дальневосточного отделения Российской академии наук
690022 Владивосток, Россия
* E-mail: Kulikova@biosoil.ru
Поступила в редакцию 25.09.2020
После доработки 07.12.2020
Принята к публикации 08.12.2020
Аннотация
Меланиновая окраска оперения птиц реализуется благодаря соотношению и распределению в структуре пера двух типов меланиновых пигментов – эумеланина и феомеланина. В обзоре рассмотрены разнообразные аспекты меланогенеза, транспортировки и депонирования меланинов и генная регуляция многочисленных сопряженных с ними процессов. Изложены современные представления о функциональной роли генов-кандидатов и описаны результаты анализа их изменчивости у представителей разных видов птиц. Приводятся данные об использовании полногеномного и транскриптомного анализов для изучения молекулярно-генетических основ расцветки и рисунка оперения.
Расцветка оперения птиц включает всю палитру цветов, видимую человеческим глазом. И даже больше, ведь тетрахроматическое зрение позволяет птицам различать цвета и оттенки значительно лучше, чем это удается млекопитающим с их дихроматическим или трихроматическим зрением. Окраска оперения служит для маскировки, терморегуляции, защиты от УФ-излучения и микробных инвазий, добычи пропитания и социального общения, являясь зачастую определяющим фактором в выборе полового партнера [1]. Существуют три основных механизма окраски оперения: избирательное поглощение света пигментами пера, дифракционные и интерференционные оптические явления, обусловленные структурой пера, и одновременное действие обоих механизмов. Соответственно выделяют пигментную, структурную и смешанную окраску оперения.
В формировании пигментной окраски оперения участвуют меланины, каротиноиды, порфирины, пситтакофулвины и другие пигменты. Меланины – самый распространенный тип пигментов, они присутствуют практически у всех видов птиц. Эумеланин придает оперению цвет от серого до черного, феомеланин – от приглушенно-желтого до красновато-коричневого. Каротиноиды занимают второе после меланинов место по встречаемости в классе Aves и окрашивают оперение в желтый, оранжевый и красный цвета. Остальные типы пигментов встречаются намного реже. Меланины являются лидерами среди пигментов птиц не только по встречаемости, но и по универсальности применения. Они используются для создания структурной окраски оперения в качестве подлежащего пигментного слоя, который служит для предотвращения некогерентного светорассеяния тканями, расположенными ниже светорассеивающих наноструктур пера, и тем самым способствует устойчивости диапозона и сохранению интенсивности и яркости отраженного света [1]. Формирование рисунка (узора) оперения также невозможно без меланинов. Анализ цвета оперения 9049 видов птиц показал, что в 98.2% случаев сложная окраска реализуется только в присутствии меланинов [2]. Меланины защищают ДНК поверхностно лежащих клеток от УФ-излучения, так как обладают широким спектром поглощения и отражения излучения в УФ и видимой части спектра. И, наконец, они выполняют функцию защиты от механических повреждений, поскольку придают прочность биологическим тканям [1].
В последние годы было проведено множество работ, посвященных изучению молекулярно-генетических основ формирования окраски оперения у птиц. Появилось много новых данных, особенно в результате применения методов секвенирования нового поколения, позволяющих получать последовательности целых геномов и транскриптомов отдельных особей, а в последнем случае и отдельных клеток. В настоящем обзоре мы попытались наиболее полно обобщить и подытожить всю имеющуюся в научной литературе информацию по данной теме, начиная с характеристики пигментов, биохимических реакций и сигнальных путей, лежащих в основе меланогенеза, и заканчивая результатами исследований, в которых применялись самые современные методы молекулярно-генетического анализа.
МЕЛАНИНЫ И МЕЛАНОГЕНЕЗ
Меланины представляют собой полимеры фенольной и (или) индольной природы. В перьях в разном соотношении встречаются два типа меланинов: эумеланин (темно-коричневый и черный пигмент) и феомеланин (желтоватый, красно-коричневый пигмент). Оба типа меланинов поглощают УФ и часть видимого излучения и выделяют его в виде тепла, но спектр поглощения эумеланина шире, особенно в красной части спектра, что объясняют большим количеством индолхинонов и карбонильных групп [3]. У птиц, так же как и у всех позвоночных, меланины вырабатываются специализированными клетками меланоцитами в особых органеллах меланосомах. По мере созревания меланосомы с помощью системы микротрубочек передаются к концам отростков (дендритов) меланоцитов, затем зрелые органеллы поступают в межклеточное пространство, откуда их захватывают кератиноциты. Кератиноциты впоследствии претерпевают кератинизацию и гибнут, оставляя после себя ороговевший кератин с вкрапленными в него меланосомами и пузырьками воздуха – структурный материал растущих перьев, волос, шерсти и т.д. [1].
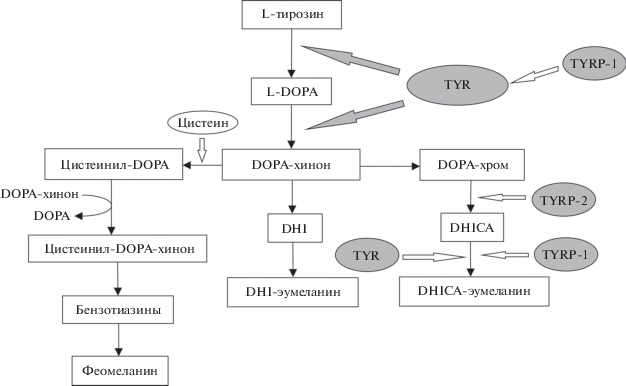
Процесс синтеза меланина в меланосомах – меланогенез – наиболее полно изучен на примере высших позвоночных, включая человека, хотя протекает он примерно одинаково у всех позвоночных (рис. 1). Субстратом для синтеза меланина является аминокислота L-тирозин, которая попадает в организм с пищей или синтезируется из L-фенилаланина. Фермент тирозиназа (TYR), мембранный гликопротеин меланоцитов, катализирует лимитирующую реакцию меланогенеза – окисление L-тирозина до L-диоксифенилаланина (DOPA). Далее DOPA окисляется в хинон (DOPA-хинон). Дальнейшие реакции идут по двум разным биохимическим путям, которые приводят к образованию эумеланина или феомеланина. Для синтеза эумеланина необходимы два интегральных гликопротеина TYRP1 и TYRP2/DCT, их аминокислотные последовательности на 40% гомологичны тирозиназе, поэтому их называют “TYRP, tyrosinase related proteins” – “белки родственные тирозиназе”. Функция TYRP1 состоит в активации и стабилизации тирозиназы, поддержании структуры меланосом. TYRP2 катализирует превращение DOPA-хрома в 5,6-дигидроксииндол-2-карбоновую кислоту (DHICA), полимеризация которой приводит к образованию DHICA-меланина. DOPA-хром может также превращаться в 5,6-дигидроксииндол (DHI). Продуктом окислительной полимеризации DHI является DHI-эумеланин. Увеличение соотношения DHI/DHICA приводит к образованию черного эумеланина, а уменьшение – коричневого эумеланина. Синтез феомеланина протекает только в присутствии серосодержащей аминокислоты цистеин и в отсутствие активированной TYR по несколько иному пути. На стадии образования DOPA-хинона к нему неферментативно присоединяется цистеин, в результате чего образуется 5-S-цистеинил-DOPA и 2-S-цистеинил-DOPA, которые претерпевают дальнейшие спонтанные превращения, а образующиеся в итоге бензотиазины становятся мономерными единицами полимера феомеланина (рис. 1).
Основные сигнальные пути меланогенеза
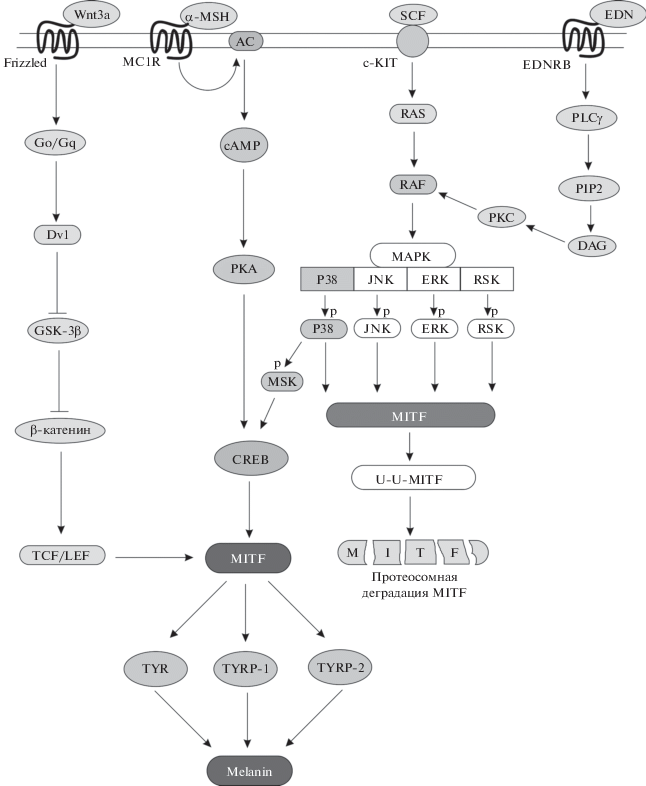
К настоящему времени открыто и изучено множество сигнальных систем, приводящих к синтезу меланина в меланосомах. Их главной мишенью является активация транскрипционного фактора микрофтальмии (MITF), который запускает экспрессию ферментов меланогенеза TYR, TYRP1, TYRP2 (рис. 2). Сигнальные системы меланогенеза можно разделить на две группыпо типу рецептора на поверхности клеток. Впервой из них используются рецепторы, сопряженные с G-белками (семейство GPCR – G-Protein Coupled Receptors), например меланокортиновый рецептор (MC1R), В-рецептор к эндотелину (EDNRB), рецептор Frizzled (Fz). Во второй группе рецепторы обладают тирозинкиназной активностью (белковая тирозинкиназа С-KIT, основной фактор роста фибробластов (FGF2) и т.д.). Несмотря на то что главным сигнальным каскадом меланогенеза считают SCF/KIT [6], большинство работ погенетической регуляции окраски оперения так или иначе связано с изучением меланокортинового сигнального пути.
Меланокортиновая сигнальная система. Эта система – классический и наиболее полно изученный путь меланогенеза, опосредованный активацией меланокортинового рецептора первого типа (MC1R), встроенного в мембрану меланоцитов (рис. 2). MC1R относится к GPCR-семейству и состоит их семи трансмембранных доменов и внеклеточного N- и внутриклеточного C‑концов, обладает высокой аффинностью к α‑меланоцитстимулирующему гормону (α-MSH) и к адренокортикотропину (ACTH). У птиц эти гормоны вырабатываются паракринно в фолликуле пера кератиноцитами, меланоцитами и фибробластами [7]. После взаимодействия со своими агонистами MC1R претерпевает конформационные изменения, что приводит к активации другого мембранного белка – аденилатциклазы (AC), превращающего АТФ в цАМФ. Повышение внутриклеточной концентрации цАМФ активирует протеинкиназу А (PKA), которая фосфорилирует транскрипционный фактор CREB. CREB запускает транскрипцию MITF, главного регулятора меланогенеза. В свою очередь MITF активирует экспрессию TYR, TYRP1, TYRP2, что приводит к синтезу эумеланина (рис. 2). Антагонист MC1R, сигнальный белок Агути (ASIP), стабилизирует неактивную конформацию рецептора, что в итоге вызывает снижение концентрации ключевого фермента меланогенеза TYR, прекращение синтеза эумеланина и при условии достаточной концентрации цистеина в клетке, которую обеспечивает работа белка-переносчика цистеина SLC7A11 [7], синтез желтого пигмента феомеланина.
Эндотелиновый сигнальный путь. Эндотелиновая регуляция меланогенеза птиц изучена недостаточно, однако предполагают, что она функционирует так же как и у млекопитающих [8]. Известно, что у птиц связывание сигнального полипептидаэндотелина-3 (EDN3) с мембранным рецептором EDNRB2 активирует пролиферацию, дифференциацию и миграцию меланоцитов и их предшественников, клеток нервного валика и меланобластов [9], а также запускает и регулирует меланогенез [10–12]. Связывание EDN с EDNRB активирует фосфолипазу Сγ (PLCγ), которая расщепляет полифосфоинозитид (PIP2) до инозитолтрифосфата (IP3) и диацилглицерола (DAG), что приводит к мобилизации внутриклеточного Ca2+ и активации протеинкиназы С (PKC) (рис. 2). PKC фосфорилирует протеинкиназу RAF-1, далее RAF-1 запускает митоген-активируемый протеиназный каскад (MAPK). MAPK-протеинкиназы фосфорилируют MITF, причем активация ERK и JNK приводит к кратковременной экспрессии и последующей убиквитин-зависимой деградации MITF, выключая эумеланогенез, тогда как P38 фосфорилирует транскрипционный фактор CREB, который активирует экспрессию MITF и тем самым запускает меланогенез.
Канонический сигнальный путь WNT/β-катенин. WNT-система задействована главным образом во время эмбрионального развития, а также в более поздних процессах органогенеза и в ходе регенерации тканей взрослого организма. WNT-каскад регулирует главным образом пролиферацию и дифференцировку клеток, в том числе и клеток нервного гребня будущих меланоцитов [13]. Для передачи сигнала внутрь клетки липогликопротеины семейства WNT должны связать соответствующие GPCR-рецепторы группы Frizzled (рис. 2). Экспрессию MITF в меланобластах и их последующую дифференцировку в меланоциты инициирует связывание лиганда Wnt3a c рецептором Frizzled [14]. Меланогенез в дифференцированных меланоцитах также может запускаться с помощью WNT-канонического пути в результате взаимодействия Wnt3a с Frizzled-3 [15]. Связанный с гетеротримерным G-белком рецептор Frizzled вызывает диссоциацию G-белка и последующий распад деструктивного Axin-комплекса, связывающего и фосфорилирующего цитоплазма-тический β-катенин. Свободный β-катенин диффундирует в ядро, где он образует комплекс с транскрипционными факторами семейства TCF/LEF и активирует транскрипцию MITF [16].
SCF-KIT сигнальный путь. SCF-KIT также играет важную роль в выживании, пролиферации и дифференцировке клеток разного типа [17]. Связывание тирозинкиназного рецептора c-KIT меланоцитов с лигандом SCF (Stem Cell Factor) приводит к димеризации и активации рецептора [18]. Активированный KIT фосфорилирует разные субстраты, включая и серин-треонинкиназу RAF при посредничестве белка RAS. RAF запускает сигнальный каскад MAPK. Далее события происходят по общему с эндотелиновым сигнальным путемсценарию (см. выше), поэтому SCF-KIT и эндотелиновый сигнальные пути рассматривают как синэргичные [19].
Генетические основы меланиновой окраски оперения. Формирование меланиновой окраски оперения – это результат действия и взаимодействия множества генов, как структурных, так и регуляторных. Сюда относятся гены, отвечающие за спецификацию клеток нервного гребня и их дальнейшую дифференциацию, т.е. превращение в меланобласты и меланоциты, за миграцию меланобластов в дерму, в область фолликула пера; гены, продукты которых являются либо непосредственными участниками, либо регуляторами синтеза меланина; гены, контролирующие формирование, нормальное функционирование и транспортировку меланосом. По меньшей мере 200 генов, ответственных за пигментацию, идентифицированы у млекопитающих [20], большинство их них имеет ортологов у птиц [21].
Миграция и дифференциация меланоцитов
Процесс спецификации клеток нервного гребня, дающих начало меланобластам, запускается экспрессией большого числа генов и активацией целого ряда сигнальных каскадов. У птиц одним из маркеров, начавших миграцию в дорсолатеральном направлении меланобластов, является рецептор к эндотелину EDNRB2 (рис. 2). Ген рецептора начинает экспрессироваться в клетках нервного гребня, начавших спецификацию по типу меланобластов, еще до начала их миграции, а связывание EDNRB2 с его лигандом EDN3 стимулирует размножение и дифференциацию меланоцитов. Мутации в гене EDNRB2 приводят к гипопигментации кожных покровов и их производных у птиц [10, 11], но в отличие от млекопитающих, у которых экспрессируется паралог EDNRB2 – EDNRB, не связаны с такими физиологическими нарушениями как глухота, мегаколон и нарушение моторики кишечника [22, 23]. Так, у японского перепела Coturnix coturnix аутосомная рецессивная мутация (s) в гене EDNRB2 приводит к аминокислотной замене Arg332His и связана с окраской оперения по типу “панды” (небольшие области пигментированного оперения в области головы, спины и хвоста на фоне белого оперения). При этом экспрессия EDNRB2 в коже перепелов с фенотипом “панда” снижена в 38 раз по сравнению с нормально окрашенными особями [10]. Эта же мутация обусловливает крапчатую окраску оперения у нескольких пород домашних кур [11] и пятнистую окраску оперения у домашней утки [12]. Данная замена находится в шестом домене EDNRB2 и, по-видимому, создает пространственные сложности для домена и третьей цитоплазматической петли рецептора, что отрицательно сказывается на его активности [12]. Аутосомная рецессивная мутация (mow) в гене EDNRB2 у домашней курицы породы Minohoku вызывает аминокислотную замену Cys244Phe в наружной петле между четвертым и пятым мембранными доменами рецептора, что приводит к ухудшению способности EDNRB2 связываться со своим лигандом EDN3. Фенотипически mow мутанты имеют белое оперение с несколькими небольшими участками частично или полностью пигментированных перьев в отличие от типичных представителей данной породы со светло-коричневой окраской оперения [11]. Среди серых домашних гусей породы Ганг встречаются особи с белым оперением, за исключением нескольких серых пятен на спине. Оказалось, что почти полное отсутствие пигментации оперения объясняется инсерцией длиной 14 пн в третьем экзоне гена EDNRB2, которая сдвигает рамку считывания и приводит к появлению дефектной мРНК. Все гуси с белым оперением – гомозиготы по данной мутации, у гетерозигот наблюдается промежуточная окраска оперения [24]. По-видимому, дефекты гена EDNRB2 нарушают миграцию меланобластов, поэтому меланоциты в фолликуле пера полностью или частично отсутствуют, и пигмент не продуцируется или продуцируется в небольшом количестве, соответственно.
Свое название транскрипционный фактор MITF (microphthalmia-associated transcription factor) получил от генетического заболевания – микрофтальмии, проявляющегося в виде аномального недоразвития глазного яблока, нарушений пигментации кожных покровов и радужной оболочки глаз. Микрофтальмию вызывают мутации в гене MITF [25, 26]. Он экспрессируется практически во всех типах клеток позвоночных, но главную роль играет именно в пигментных клетках, регулируя спецификацию, размножение, выживание, миграцию, меланогенез и злокачественное перерождение меланоцитов [27]. С гена MITF считывается девять изоформ транскрипционного фактора, которые отличаются по последовательности N-конца [28]. MITF-M – самая распространенная изоформа в меланоцитах, ключевой регулятор генов меланогенеза и транспорта меланосом [29]. Экспрессия MITF-M регулируется множеством других транскрипционных факторов, включая и сам MITF, и с помощью сигнальных путей меланогенеза (рис. 2) [27].
Ген MITF обычно начинает экспрессироваться в клетках, покинувших нервный гребень и специализирующихся по типу меланобластов. У кур и перепелов это происходит на третий день эмбрионального развития [30, 31]. Предполагается, что у птиц MITF регулирует именно дифференциацию меланоцитов и меланогенез, но не влияет на их миграцию [30]. Дифференцированная экспрессия MITF отмечена на ранней стадии развития меланоцитов в фолликуле растущего после удаления пера у серой вороны Corvus cornex: в фолликулах черных перьев уровень экспрессии MITF в меланоцитах выше, чем в фолликулах серых перьев [32].
Впервые среди птиц мутации в гене MITF были обнаружены у японского перепела. Одна из них представляла собой несинонимичную замену в основном домене, другая – делецию двух нуклеотидов в районе С-конца транскрипционного фактора, которая вызывала сдвиг рамки считывания. У гомозигот по мутантному аллелю SILVER (В) наблюдались дефекты развития глаз, отсутствие пигментации оперения [33] и нарушение остеокластогенеза, приводящее к разрушению костной ткани [34]. Впоследствии было показано, что именно вторая мутация (делеция двух нуклеотидов в 11-м экзоне гена) является функционально значимой [35]. Также у гусей и уток разных пород были обнаружены несколько синонимичных и несинонимичных замен как в кодирующих, так и в некодирующих участках MITF, коррелировавших в разной степени с окраской оперения [36–39]. В результате полногеномного сравнительного исследования домашней утки пекинской породы и ее предка, кряквы Anas platyrhynchos, у всех представителей пекинской породы была идентифицирована инсерция размером 6.6 тпн между первым и вторым экзонами гена. Эта инсерция способствует значительному снижению экспрессии изоформы MITF-М в меланоцитах и отключению всех регулируемых MITF генов меланогенеза, что объясняет белую окраску оперения пекинской утки [40]. Совсем недавно был выявлен возможный эпигенетический механизм регуляции окраски оперения у домашней утки с помощью метилирования MITF. Показано, что один их двух СрG-островков в районе промотора MITF отличается значительным повышением степени метилирования в фолликулах белых перьев по сравнению с фолликулами пигментированных перьев [39]. Известно, что метилирование СрG-островков промоторной зоны гена обычно приводит к подавлению экспрессии соответствующего гена [41]. Степень метилирования CpG-островка негативно коррелировала с экспрессией изоформы MITF-M, что свидетельствует в поддержку предположения об эпигенетической регуляции.
Экспрессии MITF предшествует появление в клетках нервного гребня двух важнейших транскрипционных факторов PAX3 и SOX10. Их взаимодействие и связывание с цис-регуляторным участком MITF запускает транскрипцию последнего. PAX3 (paired box protein 3) координирует развитие множества типов клеток нервного гребня, включая и меланоциты [42]. У человека мутации PAX3 вызывают синдром Ваарденбурга I и III типа, редкое аутосомно-доминантное заболевание, характеризующееся потерей слуха и нарушениями пигментации кожи, волос и радужной оболочки глаза [43]. У млекопитающих они являются причиной пятнистой окраски шерсти [44], а некоторые из них в гомозиготном состоянии приводят к летальному исходу [45]. У птиц мутации в гене PAX3 не изучены.
SOX10 (Sry related HMG box 10) – более узкоспециализированный транскрипционный фактор, регулирующий преимущественно спецификацию и дифференциацию меланоцитов [30]. Помимо MITF, SOX10 ко-активирует экспрессию генов тирозиназы TYR, родственного тирозиназе белка TYRP1, DOPА-хром-таутомеразы TYRP2/DCT [46]. У птиц обнаружена цис-регуляторная мутация гена SOX10, которая представляет собой делецию его предполагаемого энхансера. У домашних кур такая аутосомная рецессивная мутация DB (Dark Brown) приводит к уменьшению продукции эумеланина и увеличению продукции феомеланина в оперении определенных участков тела [47]. По-видимому, из-за отсутствия энхансера уровень экспрессии SOX10 снижается и, как следствие, падает экспрессия MITF и ключевых ферментов эумеланогенеза. Делеция энхансера SOX10 была также обнаружена у сизого голубя Columba livia. В фолликулах перьев мутантных птиц экспрессия SOX10 и его гена-мишени TYRP1, кодирующего белок, необходимый для эумеланогенеза, значительно снижена, а цвет оперения – рыжий, феомеланиновый [48]. Транскриптомный анализ показал, что в регенерирующих перьях мутантных голубей значительно снижена экспрессия генов меланогенеза: TYRP1, SLC24A5, PMEL17, NR4A3 и GSTA2. У всех этих генов недалеко от сайта инициации транскрипции были обнаружены сайты связывания SOX10, что доказывает прямую регуляцию их экспрессии с помощью SOX10 [49]. Остается открытым вопрос о переключателе синтеза пигмента, т.е. посреднике между SOX10 и синтезом эумеланина или феомеланина; ведь гены, чьи продукты известны как переключатели (TYR, MC1R, SLC7A11, ASIP, POMC), экспрессировались у диких и мутантных особей одинаково. Согласно одной из гипотез снижение экспрессии генов TYRP1 и PMEL17, которые способствуют стабильности тирозиназы (TYR) и ее транспортировке, отрицательно сказывается на активности TYR и тем самым запускает синтез феомеланина [49].
Меланогенез
Меланокортиновый рецептор первого типа MC1R – трансмембранный белок рецептор из семейства GPCR. При связывании MC1R с α-MSH и ACTH происходит активация меланокортинового сигнального пути, которая в итоге приводит к продукции эумеланина в меланоцитах (рис. 2). В среднем длина кодирующего участка гена MC1R составляет 1 тпн, а его продукт состоит примерно из 310 аминокислотных остатков [50]. Сначала считали, что ген состоит только из одного экзона [51], однако оказалось, что у человека он состоит из четырех экзонов и подвергается как внутри-, так и межгенному сплайсингу [52]. У птиц мультиэкзонная структура MC1R не выявлена, кодирующий экзон состоит из 945 пн [53]. Данный ген обладает высокой степенью полиморфизма, подробно изучены многочисленные как синонимичные, так и несинонимичные замены и их связь с изменчивостью окраски оперения у птиц [21]. Полагают, что большое число замен объясняется минимальным плейотропным действием гена [54], а мутации влияют главным образом на локализацию рецептора в мембране меланоцитов, его способность связывать лиганды и передавать сигнал через гетеротримерные G-белки [55]. Большинство обнаруженных мутаций, ассоциированных с окраской оперения, являются несинонимичными заменами и, как правило, усиливают или ослабляют общую пигментацию или пигментацию отдельных участков тела птиц [56–73]. Так, например, замена Glu92Lys переводит рецептор MC1R в состояние конститутивной активации, вызывая меланизм у бананового певуна и домашней курицы [54, 60, 74], в меньшей степени ее эффект выражен у перепелов [59, 62]. Есть мутации, которые у одних видов вызывают меланизм, но не влияют на пигментацию других видов, например Arg230His [53, 63]. Замену Val85Met ассоциируют с меланизмом у белого гуся Chen c. caerulescens и красноногой олуши Sula sula [53, 56] и с феомеланизмом у сизого голубя Columba livia [57]. Ввиду популярности данного гена-кандидата в генетических исследованиях описано довольно много признаков окраски оперения, не связанных с его изменчивостью [63, 75–78].
В немногочисленных работах выявлена связь между мутациями в гене MC1R и другими генами и признаками. Так, у темноокрашенной морфы чеглока Элеоноры Falco eleonorae обнаружена делеция 12 пн, которая приводит к потере четырех аминокислот рецептором и снижению иммунного ответа на фитоагглютинин, тогда как у светлой морфы делеция отсутствует, а иммунный ответ гораздо сильнее [64]. Возможно, такая ассоциация между аллельным вариантом MC1R и интенсивностью воспалительной реакции объясняется плейотропным действием гена MC1R, который экспрессируется не только в меланоцитах, но и во многих клетках иммунной системы [79]. Мутация Val126Ile в гене MC1R обыкновенной сипухи Tyto alba обусловливает 30% изменчивости окраски оперения живота Tyto alba, носители W-аллеля MC1R с валином в 126-й позиции обладают более светлой окраской, присутствие же изолейцина (R-аллель) коррелирует с рыжей окраской оперения [66]. Оказалось, что у гомозигот WW в 2.5 раза сильнее выражен половой диморфизм в отношении окраски оперения, что возможно объясняется эпистатическим эффектом аллеля W на гены, определяющие половой диморфизм. У носителей R-аллеля выявлены не только повышенная экспрессия генов меланогенеза, но и изменение уровня экспрессии плейотропных меланокортиновых генов, кодирующих гормоны, которые регулируют множество различных процессов в организме [67].
Сигнальный белок Агути ASIP – паракринный пептид, который продуцируется в фолликуле пера и служит эндогенным антагонистом α-MSH (рис. 2), конкурируя с ним за связывание с MC1R [80]. ASIP инактивирует меланокортиновый рецептор, что приводит к блокировке экспрессии MITF и ферментов эумеланогенеза и прекращению синтеза эумеланина. Будет ли вместо эумеланина синтезироваться феомеланин или меланоцит просто прекратит синтез пигментов – зависит уже от работы других генов.
Ген ASIP состоит из трех кодирующих и трех классов некодирующих экзонов, которые подвергаются альтернативному сплайсингу, и имеет три промотора. В среднем с гена ASIP у птиц считывается до семи изоформ мРНК, которые отличаются последовательностями некодирующих участков [80]. С дистального промотора или промотора 1-го класса ASIP считывается изоформа, которая экспрессируется главным образом в вентральной области тела птицы и обеспечивает защитную окраску [80, 81], т.е. темный верх (спина) и светлый низ (нижний отдел груди, живот). Эта же изоформа участвует в формировании межполовых отличий по окраске оперения у домашних кур. У куриц и цыплят она транскрибируется только в вентральной области, а у петухов еще и в фолликулах ярко-золотых и оранжевых перьев спины, причем в присутствии эстрогена этого не происходит, и у петушков развивается окраска перьев по типу самок [82].
Впервые роль ASIP в формировании окраски оперения птиц была подтверждена в результате анализа изменчивости кодирующей последовательности гена и окраски оперения японского перепела Coturnix japonica. Было показано, что причиной черно-коричневой окраски оперения у перепелов является рецессивная мутация rb (recessive black) в виде делеции 8 пн, которая сдвигает рамку считывания ASIP и приводит к удалению стоп-кодона и изменению аминокислотной последовательности концевого участка пептида. У сигнального белка нарушается третичная структура, что негативно влияет на его способность связываться с MC1R и, как следствие, делает невозможным переключение меланоцита с синтеза эумеланина на синтез феомеланина [83]. Генетической основой летальной в гомозиготном состоянии мутации Y (yellow) оказалась делеция размером 90 тпн, которая приводит к удалению двух расположенных рядом с ASIP локусов: RALY и EIF2B. В результате экспрессию ASIP контролирует промотор RALY, что вызывает значительное повышение экспрессии пептида во многих тканях птицы [81]. У гетерозигот (Y/+) наблюдается более светлая окраска оперения и нарушения обмена веществ. По-видимому, избыточная продукция ASIP приводит к связыванию пептида с другими меланокортиновыми рецепторами, в том числе с MC3R и MC4R в гипоталамусе, что вызывает, среди прочего, повышение аппетита и ожирение.
К настоящему времени изучен целый ряд функциональных мутаций как в кодирующих, так и в регуляторных участках гена ASIP. Например, замену Ile55Thr в первом кодирующем экзоне ASIP ассоциируют с меланизмом в одной из островных популяций черноспинного монарха Monarcha castaneiventris. Эта мутация каким-то образом нарушает способность регулятора связываться с MC1R и блокировать синтез эумеланина [84]. Мутация fawn-2/beige вызывает у японского перепела осветление окраски оперения со смещением в сторону желтизны. Это тандемная дупликация размером 71 тпн, которая включает одну полную копию гена AHCY на одной цепи ДНК и части генов ASIP и ITCH на другой цепи ДНК. Таким образом, у мутантов появляются еще два некодирующих (e4 и e5) и три кодирующих экзона ASIP, которые расположены сразу за некодирующим экзоном 1 гена ITCH. Авторы полагают, что дуплицированная последовательность стимулирует повышенную экспрессию ASIP, что и приводит к изменению окраски оперения птиц [85].
Гены тирозиназы (Tyrosinase, TYR) и родственных тирозиназе белков (Tyrosinase related proteins, TYRP1 и TYRP2) кодируют ферменты, необходимые для синтеза меланинов (рис. 1). Ген TYR состоит из пяти экзонов и четырех интронов, имеет открытую рамку считывания из 1590 пн и кодирует фермент, состоящий из 529 аминокислотных остатков [86]. Мутации в кодирующих и некодирующих участках гена TYR ассоциируют с полиморфизмом окраски оперения и кожи у домашнего гуся и курицы [36, 87, 88]. Снижение уровня экспрессии TYR коррелирует с белой или осветленной, менее пигментированной окраской оперения у обыкновенного перепела Coturnix coturnix и домашней утки [89, 90]. Полный альбинизм или отсутствие меланиновой пигментации в радужной оболочке глаз, коже и ее производных вызывают, как правило, мутации, блокирующие экспрессию гена TYR или приводящие к трансляции дефектного белка, неспособного выполнять свои функции. Такова, например, мутация recessive white у домашней курицы. Она обусловлена инсерцией последовательности ретровируса из семейства вирусов лейкоза птиц длиной 7.7 тпн в четвертом интроне гена. В результате пятый экзон гена не транскрибируется, образуется дефектная мРНК [87]. Также у кур-альбиносов обнаружена делеция шести нуклеотидов, которая приводит к удалению двух аминокислот из предполагаемого связывающего медь домена А тирозиназы [91]. Недавно у домашних гиперпигментированных кур (black-bone chicken) были выделены и клонированы пять изоформ мРНК тирозиназы. Все изоформы экспрессируются в перьевых фолликулах, коже и мышцах, причем в светлой коже и в фолликулах белых перьев значительно менее интенсивно, чем в пигментированных коже и перьях. Функции изоформ остаются невыясненными [92].
Родственный тирозиназе белок TYRP1 активирует и стабилизирует тирозиназу, поддерживает структуру меланосом, участвует в полимеризации DHICA с образованием эумеланина (рис. 1). Ген TYRP1 имеет примерно 40% сходства по нуклеотидной последовательности с геном TYR и кодирует белок из 535–536 аминокислотных остатков [93]. Мутации в гене TYRP1 вызывают изменение темно-серой или черной окраски оперения на коричневую или светло-коричневую [48, 94, 95]. Несинонимичная замена Phe282Ser в третьем экзоне гена обусловливает светло-коричневую окраску оперения у японского перепела [94]. Балобаны Falco cherrug – гомозиготные носители рецессивной точечной мутации C79T и инсерции 79insT80 в первом экзоне гена имеют светло-коричневую окраску оперения в отличие от темно-коричневой “дикой” окраски. Наличие обеих мутаций вызывает сдвиг рамки считывания, преждевременное появление стоп-кодона и трансляцию белка из 81 аминокислотного остатка вместо 536 [96]. У сизого голубя Columbia livia обнаружены три рецессивные мутации в гене TYRP1, которые также приводят к сдвигу рамки считывания и преждевременному появлению стоп-кодона и ассоциируются с коричневой окраской оперения. Мутация Ala23Pro в сайте расщепления сигнальной последовательности белка приводит к пепельно-рыжей окраске оперения Columbia livia. Она не влияет на каталитическую активность TYRP1, а нарушает его способность активировать и стабилизировать тирозиназу и поддерживать структуру меланосом. В меланосомах гомозигот по данной мутации снижено содержание эумеланина, а матрикс меланосом имеет неупорядоченную структуру [48]. У домашних кур- носителей рецессивной мутации His214Arg в третьем экзоне гена формируется шоколадная окраска оперения вместо ожидаемой черной. Оказывается, данная мутация изменяет конформацию цинк-содержащего активного центра фермента, что приводит к синтезу аномального эумеланина, его неправильной укладке в меланосомах, остановке созревания меланосом и увеличению их числа с целью компенсации [95].
DOPA-хром-таутомераза Dct, или TYRP2, катализирует превращение DOPA-хром в 5,6-дигидроксииндол-2-карбоновую кислоту (DHICA), полимеризация которой приводит к образованию коричневого DHICA-меланина (рис. 1). Показано, что TYRP2 интенсивно экспрессируется в пигментированной коже домашних кур [97]. У уток обнаружена ассоциация между окраской оперения и SNPs в экзонах гена [37].
Мембранные транспортные белки
Продукт гена SLC45A2, еще известный как мембран-ассоциированный транспортный белок MATP, участвует в посттрансляционной модификации и транспортировке тирозиназы в меланосомы [98]. Также он функционирует как Na+/H+ обменник и участвует в поддержании рН и ионного гомеостаза меланосом, влияя тем самым на активность тирозиназы [99]. Однако окончательно функция SLC45A2 до сих пор неизвестна. Мутации в гене SLC45A2 вызывают снижение вплоть до полной остановки синтеза одного или обоих типов меланинов у домашней курицы, японского перепела и сизого голубя [48, 100]. Нулевые рецессивные мутации в гене вызывают неполный альбинизм у кур и перепелов, который проявляется в виде белого оперения с тусклым желто-бежевым оттенком и отсутствия пигментации радужной оболочки глаз. У птиц-носителей замен Leu347Met и Tyr 277Cys в меланосомах не синтезируется феомеланин, хотя синтез эумеланина осуществляется нормально [100]. Такой же эффект имеет мутация Ala477Val в гене SLC45A2 белого тигра, однако почему это происходит до сих пор остается загадкой [101].
Ген SLC7A11 кодирует цистин-глутаматный транспортер, мембранный белок, который переносит цистеин в форме цистина из межклеточного пространства в цитозоль меланоцитов. Цистеин используется меланоцитом как источник сульфгидрильной группы, необходимой для синтеза феомеланина. У серой неясыти Strix aluco экспрессия SLC7A11 коррелирует с экспрессией ASIP и MITF, что закономерно, ведь связывание ASIP c MC1R блокирует синтез эумеланина, а MITF запускает транскрипцию SLC7A11 [7]. У зебровой амадины Taeniopygia guttata в условиях окислительного стресса экспрессия SLC7A11 падает и феомеланин синтезируется в значительно меньшем количестве, поскольку цистеин используется организмом в качестве строительного блока главного внутриклеточного антиоксиданта – глутатиона [102]. Снижение уровня экспрессии SLC7A11 у обыкновенного поползня Sitta europaea отмечается и в противоположной ситуации, в случае избытка цистеина, видимо для того, чтобы сократить поступление цистеина в меланоциты и избежать окислительного стресса, который может вызвать его аккумуляция [103]. Тем не менее концентрация феомеланина в перьях Sitta europaea, получающего избыток цистеина с пищей, растет. По-видимому, связь между интенсивностью феомеланиновой окраски оперения и уровнем экспрессии гена SLC7A11 у обыкновенного поползня отсутствует.
Известны и другие белки-переносчики растворимых соединений, например калий-зависимый натрий-кальциевый ионообменник SLC24A5, дисфункция которого вызывает глазокожный альбинизм OCA6 у человека. Снижение экспрессии гена SLC24A5 уменьшает пигментацию кур [104]. Продукт гена OCA2, полипептид Р, является мембранным транспортным белком меланосом и участвует в транспорте тирозина в меланосомы. Полагают, что полипептид Р также задействован в переносе ионов хлора, способствуя тем самым регуляции pH меланосом [105]. Снижение экспрессии гена OCA2 сопряжено с уменьшением пигментации оперения серого юнко Junco hyemalis и домашней курицы [8, 106, 107].
Образование и транспорт меланосом
Своей эллипсоидной формой эумеланосомы обязаны присутствию внутри просветного фибриллярного гликопротеина PMEL17 или SILV, SILVER, gp100, ME20. Он формирует каркас эумеланосом в виде фибриллярных слоев, который облегчает полимеризацию эумеланина и служит местом для его упаковки и хранения, обеспечивает компартментализацию токсичных промежуточных продуктов меланогенеза, способствуeт транспортировке эумеланина путем агрегации эумеланиновых полимеров [108]. У птиц ген PMEL17 состоит из 11 экзонов и имеет размер 4.1 тпн [109]. Три аллеля PMEL17 (Dominant White, Dun и Smoky), которые в разной степени подавляют эумеланогенез, обнаружены у домашней курицы [109]. Фенотипически аллели дают белую, серо-коричневую и темно-серую окраску оперения, соответственно. Аллель Dominant White представляет собой инсерцию 10 пн в десятом экзоне гена, которая приводит к появлению трех новых аминокислот в трансмембранном участке белка. Делеция 15 пн (аллель Dun) вызывает потерю пяти аминокислот также в трансмембранном домене гликопротеина. Делеция 12 пн в шестом экзоне может компенсировать инсерцию 10 пн в десятом экзоне аллеля Dominant White (аллель Smoky). Поэтому носители Smoky восстанавливают пигментацию и имеют темно-серую или серую окраску оперения. У японского перепела нонсенс-мутация в четвертом экзоне PMEL приводит к преждевременному появлению стоп-кодона и считыванию дефектного протеина, состоящего из 148 вместо 733 аминокислот [110]. В меланоцитах особей, гомозиготных по данной мутации, экспрессия PMEL падает и содержание эумеланина в перьях снижается, что фенотипически проявляется как бледно-желтая окраска оперения. Также показано, что ген PMEL обладает плейотропным действием. Мутации PMEL, влияющие на пигментацию кур, связаны и с отклонениями в социальном поведении [111].
Транспорт меланосом в дендриты для передачи кератиноцитам осуществляется с помощью миозина 5MyoVa, RAS ГТФ-азы RAB27a и меланофилина MLPH. Три белка соединяют меланосомы с актиновым цитоскелетом меланоцитов: MyoVa соединяется с филаментами актина, RAB27a – с меланосомой, а MLPH связывается с одной стороны с MyoVa, а с другой с RAB27a. Рецессивная аутосомная мутация lavender в гене MLPH, представляющая собой несинонимичную замену Arg35Trp в первом экзоне гена MLPH, вызывает значительное уменьшение интенсивности пигментации или “разбавление” окраски оперения у домашней курицы, японского перепела, мускусной утки, причем это касается как эумеланиновой, так и феомеланиновой окраски [112–114]. По-видимому, мутация изменяет трехмерную структуру меланофилина, что негативно влияет на его способность связываться с 5MyoVa и RAB27a, нарушая таким образом внутриклеточный транспорт меланосом [114]. “Разбавленную” окраску оперения японского перепела также определяет хромосомная перестройка, которая затрагивает четыре рядом расположенных гена MLPH, PRLH, RAB17 и LRRFIP1. В результате двух инверсий и одной делеции происходит удаление последовательностей генов PRLH, RAB17 и частично MLPH. Гомозиготы по данной мутации помимо значительно разбавленной окраски оперения имеют меньший вес, более высокую температуру тела и повышенный аппетит по сравнению с “дикими” особями [115].
РИСУНОК ОКРАСКИ ОПЕРЕНИЯ
Большинство из вышеописанных генетических механизмов определяет либо тип пигмента, либо выраженность пигментации, т.е. расцветку оперения. Однако в окраске оперения огромную роль играет рисунок, как пера, так и тела птицы. Рисунок оперения служит основой для формирования покровительственной окраски и является определяющим фактором для узнавания особей своего вида, выбора полового партнера, передачи разного рода сигналов.
Рисунок пера
Окраска растущего пера реализуется посредством передачи меланоцитами зрелых пигментсодержащих меланосом кератиноцитам, из которых формируются роговые структуры пера. Клетки-предшественницы меланоцитов формируют кольцо в основании перьевого фолликула и отправляют незрелые, недифференцированные меланоциты вверх вдоль периметра перьевого цилиндра [116]. По мере продвижения происходит дифференцировка меланоцитов, которая подразумевает синтез пигментов, их упаковку и хранение в меланосомах. Если по каким-либо причинам дифференцировка или миграция меланоцитов нарушаются, то в пере появляется белая полоса, или пятно, или все перо оказывается белым, лишенным пигмента [117]. Так, сцепленный с полом полосатый рисунок пера у домашней курицы обусловлен мутациями в гене CDKN2A, которые вызывают преждевременную дифференцировку меланоцитов [118]. Это две несинонимичные замены Val9Asp и Arg10Cys и две некодирующие замены в интроне 1 и промоторе. Различные комбинации мутаций дают три функциональных аллеля. У носителей мутантных аллелей наблюдаются в разной степени снижение пигментации оперения и полосатый рисунок пера. В фолликулах перьев мутантных птиц меланоциты уже на раннем этапе миграции находятся на значительно более поздней, чем обычно, стадии зрелости. Пул клеток-предшественниц меланоцитов в результате их преждевременного созревания быстро исчерпывается и транспортируемых ими от основания фолликула к растущим бородкам пера пигментов не хватает для непрерывной окраски пера. Поэтому до тех пор, пока стволовые клетки не сгенерируют новую волну клеток-предшественниц меланоцитов, в растущем пере формируется лишенный пигментации участок, затем цикл повторяется.
Крапчатая окраска, при которой кончик опахала пера окрашен в белый цвет, так же как и окраска оперения по типу “панды” у кур некоторых пород и японского перепела обусловлены мутациями в гене эндотелинового рецептора EDNRB2. Мутации Arg332His и Cys244Phe негативно влияют на способность рецептора связываться со своим лигандом EDN3, в результате чего нарушается миграция, пролиферация и дифференциация меланоцитов. В этом случае пигментные клетки в фолликуле пера вообще отсутствуют или присутствуют в количестве, недостаточном для его нормальной пигментации [11].
Важную роль в регуляции рисунка пера играет паракринный сигнальный пептид ASIP, или Agouti, ингибитор синтеза эумеланина, который секретируется в пульпе растущего пера. В месте контакта пульпы c высоким содержанием ASIP и формирующихся структур пера меланоциты могут прекратить продукцию эумеланина или переключиться на синтез феомеланина. Соответственно формируется белая или желто-коричневая окраска данного участка пера, причем любой заданной формы [80, 116].
Рисунок оперения
Закладка ювенильного рисунка оперения спинной стороны эмбрионов у японского перепела и ряда других видов отряда Курообразных осуществляется с помощью двух взаимодополняющих механизмов [119, 120]. В первом решающую роль играет градиент концентрации ASIP, предопределяющий местоположение желтых и черных полос [119]. Экспрессия ASIP начинается еще до формирования фолликулов пера, в дерме, по обеим сторонам нервной трубки, причем расположение ASIP-содержащих доменов совпадает с будущей локализацией желтых продольных полос. Второй механизм осуществляется с помощью щелевых контактов между меланоцитами [120]. Щелевые контакты состоят из молекул мембранного белка коннексина 40 (CX 40). В случае дефектного гена коннексина 40 у эмбрионов развивается однотонная черная окраска оперения, а если меланоциты активно экспрессируют нормальный коннексин, то формируется полосатая окраска спины. Показано также, что щелевые контакты могут регулировать ширину черных и желтых доменов.
ASIP также участвует в формировании покровительственной окраски оперения, когда вентральная сторона тела более светлая, а дорсальная сторона более темная. Высокий уровень транскрипции ASIP отмечен в фолликулах вентральной, бледной, почти лишенной пигментации стороне тела эмбрионов японского перепела [121]. На роль регуляторов экспрессии ASIP претендуют продукты генов β-дефенсина, Corin, аттрактина и т.д., однако для птиц такие исследования не проводились. Недавно, тем не менее, показано, что присутствие однонуклеотидного полиморфизма в интроне гена RALY, расположенного рядом с ASIP, у двух близкородственных гибридизующихся видов певчих птиц рода Setophaga четко ассоциировано с окраской оперения головы, щек и груди, различающейся у этих видов. Авторы предположили, что продукт гена RALY регулирует экспрессию ASIP, а блок RALY–ASIP обладает плейотропным действием и влияет на формирование механизмов репродуктивной изоляции [122].
ПОЛНОГЕНОМНЫЕ И ТРАНСКРИПТОМНЫЕ ИССЛЕДОВАНИЯ
Развитие и широкое применение методов полногеномного секвенирования значительно расширили возможности генетических исследований. С их помощью стало возможно идентифицировать новые, неизвестные ранее участки генома, вовлеченные тем или иным образом в формирование расцветки и рисунка оперения у птиц. Чаще всего такие исследования проводятся на близкородственных видах птиц, вступающих в гибридизацию и различающихся по окраске оперения [123–126]. Геномы видов сравнивают и ищут дивергентные участки ДНК. В большинстве таких работ, а их число неуклонно растет, показано, что дивергентные участки генома, связанные с пигментацией оперения, содержат регуляторные гены, продукты которых влияют или на сигнальные пути, или на экспрессию отдельных генов меланогенеза. Так, наиболее дифференцированными участками геномов золотокрылого Vermivora chrysoptera и синекрылого V. cyanoptera пеночковых певунов, видов с резко выраженными многочисленными отличиями по расцветке и рисунку оперения, оказались участки ДНК, расположенные выше таких связанных с пигментацией генов как ASIP, WNT, EDA, BCO2, FST. Эти некодирующие участки, скорее всего, выполняют функцию цис-регуляторов экспрессии соответствующих белок-кодирующих генов [126]. Полногеномный анализ ассоциаций (ПГАА) показал, что большинство статистически значимых SNPs, дифференцирующих серую и коричневую морфы максаренской белоглазки Zosterops borbonicus, локализуются в некотором полиморфном локусе размером 3 млн пн хромосомы 1. Причем в генах-кандидатах, расположенных в данном локусе (RS1, AP1S2, GPM6B, TRAPPC2, RAB9A, APXL, OA1), несинонимичные замены, связанные с окраской оперения, не обнаружены. По-видимому, они сосредоточены в области цис-регуляторных участков генов, запускающих или блокирующих синтез феомеланина у коричневой и серой морф, соответственно [127]. Самцы девяти южноамериканских симпатричных видов овсянок (род Sporophyla), прошедших через недавнюю радиацию, различаются по окраске оперения и по песням для защиты территории и привлечения самок. Большинство дивергентных участков их геномов содержат гены, так или иначе связанные с меланогенезом, в том числе ASIP, SLC45A2, TYR, TYRP1, KitL и т.д. Причем SNPs обнаружены не в кодирующих последовательностях, а в некодирующих участках предположительно цис-регуляторной природы, которые контролируют экспрессию генов, в том числе и меланогенных [128]. В Z-хромосоме Гульдовой амадины Erythrura gouldiae выше гена фоллистатина FST обнаружен участок размером 72 тпн, дифференцирующий две морфы амадины, различающиеся по окраске оперения головы, ряду поведенческих и физиологических признаков [129, 130]. Данный фрагмент не содержит кодирующей ДНК и, по мнению авторов, представляет собой цис-регулятор плейотропного гена фоллистатина FST. Фоллистатин антагонистически действует на гены семейства TGF-β (активин, BMP и др.), которые участвуют в регуляции дифференциации меланоцитов и меланогенеза, развития зрительной и репродуктивной систем. Регуляторную функцию выполняет и число копий последовательности в регионе CNV, которое коррелирует с уровнем экспрессии гена NDP в фолликуле растущего пера сизого голубя Columbia livia [131]. Чем выше уровень экспрессии гена, тем темнее окраска оперения крыла, характерная для темно-чеканной и чеканной морф. У дикой морфы со светлым крылом и двумя темными полосами на нем число копий CNV не превышает двух.
В целом, внутри- и межвидовая изменчивость окраски оперения у диких видов птиц чаще всего сопряжена с пигментацией отдельных участков тела, например горла, макушки, полос вокруг глаз, небольших участков в районе крыла, груди и т.д. Причем окраску таких участков по данным ПГАА контролируют определенные некодирующие последовательности генома [126, 128, 130–132]. Такой модульный тип окраски оперения в результате генетической рекомбинации способствует появлению новых, уникальных цветовых комбинаций и может служить основой для быстрого с точки зрения эволюции видообразования в случае радиации нескольких видов, как это произошло, например, у муний [132] и овсянок [128].
Значительную роль в возникновении внутривидовых морф, различающихся окраской оперения, могут играть структурные перестройки генома. Так, у турухтана Philomachus pugnax инверсия участка 11-й хромосомы размером 4.5 млн пн привела к появлению трех морф у самцов: “независимых” (independents), “спутников” (satellites) и “фэдеров” (faeders), которые составляют 80–95, 5–20 и менее 1% всех самцов соответственно [133]. В брачный сезон самцы разных морф разительно различаются окраской и формой оперения, а также поведением. Данная инверсия характерна для “спутников” и “фэдеров” только в гетерозиготном состоянии. В гомозиготном состоянии она летальна из-за нарушения последовательности гена CENPN, кодирующего центромерный белок N, необходимый для нормального деления клеток. Всего в районе инверсии находится около 125 генов, включая и ген меланокортинового рецептора MC1R. Она содержит целый ряд миссенс-мутаций, включая три делеции размером от 3.3 до 17.7 тпн. Авторы исследования полагают, что инверсия произошла у предков “независимых” морф 3.8 ± 0.15 млн лет назад и привела к появлению хромосомы “фэдеров”, а примерно 520 тыс. лет назад произошло очень редкое событие – рекомбинация между неинвертированной и инвертированной последовательностями, в результате чего появилась хромосома “спутников”.
У белогорлого воробья Zonotrichia albicolis причиной появления двух морф, также различающихся окраской оперения и поведением, стала инверсия участка 2-й хромосомы размером 100 млн пн (10% генома) [134]. Примерно половина самцов и самок вида, обладателей белой макушки, для которых характерна повышенная агрессивность и склонность к промискуитету, являются гетерозиготами по инверсии. У представителей второй морфы с коричневой макушкой, моногамных, самцы которой заботятся о потомстве наравне с самками, инверсия отсутствует. Соотношение белой и коричневой морф 1 : 1 в популяциях вида поддерживается благодаря дисассортативному скрещиванию, т.е. когда пары образуются главным образом между представителями разных морф. Оказалось, что в районе инверсии находится от 1000 до 1100 генов, многие из которых связаны с нейрофизиологией поведения, включая гены, кодирующие половые гормоны и их рецепторы. Также идентифицированы два гена Fig4 и LYST, продукты которых влияют на пигментацию. Высокая степень дивергенции инвертированной и неинвертированной последовательностей и филогенетические реконструкции указывают на появление инверсии в генном пуле вида задолго до его становления в результате гибридизации с ныне вымершим видом.
Большой вклад в изучение формирования окраски оперения внес и ставший недавно относительно доступным высокопроизводительный транскриптомный анализ. В большинстве исследований такого рода сравниваются транскриптомы перьев разной окраски/рисунка из разных участков тела птицы или проводится сравнительный анализ экспрессии генов в перьях одних и тех же участков тела близкородственных видов. Сравнение профилей экспрессии генов-кандидатов и секвенирование транскриптомов показывают, что в фолликулах перьев с более светлой окраской снижена экспрессия генов меланогенеза, также среди дифференциально экспрессирующихся генов значительную долю составляют регуляторные гены [8, 90, 106, 107, 135]. Чаще всего в фолликулах светлых перьев отмечают снижение уровня экспрессии генов TYR, TYRP1, PMEL, SLC45A2, SLC24A5, MLANA, OCA2 и т.д. и повышение уровня экспрессии ASIP [8, 106, 135]. Спектр дифференциально эспрессирующихся генов транскрипционных факторов и участников сигнальных путей довольно широкий. Так, у мучуаньской породы кур это гены семейства гомеобокс HOXB9, HOXC8, HOXA9, HOXC9 и сигнального пути TGF-β: BMP5 и PITX2 [109]. У кур линии “Yufen I” в фолликулах полосатых и белых перьев отмечен разный уровень экспрессии MC1R, генов-участников сигнальных путей WNT и SCF-KIT, а также MED23, энхансера MITF [136].
Весьма интересные результаты получены при изучении экспрессии генов в фолликулах растущих перьев у двух подвидов серого юнко Junco hyemalis, которые различаются окраской оперения головы, спины и боков [106]. Сравнение профилей экспрессии генов в фолликулах перьев из головы и спины птиц показало, что в регуляцию окраски оперения вовлечены WNT и HOX гены, которые с той же вероятностью могут регулировать и морфогенез пера, учитывая, что не только цвет, но строение и форма пера из этих участков различаются. Сравнение профилей экспрессии генов между подвидами выявило дифференциальную экспрессию генов ASIP, HAND2, MFSD12, KCNJ13. Ген HAND2 кодирует транскрипционный фактор, активатор экспрессии гена SHH (sonic hedgehog), ключевого регулятора органогенеза и сегментации у эукариот. Продукт гена KCNJ13 – калиевый канал, который модулирует взаимодействие между пигментными клетками, ген MFSD12 кодирует ингибитор эумеланогенеза. Также показано, что окраска пера серого юнко зависит еще и от распределения меланосом в разных частях пера: стержне, бородках и бородочках, которое может менять окраску пера от светло-коричневой до черной при одинаковом содержании меланина. Поэтому различия в окраске оперения достигаются не только путем регуляции сигнальных путей или отдельных генов меланогенеза, но и с помощью модуляции распределения пигментов в пере. На роль регулятора дифференциального депонирования меланосом в разных частях растущего пера по мнению авторов может претендовать ген HAND2 [106].
ЗАКЛЮЧЕНИЕ
На начальном этапе молекулярно-генетические исследования меланиновой окраски оперения птиц проводились путем анализа изменчивости генов-кандидатов, идентифицированных на модельных видах млекопитающих. Сопоставление обнаруженных генетических полиморфизмов в генах-кандидатах с мутантными фенотипами позволило уточнить роль конкретных генов в формировании окраски оперения и выявить функциональные мутации. Таким образом была выяснена роль таких генов как ASIP, MC1R, EDNRB, MITF и т.д. [10, 34, 53, 60, 81, 83]. Однако функциональные исследования генетических основ окраски оперения проводились главным образом на домашних модельных видах птиц, таких как курица [11, 58, 82], утка [12, 40] и перепел [10, 59]. К тому же все большее число работ демонстрировало, что генетический полиморфизм генов-кандидатов не может объяснить фенотипическую изменчивость многих признаков окраски оперения [75–78, 137, 138]. Было показано, что несинонимичные замены, делеции, инсерции в кодирующих и некодирующих участках генов-кандидатов приводят к изменению окраски всего тела птицы, например к меланизму [53, 56, 58–62, 68, 84], альбинизму [35, 40, 87, 91], общему осветлению за счет снижения или нарушения синтеза феомеланина и/или эумеланина [47, 48, 81, 85, 94–96, 100, 109, 110, 112–114], крапчатой окраске оперения [10, 11, 118] и за редкими исключениями [131] никак не связаны с пигментацией отдельных участков тела птицы, т.е. c рисунком оперения.
Развитие методов полногеномного и транскриптомного секвенирования дало возможность заглянуть в неисследованные ранее области генома, идентифицировать новые локусы, ассоциированные с меланиновой окраской оперения, установить роль известных ранее генов и различных комбинаций их аллелей, а также изучить пространственно-временную организацию экспрессии генов под контролем транскрипционных факторов и эпигенетических изменений не только у модельных видов, но и в природных популяциях немодельных видов птиц. В частности, полногеномные и транскриптомные исследования показали, что в формировании окраски оперения важнейшую роль играют регуляторные гены. Так, рисунок оперения определяют не структурные гены, мутации в которых лишь нарушают общую схему реализации программы окраски, а регуляторные, осуществляющие пространственно-временную модуляцию сигнальных путей меланогенеза или экспрессии определенных генов [8, 106, 107, 121, 126–130, 132]. Однако результаты полногеномных и транскриптомных исследований сами по себе не полны и должны подкрепляться изучением функциональной роли выявленных участков геномов, ассоциированных с окраской оперения. С этой целью проводят сравнение с референсными или эталонными геномами близкородственных модельных видов. К сожалению, на настоящий момент референсные геномы доступны лишь для небольшого числа видов птиц. Также в выяснении функциональной роли участков генома может помочь применение таких подходов как CRISP/Cas9 и трансфекция культур клеток [139].
Учитывая полигенную природу наследования большинства признаков меланиновой окраски оперения, ясно, что на них могут влиять сразу несколько десятков локусов или даже несколько полигенных систем, включая системы генов-модификаторов и генов-регуляторов. Количественная изменчивость признаков окраски оперения ставит перед исследователями сложнейшую задачу выявления всех полигенов. Однако многие из них оказывают настолько минорный эффект, что ими, казалось бы, можно пренебречь. Но вкупе множество локусов со слабым фенотипическим эффектом контролирует порой значительную часть наследуемой изменчивости признаков окраски оперения [140]. Иногда идентифицированные с помощью картирования генома локусы большого эффекта объясняют лишь меньшую часть наследуемой изменчивости [141] или вообще отсутствуют [142]. Картирование локусов малого эффекта представляет собой пока крайне сложную задачу для исследователей из-за слабой фенотипической выраженности и низкой частоты каузативных вариантов (менее 5%) [139]. Поэтому невозможность обнаружить локусы, слабо влияющие на признак, не говоря уже об их аллельном разнообразии, степени эффекта и взаимодействии, является на данный момент одним из ограничений для полного понимания генетической архитектуры количественных признаков окраски оперения у птиц.
Важную роль в формировании окраски оперения играют и средовые факторы, которые также определяют скорее непрерывные, чем дискретные, различия между особями, а также гормональная регуляция, состояние здоровья птиц [143]. Нельзя также забывать о действии отбора на другие генетически коррелированные признаки. Сложность представляет и тот факт, что сходные фенотипы могут контролироваться различными генами, тогда как аллельные варианты одного и того же гена могут приводить к полиморфизму окраски оперения. Однако, несмотря на множество трудностей, стоящих перед исследователями, изучение молекулярно-генетических основ меланиновой окраски оперения привело к идентификации множества генов и пониманию процессов их взаимодействий друг с другом. Дальнейшие исследования в этом направлении позволят лучше понять процессы формирования многочисленных признаков расцветки и рисунка оперения птиц, лежащих в основе индивидуальных, межпопуляционных и межвидовых различий.
Автор искренне благодарен Ю.Н. Журавлеву, С.В. Шедько и М.В. Павленко, прочитавшим статью в рукописи, за их ценные критические замечания и советы.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Список литературы
Hill G.E., McGraw K.J. (Eds.) Bird Coloration. Mechanisms and Measurements. Boston, MA: Havard Univ. Press, 2006. V. I. 640 p.
Galván I., García-Campa J., Negro J.J. Complex plumage patterns can be produced only with the contribution of melanins // Physiol. Biochem. Zool. 2017. V. 90. № 5. P. 600–604. https://doi.org/10.1086/693962
Krishnaswamy A., Baranoski G.V.G. A biophysically-based spectral model of light interaction with human skin // Eurographics. 2004. V. 23. № 3. P. 331–340. https://doi.org/10.1111/j.1467-8659.2004.00764.x
Videira I.F., Moura D.F., Magina S. Mechanisms regulating melanogenesis // An. Bras. Dermatol. 2013. V. 88. № 1. P. 76–83. https://doi.org/10.1590/s0365-05962013000100009
Pillaiyar T., Manickam M., Jung S.H. Recent development of signaling pathways inhibitors of melanogenesis // Cell. Signal. 2017. V. 40. P. 99–115. https://doi.org/10.1016/j.cellsig.2017.09.004
Serre C., Busuttil V., Botto J.M. Intrinsic and extrinsic regulation of human skin melanogenesis and pigmentation // Int. J. Cosmet. Sci. 2018. V. 40. № 4. P. 328–347. https://doi.org/10.1111/ics.12466
Emaresi G., Ducrest A.-L., Bize P. et al. Pleiotropy in the melanocortin system: Expression levels of this system are associated with melanogenesis and pigmentation in the tawny owl (Strix aluco) // Mol. Ecol. 2013. V. 22. № 19. P. 4915–4930. https://doi.org/10.1111/mec.12438
Liu X., Zhou R., Peng Y. et al. Feather follicles transcriptome profiles in Bashang long-tailed chickens with different plumage colors // Genes & Genomics. 2019. V. 41. № 11. P. 1357–1367. https://doi.org/10.1007/s13258-018-0740-y
Natafa V., Amemiyab A., Yanagisawab M., Le Douarina N.M. The expression pattern of endothelin 3 in the avian embryo // Mech. Dev. 1998. V. 73. № 2. P. 217–220.
Miwa M., Inoue-Murayama M., Aoki H. et al. Endothelin receptor B2 (EDNRB2) is associated with the panda plumage colour mutation in Japanese quail // Anim. Genet. 2007. V. 38. № 2. P. 103–108. https://doi.org/10.1111/j.1365-2052.2007.01568.x
Kinoshita K., Akiyama T., Mizutani M. et al. Endothelin receptor B2 (EDNRB2) is responsible for the tyrosinase-independent recessive white (mo(w)) and mottled (mo) plumage phenotypes in the chicken // PLoS One. 2014. V. 9. № 1: e86361. https://doi.org/10.1371/journal.pone.0086361
Li L., Li D., Liu L. et al. Endothelin receptor B2 (EDNRB2) gene is associated with spot plumage pattern in domestic ducks (Anas platyrhynchos) // PLoS One. 2015. V. 10. № 5: e0125883. https://doi.org/10.1371/journal.pone.0125883
Jin E.J., Erickson C.A., Takada S., Burrus L.W. Wnt and BMP signaling govern lineage segregation of melanocytes in the avian embryo // Dev. Biol. 2001. V. 233. № 1. P. 22–37. https://doi.org/10.1006/dbio.2001.0222
Dunn K.J., Brady M., Jambor C.O. et al. WNT1 and WNT3a promote expansion of melanocytes through distinct modes of action // Pigment Cell Res. 2005. V. 18. № 3. P. 167–180. https://doi.org/10.1111/j.1600-0749.2005.00226.x
Chang C.H., Tsai R.K., Tsai M.H. et al. The roles of Frizzled-3 and Wnt3a on melanocyte development: In vitro studies on neural crest cells and melanocyte precursor cell lines // J. Dermatol. Sci. 2014. V. 75. № 2. P. 100–108. https://doi.org/10.1016/j.jdermsci.2014.04.012
Takeda K., Yasumoto K., Takada R. et al. Induction of melanocyte-specific microphthalmia-associated transcription factor by Wnt-3a // J. Biol. Chem. 2000. V. 275. № 19. P. 14013–14016. https://doi.org/10.1074/jbc.C000113200
Ashman L.K. The biology of stem cell factor and its receptor C-kit // Int. J. Biochem. Cell Biol. 1999. V. 31. № 10. P. 1037–1051. https://doi.org/10.1016/s1357-2725(99)00076-x
Hou L., Panthier J.J., Arnheiter H. Signaling and transcriptional regulation in the neural crest-derived melanocyte lineage: interactions between KIT and MITF // Development. 2000. V. 127. № 4. P. 5379–5389.
Imokawa G., Kobayashi T., Miyagishi M. Intracellular signaling mechanisms leading to synergistic effects of endothelin-1 and stem cell factor on proliferation of cultured human melanocytes: Cross-talk via trans-activation of the tyrosine kinase c-kit receptor // J. Biol. Chem. 2000. V. 275. № 43. P. 33321–33328. https://doi.org/10.1074/jbc.M004346200
Nordlund J.J., Boissy R.E., Hearing V.J. (Eds.). The Pigmentary System: Physiology and Pathophysiology. 2nd ed. Oxford: Blackwell Publ. Ltd., 2006. 1228 p.
Roulin A., Ducrest A.L. Genetics of colouration in birds // Semin. Cell Dev. Biol. 2013. V. 24. № 6–7. P. 594–608. https://doi.org/10.1016/j.semcdb.2013.05.005
McCallion A.S., Chakravarti A. EDNRB/EDN3 and Hirschsprung disease type II // Pigment Cell Res. 2001. V. 14. № 3. P. 161–169. https://doi.org/10.1034/j.1600-0749.2001.140305.x
Matsushima Y., Shinkai Y., Kobayashi Y. et al. A mouse model of Waardenburg syndrome type 4 with a new spontaneous mutation of the endothelin-B receptor gene // Mamm. Genome. 2002. V. 13. № 1. P. 30–35. https://doi.org/10.1007/s00335-001-3038-2
Xi Y., Wang L., Liu H. et al. A 14-bp insertion in endothelin receptor B-like (EDNRB2) is associated with white plumage in Chinese geese // BMC Genomics. 2020. V. 21. № 1. 162. https://doi.org/10.1186/s12864-020-6562-8
Hertwig P. Neue Mutationen und Kopplungsgruppen bei der Hausmaus // Z. Indukt. Abstamm. Vererbungsl. 1942. V. 80. P. 220–246.
Hodgkinson C.A., Moore K.J., Nakayama A. et al. Mutations at the mouse microphthalmia locus are associated with defects in a gene encoding a novel basic-helix-loop-helix-zipper protein // Cell. 1993. V. 74. № 2. P. 395–404. https://doi.org/10.1016/0092-8674(93)90429-t
Goding C.R., Arnheiter H. MITF-the first 25 years // Genes Dev. 2019. V. 33. № 15–16. P. 983–1007. https://doi.org/10.1101/gad.324657.119
Shibahara S., Takeda K., Yasumoto K. et al. Microphthalmia-associated transcription factor (MITF): multiplicity in structure, function, and regulation // J. Invest. Dermatol. Symp. Proc. 2001. V. 6. № 1. P. 99–104. https://doi.org/10.1046/j.0022-202x.2001.00010.x
Cheli Y., Ohanna M., Ballotti R., Bertolotto C. Fifteen-year quest for microphthalmia-associated transcription factor target genes // Pigment Cell Melanoma Res. 2010. V. 23. № 1. P. 27–40. https://doi.org/10.1111/j.1755-148X.2009.00653.x
Thomas A.J., Erickson C.A. The making of a melanocyte: The specification of melanoblasts from the neural crest // Pigment Cell Melanoma Res. 2008. V. 21. № 6. P. 598–610. https://doi.org/10.1111/j.1755-148X.2008.00506.x
Li Y., Zhu X., Yang L. et al. Expression and network analysis of genes related to melanocyte development in the Silky Fowl and White Leghorn embryos // Mol. Biol. Rep. 2011. V. 38. № 2. P 1433–1441. https://doi.org/10.1007/s11033-010-0248-2
Wu C.C., Klaesson A., Buskas J. et al. In situ quantification of individual mRNA transcripts in melanocytes discloses gene regulation of relevance to speciation // J. Exp. Biol. 2019. V. 222. № 5: jeb194431. https://doi.org/10.1242/jeb.194431
Mochii M., Mazaki Y., Mizuno N. et al. Role of Mitf in differentiation and transdifferentiation of chicken pigmented epithelial cell // Dev. Biol. 1998. V. 193. № 1. P. 47–62. https://doi.org/10.1006/dbio.1997.8800
Kawaguchi N., Ono T., Mochii M., Noda M. Spontaneous mutation in Mitf gene causes osteopetrosis in silver homozygote quail // Dev. Dyn. 2001. V. 220. № 2. P. 133–140. https://doi.org/10.1002/1097-0177(2000)9999:9999<::AID-DVDY1095>3.0.CO;2-7
Minvielle F., Bed’hom B., Coville J.L. et al. The “silver” Japanese quail and the MITF gene: Causal mutation, associated traits and homology with the “blue” chicken plumage // BMC Genet. 2010. V. 11:15. https://doi.org/10.1186/1471-2156-11-15
Wang Y., Li S.-M., Huang J. et al. Mutations of TYR and MITF genes are associated with plumage colour phenotypes in geese // Asian-Australas. J. Anim. Sci. 2014. V. 27. № 6. P. 778–783. https://doi.org/10.5713/ajas.2013.13350
Sultana H., Seo D., Choi N.R. et al. Identification of polymorphisms in MITF and DCT genes and their associations with plumage colors in Asian duck breeds // Asian-Australas. J. Anim. Sci. 2018. V. 31. № 2. P. 180–188. https://doi.org/10.5713/ajas.17.0298
Yang L., Mo C., Shen W. et al. The recessive C locus in the MITF gene plays a key regulatory role in the plumage colour pattern of duck (Anas platyrhynchos) // Br. Poult. Sci. 2019. V. 60. № 2. P. 105–108. https://doi.org/10.1080/00071668.2018.1564237
Lin R., Lin W., Zhou S. et al. Integrated analysis of mRNA expression, CpG island methylation, and polymorphisms in the MITF gene in ducks (Anas platyrhynchos) // Biomed. Res. Int. 2019:8512467. https://doi.org/10.1155/2019/8512467
Zhou Z., Li M., Cheng H. et al. An intercross population study reveals genes associated with body size and plumage color in ducks // Nat. Commun. 2018. V. 9. № 1: 2648. https://doi.org/10.1038/s41467-018-04868-4
Jones P.A. Functions of DNA methylation: islands, start sites, gene bodies and beyond // Nat. Rev. Genet. 2012. V. 13. № 7. P. 484–492. https://doi.org/10.1038/nrg3230
Kubic J.D., Young K.P., Plummer R.S. et al. Pigmentation PAX-ways: The role of Pax3 in melanogenesis, melanocyte stem cell maintenance, and disease // Pigment Cell Melanoma Res. 2008. V. 21. № 6. P. 627–645. https://doi.org/10.1111/j.1755-148X.2008.00514.x
Otręba M., Miliński M., Buszman E. et al. Hereditary hypomelanocytoses: the role of PAX3, SOX10, MITF, SNAI2, KIT, EDN3 and EDNRB genes // Postepy Hig. Med. Dosw. 2013. V. 67. P. 1109–1118. https://doi.org/10.5604/17322693.1077722
Chalepakis G., Goulding M., Read A. et al. Molecular basis of splotch and Waardenburg Pax-3 mutations // PNAS. 1994. V. 91. № 9. P. 3685–3689. https://doi.org/10.1073/pnas.91.9.3685
Ohno T., Maegawa T., Katoh H. et al. A new missense mutation in the paired domain of the mouse Pax3 gene // Exp. Anim. 2017. V. 66. № 3. P. 245–250. https://doi.org/10.1538/expanim.17-0013
Wegner M. Secrets to a healthy Sox life: lessons for melanocytes // Pigment Cell Res. 2005. V. 18. № 2. P. 74–85. https://doi.org/10.1111/j.1600-0749.2005.00218.x
Gunnarsson U., Kerje S., Bed’hom B. et al. The Dark brown plumage color in chickens is caused by an 8.3-kb deletion upstream of SOX10 // Pigment Cell Melanoma Res. 2011. V. 24. № 2. P. 268–274. https://doi.org/10.1111/j.1755-148X.2011.00825.x
Domyan E.T., Guernsey M.W., Kronenberg Z. et al. Epistatic and combinatorial effects of pigmentary gene mutations in the domestic pigeon // Curr. Biol. 2014. V. 24. № 4. P. 459–464. https://doi.org/10.1016/j.cub.2014.01.020
Domyan E.T., Hardy J., Wright T. et al. SOX10 regulates multiple genes to direct eumelanin versus pheomelanin production in domestic rock pigeon // Pigment Cell Melanoma Res. 2019. V. 32. № 5. P. 634–642. https://doi.org/10.1111/pcmr.12778
Cone R.D., Lu D., Koppula S. et al. The melanocortin receptors: agonists, antagonists, and the hormonal control of pigmentation // Recent Prog. Horm. Res. 1996. V. 51. P. 287–317.
Smith A.G., Box N.F., Marks L.H. et al. The human melanocortin-1 receptor locus: Analysis of transcription unit, locus polymorphism and haplotype evolution // Gene. 2001. V. 281. № 1–2. P. 81–94. https://doi.org/10.1016/s0378-1119(01)00791-0
Katritch V., Cherezov V., Stevens R.C. Structure-function of the G protein-coupled receptor superfamily // Annu. Rev. Pharmacol. Toxicol. 2013. V. 53. P. 531–556. https://doi.org/10.1146/annurev-pharmtox-032112-135923
Mundy N.I., Badcock N.S., Hart T. et al. Conserved genetic basis of a quantitative plumage trait involved in mate choice // Science. 2004. V. 303. № 5665. P. 1870–1873. https://doi.org/10.1126/science.1093834
Mundy N.I. A window on the genetics of evolution: MC1R and plumage colouration in birds // Proc. Biol. Sci. 2005. V. 272. № 1573. P. 1633–1640. https://doi.org/10.1098/rspb.2005.3107
Dessinioti C., Antoniou C., Katsambas A., Stratigos A.J. Melanocortin 1 receptor variants: functional role and pigmentary associations // Photochem. Photobiol. 2011. V. 87. № 5. P. 978–987. https://doi.org/10.1111/j.1751-1097.2011.00970.x
Baião P.C., Schreiber E., Parker P.G. The genetic basis of the plumage polymorphism in red-footed boobies (Sula sula): A melanocortin-1 receptor (MC1R) analysis // J. Hered. 2007. V. 98. № 4. P. 287–292. https://doi.org/10.1093/jhered/esm030
Guernsey M.W., Ritscher L., Miller M.A. et al. A Val85Met mutation in melanocortin-1 receptor is associated with reductions in eumelanic pigmentation and cell surface expression in domestic rock pigeons (Columba livia) // PLoS One. 2013. V. 8. № 8: e74475. https://doi.org/10.1371/journal.pone.0074475
Kerje S., Lind J., Schütz K. Melanocortin 1-receptor (MC1R) mutations are associated with plumage colour in chicken // Anim. Genet. 2003. V. 34. № 4. P. 241–248. https://doi.org/10.1046/j.1365-2052.2003.00991.x
Nadeau N.J., Minvielle F., Mundy N.I. Association of a Glu92Lys substitution in MC1R with extended brown in Japanese quail (Coturnix japonica) // Anim. Genet. 2006. V. 37. № 3. P. 287–289. https://doi.org/10.1111/j.1365-2052.2006.01442.x
Theron E., Hawkins K., Bermingham E. et al. The molecular basis of an avian plumage polymorphism in the wild: A melanocortin-1-receptor point mutation is perfectly associated with the melanic plumage morph of the bananaquit, Coereba flaveola // Curr. Biol. 2001. V. 11. № 8. P. 550–557. https://doi.org/10.1016/s0960-9822(01)00158-0
Cibois A., Thibault J.-C., Pasquet E. The molecular basis of the plumage colour polymorphism in the Tahiti reed-warbler Acrocephalus caffer // J. Avian Biol. 2012. V. 43. № 1. P. 3–8. https://doi.org/10.1111/j.1600-048X.2011.05546.x
Kageyama M., Takenouchi A., Kinoshita K. et al. The “Extended Brown” plumage color mutant of blue-breasted quail (Coturnix chinensis) is associated with a mutation in the melanocortin 1-receptor gene (MC1R) // J. Poult. Sci. 2018. V. 55. № 4. P. 233–238. https://doi.org/10.2141/jpsa.0180006
Pointer M.A., Mundy N.I. Testing whether macroevolution follows microevolution: Are colour differences among swans (Cygnus) attributable to variation at the MC1R locus? // BMC Evol. Biol. 2008. V. 8:249. https://doi.org/10.1186/1471-2148-8-249
Gangoso L., Grande J.M., Ducrest A.L. et al. MC1R-dependent, melanin-based colour polymorphism is associated with cell-mediated response in the Eleonora’s falcon // J. Evol. Biol. 2011. V. 24. № 9. P. 2055–2063. https://doi.org/10.1111/j.1420-9101.2011.02336.x
Uy J.A., Moyle R.G., Filardi C.E., Cheviron Z.A. Difference in plumage color used in species recognition between incipient species is linked to a single amino acid substitution in the melanocortin-1 receptor // Am. Nat. 2009. V. 174. № 2. P. 244–254. https://doi.org/10.1086/600084
San-Jose L.M., Ducrest A.L., Ducret V. et al. Effect of the MC1R gene on sexual dimorphism in melanin-based colorations // Mol. Ecol. 2015. V. 24. № 11. P. 2794–2808. https://doi.org/10.1111/mec.13193
San-Jose L.M., Ducrest A.L., Ducret V. et al. MC1R variants affect the expression of melanocortin and melanogenic genes and the association between melanocortin genes and coloration // Mol. Ecol. 2017. V. 26. № 1. P. 259–276. https://doi.org/10.1111/mec.13861
Yu W., Wang C., Xin Q. et al. Non-synonymous SNPs in MC1R gene are associated with the extended black variant in domestic ducks (Anas platyrhynchos) // Anim. Genet. 2013. V. 44. № 2. P. 214–216. https://doi.org/10.1111/j.1365-2052.2012.02377.x
Sultana H., Seo D.W., Park H.B. et al. Identification of MC1R SNPs and their association with plumage colors in Asian duck // J. Poult. Sci. 2017. V. 54. № 2. P. 111–120. https://doi.org/10.5713/ajas.2012.12581
Johnson J.A., Ambers A.D., Burnham K.K. Genetics of plumage color in the Gyrfalcon (Falco rusticolus): Analysis of the melanocortin-1 receptor gene // J. Hered. 2012. V. 103. № 3. P. 315–321. https://doi.org/10.1093/jhered/ess023
Bam S., Hart L., Willows-Munro S. Mc1r genotype and plumage colouration in highly polymorphic jackal buzzards, Buteo rufofuscus // Afr. Zool. 2019. V. 54. № 4. P. 239–242. https://doi.org/10.1080/15627020.2019.1658539
Bourgeois Y.X., Bertrand J.A., Thébaud C., Milá B. Investigating the role of the melanocortin-1 receptor gene in an extreme case of microgeographical variation in the pattern of melanin-based plumage pigmentation // PLoS One. 2012. V. 7. № 12: e50906. https://doi.org/10.1371/journal.pone.0050906
Vieira S.N., Araripe J., Aleixo A., do Rêgo P.S. Plumage polymorphism and variation in the melanocortin-1 receptor gene in the Fuscous Flycatcher, Cnemotriccus fuscatus (Wied, 1831) // Rev. Bras. Ornitol. 2018. V. 26. P. 251–257. https://doi.org/10.1007/BF03544439
Ling M.K., Lagerström M.C., Fredriksson R. et al. Association of feather colour with constitutively active melanocortin 1 receptors in chicken // Eur. J. Biochem. 2003. V. 270. № 7. P. 1441–1449. https://doi.org/10.1046/j.1432-1033.2003.03506.x
Dobson A.E., Schmidt D.J., Hughes J.M. Sequence variation in the melanocortin-1 receptor (MC1R) does not explain continent-wide plumage color differences in the Australian Magpie (Cracticus tibicen) // J. Hered. 2012. V. 103. № 6. P. 769–780. https://doi.org/10.1093/jhered/ess053
Luna L.W., Silva W., Araripe J. et al. Mutations in the melanocortin-1 receptor (MC1R) gene have no influence on the distinct patterns of melanic plumage found in the manakins of the genus Antilophia (Aves: Pipridae) // An. Acad. Bras. Cienc. 2018. V. 90. № 3. P. 2873–2879. https://doi.org/10.1590/0001-3765201820171003
Derelle R., Kondrashov F.A., Arkhipov V.Y. et al. Color differences among feral pigeons (Columba livia) are not attributable to sequence variation in the coding region of the melanocortin-1 receptor gene (MC1R) // BMC Res. Notes. 2013. V. 6. № 1: 310. https://doi.org/10.1186/1756-0500-6-310
Cheviron Z.A., Hackett S.J., Brumfield R.T. Sequence variation in the coding region of the melanocortin-1 receptor gene (MC1R) is not associated with plumage variation in the blue-crowned manakin (Lepidothrix coronata) // Proc. Biol. Sci. 2006. V. 273. № 1594. P. 1613–1618. https://doi.org/10.1098/rspb.2006.3499
Neumann Andersen G., Nagaeva O., Mandrika I. et al. MC1 receptors are constitutively expressed on leucocyte subpopulations with antigen presenting and cytotoxic functions // Clin. Exp. Immunol. 2001. V. 126. № 3. P. 441–446. https://doi.org/10.1046/j.1365-2249.2001.01604.x
Yoshihara C., Fukao A., Ando K. et al. Elaborate color patterns of individual chicken feathers may be formed by the agouti signaling protein // Gen. Comp. Endocrinol. 2012. V. 175. № 3. P. 495–499. https://doi.org/10.1016/j.ygcen.2011.12.009
Nadeau N.J., Minvielle F., Ito S. et al. Characterization of Japanese quail yellow as a genomic deletion upstream of the avian homolog of the mammalian ASIP (agouti) gene // Genetics. 2008. V. 178. № 2. P. 777–786. https://doi.org/10.1534/genetics.107.077073
Oribe E., Fukao A., Yoshihara C. et al. Conserved distal promoter of the agouti signaling protein (ASIP) gene controls sexual dichromatism in chickens // Gen. Comp. Endocrinol. 2012. V. 177. № 2. P. 231–237. https://doi.org/10.1016/j.ygcen.2012.04.016
Hiragaki T., Inoue-Murayama M., Miwa M. et al. Recessive black is allelic to the yellow plumage locus in Japanese quail and associated with a frameshift deletion in the ASIP gene // Genetics. 2008. V. 178. № 2. P. 771–775. https://doi.org/10.1534/genetics.107.077040
Uy J.A., Cooper E.A., Cutie S. et al. Mutations in different pigmentation genes are associated with parallel melanism in island flycatchers // Proc. Biol. Sci. 2016. V. 283. № 1834: 20160731. https://doi.org/10.1098/rspb.2016.0731
Robic A., Morisson M., Leroux S. et al. Two new structural mutations in the 5' region of the ASIP gene cause diluted feather color phenotypes in Japanese quail // Genet. Sel. Evol. 2019. V. 51. № 1: 12. https://doi.org/10.1186/s12711-019-0458-6
Yang J., Liu X., Zhang J. et al. Molecular cloning and biochemical analysis of tyrosinase from the Crested Ibis in China // Biochem. Genet. 2012. V. 50. № 11–12. P. 936–945. https://doi.org/10.1007/s10528-012-9533-1
Chang C.M., Coville J.L., Coquerelle G. et al. Complete association between a retroviral insertion in the tyrosinase gene and the recessive white mutation in chickens // BMC Genomics. 2006. V. 7:19. https://doi.org/10.1186/1471-2164-7-19
Yu S., Liao J., Tang M.A. functional single nucleotide polymorphism in the tyrosinase gene promoter affects skin color and transcription activity in the black-boned chicken // Poult. Sci. 2017. V. 96. № 11. P. 4061–4067. https://doi.org/10.3382/ps/pex217
Xu Y., Zhang X.H., Pang Y.Z. Association of tyrosinase (TYR) and tyrosinase-related protein 1 (TYRP1) with melanic plumage color in Korean Quails (Coturnix coturnix) // Asian-Australas. J. Anim. Sci. 2013. V. 26. № 11. P. 1518–1522. https://doi.org/10.5713/ajas.2013.13162
Li S., Wang C., Yu W. et al. Identification of genes related to white and black plumage formation by RNA-Seq from white and black feather bulbs in ducks // PLoS One. 2012. V. 7. № 5: e36592. https://doi.org/10.1371/journal.pone.0036592
Tobita-Teramoto T., Jang G.Y., Kino K. et al. Autosomal albino chicken mutation (ca/ca) deletes hexanucleotide (-deltaGACTGG817) at a copper-binding site of the tyrosinase gene // Poult. Sci. 2000. V. 79. № 1. P. 46–50. https://doi.org/10.1093/ps/79.1.46
Yu S., Wang G., Liao J., Tang M. Five alternative splicing variants of the TYR gene and their different roles in melanogenesis in the Muchuan black-boned chicken // Br. Poult. Sci. 2019. V. 60. № 1. P. 8–14. https://doi.org/10.1080/00071668.2018.1533633
Liang Z., Wang C., Yu H. et al. Molecular cloning, characterization and expression analysis of duck tyrosinase-related protein-1 // J. Anim. Vet. Adv. 2010. V. 9. № 16. P. 2102–2108. https://doi.org/10.3923/javaa.2010.2102.2108
Nadeau N.J., Mundy N.I., Gourichon D. et al. Association of a single-nucleotide substitution in TYRP1 with roux in Japanese quail (Coturnix japonica) // Anim. Genet. 2007. V. 38. № 6. P. 609–613. https://doi.org/10.1111/j.1365-2052.2007.01667.x
Li J., Bed’hom B., Marthey S. et al. A missense mutation in TYRP1 causes the chocolate plumage color in chicken and alters melanosome structure // Pigment Cell Melanoma Res. 2019. V. 32. № 3. P. 381–390. https://doi.org/10.1111/pcmr.12753
Cortimiglia C., Castiglioni B., Pizzi F. et al. Involvement of tyrosinase-related protein 1 gene in the light brown plumage phenotype of Falco cherrug // Anim. Genet. 2017. V. 48. № 1. P. 125–126. https://doi.org/10.1111/age.12506
Zhang X.D., Wang H.H., Zhang C.X. et al. Analysis of skin color change and related gene expression after crossing of Dongxiang black chicken and ISA layer // Genet. Mol. Res. 2015. V. 14. № 3. P. 11551–11561. https://doi.org/10.4238/2015
Costin G.E., Valencia J.C., Vieira W.D. et al. Tyrosinase processing and intracellular trafficking is disrupted in mouse primary melanocytes carrying the underwhite (uw) mutation. A model for oculocutaneous albinism (OCA) type 4 // J. Cell Sci. 2003. V. 116. № 15. P. 3203–3212. https://doi.org/10.1242/jcs.00598
Dooley C., Schwarz H., Mueller K. et al. Slc45a2 and V-ATPase are regulators of melanosomal pH homeostasis in zebrafsh, providing a mechanism for human pigment evolution and disease // Pigment Cell Melanoma Res. 2013. V. 26. № 2. P. 205–217. https://doi.org/10.1111/pcmr.12053
Gunnarsson U., Hellström A.R., Tixier-Boichard M. et al. Mutations in SLC45A2 cause plumage color variation in chicken and Japanese quail // Genetics. 2007. V. 175. № 2. P. 867–877. https://doi.org/10.1534/ genetics.106.063107
Xu X., Dong G.X., Schmidt-Küntzel A. et al. The genetics of tiger pelage color variations // Cell Res. 2017. V. 27. № 7. P. 954–957. https://doi.org/10.1038/cr.2017.32
Galván I., Inácio Â., Romero-Haro A.A., Alonso-Alvarez C. Adaptive downregulation of pheomelanin-related SLC7A11 gene expression by environmentally induced oxidative stress // Mol. Ecol. 2017. V. 26. № 3. P. 849–858. https://doi.org/10.1111/mec.13952
Rodríguez-Martínez S., Márquez R., Inácio Â., Galván I. Changes in melanocyte RNA and DNA methylation favour pheomelanin synthesis and may avoid systemic oxidative stress after dietary cysteine supplementation in birds // Mol. Ecol. 2019. V. 28. № 5. P. 1030–1042. https://doi.org/10.1111/mec.15024
Liu X.F., Luo J., Hu X.X. et al. Repression of Slc24a5 can reduce pigmentation in chicken // Front. Biosci. 2011. V. 3. № 1. P. 158–165. https://doi.org/10.2741/e229
Bellono N.W., Escobar I.E., Lefkovith A.J. et al. An intracellular anion channel critical for pigmentation // Elife. 2014. V. 3: e04543. https://doi.org/10.7554/eLife.04543
Abolins-Abols M., Kornobis E., Ribeca P. et al. Differential gene regulation underlies variation in melanic plumage coloration in the dark-eyed junco (Junco hyemalis) // Mol. Ecol. 2018. V. 27. № 22. P. 4501–4515. https://doi.org/10.1111/mec.14878
Yu S., Wang G., Liao J. et al. Transcriptome profile analysis of mechanisms of black and white plumage determination in black-bone chicken // Cell. Physiol. Biochem. 2018. V. 46. № 6. P. 2373–2384. https://doi.org/10.1159/000489644
Theos A.C., Truschel S.T., Raposo G., Marks M.S. The Silver locus product Pmel17/gp100/Silv/ME20: conreoversial in name and function // Pigment Cell Res. 2005. V. 18. № 5. P. 322–336. https://doi.org/10.1111/j.1600-0749.2005.00269.x
Kerje S., Sharma P., Gunnarsson U. et al. The Dominant white, Dun and Smoky color variants in chicken are associated with insertion/deletion polymorphisms in the PMEL17 gene // Genetics. 2004. V. 168. № 3. P. 1507–1518. https://doi.org/10.1534/genetics.104.027995
Ishishita S., Takahashi M., Yamaguchi K. et al. Nonsense mutation in PMEL is associated with yellowish plumage colour phenotype in Japanese quail // Sci. Rep. 2018. V. 8:16732. https://doi.org/10.1038/s41598-018-34827-4
Karlsson A.C., Kerje S., Andersson L., Jensen P. Genotype at the PMEL17 locus affects social and explorative behaviour in chickens // Br. Poult. Sci. 2010. V. 51. № 2. P. 170–177. https://doi.org/10.1080/00071661003745802
Mayerson P.L., Brumbaugh J.A. Lavender, a chick melanocyte mutant with defective melanosome translocation: A possible role for 10 nm filaments and microfilaments but not microtubules // J. Cell Sci. 1981. V. 51. P. 25–51.
Minvielle F., Gourichon D., Monvoisin J.L. Testing homology of loci for two plumage colors, “lavender” and “recessive white,” with chicken and Japanese quail hybrids // J. Hered. 2002. V. 93. № 1. P. 73–76. https://doi.org/10.1093/jhered/93.1.73
Vaez M., Follett S.A., Bed’hom B. et al. A single point-mutation within the melanophilin gene causes the lavender plumage colour dilution phenotype in the chicken // BMC Genet. 2008. V. 9: 7. https://doi.org/10.1186/1471-2156-9-7
Bed’hom B., Vaez M., Coville J.L. et al.The lavender plumage colour in Japanese quail is associated with a complex mutation in the region of MLPH that is related to differences in growth, feed consumption and body temperature // BMC Genomics. 2012. V. 13: 442. https://doi.org/10.1186/1471-2164-13-442
Lin S.J., Foley J., Jiang T.X. et al. Topology of feather melanocyte progenitor niche allows complex pigment patterns to emerge // Science. 2013. V. 340. № 6139. P. 1442–1446. https://doi.org/10.1126/science.1230374
Oh J.W., Lin S.J., Plikus M.V. Regenerative metamorphosis in hairs and feathers: Follicle as a programmable biological printer // Exp. Dermatol. 2015. V. 24. № 4. P. 262–264. https://doi.org/10.1111/exd.12627
Schwochow Thalmann D., Ring H., Sundström E. et al. The evolution of Sex-linked barring alleles in chickens involves both regulatory and coding changes in CDKN2A // PLoS Genet. 2017. V. 13. № 4:e1006665. https://doi.org/10.1371/journal.pgen.1006665
Haupaix N., Curantz C., Bailleul R. et al. The periodic coloration in birds forms through a prepattern of somite origin // Science. 2018. V. 361. № 6408: eaar4777. https://doi.org/10.1126/science.aar4777
Inaba M., Jiang T.X., Liang Y.C. et al. Instructive role of melanocytes during pigment pattern formation of the avian skin // PNAS. 2019. V. 116. № 14. P. 6884–6890. https://doi.org/10.1073/pnas.1816107116
Gluckman T.L., Mundy N.I. The differential expression of MC1R regulators in dorsal and ventral quail plumages during embryogenesis: Implications for plumage pattern formation // PLoS One. 2017. V. 12. № 3: e0174714. https://doi.org/10.1371/journal.pone.0174714
Wang S., Rohwer S., de Zwaan D.R. et al. Selection on a pleiotropic color gene block underpins early differentiation between two warbler species // bioRxiv. 2019. 853390. https://doi.org/10.1101/853390
Poelstra J.W., Vijay N., Bossu C.M. et al. The genomic landscape underlying phenotypic integrity in the face of gene flow in crows // Science. 2014. V. 344. № 6190. P. 1410–1414. https://doi.org/10.1126/science.1253226
Mao H., Wang X., Fan Y. et al. Whole-genome SNP data unravel population structure and signatures of selection for black plumage of indigenous chicken breeds from Jiangxi province, China // Anim. Genet. 2019. V. 50. № 5. P. 475–483. https://doi.org/10.1111/age.12827
Knief U., Bossu C.M., Saino N. et al. Epistatic mutations under divergent selection govern phenotypic variation in the crow hybrid zone // Nat. Ecol. Evol. 2019. V. 3. № 4. P. 570–576. https://doi.org/10.1038/s41559-019-0847-9
Toews D.P., Taylor S.A., Vallender R. et al. Plumage genes and little else distinguish the genomes of hybridizing warblers // Curr. Biol. 2016. V. 26. № 17. P. 2313–2318. https://doi.org/10.1016/j.cub.2016.06.034
Bourgeois Y.X., Delahaie B., Gautier M. et al. A novel locus on chromosome 1 underlies the evolution of a melanic plumage polymorphism in a wild songbird // R. Soc. Open Sci. 2017. V. 4. № 2: 160805. https://doi.org/10.1098/rsos.160805
Campagna L., Repenning M., Silveira L.F. et al. Repeated divergent selection on pigmentation genes in a rapid finch radiation // Sci. Adv. 2017. V. 3. № 5:e1602404. https://doi.org/10.1126/sciadv.1602404
Toomey M.B., Marques C.I., Andrade P. et al. A non-coding region near Follistatin controls head colour polymorphism in the Gouldian finch // Proc. Biol. Sci. 2018. V. 285. № 1888: 20181788. https://doi.org/10.1098/rspb.2018.1788
Kim K.W., Jackson B.C., Zhang H. et al. Genetics and evidence for balancing selection of a sex-linked colour polymorphism in a songbird // Nat. Commun. 2019. V. 10. № 1: 1852. https://doi.org/10.1038/s41467-019-09806-6
Vickrey A.I., Bruders R., Kronenberg Z. et al. Introgression of regulatory alleles and a missense coding mutation drive plumage pattern diversity in the rock pigeon // Elife. 2018. V. 7: e34803. https://doi.org/10.7554/eLife.34803
Stryjewski K.F., Sorenson M.D. Mosaic genome evolution in a recent and rapid avian radiation // Nat. Ecol. Evol. 2017. V. 1. № 12. P. 1912–1922. https://doi.org/10.1038/s41559-017-0364-7
Lamichhaney S., Fan G., Widemo F. et al. Structural genomic changes underlie alternative reproductive strategies in the ruff (Philomachus pugnax) // Nat. Genet. 2016. V. 48. № 1. P. 84–88. https://doi.org/10.1038/ng.3430
Tuttle E.M., Bergland A.O., Korody M.L. et al. Divergence and functional degradation of a sex chromosome-like supergene // Curr. Biol. 2016. V. 26. № 3. P. 344–350. https://doi.org/10.1016/j.cub.2015.11.069
Poelstra J.W., Vijay N., Hoeppner M.P., Wolf J.B. Transcriptomics of colour patterning and coloration shifts in crows // Mol. Ecol. 2015. V. 24. № 18. P. 4617–4628. https://doi.org/10.1111/mec.13353
Wang X., Li D., Song S. et al. Combined transcriptomics and proteomics forecast analysis for potential genes regulating the Columbian plumage color in chickens // PLoS One. 2019. V. 14. № 11: e0210850. https://doi.org/10.1371/journal.pone.0210850
Skoglund P., Höglund J. Sequence polymorphism in candidate genes for differences in winter plumage between Scottish and Scandinavian Willow Grouse (Lagopus lagopus) // PLoS One. 2010. V. 5. № 4:e10334. https://doi.org/10.1371/journal.pone.0010334
Bourgeois Y.X., Bertrand J.A., Delahaie B. et al. Candidate gene analysis suggests untapped genetic complexity in melanin-based pigmentation in birds // J. Hered. 2016. V. 107. № 4. P. 327–335. https://doi.org/10.1093/jhered/esw017
San-Jose L.M., Roulin A. Genomics of coloration in natural animal populations // Philos. Trans. R. Soc. Lond. B Biol. Sci. 2017. V. 372. № 1724:20160337. https://doi.org/10.1098/rstb.2016.0337
Mackay T.F. The genetic architecture of quantitative traits // Annu. Rev. Genet. 2001. V. 35. P. 303–339. https://doi.org/10.1146/annurev.genet.35.102401.090633
Dembeck L.M., Huang W., Magwire M.M. et al. Genetic architecture of abdominal pigmentation in Drosophila melanogaster // PLoS Genet. 2015. V. 11. № 5: e1005163. https://doi.org/10.1371/journal.pgen.1005163
Kardos M., Husby A., McFarlane S.E. et al. Whole-genome resequencing of extreme phenotypes in collared flycatchers highlights the difficulty of detecting quantitative trait loci in natural populations // Mol. Ecol. Resour. 2016. V. 16. № 3. P. 727–741. https://doi.org/10.1111/1755-0998.12498
Galván I., Solano F. Bird integumentary melanins: biosynthesis, forms, function and evolution // Int. J. Mol. Sci. 2016. V. 17. № 4:520. https://doi.org/10.3390/ijms17040520
Дополнительные материалы отсутствуют.