Генетика, 2021, T. 57, № 8, стр. 934-940
Тест-система для диагностики BLAD-мутации в популяциях крупного рогатого скота
К. Д. Сабетова 1, И. Ю. Подречнева 1, *, С. Г. Белокуров 1, П. О. Щеголев 1, И. А. Кофиади 2, **
1 Костромская государственная сельскохозяйственная академия
156530 п. Караваево, Костромская область, Россия
2 Институт иммунологии Федерального медико-биологического агентства России
115478 Москва, Россия
* E-mail: irina-podrechneva017@rambler.ru
** E-mail: kofiadi@mail.ru
Поступила в редакцию 02.10.2020
После доработки 30.11.2020
Принята к публикации 18.12.2020
Аннотация
Разработана молекулярно-генетическая тест-система для определения мутации дефицита адгезии лейкоцитов крупного рогатого скота (BLAD) с использованием ПЦР в реальном времени (ПЦР-РВ) и апробации на маточном поголовье в племенных хозяйствах Костромской области. Материалом для исследования служили образцы биологического материала (кровь) крупного рогатого скота костромской, ярославской, черно-пестрой и голштинской пород в хозяйствах Костромской области. Общее количество образцов 430. Установлено, что в племенных хозяйствах по разведению костромской и ярославской пород мутации BLAD не выявлено. Однако в 192 пробах крови черно-пестрой породы, “улучшенной” голштинской породой, обнаружены семь коров-носителей этой моногенной рецессивной аномалии. Таким образом, усовершенствованная тест-система диагностики BLAD-мутации позволяет своевременно выявлять и регистрировать животных-носителей, что способствует элиминации нежелательных аллелей и оздоровлению популяций крупного рогатого скота.
В ХХ столетии интенсивное использование мирового породного генофонда и биотехнологий репродукции (искусственное осеменение, трансплантация эмбрионов, клонирование) позволило значительно повысить генетический потенциал продуктивности животных за счет получения потомства производителей – лидеров породы. Вместе с тем в поголовье все чаще проявляются признаки генетической эрозии – накопления груза вредных рецессивных мутаций [1–5].
Одной из ее форм является иммиграционный груз (immigration load), когда за счет притока генов из других популяций или пород происходит насыщение улучшаемой породы как положительными в селекционном отношении генами, так и мутациями, отрицательно сказывающимися на здоровье и продуктивности животных. Наследственные заболевания имеют разную степень распространенности в стадах крупного рогатого скота в разных странах мира, но только целенаправленная работа по выявлению и выбраковке носителей мутационных генов позволяет эффективно бороться с их дальнейшим распространением [6–10].
Массовое использование быков-производителей голштинской породы для “улучшения” популяций отечественного черно-пестрого скота внесли в генофонд отечественных пород рецессивные мутации, обусловливающие, в том числе, дефицит адгезии лейкоцитов (Bovine Leukocyte Adhesion Deficiency – BLАD). По сведениям Р.Р. Шайдуллина, Т.Х. Фаизова и А.С. Ганиева, все носители данной мутации являются потомками голштинского быка К. Айвенго Белла 1667366 (линия Монтвик Чифтейн 95679), сперму которого активно использовали для осеменения коров в 50–60-х гг. прошлого века [11].
Молекулярная основа BLAD представляет собой точечную aмутацию (A→G) в нуклеотиде 383. Мутация нарушает нормальную функцию нейтрофилов, дефектные нейтрофилы теряют способность мигрировать через эпителий капилляров и субэпителиальные мембраны. Ген BLAD является “шлейфом” высокой молочности. У особей, гомозиготных по рецессивному аллелю, резко снижается устойчивость к бактериальным и вирусным инфекциям, замедляется рост. Большинство телят погибает в возрасте 3–7 мес. от кишечных и легочных инфекций [12–14].
Разработка и реализация национальных программ против распространения BLAD-синдрома привели к тому, что частота рецессивного аллеля гена CD18 в последнее время значительно снизилась. Однако без систематического мониторинга популяций черно-пестрого скота и других пород с прилитием крови крупного рогатого скота голштинской породы частота встречаемости данной мутации может вновь возрасти. Поэтому разработка новых, более совершенных, тест-систем методом ПЦР для выявления носителей BLAD по-прежнему актуальна.
Цель работы – разработка быстрой и чувствительной тест-системы для выявления наследственного дефекта BLAD с детекцией в режиме real-time и выявление с ее помощью распространения скрытых носителей в популяциях молочного скота Костромской области.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для исследования служили образцы крови крупного рогатого скота костромской, ярославской, черно-пестрой пород. Всего было отобрано 430 проб. Для выделения ДНК из биообразцов использовались реактивы из комплекта “ПРОБА-ГС-ГЕНЕТИКА” (производитель ООО “НПО ДНК-Технология”): лизирующий раствор, сорбент, промывочные растворы № 1, 2, 3 и элюирующий раствор.
Тест-система предназначена для проведения исследований по идентификации однонуклеотидной замены (A→G) в позиции 383 гена CD18, ассоциированной с дефицитом адгезии лимфоцитов у крупного рогатого скота (BLAD).
Определение генотипа основано на проведении полимеразной цепной реакции (ПЦР) с праймерами, общими для “дикого” и “мутантного” вариантов нуклеотидной последовательности:
BLAD-d 5'-TGGCAGGTCAGGCAGTTGCGTT-3',
BLAD-r 5'-CGACTCGGTGATGCCATTGAGG-3'.
После завершения температурной программы ПЦР флуоресцентные зонды гибридизуются на полученную матрицу путем понижения температуры реакционной смеси. Для определения варианта последовательности используется два типа олигонуклеотидов, гибридизующихся на матрицу. Первый тип олигонуклеотидов помечен флуорофором, второй – гасителем флуоресценции.
Для генотипирования используются два сиквенс-специфичных олигонуклеотида, несущих различные флуорофоры (FAM – предковый аллель, VIC – мутантный аллель):
BLAD-pf 5'-CCCCATCGACCTGTACT-(FAM),
BLAD-pv 5'-CCCCATCGGCCTGTACT-(VIC)
и один олигонуклеотид с гасителем флуоресценции, общий для обоих аллелей:
BLAD-pq (BHQ)-ACCTGATGGACCTCTCCTACTC-(P),
а также минеральное масло, защищающее реакционную смесь от испарения в ходе ПЦР.
Определение генотипа проводилось путем измерения уровня флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц. Результаты ПЦР регистрировались в режиме реального времени. Если анализируемый образец содержит только один вариант нуклеотидной последовательности гена, т.е. гомозиготен по данному полиморфизму, температура плавления для зонда, образующего совершенный (полностью комплементарный) дуплекс, существенно выше, нежели для зонда, образующего несовершенный (частично некомплементарный) дуплекс. При анализе гетерозиготного образца, содержащего оба варианта нуклеотидной последовательности, оба варианта зондов образуют совершенный дуплекс, поэтому температуры их плавления практически одинаковы. В реакции используется фермент Taq-полимераза в количестве 2.5 единицы активности на реакцию. Для предотвращения испарения амплификационной смеси на водную фазу реакции наслаивается 20 мкл минерального масла.
Тест-система адаптирована к использованию с амплификаторами ДТ-48 (ЗАО “НПФ ДНК-Технология”, Россия). Время проведения анализа составляет 80 мин (табл. 1).
Таблица 1.
Программа амплификации для детектирующего амплификатора ДТ-48 (ООО “НПО ДНК-Технология”)
| № этапа | Температура, °С | Продолжительность, мин | Режим оптического измерения | Число циклов | Тип блока |
|---|---|---|---|---|---|
| 1 | 80.0 94.0 |
02:00 05:00 |
1 | Цикл | |
| 2 | 94.0 67.0 |
00:30 00:15 |
V | 5 | Цикл |
| 3 | 94.0 67.0 |
00:05 00:15 |
V | 45 | Цикл |
| 4 | 94.0 | 00:05 | 1 | Цикл | |
| 5 | 25.0 | 00:30 | 1 | Цикл | |
| 6 | 25.0 | 00:15 | V | 50 | Плавление |
| 7 | 10.0 | Хранение | Хранение | ||
Регистрация результатов ПЦР проводится программным обеспечением для детектирующего амплификатора ДТ-48 автоматически.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известен способ одновременного определения синдрома недостаточной адгезии лейкоцитов (BLAD) и комплексного порока позвоночника (CVM) у крупного рогатого скота методом полимеразной цепной реакции в реальном времени [15–18]. Недостатком данного способа является то, что для детекции результатов ПЦР и проведения генотипирования используют анализ кинетических кривых ПЦР с определением порогового (threshold) цикла. Надeжность анализа зависит в данном случае от нескольких параметров: качества очистки образца ДНК, эффективности фермента Taq-полимеразы, оптических характеристик амплификатора. Варьирование этих параметров повышает вероятность ошибки и ограничивает возможность автоматизированного определения генотипа.
Принцип действия: определение генотипа основано на проведении полимеразной цепной реакции (ПЦР) с праймерами, общими для “дикого” и “мутантного” вариантов нуклеотидной последовательности:
BLAD-d 5'-TGGCAGGTCAGGCAGTTGCGTT-3',
BLAD-r 5'-CGACTCGGTGATGCCATTGAGG-3'.
После завершения температурной программы ПЦР флуоресцентные зонды гибридизуются на полученную матрицу путем понижения температуры реакционной смеси. Для определения варианта последовательности используются три типа олигонуклеотидов, гибридизующихся на матрицу:
BLAD-pf 5'-CCCCATCGACCTGTACT-(FAM),
BLAD-pv 5'-CCCCATCGGCCTGTACT-(VIC),
BLAD-pq (BHQ)-ACCTGATGGACCTCTCCTACTC-(P).
Первый тип олигонуклеотидов мечен флуорофором, второй – гасителем флуоресценции.
Для генотипирования используется один общий олигонуклеотид с гасителем флуоресценции (зонд BLAD-pq) и два сиквенс-специфичных олигонуклеотида, несущих различные флуорофоры: BLAD-pf и BLAD-pv (FAM маркирует предковый аллель, VIC – мутантный аллель). Определение генотипа проводится путем измерения уровня флуоресценции в ходе температурной денатурации дуплексов олигонуклеотидов и полученных матриц. Результаты регистрируются в режиме реального времени.
Если анализируемый образец содержит только один вариант нуклеотидной последовательности гена, т.е. гомозиготен по данному полиморфизму, температура плавления для зонда, образующего совершенный (полностью комплементарный) дуплекс, существенно выше, нежели для зонда, образующего несовершенный (частично некомплементарный) дуплекс (рис. 1).
Рис. 1.
Кривые плавления ДНК-дуплексов гомозиготного образца, полученные с помощью детектирующего амплификатора ДТ-48 (ООО “НПФ ДНК-Технология”). а – канал FAM, б – канал HEX.
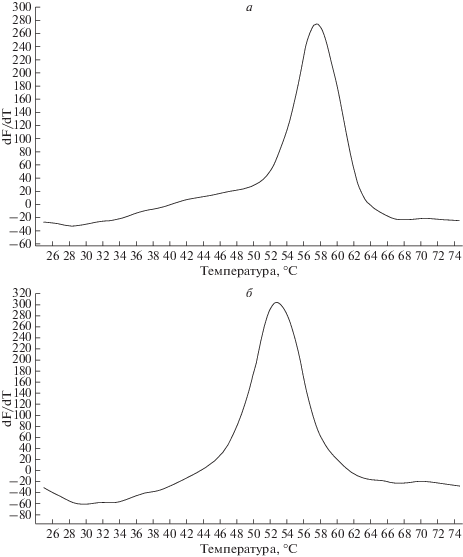
При анализе гетерозиготного образца, содержащего оба варианта нуклеотидной последовательности, оба варианта зондов образуют совершенный дуплекс, поэтому температуры их плавления неодинаковы (рис. 2).
Рис. 2.
Кривые плавления ДНК-дуплексов гетерозиготного образца, полученные с помощью детектирующего амплификатора ДТ-48 (ООО “НПФ ДНК-Технология”). а – канал FAM, б – канал HEX.
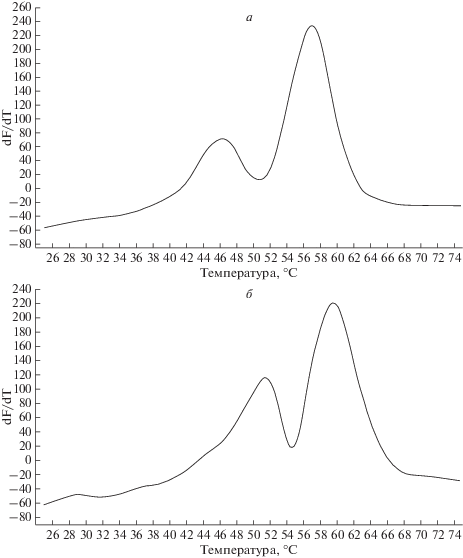
Разные кривые плавления дают возможность четко разделять образцы на основе их форм. Специфичность тест-системы оценивали биоинформационным методом, сравнивая последовательность разработанных праймеров против базы данных геномных последовательностей GenBank и проверяя их на температурную стабильность и температуру отжига с помощью программного обеспечения Oligo 6.0. По результатам проверки ни один из праймеров не обладал достаточной степенью гомологии с геномом человека для того чтобы привести к синтезу неспецифической мишени на расчeтной температуре отжига. Чувствительность тест-системы оценивали методом серийных разведений – она составляет 50 копий ДНК на реакцию. Тест-система демонстрирует стабильную воспроизводимость результатов при анализе количества копий ДНК, превышающего порог чувствительности тест-системы.
Разработанную тест-систему для диагностики дефицита лейкоцитарной адгезии (BLAD) апробировали в племенных стадах Костромской области по разведению костромской, ярославской и черно-пестрой, “улучшенной” голштинской породой. В качестве отрицательного контроля взята костромская порода крупного рогатого скота, у которой отсутствует эта рецессивная мутация. В табл. 2 приведены результаты лабораторных исследований.
Таблица 2.
Результаты исследования крупного рогатого скота различных пород на присутствие BLAD-мутации
| Порода | Не носители TL |
Носители BL |
Носитель в гомозиготном состоянии | ||
|---|---|---|---|---|---|
| число | % | число | % | ||
| Костромская | 98 | 100 | – | – | – |
| Ярославская | 96 | 100 | – | – | – |
| Голштинская | 50 | 100 | – | – | – |
| Черно-пестрая “улучшенная” голштинами | 185 | 96.4 | 7 | 3.6 | – |
Из данных таблицы следует, что в племенных хозяйствах по разведению отечественных костромской и ярославской пород BLAD-мутации не выявлено. Однако из 192 проб крови черно-пестрой породы, “улучшенной” голштинской породой, выявлено 3.6% животных-носителей этой аномалии, что превышает среднюю частоту встречаемости BLAD-мутации в отечественных популяциях, которая составляет 2.17% (по данным Л.К. Эрнста) [19, 20].
Таким образом, разработанная тест-система BLAD-мутации позволяет своевременно выявлять и регистрировать животных-носителей, что способствует элиминации нежелательных аллелей и оздоровлению популяций крупного рогатого скота.
Авторы выражают глубокую признательность ФГБУ “ГНЦ Институт иммунологии” ФМБА России за методическую поддержку и помощь в разработке тест-системы.
Исследования проведены при финансовой поддержке Министерства сельского хозяйства Российской Федерации в рамках государственного задания, регистрационный номер проекта АААА-А19-119092690091-7.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Эрнст Л.К., Жигачев А.И. Профилактика генетических аномалий крупного рогатого скота. Л., 1990. 238 с.
Жигачев А.И. Заболевания скота XXI века – откуда они? // Наше племенное дело. 2004. № 3. С. 9–11.
Sahana G., Nielsen U.S., Aamand G.P. et al. Novel harmful recessive haplotypes identified for fertility traits in nordicholstein cattle // PLoS One. 2013. V. 8: e82909. https://doi.org/10.1371/journal.pone.0082909
VanRaden P.M., Olson K.M., Null D.J., Hutchison J.L. Harmful recessive effects on fertility detected by absence of homozygous haplotypes // J. Dairy Sci. 2011. Is. 94. P. 6153–6161. https://doi.org/10.3168/jds.2011-4624
Усова Т.П., Усманова Н.Н., Литвина Н.И., Усов Н.В. Распространение BLAD-синдрома убыков-производителей голштинской породы отечественной и импортной селекции // Вестник Рос. гос. аграрного заочного ун-та [Балашиха]. 2017. № 25(30). С. 20–24.
Гладырь Е.А., Зиновьева Н.А., Эрнст Л.К. и др. Молекулярные методы в диагностике заболеваний и наследственных дефектов сельскохозяйственных животных // Зоотехния. 2009. № 8. С. 26–27.
Зиновьева Н.А., Гладырь Е.А., Харзинова В.Р. и др. Роль ДНК-диагностики в контроле и элиминации рецессивных наследственных аномалий сельскохозяйственных животных // Достижения науки и техники АПК. 2012. № 11. С. 37–40.
Fritz S., Capitan A., Djari A. et al. Detection of haplotypes associated with prenatal death in dairy cattle and identification of deleterious mutations in GART, SHBG and SLC37A2 // PLoS One. 2013. № 8(6): e65550. https://doi.org/10.1371/journal.pone.0065550
Нургалиев Ф.М., Тюлькин С.В., Ахметов Т.М. Оптимизация способов выявления у животных рецессивных мутаций // Уч. зап. Казанской гос. академии ветеринарной медицины им. Н.Э. Баумана. 2011. Т. 208. С. 39–44.
Меллат Э. BLAD – генетическое расстройство крупного рогатого скота // Сб. статей XIII межд. научно-практ. конф. М.: ООО “Актуальность РФ”, 2018. С. 16–18.
Шайдуллин Р.Р., Фаизов Т.Х., Ганиев А.С. Характер распространения летальных генов у молочного скота // Уч. зап. Казанской гос. академии ветеринарной медицины им. Н.Э. Баумана. 2015. Т. 222. № 2. С. 242–245.
Зиновьева Н.А., Доцев А.В., Сермягин А.А. и др. Изучение генетического разнообразия и популяционной структуры российских пород крупного рогатого скота с использованием полногеномного анализа SNP // С.-х. биология. 2016. № 51(6). С. 788–800. https://doi.org/10.15389/agrobiology.2016.6.788rus
Зиновьева Н.А., Стрекозов Н.И., Ескин Г.В. и др. Моногенные наследственные дефекты и их роль в воспроизводстве // Животноводство России. 2015. № 6. С. 30–31.
Тумилович Я.И., Борунова С.М. Генетические аномалии у крупного рогатого скота голштинской породы // Достижения молодых ученых в ветеринарной практике: Материалы IV межд. науч. конф., посвященной 55-летию аспирантуры ФГБУ “ВНИИЗЖ”. 2016. С. 104–105.
Филипенкова Г.В., Делян А.С., Светличкин В.В. Теоретическое и экспериментальное обоснование методов ДНК-анализа для оценки генетического материала голштинской породы КРС // Аэкономика: экономика и сельское хозяйство. 2017. № 8(20). URL: https://cyberleninka.ru/article/n/teoreticheskoe-i-eksperimentalnoe-obosnovanie-metodov-dnk-analiza-dlya-otsenki-geneticheskogo-materiala-golshtinskoy-porody-krs
Марзанова С.Н., Девришов Д.А., Алексеев Я.И. и др. Способ одновременной генодиагностики двух мутантных аллелей, вызывающих CVM и BLAD у крупного рогатого скота, и тест-система для его осуществления // Патент на изобретение RU 2601151 C2, 27.10.2016. Заявка № 2015104459/10 от 11.02.2015.
Лазарева А.Д., Русакова А.В., Денисова В.В. и др. Исследование мутации комплексного порока позвоночника (CVM) и дефицита лейкоцитарной адгезии (BLAD) у крупного рогатого скота // XLVIII Огаревские чтения: Материалы науч. конф. В 3-х частях / Под ред. Сенина П.В. 2020. С. 129–132.
Трухачев В.И., Селионова М.И., Чижова Л.Н. и др. ДНК-диагностика наследственных заболеваний молочного скота // Вестник АПК Ставрополья. 2017. № 2(26). С. 120–125.
Эрнст Л.К., Зиновьева Н.А., Сибагатуллин Ф.С. и др. Изучение мутантных генов наследственных заболеваний быков-производителей в разных регионах Российской Федерации // Ветеринарный врач. 2012. № 1. С. 43–47.
Эрнст Л.К., Гладырь Е.А., Горелов П.В. и др. Характеристика региональных популяций быков-производителей по генам наследственных заболеваний // Достижения науки и техники АПК. 2011. № 10. С. 28–30.
Дополнительные материалы отсутствуют.


