Генетика, 2021, T. 57, № 9, стр. 1089-1098
Профиль экспрессии группы генов и микроРНК при раке молочной железы: связь с прогрессией и иммуногистохимическим статусом опухоли
Е. А. Филиппова 1, *, И. В. Пронина 1, А. М. Бурденный 1, Т. П. Казубская 2, В. И. Логинов 1, Э. А. Брага 1
1 Научно-исследовательский институт общей патологии и патофизиологии
125315 Москва, Россия
2 Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина
115478 Москва, Россия
* E-mail: p.lenyxa@yandex.ru
Поступила в редакцию 26.10.2020
После доработки 04.12.2020
Принята к публикации 14.12.2020
Аннотация
Актуальной задачей онкогеномики является поиск генов, экспрессия которых ассоциирована с показателями, специфично различающими тип рака молочной железы (РМЖ) и прогноз заболевания. Методом ПЦР в реальном времени на выборке из 41 образца РМЖ охарактеризована связь уровней экспрессии мРНК пяти опухоль-ассоциированных генов (BCL6, CHL1, AXL, ACSL1, TGFB2) и семи потенциально регуляторных микроРНК (miR-132-3р, miR-137, miR-148a-3р, miR-219-5р, miR-24-2-5р, miR-339-3p, miR-375) с клинико-патологическими параметрами опухолей и иммуногистохимическим статусом. Показано снижение уровня экспрессии CHL1 и AXL и повышение уровня BCL6 на поздних стадиях РМЖ. Кроме того, III–IV стадии РМЖ ассоциированы с увеличением уровня miR-339-3p, а метастазы в лимфоузлах – со снижением уровня miR-148a-3р. При высоком показателе пролиферации Ki-67 отмечено также увеличение уровня miR-375. Опухоли, не экспрессирующие рецептор прогестерона (PR), проявляют снижение уровня экспрессии BCL6, miR-375 и miR-24-2-5р. Снижение уровня экспрессии BCL6 наблюдали также в РМЖ с отрицательным статусом эстрогенового рецептора (ER–). В образцах РМЖ с отрицательным HER2-статусом отмечено статистически значимое снижение уровня экспрессии гена TGFB2 и miR-219-5р, а также снижение уровня экспрессии TGFB2 выявлено при люминальном А РМЖ. Таким образом, определены новые возможные молекулярные показатели прогрессии РМЖ и биомаркеры, которые могут быть полезны при дифференциальной диагностике молекулярного подтипа РМЖ.
Рак молочной железы (РМЖ) является наиболее распространенным видом рака у женщин как в развитых, так и в развивающихся странах [1]. Несмотря на значительные успехи в диагностических и терапевтических подходах за последние десятилетия, РМЖ все еще является второй по частоте причиной смерти от рака у женщин [2]. Опухоли молочной железы характеризуются значительной вариабельностью клеточного состава, а также гистологической, экспрессионной, генотипической гетерогенностью [3]. В клетках РМЖ изменена экспрессия многих генов, при этом профиль их экспрессии зависит от патологического фенотипа опухоли [4]. Описание подтипов РМЖ дополняется новыми данными по геномным нарушениям, метилированию ДНК, профилю экспрессии микроРНК и белоккодирующих генов (БКГ) [5]. Однако данные транскриптомного и протеомного анализов пока не позволяют выявить специфических маркеров для прогноза и лечения заболевания [6].
Следует отметить, что около 60% всех случаев РМЖ являются гормонозависимыми, из которых 75% случаев являются ER-положительными, а 65% – PR-положительными [7, 8]. В 20–30% всех случаев РМЖ наблюдается сверхэкспрессия HER2 (рецептора эпидермального фактора роста 2-го типа, ген ERBB2), которая связана с неблагоприятным клиническим исходом у пациентов с РМЖ [9]. Выделяют пять основных подтипов РМЖ, а именно: люминальный А (ER+, PR±, HER-2 негативный, Ki-67 < 16%); люминальный Б HER2-отрицательный (ER+ и/или PR±, HER-2 негативный, Ki-67 > 16%); люминальный Б HER2- положительный (ER+ и/или PR±, Ki-67 любой, HER-2 позитивный); HER2-обогащенный (ER, PR отсутствуют, HER-2 позитивный); тройной негативный рак (ER, PR отсутствуют, HER-2 негативный). Следует отметить, что на практике онкологи сталкиваются с ситуациями, когда люминальные подтипы РМЖ, характеризующиеся благоприятным течением, ведут себя крайне агрессивно, при этом заболевание быстро прогрессирует и нередко заканчивается летальным исходом. И наоборот, наиболее агрессивный рак с тройным негативным фенотипом может протекать годами и не требовать серьезных терапевтических методов лечения. Все это требует поиска дополнительных молекулярно-генетических маркеров, позволяющих повысить точность как цитологического, так и гистологического заключений и максимально индивидуализировать лечение больных РМЖ.
На сегодняшний день идентифицированы многочисленные БКГ и гены микроРНК – супрессоры опухолевого роста и онкогены, изменение уровня экспрессии которых ассоциировано с развитием и прогрессией рака, в том числе и РМЖ [10]. МикроРНК, являясь важными регуляторами экспрессии генов на посттранскрипционном уровне, представляют собой перспективные маркеры многих видов рака, включая РМЖ [11]. Идентифицированы микроРНК, ускоряющие, а в некоторых случаях и замедляющие пролиферацию в клетках при тройном негативном РМЖ, для которого нет специфичного лечения, кроме хирургического, химио- и радиотерапии [12]. В настоящее время микроРНК рассматриваются как перспективные мишени не только для диагностики, но и для лечения этого типа рака [13].
Таким образом, поиск ассоциаций между изменением уровня экспрессии БКГ и генов микроРНК и молекулярными подтипами РМЖ, клинико-патологическими и иммуногистохимическими характеристиками больных РМЖ позволит найти новые маркеры для раннего выявления РМЖ, прогноза возникновения рецидива и вероятного ответа на гормональную и/или химиотерапию.
Цель данного исследования – изучение изменения уровня экспрессии мРНК группы опухоль-ассоциированных белоккодирующих генов и микроРНК с клинико-патоморфологическими параметрами РМЖ и его иммуногистохимическим статусом.
МАТЕРИАЛЫ И МЕТОДЫ
Материал исследования. Образцы РМЖ собраны и морфологически охарактеризованы в НМИЦ онкологии им. Н.Н. Блохина Минздрава России. Исследовали образцы РМЖ у больных, которые до операции не получали лучевую или химиотерапию. Все опухоли молочной железы были классифицированы в соответствии с TNM-классификацией Международного противоракового союза [14] и гистологически верифицированы на основании критериев классификации ВОЗ [15]. Использовали образцы опухолей и парные гистологически неизмененной ткани молочной железы, полученные от 41 больной РМЖ; клинико-морфологические данные пациенток приведены в табл. 1.
Таблица 1.
Клинико-патоморфологическая характеристика больных РМЖ
| Клинико-патоморфологический параметр | N = 41 | |
|---|---|---|
| Клиническая стадия | I | 6 |
| II | 24 | |
| III | 11 | |
| Степень дифференцировки | G1 | 3 |
| G2 | 33 | |
| G3 | 3 | |
| Размер первичной опухоли | Т1 | 7 |
| Т2 | 25 | |
| Т3 | 4 | |
| Т4 | 5 | |
| Лимфогенное метастазирование | N0 | 18 |
| N1–3 | 23 | |
| Иммуногистохимический тип опухоли | Люминальный тип А (ER+; PR+; HER-2 негативный, Ki-67 < 16%) |
5 |
| Люминальный тип Б (негативный) (ER и/или PR+; HER-2 негативный, Ki-67 > 16%) |
7 | |
| Люминальный тип Б (позитивный) (ER и/или PR+, Ki67 любой, HER-2 позитивный) |
21 | |
| HER-2+ (ER, PR отсутствуют, HER-2 позитивный) |
6 | |
| Тройной негативный рак (ER, PR отсутствуют, HER-2 негативный) |
2 | |
| Статус рецепторов эстрогена | Положительный | 29 |
| Отрицательный | 12 | |
| Статус рецепторов прогестерона | Положительный | 23 |
| Отрицательный | 18 | |
| Статус HER2 | Положительный | 27 |
| Отрицательный | 14 | |
| Статус Ki67 | Низкий, <16% | 11 |
| Промежуточный, 16–30% | 14 | |
| Высокий, >30% | 16 | |
Образцы тканей хранили при –70°С. Полученные в ходе биопсии или оперативного вмешательства образцы объемом до 5 мм3 измельчали, с использованием гомогенизатора-диспергатора Ultra-Turrax T10 basic (IKA, Германия).
Выделение тотальной РНК. Тотальную РНК выделяли с использованием протокола гуанидин-тиоцианат-фенол-хлороформной экстракции [16]. Концентрацию суммарной РНК определяли спектрофотометрически при 260 нм. Качество РНК также оценивали спектрофотометрически с использованием коэффициентов поглощения при 260 против 230 нм и 260 против 280 нм. Сохранность РНК определяли по соотношению интенсивностей полос 28S рРНК и 18S рРНК при электрофорезе в 1%-ном денатурирующем агарозном геле. Перед использованием все образцы РНК обрабатывали ДНКазой, свободной от РНКазы.
Анализ уровня экспрессии генов. Обратную транскрипцию мРНК БКГ проводили с помощью обратной транскриптазы MMLV (Евроген, Россия) с добавлением “случайных” гекса- и нанонуклеотидных праймеров. При каждой постановке реакции обратной транскрипции были включены отрицательные контроли, не содержащие РНК.
Количественную ПЦР в реальном времени (ПЦР-РВ) для мРНК пяти генов ACSL1, AXL, BCL6, CHL1, TGFB2 проводили на кДНК по технологии SYBR Green с использованием набора qPCRmix-HS SYBR (5×) в соответствии с протоколом производителя (Евроген) на амплификаторе BioRad CFX96 qPCRSystem (Bio-Rad, США), последовательности праймеров приведены в табл. 2. В качестве эндогенного внутреннего контроля, относительно которого проводили нормирование продуктов амплификации исследуемого гена, был выбран ген “домашнего хозяйства” B2M (табл. 2).
Таблица 2.
Праймеры, использованные при анализе БКГ методом ПЦР-РВ
| Ген | Структура праймеров (5'–3') | Тотж, °С | Размер продукта, пн | Ссылка |
|---|---|---|---|---|
| ACSL1 | F: ACTGTCTTCCCCGTGGTTCC R: AGGCTGTTGTTTCTGATGATGC |
60 | 152 | # |
| AXL | F: TACCGCGTGCGCAAGTCCTACA R: TGGCAATCTTCATCGTCTTCACAG |
60 | 226 | [18] |
| BCL6 | F: CCAGCCACAAGACCGTCCAT R: CTCCGCAGGTTTCGCATTT |
60 | 141 | [19] |
| CHL1 | F: GAACTATCCTTGCCAATGCCAATAT R: TTCTGCCAGGACACGACTGC |
60 | 153 | [17] |
| TGFB2 | F: TGCAGAACCCAAAAGCCAGAGTG R: TACAAAAGTGCAGCAGGGACAGTG |
60 | 236 | # |
| В2М | F: TGACTTTGTCACAGCCCAAGATAG R: CAAATGCGGCATCTTCAAACCTC |
60 | 81 | [17] |
При обратной транскрипции зрелых микроРНК из тотальной РНК и при проведении ПЦР-РВ использовали готовые наборы TaqMan MicroRNA Assays (Applied Biosystems, США) в соответствии с протоколом производителя на амплификаторе BioRad CFX96.
Все реакции ПЦР повторяли трижды. В качестве отрицательного контроля использовали пробы без кДНК. Данные анализировали с использованием относительной количественной оценки по ΔΔCt-методу. Изменения уровня микроРНК менее чем в 2 раза (|ΔΔCt| ≤ 2) рассматривали как отсутствие изменений [17].
Статистический анализ. Статистическая обработка результатов осуществлялась с использованием пакета статистических программ “IBM SPSS Statistics 22” и она включала определение медианы и интерквартильного размаха. Для оценки достоверности различий применялся непараметрический критерий Манна–Уитни, критерий Краскала–Уоллиса. Различия считали достоверными при р < 0.05, где р – показатель статистической значимости (достоверности) различий между изучаемыми выборками. Применяли поправку на множественное сравнение Бенджамини–Хохберга и оценивали величину FDR (false discovery rate, частота ложного обнаружения).
РЕЗУЛЬТАТЫ
Анализ уровня экспрессии белоккодирующих генов и микроРНК
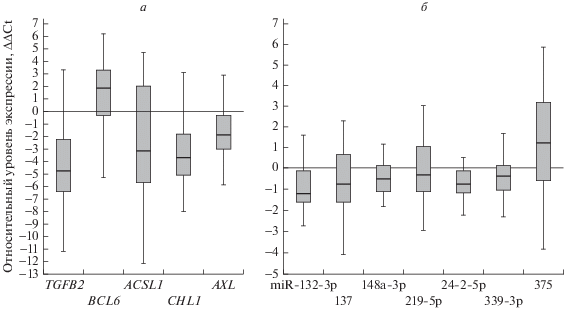
Данная работа была направлена на анализ изменения уровня экспрессии мРНК белоккодирующих генов и микроРНК, связанных с фундаментальными биологическими процессами, таким как эпителиально-мезенхимальный переход (EMT) при раке молочной железы. Нами были отобраны пять белоккодирующих генов (BCL6, CHL1, AXL, ACSL1, TGFB2) и семь микроРНК (miR-132-3р, miR-137, miR-148a-3р, miR-219-5р, miR-24-2-5р, miR-339-3p и miR-375), предположительно связанных с клеточной адгезией, подвижностью и EMT по данным http://www.genecards.org, http://atlasgeneticsoncology.org/Genes/, https://www.ncbi.nlm.nih.gov/ pubmed. Методом количественной ПЦР в реальном времени были исследованы профили экспрессии этих генов на выборке из 41 парного (опухоль/гистологически нормальная ткань молочной железы) образца РМЖ. Показано статистически значимое снижение уровня экспрессии БКГ CHL1, AXL, ACSL1, TGFB2 в опухоли по сравнению с гистологически неизмененной тканью молочной железы (p < 0.01, FDR = 0.05). Выявлено значимо частое повышение уровня экспрессии мРНК гена BCL6 (p < 0.001, FDR = 0.05) в опухоли по сравнению с гистологически неизмененной тканью молочной железы (рис. 1а), что указывает на проявление про-опухолевых свойств BCL6 при РМЖ. При анализе уровня экспрессии семи микроРНК (miR-132-3р, miR-137, miR-148a-3р, miR-219-5р, miR-24-2-5р, miR-339-3p, miR-375) показано статистически значимое снижение уровня экспрессии двух микроРНК miR-132-3р и miR-137 (р = 7.4 × × 10–6 и р = 0.049 соответственно) в опухолевых образцах РМЖ по сравнению с парной гистологически нормальной тканью, что позволяет предположить опухоль-супрессорную функцию этих микроРНК при РМЖ (рис. 1б).
В то же время показано статистически значимое увеличение уровня экспрессии miR-375 в опухолевых образцах, которое указывает на ее онкогенные свойства при РМЖ. При этом изменение экспрессии miR-148a-3р, miR-219-5р, miR-24-2-5р, miR-339-3p было статистически не достоверно.
Связь уровня экспрессии БКГ и микроРНК с клинико-патологическими параметрами прогрессии РМЖ
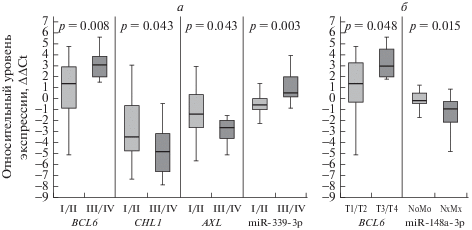
Затем мы проанализировали связь между уровнем экспрессии БКГ и микроРНК и клинико-патологическими характеристиками образцов от больных РМЖ и обнаружили, что уровень экспрессии генов CHL1, AXL статистически значимо (p < 0.05, критерий Манна–Уитни) снижался на более поздних стадиях (III–IV против I–II) РМЖ, в то время как уровень экспрессии гена BCL6, а также микроРНК miR-339-3p достоверно увеличивался на III–IV стадии по сравнению с I–II стадией РМЖ (рис. 2а). Отмечено снижение уровня экспрессии miR-148a-3р при наличии метастазов в лимфатических узлах (N0M0 против NxMx, р = 0.02), а для гена BCL6 увеличение уровня экспрессии связано с увеличением размера опухоли (Т1/Т2 против Т3/Т4, р < 0.05) (рис. 2б). Таким образом, полученные данные указывают на возможную негативную роль генов CHL1 и AXL, а также miR-148a-3р в сдерживании прогрессии или метастазирования РМЖ, но позитивную роль BCL6 и miR-339-3p – в прогрессии РМЖ.
Связь уровня экспрессии БКГ и микроРНК с иммуногистохимическими показателями образцов РМЖ
Проведен анализ изменения уровня экспрессии БКГ и микроРНК в зависимости от иммуногистохимического статуса опухоли больных РМЖ (экспрессия ER, PR, HER2, Ki-67, рис. 3а–д). Показано статистически значимое повышение уровня экспрессии TGFB2 в люминальном типе Б по сравнению с типом А (рис. 3а), что позволяет отнести данный ген к потенциальному биомаркеру при дифференциальной диагностике типа РМЖ. Выявлено снижение уровня экспрессии BCL6 в опухолях РМЖ с ER-отрицательным статусом по сравнению с ER-положительным (рис. 3б). Показано статистически значимое снижение уровня экспрессии гена BCL6, miR-375 и miR-24-2-5р в опухолях молочной железы, не экспрессирующих рецептор прогестерона (PR) (рис. 3в).
Рис. 3.
Связь уровня экспрессии БКГ и микроРНК с иммуногистохимическими показателями образцов РМЖ: а – с иммуногистохимическим типом опухоли (люминальный А/люминальный Б), б – с экспрессией рецептора эстрогена, в – с экспрессией рецептора прогестерона, г – с экспрессией рецептора эпидермального фактора роста 2-го типа, д – с индексом пролиферации Ki-67.
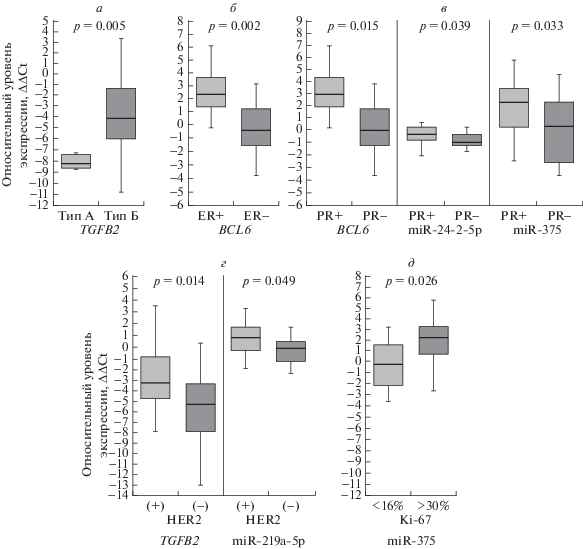
При сопоставлении уровня экспрессии БКГ и микроРНК с экспрессией рецептора эпидермального фактора роста 2-го типа (HER2) было показано, что уровень экспрессии гена TGFB2 и miR-219 значимо снижался при отсутствии экспрессии HER2 (рис. 3г). В то же время отмечалось статистически значимое увеличение уровня экспрессии miR-375 в опухолях молочной железы при высоком уровне экспрессии антигена Ki-67 (рис. 3д).
ОБСУЖДЕНИЕ
В нашей работе построены профили экспрессии пяти БКГ и семи микроРНК, показано значимое снижение уровня экспрессии генов CHL1, AXL, ACSL1, TGFB2 в опухолевых образцах РМЖ по сравнению с гистологически неизмененной тканью молочной железы. В то же время отмечено статистически значимое повышение уровня экспрессии гена BCL6 в опухоли по сравнению с гистологически неизмененной тканью молочной железы. Функция CHL1 в канцерогенезе недостаточно изучена, и механизм, посредствам которого CHL1 участвует в развитии опухоли, является важным вопросом в биологии. В работе [20] показано снижение уровня экспрессии CHL1 в опухолях молочной железы, а также сообщается, что сниженная экспрессия CHL1 способствует пролиферации и инвазии клеток РМЖ как in vitro, так и in vivo. Кроме того, нами впервые показано снижение уровня экспрессии мРНК CHL1 на более поздних стадиях (III–IV) РМЖ. Противоречивые данные встречаются в зарубежной литературе в отношении уровня экспрессии гена AXL. В работах [21, 22] говорится о повышенной экспрессии AXL при РМЖ. В настоящей работе выявлено снижение уровня экспрессии гена AXL в опухолевых образцах молочной железы. Однако другими авторами показано, что экспрессия мРНК AXL значительно повышена в клеточной линии РМЖ MDA-MB-231, но снижена в клеточных линиях РМЖ MCF7 и SK-BR-3 [23], что согласуется с полученными нами данными. Более того, из 343 образцов инвазивной протоковой карциномы низкая экспрессия AXL обнаружена в 173 (50.4%) случаях, высокая – в 170 (49.6%). Таким образом, требуются дополнительные исследования, уточняющие роль и функцию гена AXL при РМЖ. При сопоставлении уровня экспрессии с клинико-патологическими характеристиками нами отмечено снижение уровня экспрессии AXL при более тяжелой стадии (III) РМЖ. В мировой литературе [21, 24] встречаются указания на корреляцию экспрессии со стадией онкологического процесса, однако говорится о повышенной экспрессии AXL на более поздних стадиях. Сообщается также об отсутствии какой-либо связи экспрессии AXL с клинико-патологическими характеристиками [23]. Противоречивые данные, полученные нами и другими авторами, требуют дополнительного исследования на большей выборке для понимания роли гена AXL в возникновении и развитии РМЖ. В единичных работах [25, 26] говорится о снижении уровня ACSL1 при РМЖ, в частности при люминальном А типе РМЖ, что подтверждается нашими результатами.
Нами показано статистически значимое снижение уровня экспрессии TGFB2 в опухоли по сравнению с гистологически нормальной тканью молочной железы. В работе [27] сообщается, что уровень экспрессии мРНК TGFB2 значительно снижен в более крупных опухолях по сравнению с опухолями молочной железы, имеющих размер T1, а также в опухолях больных с метастазами в лимфатических узлах и с метастазами в другие органы. Однако нами показан более низкий уровень экспрессии мРНК TGFB2 при люминальном А типе РМЖ по сравнению с люминальным Б типом. Эти результаты показывают, что TGFB2 экспрессируется на разных уровнях в зависимости от молекулярных подтипов РМЖ и, следовательно, может выступать в качестве потенциального диагностического маркера при дифференциальной диагностике различных подтипов РМЖ в дополнение к уже используемым маркерам. Более того, нами впервые показан более низкий уровень экспрессии TGFB2 в отсутствие экспрессии HER2, в то время как более высокий уровень экспрессии TGFB2 наблюдался в присутствии HER2.
Нами показано статистически значимое увеличение уровня экспрессии гена BCL6 в опухолевых образцах РМЖ по сравнению с неизмененной тканью молочной железы. Как известно, ген BCL6 играет онкогенную роль в канцерогенезе различных злокачественных новообразований [28]. О повышенной экспрессии BCL6 при РМЖ также сообщалось ранее [28, 29]. Таким образом, полученные нами данные подтверждают данные литературы. Нами показано, что уровень мРНК BCL6 выше на более поздних стадиях РМЖ, что также согласуется с данными других авторов [28]. О связи повышенной экспрессии BCL6 с размером опухоли и более поздними стадиями сообщалось в работах [29, 30], что также подтверждается нашими результатами. Увеличение уровня экспрессии мРНК BCL6 при РМЖ связано с плохими прогностическими признаками, такими как поздняя стадия и больший размер опухоли. Таким образом, ингибиторы BCL6 могут рассматриваться в качестве таргетной терапии РМЖ. Кроме того, нами установлено, что высокая экспрессия BCL6 в значительной степени коррелировала с ER и PR-статусом опухоли; это указывает на то, что BCL6 может способствовать усилению экспресcии ER и PR. Однако его точный механизм действия требует дальнейшего изучения. Показано, что высокая экспрессия белка BCL6 связана с неблагоприятным клиническим исходом у ER-позитивных и пременопаузальных пациенток с РМЖ [31]. О связи повышенной экспрессии BCL6 с положительной экспрессией PR нами сообщается впервые.
Нами показано снижение уровня экспрессии miR-132 и miR-137, а также увеличение уровня экспрессии miR-375 при РМЖ; экспрессия miR-148a-3р, miR-219а-5р, miR-24-2-5р, miR-339-3p оставалась без изменений. Показано, что уровень экспрессии miR-137 был значительно ниже в опухолевых тканях молочной железы по сравнению с таковым в парных смежных нормальных тканях молочной железы [32]. Сниженная экспрессия miR-132-3р и ее функциональная роль в качестве супрессора опухолевого роста показана при различных типах рака, включая РМЖ [33], рак простаты [34], колоректальный рак [35], остеосаркому [36], немелкоклеточный рак легких [37, 38] и гепатоцеллюлярную карциному [39–41]. Однако отмечается повышенная экспрессия miR-132 при глиоме и раке желудка и можно предположить, что miR-132 может служить онкогеном в этих видах рака [42, 43]. Эти сообщения продемонстрировали, что нарушение регуляции экспрессии miR-132 специфично для каждого типа рака, и предполагают, что лежащие в их основе механизмы могут отличаться. Например, микроРНК miR-132 может действовать как супрессор опухолевого роста посредством подавления FOXA1 [44].
Сведения литературы по изменению экспрессии miR-375 в опухолях отличаются неоднозначностью и, по-видимому, специфичны для разных видов рака. Так, например, в одной из работ [45] показано снижение уровня экспрессии miR-375 в клеточных линиях РМЖ MCF-7/ADM и MCF-7/ PTX, которое может являться результатом метилирования промоторного СpG-островка гена MIR-375. Напротив, на ER-позитивных клеточных линиях РМЖ отмечена высокая экспрессия miR-375, которая связана с локальным гипометилированием ДНК [46]. В свою очередь, miR-375 в одних работах рассматривается как новый биологический маркер для раннего выявления метастазов [47], в других – как новый прогностический маркер течения РМЖ [48, 49]. Нами показано увеличение уровня экспрессии miR-375 в опухолевых образцах РМЖ по сравнению с нормальной тканью молочной железы. При этом нами обнаружено снижение уровня экспрессии miR-375 в опухолях молочной железы, не экспрессирующих прогестероновый рецептор (PR). В то же время отмечалось статистически значимое увеличение уровня экспрессии miR-375 в опухолях молочной железы при высоком уровне экспрессии антигена Ki-67, что усиливает наше предположение об онкогенной роли этой микроРНК при РМЖ. Таким образом, и наши результаты показывают неоднозначность поведения miR-375. Так, в зависимости от клеточного контекста miR-375 проявляет как онкогенные, так и супрессорные черты. Корреляция снижения уровня miR-375 с потерей PR может быть полезна при разработке молекулярной классификации подвидов РМЖ.
Таким образом, полученные данные указывают на возможную роль BCL6 и miR-339-3p в прогрессии РМЖ и роль CHL1 и miR-148a-3р в сдерживании прогрессии РМЖ. Кроме того, гены BCL6 и TGFB2, а также микроРНК miR-375, miR-24-2-5р и miR-219 можно отнести к потенциальным биомаркерам при дифференциальной диагностике типа РМЖ.
Работа выполнена за счет средств Российского научного фонда (грант № 20-75-00126); часть исследований, а именно анализ БКГ, – в рамках Государственного задания Минобрнауки РФ.
Все процедуры, выполненные в данной работе, соответствуют этическим стандартам институционального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики. У всех пациентов получено письменное информированное согласие.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
World Health Organization. Global Cancer Observatory (GCO). Available from: URL:https://gco.iarc.fr/today/data/factsheets/cancers/20-Breast-fact-sheet.pdf Accessed 5 Sep 2020.
Bray F., Ferlay J., Soerjomataram I. et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries // CA Cancer J. Clin. 2018. V. 68. № 6. P. 394–424. https://doi.org/10.3322/caac.21492
Ng C.K., Pemberton H.N., Reis-Filho J.S. Breast cancer intratumor genetic heterogeneity: causes and implications // Expert Rev. Anticancer Ther. 2012. V. 12. № 8. P. 1021–1032. https://doi.org/10.1586/era.12.85
Meng L., Xu Y., Xu C., Zhang W. Biomarker discovery to improve prediction of breast cancer survival: Using gene expression profiling, meta-analysis, and tissue validation // Onco Targets Ther. 2016. V. 9. P. 6177–6185. https://doi.org/10.2147/OTT.S113855
Heng Y.J., Lester S.C., Tse G.M. et al. The molecular basis of breast cancer pathological phenotypes // J. Pathol. 2017. V. 241. № 3. P. 375–391. https://doi.org/10.1002/path.4847
Wang J., Ma Z., Carr S.A. et al. Proteome profiling outperforms transcriptome profiling for coexpression based gene function prediction // Mol. Cell Proteomics. 2017. V. 16. № 1. P. 121–134. https://doi.org/10.1074/mcp.M116.060301
Yip C.H., Rhodes A. Estrogen and progesterone receptors in breast cancer // Future Oncol. 2014. V. 10. № 14. P. 2293–2301. https://doi.org/10.2217/fon.14.110
Колядина И.В., Поддубная И.В., Франк Г.А. и др. Прогностическое значение рецепторного статуса опухоли при раннем раке молочной железы // СТМ. 2012. № 4. С. 48–53.
Figueroa-Magalhães M.C., Jelovac D., Connolly R., Wolff A.C. Treatment of HER2-positive breast cancer // Breast. 2014. V. 23. № 2. P. 128–136. https://doi.org/10.1016/j.breast.2013.11.011
Hanahan D. Rethinking the war on cancer // Lancet. 2014. V. 383. № 9916. P. 558–563. https://doi.org/10.1016/S0140-6736(13)62226-6
Брага Э.А., Филиппова Е.А., Логинов В.И. и др. Системы маркеров на основе метилирования генов микроРНК в диагностике рака молочной железы на I–II стадиях // Бюл. эксперим. биологии и медицины. 2019. Т. 168. № 8. С. 238–242.
Gyparaki M.T., Basdra E.K., Papavassiliou A.G. MicroRNAs as regulatory elements in triple negative breast cancer // Cancer Lett. 2014. V. 354. № 1. P. 1–4. https://doi.org/10.1016/j.canlet.2014.07.036
Tomar D., Yadav A.S., Kumar D. et al. Non-coding RNAs as potential therapeutic targets in breast cancer // Biochim. Biophys. Acta Gene Regul. Mech. 2020. V. 1863. № 4. e194378. https://doi.org/10.1016/j.bbagrm.2019.04.005
Sobin L.H., Gospodarowicz M.K., Wittekind Ch. International Union against Cancer. TNM Classification of Malignant Tumours., 7th ed. 2009. Chichester, West Sussex, UK; Hoboken, NJ: Wiley-Blackwell, 2010. 332 p. https://www.ncbi.nlm.nih.gov/nlmcatalog/101511218.
WHO Classification of Tumours of Female Reproductive Organs. 4th ed. / Eds Kurman R.J., Carcangiu M.L., Herrington C.S., Young R.H. Lyon: IARC Press, 2014. 316 p.
Пронина И.В., Логинов В.И., Ходырев Д.С. и др. Уровень экспрессии гена RASSF1А в первичных эпителиальных опухолях разной локализации // Мол. биология. 2012. Т. 46. № 2. С. 260–268. https://doi.org/10.1134/S0026893312010189
Pronina I.V., Loginov V.I., Burdennyy A.M. et al. DNA methylation contributes to deregulation of 12 cancer associated microRNAs and breast cancer progression // Gene. 2017. V. 604. P. 1–8. https://doi.org/10.1016/j.gene.2016.12.018
Пронина И.В., Филиппова Е.А., Лукина С.С. и др. Роль микроРНК в регуляции экспрессии генов AXL, DAPK1, NFIB при раке молочной железы // Патогенез. 2018. Т. 16. № 4. С. 130–133. https://doi.org/10.25557/2310-0435.2018.04.130-133
Wu Z.S., Wu Q., Wang C.Q. et al. MiR-339-5p inhibits breast cancer cell migration and invasion in vitro and may be a potential biomarker for breast cancer prognosis // BMC Cancer. 2010. V. 10. e542. https://doi.org/10.1186/1471-2407-10-542
He L.H., Ma Q., Shi Y.H. et al. CHL1 is involved in human breast tumorigenesis and progression // Biochem. Biophys. Res. Commun. 2013. V. 438. № 2. P. 433–438. https://doi.org/10.1016/j.bbrc.2013.07.093
Li Y., Jia L., Ren D. et al. Axl mediates tumor invasion and chemosensitivity through PI3K/Akt signaling pathway and is transcriptionally regulated by slug in breast carcinoma // IUBMB Life. 2014. V. 66. № 7. P. 507–518. https://doi.org/10.1002/iub.1285
Jin G., Wang Z., Wang J. et al. Expression of Axl and its prognostic significance in human breast cancer // Oncol. Lett. 2017. V. 13. № 2. P. 621–628. https://doi.org/10.3892/ol.2016.5524
Tanaka K., Tokunaga E., Inoue Y. et al. Impact of expression of vimentin and Axl in breast cancer // Clin. Breast Cancer. 2016. V. 16. № 6. P. 520–526. https://doi.org/10.1016/j.clbc.2016.06.015
Li Y., Jia L., Liu C. et al. Axl as a Downstream effector of TGF-β1 via PI3K/Akt-PAK1 signaling pathway promotes tumor invasion and chemoresistance in breast carcinoma // Tumour Biol. 2015. V. 36. № 2. P. 1115–1127. https://doi.org/10.1007/s13277-014-2677-3
Chen W.C., Wang C.Y., Hung Y.H. et al. Systematic analysis of gene expression alterations and clinical outcomes for long-chain acyl-coenzyme A synthetase family in cancer // PLoS One. 2016. V. 11. № 5. e0155660. https://doi.org/10.1371/journal.pone.0155660
Yen M.C., Kan J.Y., Hsieh C.J. et al. Association of long-chain acyl-coenzyme A synthetase 5 expression in human breast cancer by estrogen receptor status and its clinical significance // Oncol. Rep. 2017. V. 37. № 6. P. 3253–3260. https://doi.org/10.3892/or.2017.5610
Hachim M.Y., Hachim I.Y., Dai M. et al. Differential expression of TGFβ isoforms in breast cancer highlights different roles during breast cancer progression // Tumour Biol. 2018. V. 40. № 1. e1010428317748254. https://doi.org/10.1177/1010428317748254
Badr E., Masoud E., Abdou A.G., Eldien M.S. BCL6 mRNA expression level in invasive duct carcinoma not otherwise specified // Clin. Diagn. Res. 2016. V. 10. № 12. P. XC01–XC04. https://doi.org/10.7860/JCDR/2016/22796.8985
Wu Q., Liu X., Yan H. et al. B-cell lymphoma 6 protein stimulates oncogenicity of human breast cancer cells // BMC Cancer. 2014. V. 14. e418. https://doi.org/10.1186/1471-2407-14-418
Ang L., Zheng L., Wang J. et al. Expression of and correlation between BCL6 and ZEB family members in patients with breast cancer // Exp. Ther. Med. 2017. V. 14. № 5. P. 3985–3992. https://doi.org/10.3892/etm.2017.5101
Sato T., Tran T.H., Peck A.R. et al. Prolactin suppresses a progestin-induced CK5-positive cell population in luminal breast cancer through inhibition of progestin-driven BCL6 expression // Oncogene. 2014. V. 33. № 17. P. 2215–2224. https://doi.org/10.1038/onc.2013.172
Chen F., Luo N., Hu Y. et al. MiR-137 suppresses triple-negative breast cancer stemness and tumorigenesis by perturbing BCL11A-DNMT1 interaction // Cell Physiol. Biochem. 2018. V. 47. № 5. P. 2147–2158. https://doi.org/10.1159/000491526
Zhang Z.G., Chen W.X., Wu Y.H. et al. MiR-132 prohibits proliferation, invasion, migration, and metastasis in breast cancer by targeting HN1 // Biochem. Biophys. Res. Commun. 2014. V. 454. P. 109–114. https://doi.org/10.1016/j.bbrc.2014.10.049
Qu W., Ding S.M., Cao G. et al. miR-132 mediates a metabolic shift in prostate cancer cells by targeting Glut1 // FEBS Open Biol. 2016. V. 6. P. 735–741. https://doi.org/10.1002/2211-5463.12086
Zheng Y.B., Luo H.P., Shi Q. et al. miR-132 inhibits colorectal cancer invasion and metastasis via directly targeting ZEB2 // World J. Gastroenterol. 2014. V. 20. № 21. P. 6515–6522. https://doi.org/10.3748/wjg.v20.i21.6515
Wang J., Xu G., Shen F., Kang Y. miR-132 targeting cyclin E1 suppresses cell proliferation in osteosarcoma cells // Tumour Biol. 2014. V. 35. P. 4859–4865. https://doi.org/10.1007/s13277-014-1637-2
Li Y., Zu L., Wang Y. et al. miR-132 inhibits lung cancer cell migration and invasion by targeting SOX4 // J. Thorac Dis. 2015. V. 7. P. 1563–1569. https://doi.org/10.3978/j.issn.2072-1439.2015.09.06
Zhang B., Lu L., Zhang X. et al. Hsa-miR-132 regulates apoptosis in non-small cell lung cancer independent of acetylcholinesterase // J. Mol. Neurosci. 2014. V. 53. № 3. P. 335–344. https://doi.org/10.1007/s12031-013-0136-z
Lei C.J., Yao C., Li D.K. et al. Effect of co-transfection of miR-520c-3p and miR-132 on proliferation and apoptosis of hepatocellular carcinoma Huh7 // Asian Pac. J. Trop. Med. 2016. V. 9. № 9. P. 898–902. https://doi.org/10.1016/j.apjtm.2016.07.015
Lei C.J., Li L., Gao X. et al. Hsa-miR-132 inhibits proliferation of hepatic carcinoma cells by targeting YAP // Cell Biochem. Funct. 2015. V. 33. № 5. P. 326–333. https://doi.org/10.1002/cbf.3119
Wei X., Tan C., Tang C. et al. Epigenetic repression of miR-132 expression by the hepatitis B virus x protein in hepatitis B virus-related hepatocellular carcinoma // Cell Signal. 2013. V. 25. № 5. P. 1037–1043. https://doi.org/10.1016/j.cellsig.2013.01.019
Li W., Zhang J., Chen T. et al. miR-132 upregulation promotes gastric cancer cell growth through suppression of FoxO1 translation // Tumour Biol. 2016. V. 37. P. 15551–15557. https://doi.org/10.1007/s13277-015-3924-y
Liu Q., Liao F., Wu H. et al. Upregulation of miR-132 expression in glioma and its clinical significance // Tumour Biol. 2014. V. 35. P. 12299–12304. https://doi.org/10.1007/s13277-014-2541-5
Wang D., Ren J., Ren H. et al. MicroRNA-132 suppresses cell proliferation in human breast cancer by directly targeting FOXA1 // Acta Pharmacol. Sin. 2018. V. 39. № 1. P. 124–131. https://doi.org/10.1038/aps.2017.89
Liu S.L., Sui Y.F., Lin M.Z. MiR-375 is epigenetically downregulated due to promoter methylation and modulates multi-drug resistance in breast cancer cells via targeting YBX1 // Eur. Rev. Med. Pharmacol. Sci. 2016. V. 20. № 15. P. 3223–3229.
de Souza Rocha Simonini P., Breiling A., Gupta N. et al. Epigenetically deregulated microRNA-375 is involved in a positive feedback loop with estrogen receptor alpha in breast cancer cells // Cancer Res. 2010. V. 70. № 22. P. 9175–9184. https://doi.org/10.1158/0008-5472.CAN-10-1318
Madhavan D., Peng C., Wallwiener M. et al. Circulating miRNAs with prognostic value in metastatic breast cancer and for early detection of metastasis // Carcinogenesis. 2016. V. 37. № 5. P. 461–470. https://doi.org/10.1093/carcin/bgw008
Luo D., Wilson J.M., Harvel N. et al. A systematic evaluation of miRNA:mRNA interactions involved in the migration and invasion of breast cancer cells // J. Transl. Med. 2013. V. 11. e57. https://doi.org/10.1186/1479-5876-11-57
Zehentmayr F., Hauser-Kronberger C., Zellinger B. et al. Hsa-miR-375 is a predictor of local control in early stage breast cancer // Clin. Epigenetics. 2016. V. 8. e28. https://doi.org/10.1186/s13148-016-0198-1
Дополнительные материалы отсутствуют.