Генетика, 2021, T. 57, № 9, стр. 1031-1038
Сравнительное изучение ДНК-повреждающей активности эпихлоргидрина с помощью биосенсоров Escherichia coli и методом ДНК-комет на мышах
К. Г. Орджоникидзе 1, Е. В. Игонина 1, Б. С. Жошибекова 2, С. К. Абилев 1, *
1 Институт общей генетики им. Н.И. Вавилова Российский академии наук
119991 Москва, Россия
2 Казахский национальный женский педагогический университет
090000 Алматы, Казахстан
* E-mail: abilev@vigg.ru
Поступила в редакцию 12.12.2020
После доработки 25.01.2021
Принята к публикации 26.01.2021
Аннотация
Проведено сравнительное изучение генотоксических эффектов метилметансульфоната (ММС) и эпихлоргидрина (ЭХГ) с помощью бактериальных биосенсоров E. coli и метода ДНК-комет на мышах. Показано, что ЭХГ более слабо индуцирует SOS-ответ и экспрессию гена alkA в клетках бактерий, чем ММС. Эксперименты in vivo на мышах с использованием метода ДНК-комет показали ДНК-повреждающую активность ЭХГ и ММС в клетках печени, почек и легких при экспозиции 3 ч. Уровни повреждений ДНК, вызываемых ЭХГ в этих органах при экспозиции 3 ч, оказались ниже, чем для ММС. Генотоксический эффект ЭХГ при экспозиции 18 ч оказался статистически значимым только в клетках почек в дозе 20 мг/кг.
Эпихлоргидрин (ЭХГ) является основным полупродуктом промышленного синтеза глицерина, красителей и поверхностно-активных веществ и для получения синтетических материалов (главным образом, эпоксидных и ионообменных смол) и полимеров, применяемых в различных областях промышленности, а также в медицине.
ЭХГ является высокореакционноспособным и высокотоксичным веществом, отравление которым приводит к тяжелым и часто смертельным последствиям, связанными с алкилированием сульфгидрильных, аминных, карбоксильных групп белков крови и поражениям таких жизненно важных органов, как печень, почки, легкие и мозг [1]. По итогам обширных исследований токсичности, генотоксичности и канцерогенности ЭХГ на грызунах Международное агентство по изучению рака (IARC) в 90-е годы прошлого века включило его в число вероятных канцерогенов для человека–класс 2B [2]. ЭХГ, по данным IARC, вызывает злокачественные лимфомы, гиперплазии, папилломы и карциномы, подкожные фибромы, гипофизарные и легочные опухоли у грызунов, индуцирует повреждения и разрывы ДНК, проявляет мутагенную активность в различных тест-системах, включая бактериальные. Результаты этих исследований легли в основу ряда документов, регулирующих условия его производства и применения, что привело к снижению уровня взаимодействия работников с ЭХГ. В настоящее время ежегодно в мире используется около двух млн тонн ЭХГ в производстве эпоксидных смол и полимеров [3].
Мутагенное действие ЭХГ на людей было показано еще в 70-е и 80-е годы ХХ в. при изучении хромосомных аберраций в лимфоцитах работников, занятых на производстве [4–6]. Итоги изучения генотоксического действия ЭХГ на людей в период 1990–2001 гг. обобщены в обзоре [7]. Результаты изучения генотоксичности ЭХГ на лабораторных животных и на клеточных культурах приведены в работах [3, 8, 9].
ЭХГ содержит активную эпоксидную группу, которая реагирует с нуклеофильными сайтами ДНК и белков, а также хлоридную группу, которая может вступать в реакции с ДНК или белками. Эта особенность структуры ЭХГ придает ему свойства бифункционального алкилирующего агента, способного вызывать кросс-сшивки между нуклеофильными участками ДНК и белков, что и обусловливает его токсические и генотоксические эффекты [3, 10, 11]. В результате реакции эпоксидной группы ЭХГ в клетках образуются 3-хлор-2-гидроксипропиловые аддукты с белками и ДНК, что придает ему свойство монофункционального агента. Формирование стабильных аддуктов 2,3-дигидропропил-гемоглобин показано у крыс и человека после воздействия ЭХГ [12, 13].
В ДНК ЭХГ реагирует преимущественно с гуанином в позиции N-7 так же, как этилметансульфонат (ЭМС) и метилметансульфонат (ММС), которые получили широкое применение в качестве позитивного контроля в генотоксикологических исследованиях как in vitro, так in vivo. Гуанин, замещенный в позиции N-7, является преобладающим аддуктом ДНК, формирующимся при воздействии большинства алкилирующих агентов, и поэтому он является первым маркером воздействия подобных химических веществ. Другие аддукты, например, аддукты ЭХГ с N-3 аденином, могут быть более значимы биологически, однако из-за низких концентраций труднее их анализировать. Поэтому для определения профессионального воздействия ЭХГ на работников используется метод количественного определения 7-(3-хлор-2-гидроксипропил)-гуанина в лейкоцитах человека [13].
Соотношение кросс-сшивок и стабильных аддуктов, образуемых ЭХГ с белками и ДНК, зависит от экспериментальной системы. Так, цитотоксичность ЭХГ преимущественно считается следствием его способности вызывать крос-сшивки с белками и ДНК, тогда как генотоксические эффекты ЭХГ могут быть следствием образования как аддуктов с ДНК, так и сшивок. В последнее время растет интерес к изучению генотоксичности ЭХГ. С одной стороны, это связано с тем, что несмотря на многочисленные исследования генотоксичности ЭХГ в 90-х годах прошлого века, есть не выясненные вопросы о механизме его генотоксичности. С другой – ежегодный рост производства ЭХГ на 4% с целью промышленного синтеза различных синтетических материалов обращает внимание исследователей на необходимость изучения эколого-генетических последствий загрязнения окружающей среды ЭХГ.
Целью настоящей работы является сравнительное изучение индукции ЭХГ и ММС в клетках E. coli, SOS-ответа на повреждение ДНК и алкилтрансферазы в ответ на алкилирование ДНК, а также разрывов ДНК во внутренних органах мышей методом ДНК-комет.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы
В работе использовали два биосенсора на основе штамма E. coli K12: MG1655 (pColD-lux) и MG1655 (pAlkA–lux), несущего рекомбинантную плазмиду с lux-опероном люминесцирующей бактерии Photorhabdus luminescens транскрипционно слитыми с промоторами гена колицина col (cda) и alkA соответственно. Биосенсор MG1655 (pColD-lux) люминесцирует в ответ на повреждение или остановку синтеза ДНК, то есть характеризует уровень SOS-ответа бактерий. MG1655 (pAlkA–lux) люминесцирует в результате активации промотора PalkA в ответ на алкилирование ДНК.
Штаммы предоставлены Г.Б. Завильгельским и И.В. Мануховым (ГосНИИгенетика, Москва). Генотип штамма и карта рекомбинантной плазмиды приведены в работе [14].
Процедура определения люминесценции биосенсоров
Культуры клеток E. coli выращивали на полноценной среде Луриа-Бертани (LB) с добавлением ампициллина в конечной концентрации 100.0 мкг/мл в течение ночи при температуре 37°С. Ночную культуру разбавляли свежей средой в 10 раз (1 × × 106 клеток/мл). Измерения проводили на денситометре DEN-1B (“Biosan”). Затем суспензию подращивали в течение 2 ч при 37°С на шейкере до ранней логарифмической фазы.
Для определения активных концентраций генотоксикантов аликвоты культуры (по 180 мкл) переносили в стерильные ячейки планшета, в них же добавляли индукторы в разных концентрациях в объеме 20 мкл, в качестве контроля использовали дистиллированную воду или соответствующий растворитель. Через 60 и 90 мин инкубации планшетов при 37°С проводили измерения люминесценции на микропланшетном ридере StatFax 4400, Awareness Technology Inc. (США).
Оценка генотоксичности на мышах in vivo
Для изучения ДНК-повреждающей активности ЭХГ и ММС в клетках различных органов мышей использовали метод ДНК-комет (Comet Assay). Эксперименты проводили in vivo согласно протоколу OECD 489 [15] и рекомендациям по in vivo Сomet assay [16]. Метод основан на электрофоретической подвижности ДНК заранее лизированных и помещенных в агарозный гель клеток. Под влиянием электрического поля ДНК мигрирует к аноду в виде отдельных фрагментов или петель и формирует электрофоретический след, напоминающий хвост кометы, параметры которого зависят от количества разрывов в ДНК. Нами был использован щелочной вариант метода, позволяющий выявлять, помимо двухнитевых разрывов ДНК, однонитевые разрывы и щелочно-лабильные сайты [17].
ЭХГ и ММС вводили мышам внутрибрюшинно в дозах 20 и 60 мг/кг. В качестве отрицательного контроля использовали воду. В каждой группе было пять половозрелых самцов мышей линии BALB/c массой тела 25 г с экспозицией 3 и 18 ч.
Для получения гель-слайдов использовали предметные стекла, предварительно покрытые 1%-ным агарозным гелем (Sigma, тип II, США). Исследуемые клетки заключали в гель легкоплавкой агарозы (Sigma, тип VIIa, США), приготовленной на фосфатно-солевом буферном растворе (ФСБ) при 37°С и наносили на подготовленные гель-слайды. После этого иммобилизованные клетки подвергали лизису (10 мМ Tрис-HCl (pH 10), 2.5 M NaCl, 100 мM ЭДТА-Na, 1%-ный Tритон-Х100 и 10%-ный диметилсульфоксид) при температуре 4°С в темноте в течение 1 ч.
Денатурацию ДНК в течение 20 мин и электрофорез проводили в щелочных условиях (0.3 М NaOH, 1 мМ ЭДТА-Na, рН 13; 25 V, 300 mA, 20 мин). После электрофореза препараты подвергали нейтрализации в течение 15 мин (0.4 M Tris-HCl pH 7.5), фиксировали и окрашивали флуоресцирующим красителем SYBR Green I. Анализ микропрепаратов проводили на флуоресцентном микроскопе “Axioplan 2 Imaging” (Carl Zeiss, Germany) с использованием высокочувствительной камеры CV-M4+CL (JAI, Japan) и программного обеспечения Comet Imager 2.0. В качестве показателя поврежденности ДНК, в соответствии с рекомендациями OECD [15–17], использовали процентное содержание ДНК в хвосте кометы, отражающее относительное количество фрагментов ДНК, мигрирующих к аноду при электрофорезе. От каждого животного анализировали не менее 100 клеток печени, почек и легких на процент ДНК в хвосте кометы и подсчитывали среднее значение медианы по группе. Согласно рекомендациям OECD 489 Guideline (2016), медиана процентного содержания ДНК в хвосте комет определялась для каждого животного (не менее 100 клеток на животное, полученных с двух слайдов), после чего подсчитывалось среднее значение медианы по группе.
Статистическая обработка
Все данные, полученные с использованием биосенсоров, подвергали статистической обработке с вычислением среднего значения и его ошибки. Значимость различий средних значений оценивали с использованием t-критерия Стьюдента. Для статистической обработки данных, полученных методом ДНК-комет, использовали непараметрический тест Манна–Уитни и программу SPSS Statistics v.25.
РЕЗУЛЬТАТЫ
Определение генотоксичности на E. coli
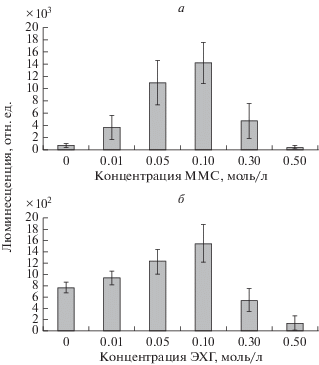
Известно, что алкилирующие химические соединения обладают генотоксическими свойствами и индуцирует SOS-ответ в клетках E. сoli [18, 19]. В индукции SOS-ответа важную роль играют продукты генов lexA и recA, а также наличие однонитевых разрывов в ДНК, которые возникают как при прямой индукции разрывов, так и при блокировании синтеза повреждающими ДНК агентами [20]. Из наших результатов, представленных на рис. 1, следует, что ММС и ЭХГ индуцируют SOS-ответ у биосенсора MG1655 (pColD-lux), и это свидетельствует об их способности повреждать ДНК. Однако уровень отклика у биосенсора MG1655 (pColD-lux) на воздействие ММС был на порядок выше, чем у ЭХГ. Например при концентрации в 0.1 моль/л люминесценция при действии ЭХГ составила 1500 отн. ед., тогда как при действии ММС – 14 000 отн. ед.
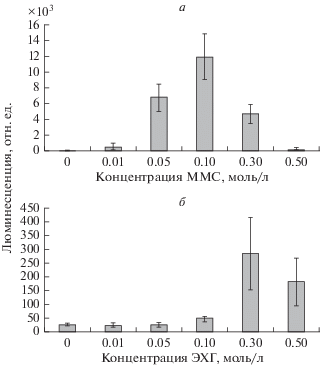
Для изучения способности ММС и ЭХГ алкилировать ДНК был использован биосенсор MG1655 (pAlkA–lux), который люминесцирует при индукции гена adaA в ответ на алкилирование ДНК [21]. Из рис. 2 видно, что ММС активно индуцирует экспрессию гена adaA, тогда как ЭХГ является слабым индуктором этого гена. Сравнение количественных показателей индукции люминесценции, характеризующих уровень экспрессии гена adaA, показало, что при действии ММС в концентрации 0.1 моль/л интенсивность люминесценции составляет 12 000 отн. ед., тогда как при действии ЭХГ статистически значимая индукция люминесценции происходит в концентрациях 0.3 и 0.5 моль/л. При этом максимальная интенсивность люминесценции при действии ЭХГ и концентрации 0.3 моль/л составляет 285 отн. ед., что в 42 раза меньше люминесценции MG1655 (pAlkA–lux) при действии ММС в концентрации 0.1 моль/л.
Важным показателем индукции люминесценции является амплитуда ответа биосенсора, то есть отношение показателя люминесценции при действии изучаемого фактора к показателю спонтанного уровня люминесценции биосенсора в контроле. Амплитуда ответа биосенсора MG1655 (pAlkA–lux) при действии ММС составила 480 отн. ед., при действии ЭХГ – 10.
Определение генотоксичности в клетках внутренних органов мышей
В работе анализировали уровень поврежденности ДНК в клетках печени, почек и легких мышей, получавших ММС и ЭХГ в дозах 20 и 60 мг/кг и 3 и 18 ч экспозиции. В качестве показателя уровня поврежденности ДНК определяли процентное содержание (%) ДНК в хвосте “кометы”. Этот показатель характеризует количество ДНК, высвободившееся из ядра при электрофорезе и мигрирующего в сторону анода (хвост кометы). Такое поведение ДНК является результатом как спонтанных и индуцированных разрывов в цепи ДНК, так и щелочелабильных апуриновых и апиримидиновых сайтов, которые при щелочном электрофорезе реализуются в разрывы. Полученные результаты приведены в табл. 1. ММС и ЭХГ в дозах 20 и 60 мг/кг при 3 ч экспозиции достоверно повышали показатель содержания (%) ДНК в хвосте кометы в клетках печени, почек и легких мышей по сравнению с контролем. ММС проявил генотоксичность и при 18 ч экспозиции в обеих дозах. ЭХГ, в отличие от ММС, при 18 ч экспозиции проявил активность только в клетках почек мышей в дозе 20 мг/кг.
Таблица 1.
ДНК-повреждающее действие ММС и ЭХГ в клетках печени, почек и легких мышей
| Экспозиция | Вариант | Печень, % ДНК в хвосте | Почки, % ДНК в хвосте | Легкие, % ДНК в хвосте |
|---|---|---|---|---|
| 3 часа | Контроль, вода | 7.98 ± 0.66 | 5.39 ± 1.13 | 4.19 ± 0.36 |
| ММС, 20 мг/кг | 28.83 ± 6.61** | 38.77 ± 6.48** | 39.61 ± 6.12** | |
| ММС, 60 мг/кг | 36.68 ± 8.26 ** | 51.58 ± 11.45** | 62.88 ± 3.37** | |
| ЭХГ, 20 мг/кг | 17.17 ± 0.93** | 12.28 ± 1.46** | 7.70 ± 0.53** | |
| ЭХГ, 60 мг/кг | 19.08 ± 1.01** | 14.43 ± 1.21** | 10.60 ± 1.40* | |
| 18 часов | Контроль, вода | 14.83 ± 1.54 | 8.75 ± 0.33 | 7.06 ± 0.75 |
| ММС, 20 мг/кг | 27.23 ± 1.40** | 28.37 ± 0.91** | 25.17 ± 2.51** | |
| ММС, 60 мг/кг | 37.72 ± 1.58** | 36.32 ± 2.00** | 36.99 ± 2.36** | |
| ЭХГ, 20 мг/кг | 13.71 ± 0.89 | 17.74 ± 5.15* | 10.16 ± 2.26 | |
| ЭХГ, 60 мг/кг | 11.94 ± 1.03 | 10.48 ± 1.18 | 7.89 ± 0.29 |
Более детальный анализ полученных данных приведен на диаграммах “ящик с усами” (Box Plot) (рис. 3), которые позволяют проводить сравнение результатов, полученных при различных сроках экспозиции ММС и ЭХГ для различных органов мышей по таким показателям, как медиана, минимальное и максимальное значение выборки и выбросы, и распределение по квартилям. На рис. 3 представлено распределения числовых значений показателя “% ДНК в хвосте кометы” клеток печени мыши. Для ММС, в отличие от ЭХГ, наблюдается разброс числовых значений показателя “% ДНК в хвосте кометы” от 17 до 40 в случае дозы 20 мг/кг и от 27 до 50 в случае дозе 60 мг/кг. ЭХГ в обеих дозах при экспозиции 18 ч не проявил активности. ММС при экспозиции 18 ч был менее активен, чем при трехчасовой экспозиции, однако в дозе 60 мг/кг был более активен, чем в дозе 20 мг/кг.
Рис. 3.
Результаты анализа индукции ММС и ЭХГ ДНК-комет в клетках печени (а), почек (б) и легких (в) мышей.
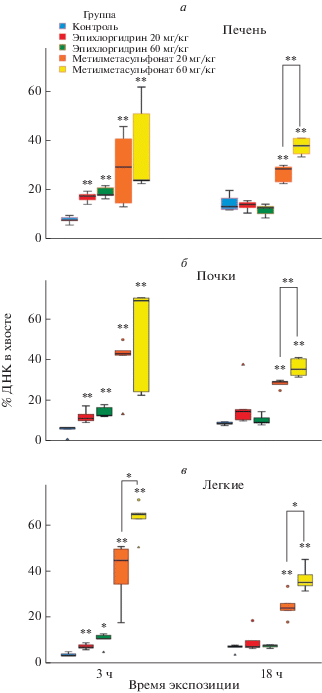
В почках наблюдается такая же картина. Однако при трехчасовой экспозиции ММС в дозе 60 мг/кг показал высокую активность с большим разбросом числовых значений показателя “% ДНК в хвосте кометы”. ЭХГ при экспозиции 3 ч был менее активен, чем ММС, но значимо отличался от контроля. ЭХГ не проявил активности в дозе 60 мг/кг при 18 ч экспозиции, однако ММС проявил высокую активность. Отмечены выбросы как ММС, так и у ЭХГ, при обеих сроках экспозиции. В легких ММС в дозе при экспозиции 3 ч проявил высокую активность с небольшим разбросом числовых значений показателя “% ДНК в хвосте кометы”. ЭХГ повторил картину, полученную на почках. При 18-часовой экспозиции оба соединения показали такую же картину, как на почках. Зафиксированы выбросы как в бóльшую, так и меньшую сторону.
ОБСУЖДЕНИЕ
Алкилирующие вещества по кинетике реакций с биологическими молекулами делятся на два типа: SN1 и SN2. ММС относится к типу SN2 и преимущественно реагирует с однонитевой ДНК, приводя к образованию N1-метиладенина и N3‑метилцитозина, а при воздействии на двунитевую ДНК, как правило, в 70–80% случаев метилирует N7-позицию гуанина [22, 23]. Н3-метиладенин, который является вторым по распространенности продуктом алкилирования двунитевой ДНК, удаляется из нее 3-метиладенин-ДНК-гликозилазой, продуктом гена adaA, экспрессия которого контролируется сенсорным белком Ada. Поэтому уровень экспрессии гена adaA, регистрируемый по люминесценции биосенсора E. coli K12 MG1655 (pAlkA–lux), отражает уровень индукции белка Ada в ответ на алкилирование. У E. coli белку Ada присущи две функции – репарационная (репарация О6-алкилгуанина и О4-метилтимина) и регуляторная (усиление транскрипции) четырех генов ada-регулона – ada, alkA, alkB и aid. Активация белка Ada, как регулятора транскрипции, происходит в результате его алкилирования. Метилирование N-Ada домена приводит к повышению аффинности этого белка к промоторным участкам Ada-регулона и превращает его в сильный транскрипционный активатор [23–25]. Данное свойство белка Ada может быть причиной большой разницы между ММС и ЭХГ в индукции люминесценции у E. coli K12 MG1655 (pAlkA–lux). В наших экспериментах ММС в концентрации 0.1 моль/л вызвала интенсивность люминесценции E. coli K12 MG1655 (pAlkA–lux), что составило 14 000 отн. ед., тогда как при действии ЭХГ в концентрации 0.3 моль/л – 285 отн. ед., что в 42 раза меньше люминесценции MG1655 (pAlkA–lux) при действии ММС в концентрации 0.1 моль/л.
Если сравнивать отношение показателя люминесценции при действии изучаемых соединений к показателю спонтанного уровня люминесценции биосенсора в контроле, то ответ биосенсора MG1655 (pAlkA–lux) при действии ММС составил 480, а при действии ЭХГ – 10. ММС может алкилировать как ДНК, так и белки путем прямого переноса метильной группы на сайты алкилирования, тогда как ЭХГ образует как аддукты, так и сшивки. Последнее обстоятельство может резко снизить аффинность белка Ada к промоторным участкам Ada-регулона, что приводит к резкому снижению экспрессии гена alkA.
В наших экспериментах in vivo методом ДНК-комет на мышах ММС и ЭХГ статистически значимо повышали уровень содержания ДНК в хвосте кометы по сравнению с контролем в клетках печени, почек и легких при экспозиции 3 ч в дозах 20 и 60 мг/кг. Однако генотоксический эффект ЭХГ при экспозиции 18 ч оказался статистически значимым только в клетках почек в дозе 20 мг/кг. ММС при экспозиции 18 ч, в отличие от ЭХГ, проявил генотоксичность во всех органах и в обеих дозах (табл. 1). Уровень повреждений ДНК, вызываемый ЭХГ в клетках печени при экспозиции 3 ч, оказался ниже, чем для ММС, что может быть следствием биотрансформации ЭХГ в печени.
Результаты изучения органной специфичности ММС согласуются с результатами ранее опубликованного исследования методом ДНК-комет [26]. В этой работе было показано, что ММС вызывает повреждения ДНК в клетках печени, почек и костного мозга при экспозиции 4 и 24 ч. При этом при экспозиции 4 ч генотоксичность ММС была выше, чем при экспозиции 24 ч, что может быть следствием процессов детоксикации и репарации, которые приводят к снижению общего количества поврежденных клеток.
Исследование генотоксичности методом ДНК-комет на восьми органах мышей 22 монофункциональных алкилирующих агентов и десяти кросс-сшивателей показали, что все тестированные химические агенты показали генотоксичность по крайней мере в одном органе. Кросс-сшиватели, включая ЭХГ, показали более высокую активность в клетках органов желудочно-кишечного тракта по сравнению с печенью и легкими [27]. Сравнительное исследование цитотоксичности противоопухолевого препарата метхлорамина (МХА) диэпоксибутана (ДЭБ) и ЭХГ на культуре человеческих лейкемических клеток HL-60 методом ДНК-комет показало, что цитотоксичность их зависит от концентрации и продолжительности воздействия. По цитотоксичности они располагались в следующем порядке: МХА > ДЭБ > ЭХГ, который коррелировал с уровнем кросс-сшивок ДНК–ДНК и ДНК–белок в клетках. ЭХГ вызывал меньше сшивок, чем ДЭБ, однако они отличались стабильностью, что может привести к блокировке клеточного цикла и последующего запуска апоптоза. Проведенные количественные эксперименты с использованием ПЦР в реальном времени показали, что обработка клеток HL-60 ДЭБ и ЭХГ приводит к усилению экспрессии ряда генов, участвующих во внутреннем (митохондриальном) пути апоптоза [10].
Исследование скорости репарации разрывов ДНК, индуцированных ЭХГ, в культуре фибробластов человека выявило, что в течение 2 ч после воздействия низкой концентрации (0.1 мМ) восстанавливается до 50%, а при высокой концентрации (0.2 мМ) – 26% двунитевых разрывов. Однако через 18 ч после воздействия ЭХГ в низкой концентрации восстановление разрывов ДНК было незначительным, при более высокой концентрации наблюдалось быстрое накопление двунитевых разрывов, что, вероятно, является результатом апоптоза клеток и деградации ДНК [28].
В конечном генотоксическом эффекте ЭХГ, особенно в экспериментах in vivo с грызунами, большую роль играет его биотранcформация, спектр и уровень которой разнятся по органам, а также скорость репарации разрывов ДНК. Например эпоксидгиролаза способна инактивировать ЭХГ [29, 30]. Низкий уровень показателя “% ДНК в хвосте кометы” при экспозиции 18 ч ЭХГ в высокой дозе может быть следствием большого количества сшивок, приведших как к апоптозу клеток, так и инактивацией его эпоксидгидролазой.
Таким образом, сравнительное изучение генотоксических эффектов ММС и ЭХГ с помощью бактериальных биосенсоров E. coli показало, что ЭХГ более слабо индуцирует SOS-ответ и экспрессию гена alkA в клетках бактерий, чем ММС. В экспериментах in vivo на мышах с использованием метода ДНК-комет ЭХГ показал ДНК-повреждающую активность в клетках печени, почек и легких при экспозиции 3 ч, так же, как и ММС. При этом ДНК-повреждающая активность ЭХГ оказалась ниже, чем активность ММС. ЭХГ при экспозиции 18 ч проявил ДНК-повреждающую активность только в дозе 20 мг/кг и в клетках почек. Отсутствие генотоксического эффекта ЭХГ в дозе 60 мг/кг в печени и легких мышей может быть следствием процессов биотрансформации его в этих органах или следствием апоптоза и деградации ДНК, вызванных большим количеством сшивок.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта людей.
Все применимые международные, национальные и/или институциональные принципы ухода и использования животных были соблюдены.
Авторы заявляют, что у них нет конфликтов интересов.
Список литературы
Lawrence W.H., Malikj M., Autian J. Toxicity profile of epichlorohydrin // J. Farm. Sci. 1972. V. 61. № 11. P. 1712–1717.
IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Epichlorohydrin. Lyon, France: IARC, 1999. V. 71. P. 603–628.
Passang T., Millard J.T. Epichlorohydrin-induced DNA-protein cross-links in human leukemia cells // FASEB J. 2019. V. 33.1. Suppl. 457–517. https://doi.org/10.1096/fasebj.2019.33.1supplement.457.17
Kučerová, M., Zhurkov, V.S., Polívková, Z. et al. Mutagenic effect of epichlorohydrin. II. Analysis of chromosomal aberrations in lymphocytes of persons occupationally exposed to epichlorohydrin // Mutat. Res. 1977. V. 48. P. 355–360. https://doi.org/10.1016/0027-5107(77)90178-6
Šrám R.J., Zudová Z., Kuleshov N.P. Cytogenetic analysis of peripheral lymphocytes in workers occupationally exposed to epichlorohydrin // Mutat. Res. 1980. V. 70. P. 115–120. https://doi.org/10.1016/0027-5107(80)90064-0
Srám R.J., Tomatis L., Clemmesen J., Bridges B.A. An evaluation of the genetic toxicity of epichlorohydrin. A report of an expert group of the International Commission for Protection against Environmental Mutagens and Carcinogens // Mutat. Res. 1981. Nov. V. 87(3). P. 299–319.
Kolman A., Chovanec M., Golkar O.S. Genotoxic effects of ethylene oxide, propylene oxide and epichlorohydrin in humans: Update review (1990–2001) // Mutat. Res./Rev. in Mutat. Res. 2002. V. 512. P. 173–194.
Giri A.K. Genetic toxicology of epichlorohydrin: A review // Mutat. Res. 1997. V. 386. № 1. P. 25–38. https://doi.org/10.1016/s1383-5742(96)00042-7
Rossi A.M., Migliore L., Lascialfari D. et al. Genotoxicity, metabolism and blood kinetics of epichlorohydrin in mice // Mutat. Res. 1983. V. 118. № 3. P. 213–226. https://doi.org/10.1016/0165-1218(83)90144-1
Phuong M. Le, Silvestri V.L., Redstone S.C. et al. Cross-linking by epichlorohydrin and diepoxybutane correlates with cytotoxicity and leads to apoptosis in human leukemia (HL-60) cells // Toxicol. Appl. Pharmacol. 2018. V. 352. P. 19–27. https://doi.org/10.1016/j.taap.2018.05.020
Romano K.P., Newman A.G., Zahran R.W. et al. DNA interstrand cross-linking by epichlorohydrin // Chem. Res. Toxicol. 2007. V. 20. № 5. P. 832–838. https://doi.org/10.1021/tx700066h
Hindsø Landin H., Segerbäck D., Damberg C. et al. Adducts with haemoglobin and with DNA in epichlorohydrin-exposed rats // Chem. Biol. Interact. 1999. V. 117. P. 49–64. https://doi.org/10.1016/S0009-2797(98)00099-4
Plna K., Osterman-Golkar S., Nogradi E. et al. 32P-post-labeling of 7-(3-chloro-2-hydroxypropyl)-guanine in white blood cells of workers occupationally exposed to epichlorohydrin // Carcinogenesis. 2000. V. 21. № 2. P. 275–280. https://doi.org/10.1093/carcin/21.2.275
Котова В.Ю., Манухов И.В., Завильгельский Г.Б. Lux-биосенсоры для детекции SOS-ответа, теплового шока и окислительного стресса // Биотехнология. 2009. № 6. С. 16–25. https://doi.org/10.1134/S0003683810080089
OECD. Test № 489: In Vivo Mammalian Alkaline Comet Assay, OECD Guidelines for the Testing of Chemicals, Section 4. Paris: OECD Publishing, 2016. 26 p.
Tice R.R., Agurell E., Anderson D. et al. Single cell gel/comet assay: Guidelines for in vitro and in vivo genetic toxicology testing // Environ. Mol. Mutagen. 2000. V. 35. № 3. P. 206–221. https://doi.org/10.1002/(SICI)1098-2280(2000)35:33. 0.CO;2-J
Hartmann A., Agurell E., Beevers C. et al. Recommendations for conducting the in vivo alkaline Comet assay // Mutagenesis. 2003. V. 18. № 1. P. 45–51. https://doi.org/10.1093/mutage/18.1.45
Игонина Е.В., Марсова М.В., Абилев С.К. Lux-биосенсоры: скрининг биологически активных соединений на генотоксичность // Экол. генетика. 2016. Т. 14. С. 52–62. https://doi.org/10.17816/ecogen14452-62
Manukhov I.V., Kotova V.Yu., Zavilgelsky G.B. Action of 1,1-dimethylhydrazine on bacterial cells is determined by hydrogen peroxide // Mutat. Res. 2007. V. 634. P. 176–179. https://doi.org/10.1016/j.mrgentox.2007.07.012
Завильгельский Г.Б. SOS-репарации 60 лет // Мол. биология. 2013. Т. 17. № 5. С. 699–706. https://doi.org/10.7868/S0026898413050224
Sedgwick B., Batesb P.A., Paik J. et al. Repair of alkylated DNA: Recent advances // DNA Repair. 2007. V. 6. № 4. P. 429–442. https://doi.org/10.1016/j.dnarep.2006.10.005
Mielecki D., Grzesiuk E. Ada response – a strategy for repair of alkylated DNA in bacteria // FEMS Microbiol. Lett. 2014. V. 355. № 1. P. 1–11. https://doi.org/10.1111/1574-6968
Sakumi K., Igarashi K., Sekiguchi M. et al. The Ada protein is a class I transcription factor of Escherichia coli // J. Bacteriol. 1993. V. 175. P. 2455–2457. https://doi.org/10.1128/jb.175.8.2455-2457.1993
Landini P., Volkert M.R. Regulatory responses of the adaptive response to alkylation damage: A simple regulon with complex regulatory features // J. Bacteriology. 2000. V. 182. № 23. P. 6543–6549. https://doi.org/10.1128/JB.182.23.6543-6549.2000
Mielecki D., Wrzesiński M., Grzesiuk E. Inducible repair of alkylated DNA in microorganisms // Mutat. Res. 2015. V. 763. P. 294–305. https://doi.org/10.1016/j.mrrev.2014.12.001
Oshida K., Iwanaga E., Miyamoto-Kuramitsu K. , Miyamoto Y. An in vivo comet assay of multiple organs (liver, kidney and bone marrow) in mice treated with methyl methanesulfonate and acetaminophen accompanied by hematology and/or blood chemistry // J. Toxicol. Sci. 2008. V. 33. № 5. P. 515–524. https://doi.org/10.2131/jts.33.515
Tsuda S., Matsusaka N., Madarame H. et al. The alkaline single cell electrophoresis assay with eight mouse organs: Results with 22 mono-functional alkylating agents (including 9 dialkyl N-nitrosoamines) and 10 DNA crosslinkers // Mutat. Res. 2000. Apr 13. V. 467(1). P. 83–98. https://doi.org/10.1016/s1383-5718(00)00014-0
Chovanec M., Näslund M., Spivak I. et al. Rejoining of DNA strand breaks induced by propylene oxide and epichlorohydrin in human diploid fibroblasts // Environ. and Mol. Mutagenesis. 1998. V. 32. № 3. P. 223–228. https://doi.org/10.1002/(sici)1098-2280(1998)32:3<223:: aid-em4>3.0.co;2-9
Rossi A.M., Migliore L., Lascialfari D. et al. Genotoxicity, metabolism and blood kinetics of epichlorohydrin in mice // Mutat. Res. 1983. V. 118. № 3. P. 213–226. https://doi.org/10.1016/0165-1218(83)90144-1
Rossi A.M., Migliore L., Loprieno N. et al. Valuation of epichlorohydrin (ECH) genotoxicity: Microsomal epoxide hydrolase-dependent deactivation of ECH mutagenicity in Schizosaccharomyces pombe in vitro // Mut. Res./Fund. and Mol. Mechanisms of Mutagenesis. 1983. V. 109. Iss. 1. P. 41–52. https://doi.org/10.1016/0027-5107(83)90093-3
Дополнительные материалы отсутствуют.