Генетика, 2022, T. 58, № 11, стр. 1334-1346
Гиперметилирование промоторов генов в лейкоцитах крови облученных лиц – итоги исследований
Н. С. Кузьмина 1, 2, *, Н. Ш. Лаптева 1, А. В. Рубанович 1
1 Институт общей генетики им. Н.И. Вавилова Российской академии наук
119991 Москва, Россия
2 Институт химической физики им. Н.Н. Семенова Российской академии наук
119991 Москва, Россия
* E-mail: nin-kuzmin@yandex.ru
Поступила в редакцию 21.04.2022
После доработки 20.05.2022
Принята к публикации 24.05.2022
- EDN: LZPXWC
- DOI: 10.31857/S0016675822110066
Аннотация
С помощью метода метилчувствительной ПЦР проведено изучение гиперметилирования СpG-островков промоторов четырех генов (р53, АТМ, SOD3, ESR1) в лейкоцитах крови облученных лиц (100 чел.: ликвидаторы аварии на ЧАЭС, профессионалы-атомщики г. Сарова, жители территорий с радионуклидными загрязнениями) и у 140 человек контрольной группы. Полученные данные существенно дополнили и позволили подытожить результаты по изучению на протяжении нескольких лет радиационно-индуцированного гиперметилирования промоторов генов в различных контингентах лиц, подвергшихся хроническому или фракционированному облучению в широком диапазоне доз. Показана дифференциальная значимость возраста и радиационного воздействия в метилировании CpG-островков промоторов разных генов, что демонстрируют однонаправленные эффекты, наблюдаемые в независимых выборках облученных лиц. ROC-анализ показал высокую информативность рассмотрения выявляемых эпигенетических нарушений как биомаркеров перенесенного облучения (AUC = 0.846 ± 0.015, р = 1.5Е-48). Гиперметилирование CpG-островков генов RASSF1A и р14/ARF зависит от возраста, а эпигенетическая модификация локусов p16/INK4A и GSTP1 высоко значимо ассоциирована с радиационным воздействием, что верифицировано на двух тестовых выборках обследованных индивидов. Выявленный дозозависимый характер гиперметилирования изученных генов косвенно подтверждается наличием положительной ассоциативной связи между уровнем аберраций хромосомного типа и частотой метилированных локусов (r = 0.604, p = 2.3E-11).
Многолетний мониторинг генетического статуса представителей облученных локальных популяций, участников ликвидации радиационных катастроф, лиц, подвергшихся радиационному воздействию в результате профессиональной деятельности, проводимый как нами, так и другими исследователями (анализ аберраций хромосом, разрывов ДНК, мутаций генов и мини-/микросателлитных локусов) свидетельствует о повышенном уровне соматического мутагенеза в ближайшие и отдаленные сроки после экспонирования [1–5]. Эпигенетические эффекты – новый аспект последствий радиационного воздействия на организм человека. Их изучение представляет собой не только фундаментальную проблему, связанную с оценкой закономерностей действия радиации и реальных рисков облучения в широком диапазоне доз, но и важно с точки зрения прикладных аспектов радиационной медицины. Исходя из последних достижений эпигенетики, изучение таких локус-специфических изменений метилирования ДНК как гиперметилирование промоторов ряда генов в нормальных лейкоцитах облученного человека представляется крайне важным и актуальным. Эти биомаркеры отдаленного радиационного воздействия могли бы иметь очевидную прогностическую ценность в отношении здоровья облученного индивида [6].
Ранее нами были впервые исследованы эпигенетические изменения четырех локусов (RASSF1A, p16/INK4A, p14/ARF, GSTP1) в двух независимых выборках облученных лиц и показана значимость радиационного фактора в индукции гиперметилирования CpG-островков промоторов ряда генов в лейкоцитах крови, выявляемого в отдаленные сроки после перенесенного облучения [7, 8]. Очевидно, что для оценки прогностического потенциала выявляемых отдаленных эпигенетических нарушений как маркеров радиационного воздействия требуется расширение спектра исследуемых генов с охватом различных контингентов облученных лиц. Для решения этой проблемы также требуется проанализировать связь рассматриваемых модификаций с поврежденностью генома, регистрируемой в виде цитогенетических нарушений – аберраций хромосомного типа, характерных преимущественно для радиационного воздействия при отсутствии явных доказательств их сопряженности с индукцией тех или иных патологий [6]. В рамках предыдущих работ нами уже было изучено гиперметилирование промоторов восьми генов в лейкоцитах крови сотрудников реакторного и радиохимического производств, подвергшихся пролонгированному внешнему воздействию γ-излучения или сочетанному внешнему (γ-лучи)/ внутреннему (α-частицы) облучению [8–10].
В настоящей работе продолжено изучение гиперметилирования промоторов генов клеточного цикла (р53, АТМ), антиоксидантной защиты (SOD3), эстрогенового рецептора (ESR1) в лейкоцитах крови различных контингентов облученных лиц (ликвидаторы аварии на Чернобыльской АЭС, профессионалы-атомщики г. Сарова, жители территорий с радионуклидными загрязнениями). Полученные результаты существенно дополнили и позволили нам проанализировать совокупность полученных на протяжении нескольких лет данных по выявленным эпигенетическим модификациям в зависимости от дозы, интенсивности воздействующего излучения, возраста и цитогенетического статуса индивида.
МАТЕРИАЛЫ И МЕТОДЫ
Экспериментальная часть данной работы включала в себя обследование 100 облученных лиц (ликвидаторы аварии на Чернобыльской АЭС, профессионалы-атомщики г. Сарова, жители территорий с радионуклидными загрязнениями) и 140 человек контрольной группы. Подробная характеристика облученных лиц этих групп представлена в нашей более ранней публикации [7].
Помимо смешанной выборки лиц, куда вошли вышеперечисленные контингенты, мы обследовали также 149 работников (от 52 до 86 лет) реакторного и радиохимического производств ПО “Маяк” (г. Озерск), подвергшихся пролонгированному внешнему воздействию γ-излучения и сочетанному внешнему (γ-лучи)/внутреннему (α‑частицы, инкорпорированный 239Pu) облучению и представляющих собой однородные группы лиц, имеющих продолжительный стаж работы в условиях одного завода. Контрольная группа включала биологический материал необлученных лиц – жителей г. Озерска, соответствующих по всем общепринятым показателям облученной группе (50 чел.). Уникальный банк ДНК работников ПО “Маяк” создан в клиническом отделе Южно-уральского института биофизики ФМБА России (г. Озерск). К моменту взятия образцов периферической крови дозы воздействия γ- и α-излучений на ККМ (красный костный мозг) составили соответственно от 142 до 2950 мГр и от 0 до 68 мГр. Характеристики этой когорты детально были изложены в наших предыдущих публикациях, где также частично представлены результаты ее обследования [8–10]. Здесь же приводятся обобщенные результаты эпигенетического анализа и их сравнение с таковыми, полученными для других групп облученных лиц.
В итоге общая численность обследованной выборки составила 605 человек (2.5–84 года), из них 273 облученных человека (36–84 года; ликвидаторы аварии на ЧАЭС, профессионалы-атомщики г. Сарова, жители территорий с радионуклидными загрязнениями, работники ПО “Маяк” г. Озерска). Следует подчеркнуть, что для большинства обследованных лиц промежуток времени между окончанием работы в условиях радиационного воздействия и взятием крови находился в диапазоне от нескольких месяцев до 61 года (в среднем 15.74 ± 1.04 лет). Если для работников атомной промышленности дозы облучения были рассчитаны и документированы, то для остальных контингентов облученных лиц такая информация отсутствовала.
Анализ гиперметилирования CpG-островков промоторов генов клеточного цикла (р53, АТМ), антиоксидантной защиты (SOD3), эстрогенового рецептора (ESR1) выполнен с применением детально описанной ранее оптимизированной и стандартизованной в лаборатории метилчувствительной полимеразной цепной реакции (МЧ-ПЦР), позволяющей диагностировать 0.1–1% метилированных аллелей в образце ДНК лейкоцитов крови [7, 8]. Вкратце реакцию метилчувствительной ферментативной рестрикции проводили с использованием эндонуклеазы AciI (Fermentas, Литва), которая гидролизует только неметилированные участки узнавания (5'…C↓C GC…3'). Доля проанализированных CpG-динуклеотидов составила 25, 12.2, 17.1, 8.3% для исследованных фрагментов промоторов генов р53, АТМ, SOD3, ESR1 соответственно. Образцы ДНК до и после гидролиза использовали в качестве матрицы для амплификации фрагментов промоторов кандидатных генов. Результаты каждого анализа были воспроизведены в трех независимых экспериментах.
Статистическая обработка результатов осуществлялась с помощью программ WINPEPI (PEPI-for-Windows) и SPSS 20.0.0 общепринятыми статистическими методами. Значимость различий между группами оценивалась с помощью точного критерия Фишера с проведением коррекции р-значений на множественность сравнений (False Discovery Rate, FDR). Корреляционный и регрессионный (множественная регрессия, логистическая регрессия) анализы были использованы с целью оценки зависимости между исследуемыми показателями (метилирование, возраст, радиационное воздействие и его доза). Адекватность полученных регрессионных моделей оценивалась с помощью ROС-анализа (анализ характеристической кривой), позволившего сделать выводы о прогностической эффективности совокупности рассматриваемых эпигенетических показателей.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
Анализ ассоциаций в объединенной выборке обследованных лиц. Из таблицы сопряженности (2 × 2) радиационного воздействия и метилирования для совокупной выборки видно, что частоты облученных лиц с выявленными случаями метилирования промоторов всех проанализированных генов, кроме RASSF1A, статистически значимо превышали аналогичные показатели в контроле (табл. 1). Поскольку контрольная группа в данном исследовании включала лиц широкого возрастного диапазона (в том числе молодых людей 20–35 лет и детей 2.5–16 лет), для каждого гена была построена логистическая регрессия вида: метилирование ~ Возраст + Статус облучения (табл. 2). Видно, что метилирование генов RASSF1A и р14/ARF зависит исключительно от возраста, в то время как эпигенетический статус GSTP1, p53, ATM и ESR1 преимущественно сопряжен с перенесенным облучением. Метилирование остальных генов (p16, SOD3) зависит как от возраста, так и от радиационного воздействия.
Таблица 1.
Результаты изучения гиперметилирования промоторов генов в совокупной выборке обследованных лиц
| Ген | Отсутствие (0)/наличие метилирования (1) | Контроль | Облученные | OR | р* | FDR** |
|---|---|---|---|---|---|---|
| RASSF1A | 0 | 322 | 250 | 1.56 | 0.198 | 0.198 |
| 1 | 10 | 23 | ||||
| p16/INK4A | 0 | 328 | 234 | 13.67 | 1.5E-9 | 2.1E-8 |
| 1 | 4 | 39 | ||||
| p14/ARF | 0 | 321 | 249 | 2.81 | 0.005 | 0.007 |
| 1 | 11 | 24 | ||||
| GSTP1 | 0 | 330 | 243 | 20.37 | 5.2E-9 | 2.1E-8 |
| 1 | 2 | 30 | ||||
| p53 | 0 | 169 | 211 | 3.04 | 0.002 | 0.003 |
| 1 | 10 | 38 | ||||
| ATM | 0 | 174 | 219 | 4.77 | 5.1E-4 | 0.001 |
| 1 | 5 | 30 | ||||
| ESR1 | 0 | 167 | 212 | 2.43 | 0.009 | 0.010 |
| 1 | 12 | 37 | ||||
| SOD3 | 0 | 158 | 162 | 4.04 | 3.9E-8 | 1.0E-7 |
| 1 | 21 | 87 |
Таблица 2.
Результаты оценки зависимости метилирования разных генов от возраста и радиационного воздействия (логистическая регрессия) в совокупной выборке обследованных лиц
| Ген | Фактор | B* | SE(B) | р** | Exp(B) |
|---|---|---|---|---|---|
| RASSF1A | Возраст | 0.044 | 0.013 | 0.001 | 1.045 |
| Статус | 0.298 | 0.421 | 0.479 | 1.347 | |
| p16/INK4A | Возраст | 0.035 | 0.013 | 0.008 | 1.036 |
| Статус | 1.956 | 0.559 | 4.7E-4 | 7.069 | |
| p14/ARF | Возраст | 0.066 | 0.016 | 2.4E-5 | 1.068 |
| Статус | 0.040 | 0.400 | 0.920 | 1.041 | |
| GSTP1 | Возраст | 0.008 | 0.014 | 0.537 | 1.007 |
| Статус | 2.816 | 0.794 | 3.9E-4 | 15.719 | |
| p53 | Возраст | 0.020 | 0.011 | 0.066 | 1.022 |
| Статус | 0.850 | 0.387 | 0.028 | 2.341 | |
| ATM | Возраст | 0.010 | 0.012 | 0.400 | 1.010 |
| Статус | 1.409 | 0.519 | 0.007 | 4.092 | |
| ESR1 | Возраст | 0.010 | 0.010 | 0.299 | 1.010 |
| Статус | 0.737 | 0.371 | 0.047 | 2.090 | |
| SOD3 | Возраст | 0.022 | 0.008 | 0.005 | 1.022 |
| Статус | 1.114 | 0.280 | 7.0E-5 | 3.046 |
Анализ ассоциаций с верификацией № 1. Для первой сформированной нами ранее смешанной выборки (ликвидаторы аварии на ЧАЭС, профессионалы-атомщики г. Сарова, жители территорий с радионуклидными загрязнениями) частоты случаев метилирования изученных генов, как правило, значимо превышали таковые показатели в соответствующем контроле (для p14/ARF р = 0.074) (табл. 3). Однако верификация данных на второй (тестовой) выборке (работники ПО “Маяк”) хотя и показала такую же направленность выявляемых эффектов радиационного воздействия, тем не менее их уверенное воспроизведение отмечается только для генов p16/INK4A, GSTP1 и SOD3 (табл. 4).
Таблица 3.
Результаты изучения гиперметилирования промоторов генов в смешанной выборке обследованных лиц (выборка открытия)
| Ген | Отсутствие (0)/наличие метилирования (1) |
Контроль | Облученные | OR | р* | FDR** |
|---|---|---|---|---|---|---|
| RASSF1A | 0 | 274 | 114 | 5.71 | 4.7E-5 | 1.8E-4 |
| 1 | 8 | 10 | ||||
| p16/INK4A | 0 | 281 | 112 | 30.11 | 4.3E-6 | 3.4Е-5 |
| 1 | 1 | 12 | ||||
| p14/ARF | 0 | 278 | 118 | 3.53 | 0.074 | 0.074 |
| 1 | 4 | 6 | ||||
| GSTP1 | 0 | 280 | 113 | 13.63 | 6.7E-5 | 1.8E-4 |
| 1 | 2 | 11 | ||||
| p53 | 0 | 122 | 86 | 2.84 | 0.036 | 0.041 |
| 1 | 7 | 14 | ||||
| ATM | 0 | 125 | 85 | 7.21 | 2.5E-4 | 5.0E-4 |
| 1 | 4 | 15 | ||||
| ESR1 | 0 | 121 | 82 | 3.32 | 0.006 | 0.008 |
| 1 | 8 | 18 | ||||
| SOD3 | 0 | 117 | 73 | 3.61 | 0.001 | 0.002 |
| 1 | 12 | 27 |
Таблица 4.
Результаты изучения гиперметилирования промоторов генов в выборке работников ПО “Маяк” (тестовая выборка)
| Ген | Отсутствие (0)/наличие метилирования (1) |
Контроль | Облученные | OR | р* |
|---|---|---|---|---|---|
| RASSF1A | 0 | 48 | 136 | 2.29 | 0.365 |
| 1 | 2 | 13 | |||
| p16/INK4A | 0 | 47 | 122 | 3.47 | 0.041 |
| 1 | 3 | 27 | |||
| p14/ARF | 0 | 43 | 131 | 0.84 | 0.806 |
| 1 | 7 | 18 | |||
| GSTP1 | 0 | 50 | 130 | 15.09** | 0.004 |
| 1 | 0 | 19 | |||
| p53 | 0 | 47 | 125 | 3.01 | 0.094 |
| 1 | 3 | 24 | |||
| ATM | 0 | 49 | 134 | 5.49 | 0.078 |
| 1 | 1 | 15 | |||
| ESR1 | 0 | 46 | 130 | 1.68 | 0.451 |
| 1 | 4 | 19 | |||
| SOD3 | 0 | 41 | 89 | 3.07 | 0.006 |
| 1 | 9 | 60 |
* Точный двусторонний тест Фишера. ** OR вычислен с прибавлением 0.5 к каждой ячейке таблицы 2 × 2 (байесовская оценка).
Анализ ассоциаций с верификацией № 2. Если ранжировать всех обследованных нами лиц по наличию/отсутствию информации о дозе радиационного воздействия, значимые эффекты облучения, проходящие через поправку на множественность сравнений, выявлены для всех генов, кроме p14/ARF, только у работников атомной промышленности (выборка открытия: атомщики г. Сарова и работники ПО “Маяк”) с рассчитанной и документированной дозой облучения (табл. 5). В другой же обследованной группе индивидов (тестовая выборка: ликвидаторы аварии на ЧАЭС и жители территорий с радионуклидными загрязнениями) уверенное воспроизведение эффектов облучения отмечается только для генов p16/INK4A и GSTP1 (табл. 6).
Таблица 5.
Результаты изучения гиперметилирования промоторов генов в выборке лиц с документированной дозой облучения (выборка открытия)*
| Ген | Отсутствие (0)/наличие метилирования (1) |
Контроль | Облученные | OR | р** | FDR*** |
|---|---|---|---|---|---|---|
| RASSF1A | 0 | 143 | 154 | 4.95 | 0.008 | 0.011 |
| 1 | 3 | 16 | ||||
| p16/INK4A | 0 | 143 | 141 | 9.08 | 6.7E-6 | 1.8Е-5 |
| 1 | 3 | 29 | ||||
| p14/ARF | 0 | 138 | 152 | 2.04 | 0.106 | 0.106 |
| 1 | 8 | 18 | ||||
| GSTP1 | 0 | 146 | 150 | 39.9**** | 2.5E-6 | 1.0E-5 |
| 1 | 0 | 20 | ||||
| p53 | 0 | 114 | 138 | 5.16 | 0.001 | 0.002 |
| 1 | 4 | 25 | ||||
| ATM | 0 | 116 | 144 | 7.65 | 0.001 | 0.002 |
| 1 | 2 | 19 | ||||
| ESR1 | 0 | 112 | 139 | 3.22 | 0.011 | 0.013 |
| 1 | 6 | 24 | ||||
| SOD3 | 0 | 106 | 100 | 5.57 | 5.5E-8 | 4.4Е-7 |
| 1 | 12 | 83 |
* Облученные лица (профессионалы-атомщики г. Сарова, работники ПО “Маяк”) и необлученные лица (курсанты Военно-технического университеа Министерства обороны Российской Федерации, жители г. Сарова). ** Точный двусторонний тест Фишера. *** Коррекция на множественность сравнений. **** OR вычислен с прибавлением 0.5 к каждой ячейке таблицы 2 × 2 (байесовская оценка).
Таблица 6.
Результаты изучения гиперметилирования промоторов генов в выборке лиц с неопределенной дозой облучения (тестовая выборка)*
| Ген | Отсутствие (0)/наличие метилирования (1) |
Контроль | Облученные | OR | р** |
|---|---|---|---|---|---|
| RASSF1A | 0 | 179 | 96 | 1.86 | 0.264 |
| 1 | 7 | 7 | |||
| p16/INK4A | 0 | 185 | 93 | 19.89 | 1.9Е-4 |
| 1 | 1 | 10 | |||
| p14/ARF | 0 | 183 | 97 | 3.77 | 0.073 |
| 1 | 3 | 6 | |||
| GSTP1 | 0 | 184 | 93 | 9.89 | 7.9Е-4 |
| 1 | 2 | 10 | |||
| p53 | 0 | 55 | 73 | 1.63 | 0.456 |
| 1 | 6 | 13 | |||
| ATM | 0 | 58 | 75 | 2.84 | 0.155 |
| 1 | 3 | 11 | |||
| ESR1 | 0 | 55 | 73 | 1.63 | 0.456 |
| 1 | 6 | 13 | |||
| SOD3 | 0 | 52 | 62 | 2.24 | 0.072 |
| 1 | 9 | 24 |
Эффективность выявления облученных лиц. Анализ параметров модели логистической регрессии, построенной на выборке лиц с документированной информацией о величине дозы облучения (выборка открытия), свидетельствует о высокой сопряженности метилирования с перенесенным радиационным воздействием: p = 4.2E-32, Найджелкерк R2 = 0.595, доля правильных прогнозов 81.3%. Константа, а также коэффициенты логистической регрессии при предикторах (переменных) возраст и частота метилированных генов (отношение числа метилированных генов к общему числу проанализированных локусов) составили соответственно –5.569, 0.085 и 6.112.
В табл. 7 представлены исходные данные по трем выборкам обследованных лиц (выборка открытия, тестовая выборка, совокупная выборка), а именно частоты истинно облученных лиц, что было подтверждено (TP – “truе positive”, ИП – истинно положительные результаты) или, наоборот, не доказано (FN – “false negative”, ЛО – ложноотрицательные результаты) рассматриваемым эпигенетическим методом, и частоты истинно необлученных лиц, результаты обследования которых классифицируются как ложноположительные, ЛП (FР – “false positive”) и истинно отрицательные, ИО (ТN – “true negative”). На основании этих данных были рассчитаны основные характеристики применяемого теста, основанного на анализе гиперметилирования генов: чувствительность, т.е. способность выявлять (“видеть”) облученных лиц, и специфичность, т.е. способность не принимать необлученных людей за облученных.
Таблица 7.
Классификация исходных данных* и квалификационные характеристики эпигенетического теста
| Выборка | Наблюдаемый (фактический) статус | Предсказанный статус (на основании результатов исследований) | ||||
|---|---|---|---|---|---|---|
| статус | процент корректных прогнозов | |||||
| 0 | 1 | |||||
| Выборка открытия | Статус | 0 | 100 | 46 | Специфичность | 68.5 |
| 1 | 17 | 153 | Чувствительность | 90 | ||
| Общий процент корректных прогнозов** | 80.1 | |||||
| Тестовая | 0 | 1 | ||||
| Статус | 0 | 156 | 30 | Специфичность | 83.9 | |
| 1 | 73 | 30 | Чувствительность | 29.1 | ||
| Общий процент корректных прогнозов** | 64.4 | |||||
| Объединенная | 0 | 1 | ||||
| Статус | 0 | 247 | 85 | Специфичность | 74.4 | |
| 1 | 77 | 196 | Чувствительность | 71.8 | ||
| Общий процент корректных прогнозов** | 73.2 | |||||
| * В четырехпольной таблице в соответствующих ячейках представлено количество лиц следующих групп: | ||||||
| 0 | 1 | |||||
| 0 | ИО (TN) | ЛП (FP) | ||||
| 1 | ЛО (FN) | ИП (TP) | ||||
| ** Рассчитывается как отношение числа лиц с подтвержденным в результате проведенных исследований статусом (TN + TP) к общему числу обследованных (TN + FN + FP + TP). | ||||||
Как видно, чувствительность эпигенетического теста, определенная по выборке открытия, достигает высоких значений (90%), но была наименьшей (29.1%) при обследовании тестовой выборки индивидов. Специфичность, напротив, имеет более высокие значения в группе лиц с недокументированной дозой облучения (84% против 68.5% для выборки открытия). ROC-анализ показал хорошую/очень хорошую прогностическую силу рассмотрения гиперметилирования генов как биомаркеров перенесенного облучения: площадь под ROC-кривой AUC = 0.879 ± 0.020, p = 2.9E-31 и AUC = 0.744 ± 0.028, p = 6.0E-12 для выборки открытия и тестовой выборки соответственно. Общая доля корректных прогнозов была наибольшей в выборке открытия (80.1% против 64.4% для тестовой выборки). На рис. 1 представлены ROC-кривые, построенные для выборки открытия и тестовой выборки.
Рис. 1.
Прогностическая эффективность рассмотрения гиперметилирования генов как отдаленных биомаркеров радиационного воздействия (ROC-анализ).
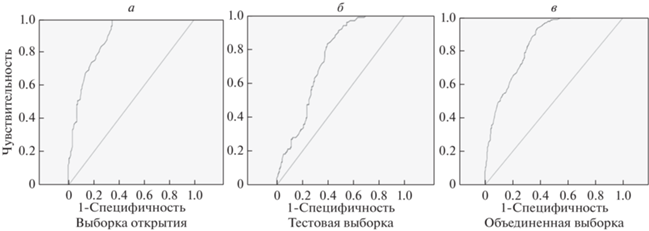
В табл. 7 и на рис. 1 представлены результаты ROC-анализа, выполненного для объединенной выборки обследованных лиц, которые свидетельствуют о значимой сопряженности статуса “облученный” с метилированием проанализированных генов: AUC = 0.846 ± 0.015, р = 1.5Е-48. Таким образом, мы наблюдаем очень хорошую прогностическую эффективность рассмотрения гиперметилирования генов как отдаленных биомаркеров радиационного воздействия. При этом значения чувствительности, специфичности и доли корректных прогнозов были примерно одинаковы и составили более 70%.
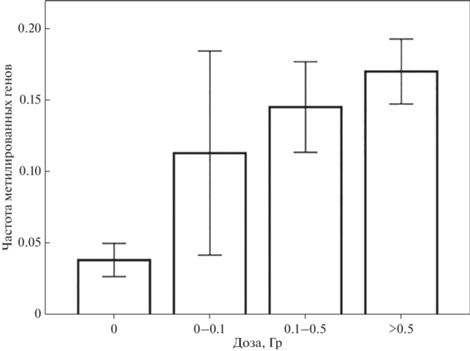
Зависимость гиперметилирования генов от дозы облучения. Зависимость частоты метилированных генов у работников атомной промышленности от дозы внешнего воздействия γ-излучения адекватно характеризует непараметрическая корреляция по Спирмену: r = 0.458, p = 1.8E-16 (по Пирсону r = = 0.372, р = 5.4E-11). Рис. 2 наглядно демонстрирует наблюдаемую сопряженность. Однако в нее значительный вклад дает возрастная зависимость метилирования.
Рис. 2.
Зависимость средней частоты метилированных генов от дозы внешнего воздействия γ-излучения. Указаны 95%-ные доверительные интервалы.
Частная корреляция дозы и числа метилированных локусов (на один ген) при фиксированном возрасте равна r = 0.200, p = 0.001. Множественная регрессия вида: частота метилированных генов ~ ~ возраст + доза характеризуется R2 = 0.211, p = 1.4E-15. Регрессионные коэффициенты модели для дозы и возраста соответственно равны: β = 0.211, р = = 0.001 и β = 0.314, р = 4.6Е-7.
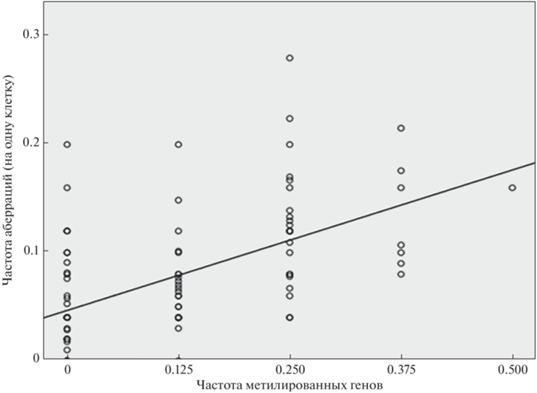
Сопряженность между гиперметилированием промоторов генов и цитогенетическими показателями. Результаты оценки у части индивидов (101 чел.: ликвидаторы аварии на ЧАЭС, взрослые жители территорий с радионуклидными загрязнениями) гиперметилирования промоторов восьми вышеперечисленных генов в зависимости от цитогенетического статуса показали следующее. Так как распределения обследованных лиц по частотам метилированных генов и аберраций хромосом не имели нормального характера, были вычислены соответствующие ранговые корреляции по Спирмену. Наблюдается положительная значимая сопряженность между суммарным уровнем нарушений хромосомного типа и метилированием локусов (r = 0.604, p = 2.3E-11). В частности, только для дицентриков и колец – объективных маркеров радиационного воздействия такая ассоциативная связь характеризуется следующими показателями: r = 0.441, p = 3.9E-6. В то же время рассматриваемая сопряженность для аберраций хроматидного типа отсутствовала (r = 0.074, p = 0.460). Визуально сопряженность нарушений метилирования с общей частотой аберраций хромосомного типа (по Пирсону r = 0.572, p = 4.3E-10) представлена на рис. 3.
ОБСУЖДЕНИЕ
Подводя итог многолетнему мониторингу популяций человека, проводимому лабораторией экологической генетики на протяжении десятилетий, спустя годы и десятки лет после перенесенного радиационного воздействия наблюдаются не только выраженная поврежденность генома соматических и половых клеток облученных лиц, но и эпигенетические нарушения. Последнее доказывают полученные нами данные, изложенные в настоящей статье. ROC-анализ показал высокую информативность рассмотрения выявляемых эпигенетических нарушений как биомаркеров перенесенного облучения. Гиперметилирование CpG-островков генов RASSF1A и р14/ARF зависит от возраста, а эпигенетическая модификация локусов p16/INK4A и GSTP1 высокозначимо ассоциирована с радиационным воздействием, что верифицировано на двух тестовых выборках обследованных индивидов.
Воспроизводимость значимых эффектов облучения только для части генов при верификации данных на второй тестовой выборке работников ПО “Маяк” (первый способ ранжирования обследованных лиц) при сохранении направленности выявляемых эффектов радиационного воздействия (табл. 3, 4), вероятно, объясняется более молодым возрастом обследованных лиц первой группы, характеризующихся большей чувствительностью к облучению.
В то же время при втором способе ранжирования индивидов значимые эффекты облучения выявляются для семи из восьми изученных генов у работников атомной промышленности. При этом в тестовой выборке ликвидаторов аварии на ЧАЭС и жителей территорий с радионуклидными загрязнениями воспроизведение эффектов облучения отмечается только для генов p16/INK4A и GSTP1 (табл. 5, 6). Вероятно, это связано с гораздо более молодым возрастом обследованных лиц контрольной группы в первом исследовании (20-летние курсанты Военно-технического университета) по сравнению с работниками атомной промышленности (52–86 лет). В то же время часть облученных и необлученных лиц тестовой выборки имела противоположные возрастные характеристики по сравнению с обследованными индивидами выборки открытия. Поэтому, несмотря на выявленное отсутствие зависимости метилирования ряда генов от возраста индивидов (табл. 2), накопление в течение жизни стохастических эффектов – эпигенетических модификаций, представляющих собой совокупные эффекты воздействия множества экзогенных факторов, вероятно и является объяснением полученных результатов. Тем не менее статус метилирования генов p16/INK4A и GSTP1 однозначно более “уязвим” к действию факторов радиационной природы.
Вышеприведенное объяснение можно применить и в отношении низкой чувствительности рассматриваемого эпигенетического теста, оцененной для тестовой выборки индивидов, при высоких значениях этого показателя в выборке открытия (второй способ ранжирования обследованных лиц) (табл. 7, рис. 3). Необходимо учитывать и более низкие уровни облучения первой когорты, в которую вошли не только ликвидаторы аварии на ЧАЭС, но и жители территорий с радионуклидными загрязнениями. Для последних характерно радиационное воздействие в суммарных дозах, в среднем превышающих в 2–2.5 раза таковые от естественного радиационного фона. Именно при таком облучении проявляются обусловленные генетическим полиморфизмом наибольшая гетерогенность человеческой популяции по индивидуальной радиочувствительности и феномен гиперчувствительности, связанный с наличием пороговой дозы радиации для активации клеточных защитных механизмов [11].
Наблюдаемая сопряженность между генетическими (аберрации хромосомного типа) и эпигенетическими показателями, по нашему мнению, вполне согласуется с предполагаемыми механизмами индукции гиперметилирования генов под действием радиации (сверхрегуляция ДНК метилтрансфераз активными формами кислорода, рекрутирование этих ферментов к специфическим сайтам репарации ДНК) и ранее подробно рассмотренной общностью причин сохранения индуцированных нарушений генома и эпигенома. Они могут быть связаны не только с непосредственным действием квантов радиации/ионизирующих частиц на клетки крови и их стволовые гемопоэтические предшественники, но и с немишенными отсроченными эффектами облучения, такими как радиационно-индуцированные геномная нестабильность и эффект “свидетеля” [7–10].
Предполагается важная роль механизмов хронического оксидативного стресса в реализации “байстэндер” эффектов. Выявлены значимо повышенные уровни ДНК-метилтрансфераз и маркеров оксидативного стресса – 8-гидрокси-2'-деоксигуанозина (8-OHDG) и 4-гидроксиноненала (4-HNE, продукт липидной пероксидации), которые были сопряжены с дозовой нагрузкой у врачей, подвергшихся многолетнему низкоинтенсивному облучению в результате профессиональной деятельности. Уровень 8-OHDG отрицательно коррелировал с тотальным метилированием генома и положительно – с концентрацией гомоцистеина (продукт трансметилирования метионина) в сыворотке крови [12]. В других исследованиях показана обратная сопряженность между общим уровнем метилирования ДНК/метилированием LINE-1 повтора и хромосомными нарушениями (частота аберраций хромосомного типа, анеуплоидий) [13, 14].
Индукция гиперметилирования генов и реальность сохранения этих эпигенетических эффектов в отдаленный период после воздействия ионизирующих излучений показаны в нескольких работах на животных, что обсуждалось нами ранее [6–10]. Имеются единичные исследования радиационно-индуцированных нарушений метилома и у растений, в том числе выполненные на природных популяциях. Так, повышение общего уровня метилирования генома в результате хронического воздействием радиации в малых дозах показано при исследовании сосны и сои, произрастающих на территориях, загрязненных радионуклидами в результате аварии на ЧАЭС (территории вблизи Чернобыльской АЭС, Брянская и Гомельская обл.) [15, 16]. Наблюдаемые в популяциях растений эпигенетические изменения были подтверждены в недавнем экспериментальном исследовании по изучению влияния радиации на метилирование ДНК у растений трех поколений [17]. Так, 7-дневные растения Arabidopsis thaliana подвергались воздействию γ-излучения (30 и 110 мГр/ч) либо естественному фоновому излучению в течение 14 дней. Если родительское поколение состояло из ранее неэкспонированных растений, то особи поколений 1 и 2 – потомки облученных родителей. Выраженное увеличение числа дифференциально-метилированных регионов (ДМР) наблюдалось у представителей всех трех поколений, подвергшихся воздействию радиации с низкой мощностью дозы, причем во второй генерации рассматриваемые изменения были наиболее выражены. При этом значимые эпигенетические эффекты воздействия облучения с высокой мощностью дозы не выявлены. Большинство ДМР, ассоциированных с транспозонами, были гиперметилированы. Гены, характеризующиеся измененным эпигенетическим статусом, ассоциированы с развитием, различными стрессовыми реакциями, включая репарацию ДНК и сплайсинг РНК. По мнению авторов, полученные результаты могут указывать на роль метилирования ДНК в регуляции этих генов в ответ на воздействие радиации и обеспечивают адаптацию растений в течение нескольких поколений [17]. Повышение тотального уровня метилирования генома как защитного механизма при воздействии низкоинтенсивной радиации отмечалось и обсуждалось также другими исследователями [6].
Очевидно, что наблюдаемое нами в отдаленный период после экспонирования дозозависимое гиперметилирование отдельных CpG-динуклеотидов CpG-островков промоторов ряда генов, затрагивающее малую фракцию клеточной популяции облученного организма и ассоциированное с цитогенетическими нарушениями, преимущественно является результатом повреждающего действия радиации на молекулы клетки (мишенные и немишенные эффекты облучения), а не индукцией генерализованных изменений метилирования ДНК как ответ клетки на облучение [10].
До недавнего времени исследования, подобные нашим работам, отсутствовали. Однако за последний год появились другие статьи, посвященные данной тематике. При обследовании 11 работников Сибирского химического комбината выявлена значимая ассоциация степени метилирования промоторов генов апоптоза BAD, BID и HRK с дозой γ-излучения. Уровень метилирования локуса BCLAF1 сопряжен с возрастом обследованных лиц, но не с цитогенетическими показателями и дозой облучения [18]. Выявлена сопряженность степени метилирования генов BAX и APAF1 с частотой аберрантных клеток и уровнем дицентриков соответственно. Этими же авторами не выявлено рассматриваемых эффектов облучения в отношении локуса Bak1. Тем не менее отмечается, что неметилированный промотор преимущественно встречается в подгруппе лиц с более высокой дозовой нагрузкой [19]. В другой работе [20] не выявлено отличий в статусе метилирования CpG-островков промоторных регионов генов CDKN1A, BCL-2, ATM у жителей прибрежных сел р. Течи с кумулятивной дозой на ККМ от 0.09 до 3.51 Гр (54 чел.) по сравнению с лицами с более низкой дозовой нагрузкой (14 чел., менее 70 мГр). В целом полученные этими коллективами данные, посвященные изучению эпигенетического статуса других генов клеточного цикла/апоптоза, согласуются со сделанными нами выводами о дифференциальной значимости возраста и облучения в метилировании CpG-островков промоторов разных генов.
Радиационно-индуцированное гиперметилирование клеток крови человека было выявлено и в эксперименте in vitro. Так, в облученных мононуклеарных клетках (0.1 Гр) показано возрастание уровня метилирования промоторов двух генов MRE11A и TNFα из 13 изученных (PARP1, ATM, BRCA1, MLH1, XPC, RAD23B, APC, TNFα, DNMT3A, MRE11A, MGMT, CDKN2A, MTHFR) через 72 ч пролиферации этих клеток в культуре. При радиационном воздействии в высокой дозе (2 Гр) спектр генов с этой эпигенетической модификацией расширился до пяти локусов MRE11A, PARP1, BRCA1, DNMT3A и RAD23B, а рассматриваемый эффект уже наблюдался через 48 ч культивирования [21].
Нарушения генома/эпигенома приводят к аккумуляции в облученном организме клеток с измененной пенетрантностью/экспрессивностью гено-/фенотипов. Уже экспериментально с использованием нескольких биологических объектов доказано, что генотоксиканты являются мощными индукторами ошибок транскрипции, а именно изменений транскриптома, затрагивающих все классы РНК-молекул, количество которых существенно превышает уровень регистрируемых реализованных в мутации повреждений ДНК [22]. Поэтому выявленный нами спектр нарушений генома/эпигенома является не только биоиндикатором воздействия радиации, но и может свидетельствовать о развитии функционального дисбаланса клеток организма, приводящего к преждевременному развитию мультифакториальной патологии и ее хронизации. В целом можно говорить об изменении качества жизни и снижении биологической устойчивости облученных индивидов и популяции в целом.
Реакция организма человека и популяции в целом на облучение происходит на фоне действия множества других факторов, что особенно следует учитывать для населения городов. С одной стороны, это резкое изменение генетической структуры популяции. В работах Ю.П. Алтухова и его сотрудников дается анализ популяционно-генетических процессов в городском населении, не соответствующих критериям нормы. Так, генофонд коренных граждан не воспроизводится в последующих поколениях, а внутрипопуляционное генетическое разнообразие возрастает за счет совокупности ряда факторов: давление миграции, процессы аутбридинга, отчасти релаксация отбора, связанного с дифференциальной дорепродуктивной смертностью и дифференциальной плодовитостью. С другой стороны, ухудшение для большой части населения социально-экономических условий, нарастание психо-эмоционального стресса, резкое введение в окружающую среду множества генотоксикантов даже в малых концентрациях приводят к тому, что селективно-нейтральные генотипы оказываются селективно-значимыми, происходит срыв адаптивных возможностей организма, разрушаются адаптивные комплексы генов, усиливаются темпы рекомбинационных/мутационных процессов [23, 24].
Дальнейшие исследования с использованием совокупности современных молекулярно-генетических методов необходимы как для оценки закономерностей мутагенеза/эпимутагенеза в облученных популяциях людей, так и для создания системы высокопрогностических превентивных маркеров развития отдаленной патологии, сопряженной с перенесенным радиационным воздействием.
Работа частично выполнена в рамках темы Государственного задания Минобрнауки России “Механизмы генетических процессов у микроорганизмов, растений, животных и человека” (№ 0092-2019-0007), подтемы “Эпигенетические эффекты воздействия мутагенов физической и химической природы на человека”.
Все процедуры, выполненные в исследовании с участием людей, соответствуют этическим стандартам институционального и/или национального комитета по исследовательской этике и Хельсинкской декларации 1964 г. и ее последующим изменениям или сопоставимым нормам этики.
От каждого из включенных в исследование участников было получено информированное добровольное согласие.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Шевченко В.А., Снигирева Г.П. Значимость цитогенетического обследования для оценки последствий Чернобыльской катастрофы // Радиац. биология. Радиоэкология. 2006. Т. 46. № 2. С. 133–139.
Шевченко В.А., Сусков И.И., Снигирева Г.П. и др. Генетический статус населения, подвергшегося воздействию ядерных испытаний // Вестник науч. программы “Семипалатинский полигон-Алтай”. 1994. № 3. С. 5–32.
Смирнова С.Г., Орлова Н.В., Крикунова Л.И. и др. Частота лимфоцитов с мутациями по локусу Т‑клеточного рецептора у жителей радиационно загрязненных районов Брянской области спустя 28 лет после аварии на Чернобыльской АЭС // Радиац. биология. Радиоэкология. 2016. Т. 56. № 3. С. 285–292. https://doi.org/10.7868/S0869803116030164
Пилинская М.А., Дыбский С.С., Шеметун Е.В., Дыбская Е.Б. Соматический хромосомный мутагенез у жителей Украины, пострадавших от действия ионизирующего излучения, в разные сроки после аварии на Чернобыльской АЭС // Вестник РАМН. 2011. № 9. С. 63–68.
Шайхаев Г.О., Кузьмина Н.С., Мязин А.Е. и др. Изучение частоты мутаций в мини- и микросателлитных локусах ДНК в клетках членов семей работников атомной промышленности, работавших с тритием и его окисью // Радиац. биология. Радиоэкология. 2008. Т. 48. № 6. С. 690–697.
Кузьмина Н.С. Радиационно-индуцированные нарушения метилирования ДНК: исследования in vitro и in vivo // Радиац. биология. Радиоэкология. 2020. Т. 60. № 5. С. 481–506. https://doi.org/10.31857/S0869803120050070
Kuzmina N.S., Lapteva N.Sh., Rubanovich A.B. Hypermethylation of gene promoters in peripheral blood leukocytes in humans long term after radiation exposure // Environ. Res. 2016. V. 146. P. 10–17. https://doi.org/10.1016/j.envres.2015.12.008
Kuzmina N.S., Lapteva N.Sh., Rusinova G.G. et al. Gene hypermethylation in blood leukocytes in humans long term after radiation exposure – validation set // Environ. Pollut. 2018. V. 234. P. 935–942. https://doi.org/10.1016/j.envpol.2017.12.039
Кузьмина Н.С., Лаптева Н.Ш., Русинова Г.Г. и др. Дозовая зависимость гиперметилирования промоторов генов в лейкоцитах крови лиц, подвергшихся сочетанному воздействию гамма- и альфа-излучений // Генетика. 2018. Т. 54. № 13. Приложение. С. S22–S26. https://doi.org/10.1134/S0016675818130118
Kuzmina N.S., Lapteva N.Sh., Rusinova G.G. et al. Dose dependence of hypermethylation of gene promoters in blood leukocytes in humans occupationally exposed to external gamma radiation // Biology Bulletin. 2019. V. 46. № 11. P. 1489–1495. https://doi.org/10.1134/S1062359019110062
Martin L.M., Marples B., Lynch T.H. et al. Exposure to low dose ionising radiation: Molecular and clinical consequences // Cancer Lett. 2013. V. 338. № 2. P. 209–218. https://doi.org/10.1016/j.canlet.2013.05.021
Chen B., Dai Q., Zhang Q. et al. The relationship among occupational irradiation, DNA methylation status, and oxidative damage in interventional physicians // Medicine (Baltimore). 2019. V. 98. № 39. e17373. https://doi.org/10.1097/MD.0000000000017373
Lee Y., Kim Y.J., Choi Y.J. et al. Radiation-induced changes in DNA methylation and their relationship to chromosome aberrations in nuclear power plant workers // Int. J. Radiat. Biol. 2015. V. 91. № 2. P. 142–149. https://doi.org/10.3109/09553002.2015.969847
Cho Y.H., Jang Y., Woo H.D. et al. LINE-1 hypomethylation is associated with radiation-induced genomic instability in industrial radiographers // Environ. Mol. Mutagen. 2018. V. 60. № 2. P. 174–184. https://doi.org/10.1002/em.22237
Georgieva M., Rashydov N.M., Hajduch M. DNA damage, repair monitoring and epigenetic DNA methylation changes in seedlings of Chernobyl soybeans // DNA Repair. 2017. V. 50. P. 14–21. https://doi.org/10.1016/j.dnarep.2016.12.002
Volkova P.Yu., Geras’kin S.A., Horemans N. et al. Chronic radiation exposure as an ecological factor: Hypermethylation and genetic differentiation in irradiated Scots pine populations // Environ. Pollut. 2018. V. 232. P. 105–112. https://doi.org/10.1016/j.envpol.2017.08.123
Laanen P., Saenen E., Mysara M. et al. Changes in DNA methylation in Arabidopsis thaliana plants exposed over multiple generations to gamma radiation // Front. Plant Sci. 2021. № 12. P. 611783. https://doi.org/10.3389/fpls.2021.611783
Исубакова Д.С., Цымбал О.С., Брониковская Е.В. и др. Метилирование промоторов генов апоптоза в лимфоцитах крови работников, подвергавшихся в процессе профессиональной деятельности долговременному внешнему облучению // Бюл. эксперим. биологии и медицины. 2021. Т. 171. № 3. С. 339–343. https://doi.org/10.47056/0365-9615-2021-171-3-339-343
Цымбал О.С., Исубакова Д.С., Брониковская Е.В. и др. Роль метилирования Вak1 в индукции хромосомных аберраций при хроническом низкоинтенсивном внешнем облучении // Мед. радиология и радиац. безопасность. 2020. Т. 65. № 5. С. 29–34. https://doi.org/10.12737/1024-6177-2020-65-5-29-34
Блинова Е.А., Никифоров В.С., Янишевская М.А., Аклеев А.В. Метилирование генов BCL-2, CDKN1A и ATM у лиц, подвергшихся хроническому облучению // Медицина экстрем. ситуаций. 2021. Т. 23. № 3. С. 11–15. https://doi.org/10.47183/mes.2021.028
Priya R., Das B. Global DNA methylation profile at LINE-1 repeats and promoter methylation of genes involved in DNA damage response and repair pathways in human peripheral blood mononuclear cells in response to γ-radiation // Mol. Cell Biochem. 2022. V. 477. № 1. P. 267–281. https://doi.org/10.1007/s11010-021-04265-4
Fritsch C., Gout J.-F., Haroon S. et al. Genome-wide surveillance of transcription errors in response to genotoxic stress // PNAS. 2021. V. 118. № 1. e2004077118. https://doi.org/10.1073/pnas.2004077118
Динамика популяционных генофондов при антропогенных воздействиях / Под ред. Алтухова Ю.П. М.: Наука. 2004. 619 с.
Курбатова О.Л., Победоносцева Е.Ю. Городские популяции: возможности генетической демографии (миграция, подразделенность, аутбридинг) // Вестник ВОГиС. 2006. Т. 10. № 1. С. 155–188.
Дополнительные материалы отсутствуют.