Генетика, 2022, T. 58, № 5, стр. 509-529
Создание рекомбинантных штаммов-продуцентов гиалуроновой кислоты на основе Bacillus subtilis
С. В. Рыков 1, 2, *, И. Ю. Батталова 1, А. С. Миронов 3
1 ООО “Центр трансфера биотехнологий Ока-Биотех”
119421 Москва, Россия
2 Национальный исследовательский центр “Курчатовский институт” – ГосНИИгенетика,
Курчатовский геномный центр
117545 Москва, Россия
3 Институт молекулярной биологии им. В.А. Энгельгардта Российской академии наук
119991 Москва, Россия
* E-mail: enterru@yandex.ru
Поступила в редакцию 22.11.2021
После доработки 14.12.2021
Принята к публикации 17.12.2021
- EDN: YEKLZN
- DOI: 10.31857/S0016675822050083
Аннотация
Гиалуроновая кислота находит все более широкое применение в производстве фармацевтических и косметических средств, что обусловливает возрастающую потребность в высококачественной субстанции. Основными промышленными способами получения гиалуроновой кислоты являются экстракция из сырья животного происхождения и ферментация условно-патогенных штаммов Streptococcus. Рекомбинантная продукция на основе безопасных для человека микроорганизмов представляется рациональным и экономически обоснованным способом получения гиалуроновой кислоты. Созданные на основе платформы Bacillus subtilis рекомбинантные штаммы-продуценты позволяют получать выход и качество продукта, сопоставимые с таковыми у промышленно освоенных штаммов стрептококков. Варьирование генетических, биохимических и биотехнологических факторов позволяет получать продукты с различной целевой молекулярной массой. Несмотря на достигнутые результаты, потенциал платформы B. subtilis для создания продуцентов гиалуроновой кислоты не исчерпан.
Гиалуроновая кислота (ГК) является высокомолекулярным линейным несульфатированным гликозоаминогликаном, состоящим из повторяющихся дисахаридных звеньев, соединенных β-1,4-гликозидными связями. Дисахаридное звено состоит из фрагментов D-глюкуроновой кислоты и N-ацетил-D-глюкозоамина, соединенных β-1,3-гликозидной связью [1, 2]. Наличие многочисленных сульфатированных групп у родственных гликозоаминогликанов является причиной существования многочисленных изомеров, чего не наблюдается у гиалуроновой кислоты, которая всегда химически идентична, вне зависимости от методов и источников получения. В водном растворе ГК стабилизируется во вторичную структуру в виде одноцепочечной левозакрученной спирали. Дуплексы из спиралей образуют третичную структуру в виде вытянутой сетки, свойства которой зависят от молекулярного веса (МВ) и концентрации ГК [3]. Структурные характеристики и полиэлектролитная природа определяют уникальные реологические свойства растворов ГК [4, 5].
В организме человека ГК является одним из основных компонентов внеклеточного матрикса. Значительные количества ГК обнаружены в дерме и эпидермисе кожи, синовиальной суставной жидкости, гиалиновом хряще, стекловидном теле глаза [6]. ГК функционирует и как структурная, и как сигнальная молекула. Молекулярный вес является ключевым фактором, определяющим биологические функции ГК [7]. Высокомолекулярная ГК (≥106 Да) служит смазывающим фактором синовиальной жидкости, поддерживает водно-электролитный баланс и структуру внеклеточного матрикса [8], обладает анти-ангиогенным эффектом, участвует в процессах воспаления и раневого восстановления тканей через взаимодействие с фибриногеном и контроле активации клеток иммунной системы, регулировке цитокинов и миграции стволовых клеток [9, 10]. При ряде патологических состояний, таких как астма, фиброз легких и ревматоидный артрит, происходит образование низкомолекулярной ГК (104–106 Да), которая демонстрирует провоспалительную и проангиогенную активность. Низкомолекулярная ГК стимулирует выработку провоспалительных цитокинов [7], а также провоцирует перестройку внеклеточного матрикса [11]. Фрагменты и олигосахариды ГК (≤104 Да) в зависимости от типа ткани и физиологического состояния демонстрируют как провоспалительные [12], так и антивоспалительные эффекты [13].
Гиалуроновая кислота различного МВ может применяться в создании средств доставки терапевтических агентов, терапии новообразований, заболеваний глаз, суставов, легких, верхних дыхательных путей, мочевыводящей системы и в эстетической медицине [2]. В повседневную практику прочно вошли созданные на основе ГК лекарственные средства и изделия: протезы синовиальной жидкости, средства для лечения травм и ожогов кожи, вискоэластики для катарактальной хирургии и глазные капли, средства для лечения ринитов, дермальные филлеры [14]. Значительный эстетический и поддерживающий эффект обеспечивает широкое применение ГК в косметических средствах и биологически активных добавках.
В обзоре проанализированы результаты, полученные при работах по созданию рекомбинантных штаммов-продуцентов ГК на основе платформы Bacillus subtilis.
СПОСОБЫ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ ГК
В промышленных масштабах ГК получают двумя способами – экстракцией из сырья животного происхождения и ферментацией штаммов природных микробных продуцентов. Способ получения ГК из сырья животного происхождения является отработанной технологией, которая позволяет получать продукт с высоким МВ и приемлемыми затратами. Сырьем для крупномасштабного производства являются гребни домашних кур и стекловидное тело глаза крупного рогатого скота [15]. Недостаток способа – низкий выход продукта с высокой вариабельностью по МВ, что связано с низкой концентрацией полимера в ткани, неконтролируемой деградацией эндогенными гиалуронидазами и жесткими условиями экстракции. Препарат, полученный данным способом, может содержать инфекционные агенты – вирусы или прионы, а также следовые количества белков и нуклеиновых кислот, которые могут вызывать аллергические реакции [16, 17].
Ферментация штаммов природных продуцентов – основной промышленный способ получения ГК [18]. В качестве продуцентов применяются селекционные штаммы Streptococcus equi subsp. zooepidemicus и S. equi subsp. equi, которые способны давать в оптимальных условиях выход продукта в 6–7 г/л с МВ 2.0–3.5 МДа [19]. Главным недостатком способа является применение штаммов, созданных на основе патогенного для сельскохозяйственных животных и условно-патогенного для человека вида стрептококков. Целевому продукту необходимо пройти многие стадии очистки для исключения попадания эндо- и экзотоксинов, что негативно сказывается на экономических характеристиках.
Идентификация генов биосинтеза ГК позволила проводить работы по созданию рекомбинантных продуцентов на различных платформах, лишенных недостатков стрептококков, с достижением таких же показателей продуктивности и МВ. Созданы штаммы-продуценты ГК как на основе промышленных платформ – Escherichia coli, так и на основе платформ с GRAS-статусом – Corynebacterium glutamicum, Lactobacillus acidophilus, Lactococcus lactis, B. subtilis [18, 20]. Перспективным методом является хемоэнзиматический способ биосинтеза ГК, который позволяет получать монодисперсные фракции высокой степени чистоты [21]. Однако, несмотря на достигнутые результаты, к настоящему моменту на рынке не представлены продукты на основе субстанции ГК, полученной ферментацией рекомбинантных штаммов отличных от стрептококков или хемоэнзиматическим способом. Поэтому получение высококачественной ГК с высоким выходом и низкой стоимостью представляет собой актуальную проблему в области молекулярной генетики и биотехнологии.
ПУТЬ БИОСИНТЕЗА ГИАЛУРОНОВОЙ КИСЛОТЫ
Природными продуцентами ГК являются штаммы грамположительных бактерий – Streptococcus pyogenes, S. uberis, S. equi subsp. zooepidemicus, S. equi subsp. equi, S. iniae, S. equisimilis, Bacillus cereus штамм G9241 и грамотрицательных бактерий – Pasteurella multocida [19, 22–25]. Все природные продуценты ГК – патогенные и условно-патогенные микроорганизмы, вызывающие заболевания животных и человека. ГК составляет основу клеточной капсулы и выступает фактором вирулентности, позволяя микроорганизму избегать узнавания и противодействия иммунной системы, а также способствует колонизации слизистых поверхностей [26]. Несмотря на очевидные преимущества для усиления вирулентности, только некоторые виды бактерий приобрели способность синтезировать капсулярную ГК.
Гены биосинтеза ГК входят в состав оперона, в котором ключевым ферментом является гиалуронсинтаза (EC 2.4.1.212) – фермент, синтезирующий ГК из активированных форм мономеров – УДФ-глюкуроната и УДФ-N-ацетилглюкозоамина. Существуют два класса бактериальных гиалуронсинтаз, которые различаются структурой молекулы и аминокислотной последовательностью [27]. Наиболее распространенным является класс 1, который отвечает за биосинтез ГК у стрептококков и позвоночных и представляет собой мембранный фермент [28]. Класс 2 представлен только гиалуронсинтазой оперона P. multocida и является ассоциированным с мембраной ферментом [25]. Оперон биосинтеза ГК стрептококков также включает от двух до четырех генов биосинтеза предшественников активированных мономеров, а в случае P. multocida включает также гены с функцией транслокации во внеклеточное пространство растущей цепи ГК.
Путь биосинтеза ГК детально исследован у стрептококков [29, 30]. УДФ-глюкуронат и УДФ-N-ацетилглюкозоамин являются производными глюкозо-6-фосфата и фруктозо-6-фосфата соответственно. Путь биосинтеза ГК представлен на рис. 1. Первой реакцией биосинтеза УДФ-глюкуроната является обратимая конверсия глюкозо-6-фосфата в глюкозо-1-фосфат с помощью α-фосфоглюкомутазы (EC 5.4.2.2). Далее глюкозо-1-фосфат уридилтрансфераза (EC 2.7.7.9) катализирует образование УДФ-глюкозы из УТФ и глюкозо-1-фосфата. Затем образуется УДФ-глюкуроновая кислота в реакции окисления первичной спиртовой группы УДФ-глюкозы с помощью УДФ-глюкозодегидрогеназы (EC 1.1.1.22).
Рис. 1.
Путь биосинтеза гиалуроновой кислоты и ассоциированные биохимические пути. ПФП – пентозофосфатный путь, ТХК – тейхоевые кислоты, ТХУК – тейхуроновые кислоты, ГК – гликолиз, ПГ – пептидогликан. Приведены гены-гомологи: подчеркнутые надстрочные из генома Streptococcus, подстрочные из генома B. subtilis.
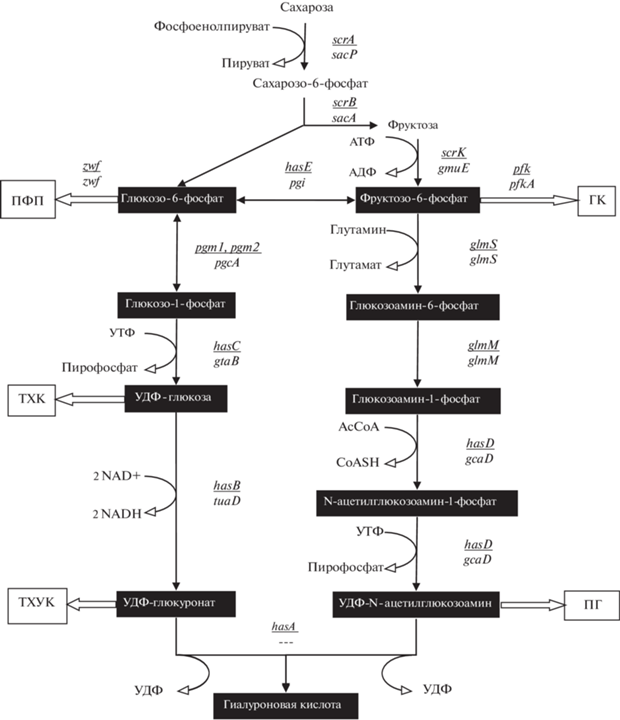
Первой реакцией биосинтеза УДФ-N-ацетил-глюкозоамина является перенос аминогруппы с глутамина на фруктозо-6-фосфат посредством амидотрансферазы (EC 2.6.1.16) с образованием глюкозамин-6-фосфата. Затем происходит перегруппировка фосфатных групп с помощью мутазы (EC 5.4.2.10) с образованием глюкозамин-1-фосфата. Далее происходит перенос ацетильной группы ацетилтрансферазой (EC 2.3.1.157) с образованием N-ацетилглюкозамин-1-фосфата и пирофосфорилаза (EC 2.7.7.23) в реакции с УТФ синтезирует УДФ-N-ацетилглюкозамин.
УДФ-N-ацетилглюкозоамин, УДФ-глюкоза и глюкозо-1-фосфат участвуют в биосинтезе пептидогликана и других компонентов клеточной стенки, что создает очевидную конкуренцию пути биосинтеза ГК. Для обеспечения метаболических потребностей клетки в нуклеотидных сахарах геном стрептококков содержит дополнительные гены глюкозо-1-фосфат уридилтрансферазы (hasC2), α‑фосфоглюкомутазы (pgm1, pgm2) и ацетилтрансферазы/пирофосфорилазы (gcaD). В то же время ген УДФ-глюкозодегидрогеназы (hasB) представлен единственной копией в опероне биосинтеза ГК. Таким образом, метаболизм стрептококков способен поддерживать синтез большого количества ГК во внеклеточной капсуле.
Пути биосинтеза УДФ-N-ацетилглюкозоамина и УДФ-глюкозы у стрептококков и B. subtilis биохимически идентичны. Геном B. subtilis содержит гомологи всех генов биосинтеза предшественников ГК. Это позволяет использовать гены B. subtilis для создания эффективных искусственных оперонов, поскольку известно, что собственные гены лучше экспрессируются, чем гомологичные чужеродные.
РЕКОМБИНАНТНЫЕ ПРОДУЦЕНТЫ ГИАЛУРОНОВОЙ КИСЛОТЫ НА ОСНОВЕ ШТАММОВ B. subtilis
Рекомбинантные штаммы-продуценты ГК на основе B. subtilis, полученные к настоящему времени, представлены в табл. 1 и 2.
Таблица 1.
Штаммы-продуценты гиалуроновой кислоты на основе B. subtilis (культивирование в колбах при 37°С)
| Название штамма | Генотип | Источник гена гиалуронсинтазы | Промотор оперона | Выход, г/л | МВ, МДа |
ОД600 | Ссылка |
|---|---|---|---|---|---|---|---|
| RB-AB | 1A751 amyE::(PVegII-seHasA-seHasB) | S. equi subsp. zooepidemicus | Конститутивный PVegII | 0.84 | н/д | 6.5 | [35] |
| RB-AD | 1A751 amyE::(PVegII-seHasA-TuaD) | 1.14 | н/д | 6.0 | |||
| RB-ADV | 1A751 amyE::(PVegII-seHasA-TuaD, PVegII-vhb) | 1.8 | н/д | 7.5 | |||
| TPG223 | 168 lacA::(Pxyl -PmHAS), [pHCMC05::(Pspac-tuaD-gtaB)] | Pasteurella multocida | Индуцибельный Pxyl, индуцибельный Pspac | 6.8 | 4.55 | н/д | [37] |
| PG6181 | 168 lacA::(Pxyl -PmHAS), [pHCMC05::(Pspac -gcaD)] | 1.68 | 0.013 | н/д | |||
| PP6502 | 168 lacA::(Pxyl -PmHAS), [pHCMC05::(Pspac -pgi)] | 3 | 4.54 | н/д | |||
| E168A | 168 lacA::(Pxyl -hasA) | S. zooepidemicus | Индуцибельный Pxyl | 1 | 1.51 | н/д | [38] |
| E168A/pP43-D | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-tuaD)] | Индуцибельный Pxyl, конститутивный P43 |
2 | 1.76 | н/д | ||
| E168A/pP43-DB | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-tuaD, gtaB)] | 2.5 | 1.6 | н/д | |||
| E168A/pP43-DBA | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-tuaD, gtaB, pgcA)] | 2.1 | 1.56 | н/д | |||
| E168A/pP43-U | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-glmU)] | 2.2 | 1.68 | н/д | |||
| E168A/pP43-UMS | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-glmU, glmM, glmS)] | 2.6 | 1.83 | н/д | |||
| E168A/pP43-UMSI | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-glmU, glmM, glmS, pgi), KanR] | 2.5 | 1.82 | н/д | |||
| E168A/pP43-DU | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-tuaD, glmU)] | 2.2 | 1.4 | н/д | |||
| E168A/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | 2.7 | 1.61 | н/д | |||
| E168T | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG) | S. zooepidemicus | Индуцибельный Pxyl, конститутивный P43 |
1.2 | 1.57 | н/д | |
| E168G | 168 lacA::(Pxyl -hasA), pfkA(ATG-> GTG) | 1.18 | 1.59 | н/д | |||
| E168T/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG); [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | 3.2 | 1.69 | н/д | |||
| E168TH/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG); nagA::(PlepA-sp-R0-H6LHyal), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | Индуцибельный Pxyl, конститутивные PlepA, P43, Pveg | 4.35 | 0.0022 | н/д | ||
| E168THR1/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG); nagA::PlepA-sp-R1-H6LHyal), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | 2.9 | 0.0026 | н/д | |||
| E168THR2/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG)); nagA::PlepA-sp-R2-H6LHyal), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | 3.3 | 0.003 | н/д | |||
| AW008 | 1A751 amyE::(Pgrac-seHas-tuaD) | S. equisimilis | Индуцибельный Pgrac | 0.48 | 1.7 | 4 | [45] |
| AW009 | 1A751 amyE::(Pgrac. UPmod-seHas-tuaD) | Индуцибельный Pgrac.UPmod | 0.97 | 1.5 | 6 | ||
| AW005-3 | 1A751 amyE::(Pgrac. UPmod-seHas-tuaD), wprA::(PxylA.SphI+1-pfkA-gRNA.P41NT) | 1.6 | 1.2 | 5 | |||
| AW006-3 | 1A751 amyE::(Pgrac.UPmod-seHas-tuaD), wprA::(PxylA.SphI+1-pfkA-gRNA.P41NT(10C-A)) | 1.7 | 1.3 | 5.5 | |||
| AW014-3 | 1A751 amyE::(Pgrac.UPmod-seHas-tuaD), wprA::(PxylA.SphI+1-zwf-gRNA.P92NT(15C-A)) | 1.3 | 1.6 | 9 | |||
| AW016-3 | 1A751 amyE::(Pgrac.UPmod-seHas-tuaD), wprA::(PxylA.SphI+1-zwf-gRNA.P603NT(10U-C)) | 1.4 | 1.4 | 4 | |||
| AW018-3 | 1A751 amyE::(Pgrac.UPmod-seHas-tuaD), wprA::(PxylA.SphI+1-zwf-gRNA.P603NT(10U-C), PxylA.SphI+1-pfkA-gRNA.P41NT) | S. equisimilis | Индуцибельный Pgrac.UPmod | 2.2 | 1.5 | 7.5 | |
| AW019-3 | 1A751 amyE::(Pgrac.UPmod-seHas-tuaD), wprA::(PxylA.SphI+1-zwf-gRNA.P603NT(10U-C), PxylA.SphI+1-pfkA-gRNA.P41NT(10C-A)) | 2.3 | 1.7 | 6.5 | |||
| AW008 | 1A751 amyE::(Pgrac-seHas-tuaD) | S. equisimilis | Индуцибельный Pgrac | 1.48 | 1.7 | 4.2 | [48] |
| AW001-4 | 1A751 amyE::(Pgrac-seHas-tuaD), thrC::(Pgrac-pgsA-clsA) | 0.63 | 2.0 | 7.7 | |||
| AW004-4 | 1A751 amyE::(Pgrac-seHas-tuaD), wprA::(PxylA.SphI+1-ftsZ-gRNA.P79NT(15C-U)) | 0.79 | 1.5 | 7.8 | |||
| AW005-4 | 1A751 amyE::(Pgrac-seHas-tuaD), wprA::(PxylA.SphI+1-ftsZ-gRNA.P79NT(15C-U)) | 1.46 | 1.6 | 7 | |||
| AW007-4 | 1A751 amyE::(Pgrac-seHas-tuaD), thrC::(Pgrac.UPmod-pgsA-clsA) | Индуцибельные Pgrac, Pgrac.UPmod | 0.8 | 1.4 | 7.5 | ||
| AW009-4 | 1A751 amyE::(Pgrac-seHas-tuaD), thrC::(Pgrac.UPmod-pgsA-clsA), wprA::(PxylA.SphI+1-ftsZ-gRNA.P244NT) | 0.95 | 2.0 | 8 | |||
| AW011-4 | 1A751 amyE::(Pgrac-seHas-tuaD), thrC::(Pgrac.UPmod-pgsA-clsA), wprA::(PxylA.SphI+1-ftsZ-gRNA.P533NT) | 1.05 | 2.1 | 7.5 | |||
| WA | WB600 Δupp, [pHY300plk::hasA] | S. ubris* | н/д | 0.9 | н/д | 4.3 | [41] |
| WmA | WB600 Δupp, ΔsigF, [pHY300plk::hasA] | 1.2 | н/д | 4.8 | |||
| WmB | WB600 Δupp, ΔsigF, [pHY300plk::hasA,tuaD,gtaB] | 3.2** | н/д | н/д | |||
| 1B | 168 [pHY300plk::hasA,tuaD,gtaB] | 1.7** | н/д | н/д |
Таблица 2.
Штаммы-продуценты гиалуроновой кислоты на основе B. subtilis (культивирование в ферментерах при 37°С)
| Штамм | Генотип | Источник гена гиалуронсинтазы | Промотор оперона | Выход, г/л | МВ, МДа |
ОД600 | Ссылка |
|---|---|---|---|---|---|---|---|
| RB163 | A164∆5 amyE::(PscBAN-seHasA-TuaD-gcaD) | S. equisimilis | Конститутивный PamyQ (PscBAN) | н/д | 1.5 | н/д | [31] [32] |
| RB161 | A164∆5 amyE::(PscBAN-seHasA-TuaD-gtaB) | н/д | 1.6 | н/д | |||
| TH-1 | A164∆5 amyE::(PscBAN-seHasA-seHasB-seHasC-seHasD) | н/д | 1.5 | н/д | |||
| RB187 | A164∆5 amyE::(PscBAN-seHasA-TuaD-gtaB), ∆cat | н/д | 3.5 | н/д | |||
| RB194 | A164∆5 amyE::(PscBAN-seHasA-TuaD-gtaB), ∆cat, ∆cypX | н/д | 3.4 | н/д | |||
| RB200 | A164∆5 amyE::(PscBAN-seHasA-TuaD), ∆cat, ∆cypX | н/д | 4.5 | н/д | |||
| 1012/pBS5 | 1012 [pHT01::(Pgrac-hasA-tuaD)] | S. zooepidemicus | Индуцибельный Pgrac | 7.5 | 0.2–0.4 | н/д | [36] |
| 1012/pBS5 | 1012 [pHT01::(Pgrac-hasA-tuaD)] | 3.3* | 1.5–2* | н/д | |||
| WB800N/pBS5 | WB800N [pHT01::(Pgrac-hasA-tuaD)] | 4.0 | 0.5–0.8 | н/д | |||
| E168T/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG); [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | S. zooepidemicus | Индуцибельный Pxyl, конститутивные PlepA, P43, Pveg | 6 | 1.42 | 21 | [38] |
| E168TH/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG); nagA::(PlepA-sp-R0-H6LHyal), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | 19.38 | 0.0066 | 28 | |||
| E168THR1/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG); nagA::PlepA-sp-R1-H6LHyal), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | 9.18 | 0.018 | 23 | |||
| E168THR2/pP43-DU-PBMS | 168 lacA::(Pxyl -hasA), pfkA(ATG-> TTG)); nagA::PlepA-sp-R2-H6LHyal), [pP43NMK::(P43-tuaD-gluM, Pveg-gtaB-glmM-glmS)] | S. zooepidemicus | Индуцибельный Pxyl, конститутивные PlepA, P43, Pveg | 7.13 | 0.0496 | 24 | [38] |
| AM2640 | 168 amyE::(Prpsf-gsib-seHasA-tuaD) | S. equisimilis | Конститутивный тандемный Prpsf-gsib | 1.8 | н/д | н/д | [43] |
| AM2681 | 168 amyE::(Prpsf-gsib-seHasA-tuaD), Prpsf-gsib-gtaB | 2.21 | н/д | н/д | |||
| AM2686 | 168 amyE::(Prpsf-gsib-seHasA-tuaD), Prpsf-gsib-gcaD-prs | 2.83 | н/д | н/д | |||
| AM2694 | 168 amyE::(Prpsf-gsib- seHasA-tuaD), Prpsf-gsib-gtaB, Prpsf-gsib -gcaD-prs | 3.21 | н/д | н/д | |||
| WmB | WB600 Δupp, ΔsigF, [pHY300plk::hasA-tuaD-gtaB] | S. ubris**** | н/д | 3.65** | 0.392** | 20 | [41] |
| 3.4 | 0.45 | 17 | |||||
| 1.6*** | 6.973*** | 7.5 | |||||
| KCNHA10 | 3NA amyE::(Phyper-spank-szHasA-tuaD-gtaB-gcaD) | S. zooepidermicus | Индуцибельный Phyper-spank | 7 | 0.953 | н/д | [53] |
Первая работа по гетерологичной продукции ГК в B. subtilis подтвердила высокий потенциал платформы [31, 32]. Продемонстрирована способность рекомбинантных штаммов секретировать ГК во внеклеточное пространство и накапливать продукт в культуральной жидкости. По характеристикам ГК соответствовала продукту природных микробных продуцентов на основе штаммов Streptococcus. Гетерологичная экспрессия только гиалуронсинтазы seHas, в отличие от штаммов E. coli, не оказывала негативного влияния на скорость роста B. subtilis и не приводила к биосинтезу ГК без дополнительной экспрессии генов биосинтеза УДФ-глюкуроната [33]. Комбинирование в опероне генов биосинтеза двух предшественников позволило выявить лимитирующую стадию биосинтеза, которой является синтез УДФ-глюкуроната. Оперон из seHasA и собственной УДФ-глюкозодегидрогеназы tuaD достаточен для эффективной продукции ГК. Дополнение оперона генами биосинтеза УДФ-N-ацетилглюкозоамина gcaD и УДФ-глюкуроната gtaB увеличивает выход ГК на 10–20%. Разнесение генов seHasA и tuaD‑gtaB по разным оперонам в хромосоме B. subtilis не приводит к заметным изменениям в выходе или МВ продукта по сравнению с единым опероном seHasA-tuaD-gtaB. Искусственный оперон на основе собственных генов синтеза предшественников в B. subtilis демонстрировал большую эффективность по выходу, чем созданный на основе генов оперона биосинтеза ГК из природного продуцента S. equisimilis. Неожиданным оказался эффект делеции гена устойчивости к хлорамфениколу cat и оксидазы семейства цитохром C450, задействованной в синтезе красного пигмента, cypX, который выражался в увеличении выхода высокомолекулярной ГК.
Биосинтез ГК как штаммами стрептококков, так и рекомбинантными продуцентами B. subtilis – энергетически затратный процесс. Способом интенсификации энергетического метаболизма бактериальной клетки является повышение доступности кислорода с помощью бактериального гемоглобина [34]. Гетерологичная экспрессия VHb оказала положительное влияние на культуральные свойства штамма и выход продукта у штамма-продуцента ГК на основе B. subtilis [35]. Штамм с vhb демонстрировал характерный пролонгированный лаг-период и увеличенную скорость роста и достигал большей на 25% конечной плотности культуры (7.5 против 6.2 ОД). Выход ГК увеличился в 2 раза – с 0.9 до 1.8 г/л. Также был экспериментально подтвержден эффект влияния экспрессии собственных генов биосинтеза предшественников на выход продукта. Штаммы с опероном из гиалуронсинтазы с УДФ-глюкозодегидрогеназой разного происхождения демонстрировали различие в продуктивности. Активность УДФ-глюкозодегидрогеназы была выше в 3 раза у штамма с собственным геном tuaD, чем с гетерологичным hasB. Отличие в активности приводило к увеличению выхода ГК на 36%.
Применение индуцируемого промотора для экспрессии оперона биосинтеза ГК позволило получать ГК с различным МВ [36]. Условия ферментации и время культивирования оказывали определяющее влияние на МВ и выход ГК. Так, проведение ферментации в течение 80–160 ч приводило к получению продукта с МВ 0.1–0.5 МДа, 40–80 ч – 0.5–1 МДа, а 12–40 ч – 1.0–2.0 МДа. Однако для эффективной и безопасной для клеток экспрессии оперона понадобилось проводить селекцию трансформантов на градиенте ИПТГ и экспериментально определять рабочую концентрацию индуктора.
Двухэтапная контролируемая экспрессия с различными индукторами также позволяла варьировать МВ ГК [37]. Экспрессия интегрированной гиалуронсинтазы PmHAS контролируется индуцибельным промотором Pxyl, в то время как оперон на плазмиде контролируется индуцибельным промотором Pspac. В случае одновременной индукции кассеты и оперона на 2-м часе с начала культивирования штамма TPG223 продукция ГК достигает 6.8 г/л при МВ 3.38–4.55 МДа. Индукция кассеты PmHAS на 8-м часу, а оперона tuaD-gtaB на 2-м часу демонстрирует снижение продукции ГК до 3.1 г/л при значительном снижении МВ – до 0.006–0.008 МДа.
Было проведено систематическое исследование влияния гиперэкспрессии генов биосинтеза предшественников УДФ-глюкуроновой кислоты и УДФ-N-ацетилглюкозоамина на выход и МВ ГК [38]. Наилучшие показатели с выходом 2.7 г/л и МВ в 1.61 МДа демонстрирует штамм E168A/pP43-DU-PBMS, содержащий в составе оперонов гены полного пути биосинтеза УДФ-глюкуроновой кислоты tuaD-gluM и УДФ-N-ацетилглюкозоамина gtaB-glmM-glmS. Выявлена положительная корреляция между экспрессией генов биосинтеза УДФ-N-ацетилглюкозоамина и повышением МВ продукта, что не выявляется для генов биосинтеза УДФ-глюкуроновой кислоты.
Впервые продемонстрирована возможность повышения продуктивности штаммов-продуцентов путем снижения расхода предшественника УДФ-N-ацетилглюкозоамина фрутозо-6-фосфата в пути гликолиза. Снижение экспрессии гена 6-фосфофруктокиназы pfkA, которая является первым звеном для конверсии фруктозо-6-фосфата в пути гликолиза, осуществлено через замену инициирующего кодона ATG на варианты TTG и GTG. Штамм E168T/pP43-DU-PBMS, который отличается от E168A/pP43-DU-PBMS только заменой кодона ATG на TTG гена pfkA, демонстрировал по сравнению с последним увеличенный с 2.7 до 3.2 г/л выход ГК при схожей скорости роста и МВ продукта.
Также продемонстрирована возможность получения низкомолекулярной ГК с помощью гетерологичной экспрессии гиалуронидазы в штамме-продуценте ГК. Низкомолекулярные фракции и олигосахариды ГК с заданной массой ранее получали с помощью ферментативного гидролиза in vitro рекомбинантной гиалуронидазой пиявок LHyal [39]. Степень деполимеризации ГК зависит от концентрации гиалуронидазы, поэтому для получения фракций с заданной массой уровень гиалуронидазы LHyal, экспрессируемой с конститутивного промотора Plepa, варьировали с помощью библиотеки сайтов связывания с рибосомой [40]. Кассеты с LHyal интегрировали в геном штамма E168T/pP43-DU-PBMS, который содержал модификацию стартового кодона гена pfkA и полные пути биосинтеза предшественников. В результате наблюдали увеличение выхода ГК с соответствующим снижением МВ – 4.35, 2.9 и 3.3 г/л при 0.0022, 0.0026 и 0.003 МДа для различных вариантов соответственно. Масштабирование ферментации подтвердило ступенчатый характер изменения масс получаемых фракций и увеличение выхода ГК. Наблюдалась большая плотность культур штаммов с гиалуронидазой, что связано с лучшими условиями по доступности кислорода.
Экспрессия гиалуронидазы пиявки с чувствительной к температуре плазмиды pKSV7 в штамме-продуценте WmB приводила к получению ГК различной массы при различной температуре [41, 42]. Культивирование при пермиссивной температуре в 32°С приводило к снижению МВ ГК с 0.392 до 0.00861 МДа.
Увеличение выхода ГК также наблюдается при замене промоторов у геномных копий генов биосинтеза предшественников, что приводит к увеличению их экспрессии и позволило обойтись без необходимости расширения рекомбинантного оперона [43, 44]. Замена на сильный тандемный промотор Prpsf-gsib промоторов генов gtaB и gcaD позволила без расширения минимального оперона seHasA-tuaD достичь продуктивности в 2.35 и 3.21 г/л при культивировании в течение 24 и 48 ч соответственно. Применение тандемного промотора Prpsf-gsib позволяет обеспечить более эффективный профиль экспрессии целевых генов и соответственно более эффективную продукцию целевого продукта. Промотор PrpsF относится к наиболее сильным промоторам в геноме B. subtilis и обеспечивает максимально высокий уровень транскрипции на логарифмической стадии роста. Инициация транскрипции гена gsiB инициируется с участием альтернативной сигма-субъединицы σB и достигает максимума на стационарной фазе роста. Увеличение экспрессии генов биосинтеза предшественников положительно сказывается на выходе продукта, что подтверждает и дополняет выводы предшествующих исследований.
Дальнейшее развитие подхода с частичным перенаправлением метаболических потоков с пентозофосфатного пути и гликолиза на биосинтез ГК продемонстрировало существенный потенциал данного направления для увеличения выхода ГК [45]. Глюкозо-6-фосфат расходуется в пентозо-фосфатном пути через конверсию глюкозо-6-фосфат-1-дегидрогеназой, кодируемой геном zwf, в 6-фосфоглюконолактон. Фруктозо-6-фосфат расходуется в пути гликолиза через конверсию 6‑фосфофруктокиназой, кодируемой геном pfkA, в фруктозо-1,6-бифосфат. Инактивация гена zwf приводит к значительному перенаправлению метаболического потока в путь гликолиза, а инактивация гена pfkA летальна для B. subtilis [46]. Для контролируемого подавления экспрессии генов zwf и pfkA применен метод CRISPR интерференции, который позволяет варьировать эффективность транскрипции в широких пределах [47]. Подавление транскрипции гена pfkA привело, по сравнению с исходным штаммом, к увеличению выхода ГК до 50% с небольшим уменьшением МВ ГК и плотности культуры. Подавление транскрипции гена zwf привело к повышению выхода ГК на 44 и 74% только в случае двух вариантов гидовой РНК AW014-3 и AW016-3 соответственно, в то время как остальные снижали выход и МВ продукта.
Одновременное подавление транскрипции генов pfkA и zwf оказывало значительный эффект на продуктивность штаммов B. subtilis. Штаммы с одновременным подавлением транскрипции генов pfkA и zwf AW018-3 и AW019-3 демонстрировали, по сравнению с базовым штаммом AW009, повышение выхода ГК на 98 и 108% соответственно, при незначительном повышении МВ. Скорость роста штаммов AW018-3 и AW019-3 не отличалась от AW009, однако оказалась выше, чем у штаммов с подавлением либо pfkA, либо zwf. Также подавление pfkA и zwf в штаммах AW018-3 и AW019-3 приводило к уменьшению накопления ацетоина в культуральной среде по сравнению с AW009 на 167 и 118% соответственно, что отражало снижение метаболического потока через путь гликолиза. Подавление экспрессии pfkA и zwf на штамме AW009 дает значительно больший эффект, чем гетерологичная экспрессия генов биосинтеза предшественников pgcA и glmS.
Предшественники ГК расходуются также в процессах синтеза компонентов клеточной стенки. УДФ-N-ацетилглюкозоамин участвует в синтезе тейхоевых кислот и компонентов пептидогликана с помощью ферментов, которые кодируются генами tagO и murAA. Подавление экспрессии генов tagO и murAA с помощью интерференции приводило к значительному снижению скорости роста штаммов, генетической нестабильности и потере характерного мукоидного фенотипа.
Создание условий для эффективного функционирования мембранных гиалуронсинтаз с помощью мембранной инженерии позволяет увеличить продуктивность штаммов-продуцентов ГК [48]. Гиалуронсинтазам 1-го типа требуется наличие в составе мембраны фосфолипида кардиолипина, с которым фермент образует функциональный комплекс in vivo и in vitro [49]. Кардиолипин составляет незначительную часть липидов клеточной мембраны B. subtilis. Биосинтез кардиолипина осуществляется с помощью кардиолипинсинтазы ClsA из фосфатидилглицерола, который в свою очередь синтезируется с помощью фосфатидилглицеролсинтазы PgsA [50]. Штамм B. subtilis AW001-4 с конститутивной экспрессией генов pgsA и clsA продемонстрировал по сравнению с контрольным штаммом AW008 увеличение выхода ГК на 32%, МВ до 2.06 МДа и конечной плотности культуры на 83%. Флуоресцентная микроскопия зафиксировала увеличение содержания кардиолипина в районах полюсов и септы клеток. Инактивация генов биосинтеза других липидов клеточной мембраны фосфатидилэтаноламина pssA и нейтральных гликолипидов ugtP не оказала эффекта на продуктивность и скорость роста контрольного штамма AW008.
Локализация кардиолипинсинтазы ClsA происходит в районе септы и зависит от гомолога тубулина FtsZ [51]. Подавление экспрессии FtsZ потенциально может привести к распределению ClsA и повысить концентрацию кардиолипина по всей мембране [52]. Подавление транскрипции ftsZ у штамма AW001-4 с сильной конститутивной экспрессией pgsA и clsA приводило к генетической нестабильности. Только штамм AW004-4 сохранял мукоидный фенотип после восстановления из глицеринового стока и синтезировал на 25% больше ГК, чем AW001-4 при незначительном снижении МВ. Подавление транскрипции ftsZ у контрольного штамма AW008 тем же вариантом гидовой РНК, что и у AW004-4, приводило к увеличению выхода ГК на 204%, увеличению конечной плотности культуры и снижению МВ до 1.67 МДа. На основе штамма AW007-4 с ослабленной конститутивной экспрессией pgsA и clsA удалось получить генетически стабильные штаммы с четырьмя вариантами гидовой РНК. Штаммы AW009-4 и AW011-4 продемонстрировали увеличение выхода, МВ и конечной плотности культуры на 10–15% по сравнению со штаммом AW007-4.
Инактивация генов факторов споруляции оказывает влияние на выход и МВ ГК. Штамм WmA с делецией гена сигма-фактора sigF, который участвует в активации генной сети ранней споруляции, демонстрирует больший на 30% выход ГК по сравнению со штаммом WA без делеции [41]. Продуценты на основе штамма WB600 демонстрировали больший выход ГК по сравнению с продуцентами на основе штамма B. subtilis 168. Так, в оптимальных условиях созданный на основе WB600 штамм WmB с делецией sigF накапливал в культуральной среде 3.21 г/л продукта, в то время как штамм 1B на основе 168 только 1.7 г/л. Обнаружен интересный эффект влияния температуры культивирования на МВ ГК. Культивирование при повышенной температуре 47°С приводило к резкому увеличению МВ ГК до 6.973 МДа. Культивирование при 32°С, при котором наблюдалось наибольшее количество продукта, приводило к синтезу ГК с МВ до 0.392 МДа.
Инактивация способности к споруляции в штаммах, полученных путем ненаправленного мутагенеза, положительно влияет на продукцию ГК. Так, штамм 3NA, содержащий мутацию гена инициации споруляции spo0A, способен достигать плотности культуры в 75 г/л в условиях ферментации с подпиткой, что делает его отличным кандидатом для использования в промышленности [53]. Оптимизация процесса культивирования и питательной среды позволила штамму KCNHA10, содержащему рекомбинантный оперон с генами szHasA, tuaD, gtaB и gcaD, достичь за 12 ч плотности культуры в 29.4 г/л и синтезировать 7 г ГК с МВ 1 МДа на литр культуры. Технико-экономический анализ данного производственного процесса продемонстрировал большую экономическую эффективность, чем у процесса на основе штаммов стрептококков.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА ХАРАКТЕРИСТИКИ ШТАММА-ПРОДУЦЕНТА И ПРОДУКТА, И ПУТИ ДАЛЬНЕЙШЕГО РАЗВИТИЯ ШТАММОВ-ПРОДУЦЕНТОВ
Данные, полученные в результате создания бактериальных штаммов-продуцентов ГК, позволяют сделать выводы о влиянии различных генетических факторов на выход и технические характеристики продукта.
Базовый штамм и его модификации
При создании рекомбинантных продуцентов были использованы различные штаммы B. subtilis, самым распространенным из которых является штамм 168 и его производные (табл. 3). Важными преимуществами штамма 168 являются способность расти на простых средах, изученная биохимия и генетика, простота генетических манипуляций и высокая эффективность трансформации. Штаммы WB600 и WB800N создавались на базе штамма 168 как платформы для эффективной гетерологичной экспрессии белков [54]. Для увеличения стабильности секретируемых белков в штамме WB800N сделаны делеции генов восьми внеклеточных протеаз – nprE, aprE, epr, bpr, mpr, nprB, vpr и wprA, а в штамме WB600 делетированы гены шести протеаз – nprE, aprE, epr, bpr, mpr, nprB. Такие модификации позволяют добиться повышения секреции и стабильности рекомбинантных белков, что актуально и для мембранных белков вроде HasA. Единственное описанное в литературе прямое сравнение эффективности штаммов показало преимущество дефицитного по внеклеточной протеазной активности штамма WB600 с делецией гена sigF над штаммом 168 при продукции ГК [41]. Штамм 3NA является мутантной версией штамма 168 со сдвигом рамки считывания гена spo0A и характеризуется отсутствием споруляции, низкой экспрессией протеаз и способностью достигать высокой клеточной плотности в условиях ферментации с подпиткой [53]. Штамм 168 и штаммы с мутациями сигма-факторов споруляции в условиях синтетической среды достигают плотности культуры 5–15 г/л, что существенно ниже такового у 3NA [55]. В сравнении со штаммом 168 геном штамма 3NA содержит 425 генетических вариаций, поэтому однозначно сделать вывод о мутации spo0A как причине приобретения улучшенных технологических свойств нельзя.
Таблица 3.
Штаммы B. subtilis, использованные при создании штаммов-продуцентов гиалуроновой кислоты
| Штамм | Генотип | Номер штамма в коллекциях | Ссылки |
|---|---|---|---|
| 168 | trpC2 | BGSC 1A1 | [37, 38] |
| 1012 | trpC2, leuA8, metB5, hsdRM1 | DSM 8773 | [36] |
| WB600 | trpC2, ΔnprE, ΔaprE, ΔnprB::EmR, Δbpr, Δmpr, Δepr | – | [41] |
| WB800N | trpC2, ΔnprE, ΔaprE, nprB::bsr, Δbpr, mpr::ble, Δepr, Δvpr, wprA::hyg, cm::NeoR | – | [36] |
| 3NA | trpC2, spo0A | BGSC 1S1 | [53] |
| A164∆5 | ATCC 6051a ∆amyE, ∆spoIIAC, ∆aprE, ∆nprE , ∆srfC | – | [31, 32] |
| BGSC 1A751 | His, ΔnprE, ΔaprE, ΔbglS, ΔbglC | BCRC 51921 | [35, 45, 48] |
В то же время B. subtilis 168 является модельным лабораторным штаммом и в процессе создания прошел многочисленные стадии ненаправленного мутагенеза, что привело к накоплению в его геноме многочисленных мутаций [56]. Сообщается о генетической нестабильности штамма 168 с интегрированным в геном опероном Pgrac-seHas‑tuaD [48]. По неизвестной причине при восстановлении из криохранения этот штамм формировал сегрегированные популяции с большинством клеток дикого немукоидного фенотипа. Такую же генетическую нестабильность демонстрировал штамм-продуцент на основе BGSC 1A786 (amyE::cat, lacA::spec, leuC8, metA4, hsd(RI)R+M–). Только продуценты на основе BGSC 1A751 демонстрировали генетическую стабильность характерного мукоидного фенотипа. Штамм 1A751, являющийся потомком штамма DB104, содержит мутации в генах протеаз nprE и aprE, а также делеции генов эндо-β-1,3-1,4-глюканазы bglS и эндо-β-1,4-глюканазы bglC [57].
Штаммы, отличные от B. subtilis 168, могут обладать свойствами, которые позволяют ожидать возможный положительный эффект на продукцию ГК. Так, промышленный штамм A164∆5, применяемый для рекомбинантной продукции белков, отличается улучшенными ростовыми характеристиками и высоким выходом секретируемых белков [32]. Штамм A164∆5 является улучшенной модификацией штамма ATCC 6051a, который также превосходит B. subtilis 168 по продукции рекомбинантных белков [58]. Модификации, которые позволили улучшить технологические свойства штамма ATCC 6051a, включают делецию генов: биосинтеза сурфактина srfC (снижение пенообразования), сигма-фактора F SpoIIAC (блокировка спорообразования), протеаз nprE и aprE, альфа-амилазы amyE. Недостатком штамма A164∆5 является низкая эффективность трансформации, что привело к необходимости использования для генно-инженерных манипуляций промежуточного штамма B. subtilis 16844 [32].
Гиалуронсинтаза
Выбор гена гиалуронсинтазы оказывает влияние на продукцию и МВ ГК. При создании штаммов-продуцентов ген гиалуронсинтазы выбирали основываясь либо на данных немногочисленных исследований каталитических свойств ферментов [31, 45, 48], либо по характеристикам продуктивности природных продуцентов [38, 53]. Так, рекомбинантная синтаза seHAS из S. equisimilis демонстрирует двукратно большую скорость элонгации, чем рекомбинантная синтаза spHAS из S. pyogenes [23, 59].
Прямое сравнение эффективности гиалуронсинтаз из Streptococcus было проведено in vitro и in vivo на платформе L. lactis [22]. В одинаковых условиях гиалуронсинтазы различаются по МВ синтезируемой ГК. Максимальный МВ ГК, синтезируемой рекомбинантными штаммами L. lactis in vivo, коррелирует с результатами, полученными in vitro, и составляет для suHAS из S. uberis и spaHAS из S. parauberis ~2.2 МДа, для szHAS из S. zooepidemicus ~1.4 МДа, для spHAS ~0.4 МДа. Величина МВ ГК хорошо согласуется с филогенетической группировкой по аминокислотным последовательностям гиалуронсинтаз. Так, suHAS и spaHAS образуют одну филогенетическую группу, отличную от szHAS и spHAS. Однако авторам не удалось получить результатов с генами гиалуронсинтаз из S. equi subsp. equi и S. iniae на платформе Lactococcus in vivo, хотя штаммы S. equi subsp. equi известны как эффективные продуценты ГК.
Получены интересные результаты с гиалуронсинтазой 2-го типа из P. multocida [37]. В отличие от синтаз из стрептококков гиалуронсинтаза PmHAS не является мембранным белком и содержит на C-конце якорный домен, который удерживает фермент с внутренней стороны плазматической мембраны. В оперон биосинтеза ГК P. multocida входят дополнительные гены, гомологичные белкам мембранных транспортеров – hexA, hexB, hexC, hexD [60]. Функции синтеза ГК и трансмембранного переноса ГК у P. multocida разделены между синтазой PmHAS и белками hexA, hexB, hexC и hexD [61, 62]. Гиалуронсинтазы 1-го типа, к которым относятся синтазы стрептококков, совмещают функции синтеза и транслокации цепи ГК во внеклеточное пространство [63]. Было сделано предположение, что в транслокации ГК во внеклеточное пространство S. pyogenes задействован ABC-транспортерный комплекс [64]. Однако данная гипотеза опровергается как данными in vitro исследований [65, 66], так и опытом успешной гетерологичной продукции ГК на различных микробных платформах с помощью гиалуронсинтаз 1-го типа [18]. Гиалуронсинтаза PmHAS была использована при создании продуцентов ГК на платформах E. coli [67], Agrobacterium sp. [68] и Synechococcus sp. [69]. Экспрессия PmHAS в штаммах E. coli и Agrobacterium sp. приводила к повышению вязкости культуральной жидкости, что свидетельствовало о внеклеточном накоплении ГК. Распределение синтезированной ГК между внеклеточной, сорбированной на поверхности и внутриклеточной фракциями было выяснено при изучении штаммов-продуцентов, созданных на основе цианобактерии Synechococcus. Обнаружено, что от 42 до 88% тотальной ГК накапливалось во внутриклеточном пространстве данных штаммов. Внутриклеточное накопление ГК являлось одной из причин снижения скорости роста продуцентов. Вопрос о механизме экспорта ГК во внеклеточное пространство у рекомбинантных штаммов, экспрессирующих PmHAS, остается открытым. Гиалуронсинтаза PmHAS обладает значительным биотехнологическим потенциалом и способна синтезировать высокомолекулярную ГК. Делеция якорного домена позволяет получить PmHAS в растворимом виде, что делает ее очевидным кандидатом для бесклеточного способа синтеза ГК, который позволяет получать монодисперсный высокомолекулярный продукт [21]. Также фермент PmHAS превосходит стрептококковые гиалуронсинтазы по кинетическим характеристикам: величины Kм ниже стрептококковых в 2 раза и составляют 75 и 20 мкM для УДФ-N-ацетилглюкозоамина и УДФ-глюкуроновой кислоты соответственно [70]. Необходима дальнейшая работа для прояснения роли транспортных систем в транслокации ГК во внеклеточное пространство как у штаммов P. multocida, так и у рекомбинантных штаммов на основе PmHAS на различных платформах.
Возможность получения PmHAS в растворимой форме облегчает задачу улучшения характеристик фермента эволюционными методами и методами рационального конструирования. Так, комбинирование найденных с помощью эволюционного метода KnowVolution четырех аминокислотных замен позволило получить вариант PmHAS, способный синтезировать ГК с массой до 4.7 МДа [71]. Рациональное конструирование улучшенных вариантов гиалуронсинтаз 1-го типа осложняется отсутствием модели трехмерной структуры белка, хотя методами численного моделирования частично восполняется данный пробел [72]. К настоящему моменту известна только одна работа по улучшению характеристик гиалуронсинтазы szHAS с помощью эволюционного метода [73]. С помощью отбора in vivo на штаммах B. subtilis удалось выявить вариант szHAS, который демонстрировал увеличение выхода ГК с 1.22 до 2.24 г/л при увеличении МВ с 1.20 до 1.36 МДа.
Путь биосинтеза предшественников
Геном B. subtilis содержит все гены биосинтеза УДФ-глюкуроната и УДФ-N-ацетилглюкозоамина, однако гетерологичная экспрессия только гиалуронсинтазы не приводит к синтезу ГК. Эффективный биосинтез ГК рекомбинантными продуцентами может осуществляться только с минимального оперона, в который входит, помимо гиалуронсинтазы, ген УДФ-глюкозодегидрогеназы, катализирующий последний этап биосинтеза УДФ-глюкуроната. Дополнение минимального оперона генами биосинтеза УДФ-N-ацетилглюкозоамина приводит к значительно меньшему эффекту повышения выхода ГК по сравнению с добавлением гена УДФ-глюкозодегидрогеназы [31]. Необходимость гетерологичной экспрессии УДФ-глюкозодегидрогеназы связана с отсутcтвием экспрессии гена tuaD (гомолога гена ugd из E. coli и hasB из Streptococcus), который входит в состав оперона биосинтеза тейхуроновой кислоты tuaABCEDFGH. Тейхуроновая кислота является анионным полимером, синтез которого активируется в условиях фосфатного голодания для замены в составе клеточной стенки богатой фосфором тейхоевой кислоты [74]. Также о принципиальной важности УДФ-глюкозодегидрогеназы свидетельствует факт обязательного наличия гена hasB в оперонах биосинтеза ГК у представителей рода Streptococcus, где минимальный оперон состоит из генов hasA и hasB (как у S. uberis). Выдвинута гипотеза о возникновении у предкового штамма оперона биосинтеза ГК как пары hasA/hasB, в который остальные гены биосинтеза предшественников (hasC, hasD, hasE) добавлялись в процессе эволюции [75]. Делеция гена hasB у S. zooepidemicus приводит к полной инактивации биосинтеза ГК и оказывает незначительный эффект на ростовые свойства штамма [30]. В ряде работ продемонстрировано накопление ГК штаммами-продуцентами B. subtilis с рекомбинантными оперонами, которые не содержат гена tuaD или его гомолога [37, 38]. С учетом роли УДФ-глюкозодегидрогеназы и принимая во внимание характер ее экспрессии, представляется необходимым провести дальнейшие исследования по данному вопросу.
Расширение рекомбинантного оперона генами биосинтеза предшественников приводит к увеличению выхода ГК у рекомбинантных штаммов на основе платформ B. subtilis, C. glutamicum и L. lactis [18]. Комбинация различных генов приводит к увеличению выхода ГК с разной эффективностью. Включение в состав искусственного оперона, содержащего szHas и tuaD, генов gtaB, glmM и gcaD приводит к увеличению выхода ГК на 30% [38].
Расширенный оперон биосинтеза ГК оказывает значительное влияние на продукцию ГК у природных продуцентов. Так, штаммы S. equi и S. zooepidemicus, содержащие в геноме оперон hasABCDE, продуцируют существенно больше ГК, чем S. uberis и S. pyogenes, содержащие hasAВС и hasAВ соответственно [75]. Вероятно, включение дополнительных генов в оперон подвидов S. equi происходило под давлением селективного отбора на продукцию ГК, что привело к способности направлять до 10% поступающих сахаров в биосинтез ГК [76].
Важным аспектом, влияющим на производительность штамма и МВ продукта, является уровень экспрессии гиалуронсинтазы и генов биосинтеза предшественников. Высокий уровень экспрессии tuaD, который является токсичным для E. coli и осложняет создание генно-инженерных конструкций [38], может оказать негативное влияние и на физиологию B. subtilis [36]. Так, снижение эффективности промотора Pgrac оперона seHas-tuaD привело к увеличению выхода ГК на 100%, снижению МВ на 17% и увеличению конечной плотности культуры на 47% [45].
Уровень экспрессии гиалуронсинтазы и генов биосинтеза предшественников, который зависит от состава рекомбинантного оперона и силы промоторов, определяет баланс УДФ-глюкуроната и УДФ-N-ацетилглюкозоамина в клетке и в конечном итоге МВ продукта. Повышенная по отношению к hasB экспрессия hasA приводит к снижению МВ ГК, синтезируемой рекомбинантным штаммом L. lactis [77]. Гиперэкспрессия генов пути биосинтеза УДФ-глюкуроната у штамма S. equi снижает МВ ГК, в то время как гиперэкспрессия генов пути биосинтеза УДФ-N-ацетилглюкозоамина приводит к повышению МВ с 1.8 до 3.4 МДа. Выявлена корреляция между МВ ГК и концентрацией УДФ-N-ацетилглюкозоамина. Биосинтез высокомолекулярной ГК является результатом баланса концентраций предшественников, который может быть доведен до оптимального значения генетическими методами [78]. Для рекомбинантных продуцентов на платформе L. lactis оптимальными условиями для синтеза высокомолекулярной ГК являлись: эквимолярная внутриклеточная концентрация УДФ-N-ацетилглюкозоамина и УДФ-глюкуроната и повышенная по отношению к hasA экспрессия hasB [79]. Схожим эффектом повышения МВ ГК обладает добавление в культуральную среду N-ацетилглюкозоамина, причем как в случае природных продуцентов, так и в случае рекомбинантных продуцентов на основе B. subtilis [45].
Энергетический и основной метаболизм
Биосинтез ГК является энергетически затратным процессом. Для получения 1 моля УДФ-N-ацетилглюкозамина и 1 моля УДФ-глюкуроната клетка затрачивает 2 моля глюкозы, 3 моля АТФ, 2 моля УТФ и 1 моль ацетил-КоА. Перспективными подходами к увеличению выхода ГК являются инактивация путей конкурентной утилизации предшественников и повышение уровня синтеза АТФ.
Гомоферментативное брожение, в основе которого лежит гликолиз, – основной способ получения энергии для молочнокислых бактерий, таких как S. zooepidermicus и L. lactis. Результатом этого процесса является образование двух молекул пирувата, двух молекул НАД · Н2 и двух молекул АТФ на одну молекулу глюкозы. Регенерация НАД+ осуществляется путем переноса двух электронов с НАД · Н2 на молекулу пирувата, что приводит к образованию лактата. Однако в аэробных условиях молочнокислые бактерии, в клетках которых отсутствует электронно-транспортная цепь, регенерируют НАД+ с помощью фермента НАД · Н2 оксидазы (NOX), что приводит к перенаправлению метаболического потока в сторону образования ацетата и образованию дополнительной молекулы АТФ на молекулу глюкозы в реакции, катализируемой ацетаткиназой (АК) [80]. Синтез дополнительного АТФ в ацетаткиназной реакции и повышение скорости регенерации НАД+ благодаря NOX коррелируют с повышением уровня синтеза ГК продуцентами на основе молочнокислых бактерий. В аэробных условиях S. zoopidemicus не только быстрее росли и накапливали биомассу, но и демонстрировали более высокие МВ и уровень биосинтеза ГК по сравнению с анаэробными условиями [81, 82]. Однако прямая гиперэкспрессия NOX в штамме S. zooepidemicus, несмотря на увеличение уровня синтеза АТФ на 33% и продукции биомассы на 15%, не приводила к увеличению выхода ГК или изменению МВ. Вероятно, в этом случае основным лимитирующим фактором являлась активность пируватдегидрогеназного комплекса, осуществляющего конверсию пирувата в ацетил-КоА [83]. В то же время рекомбинантные продуценты ГК на основе штамма L. lactis с делецией гена ldh демонстрировали трехкратное увеличение продукции ГК и МВ ГК [84].
В отличие от стрептококков, которые в присутствии кислорода регенерируют НАД+ с помощью NOX и синтезируют дополнительный АТФ с помощью фермента АК, B. subtilis используют для этого электронно-транспортную цепь и цикл трикарбоновых кислот [85]. При аэробном культивировании рекомбинантных продуцентов ГК на основе B. subtilis побочными продуктами ферментации были ацетат и ацетоин [45]. Однако снижение уровня синтеза ацетата путем инактивации пируват-дегидрогеназного комплекса создает дефицит ацетил-КоА для цикла трикарбоновых кислот, что приводит к снижению выработки АТФ [86]. Инактивация гена alsD 2-ацетолактат-декарбоксилазы, участвующей в синтезе ацетоина, негативно отражается на росте штаммов B. subtilis, хотя выяснение механизма данного явления требует дальнейших исследований [86].
Увеличение доступности кислорода для клеток является эффективной стратегией активизации биосинтеза ГК, несмотря на то что механизм эффекта различается для молочнокислых бактерий и бацилл. Концентрация кислорода в культуральной среде – лимитирующий фактор при биосинтезе ГК штаммами S. zooepidemicus и B. subtilis в силу низкой растворимости газообразного кислорода и высокой вязкости растворов ГК [87, 88]. Технологическим решением этой проблемы является повышение кислородной емкости среды путем оптимизации скорости перемешивания и применения кислородных векторов – гидрофобных жидкостей, в которых кислород имеет более высокую растворимость, чем в воде. Такой подход увеличивает выход ГК штаммами S. zooepidemicus [89]. Существенное увеличение выхода ГК и повышение плотности культуры рекомбинантного штамма B. subtilis наблюдалось при применении н-гептана, н-гексадиена, перфлуорометилдекалина и перфлуоро-1,3-диметилциклогексана. Оптимизация условий ферментации – концентрации кислородного вектора, времени его добавления и скорости перемешивания позволяло достичь концентрации ГК в 4.5 г/л всего за 10 ч культивирования [88].
При конструировании штаммов-продуцентов активно используется бактериальный гемоглобин VHb из грамотрицательной бактерии Vitreoscilla [34]. Гемоглобин VHb усиливает поток кислорода к терминальным оксидазам в условиях гипоксии, поэтому гиперэкспрессия VHb приводит к увеличению плотности культур, усилению окислительного метаболизма и выхода целевого продукта, особенно в условиях ограниченной доступности кислорода. Экспрессия VHb в B. subtilis приводила к увеличению секреции белков и повышению выхода альфа-амилазы и нейтральной протеазы [90]. Гетерологичная экспрессия VHb штаммом S. zooepidemicus ATCC 39920, продуцирующим ГК, приводила к повышению выхода ГК с 1.61 до 2.16 г/л при снижении МВ с 1.8 до 1.6 МДа [91]. При этом наблюдалось снижение продукции молочной кислоты на 35% на фоне снижения активности лактатдегидрогеназы ldh на 41% и повышение активности ацетаткиназы и NOX на 9 и 106% соответственно. Более впечатляющие результаты были получены на продуценте на основе B. subtilis, однако влияние коэкспрессии VHb на МВ ГК в данной работе исследовано не было [35].
УДФ-глюкуронат и УДФ-N-ацетилглюкозоамин используются клеткой в биосинтезе компонентов клеточной стенки, а их предшественники глюкозо-6-фосфат и фруктозо-6-фосфат расходуются в пентозофосфатном пути и гликолизе. Инактивация путей конкурентной утилизации УДФ-глюкуроната и УДФ-N-ацетилглюкозоамина оказывала большее влияние на ростовые характеристики штаммов B. subtilis и выход ГК, чем гиперэкспрессия генов пути биосинтеза прекурсоров [38, 45]. Кроме того, штаммы со сниженной активностью pfkA и zwf демонстрировали пониженный уровень продукции ацетата и ацетоина, что свидетельствует об эффективном перераспределении метаболического потока с побочных продуктов биосинтеза на ГК [45].
Утилизация сахаров
Способом улучшения штаммов-продуцентов является увеличение транспорта и метаболизма источников энергии. Исследована функция генов метаболизма сахарозы и проведена идентификация лимитирующих выход ГК стадий у штамма S. zooepidemicus [92]. Первыми стадиями утилизации сахарозы являются мембранный транспорт c фосфорилированием посредством фосфоенолпируват-зависимой фосфотрансферазной системы (кодируется геном scrA) с последующим гидролизом сахарозо-6-фосфата сахарозо-6-фосфатгидролазой (кодируется геном scrB) до фруктозы и глюкозо-6-фосфата. Гиперэкспрессия scrB, в отличие от обратного эффекта гиперэкспрессии scrA, увеличивает биомассу на 26% и выход ГК на 30%. Смещение метаболического потока к фруктозо-6-фосфату через делецию гена транспорта фруктозы fruA или фосфофруктокиназы fruK приводит к повышению выхода ГК на 22 и 27% соответственно без эффекта на клеточный рост. Гиперэкспрессия scrB в штаммах с делецинй либо fruA, либо fruK приводит к увеличению выхода ГК на 44 и 55% соответственно.
Основная система транспорта и утилизации сахарозы у B. subtilis идентична таковой у S. zooepidemicus и состоит из оперона, кодирующего фосфотрансферазу SacP и сахарозо-6-фосфатгидролазу SacA [93]. Замена собственной системы транспорта и метаболизма сахарозы у B. subtilis на энергетически более выгодную гетерологичную систему продемонстрирована на продуцентах полиглутаминовой кислоты и 2,3-бутандиола. Комбинация сахарозопермеазы cscB из E. coli и сахарозофосфорилазы sucP из Bifidobacterium adolescentis продемонстрировала увеличение потребления сахарозы на 49.4% и продукции полиглутаминовой кислоты на 38.5% по сравнению с неизмененным штаммом [94]. Комбинация сахарозопермеазы cscB из E. coli и сахарозофосфорилазы gtfA из Streptococcus mutans продемонстрировала увеличение выхода продукта на 36% по сравнению с неизмененными штаммами [95].
ЗАКЛЮЧЕНИЕ
В настоящее время создана целая линейка штаммов-продуцентов ГК на основе платформы B. subtilis. Важными преимуществами данных штаммов являются статус GRAS (Generally Recognized as Safe), низкая стоимость промышленной ферментации, легкость генетических манипуляций и отсутствие эндо- и экзотоксинов. Созданные на основе B. subtilis рекомбинантные штаммы-продуценты ГК позволяют получать выход и МВ продукта, сопоставимого с таковым у промышленно освоенных штаммов стрептококков. В то же время проведенные работы выявили ограничения платформы, которые могут быть преодолены с привлечением опыта создания продуцентов ГК на основе других микробных платформ. Анализ опубликованных в литературе данных позволяет утверждать, что сформированы условия для создания промышленной технологии получения ГК на основе штаммов-продуцентов B. subtilis.
Авторы благодарят за помощь в подготовке рукописи и ценные замечания к.б.н. О.В. Березину.
Работа частично поддержана Министерством науки и высшего образования Российской Федерации (Контракт в системе электронный бюджет № 075-10-2021-113, ID проекта: RF—193021X0001).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют об отсутствии конфликта интересов.
Список литературы
Weissmann B., Meyer K. The structure of hyalobiuronic acid and of hyaluronic acid from umbilical cord // J. Am. Chem. Society. 1954. V. 76. № 7. P. 1753–1757. https://doi.org/10.1021/ja01636a010
Fallacara A., Baldini E., Manfredini S. et al. Hyaluronic acid in the third millennium // Polymers. 2018. V. 10. № 7. https://doi.org/10.3390/polym10070701
Scott J.E., Heatley F. Hyaluronan forms specific stable tertiary structures in aqueous solution: a 13C NMR study // PNAS. 1999. V. 96. № 9. P. 4850–4855. https://doi.org/10.1073/pnas.96.9.4850
Rwei S.P., Chen S.W., Mao C.F. et al. Viscoelasticity and wearability of hyaluronate solutions // Biochem. Engineering J. 2008. V. 40. № 2. P. 211–217. https://doi.org/10.1016/j.bej.2007.12.021
Pisárčik M., Bakoš D., Čeppan M. Non-Newtonian properties of hyaluronic acid aqueous solution // Colloids and Surfaces A: Physicochemical and Engineering Aspects. 1995. V. 97. № 3. P. 197–202. https://doi.org/10.1016/0927-7757(95)03097-W
Laurent T.C., Fraser J.R.E. Hyaluronan // The FASEB J. 1992. V. 6. № 7. P. 2397–2404. https://doi.org/10.1096/fasebj.6.7.1563592
Cyphert J.M., Trempus C.S., Garantziotis S. Size matters: Molecular weight specificity of hyaluronan effects in cell biology // Int. J. Cell Biology. 2015. V. 2015. P. 563818. https://doi.org/10.1155/2015/563818
Robert L., Robert A.M., Renard G. Biological effects of hyaluronan in connective tissues, eye, skin, venous wall. Role in aging // Pathologie-Biologie. 2010. V. 58. № 3. P. 187–198. https://doi.org/10.1016/j.patbio.2009.09.010
Girish K.S., Kemparaju K. The magic glue hyaluronan and its eraser hyaluronidase: a biological overview // Life Sci. 2007. V. 80. № 21. P. 1921–1943. https://doi.org/10.1016/j.lfs.2007.02.037
Jiang D., Liang J., Noble P.W. Hyaluronan in tissue injury and repair // Annual Rev. Cell and Developmental Biol. 2007. V. 23. P. 435–461. https://doi.org/10.1146/annurev.cellbio.23.090506.123337
Heldin P., Lin C.Y., Kolliopoulos C. et al. Regulation of hyaluronan biosynthesis and clinical impact of excessive hyaluronan production // Matrix Biol. 2019. V. 78–79. P. 100–117. https://doi.org/10.1016/j.matbio.2018.01.017
Campo G.M., Avenoso A., D’Ascola A. et al. 4-mer hyaluronan oligosaccharides stimulate inflammation response in synovial fibroblasts in part via TAK-1 and in part via p38-MAPK // Current Med. Chemistry. 2013. V. 20. № 9. P. 1162–1172. https://doi.org/10.2174/0929867311320090005
Toole B.P., Ghatak S., Misra S. Hyaluronan oligosaccharides as a potential anticancer therapeutic // Current Pharmaceutical Biotechnol. 2008. V. 9. № 4. P. 249–252. https://doi.org/10.2174/138920108785161569
Dovedytis M., Liu Z.J., Bartlett S. Hyaluronic acid and its biomedical applications: A review // Engineered Regeneration. 2020. V. 1. P. 102–113. https://doi.org/10.1016/j.engreg.2020.10.001
Boeriu C.G., Springer J., Kooy F.K. et al. Production methods for hyaluronan // Int. J. Carbohydrate Chemistry. 2013. V. 2013. P. 1–14. https://doi.org/10.1155/2013/624967
Shiedlin A., Bigelow R., Christopher W. et al. Evaluation of hyaluronan from different sources: Streptococcus zooepidemicus, rooster comb, bovine vitreous, and human umbilical cord // Biomacromolecules. 2004. V. 5. № 6. P. 2122–2127. https://doi.org/10.1021/bm0498427
Zagorulko Y.Y., Zagorulko E.Y. Features of hyaluronic acid solutions for intra-articular introduction and recent trends in their development (review) // Drug Development & Registration. 2020. V. 9. № 2. P. 45–54. https://doi.org/10.33380/2305-2066-2020-9-2-45-54
Oliveira J.D. de, Carvalho L.S., Gomes A.M.V. et al. Genetic basis for hyper production of hyaluronic acid in natural and engineered microorganisms // Microbial Cell Factories. 2016. V. 15. № 1. P. 119. https://doi.org/10.1186/s12934-016-0517-4
Liu L., Liu Y., Li J. et al. Microbial production of hyaluronic acid: current state, challenges, and perspectives // Microbial Cell Factories. 2011. V. 10. P. 99. https://doi.org/10.1186/1475-2859-10-99
Gunasekaran V., Gowdhaman D., Ponnusami P. Role of membrane proteins in bacterial synthesis of hyaluronic acid and their potential in industrial production // Int. J. Biol. Macromolecules. 2020. V. 164. P. 1916–1926. https://doi.org/10.1016/j.ijbiomac.2020.08.077
Gottschalk J., Elling L. Current state on the enzymatic synthesis of glycosaminoglycans // Current Opinion in Chem. Biology. 2021. V. 61. P. 71–80. https://doi.org/10.1016/j.cbpa.2020.09.008
Schulte S., Doss S.S., Jeeva P. et al. Exploiting the diversity of streptococcal hyaluronan synthases for the production of molecular weight-tailored hyaluronan // Applied Microbiol. Biotechnol. 2019. V. 103. № 18. P. 7567–7581. https://doi.org/10.1007/s00253-019-10023-w
Kumari K., Weigel P.H. Molecular cloning, expression, and characterization of the authentic hyaluronan synthase from group C Streptococcus equisimilis // The J. Biol. Chemistry. 1997. V. 272. № 51. P. 32539–32546. https://doi.org/10.1074/jbc.272.51.32539
Oh S.Y., Budzik J.M., Garufi G. et al. Two capsular polysaccharides enable Bacillus cereus G9241 to cause anthrax-like disease // Mol. Microbiol. 2011. V. 80. № 2. P. 455–470. https://doi.org/10.1111/j.1365-2958.2011.07582.x
DeAngelis P.L., Jing W., Drake R.R. et al. Identification and molecular cloning of a unique hyaluronan synthase from Pasteurella multocida // The J. Biol. Chemistry. 1998. V. 273. № 14. P. 8454–8458. https://doi.org/10.1074/jbc.273.14.8454
Schmidt K.H., Günther E., Courtney H.S. Expression of both M protein and hyaluronic acid capsule by group A streptococcal strains results in a high virulence for chicken embryos // Med. Microbiol. Immunol. 1996. V. 184. № 4. P. 169–173. https://doi.org/10.1007/BF02456131
DeAngelis P.L. Hyaluronan synthases: Fascinating glycosyltransferases from vertebrates, bacterial pathogens, and algal viruses // Cell. Mol. Life Sciences: CMLS. 1999. V. 56. P. 670–682. https://doi.org/10.1007/s000180050461
Weigel P.H., DeAngelis P.L. Hyaluronan synthases: A decade-plus of novel glycosyltransferases // The J. Biol. Chemistry. 2007. V. 282. № 51. P. 36777–36781. https://doi.org/10.1074/jbc.R700036200
Chong B.F., Blank L.M., Mclaughlin R. et al. Microbial hyaluronic acid production // Applied Microbiol. Biotechnol. 2005. V. 66. № 4. P. 341–351. https://doi.org/10.1007/s00253-004-1774-4
Zhang Y., Luo K., Zhao Q. et al. Genetic and biochemical characterization of genes involved in hyaluronic acid synthesis in Streptococcus zooepidemicus // Applied Microbiol. Biotechnol. 2016. V. 100. № 8. P. 3611–3620. https://doi.org/10.1007/s00253-016-7286-1
Widner B., Behr R., Dollen S. von et al. Hyaluronic acid production in Bacillus subtilis // Applied Environmental Microbiol. 2005. V. 71. № 7. P. 3747–3752. https://doi.org/10.1128/AEM.71.7.3747-3752.2005
Sloma A., Behr R., Widner W. et al. Methods for producing hyaluronan in a recombinant host cell. United States Patent 8093036. 2012.
DeAngelis P.L., Papaconstantinou J., Weigel P.H. Molecular cloning, identification, and sequence of the hyaluronan synthase gene from group A Streptococcus pyogenes // The J. Biol. Chemistry. 1993. V. 268. № 26. P. 19181–19184. https://doi.org/10.1016/S0021-9258(19)36494-4
Stark B.C., Pagilla K.R., Dikshit K.L. Recent applications of Vitreoscilla hemoglobin technology in bioproduct synthesis and bioremediation // Applied Microbiol. Biotechnol. 2015. V. 99. № 4. P. 1627–1636. https://doi.org/10.1007/s00253-014-6350-y
Chien L.J., Lee C.-K. Enhanced hyaluronic acid production in Bacillus subtilis by coexpressing bacterial hemoglobin // Biotechnol. Progress. 2007. V. 23. № 5. P. 1017–1022. https://doi.org/10.1021/bp070036w
Corsa V., Negro A., Vaccaro S., Messina L. Method for obtaining recombinant host bacterial cells that produce hyaluronic acid. United States Patent 9290785. 2012.
Jia Y., Zhu J., Chen X. et al. Metabolic engineering of Bacillus subtilis for the efficient biosynthesis of uniform hyaluronic acid with controlled molecular weights // Bioresource Technology. 2013. V. 132. P. 427–431. https://doi.org/10.1016/j.biortech.2012.12.150
Jin P., Kang Z., Yuan P. et al. Production of specific-molecular-weight hyaluronan by metabolically engineered Bacillus subtilis 168 // Metabolic Engineering. 2016. V. 35. P. 21–30. https://doi.org/10.1016/j.ymben.2016.01.008
Jin P., Kang Z., Zhang N. et al. High-yield novel leech hyaluronidase to expedite the preparation of specific hyaluronan oligomers // Sci. Reports. 2014. V. 4. P. 4471. https://doi.org/10.1038/srep04471
Yuan P., Lv M., Jin P. et al. Enzymatic production of specifically distributed hyaluronan oligosaccharides // Carbohydrate Polymers. 2015. V. 129. P. 194–200. https://doi.org/10.1016/j.carbpol.2015.04.068
Li Y., Li G., Zhao X. et al. Regulation of hyaluronic acid molecular weight and titer by temperature in engineered Bacillus subtilis // 3 Biotech. 2019. V. 9. № 6. P. 225. https://doi.org/10.1007/s13205-019-1749-x
Li Y., Shi Z., Shao Y. et al. Temperature-controlled molecular weight of hyaluronic acid produced by engineered Bacillus subtilis // Biotechnol. Letters. 2021. V. 43. № 1. P. 271–277. https://doi.org/10.1007/s10529-020-03001-0
Миронов А.С., Эрраис Л.Л., Королькова Н.В. и др. Бактерия рода Bacillus, продуцирующая гиалуроновую кислоту, и способ получения гиалуроновой кислоты с использованием указанной бактерии. Патент РФ 2719140. 2020.
Миронов А.С., Эрраис Л.Л., Баева О.В. и др. Тандемный промотор, функционирующий в бактерии рода Bacillus, трансформированная бактерия рода Bacillus – продуцент целевого продукта, содержащая указанный промотор, и способ получения целевого продукта с использованием указанной бактерии. Патент РФ 2723722. 2020.
Westbrook A.W., Ren X., Oh J. et al. Metabolic engineering to enhance heterologous production of hyaluronic acid in Bacillus subtilis // Metabolic Engineering. 2018. V. 47. P. 401–413. https://doi.org/10.1016/j.ymben.2018.04.016
Fischer E., Sauer U. Large-scale in vivo flux analysis shows rigidity and suboptimal performance of Bacillus subtilis metabolism // Nat. Genetics. 2005. V. 37. № 6. P. 636–640. https://doi.org/10.1038/ng1555
Westbrook A.W., Moo-Young M., Chou C.P. Development of a CRISPR-Cas9 tool kit for comprehensive engineering of Bacillus subtilis // Applied Environmental Microbiol. 2016. V. 82. № 16. P. 4876–4895. https://doi.org/10.1128/AEM.01159-16
Westbrook A.W., Ren X., Moo-Young M. et al. Engineering of cell membrane to enhance heterologous production of hyaluronic acid in Bacillus subtilis // Biotechnol. Bioengineering. 2018. V. 115. № 1. P. 216–231. https://doi.org/10.1002/bit.26459
Triscott M.X., van de Rijn I. Solubilization of hyaluronic acid synthetic activity from streptococci and its activation with phospholipids // The J. Biol. Chemistry. 1986. V. 261. № 13. P. 6004–6009. https://doi.org/10.1016/S0021-9258(17)38485-5
Salzberg L.I., Helmann J.D. Phenotypic and transcriptomic characterization of Bacillus subtilis mutants with grossly altered membrane composition // J. Bacteriology. 2008. V. 190. № 23. P. 7797–7807. https://doi.org/10.1128/JB.00720-08
Kawai F., Shoda M., Harashima R. et al. Cardiolipin domains in Bacillus subtilis marburg membranes // J. Bacteriology. 2004. V. 186. № 5. P. 1475–1483. https://doi.org/10.1128/jb.186.5.1475-1483.2004
Nishibori A., Kusaka J., Hara H. et al. Phosphatidylethanolamine domains and localization of phospholipid synthases in Bacillus subtilis membranes // J. Bacteriology. 2005. V. 187. № 6. P. 2163–2174. https://doi.org/10.1128/JB.187.6.2163-2174.2005
Cerminati S., Leroux M., Anselmi P. et al. Low cost and sustainable hyaluronic acid production in a manufacturing platform based on Bacillus subtilis 3NA strain // Applied Microbiol. Biotechnol. 2021. V. 105. № 8. P. 3075–3086. https://doi.org/10.1007/s00253-021-11246-6
Wu S.C., Yeung J.C., Duan Y. et al. Functional production and characterization of a fibrin-specific single-chain antibody fragment from Bacillus subtilis: Effects of molecular chaperones and a wall-bound protease on antibody fragment production // Applied Environmental Microbiol. 2002. V. 68. № 7. P. 3261–3269. https://doi.org/10.1128/aem.68.7.3261-3269.2002
Reuß D.R., Schuldes J., Daniel R. et al. Complete genome sequence of Bacillus subtilis subsp. subtilis strain 3NA // Genome Announcements. 2015. V. 3. № 2. https://doi.org/10.1128/genomeA.00084-15
Zeigler D.R., Prágai Z., Rodriguez S. et al. The origins of 168, W23, and other Bacillus subtilis legacy strains // J. Bacteriology. 2008. V. 190. № 21. P. 6983–6995. https://doi.org/10.1128/JB.00722-08
Wolf M., Geczi A., Simon O. et al. Genes encoding xylan and beta-glucan hydrolysing enzymes in Bacillus subtilis: Characterization, mapping and construction of strains deficient in lichenase, cellulase and xylanase // Microbiology (Reading, England). 1995. V. 141 (Pt 2). P. 281–290. https://doi.org/10.1099/13500872-141-2-281
Kabisch J., Thürmer A., Hübel T. et al. Characterization and optimization of Bacillus subtilis ATCC 6051 as an expression host // J. Biotechnology. 2013. V. 163. № 2. P. 97–104. https://doi.org/10.1016/j.jbiotec.2012.06.034
Tlapak-Simmons V.L., Baggenstoss B.A., Kumari K. et al. Kinetic characterization of the recombinant hyaluronan synthases from Streptococcus pyogenes and Streptococcus equisimilis // The J. Biol. Chemistry. 1999. V. 274. № 7. P. 4246–4253. https://doi.org/10.1074/jbc.274.7.4246
Chung J.Y., Zhang Y., Adler B. The capsule biosynthetic locus of Pasteurella multocida A:1 // FEMS Microbiol. Letters. 1998. V. 166. № 2. P. 289–296. https://doi.org/10.1111/j.1574-6968.1998.tb13903.x
Chung J.Y., Wilkie I., Boyce J.D. et al. Role of capsule in the pathogenesis of fowl cholera caused by Pasteurella multocida serogroup A // Infection Immunity. 2001. V. 69. № 4. P. 2487–2492. https://doi.org/10.1128/IAI.69.4.2487-2492.2001
Zhang Y.F. Construction and characterization of an acapsular mutant of Pasteurella multocida strain P-1059 (A:3) // J. Vaccines & Vaccination. 2013. V. 04. № 04. https://doi.org/10.4172/2157-7560.1000184
Hubbard C., McNamara J.T., Azumaya C. et al. The hyaluronan synthase catalyzes the synthesis and membrane translocation of hyaluronan // J. Mol. Biology. 2012. V. 418. № 1–2. P. 21–31. https://doi.org/10.1016/j.jmb.2012.01.053
Ouskova G., Spellerberg B., Prehm P. Hyaluronan release from Streptococcus pyogenes: export by an ABC transporter // Glycobiology. 2004. V. 14. № 10. P. 931–938. https://doi.org/10.1093/glycob/cwh115
Kumari K., Baggenstoss B.A., Parker A.L. et al. Mutation of two intramembrane polar residues conserved within the hyaluronan synthase family alters hyaluronan product size // The J. Biol. Chemistry. 2006. V. 281. № 17. P. 11755–11760. https://doi.org/10.1074/jbc.M600727200
Medina A.P., Lin J., Weigel P.H. Hyaluronan synthase mediates dye translocation across liposomal membranes // BMC Biochemistry. 2012. V. 13. P. 2. https://doi.org/10.1186/1471-2091-13-2
Mao Z., Shin H.D., Chen R. A recombinant E. coli bioprocess for hyaluronan synthesis // Applied Microbiol. Biotechnol. 2009. V. 84. № 1. P. 63–69. https://doi.org/10.1007/s00253-009-1963-2
Mao Z., Chen R.R. Recombinant synthesis of hyaluronan by Agrobacterium sp. // Biotechnol. Progress. 2007. V. 23. № 5. P. 1038–1042. https://doi.org/10.1021/bp070113n
Zhang L., Toscano Selão T., Nixon P.J. et al. Photosynthetic conversion of CO2 to hyaluronic acid by engineered strains of the cyanobacterium Synechococcus sp. PCC 7002 // Algal Research. 2019. V. 44. P. 101702. https://doi.org/10.1016/j.algal.2019.101702
DeAngelis P.L. Enzymological characterization of the Pasteurella multocida hyaluronic acid synthase // Biochemistry. 1996. V. 35. № 30. P. 9768–9771. https://doi.org/10.1021/bi960154k
Mandawe J., Infanzon B., Eisele A. et al. Directed evolution of hyaluronic acid synthase from Pasteurella multocida towards high-molecular-weight hyaluronic acid // Chembiochem: A Eur. J. Chem. Biology. 2018. V. 19. № 13. P. 1414–1423. https://doi.org/10.1002/cbic.201800093
Agarwal G., Krishnan K.V., Prasad S.B. et al. Biosynthesis of hyaluronic acid polymer: Dissecting the role of sub structural elements of hyaluronan synthase // Sci. Reports. 2019. V. 9. № 1. P. 12510. https://doi.org/10.1038/s41598-019-48878-8
Zhang L., Huang H., Wang H. et al. Rapid evolution of hyaluronan synthase to improve hyaluronan production and molecular mass in Bacillus subtilis // Biotechnol. Letters. 2016. V. 38. № 12. P. 2103–2108. https://doi.org/10.1007/s10529-016-2193-1
Soldo B., Lazarevic V., Pagni M. et al. Teichuronic acid operon of Bacillus subtilis 168 // Mol. Microbiol. 1999. V. 31. № 3. P. 795–805. https://doi.org/10.1046/j.1365-2958.1999.01218.x
Blank L.M., Hugenholtz P., Nielsen L.K. Evolution of the hyaluronic acid synthesis (has) operon in Streptococcus zooepidemicus and other pathogenic streptococci // J. Mol. Evolution. 2008. V. 67. № 1. P. 13–22. https://doi.org/10.1007/s00239-008-9117-1
Blank L.M., McLaughlin R.L., Nielsen L.K. Stable production of hyaluronic acid in Streptococcus zooepidemicus chemostats operated at high dilution rate // Biotechnol. Bioengineering. 2005. V. 90. № 6. P. 685–693. https://doi.org/10.1002/bit.20466
Sheng J.Z., Ling P.X., Zhu X.Q. et al. Use of induction promoters to regulate hyaluronan synthase and UDP-glucose-6-dehydrogenase of Streptococcus zooepidemicus expression in Lactococcus lactis: A case study of the regulation mechanism of hyaluronic acid polymer // J. Applied Microbiol. 2009. V. 107. № 1. P. 136–144. https://doi.org/10.1111/j.1365-2672.2009.04185.x
Chen W.Y., Marcellin E., Hung J. et al. Hyaluronan molecular weight is controlled by UDP-N-acetylglucosamine concentration in Streptococcus zooepidemicus // The J. Biol. Chemistry. 2009. V. 284. № 27. P. 18007–18014. https://doi.org/10.1074/jbc.M109.011999
Hmar R.V., Prasad S.B., Jayaraman G. et al. Chromosomal integration of hyaluronic acid synthesis (has) genes enhances the molecular weight of hyaluronan produced in Lactococcus lactis // Biotechnology J. 2014. V. 9. № 12. P. 1554–1564. https://doi.org/10.1002/biot.201400215
Berezina O.V., Jurgens G., Zakharova N.V. et al. Evaluation of carbon and electron flow in Lactobacillus brevis as a potential host for heterologous 1-butanol biosynthesis // Advances in Microbiol. 2013. V. 03. № 05. P. 450–461. https://doi.org/10.4236/aim.2013.35061
Fong Chong B., Nielsen L.K. Aerobic cultivation of Streptococcus zooepidemicus and the role of NADH oxidase // Biochem. Engineering J. 2003. V. 16. № 2. P. 153–162. https://doi.org/10.1016/S1369-703X(03)00031-7
Armstrong D.C., Johns M.R. Culture conditions affect the molecular weight properties of hyaluronic acid produced by Streptococcus zooepidemicus // Applied Environmental Microbiol. 1997. V. 63. № 7. P. 2759–2764. https://doi.org/10.1128/AEM.63.7.2759-2764.1997
Chong B., Nielsen L. Amplifying the cellular reduction potential of Streptococcus zooepidemicus // J. Biotechnology. 2003. V. 100. № 1. P. 33–41. https://doi.org/10.1016/s0168-1656(02)00239-0
Kaur M., Jayaraman G. Hyaluronan production and molecular weight is enhanced in pathway-engineered strains of lactate dehydrogenase-deficient Lactococcus lactis // Metabolic Engineering Communications. 2016. V. 3. P. 15–23. https://doi.org/10.1016/j.meteno.2016.01.003
García Montes de Oca L.Y.J., Chagolla-López A., González de Vara L. et al. The composition of the Bacillus subtilis aerobic respiratory chain supercomplexes // J. Bioenergetics Biomembranes. 2012. V. 44. № 4. P. 473–486. https://doi.org/10.1007/s10863-012-9454-z
Li S., Huang D., Li Y. et al. Rational improvement of the engineered isobutanol-producing Bacillus subtilis by elementary mode analysis // Microbial Cell Factories. 2012. V. 11. P. 101. https://doi.org/10.1186/1475-2859-11-101
Huang W.C., Chen S.J., Chen T.L. The role of dissolved oxygen and function of agitation in hyaluronic acid fermentation // Biochem. Engineering J. 2006. V. 32. № 3. P. 239–243. https://doi.org/10.1016/j.bej.2006.10.011
Westbrook A.W., Ren X., Moo-Young M. et al. Application of hydrocarbon and perfluorocarbon oxygen vectors to enhance heterologous production of hyaluronic acid in engineered Bacillus subtilis // Biotechnol. Bioengineering. 2018. V. 115. № 5. P. 1239–1252. https://doi.org/10.1002/bit.26551
Lai Z.W., Rahim R.A., Ariff A.B. et al. Biosynthesis of high molecular weight hyaluronic acid by Streptococcus zooepidemicus using oxygen vector and optimum impeller tip speed // J. Bioscience Bioengineering. 2012. V. 114. № 3. P. 286–291. https://doi.org/10.1016/j.jbiosc.2012.04.011
Kallio P.T., Bailey J.E. Intracellular expression of Vitreoscilla hemoglobin (VHb) enhances total protein secretion and improves the production of alpha-amylase and neutral protease in Bacillus subtilis // Biotechnol. Progress. 1996. V. 12. № 1. P. 31–39. https://doi.org/10.1021/bp950065j
Lu J.F., Zhu Y., Sun H.L. et al. Highly efficient production of hyaluronic acid by Streptococcus zooepidemicus R42 derived from heterologous expression of bacterial haemoglobin and mutant selection // Letters in Applied Microbiol. 2016. V. 62. № 4. P. 316–322. https://doi.org/10.1111/lam.12546
Zhang X., Wang M., Li T. et al. Construction of efficient Streptococcus zooepidemicus strains for hyaluoronic acid production based on identification of key genes involved in sucrose metabolism // AMB Express. 2016. V. 6. № 1. P. 121. https://doi.org/10.1186/s13568-016-0296-7
Reid S.J., Abratt V.R. Sucrose utilisation in bacteria: genetic organisation and regulation // Applied Microbiol. Biotechnol. 2005. V. 67. № 3. P. 312–321. https://doi.org/10.1007/s00253-004-1885-y
Feng J., Gu Y., Quan Y. et al. Construction of energy-conserving sucrose utilization pathways for improving poly-γ-glutamic acid production in Bacillus amyloliquefaciens // Microbial Cell Factories. 2017. V. 16. № 1. P. 98. https://doi.org/10.1186/s12934-017-0712-y
Feng J., Gu Y., Yan P.-F. et al. Recruiting energy-conserving sucrose utilization pathways for enhanced 2,3-butanediol production in Bacillus subtilis // Acs Sustainable Chemistry & Engineering. 2017. V. 5. № 12. P. 11221–11225. https://doi.org/10.1021/acssuschemeng.7b03636
Дополнительные материалы отсутствуют.


