Генетика, 2022, T. 58, № 6, стр. 613-627
Естественная и экспериментальная инверсия пола у птиц и других групп позвоночных животных, кроме млекопитающих
А. Ф. Смирнов 1, Д. Ю. Леоке 2, А. В. Трухина 1, *
1 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
2 Биологическая станция “Рыбачий” Зоологического института Российской академии наук
238535 пос. Рыбачий, Калининградская область, Россия
* E-mail: trukhina_ant@mail.ru
Поступила в редакцию 17.08.2021
После доработки 26.12.2021
Принята к публикации 12.01.2022
- EDN: MRRSYD
- DOI: 10.31857/S001667582206011X
Аннотация
Статья посвящена актуальной на сегодняшний день проблеме – детерминации пола. По этой проблеме опубликовано множество научных статей, но до сих пор не раскрыты все подробности его механизмов, поскольку они очень разнообразны. В статье обобщен новый материал, полученный при изучении случаев естественной и экспериментальной инверсии пола у позвоночных животных. Рассмотрены представители холоднокровных позвоночных (рыбы, амфибии, рептилии) и теплокровных (птицы). Инверсия пола, которая встречается как в естественных (природных) условиях, так и в условиях эксперимента, может быть следствием генетических нарушений, которые проявляются на ранних стадиях развития эмбриона, и нормальных изменений, происходящих у половозрелых животных под контролем нейроэндокринной системы организма. Предполагается, что инверсия пола и детерминация пола могут быть взаимосвязанными явлениями. Особое внимание в статье уделено инверсии и детерминации пола у птиц, подробно рассмотрены работы по экспериментальной инверсии пола у этих животных. Для этого обобщены данные научных работ о связи между фенотипическим проявлением пола на клеточном, тканевом и органном уровнях, его хромосомным и гормональным определением, а также генетическим и эпигенетическим контролем. В конце статьи предложены перспективные направления в изучении естественной и экспериментальной инверсии пола у позвоночных.
Пол – это совокупность морфологических, физиологических и нейроэндокринных особенностей организма, обеспечивающих половое размножение, сущность которого сводится к образованию половых клеток (гамет), их слиянию при оплодотворении, образованию зиготы и формированию новой особи. С половым размножением связано множество нерешенных проблем. До сих пор обсуждаются его преимущества и недостатки по сравнению с бесполым вариантом размножения, а также их эволюционная связь. Огромное разнообразие вариантов полового размножения и соответствующих им версий определения пола привлекает особое внимание [1].
Различают два типа полового размножения: облигатный (у большинства растений и животных) и факультативный (у грибов). Говорят о соматическом поле, когда речь идет о совокупности клеток многоклеточного организма, исключая половые клетки, и гаметном поле, подразумевая превращение недифференцированных первичных половых клеток (ППК) в зрелые сперматозоиды и яйцеклетки. Развитие характерных особенностей пола в онтогенезе включает два последовательных этапа: первичное определение пола и дальнейшее появление и развитие вторичных половых признаков. Первичное определение пола начинается с момента его детерминации и заканчивается формированием яичников у самок и семенников у самцов – репродуктивных органов соматической природы. Считают, что принципиальная схема этого процесса консервативна [2, 3]. Следует отметить, что на этапе первичного определения пола при определенных нарушениях развития может произойти инверсия пола. При этом возникает несоответствие между генетическим и фенотипическим полом. Другой тип инверсии пола может происходить у половозрелой особи при определенных условиях. И в первом и во втором случаях речь идет о смене пола на противоположный.
Выделяют два основных механизма детерминации пола: генетический, который определяется посредством полоопределяющих мастер-генов, и экологический (или средовой), который зависит от условий окружающей среды (температура, рН, социальные особенности популяции и др.). Млекопитающие и птицы обладают исключительно генетическим механизмом детерминации пола (GSD), у рептилий наряду с GSD существует средовой механизм детерминации пола (ESD). Для амфибий характерна GSD-система с несформированными половыми хромосомами. Рыбы обладают разнообразными механизмами определения пола, включая ESD и GSD [1, 4, 5]. Генетическое определение пола может происходить до зачатия (при мейозе у организмов с женской гетерогаметностью) или в момент слияния половых клеток, а экологическое определение пола зависит от условий окружающей среды [4–8]. Определение пола под влиянием факторов внешней среды (ESD) в основном известно у рептилий, изопод, нематод и эхиурид (морских многощетинковых червей). При этом средовая детерминанта в определении пола у этих групп животных различна: у рептилий пол определяется температурой, у нематод – размером хозяина, у других животных – внутривидовыми взаимодействиями. Существуют две точки зрения относительно происхождения ESD. Согласно первой точке зрения ESD является примитивной, и поэтому может рассматриваться как первый механизм определения пола, позже замещенный на генетический механизм. Согласно второй точке зрения ESD возникла как адаптация к условиям окружающей среды [9]. Филогенетические исследования показали частые эволюционные переходы между генетической и температурно-зависимой детерминациями пола у животных, чувствительных к условиям окружающей среды. Эти переходы включают генетические системы, чувствительные к температуре, которые участвуют в детерминации пола посредством взаимодействия генов и условий окружающей среды [10]. У чешуйчатых (ящерицы и змеи) и у рыб переходы от экологической детерминации пола к генетической происходят чаще, чем наоборот. Это позволяет предположить, что генетическое определение пола более стабильно [11]. В разных условиях окружающей среды оказывается предпочтительной либо ESD, либо GSD. В сильно варьирующих условиях окружающей среды предпочтительнее ESD, в непредсказуемых условиях или в условиях с низкой вариабельностью – GSD. Однолокусная GSD является более стабильной, чем ESD. В течение всего периода нестабильности условий окружающей среды она приводит к сильному смещению в соотношении полов, в то время как ESD сдвигает это соотношение ненамного [12].
Выделяют две основные системы хромосомного определения пола: с мужской (XX/XY) или с женской (ZZ/ZW) гетерогаметностью, а также их многочисленные варианты [4]. У амфибий обнаружены обе системы хромосомного определения пола [13–16], при этом у разных видов половые хромосомы обладают разной степенью гомоморфности и гетероморфности. Они могут быть гомоморфными у обоих полов и иметь незначительные изменения, а могут быть гетероморфными и иметь значительные различия у представителей разных популяций одного вида [17]. Гетероморфные или гомоморфные половые хромосомы имеют тесную корреляцию с консерватизмом полоопределяющих генов. Если хромосомы гетероморфные у одного из полов, полоопределяющие гены эволюционно консервативны. Если половые хромосомы гомоморфные у обоих полов, как у 96% видов амфибий, полоопределяющие гены в половых хромосомах легко и быстро замещаются на другие гены в других хромосомах. Это явление называют “замещением полоопределяющих генов и половых хромосом” (“turnover of sex-determining genes and sex chromosomes”) и наблюдается у большинства пойкилотермных позвоночных [15, 18]. Как у рыб, так и у земноводных обнаружено, что переходы от гомоморфных половых хромосом к гетероморфным происходили чаще, чем наоборот. Кроме того, обнаружено, что переходы от мужской гетерогаметности к женской происходили с одинаковой скоростью у земноводных и чешуйчатых, тогда как переход от женской гетерогаметности к мужской у рыб происходил с большей скоростью [11].
В настоящее время существуют две точки зрения относительно эволюции систем генетического определения пола. Считают, что предковой формой генетического определения пола является система, основанная на мужской гетерогаметности, из которой впоследствии сформировалась система с женской гетерогаметностью. Однако эта гипотеза противоречит эволюционной теории гетерогаметной детерминации пола у амфибий, в соответствии с которой первичной является женская гетерогаметность [13–15]. Также есть предположение, что обе системы существовали одновременно и были равнозначными и взаимозаменяемыми. Так, например, у японской лягушки Rana rugosa встречаются обе системы хромосомного определения пола (ХХ/XY и ZZ/ZW) в пределах одного вида, но в определенных локальных популяциях [13].
Формирование гонад (гонадогенез) и их функционирование зависят от половых гормонов (эстрогенов и андрогенов). Особенно это характерно для холоднокровных позвоночных животных. У рыб, некоторых амфибий и рептилий известны случаи естественной смены пола (инверсии пола) в онтогенезе одной и той же особи, при сохранении набора половых хромосом и без нарушений функции гонад. Эти эффекты в основном опосредованы эстрогенами, андрогенами и соответствующими им ядерными рецепторами (ESR и AR). У теплокровных позвоночных (птиц и млекопитающих) естественная инверсия пола в норме не встречается, все ее проявления являются патологией и элиминируются естественным отбором. Экспериментальным путем удалось получить инверсию пола у домашней курицы. Инверсию пола можно наблюдать у человека при нарушениях полового развития, которые представляют собой многообразную группу нарушений, возникающих на разных этапах дифференцировки пола и формирования половых органов. Выделяют центральные и периферические нарушения, первые из которых связаны с повреждением мозговых структур (гипоталамо-гипофизарной системы), а вторые – с патологиями половых органов. Отдельно выделяют группу патологий с нарушением половой дифференцировки, когда закладка пола нарушается внутриутробно. Нарушения формирования пола (НФП) у человека – это врожденная патология развития, при которой наблюдается несоответствие генетического, гонадного, фенотипического и психологического пола. Значительная часть нарушений формирования пола и полового развития обусловлены именно генетическими факторами [19].
Известно, что молекулы половых гормонов через соответствующие рецепторы запускают экспрессию многих генов. Ключевые полоопределяющие гены, каскады взаимодействий их продуктов с другими генами или их производными, найдены и изучаются у многих модельных объектов, но результаты этих исследований противоречивы. Стероидные гормоны могут регулировать до 1000 генетических детерминант пола, характер их взаимодействия остается неясным [20].
В нашей статье, рассматривая описанные в научной литературе случаи естественной инверсии пола у рыб, амфибий и рептилий, а также экспериментальной инверсии пола у птиц, мы пытаемся обобщить данные о факторах, которые могут влиять на детерминацию и дифференцировку пола.
ИНВЕРСИЯ И ДЕТЕРМИНАЦИЯ ПОЛА У РЫБ, АМФИБИЙ И РЕПТИЛИЙ
Естественная инверсия пола характерна для небольшого количества видов холоднокровных позвоночных. Возможно, это связано с недостаточной изученностью данных групп и в дальнейшем это явление будет обнаружено у большего количества видов. Наиболее часто естественная инверсия пола встречается у рыб [21], но даже для этой группы процент обнаруженных видов с этим явлением очень мал. Значительно реже инверсия пола в природе встречается у амфибий [15, 16], а у рептилий известен только один вид с этим явлением [10].
В путях детерминации пола у позвоночных наблюдается эволюционный консерватизм, так как у всех выявлен ряд семейств генов, вовлеченных в этот процесс, что, видимо, ограничивает частоту встреч естественной инверсии пола. Экспрессия генов находится под контролем стероидных гормонов и влиянием условий окружающей среды. У рыб и амфибий дифференциация гонад чувствительна к воздействию эстрогенов и андрогенов, у рептилий – только к влиянию эстрогенов [8, 20]. У них даже однократная инъекция эстрогенов или ингибиторов ароматазы (блокируют синтез эстрогенов из андрогенов) может привести к инверсии пола. Следует также отметить, что характер воздействия экзогенных половых гормонов на пол зависит от стадии онтогенеза особи и от частоты гормонального воздействия [8].
Подробнее остановимся отдельно на каждой группе холоднокровных животных.
Рыбы
Рыбы представляют собой уникальную модель для изучения гермафродитизма у позвоночных животных [21–26]. Рыбы обладают самыми разнообразными типами репродуктивных систем (от гермафродитизма до гонохоризма) и стратегиями размножения среди позвоночных животных, а также пластичностью изменения пола во взрослом состоянии [21]. Для рыб характерна пластичность половых и соматических клеток, поддерживаемая на протяжении всего жизненного цикла и находящаяся под влиянием факторов внешней среды. У рыб температурное определение пола распространено менее, чем думали ранее, из-за большей редкости унисексуальных популяций даже в экстремальных условиях. Эффект эстрогенов, действующих через соответствующие рецепторы, заметен сильнее. Показано, что 2% костистых рыб, принадлежащих к 20-ти различным семействам, способны менять пол. Изменения гонад соответствуют изменениям концентрации стероидов в плазме. При этом стероиды, контролирующие дифференциацию гонад, – 17-β-эстрадиол (Е2) и 11-кетотестостерон (11-КТ) – являются главными половыми стероидными гормонами. Например, у черного окуня соотношение полов регулируется динамически: один пол увеличивается в количестве, а количество другого остается постоянным [21, 22]. Судьба первоначальной гонады определяется и поддерживается через передачу сигналов от гипоталамо-гипофизарной системы к полоопределяющему гену. В целом экспрессия генов dmrt1 (doublesex и mab-3-связанного фактора транскрипции 1) в семеннике и сyp19a1a в яичнике имеет решающее значение для развития самцов и самок соответственно [21, 22].
При изучении механизмов регуляции соотношения полов у костистых рыб было описано большое разнообразие механизмов детерминации пола. Это разнообразие связано как с генетическими факторами, так и с условиями окружающей среды, такими как температура, рН, и даже с социальными факторами, которые могут влиять на соотношение полов. Иногда условия окружающей среды влияют на детерминацию пола быстрее, чем генетическая система [21, 23, 27].
Фенотипический пол у рыб можно изменить под действием экзогенных гормонов, если их использовать до половой дифференциации [21, 28, 29]. Молодые рыбы чувствительны к физическим и химическим факторам окружающей среды, которые влияют на их гипоталамо-гипофизарную систему [21]. У одних видов дифференциация пола находится под строгим генетическим контролем и не требует производства половых стероидных гормонов. У других видов для дифференциации гонад необходимы половые гормоны и этот феномен ассоциирован с зависимостью дифференциации пола от условий окружающей среды (главным образом от температуры). Характер гонадной половой дифференциации может быть разнообразным: виды могут быть гермафродитными или гонохористичными, некоторые из которых проявляют ювенильный гермафродитизм [20, 21, 30, 31].
Генетическая детерминация пола у рыб может включать как моногенные, так и полигенные системы, а ключевые полоопределяющие гены могут располагаться в аутосомах и/или в половых хромосомах. Некоторые семейства генов, которые вовлечены в детерминацию пола у других позвоночных, недавно были найдены и у рыб, что предполагает наличие эволюционного консерватизма в путях детерминации пола. У рыб описаны как мужская (XY), так и женская (ZW) гетерогаметные системы, а также многие другие их вариации. Половые хромосомы обнаружены приблизительно у 10% изученных видов рыб. Некоторые виды рыб размножаются гиногенетически, т.е. имеют популяцию только из особей женского пола [32].
В отношении механизмов детерминации пола рыбы принадлежат к наиболее сложной группе позвоночных животных [21]. Согласно известным механизмам детерминации пола рыб разделяют на три группы:
• гонохорические: пол определяется генетически и фиксирован на протяжении всей жизни особи;
• последовательные гермафродиты (протоандрические виды – пол меняется в направлении самец → самка, и протогенические виды – пол меняется в направлении самка → самец, а также в обоих направлениях в течение всей жизни);
• унисексуальные, представленные только одним полом, что характерно для вида Poecilia formosa.
Характер дифференциации пола у костистых рыб также дивергентен и изменчив. У различных гонохорических видов, таких как лобан или черная кефаль, канальный сомик, обыкновенный судак и медака, недифференцированные гонады развиваются в яичники у генетических самок раньше, чем в семенники у генетических самцов. Однако у недифференцированных гонохорических видов, таких как обыкновенный угорь, сима, суматранский барбус и данио-рерио, недифференцированные гонады вначале развиваются в яичнико-подобные гонады. У одной половины этих рыб яичнико-подобные гонады позже становятся яичниками и производят ооциты. У другой половины этих рыб они развиваются в семенники и рыбы становятся самцами [33].
Амфибии
Пол большинства амфибий генетически детерминирован, хотя в последнее время появились сообщения о существовании негенетической детерминации пола у этой группы позвоночных животных [13]. На половых хромосомах различных видов лягушек картированы многие гены, ассоциированные с дифференциацией гонад, и выявлены гены с эффектами феминизации и маскулинизации. По-прежнему мало известно о молекулярных механизмах, лежащих в основе детерминации пола у лягушек [12, 13].
В случае бугорчатой лягушки перестройки, возникающие в половых хромосомах, могут стать причиной изменения механизма гонадной дифференцировки: от чувствительной до устойчивой инверсии пола, включающей связь между изменениями в половых хромосомах и контролем за соотношением полов [14]. Необычная система детерминации пола описана у японской рисовой лягушки Fejervarya kawamurai. Получаемое в потомстве соотношение полов у этой лягушки трудно объяснить только механизмом детерминации пола, основанным на генетической и средовой системах. Оно зависит от того, какие особи вступили в скрещивание. В случае близкородственного и обратного скрещиваний, а также диплоидного гиногенеза соотношение полов сдвигается в сторону большего количества самцов, но при этом повышена смертность среди потомства. При скрещивании аутбредных самок с самцами из географически изолированных популяций соотношение полов становится нормальным (1 : 1) и смертность снижается [14].
Процессы детерминации и дифференциации пола хорошо изучены у многих бесхвостых амфибий [34], и только несколько видов хвостатых амфибий изучены в этом плане: иглистый и магрибский тритоны (Pleurodeles waltl и P. poireti), гребенчатый тритон Triturus cristatus, огненнобрюхий тритон Cynops pyrrhogaster, огненная саламандра Salamandra salamandra, тигровая и мексиканская амбистомы (Ambystoma tigrinum и A. mexicanum). На этих видах были исследованы: влияние половых гормонов на дифференциацию по полу, температурно-зависимая инверсия пола, эффект андрогенов и Р450-ароматазы на дифференциацию пола, экспрессия генов, регулирующих этот процесс. В целом и хвостатые и бесхвостые амфибии имеют сходный механизм дифференциации гонад по полу. Обе группы являются гонохорическими. Особый интерес вызывает развитие гонад у мексиканской амбистомы, для которой характерно явление неотении [35]. Кроме того, у амфибий найдены интересные случаи естественной инверсии пола: с изменением состава половых хромосом в кариотипе, под влиянием температурных и других условий развития молодых амфибий [15, 16]. Например, инверсия пола распространена в популяциях крикливой лягушки Lithobates clamitans [36].
Модели дифференциации пола у земноводных можно разделить на три типа [12]:
• прямое развитие недифференцированных половых желез в семенники или яичники;
• развитие недифференцированной гонады в яичник и последующее развитие семенника из яичника;
• развитие семенника через межсексуальную фазу.
Доминирующая гипотеза определения пола для земноводных предлагается в отношении японской морщинистой лягушки Rana rugosa. У нее описаны четыре популяции, в одной из которых (северная популяция) самки гетерогаметны. Предполагается, что в данном случае нет необходимости в полоопределяющих генах в связи с наличием транскрипционных факторов, локализованных в Х- или W-хромосомах. У самцов механизм определения пола поддерживает регуляцию секреции стероидных гормонов в недифференцированных гонадах путем ингибирования транскрипции гена cyp19, существенного для образования яичников [12]. Согласно экспериментальным данным, полная инверсия пола наблюдается у AR–T-трансгенной самки лягушки (ZW) при низкой дозе тестостерона в воде во время выращивания головастиков. В инвертированных по полу семенниках экспрессия генов dmrt1, ar и cyp17, необходимых для маскулинизации, была значительно повышена. В том же эксперименте никакой инверсии пола не наблюдалось у экспериментальных самок при использовании доз тестостерона достаточных, чтобы вызвать полную инверсию пола у дикого типа лягушек. В половых железах таких самок экспрессия генов, необходимых для маскулинизации, не была достаточно отрегулирована. Эти результаты демонстрируют, что андрогеновый рецептор (АР) вместе с андрогенами может быть детерминатором пола у самцов амфибий [37, 38].
У амфибий обнаружены многие полоопределяющие гены (Sf1, WT1, Sox9, Amh, Dmrt1, Dax1, Sox3, Sox18, Sox12 и др.) и изучена их экспрессия в гонадах самцов и самок. Их наличие в геноме амфибий и характер их экспрессии указывает на консерватизм системы детерминации и дифференциации пола у позвоночных [16, 39]. На основе анализа генов, сцепленных с полом, и данных о кариотипах у лягушек было обнаружено восемь генов в шести различных хромосомах, которые могут быть кандидатами в качестве полоопределяющих генов. Два случая замещения по типу “turnover of sex-determining genes and sex chromosomes” были изучены у прудовой лягушки Дарумы Pelophylax porosa brevipoda и у бурой лягушки Rana japonica из Японии. Интересные случаи описаны у травяной лягушки R. temporaria, лягушки Наппарагава Rana sakuraii, бугорчатой лягушки Glandirana rugosa, поющей бюргерии Buergeria buergeri, когтистой и кенийской шпорцевых лягушек (Xenopus tropicalis и X. borealis), съедобной лягушки Pelophylax esculentus, леопардовой лягушки Lithobates pipiens, лягушки-быка L. catesbeianus и крикливой лягушки L. clamitans [14].
Рептилии
Определение пола под воздействием температуры (TSD) известно и изучено у черепах, крокодилов и ряда видов ящериц, но не найдено у змей. Предполагают, что такой механизм определения пола имеет адаптивное значение.
В период раннего развития гонады ее эпителиальные клетки разделены и объединяются в эпидермальную полоску мезенхимы мезонефроса. Далее в течение так называемого “температурно-зависимого периода” такая полоска образует семенные канальцы с эпителием, клетками Сертоли или пробелами с плоскоклеточным эпителием. Механизм определения пола по этому типу не ясен. Очевидно, он обнаруживается у видов с недифференцированными половыми хромосомами. Переход от температуры, при которой формируются самки (FPT), к температуре, при которой формируются самцы (MPT), осуществляется через температурно-чувствительный период (TSP), через так называемое “окно возможностей” [40–42]. В этот период гонада остается бипотенциальной, но вне этого периода гонада начинает развиваться в определенном направлении и изменить пол уже нельзя. У некоторых видов рептилий пол не является фиксированным на всю жизнь, и первоначальный пол может измениться [42].
У рептилий существует “открытая” программа определения пола. Считается, что в этом случае пол зависит от соотношения эстрогенов и андрогенов в период дифференциации гонад. Температура инкубации может изменить активность генов, кодирующих ароматазу, рецептор эстрогена и редуктазу. Разные таксономические группы рептилий имеют разные механизмы регулирования пола. К температуре инкубации может быть чувствительной экспрессия генов sox9 и dax1 (пресноводные черепахи – Emydidae) и генов sox9, sf1 и wt1 (сухопутные черепахи – Testudinidae). Для миссисипского аллигатора Alligator mississippiensis, красноухой черепахи Trachemys scripta и оливковой ридлеи Lepidochelys olivacea уровень экспрессии гена dmrt1 выше во время инкубации эмбрионов при температуре, которая способствует появлению самцов. У красноухой черепахи большое количество продукта хроматин-модифицирующего гена kdm6b (lysine-specific demethylase 6B), которое наблюдается при температуре, благоприятной для появления самцов, активирует экспрессию dmrt1, а снижение его экспрессии благоприятствует появлению самок. Этот феномен связан с триметилированием лизина 27 в гистоне 3 (H3K27). Эта модификация репрессирует промоторную активность гена dmrt1. Ген kdm6b является членом семейства генов Jumonji, которые у рептилий вовлечены в детерминацию пола. Один такой ген cirbp (индуцируемый холодом РНК-связывающий белок), кодирующий температурно-индуцируемый РНК-связывающий белок с функцией стабилизации мРНК и регуляции трансляции, описан у каймановой черепахи Chelydra serpentina. Его экспрессия влияет на детерминацию пола у эмбрионов, развивающихся в соответствующем температурном режиме [43].
У 34 видов рептилий с температурным и генетическим механизмами определения пола удалось обнаружить различия в структуре гена dmrt1. Изменения обнаружены в последовательности экзона 2, вблизи DM-связывающего домена. У видов с температурным определением пола в положении 54 аминокислотной последовательности DMRT1 встречается треонин (T54), а серин – в положении 57 (S57). В то же время у видов с генетическим механизмом определения пола серин наблюдается не только в положении 57, но и в 54 (S54–S57). Это первое описание молекулярных различий в конкретном гене с изменением механизма определения пола [43].
Есть только одно сообщение об инверсии пола у рептилий в дикой природе (австралийская бородатая агама Pogona vitticeps) и использовании животных с инвертированным полом, чтобы экспериментально вызывать быстрый переход от GSD к ESD [10]. В этом случае контролируемое спаривание нормальных самцов с самками с переменным полом дает жизнеспособное и плодовитое потомство, фенотипический пол которого определяется исключительно с помощью механизма TSD. При этом половая хромосома W исключена уже в первом поколении. Одномоментное появление потомства с чувствительностью к температуре и набором половых хромосом ZZ показывает новую климат-индуцированную детерминацию пола для быстрого перехода между генетической и температурно-зависимой детерминацией пола и помогает адаптироваться к условиям быстро меняющегося климата [10].
ИНВЕРСИЯ ПОЛА У ПТИЦ
У птиц, и прежде всего у курицы, описаны многочисленные примеры экспериментальной инверсии пола с помощью инъекций эстрогена, ингибиторов его метаболизма, удаления гонад. Результаты трудно интерпретировать в терминах закономерностей детерминации пола. В большинстве случаев эффект временный. У самок с инверсией пола маскулинизирован только правый яичник, а сперматозоиды, несущие W-хромосому, не формируются [44]. Особого внимания заслуживают результаты экспериментов, в которых использовалась микроинъекция ингибитора ароматазы в оплодотворенное яйцо на 4–5-е сутки инкубации. В этих случаях сообщается об инверсии пола с превращением самок в фенотипических самцов с правым овотестисом и низкой фертильностью [45–47]. В серии статей китайских исследователей описаны изменения активности главных генов детерминации пола у опытных животных и их особый гормональный и эпигенетический статус [48, 49]. Другая группа ученых получила результат, свидетельствующий о том, что аномальное развитие семенников у инвертированных по полу самок курицы регулируется генами, связанными с полом, и длинной некодирующей РНК (lncRNA), а Wnt- и TGFβ/BMP-сигнальные пути играют важную роль в дифференцировке гонад и поддержании их функции у курицы [50, 51]. Показано, что одновременная обработка ингибитором ароматазы и инсулиновым фактором роста 1 оплодотворенных яиц даже на 5-е сутки инкубации способна повлиять на процесс инверсии пола [52]. Удалось продемонстрировать инверсию пола у самок в самцов после инъекции ингибитора ароматазы в первый день инкубации, гистологически сопровождаемый более полным превращением яичника в семенник [53].
Стероидогенные факторы также влияют на развитие гонад у птиц. Сравнительный анализ показал, что у курицы важную роль в генерации поддерживающих клеток играют клетки нефрогенной мезенхимы (рис. 1, [53]). Удалось косвенно продемонстрировать оплодотворяющую способность сперматозоидов, несущих W-хромосому, у инвертированных по полу самок курицы [54–56]. К сожалению, до сих пор не изучены зависимость полноты инверсии пола от времени инъекции ингибитора ароматазы и закономерности формирования семенника вместо овотестиса в правой гонаде. Практически не изучены инвертированные по полу особи относительно их половых характеристик и фертильности, не исследована стабильность переопределения пола [56–59].
Рис. 1.
Дифференциация соматических клеток гонад у эмбрионов мыши и курицы с указанием главных экспрессирующихся генов. Клетки происходят либо от целомического эпителия, либо от мезонефроса, с различным распределением, зависящим от вида. а – линия клеток, полученная от мыши (Mus musculus). Клетки, происходящие от целомического эпителия, дают линию поддерживающих клеток и линию стероидогенных и нестероидогенных интерстициальных клеток. Мезенхима мезонефроса также дает стероидогенную линию клеток (клетки Лейдига у самцов, клетки теки у самок). У самок две волны предковых поддерживающих клеток происходят из целомического эпителия, генерируя медуллярные и кортикальные гранулезные клетки; б – линия клеток, полученная от курицы (Gallus gallus), в которой поддерживающие и стероидогенные клеточные линии происходят из мезенхимы мезонефроса. Стероидогенная клеточная линия получена через стадию поддерживающих клеток. Этот процесс вовлекает последовательную сверхрегуляцию стероидогенных генов в части поддерживающих клеток. Целомический эпителий у курицы дает начало нестероидогенным интерстициальным клеткам (адаптировано по [55]). Курсивным латинским шрифтом дана аббревиатура генов, которые экспрессируются в данных линиях клеток.

В недавнем исследовании Моррис и др. [60] описали морфологию и гистологию гонад, а также эндокринный профиль гинандроморфной курицы. На правой стороне были клетки самца, а на левой – самки. Почти все клетки (96%) на правой стороне имели кариотип ZZ, а на левой стороне имелась смесь клеток с кариотипами ZZ и ZW. Более того, число клеток с ZW-кариотипом было намного меньше, чем с ZZ-кариотипом. Уменьшенный процент клеток с кариотипом ZW (23%) не влиял на проявление черт самки. Основываясь на этих наблюдениях, было предположено, что даже небольшого процента клеток ZW достаточно для поддержания дифференциации пола в направлении самок. Однако этих клеток недостаточно для инверсии пола, и различные диморфные особенности у половозрелой особи могут возникать из-за различий в дозе генов, расположенных в Z хромосоме [61].
У позвоночных животных бипотенциальная гонада способна к развитию семенника или яичника посредством ряда регуляторных преобразований (рис. 1, [53]). У курицы развитие гонад происходит на третьи сутки эмбрионального развития и характеризуется утолщением целомического эпителия, вентрального к мезонефросу. Гистологическая дифференциация гонад у курицы происходит на 6–6.5-й день. У самок внешний кортикальный слой в левой гонаде утолщается и аккумулирует половые клетки, а внутренняя медулла образует лакуны, заполненные жидкостью. Позднее в эмбриогенезе (15.5-й день) инициируется мейоз. Основой поддерживающей клеточной линии в семенниках являются клетки Сертоли и Лейдига, а в яичниках – клетки гранулeзы и тeки (рис. 2). Эти клетки дифференцируются из клеток мезенхимы. У самцов гонада возникает из медуллы, образуя семявыносящий корд, окружающие его пре-Сертоли клетки и появляющиеся в гонадах первичные половые клетки. Клетки пре-Сертоли синтезируют антимюллеровский гормон (АМГ), вызывающий регрессию Мюллерова протока. Клетки Лейдига располагаются в мезенхиме, вне семявыносящего корда. Белок DMRT1 синтезируется в пре-Сертоли и Сертоли-клетках медуллы гонад, а также половых клетках самцов и самок. У самок он позднее исчезает. Предполагают, что он участвует в дифференциации первичных половых клеток самцов в сперматогонии. Участие гена dmrt1 в дифференцировке ППК подтверждено и у других видов птиц: у зебровой амадины Taeniopygia guttata и эму Dromaius novaehollandiae. Таким образом, dmrt1 рассматривается как главный полоопределяющий ген, который необходим для развития Мюллерова протока. Цепочка генов, важных для становления самцов у птиц, содержит помимо dmrt1 также гены HEMGN и sox9, активирующиеся позднее (соответственно на 4.5-, 5.5- и 6-й дни инкубации) и приводящие к формированию признаков самца [60–62].
Рис. 2.
Молекулярные механизмы детерминации пола у млекопитающих, ведущие к формированию поддерживающих клеток самцов или самок (адаптировано по [63]).
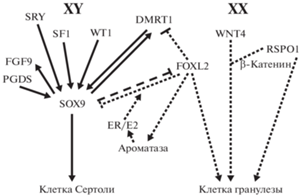
У птиц эстроген является главным регулятором развития яичников. Эстроген может временно феминизировать развитие гонад у самцов. Антиэстроген (например, тамоксифен) нарушает развитие гонад самок. Инъекция ингибиторов ароматазы приводит к частичной инверсии пола, и самка становится “самцом”. Ген ароматазы (cyp19a1) активизируется на 6.5-й день эмбрионального развития в гонадах самок, но не самцов. Нарушение экспрессии ключевых генов самцов (dmrt1 и sox9) сопровождается повышенной активностью генов самок (foxl2 и rspo1). Как и у других позвоночных, foxl2 специфичен для яичников и срабатывает на 5-й день эмбрионального развития, перед началом развития яичников. Более того, продукты генов foxl2 и cyp19a1 совместно локализуются в медуллярном корде. Предполагается наличие антагонизма между генами foxl2 и sox9 [60].
Ген dmrt1 рассматривают как главный полоопределяющий ген у птиц. Основным аргументом в пользу этой точки зрения считается инверсия пола у самцов после его “выключения” с использованием РНК-интерференции в первый день инкубации [63]. Однако противоречивыми оказались результаты экспериментов с трансгенезом [60, 64]. Также существует возможность инверсии пола самки на пол самца при введении ингибитора ароматазы [45–48, 65, 66]. Стоит упомянуть нестабильное превращение самцов в самок после инъекции эстрогенов [8, 57]. Можно предположить, что у птиц по аналогии с другими позвоночными первичное определение пола (появление той или иной гонады) зависит от содержания эстрогенов в яйце в начале эмбриогенеза. Присутствие W-хромосомы у самок предполагает, что синтез эстрогенов индуцируется генами, расположенными в этой хромосоме. Этот процесс может быть связан с рядом факторов, включая длинные некодирующие РНК [67, 68]. Следует отметить, что lncРНК-транскрипты не кодируют белки и имеют длину более чем 200 нуклеотидов. Предполагают, что развитие семенников у самцов курицы совместно регулируется половыми гормонами (прежде всего эстрогенами), связанными с полом генами, длинными некодирующими РНК и сигнальными путями Wnt и TGFβ/BMP. Желательно обратить внимание на некодирующие РНК, их связь с W-хромосомой и их роль в определении пола птицы. Схема первичного определения пола представлена в [3].
Ген dmrt1 необычен тем, что он экспрессируется как в клетках Сертоли, так и в половых клетках. У птиц функция DMRT1 заключается не в определении первичного пола, а в сохранении уже сформированного семенника [69].
Остановимся на недавно опубликованных результатах, полученных с использованием редактирования генома курицы с целью изучения первичной детерминации пола у этого объекта (рис. 3). С помощью CRISPR/CAS9-метода были получены ППК c поврежденным нефункциональным геном dmrt1 и с четырьмя классами хромосомных генотипов в соотношении 1 : 1 : 1 : 1. Это были особи ZD+ZD+, ZD+W, ZD+ZD– и ZD–W (аббревиатура ZD+ и ZD– означает носительство нормального и выключенного гена). Эмбрионы ZD+ZD– обладали гонадами самок с E5.5 по E17.5 дни развития, что демонстрирует важность потери копии гена dmrt1 у самцов. Такое развитие этих эмбрионов сохраняется и в возрасте пяти недель. Их гонады обладали только маленькими и средними фолликулами и не созревали под действием гормонов гипоталамуса, гипофиза или гранулезы, как у нормальных самок. Неожиданно у этих особей были обнаружены левый и правый яичники. Правый укороченный, как и соответствующий Мюллеров проток [70].
Рис. 3.
Схема генетической детерминации пола у курицы (а и б). Генная сеть, регулирующая развитие гонад самцов и самок. Z, W – половые хромосомы, ZD+ – присутствие гена DMRT1 в хромосоме Z, 2× DMRT1/1× DMRT1 – две/одна копии гена DMRT1 (адаптировано по [71]).
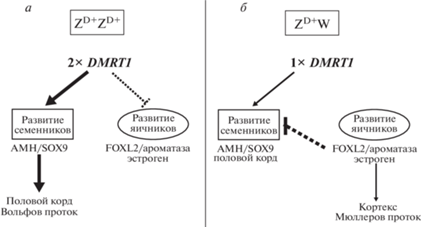
Потеря функционально активного гена dmrt1 у ZD–W-самок не сильно отражается на оогенезе эмбрионов. У них развивается левый яичник с утолщенным кортексом, содержащим половые клетки. Однако уже у пятинедельных особей невозможно обнаружить фолликулы с ооцитами. Предполагают, что повреждение гена dmrt1 приводит к потере половых клеток после проклевывания, а сам ген участвует в поддержании мейоза. Вероятно экспрессия двух копий этого гена у нормальных самцов прямо или косвенно супрессируется активностью FOXL2. Было продемонстрировано, что у ZD+ZD–-эмбрионов левая гонада развивается в яичник, а при недостатке эстрогенов обе гонады развиваются в семенники. Блокирование эстрогенов у ZD+W и ZD+ZD–-эмбрионов приводит к образованию семенников. Это показывает, что DMRT1 необходим для формирования семенников и выживания ППК, но не требуется для появления яичников. Различия между самцами и самками у птиц являются результатом комбинации хромосомной конституции и гонадных гормонов. Предполагают наличие у птиц основополагающей роли автономной половой идентичности клеток – CASI (Cell Autonomous Sex Identity) в установлении сексуального фенотипа и малое влияние гормонов на половые характеристики [71–75].
Поскольку у птиц самки являются гетерогаметными, пол будущего поколения определяется еще на стадии первого деления мейоза. Есть предположение, что самки птиц способны физиологически контролировать соотношение полов у будущего потомства, на уровне мейотического драйва [74, 75]. В этом процессе определенную роль могут играть промежуточные продукты биосинтеза стероидов, в том числе прогестерон [76–80].
Последнее время конкурировали две гипотезы об определении пола у птиц. Одна из этих гипотез рассматривала число Z-хромосом как ключевой фактор определения пола. Другая гипотеза предполагала наличие в W-хромосоме ключевого гена, контролирующего развитие яичников или подавляющего появление семенников. В настоящее время подробно изучен механизм инактивации генов на конце длинного плеча хромосомы Z у курицы с помощью РНК-интерференции, который запускается присутствием в кариотипе хромосомы W [81]. Снижение экспрессии гена dmrt1 in ovo в результате РНК-интерференции приводит к феминизации эмбриональных половых желез у генетических самцов (ZZ). В феминизированной левой гонаде наблюдается снижение экспрессии гена sox9 и увеличение экспрессии гена cyp19a1 (ген ароматазы). Это наблюдение подтверждает гипотезу о наличии дозовой компенсации с участием гена dmrt1. В феминизированной правой гонаде экспрессия соответствующих генов другая. Это указывает на дифференциальную чувствительность к воздействию белка DMRT1 в левой и правой гонадах. Половые клетки в феминизированных гонадах распределяются как в яичниках. Результаты этого эксперимента указывают на особую роль гена dmrt1 в развитии семенников, но при этом отсутствуют четкие доказательства того, что этот ген контролирует первичную детерминацию пола [77]. В некоторые схемы генетического контроля определения пола у птиц добавлены эпигенетические механизмы [63, 82–84].
W-хромосома курицы имеет длину около 7.08 Мб и содержит всего 28 генов. Эволюционно эта хромосома претерпела обширную деградацию и накопление повторяющихся нуклеотидных блоков ДНК. Было показано, что исчезновение генов, специфичных для W-хромосомы, не является случайным, и высказано предположение, что сохранение некоторых генов связано с тем, что W‑хромосома находится под высоким эволюционным давлением из-за отсутствия рекомбинации. Все гены, которые сохранены в W-хромосоме, имеют гомологов в Z-хромосоме и относятся к категории дозозависимых генов, чувствительных к снижению дозы. Ни один из этих генов не имеет значения для дифференцировки и детерминации пола [84–87]. Примечательно, что самые распространенные и специфичные для нее повторы XhoI, EcoRI, SspI и недавно описанные (GGAAA)n-последовательности плотно упакованы в хромомеры и не транскрибируются на стадии ламповых щеток. Было показано, что XhoI, EcoRI и SspI не имеют каких-либо значительных различий у представителей отрядов Курообразных, Аистообразных и Воробьинообразных. Поиск особой роли W-хромосомных генов в детерминации семенников и яичников продолжается [86]. В недавно опубликованной работе китайские исследователи сравнивали W-хромосомы 27 видов птиц, среди которых были представители Воробьинообразных, Курообразных и группы Древненебных. Ими был обнаружен значительный консерватизм данной хромосомы, несмотря на генетическую отдаленность исследованных видов, и отсутствие генов, специфичных для самок [88]. Также ими была исследована изменчивость блоков ДНК из амплификона гена hintW хромосомы W у утки и курицы. У утки был обнаружен консерватизм количества копий этих амплифицированных генов, а для курицы – описана межпородная изменчивость. Авторы предполагают наличие особой роли амплификации hintW у курицы (в отличие от уток) в репродукции самок и оогенезе [89]. W-хромосомный ген hintW (также называемый Asw и Wpkcl) стали рассматривать в качестве важнейшего регулятора детерминации пола у птиц, усиливающего активность генов foxl2 и cyp19a1 у самок и ингибирующего экспрессию генов sox9 и dmrt1 у самцов. Он контролирует образование гонадного кортекса – основы для появления семенников. HINTW не только контролирует развитие гонад, но и отвечает за асимметрию яичников – дегенерацию правой гонады. Этот ген имеет Z-хромосомный гомолог hintZ и в отличие от последнего не обладает гистидиновой триадой и способностью связывать аденозинмонофосфат (АМФ) с лизином [90, 91]. Необходимо сопоставление участия в процессе детерминации пола и других полоопределяющих генов, таких как JUN, smad2, UBE2I [92]. Привлекает внимание и феномен полоограниченных хромосом у певчих птиц [92]. Рассматривается возможность влияния специфических генов этой хромосомы на ее конденсацию по аналогии с Bkm-повторами некоторых змей [44, 93].
Рассмотренные данные послужат для интеграции схем детерминации пола у птиц и адаптации наиболее приемлемой гипотезы инверсии пола у курицы к практическому использованию.
ЗАКЛЮЧЕНИЕ
Естественная инверсия пола у позвоночных животных – довольно редкое явление. Чаще всего она встречается у рыб (всего 2% из всех изученных видов) [22], реже – у амфибий и рептилий и не наблюдается в норме у птиц и млекопитающих. Разные случаи инверсии пола были описаны и изучены у человека [20], все они являются патологией развития. Редкие случаи подобной инверсии пола выявляются в природе у птиц и млекопитающих, но такие особи, как правило, не оставляют потомства. Возможно, эволюционный консерватизм ряда полоопределяющих генов у позвоночных животных не поддерживает развитие естественной инверсии пола и этот процесс не получил преимущества в эволюции. Изучение естественной инверсии пола далеко от завершения. Процент изученных видов в этом аспекте низок [93–95].
Исследования в лабораторных условиях показали, что можно вызвать искусственную инверсию пола у птиц, например у домашней курицы. Полученные результаты в таких исследованиях, безусловно, внесли существенный вклад в понимание проблемы первичной детерминации пола у птиц, особенно относительно разноплановой роли DMRT1. Аспекты, связанные с взаимодействием полоопределяющих генов и стероидов, только затронуты. Необходимы дальнейшие исследования и создание всеобъемлющей схемы взаимодействий каскада полоопределяющих генов, половых гормонов и других участников детерминации и дифференцировки пола. Изучение механизмов детерминации и случаев инверсии пола у позвоночных нельзя рассматривать как завершенное, требуются уточнение и накопление более определенных результатов [71–75].
Возможность инвертирования пола у курицы может помочь решить экономическую проблему. Необходимо проводить исследования по инвертированию пола и в деле спасения видов, находящихся на грани исчезновения, когда счет оставшихся особей измеряется единицами, а также продолжать исследования естественной инверсии пола у других видов, для которых может быть характерным это явление. Было бы интересно проверить наличие/отсутствие инвертирования пола у видов, обитающих в экстремальных условиях (горы, пустыни), видов, имеющих узкий ареал и низкую численность. Хотелось бы понять эволюционное значение инверсии пола для позвоночных, почему это явление не получило эволюционного преимущества и почему у одних видов это нормальное явление, а у других – только патология. В этой связи нужно дальше проводить изучение молекулярных механизмов инверсии пола, ее связь с детерминацией. Инверсия пола – интересное явление в мире позвоночных животных и ее изучение может привести к новым открытиям.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 20-14-50268, “Экспансия” (The reported study was funded by RFBR, project number 20-14-50268).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Smirnov A.F., Trukhina A.V. Specific features of sex determination in birds on the example of Gallus gallus domesticus // Gene Expression and Phenotypic Traits. UK: IntechOpen Limited, 2020. P. 338–481. https://doi.org/10.5772/intechopen.91178
Cox R.M. Sex steroids as mediators of phenotypic integration, genetic correlations, and evolutionary transitions // Mol. Cell. Endocrinol. 2019. V. 502. P. 110668. https://doi.org/10.1016/j.mce.2019.110668
Weber C., Capel B. Sex reversal // Curr. Biol. 2018. V. 28. № 21. P. R1234–R1236. https://doi.org/10.1016/j.cub.2018.09.04
Wilhelm D., Palmer S.J., Koopman P. Sex determination and gonadal development in mammals // Physiol. Rev. 2007. V. 87. № 1. P. 1–28. https://doi.org/10.1152/physrev.00009.2006
Wilhelm D., Pask A.J. Genetic mechanisms of sex determination // Encyclopedia of Reproduction. Elsevier Inc.: Acad. Press, 2018. V. 3. P. 245–248. https://doi.org/10.1016/B978-0-12-801238-3.64460-4
Ni M., Feretzaki M., Sun S. et al. Sex in fungi // Annu. Rev. Genet. 2011. V. 45. P. 405–430. https://doi.org/10.1146/annurev-genet-110410-132536
Smirnov A.F., Trukhina A.V. Molecular-Genetic Mechanisms of Sex Determination in Animals. USA: Sci. Res. Publ., Inc., 2017. P. 162. ISBN: 978-1-61896-390-1.
Tagirov M.T. Sex determination and control mechanisms in birds // Biotechnologia Acta. 2013. V. 6. № 1. P. 62–72. https://doi.org/10.15407/biotech6.01.062
Bull J.J. Evolution of environmental sex determination from genotypic sex determination // Heredity. 1981. V. 47. № 2. P. 173–184.
Holleley C.E., O’Meally D., Sarre S.D. et al. Sex reversal triggers the rapid transition from genetic to temperature-dependent sex // Nature. 2015. V. 523. № 7558. P. 79–82. https://doi.org/10.1038/nature14574
Pennell M.W., Mank J.E., Peichel C.L. Transitions in sex determination and sex chromosomes across vertebrate species // Mol. Ecol. 2018. V. 27. № 19. P. 3950–3963. https://doi.org/10.1111/mec.14540
Nakamura M. Is a sex-determining gene(s) necessary for sex-determination in amphibians? Steroid hormones may be the key factor // Sex. Dev. 2013. V. 7. № 1–3. P. 104–114. https://doi.org/10.1159/000339661
Ma W.-J., Veltsos P. The diversity and evolution of sex chromosomes in frogs // Genes. 2021. V. 12. P. 483. https://doi.org/10.3390/genes12040483
Miura I. Sex determination and sex chromosomes in amphibian // Sex. Dev. 2017. V. 11. № 5–6. P. 298–306. https://doi.org/10.1159/000485270
Wallace H., Badawy G.M.I., Wallace B.M.N. Amphibian sex determination and sex reversal // Cell. Mol. Life Sci. 1999. V. 55. P. 901–909. https://doi.org/1420-682X:99:070901-09
Eggert C. Sex determination: the amphibian models // Reprod. Nutr. Dev. 2004. V. 44. P. 539–549. https://doi.org/10.1051/rnd:2004062
Keating S.E., Blumer M., Grismer L.L. et al. Sex chromosome turnover in bent-toed geckos (Cyrtodactylus) // Genes. 2021. V. 12. P. 116. https://doi.org/10.3390/genes12010116
Rovatsos M., Vukić J., Mrugała A. et al. Little evidence for switches to environmental sex determination and turnover of sex chromosomes in lacertid lizards // Sci. Rep. 2019. V. 9. P. 7832. https://doi.org/10.1038/s41598-019-44192-5
Прокопьев Я.В., Антропова Е.Ю., Мазитова М.И., Ключаров И.В. ХХ-тестикулярная форма нарушения формирования пола: редкая форма мужского бесплодия. Клиническое наблюдение // РМЖ. 2019. № 11. С. 26–28.
Ogino Y., Tohyama S., Kohno S. et al. Functional distinctions associated with the diversity of sex steroid hormone receptors ESR and AR // J. Steroid Biochem. Mol. Biol. 2018. V. 184. P. 38–46. https://doi.org/10.1016/j.jsbmb.2018.06.002
Rajendiran P., Jaafar F., Kar S. et al. Sex determination and differentiation in teleost: roles of genetics, environment, and brain // Biology (Basel). 2021. V. 10. P. 973. https://doi.org/10.3390/biology10100973
Nakamura M., Kobayashi T., Chang X.-T., Nagahama Y. Gonadal sex differentiation in teleost fish // J. Exp. Zool. 1998. V. 281. P. 362–372. https://doi.org/10.1002/(SICI)1097-010X(19980801)-281:5<362::AID-JEZ3>3.0.CO;2-M
Yamamoto Y., Hattori R.S., Patiño R., Strüssmann C.A. Environmental regulation of sex determination in fishes: insights from Atheriniformes // Curr. Top. Dev. Biol. 2019. V. 134. P. 49–69. https://doi.org/10.1016/bs.ctdb.2019.02.003
Camerino G., Parma P., Radi O., Valentini S. Sex determination and sex reversal // Curr. Opin. Genet. Dev. 2006. V. 16. № 3. P. 289–292. https://doi.org/10.1016/j.gde.2006.04.014
Guerrero-Estévez S., Moreno-Mendoza N. Sexual determination and differentiation in teleost fish // Rev. Fish Biol. Fish. 2009. V. 20. № 1. P. 101–121. https://doi.org/10.1007/s11160-009-9123-4
Hattori R.S., Strüssmann C.A., Fernandino J. et al. Genotypic sex determination in teleosts: insights from the testis-determining amhy gene // Gen. Comp. Endocrinol. 2013. V. 192. P. 55–59. https://doi.org/10.1016/j.ygcen.2013.03.019
Kobayashi Y., Nagahama Y., Nakamura M. Diversity and plasticity of sex determination and differentiation in fishes // Sex. Dev. 2012. V. 7. № 1–3. P. 115–125. https://doi.org/10.1159/000342009
Baroiller J.F., D’Cotta H., Saillant E. Environmental effects on fish sex determination and differentiation // Sex. Dev. 2009. V. 3. № 2–3. P. 118–135. https://doi.org/10.1159/000223077
Devlin R.H., Nagahama Y. Sex determination and sex differentiation in fish: an over-view of genetic, physiological, and environmental influences // Aquaculture. 2002. V. 208. № 3–4. P. 191–364. https://doi.org/10.1016/S0044-8486(02)00057-1
Strüssmann C.A., Nakamura M. Morphology, endocrinology, and environmental modulation of gonadal sex differentiation in teleost fishes // Fish Physiol. Biochem. 2002. V. 26. P. 13–29. https://doi.org/10.1023/A:1023343023556
Mustapha U.F., Huang Y., Huang Y.-Q. et al. Gonadal development and molecular analysis revealed the critical window for sex differentiation, and E2 reversibility of XY-male spotted scat, Scatophagus argus // Aquaculture. 2021. V. 544. Article 737147. https://doi.org/10.1016/j.aquaculture.2021.737147
Hsiao C.-D., Tsai H.-J. Transgenic zebrafish with fluorescent germ cell: A useful tool to visualize germ cell proliferation and juvenile hermaphroditism in vivo // Dev. Biol. 2003. V. 262. P. 313–323. https://doi.org/10.1016/S0012-1606(03)00402-0
Wu G.-C., Chang C.-F. Primary males guide the femaleness through the regulation of testicular Dmrt1 and ovarian Cyp19a1a in protandrous black porgy // Gen. Comp. Endocrinol. 2018. V. 261. P. 198–202. https://doi.org/10.1016/j.ygcen.2017.01.033
Tang Y., Chen J.-Y., Ding G.-H., Lin Z.-H. Analyzing the gonadal transcriptome of the frog Hoplobatrachus rugulosus to identify genes involved in sex development // BMC Genomics. 2021. V. 22. P. 552. https://doi.org/10.1186/s12864-021-07879-6
Mendoza-Cruz E., Moreno-Mendoza N., Zambrano L., Villagrán-SantaCruz M. Development and gonadal sex differentiation in the neotenic urodele: Ambystoma mexicanum // Zoomorphology. 2017. V. 136. P. 497–509. https://doi.org/10.1007/s00435-017-0361-z
Lambert M.R., Tran T., Kilian A. et al. Molecular evidence for sex reversal in wild populations of green frogs (Rana clamitans) // PeerJ. 2019. V. 7. P. e6449. https://doi.org/10.7717/peerj.6449
Flament S. Sex reversal in amphibians // Sex. Dev. 2016. V. 10. № 5–6. P. 267–278. https://doi.org/10.1159/000448797
Oike A., Kodama M., Yasumasu S. et al. Participation of androgen and its receptor in sex determination of an amphibian species // PLoS One. 2017. V. 12. № 6. P. e0178067. https://doi.org/10.1371/journal.pone.0178067
Roco Á.S., Ruiz-García A., Bullejos M. Testis development and differentiation in amphibians // Genes. 2021. V. 12. P. 578. https://doi.org/10.3390/genes12040578
Valenzuela N., Badenhorst D., Montiel E.E., Literman R. Molecular cytogenetic search for cryptic sex chromosomes in painted turtles Chrysemys picta // Cytogenet. Genome Res. 2014. V. 144. № 1. P. 39–46. https://doi.org/10.1159/000366076
Pieau C., Dorizzi M., Richard-Mercier N. Temperature-dependent sex determination and gonadal differentiation in reptiles // Genes and Mechanisms in Vertebrate Sex Determination / Eds Scherer G., Schmid M. Switzerland: Birkhäuser Verlag Basel, 2001. P. 117–141.
Merchant-Larios H., Díaz-Hernández V. Environmental sex determination mechanisms in reptiles // Sex. Dev. 2012. V. 7. № 1–3. P. 95–103. https://doi.org/10.1159/000341936
Georges A., Holleley C.E. How does temperature determine sex? // Science. 2018. V. 360. № 6389. P. 601–602. https://doi.org/10.1126/science.aat5993
Glersberg M.F., Kemper N. Rearing male layer chickens: A German perspective // Agriculture. 2018. V. 8. P. 176. https://doi.org/10.3390/agriculture8110176
Singh L., Wadhwa R., Naidu S. et al. Sex- and tissue specific Bkm (GATA)-binding protein in the germ cells of heterogametic sex // J. Biol. Chem. 1994. V. 269. № 41. P. 25321–25327.
Cмирнов А.Ф., Трухина А.В. Молекулярно-генетические механизмы детерминации пола у животных. СПб: Нестор-История, 2016. 168 с.
Elbrecht A., Smith R.G. Aromatase enzyme activity and sex determination in chickens // Science. 1992. V. 255. № 5043. P. 467–470. https://doi.org/10.1126/science.1734525
Vaillant S., Guémené D., Dorizzi M. et al. Degree of sex reversal as related to plasma steroid levels in genetic female chickens (Gallus domesticus) treated with Fadrozole // Mol. Rep. Dev. 2003. V. 65. № 4. P. 420–428. https://doi.org/10.1002/mrd.10318
Fazli N., Hassanabadi A., Mottaghitalab M., Hajati H. Manipulation of broiler chickens sex differentiation by in ovo injection of aromatase inhibitors, and garlic and tomato extracts // Poult. Sci. 2015. V. 94. № 11. P. 2778–2783. https://doi.org/10.3382/ps/pev236
Yang X., Zheng J., Na R. et al. Degree of sex differentiation of genetic female chicken treated with different doses of an aromatase inhibitor // Sex. Dev. 2008. V. 2. № 6. P. 309–315. https://doi.org/10.1159/000195680
Yang X., Zheng J., Qu L. et al. Methylation status of cMHM and expression of sex-specific genes in adult sex-reversed female chickens // Sex. Dev. 2011. V. 5. № 3. P. 147–154. https://doi.org/10.1159/000327712
Yang X., Deng J., Zheng J. et al. A Window of MHM demethylation correlates with key events in gonadal differentiation in the chicken // Sex. Dev. 2016. V. 10. № 3. P. 152–158. https://doi.org/10.1159/000447659
Mohammadrezaei M., Toghyani M., Gheisari A. et al. Synergistic effect of fadrozole and insulin-like growth factor-I on female-to-male sex reversal and body weight of broiler chicks // PLoS One. 2014. V. 9. № 7. P. e103570. https://doi.org/10.1371/journal.pone.0103570
Трухина А.В., Лукина Н.А., Смирнов А.Ф. Гормональная инверсия пола и некоторые аспекты его генетической детерминации у курицы // Генетика. 2018. Т. 54. № 9. С. 1047–1056.
Estermann M.A., Major A.T., Smith C.A. Gonadal sex differentiation: Supporting versus steroidogenic cell lineage specification in mammals and birds // Front. Cell Dev. Biol. 2020. V. 8. Article 616387. P. 1–10. https://doi.org/10.3389/fcell.2020.616387
Abinawanto, Zhang C., Saito N. et al. Identification of sperm-bearing female-specific chromosome in the sex-reversed chicken // J. Exp. Zool. 1998. V. 280. № 2. P. 65–72. https://doi.org/10.1002/(sici)1097-010x(19980101)28-0:1<65::aid-jez8>3.0.co;2-f
Takagi S., Ono T., Tsukada A. et al. Fertilization and blastoderm development of quail oocytes after intracytoplasmic injection of chicken sperm bearing the W chromosome // Poult. Sci. 2007. V. 86. № 5. P. 937–943. https://doi.org/10.1093/ps/86.5.937
Ellis H.L., Shioda K., Rosenthal N.F. et al. Masculine epigenetic sex marks of the cyp19a1/aromatase promoter in genetically male chicken embryonic gonads are resistant to estrogen-induced phenotypic sex conversion // Biol. Reprod. 2012. V. 87. № 1. P. 1–12. https://doi.org/10.1095/biolreprod.112.099747
Major A.T., Smith C.A. Sex reversal in birds // Sex. Dev. 2016. V. 10. P. 288–300. https://doi.org/10.1159/000448365
Morris K.R., Hirst C.E., Major A.T. et al. Gonadal and endocrine analysis of a gynandromorphic chicken // Endocrinology. 2018. V. 159. № 10. P. 3492–3502. https://doi.org/10.1210/en.2018-00553
Estermann M.A., Major A.T., Smith C.A. Genetic regulation of avian testis development // Genes. 2021. V. 12. P. 1459. https://doi.org/10.3390/genes12091459
Lambeth L.S., Cummins D.M., Doran T.J. et al. Overexpression of aromatase alone is sufficient for ovarian development in genetically male chicken embryos // PLoS One. 2013. V. 8. № 6. P. e68362. https://doi.org/10.1371/journal.pone.0068362
Vining B., Ming Z., Bagheri-Fam S. et al. Diverse regulation but conserved function: SOX9 in vertebrate sex determination // Genes. 2021. V. 12. P. 486. https://doi.org/10.3390/genes12040486
Smith C.A., Roeszler K.N., Ohnesorg T. et al. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken // Nature. 2009. V. 461. № 7261. P. 267–271. https://doi.org/10.1038/nature08298
Lambeth L.S., Morris K.R., Wise T.G. et al. Transgenic chickens overexpressing aromatase have high estrogen levels but maintain a predominantly male phenotype // Endocrinology. 2016. V. 157. № 1. P. 83–90. https://doi.org/10.1210/en.2015-1697
Wang J., Gong Y. Transcription of CYP19A1 is directly regulated by SF-1 in the theca cells of ovary follicles in chicken // Gen. Comp. Endocrinol. 2017. V. 247. P. 1–7. https://doi.org/10.1016/j.ygcen.2017.03.013
Jin K., Zuo Q., Song J. et al. CYP19A1 (aromatase) dominates female gonadal differentiation in chicken (Gallus gallus) embryos sexual differentiation // Biosci. Rep. 2020. V. 40. № 10. P. BSR20201576. https://doi.org/10.1042/BSR20201576
Hung T., Chang H.Y. Long noncoding RNA in genome regulation: prospects and mechanisms // RNA Biol. 2010. V. 7. № 5. P. 582–585. https://doi.org/10.4161/rna.7.5.13216
Yoon J.-H., Abdelmohsen K., Gorospe M. Posttranscriptional gene regulation by long noncoding RNA // J. Mol. Biol. 2013. V. 425. № 19. P. 3723–3730. https://doi.org/10.1016/j.jmb.2012.11.024
Huang Sh., Ye L., Chen H. Sex determination and maintenance: the role of DMRT1 and FOXL2 // Asian J. Androl. 2017. V. 19. № 6. P. 619–624. https://doi.org/10.4103/1008-682X.194420
Ioannidis J., Taylor G., Zhao D. et al. Primary sex determination in birds depends on DMRT1 dosage, but gonadal sex does not determine adult secondary sex characteristics // PNAS. 2021. V. 118. № 10. P. e2020909118. https://doi.org/10.1073/pnas.2020909118
Clinton M., Zhao D., Nandi S., McBride D. Evidence for avian cell autonomous sex identity (CASI) and implications for the sex-determination process? // Chromosome Res. 2012. V. 20. № 1. P. 177–190. https://doi.org/10.1007/s10577-011-9257-9
Piferrer F., Anastasiadi D. Do the offspring of sex reversals have higher sensitivity to environmental perturbations? // Sex. Dev. 2021. № 15. P. 134–147. https://doi.org/10.1159/000515192
Smith C.A., Major A.T., Esterman M.A. The curious case of avian sex determination // Trends Genet. 2021. V. 37. № 6. P. 496–497.
Smith C.A., Major A.T., Estermann M.A. Chicken, sex and revisiting an old paradigm // Endocrinology. 2021. V. 162. № 7. P. bqab106. https://doi.org/10.1210/endocr/bqab106
Shioda K., Odajima J., Kobayashi M. et al. Transcriptomic and epigenetic preservation of genetic sex identity in estrogen – feminized male chicken embryonic gonads // Endocrinology. 2021. V. 162. № 1. P. bqaa208. https://doi.org/10.1210/endocr/bqaa208
Aslam M.L., Woelders H. Steroid hormones and female energy balance: Relation to offspring primary sex ratio // Egg Innovations and Strategies for Improvements. United States: Acad. Press, 2017. P. 47–54. https://doi.org/10.1016/B978-0-12-800879-9.00005-6
Wrobel E.R., Molina E., Khan N. et al. Androgen and mineralocorticoid receptors are present on the germinal disc region in laying hens: Potential mediators of sex ratio adjustment in birds? // Gen. Comp. Endocrinol. 2019. V. 287. № 2. P. 113353. https://doi.org/10.1016/j.ygcen.2019.113353
Pinson S.E., Wilson J.L., Navara K.J. Timing matters: Corticosterone injections 4 h before ovulation bias sex ratios towards females in chickens // J. Comp. Physiol. B. 2015. V. 185. № 5. P. 539–546. https://doi.org/10.1007/s00360-015-0897-5
Bruggeman V., As P.V., Decuypere E. Developmental endocrinology of the reproductive axis in the chicken embryo // Comp. Biochem. Physiol. Part A, Mol. Integr. Physiol. 2002. V. 131. № 4. P. 839–846. https://doi.org/10.1016/S1095-6433(02)00022-3
Teranishi M., Shimada Y., Hori T. et al. Transcripts of the MHM region on the chicken Z chromosome accumulate as non-coding RNA in the nucleus of female cells adjacent to the DMRT1 locus // Chromosome Res. 2001. V. 9. № 2. P. 147–165. https://doi.org/10.1023/a:1009235120741
Geffroy B., Douhard M. The adaptive sex in stressful environment // Trends Ecol. Evol. 2019. V. 34. № 7. P. 628–640. https://doi.org/10.1016/j.tree.2019.02.012
Sánchez L., Chaouiya C. Logical modelling uncovers developmental constraints for primary sex determination of chicken gonads // J. R. Soc. Interface. 2018. V. 15. P. 20180165. https://doi.org/10.1098/rsif.2018.0165
Kuroiwa A. Sex-determining mechanism in avians // Adv. Exp. Med. Biol. 2017. V. 1001. P. 19–31. https://doi.org/10.1007/978-981-10-3975-1_2
Hirst C.E., Major A.T., Smith C.A. Sex determination and gonadal sex differentiation in the chicken model // Int. J. Dev. Biol. 2018. V. 62. № 1–2–3. P. 153–166. https://doi.org/10.1387/ijdb.170319cs
Bellott D.W., Skaletsky H., Cho T.J. et al. Avian W and mammalian Y chromosomes convergently retained dosage-sensitive regulators // Nat. Genet. 2017. V. 49. № 3. P. 387–394. https://doi.org/10.1038/ng.3778
Komissarov A.S., Galkina S.A., Koshel E.I. et al. New high copy tandem repeat in the content of the chicken W chromosome // Chromosoma. 2018. V. 127. № 1. P. 73–83. https://doi.org/10.1007/s00412-017-0646-5
Liu L., Fan Y., Zhao D. et al. Expression profile of chicken sex chromosome gene BTF3 is linked to gonadal phenotype // Sex. Dev. 2019. V. 13. № 4. P. 212–220. https://doi.org/10.1159/000506344
Xu L., Zhou Q. The female-specific W chromosomes of birds have conserved gene contents but are not feminized // Genes. 2020. V. 11. P. 1126. https://doi.org/10.3390/genes11101126
Rogers T.F., Pizzari T., Wright A.E. Multi-copy gene family evolution on the avian W chromosome // Heredity. 2021. V. 112. № 3. P. 250–259. https://doi.org/10.1093/jhered/esab016
Sun C., Jin K., Zhou J. et al. Role and function of the HintW in early sex differentiation in chicken (Gallus gallus) embryo // Anim. Biotechnol. 2021. P. 1–11. https://doi.org/10.1080/10495398.2021.1935981
Jin K., Zhou J., Zuo Q. et al. UBE2I stimulates female gonadal differentiation in chicken (Gallus gallus) embryos // J. Integr. Agric. 2021. V. 20. P. 2–10. https://doi.org/10.1016/S2095-3119(20)63486-4
Kinsella C.M., Ruiz-Ruano F.J., Dion-Côté A.M. et al. Programmed DNA elimination of germline development genes in songbirds // Nat. Commun. 2019. V. 10. P. 5468. https://doi.org/10.1038/s41467-019-13427-4
Ezaz T., Deakin J.E. Repetitive sequence and sex chromosome evolution in vertebrates // Adv. Evol. Biol. 2014. Article ID: 104683. 9 p. https://doi.org/10.1155/2014/104683
Nagahama Y., Chakraborty T., Paul-Prasanth B. et al. Sex determination, gonadal sex differentiation and plasticity in vertebrate species // J. Physiol. Rev. 2020. P. 213. https://doi.org/10.1152/physrev.00044.2019
Дополнительные материалы отсутствуют.


