Генетика, 2023, T. 59, № 7, стр. 839-842
Поиск генов-кандидатов для мутаций, нарушающих образование синаптонемного комплекса, в секвенированном геноме ржи Secale cereale
Ю. В. Сопова 1, 2, *, П. А. Зыкин 2, Т. В. Долматович 3, С. П. Соснихина 2
1 Санкт-Петербургский филиал Института общей генетики им. Н.И. Вавилова
199034 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Институт генетики и цитологии Национальной академии наук Беларуси
220072 Минск, Беларусь
* E-mail: y.sopova@spbu.ru
Поступила в редакцию 09.12.2022
После доработки 28.02.2023
Принята к публикации 02.03.2023
- EDN: QQPAKU
- DOI: 10.31857/S0016675823070123
Аннотация
Формирование синаптонемного комплекса между гомологичными хромосомами во время профазы I мейоза имеет первоочередное значение для нормального протекания процесса рекомбинации. Нарушения в образовании синаптонемного комплекса могут приводить как к асинапсису (при этом на стадии метафазы I будут присутствовать униваленты), так и гетерологичному синапсису (на стадии метафазы I будут выявляться как униваленты, так и мультиваленты). Ранее нами были получены мутанты ржи, у которых не наблюдалось образования синаптонемных комплексов (sy1 и sy9) или синапсис был гетерологичным (sy10, sy18 и sy19). Мы провели биоинформатический анализ аннотированного генома ржи и выявили потенциальные гены-кандидаты для каждого из этих мутантов. Выбор генов-кандидатов осуществляли на основе данных микросателлитного картирования и сопоставления их с аннотированными последовательностями генома ржи. В результате были выбраны следующие гены: Mei2-like для мутанта sy1, MAD2 для мутанта sy9, BUB3.3 и BUB3.1 для sy10 и sy18 соответственно, а также Meiosis 5 для sy19.
В 2021 г. были опубликованы результаты полного секвенирования генома Secale cereale [1, 2]. Доступность аннотированного генома ржи позволила провести биоинформатический анализ и выявить потенциальные гены-кандидаты, мутации в которых в гомозиготном состоянии, как было показано ранее [3–5], приводят к нарушению процессов синапсиса гомологичных хромосом. Для анализа были взяты гены, мутации в которых были ранее обозначены как sy1, sy9, sy10, sy18 и sy19.
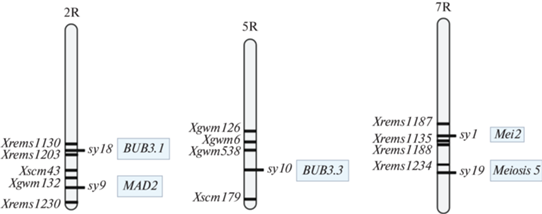
Выбор генов-кандидатов осуществляли на основе данных микросателлитного картирования [3–6] и сопоставления их с аннотированными последовательностями генома ржи. Гены Sy9 и Sy18 ранее были картированы на длинном плече 2R-хромосомы ржи вблизи центромеры. Sy9 был картирован в непосредственной близости от микросателлитных локусов Xscm43 и Xrems1230 ржи и локуса Xgwm132 пшеницы, тогда как Sy18 был картирован относительно локусов Xrems1130 и Xrems1203 ржи. Sy10 был локализован на длинном плече хромосомы 5R ржи вблизи микросателлитных локусов Xgwm126, Xgwm6 и Xgwm538 пшеницы и Xscm179 ржи. Мутации sy1 и sy19 были локализованы на длинном плече хромосомы 7R ржи рядом с локусами Xrems1187, Xrems1135 и Xrems1188 ржи (sy1) и локусом Xrems1234 ржи (sy10). Биоинформатический анализ положения маркеров на хромосомах ржи (номер сборки генома в базе GenBank – GCA_902687465.1) производился с использованием программ: Ipcress (из пакета Exonerate версии 2.4.0) и Blastn версии 2.12.0. Расположение мутаций sy1, sy9, sy10, sy18 и sy19 на хромосомах ржи и наиболее вероятные гены-кандидаты приведены на рис. 1.
Рис. 1.
Локализация мутаций sy1, sy9, sy10, sy18 и sy19 на хромосомах ржи. В прямоугольных рамках – предполагаемые гены-кандидаты для этих мутаций.
Ранее было показано, что у гомозигот по мутации sy1 наблюдается комплекс нарушений в ходе мейоза, в частности: в профазе I формируются только осевые элементы хромосом, отсутствует синаптонемный комплекс (СК), на стадии метафазы I мейоза в 96.8% случаев наблюдаются только униваленты, белок Asy1 выявлялся в виде непрерывных линейных сигналов вдоль каждой хромосомы [7].
Результаты хромосомного картирования мутанта sy1 показали, что наиболее вероятным геном-кандидатом в этом случае является ген, кодирующий Mei2-подобный белок (Mei2-like protein 6). Ранее у арабидопсиса было выявлено пять генов, относящихся к семейству Arabidopsis-mei2-Like (AML), мутации в которых приводят к нарушениям синапсиса, образованию унивалентов, фрагментации хромосом и формированию ацентриков [8]. Mei2-подобные белки содержат уникальный домен RRM, который отвечает за связывание с РНК [9], предполагается, что они могут как напрямую посттранскрипционно регулировать активность генов, так и быть вовлеченными в организацию и ремоделинг хроматина. Это согласуется с раннее полученными данными о том, что у мутанта sy1 отсутствуют ранние ферменты рекомбинации Rad51/Dmc1 [10], что может быть связано с нарушениями на уровне посттранскрипционной регуляции соответствующих генов. Было показано, что белок Mei2 является главным регулятором мейоза у Schizosaccharomyces pombe, а гены, кодирующие его ортологи, были обнаружены у разных групп эукариот, поэтому считается, что MEI2-подобные гены возникли на ранних этапах эволюции эукариот [9]. Сравнение аминокислотных последовательностей белков Mei2-like protein 6 риса, кукурузы, пшеницы и ржи показывает, что наибольшая степень сходства между белками наблюдается именно в области С-терминального домена RRM, специфичного для Mei2-подобных белков (166–274 а.к. белка Mei2-like protein 6 ржи).
Асинаптический мутант sy9 был схож с мутантом sy1 по цитологической картине нарушений в мейозе, однако у мутанта sy9 в 90% клеток белок Asy1 отсутствовал, в отличие от мутанта sy1 [11]. Анализ генов-кандидатов для мутанта sy9 выявил ген MAD2, продукт которого участвует в контроле клеточного цикла. У кукурузы белок MAD2 локализуется во внешней части мейотического кинетохора [12], для его гомолога у нематоды С. elegans была показана роль в регуляции мейотического синапсиса [13]. Белок MAD2 вместе с белками Bub1, Bub3, Cdc20 образует комплекс, контролирующий соединение кинетохор с микротрубочками веретена деления. MAD2 играет ключевую роль в сборке этого комплекса благодаря домену HORMA, впервые обнаруженному у белков HOP1, REV7 и MAD2. Домен HORMA взаимодействует с осевыми элементами хромосом, а также участвует в образовании белковых гомо- и гетеродимеров [14]. Белок Asy1 относится к тому же семейству белков, содержащих HORMA-домен, что и MAD2 [15]. Сравнение аминокислотных последовательностей белков MAD2 риса, кукурузы, пшеницы и ржи показало практически полную их идентичность, что говорит о принципиальной важности этого белка для функционирования мейоцитов растений.
Предшествующий анализ показал, что мутации sy10, sy18 и sy19 вызывают частично негомологичный синапсис и варьирующее число унивалентов в метафазе I. У мутанта sy10 белки Asy1 и Zyp1 образуют линейные треки, однако трехслойная структура СК не образуется, и синапсис проходит гетерологично [11]. У мутанта sy19 вдоль хромосом наблюдается прерывистый сигнал белка Asy1 [16]. Мутанты sy10 и sy18, как мы предполагаем, несут мутации в генах BUB3.3 и BUB3.1 соответственно. Белки BUB3.3 и BUB3.1 арабидопсиса взаимодействуют с белком MAD2 [17], у нематоды С. elegans была показана их роль в комплексе с белком МAD2 в регуляции синапсиса [18]. Эти белки содержат мотивы WD40, принципиальные для белок-белковых взаимодействий. Точковые мутации в консервативном мотиве WD40 дрожжевого Bub3 нарушают его ассоциацию с Mad2, Mad3 и Cdc20 [19].
В качестве гена-кандидата для мутанта sy19 нами был выбран ген Meiosis 5, продукт которого гомологичен белкам WM5 пшеницы и PDF1 арабидопсиса. У пшеницы этот ген экспрессируется на ранних стадиях мейоза, однако его роль в формировании синапсиса пока не изучена. Делеция одной из копий этого гена у пшеницы приводит к повышенному гомеологическому спариванию хромосом при межвидовом скрещивании [20]. Анализ аминокислотных последовательностей белков Mei5 из разных видов злаков выявил характерную последовательность, состоящую из остатков глицина, однако ее функциональная роль в настоящее время остается неизвестной.
Синапсис гомологичных хромосом в процессе мейотического деления является основой для генетической рекомбинации и сбалансированного расхождения хромосом в анафазе I. Нормальное протекание этих процессов зависит, в том числе, от правильного взаимодействия центромерных и теломерных областей хромосом. Изучение мутантов ржи, у которых в ходе мейоза наблюдаются различные нарушения, выявило ряд генов, продукты которых могут как посттранскрипционно регулировать активность генов, так и быть вовлеченными в организацию и ремоделинг хроматина, а также контролировать соединение кинетохор с микротрубочками веретена деления.
Работа выполнена в рамках госзадания ИОГен РАН (тема № 0092-2022-0002).
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rabanus-Wallace M.T., Hackauf B., Mascher M. et al. Chromosome-scale genome assembly provides insights into rye biology, evolution and agronomic potential // Nat. Genet. 2021. V. 53. P. 564–573. https://doi.org/10.1038/s41588-021-00807-0
Li G., Wang L., Yang J. et al. A high-quality genome assembly highlights rye genomic characteristics and agronomically important genes // Nat. Genet. 2021. V. 53. P. 574–584. https://doi.org/10.1038/s41588-021-00808-z
Соснихина С.П., Михайлова Е.И., Тихолиз О.А. и др. Генетическая коллекция мейотических мутантов ржи Secale cereale L. // Генетика. 2005. Т. 41. № 10. С. 1310–1321.
Долматович Т.В., Малышев С.В., Соснихина С.П. и др. Картирование мейотических генов ржи (Secale cereale L.). Локализация мутации sy18, нарушающей гомологичность синапсиса, с использованием микросателлитных маркеров // Генетика. 2013. Т. 49. № 4. С. 472–478. https://doi.org/10.7868/S0016675813040036
Долматович, Т.В., Малышев С.В., Соснихина С.П. и др. Картирование мeйотических генов ржи (Secale cereale L.). Локализация мутации sy19, нарушающей гомологичный синапсис, с помощью изозимных и микросателлитных маркеров // Генетика. 2013. Т. 49. № 5. С. 595–601. https://doi.org/10.7868/S0016675813030053
Малышев С.В., Долматович Т.В., Войлоков А.В. и др. Молекулярно-генетическое картирование асинаптических генов sy1 и sy9 ржи (Secale cereale L.) с использованием микросателлитных и изозимных маркеров // Генетика. 2009. Т. 45. № 12. С. 1634–1640.
Михайлова Е.И., Ловцюс А.В., Соснихина С.П. Некоторые особенности реализации ключевых событий мейоза у ржи и ее синаптических мутантов // Генетика. 2010. Т. 46. № 10. С. 1371–1375.
Kaur J., Sebastian J., Siddiqi I. The arabidopsis-mei2-like genes play a role in meiosis and vegetative growth in Arabidopsis // Plant Cell. 2006. V. 18. № 3. P. 545–559. https://doi.org/10.1105/tpc.105.039156
Jeffares D.C., Phillips M.J., Moore S. et al. A description of the Mei2-like protein family; structure, phylogenetic distribution and biological context // Dev. Genes Evol. 2004. V. 214. P. 149–158. https://doi.org/10.1007/s00427-004-0384-6
Jenkins G., Mikhailova E.I., Langdon T. et al. Strategies for the study of meiosis in rye // Cytogenet. Genome Res. 2005. V. 109. P. 221–227.
Mikhailova E.I., Phillips D., Sosnikhina S.P. et al. Molecular assembly of meiotic proteins Asy1 and Zyp1 and pairing promiscuity in rye (Secale cereale L.) and its synaptic mutant sy10 // Genetics. 2006. V. 174. P. 1247–1258.
Yu H.G., Muszynski M.G., Kelly Dawe R. The maize homologue of the cell cycle checkpoint protein MAD2 reveals kinetochore substructure and contrasting mitotic and meiotic localization patterns // J. Cell Biol. 1999. V. 145. P. 425–435. https://doi.org/10.1083/jcb.145.3.425
Devigne A., Bhalla N. Mad1’s ability to interact with Mad2 is essential to regulate and monitor meiotic synapsis in C. elegans // PLoS Genet. 2021. V. 17. P. e1009598. https://doi.org/10.1371/journal.pgen.1009598
Prince J.P., Martinez-Perez E. Functions and regulation of meiotic HORMA-domain proteins // Genes. 2022. V. 13. https://doi.org/10.3390/genes13050777
Balboni M., Yang C., Komaki S. et al. COMET functions as a PCH2 cofactor in regulating the HORMA domain protein ASY1 // Curr. Biol. 2020. V. 30. № 21. P. 4113–4127. https://doi.org/10.1016/j.cub.2020.07.089
Войлоков А.В., Соснихина С.П., Тихенко Н.Д. и др. Петергофская коллекция ржи и ее использование в генетических исследованиях // Экол. генетика. 2018. Т. 16. № 2. С. 40–49. https://doi.org/10.17816/ecogen16240-49
Caillaud M.C., Paganelli L., Lecomte P. et al. Spindle assembly checkpoint protein dynamics reveal conserved and unsuspected roles in plant cell division // PLoS One. 2009. V. 4. № 8. P. e6757. https://doi.org/10.1371/journal.pone.0006757
Bohr T., Nelson C.R., Klee E., Bhalla N. Spindle assembly checkpoint proteins regulate and monitor meiotic synapsis in C. elegans // J. Cell Biol. 2015. V. 211. P. 233–242. https://doi.org/10.1083/jcb.201409035
Fraschini R., Beretta A., Sironi L. et al. Bub3 interaction with Mad2, Mad3 and Cdc20 is mediated by WD40 repeats and does not require intact kinetochores // Embo J. 2001. V. 20. P. 6648–6659.
Dong C., Thomas S., Becker D. et al. WM5: Isolation and characterisation of a gene expressed during early meiosis and shoot meristem development in wheat // Funct. Plant. Biol. 2005. V. 32. P. 249–258. https://doi.org/10.1071/FP04198
Дополнительные материалы отсутствуют.


