Генетика, 2023, T. 59, № 9, стр. 1012-1022
Изменчивость В-хромосом у растений и животных в экстремальных условиях обитания
Ю. М. Борисов 1, *, Т. С. Седельникова 2, **
1 Институт проблем экологии и эволюции им. А.Н. Северцова Российской академии наук
119071 Москва, Россия
2 Институт леса им. В.Н. Сукачева – обособленное подразделение Федерального исследовательского центра “Красноярский научный центр” Сибирского отделения Российской академии наук
660036 Красноярск, Россия
* E-mail: boriss-spb@yandex.ru
** E-mail: tss@ksc.krasn.ru
Поступила в редакцию 20.02.2023
После доработки 28.03.2023
Принята к публикации 29.03.2023
- EDN: XSQVRV
- DOI: 10.31857/S0016675823080040
Аннотация
Приведен обзор данных о В-хромосомах в популяциях различных систематических групп растений и животных из экстремальных мест их обитания – границ ареала и его участков, подвергающихся воздействию неблагоприятных факторов среды. Анализ показал достаточно сходную картину распределения В-хромосом в экстремальных условиях обитания видов: прослеживается тенденция повышения полиморфизма и увеличения числа и встречаемости В-хромосом, что сопровождается изменениями кариотипа, геномными и хромосомными нарушениями у их носителей. В-хромосомы часто выявляются у видов, имеющих широкие ареалы. Обсуждается возможная адаптивная роль В‑хромосом в жизнедеятельности организма и эволюции геномов.
Адаптация живых организмов к меняющимся условиям окружающей среды является одной из наиболее важных проблем в современном мире. Как процессы адаптации связаны с изменчивостью генома эукариот известно еще недостаточно. Поэтому актуальность таких исследований несомненна. Существует предположение, что адаптивный потенциал организмов могут повышать добавочные хромосомы. Добавочные (дополнительные, сверхчисленные), или В-хромосомы известны более 100 лет. Они являются необязательными сверхкомплектными элементами генома эукариот, которые не рекомбинируют с А-хромосомами, имеют неменделевский характер наследования и идут собственным эволюционным путем. В отличие от А-хромосом, содержащих наряду с некодирующими повторами функциональные гены, В-хромосомы практически целиком состоят из повторенных последовательностей ДНК [1]. В‑хромосомы найдены более чем у 1800 видов растений и животных [2–4], с каждым годом это число растет. Вопросы о происхождении В-хромосом (из аутосом, половых хромосом или вследствие межвидовой гибридизации) и их биологическом значении (“паразитическая”, инертная или же адаптивная роль) остаются дискуссионными [5, 6].
Проведенные исследования В-хромосом в различных систематических группах организмов показали, что их наличие сказывается на работе А‑генома [2–5, 7–11]. С вариабельностью В-хромосом связаны процессы, в результате реализации которых может изменяться частота хиазм в А-хромосомах, модифицируя тем самым уровень рекомбинационной изменчивости, обычно рассматриваемой как эволюционный резерв [12]. Благодаря этим эффектам В-хромосомы служат источником генетических новшеств и тем самым позволяют организму справляться с новыми условиями среды, не изменяя своего основного набора. Вариабельность числа и морфологии добавочных В-хромосом у ряда видов, по-видимому, является очень значимой, поскольку способствует выживанию популяций в необычных и экстремальных для них условиях [5, 13, 14]. У растений и животных В-хромосомы могут выявляться в разных частях ареала вида, но наиболее часто – на его границах, а также на участках с неблагоприятными и даже экстремальными условиями обитания. Литературные данные об изменчивости В-хромосом у организмов, вынужденных адаптироваться к воздействиям экстремальных факторов среды, разрозненны. Обобщение сведений, содержащихся в таких работах, отсутствует. Цель настоящей работы заключается в обзоре статей о В-хромосомах у видов, населяющих местообитания с высоким уровнем естественной и антропогенной экстремальности.
ПОКРЫТОСЕМЕННЫЕ РАСТЕНИЯ (Angiospermae)
По последним данным, примерно 23 652 видов покрытосеменных (из них около 8% однодольных и 3% двудольных) растений имеют В-хромосомы. На самом деле это число может быть больше [6]. В природных популяциях цветковых растений встречаемость экземпляров с В-хромосомами в целом невысокая, но она возрастает в экстремальных или стрессовых условиях произрастания. Виды и формы растений, имеющие добавочные хромосомы, более устойчивы, например, к засухе и низким температурам. Такие данные получены при исследовании популяций видов жимолости (Lonicera L.). Жимолость съедобная (Lonicera edulis Turcz. et Freyn.) и жимолость алтайская (Lonicera altaica Pall.) из Тувы и Читинской области – регионов Забайкалья с низким количеством осадков – несут 2–4 В-хромосомы. L. altaica является горным и даже высокогорным растением, приспособленным переносить суровые морозы и сильную засуху. Жимолость Палласа (Lonicera pallasii Ledeb.) – обитатель субарктических областей, несет две В-хромосомы в условиях Бурятии. У жимолости узкоцветковой (Lonicera stenantha Pojark.) из Джунгарского Алатау (Казахстан) обнаружено три В-хромосомы. L. stenantha растет в высокогорьях Средней Азии и выносит резкие колебания температуры. В то же время жимолость съедобная из более мягкого климата Дальнего Востока и жимолость камчатская (Lonicera kamtschatica Pojark.), зимующая под обильным снежным покровом, В-хромосом не имеют [15]. В популяциях скерды сибирской (Crepis sibirica L.) из Западной Сибири, растущих в неблагоприятных условиях, наблюдается хромосомный полиморфизм, обусловленный системой В-хромосом и анеуплоидией. Система В-хромосом C. sibirica включает пять их типов – субметацентрические, метацентрические, субметацентрические со спутником, точечные и субакроцентрические [16].
Очевидно неслучайно, что среди растений, у которых чаще встречаются В-хромосомы и их количество может достигать больших значений (до 34 на клетку), много культурных злаков и других видов с широкими ареалами, охватывающими различные экологические условия [5]. Например, лук-резун (Allium schoenoprassum L.), распространенный даже в Арктике вплоть до 75° с. ш. (Новая Земля), может нести в этих условиях до 20 В-хромосом в одной клетке. Установленная для A. schoenoprasum высокая экологическая пластичность сопровождается увеличением числа В-хромосом и их встречаемости [13]. Еще одним примером может служить космополитный вид луговик дернистый, или щучка (Deschampsia cespitosa (L.) Beauv.), ареал которого охватывает Европу, Азию, Африку, Северную и Южную Америку, Австралию. D. cespitosa произрастает повсеместно в лесной и лесостепной зонах, в горных районах, отчасти в зоне тундр. При исследовании луговика дернистого в популяциях Северного Онтарио (Канада) было выявлено, что растения содержат В-хромосомы и отличаются высоким уровнем анеуплоидии [17].
У другого вида луговика – щучки антарктической (Deschampsia antarctica Desv.), встречающегося в Антарктиде, одна–две мелкие В-хромосомы обнаружены в кариотипах растений с самого южного о-ва Дарбу (соответственно подвергающихся наиболее экстремальным воздействиям среды) и с мыса Расмуссен, расположенного на западном антарктическом побережье. Помимо типичных диплоидных экземпляров D. antarctica, среди образцов с о-ва Грейт-Ялур обнаружено миксоплоидное растение, в основном с триплоидными клетками, несущими робертсоновскую перестройку между гомологичными хромосомами. У D. antarctica в антарктических регионах найдены полиплоидные и миксоплоидные популяции, в которых наблюдался практически весь спектр изменчивости кариотипа, характерный для рода Deschampsia [18–22].
Было установлено, что среди 862 видов кариологически исследованных древесных растений Гималаев – высочайшей горной системы Земли – около 3.9% имели В-хромосомы, что оказалось почти в 2 раза выше общего процента (1.9%) видов цветковых растений с В-хромосомами, известного на тот момент [23].
ГОЛОСЕМЕННЫЕ РАСТЕНИЯ (Gymnospermae)
У голосеменных растений, имеющих крупные геномы, В-хромосомы встречаются у 31 из 633 видов, что составляет около 5% от их общего числа. Как правило, В-хромосомы голосеменных хорошо отличаются от хромосом основного кариотипа меньшей величиной, составляющей около 30% длины А-хромосом. Дополнительные хромосомы наиболее широко распространены среди представителей рода ель (Picea A. Dietr.) семейства сосновые (Pinaceae Spreng. ex F. Rudolphi). К настоящему времени В-хромосомы выявлены в популяциях 23 видов и внутривидовых таксонов рода Picea из различных местообитаний [8, 10]. Накапливаются данные о том, что увеличение концентрации и числа В-хромосом в популяциях ели связано с усилением экстремальности условий произрастания деревьев. Так, северная граница распространения В-хромосом у ели ситхинской (Picea sitchensis (Bong.) Carr.) в Северной Америке совпадает с границей залегания вечной мерзлоты, а наибольшая их встречаемость отмечена для засушливых территорий с высокой инсоляцией [24]. Для ели сизой (Picea glauca (Moench) Voss) из регионов Северной Америки выявлена закономерность снижения встречаемости В-хромосом в направлении с востока на запад, что связано с распределением осадков [25].
Максимальная встречаемость и наибольшее число В-хромосом наблюдались в популяциях ели сибирской (Picea obovata (Ledeb.)) из восточной части ареала, особенно из регионов с резко континентальным климатом – Центральной и Восточной Сибири [26–28]. Отмечено появление В-хромосом в популяциях ели Шренка (Picea schrenkiana Fisch. et C.A. Mey.), произрастающих в горах Северного Тянь-Шаня [29]. В-хромосомы были выявлены в насаждениях P. glauca и P. obovata, испытывающих влияние антропогенных выбросов (транспортных, промышленных) в городах Воронеж, Черногорск, Ачинск, Красноярск [30, 31]. Как правило, в кариотипах популяций ели из экстремальных условий произрастания появление В‑хромосом сопровождается наличием геномных и хромосомных нарушений.
В популяциях P. obovata В-хромосомы обнаружены в семенном потомстве деревьев, произрастающих в Западной Сибири (Томская область, Томский район, окрестности пос. 86-й квартал) [32]. В проростках семян P. obovata, растущей на болоте в условиях экологического стресса, содержались одна–две добавочные хромосомы метацентрического (В1) и субметацентрического (В2) типов, их встречаемость составляла 6.8%. Проростки семян P. obovata, растущей на смежном с болотом суходоле в нормальных условиях, содержали только по одной добавочной хромосоме В1-типа, их встречаемость была в 2 раза ниже (3.2%). Число проростков с миксоплоидией и анеуплоидией, хромосомными нарушениями (кольцевыми и полицентрическими хромосомами, фрагментами, мостами) в суходольной популяции P. obovata также было в 2 раза ниже (8.0%) по сравнению с болотной (15.5%). В болотной популяции ели отмечены уникальные случаи наличия В-хромосом в полиплоидных клетках и клетках с хромосомными перестройками (рис. 1).
Рис. 1.
Метафазные пластинки хромосом ели сибирской с В-хромосомами и хромосомной перестройкой (указаны стрелками) на евтрофном болоте (окрестности пос. 86-й квартал, Томский район, Томская область). а – клетка с тетраплоидным набором хромосом и одной В-хромосомой (2n = 48 + 1B); б – клетка с диплоидным набором хромосом, одной кольцевой хромосомой (К) и одной В-хромосомой (2n = 23 + 1К + 1B).
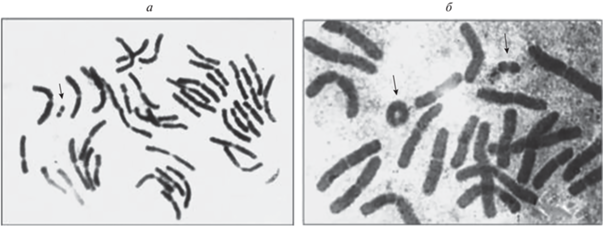
В-хромосомы у ели обыкновенной, или европейской (Picea abies (L.) H. Karst.) обнаружены впервые для вида в горном массиве Западные Родопы (Болгария, Благоевградский район), на южной границе ареала [33, 34]. Были изучены горные популяции P. abies, расположенные на территории Гарменского и Елешницкого государственных лесничеств в окрестностях с. Ковачевица (высота 1400 м над ур. м.) и с. Златарица (высота 1550 м над ур. м.). Район произрастания популяций P. abies подвержен значительному воздействию уранодобывающей промышленности и находится в зоне повышенной радиоактивности. В корневых меристемах проростков семян популяций P. abies из Западных Родоп содержались одна–четыре добавочные хромосомы как В1-, так и В2-типа. Наиболее часто встречались клетки с одной В-хромосомой, с наименьшей частотой – клетки с четырьмя В-хромосомами. Число В-хромосом могло варьировать в одном и том же проростке. В отдельных проростках, содержащих В-хромосомы, одновременно наблюдалась миксоплоидия. Встречаемость проростков с В-хромосомами в популяциях P. abies из Западных Родоп достигала 67.0%, проростков с миксоплоидией и хромосомными перестройками – 30.0%.
Обзор данных по В-хромосомам у видов Picea показал, что наибольшее их число было найдено у ели сизой – до шести, ели Глена (Picea glehnii (Fr. Schmidt) Mast.) и ели ситхинской – до пяти [8]. Однако наличие большого числа В-хромосом, по всей вероятности, неблагоприятно для видов ели. Так, деревья P. obovata, содержащие три–четыре В-хромосомы, отличались низкой фертильностью пыльцы [26]. У деревьев P. sitchensis по мере возрастания числа В-хромосом наблюдалось прогрессирующее замедление развития женской репродуктивной сферы [35]. В то же время семена P. abies, P. glauca и P. obovata, несущие небольшое число (одна–две) В-хромосом, прорастали на несколько дней быстрее, чем семена без них [25, 28, 33].
Кроме видов рода ель, В-хромосомы встречаются и у других представителей семейства сосновые из родов сосна (Pinus L.) и лиственница (Larix Mill.), но лишь в неблагоприятных условиях произрастания. В роде Pinus В-хромосомы впервые описаны в популяции сосны обыкновенной (Pinus sylvestris L.) в Челябинской области (Чебаркульский район) на территории так называемого “Уральского ядерного следа”. У одного из деревьев в одном из 13 исследованных проростков семян в кариотипе присутствовала В-хромосома, отнесенная к типу метацентрических, а также кольцевая хромосома [36]. В эксперименте по воздействию на семена P. sylvestris супермутагенов у полученных мутантных растений типа “ведьмины метла” в 1.2% клеток были обнаружены В-хромосомы и различные нарушения митоза [37]. В роде Larix В-хромосомы впервые были открыты у лиственницы Гмелина (Larix gmelinii (Rupr.) Rupr.) в популяции из суровых климатических условий Восточной Сибири (Читинская область). По морфологии В-хромосомы в читинской популяции L. gmelinii были мета- или слабо субметацентрическими, их встречаемость в проростках семян составляла 6.7% [38]. Позже В-хромосомы были обнаружены у лиственницы Сукачева (Larix sukaczewii Dylis) в двух популяциях Среднего и Северного Урала, их встречаемость не превышала 1% [39].
У лиственницы сибирской (Larix sibirica Ledeb.) В-хромосомы выявлены впервые в популяциях данного вида на п-ове Таймыр [40, 41]. Лиственница сибирская, распространенная на Таймыре на северной границе ареала, относится к субарктической расе, включающей популяции лесотундры и северо-таежной подзоны Крайнего Севера. Исследованные популяции L. sibirica произрастают на вечной мерзлоте в окрестностях г. Норильска, на участках в микрорайонах Кайеркан и Оганер. Эти участки располагаются в зоне влияния промышленных выбросов предприятий Заполярного филиала компании “Норильский никель”. По данным из открытых источников, ежегодные выбросы предприятий “Норильского никеля” составляют около 1.8 млн т загрязняющих веществ, большая часть из которых приходится на диоксид серы. В-хромосомы были найдены в 1.6% проростков семян приблизительно в половине клеток, доступных для анализа. Клетки корневых меристем содержали по одной хромосоме В2-типа. Кроме наличия В-хромосом, в проростках были выявлены миксоплоидия и анеуплоидия, а также хромосомные перестройки – кольцевые хромосомы, фрагменты, дицентрические хромосомы и др. Геномные и хромосомные нарушения обнаружены в общей сложности в 37.1% проростков. Возникновение В-хромосом в таймырской популяции L. sibirica наряду с высоким уровнем мутирования хромосом основного набора может быть связано с исключительным по своей экстремальности влиянием эколого-климатических и антропогенных факторов.
В-хромосомы найдены в популяциях лиственницы сибирской, произрастающих в Республике Хакасия на территории Ширинского района, в окрестностях пос. Соленоозерное и пос. Туим [42, 43]. Насаждение L. sibirica в пос. Соленоозерное создано в условиях типичной степи с засушливыми и солончаковыми участками. Туимская популяция L. sibirica локализована на остепненных отрогах Кузнецкого Алатау (высота около 600 м над ур. м.), в непосредственной близости от пос. Туим, где располагалось ныне закрытое подземное месторождение по отработке вольфрамовых и медно-молибденовых руд, технология извлечения которых сопряжена с выносом с отвалов шахтными и карьерными водами ряда опасных для окружающей среды химических элементов. Добавочные хромосомы типа В1 были найдены в 25.0 и 21.4% проростков семян соответственно соленоозерновской и туимской популяций L. sibirica. У растений присутствовала только одна В-хромосома, встречавшаяся не во всех клетках. Кроме В-хромосом, в 50% проростков соленоозерновского насаждения была обнаружена миксоплоидия. Ранее в семенном потомстве популяций L. sibirica, произрастающих в окрестностях пос. Туим, также были выявлены хромосомы В1-типа, миксоплоидия и хромосомные перестройки [44]. Появление В-хромосом и хромосомных нарушений в популяциях L. sibirica из Хакасии может быть связано со стрессовыми для произрастания деревьев условиями, в том числе с влиянием техногенных факторов.
МЛЕКОПИТАЮЩИЕ (Mammalia)
У млекопитающих, имеющих гораздо меньшие по сравнению с растениями геномы, доля видов с В-хромосомами существенно ниже (у приматов, в том числе у человека, В-хромосомы не найдены). Из 4629 видов ныне живущих млекопитающих [45] добавочные хромосомы были обнаружены в кариотипах 85, или 1.8% видов, причем 42 из них составляют грызуны [11]. Существует мнение, что быстрые темпы кариотипической эволюции у грызунов сопровождаются появлением В-хромосом. Среди млекопитающих у десяти видов число дополнительных хромосом достигает десяти [46]. Максимальные числа В-хромосом (до 38, это убывающий ряд мелких акроцентрических В-хромосом) обнаружены в популяциях копытных леммингов (Dicrostonyx torquatus Pallas, 1778) материковых тундр Палеарктики, а именно у животных, пойманных на крайнем северо-востоке Чукотского п-ова [47]. Однако у экземпляров D. torquatus – носителей значительного количества В-хромосом – наблюдалось снижение размеров тела и черепа, что с высокой долей вероятности может иметь отрицательное селективное значение в условиях Крайнего Севера [48]. Эти данные указывают на противоречивость результатов и сложность изучения эффектов В-хромосом. Вероятно, устойчивость системы В-хромосом является результатом взаимовлияния процессов накопления В-хромосом и вредного воздействия большого числа В-хромосом в геноме на адаптивность их носителей в случае, когда число В-хромосом становится выше критического для популяции.
Млекопитающие с большим числом В-хромосом и их значительной популяционной вариабельностью часто имеют обширный ареал, охватывающий широкий диапазон экологических условий. Одним из примеров является восточноазиатская мышь (Apodemus (Alsomys) peninsulae Thomas, 1906) с ее огромным ареалом в восточной части Палеарктики. У особей A. peninsulae, отловленных на краю северной части ареала вида в бассейне среднего течения р. Енисей, впервые выявлено множество микро-В-хромосом (от 4 до 30). Мыши, отловленные в окрестностях пос. Новоангарск, на левом берегу Ангары в 38 км от ее устья (Мотыгинский р-н Красноярского края), имели до восьми микро-В-хромосом. Новоангарск является базовым населенным пунктом компаний ОАО “Горевский ГОК” и ООО “Новоангарский ГОК”, которые занимаются добычей и обработкой залегающих в этом районе свинцово-цинковых руд. У мышей, отловленных на левом берегу р. Енисей севернее с. Берег Таскино, ниже по течению от Железногорского горно-химического комбината (Сухобузимский р-н Красноярского края), выявлено до 30 микро-В-хромосом (рис. 2). Возможно, столь уникальная для вида популяция с микро-В-хромосомами появилась вследствие влияния радиационного загрязнения поймы Енисея сбросами горно-химического комбината и других видов техногенных загрязнений на обитающих здесь животных [49].
Рис. 2.
Метафазные пластинки хромосом восточноазиатской мыши с В-хромосомами (указаны стрелками) из северной части ареала. а – клетка с диплоидным набором хромосом и восьмью В-хромосомами (2n = 48 + 8B) (окрестности пос. Новоангарск, Мотыгинский р-н, Красноярский край, левый берег р. Ангары); б – клетка с диплоидным набором хромосом и 30 В-хромосомами (2n = 48 + 30B) (окрестности с. Берег Таскино, Сухобузимский р-н, Красноярский край, левый берег р. Енисей).
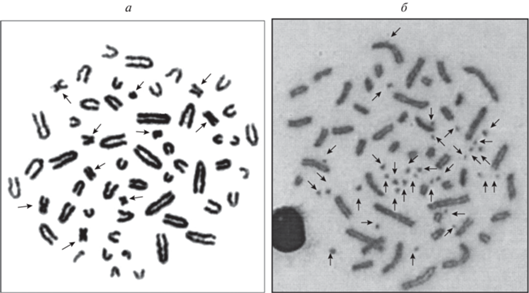
Произошедший взрывной (двух-, трехкратный) рост численности В-хромосом в 1980–2002 гг. и последующую его стабилизацию в 2002–2008 гг. в популяции восточноазиатской мыши, обитающей на территории Горного Алтая в окрестностях пос. Артыбаш на северном берегу Телецкого озера, можно отнести к значимому микроэволюционному событию для данного вида, по-видимому имеющему адаптивное значение. Кроме макро-В-хромосом, в данной популяции мышей появились микро-В-хромосомы, возникшие в результате мутации в прицентромерных гетерохроматических участках А-хромосом. Причины, вызывающие мутации хромосом в популяции мышей Горного Алтая, могут предположительно быть связаны с тем, что район Телецкого озера находится в зоне падения ступеней ракет с остатками компонентов ракетного топлива, в частности опасного для окружающей среды вещества – гептила [50].
В целом популяции A. peninsulae Сибири, Алтая, Прибайкалья, Монголии отличаются самым большим разнообразием и численностью В-хромосом. При этом каждая популяция имеет свой вариант популяционной системы В-хромосом (рис. 2). Помимо вариантов только с микро- или только с макро-В-хромосомами, в популяциях мышей Сибири встречаются комбинации с 1–10 макро- и 1–12 микро-В-хромосомами в различных сочетаниях. У сибирских мышей найдено множество уникальных вариантов системы В-хромосом, сочетающих в кариотипе пять их морфотипов – микро-, мелких акроцентрических и трех морфотипов двуплечих В-хромосом [51].
РАКООБРАЗНЫЕ (Crustacea)
Дополнительные хромосомы регулярно выявляются в метафазных клетках эмбрионов байкальской амфиподы (Polyacanthisca calceolata Bazikalova, 1937 (Crustacea, Amphipoda)) – эндемичного вида раков-бокоплавов, обитающего в литоральной зоне оз. Байкал на глубине около 1300–1400 м. Наличие В-хромосом у байкальской амфиподы рассматривается как адаптивный механизм, позволяющий этому виду совершать миграции в районы просачивания углеводородных газогидратов на дно озера [52].
РЫБЫ (Pisces)
В реках крайнего северо-востока Евразии – Анадырь и Пенжина – в кариотипе популяций чира (Coregonus nasus (Pallas, 1776)) найдено варьирующее число мелких, как правило, гетерохроматиновых В-хромосом. Климат бассейна этих рек характеризуется продолжительной суровой снежной зимой и коротким холодным летом. https://ru.wikipedia.org/wiki/%D0%90%D0%BD%-D0%B0%D0%B4%D1%8B%D1%80%D1%8C_(%D-1%80%D0%B5%D0%BA%D0%B0) – cite_note-_ca19bd9df05a346f-14. У чира анадырской популяции резко выражен полиморфизм добавочных хромосом – самки, в отличие от самцов, не имеют В-хромосом в 1/3 клеток. Мозаицизм числа В-хромосом осложняется наличием В-хромосом разной морфологии: мета-, субмета- и акроцентрических, которые могут быть крупными (сравнимыми по размерам с самыми мелкими акроцентрическими хромосомами основных наборов) или мелкими (в 2–3 раза мельче) и быть полностью или частично гетерохроматиновыми [53].
НАСЕКОМЫЕ (Insecta)
Имеются данные об увеличении числа и встречаемости В-хромосом у насекомых в экстремальных условиях обитания. Анализ генофонда природных популяций мошек (Diptera, Simulidae) показал, что В-хромосомы обнаружены преимущественно у полиморфных, широко распространенных видов. Число личинок с В-хромосомами возрастает с усилением загрязнения водоемов и воздействия других факторов на популяцию. Существует корреляция между формами мошек с В-хромосомами и местообитанием популяции: чаще они выявляются на периферии ареала, в северных или высокогорных районах, например в ручьях из снежников Памира. Популяция мошки украшенной (Odagmia ornate Meigen, 1818) из ручья на Соловецких островах Архангельской области, удаленная от основного материка на значительное расстояние, характеризуется полиморфизмом по В-хромосомам [54, 55].
В сообществах пяти видов комаров-звонцов, или хирономид (Chironomidae Newman, 1834), обитающих в малых водоемах Псковской области с различным уровнем загрязнения биогенными элементами, наиболее высокая частота встречаемости особей с В-хромосомами обнаружена в самом загрязненном водоеме [56]. У мотыля (Chironomus pilicornis (Fabricius, 1787)) в арктической популяции Оймякона (“полюс холода”) в экстремальных для развития личинок условиях обнаружены множественные В-хромосомы [57]. Их насчитывается до нескольких десятков на одно ядро клетки слюнной железы. Частота встречаемости личинок с В-хромосомами очень высока в оймяконских популяциях (24–50%). В этих условиях многоядрышковость, увеличение массы центромерного гетерохроматина и появление множественных В-хромосом могут служить клеточными механизмами адаптации к суровым условиям существования личинок в зоне вечной мерзлоты. Так, многоядрышковость способна обеспечить синтез большого количества рибосомной РНК, необходимой для белковых синтезов, протекающих в условиях низких температур с малой эффективностью [57]. В популяции другого вида мотыля – Chironomus bolatonicus (Devai, Wulker & Scholl, 1983) из зоны Чернобыля в 1987–1988 гг. впервые для вида обнаружены В-хромосомы, а также широкий спектр геномных и хромосомных нарушений [58].
Таким образом, картина распределения добавочных хромосом у животных и растений в экстремальных местах их ареала достаточно сходна. В-хромосомы чаще всего выявляются у видов, имеющих широкие ареалы. В краевых (маргинальных) популяциях различных групп организмов, обитающих на границах ареала или на участках ареала с экстремальными экологическими условиями, прослеживается тенденция возрастания встречаемости и числа В-хромосом, увеличения изменчивости систем В-хромосом. Появление В‑хромосом в таких популяциях обычно сопровождается изменениями кариотипа, расширением диапазона и увеличением частоты встречаемости геномных и хромосомных нарушений. Однако слишком большое число В-хромосом может иметь отрицательные эффекты для их носителей. В целом же влияние В-хромосом зависит от условий окружающей среды, действующих на популяцию и различающихся изменчивостью в пространстве и во времени. Поэтому каждый отдельный случай появления В-хромосом должен анализироваться во многих популяциях, а эффекты должны изучаться как можно в больших разнообразных условиях [2, 5].
В-ХРОМОСОМЫ И ГЕНЫ
В появлении В-хромосом определенную роль играют, очевидно, мобильные генетические элементы (транспозоны). Экспрессия транскрипционно активных ретротранспозонов растений может усиливаться под влиянием различных стрессовых факторов [59]. В-хромосомы являются идеальной мишенью для транспозиции мобильных элементов, и поэтому вставки таких элементов могут нести ответственность за создание структурной изменчивости, наблюдаемой в В-хромосомах [2]. При исследовании краевой популяции мятлика (Aegilops speltoides Tausch), имеющей широкий спектр хромосомных аномалий – гетерозиготность по транслокациям и изменчивость расположения на хромосомах количества сайтов 45S 5S рибосомных ДНК (рДНК), показана связь изменчивости транспозиции с изменчивостью количества В-хромосом. У одного из генотипов A. speltoides увеличение числа В-хромосом с трех до пяти коррелировало со значительным возрастанием копий мобильных элементов в S2-поколении [60]. Благодаря вариабельности гетерохроматиновых участков В-хромосом и подвижным мобильным генам, перемещающимся преимущественно по этим генетически “не активным” участкам, создается разнообразие генома, которое обусловливает ускорение его эволюционных преобразований. Считается, что гетерохроматиновые участки и В-хромосомы способны осуществлять глобальный контроль над адаптацией видов к условиям среды и определять эволюцию новых видов [5, 61, 62].
Представление об инертности В-хромосом связано с их очень низкой транскрипционной активностью или ее отсутствием. Основная часть исследований по молекулярной организации В-хромосом показала, что добавочные элементы богаты повторенной некодирующей ДНК (LINE и SINE), теломерными и центромерными повторами, рибосомной ДНК, гистоновыми генами и не несут экспрессирующихся уникальных генов [63]. Тем не менее, немало В-хромосом обнаруживают транскрипционную активность: большинство их них содержат кластеры генов рибосомной РНК, часть которой является транскрипционно активной [5]. В ряде исследований была показана экспрессия рибосомных генов, лежащих на добавочных элементах, у растений, в частности скерды волосовидной (Crepis capillaries (L.) Wallr.) [64], и животных – восточноазиатской мыши, плачущего кузнечика (Eyprepocnemis plorans (Charpentier, 1825)) [65, 66].
Наличие уникальных генов на В-хромосомах было впервые предсказано для овса посевного (Avena sativa L.) по устойчивости к ржавчине (Dherawattana, Sadanaga, 1973, цит. по [5]), позже – для паразитического гриба рода фузариум (Fusarium Link, 1809) Nectria haematococca по устойчивости к антибиотикам [67]. В последнем случае наличие гена было подтверждено скринингом фосмидной библиотеки [68] и секвенированием полного генома [69]. Использование молекулярных методов позволило выявить ряд уникальных аутосомных генов, расположенных на В-хромосомах, у различных организмов, в том числе рыб и млекопитающих [70–72].
Вопрос о транскрипционной активности генов, расположенных на В-хромосомах млекопитающих, долго оставался спорным и открытым. Первым уникальным геном, идентифицированным на В‑хромосомах позвоночных, стал протоонкоген C-KIT, выявленный на В-хромосомах хищных – лисицы (Vulpes vulpes (Linnaeus, 1758)) и енотовидной собаки (Canis procyonoides Gray, 1834). Впоследствии было обнаружено его присутствие в добавочных элементах и других видов млекопитающих, в частности сибирской косули (Capreolus pygargus (Pallas, 1771)) (2n = 70 + 0-12B) [63, 73–75]. Обнаружение транскрипта FPGT-TNNI3K, экспрессирующегося с дуплицированных генов на В-хромосомах в культуре фибробластов сибирской косули, является примером транскрипционной активности уникальных генов, расположенных на добавочных элементах кариотипа млекопитающих [63, 76].
Варьирование копийности функционально значимых генов в зависимости от числа В-хромосом может оказаться критическим для жизнедеятельности вида, что способствует пересмотру представления о В-хромосомах и необходимости учитывать их возможную роль в функционировании организма и в эволюции геномов. Сейчас очевидно, что B-хромосомы – часть общей избыточности генома, характерной для ядерных организмов. В спецвыпуске журнала “Genes” и недавно вышедшей монографии “Evolution, composition and regulation of supernumerary B chromosomes” [77] было показано, что B-хромосомы содержат не просто скопления гетерохроматина, нефункционального при реализации наследственной информации, а включают целиком некоторые кодирующие белок гены, их фрагменты, а также сегменты дупликации (удвоения участков хромосом).
Более подробный молекулярный состав В-хромосом, известный в настоящее время для ряда видов растений и млекопитающих, подтверждает наличие генов, кодирующих белок, и транскрипционную активность для некоторых из них. Поэтому концепция инертности B-хромосом устарела, но их роль еще предстоит определить. Поддержание B‑хромосом очевидно неодинаково для всех видов, поэтому текущие модели должны быть адаптированы с учетом того, что добавочные хромосомы не бездействуют, как считалось раньше. Хотя B-хромосомы не являются необходимыми для функционирования организмов, однако в них могут образовываться, например, новые гены или может происходить слияние фрагментов генов из разных частей генома. Генетики России и их зарубежные коллеги предполагают, что добавочные хромосомы могут быть “фабрикой” новых генов. Поскольку лишь в XXI в. появились методы изучения молекулярной структуры В-хромосом, позволившие получить данные по анализу некодирующей части генома и раскрыть неожиданные биологические функции у считавшихся “избыточными” последовательностей [78, 79], В-хромосомы без преувеличения можно назвать хромосомами XXI в.
Работа выполнена в рамках Базового проекта ИЛ СО РАН “Функционально-динамическая индикация биоразнообразия лесов Сибири” № FWES-2021-0009, рег. НИОКТР № 121031500336-9.
Настоящая статья не содержит каких-либо исследований с использованием в качестве объекта животных.
Настоящая статья не содержит каких-либо исследований с участием в качестве объекта людей.
Авторы заявляют, что у них нет конфликта интересов.
Список литературы
Rubtsov N.B., Borisov Y.M. Sequence composition and evolution of mammalian B chromosomes // Genes. 2018. V. 9. № 10. P. 490. https://doi.org/10.3390/genes9100490
Camacho J.P.M., Sharbel T.F., Beukeboom L.W. B chromosome evolution // Philos. Trans. R. Soc. Lond. B. 2000. V. 355 (1394). P. 163–178. https://doi.org/10.1098/rstb.2000.0556
Camacho J.P.M. B chromosomes // The Evolution of the Genome / Ed. Gregory T.R. N.Y.: Acad. Press, 2005. P. 223–286.
Jones N. B chromosomes in plants // Plant Biosystems – An Intern. J. Dealing with all Aspects of Plant Biology. 2012. V. 146. № 3. P. 727–737. https://doi.org/10.1080/11263504.2012.713406
Кунах В.А.Додаткові або В-хромосоми рослин. Походження та біологічне значення // Вісник Укр. тов-ва генетиків та селекціонерів. 2010. Т. 8. № 1. С. 99–139.
Houben A., Banaei-Moghaddam A.M., Klemme S. Biology and evolution of B chromosomes // Plant Genome Diversity. V. 2 / Eds Leitch I.J. et al. Springer-Verlag Wien, 2013. P. 149–165. https://doi.org/10.1007/978-3-7091-1160-4_10
Jones N. New species with B-chromosomes discovered since 1980 // Nucleus. 2017. V. 60. P. 263–281. https://doi.org/10.1007/s13237-017-0215-6
Muratova E.N. B-chromosomes in Gymnosperms – A Review // The Intern. J. Plant Reproductive Biol. 2018. V. 10. № 1. P. 14–25. https://doi.org/10.14787/ijprb.2018.10.1.14-25
Борисов Ю.М., Мышлявкина Т.А. В-хромосомы // Успехи соврем. биологии. 2018. Т. 138. № 4. С. 336–351. https://doi.org/10.7868/S0042132418040026
Rastogi S., Ohri D. B-chromosomes in Gymnosperms // Silvae Genetica. 2019. V. 68. № 1. P. 51–54. https://doi.org/10.2478/sg-2019-0009
Vujosevic M., Rajicic M., Blagojevic J. B chromosomes in populations of mammals Revisited // Genes. 2019. V. 9. № 10. P. 487. https://doi.org/10.3390/genes9100487
Jones R.N., Rees H. B Chromosomes. London; N.Y.; Paris: Acad. Press, 1982. 266 p.
Bougourd S.M., Plowman A.B. The inheritance of B chromosomes in Allium schoenoprasum L. // Chromosome Res. 1996. V. 4. № 2. P. 151–158. https://doi.org/10.1007/BF02259709
Bougourd S.M., Jones R.N. B Chromosomes: A physiological enigma // The New Phytologist. 1997. V. 137. № 1. P. 43–54. http://www.jstor.org/stable/2559080
Соловьева Л.В., Плеханова Н.М. О добавочных хромосомах жимолости // Цитология и генетика. 1992. Т. 26. № 3. С. 21–25.
Цитленок С.И., Пулькина С.В. Хромосомный полиморфизм Crepis sibirica (Asteraceae) // Бот. журн. 1991. Т. 76. № 11. С. 1538–1544.
Nkongolo K.K., Deck A., Michael P. Molecular and cytological analysis of Deschampsia cespitosa population from Northern Ontario (Canada) // Genome. 2001. V. 44. № 5. P. 818–825. https://doi.org/10.1139/g01-063
Cardone S., Sawatani P., Rush P. et al. Karyological studies in Deschampsia antarctica Desv. (Poaceae) // Polar Biol. 2008. V. 32. № 3. P. 427–433. https://doi.org/10.1007/s00300-008-0535-8
Parnikoza I., Kozeretska I., Kunakh V. Vascular plants of the maritime Antarctic: origin and adaptation // Am. J. Plant Sciences. 2011. № 3. P. 381–395. https://doi.org/10.4236/ajps.2011.23044
González M.L., Urdampilleta J.D., Fasanella M. et al. Distribution of rDNA and polyploidy in Deschampsia antarctica E. Desv. in Antarctic and Patagonic populations // Polar Biol. 2016. V. 39. P. 1663–1677. https://doi.org/10.4236/ajps.2011.23044
Amosova A.V., Bolsheva N.L., Samatadze T.E. et al. Molecular Cytogenetic Analysis of Deschampsia antarctica Desv. (Poaceae), Maritime Antarctic // PLoS One. 2015. V. 10(9). https://doi.org/10.1371/ journal.pone.0138878
Amosova A.V., Bolsheva N.L., Zoshchuk S.A. et al. Comparative molecular cytogenetic characterization of seven Deschampsia (Poaceae) species // PLoS One. 2017. V. 12(4). https://doi.org/10.1371/journal.pone.0175760
Bedi Y.S., Gill B.S., Bir S.S. Cytological evolution in the woody taxa of Gamopetalae and Monochlamydeae // J. Cytol. and Genet. 1985. V. 20. P. 162–203.
Moir R.B., Fox D.P. Supernumerary chromosomes in Picea sitchensis (Bong.) Carr. // Silvae Genet. 1972. V. 21. № 5. P. 182–186.
Teoh S.B., Rees H. B-chromosomes in white spruce // Proc. Roy. Soc. London. 1977. V. 198. № 1133. P. 325–344.
Брока М.В. В-хромосомный полиморфизм в природных популяциях Picea obovata Ledeb. // Роль селекции в улучшении латвийских лесов. Рига, 1990. С. 105–117.
Муратова Е.Н. В-хромосомы голосеменных // Успехи соврем. биологии. 2000. Т. 120. № 5. С. 452–465.
Муратова Е.Н., Владимирова О.С. Добавочные хромосомы кариотипа ели сибирской P. obovata // Цитология и генетика. 2001. № 4. С. 38–44.
Карпюк Т.В., Муратова Е.Н., Владимирова О.С., Седельникова Т.С. Кариологический анализ ели Шренка // Лесоведение. 2009. № 1. С. 52–58.
Буторина А.К., Богданова Е.В. Адаптивное значение и возможное происхождение В-хромосом у ели колючей // Цитология. 2001. Т. 43. № 8. С. 809–814.
Владимирова О.С., Муратова Е.Н. Кариологические особенности ели сибирской (Picea obovata Ledeb.) в условиях антропогенного загрязнения г. Красноярска // Экол. генетика. 2005. Т. III. № 1. С. 18–23.
Седельникова Т.С., Муратова Е.Н., Пименов А.В., Ефремов С.П. Кариологические особенности болотных и суходольных популяций Picea obovata в Западной Сибири // Бот. журн. 2004. Т. 89. № 5. С. 718–733.
Tashev A.N., Sedel’nikova T.S., Pimenov A.V. Supernumerary (B) chromosomes in populations of Picea abies (L.) H. Karst. from Western Rhodopes (Bulgaria) // Cytology and Genetics. 2014. V. 48. № 3. P. 160–165. https://doi.org/10.3103/S0095452714030116
Ташев А.Н., Седельникова Т.С., Пименов А.В. Число хромосом и хромосомные перестройки у ели обыкновенной Picea abies (L.) H. Karst. в лесах Рило-Родопского горного массива в Болгарии // Сиб. лесной журн. 2015. № 5. С. 77–86. https://doi.org/10.15372/SJFS20150506
Kean V.M., Fox D.P., Faulkner R. The accumulation mechanism of the supernumerary (B-) chromosome in Picea sitchensis (Bong.) Carr. and the effect of this chromosome on male and female flowering // Silvae Genetica. 1982. V. 31. № 4. P. 126–131.
Буторина А.К., Мурая Л.С., Исаков Ю.Н. Спонтанный мутагенез у сосны обыкновенной (Pinus silvestris L.). Первый случай обнаружения мутанта с кольцевой и добавочной хромосомами // ДАН СССР. 1979. Т. 248. № 4. С. 977–979.
Молотков П.И., Кириченко О.И., Бенгус Ю.В. О происхождении “ведьминой метлы” у сосны обыкновенной // Цитология и генетика. 1989. Т. 24. № 4. С. 14–19.
Муратова Е.Н. Добавочные хромосомы у лиственницы Гмелина Larix gmelinii (Rupr.) Rupr. // ДАН СССР. 1991. Т. 318. № 6. С. 1511–1514.
Путенихин В.П., Фарукшина Г.Г., Шигапов З.Х. Лиственница Сукачева на Урале: изменчивость и популяционно-генетическая структура. М.: Наука, 2004. 276 с.
Седельникова Т.С., Пименов А.В., Вараксин Г.С., Янковска В. Числа хромосом некоторых видов хвойных // Бот. журн. 2005. Т. 90. № 10. С. 1611–1612.
Sedel’nikova T.S., Pimenov A.V. Chromosomal mutations in Siberian larch (Larix sibirica Ledeb.) on Taimyr Peninsula // Biol. Bull. Russ. Acad. Sci. 2007. V. 34. № 2. P. 198–201. https://doi.org/10.1134/S1062359007020136
Седельникова Т.С., Пименов А.В. Числа хромосом видов рода Larix (Pinaceae) в лесостепи и лесотундре Средней Сибири // Бот. журн. 2017. Т. 102. № 12. С. 1694–1697.
Седельникова Т.С., Пименов А.В. Числа хромосом форм Larix sibirica (Pinaceae) в Ширинской степи Республики Хакасия // Бот. журн. 2017. Т. 102. № 5. С. 693–697.
Сизых О.А., Квитко О.В., Муратова Е.Н., Тихонова И.В. Формовое разнообразие и кариологические особенности лиственницы сибирской (Larix sibirica Ledeb.) юга Сибири // Хвойные бореальной зоны. 2006. Т. XXIII. № 2. С. 202–211.
Mammal Species of the World: A Taxonomic and Geographic Reference / Eds Wilson D.E., Reeder D.M. 2nd ed. Washington, D.C.: Smithsonian Institution Press, 1993. 1206 p.
Vujosevic M., Blagojevic J. B-chromosomes in populations of mammals // Cytogenet. Genome Res. 2004. V. 106. P. 247–256.
Чернявский Ф.Б., Козловский А.И. Видовой статус и история копытных леммингов (Dicrostonyx, Rodentia) острова Врангеля // Зоол. журн. 1980. Т. LIX. Вып. 2. С. 266–273.
Gileva E.A. The B chromosome system in the varying lemming Dicrostonyx torquatus Pall., 1779 from natural and laboratory populations // Russ. J. Genet. 2004. V.40. № 12. P. 1399–1406. https://doi.org/10.1007/s11177-005-0011-2
Borisov Y.M., Afanas’ev A.G., Lebedev T.T., Bochkarev M.N. Multiplicity of B microchromosomes in a siberian population of mice Apodemus peninsulae (2n = 48 + 4–30 B chromosomes) // Russ. J. Genet. 2010. V. 46. № 6. P. 705–711. https://doi.org/10.1134/S1022795410060116
Borisov Y.M. Increase in the number of the B-chromosomes and variants of their system in mouse Apodemus peninsulae in Mountain Altai population over 26 years // Russ. J. Genet. 2008. V. 44. № 9. P. 1070–1079. https://doi.org/10.1134/S1022795408090093
Borisov Y.M., Zhigarev I.A. B chromosome system in the Korean field mouse Apodemus peninsulae Thomas, 1907 (Rodentia, Muridae) // Genes. 2018. V. 9. № 10. P. 472. https://doi.org/10.3390/genes9100472
Natyaganova A.N., Sitnikova T.Ya. Karyotype of the Baikal amphipod Polyacanthisca calceolata Bazikalova, 1937 (Crustacea, Amphipoda) // Chromosome Science. 2012. V. 15. № 1–2. P. 43–48.
Фролов C.B. Добавочные хромосомы в кариотипе чира // Цитология. 1986. Т. 28. № 2. С. 215–218.
Чубарева Л.А. Хромосомный полиморфизм в природных популяциях кровососущих мошек и некоторых других двукрылых насекомых // Цитология. 1974. Т. 6. № 3. С. 267–280.
Чубарева Л.А., Петрова Н.А. Кариотипы мошек (Diptera, Simulidae) мировой фауны // Энтомол. обозрение. 2003. T. 72. № 1. С. 157–222.
Жиров С.В. Дополнительные хромосомы (В-хромосомы) в кариотипах некоторых видов хирономид из Псковской области // Цитология. 1999. Т. 41. № 1. С. 91–95.
Кикнадзе И.И., Истомина А.Г., Салова Т.А. Функциональная морфология политенных хромосом хирономиды Chironomus pilicornis F. из водоемов криолитозоны // Цитология. 2002. Т. 44. № 1. С. 89–95.
Петрова Н.А., Михайлова П.А. Геномные, хромосомные, хроматидные и хромонемные нарушения у Chironimus bolatonicus (Diptera) из зоны Чернобыля // Генетика. 1994. Т. 30. Приложение. С. 120–121.
Сормачева И.Д., Блинов А.Г. LTR-ретротранспозоны растений // Вавил. журн. генетики и селекции. 2011. Т. 15. № 2. С. 351–381.
Belyayev A., Kalendar R., Brodsky L. et al. Transposable elements in a marginal plant population: Temporal fluctuations provide new insights into genome evolution of wild diploid wheat // Mobile DNA. 2010. V. 1. № 6. https://doi.org/10.1186/1759-8753-1-6
Кунах В.А. Мобiльнi генетичнi елементи i пластичнiсть геному рослин. Кïев: Логос, 2013. 288 с.
Борисов Ю.М. В-хромосомы и пластичность вида // Экол. генетика. 2013. Т. XI. № 2. С. 73–83.
Дементьева П.В. Выявление и характеристика кодирующих последовательностей на В-хромосомах сибирской косули: Дис. … канд. биол. наук. Новосибирск: ФГБУ ИМКБ СО РАН, 2013. 148 с.
Leach C.R., Houben A., Field B. et al. Molecular evidence for transcription of genes on a B chromosome in Crepis capillaris // Genetics. 2005. V. 171. № 1. P. 269–278. https://doi.org/10.1534/genetics.105.043273
Rubtsov N.B., Karamysheva T.V., Andreenkova O.V. et al. Comparative analysis of micro and macro B chromosomes in the Korean field mouse Apodemus peninsulae (Rodentia, Muridae) performed by chromosome microdissection and FISH // Cytogenet. Genome Res. 2004. V. 106. № 2–4. P. 289–294. https://doi.org/10.1159/000079301
Ruiz-Estévez M., López-León M.D., Cabrero J., Camacho J.P. B-chromosome ribosomal DNA is functional in the grasshopper Eyprepocnemis plorans // PLoS One. 2012. V. 7. № 5. https://doi.org/10.1371/journal.pone.0036600
Miao V.P., Covert S.F., VanEtten H.D. A fungal gene for antibiotic resistance on a dispensable (“B”) chromosome // Science. 1991. V. 254. № 5039. P. 1773–1776. https://doi.org/10.1126/science.1763326
Han Y., Liu X., Benny U. et al. Genes determining pathogenicity to pea are clustered on a supernumerary chromosome in the fungal plant pathogen Nectria haematococca // Plant J. 2001. V. 25. № 3. P. 305–314. https://doi.org/10.1046/j.1365-313x.2001.00969.x
Coleman J.J., Rounsley S.D., Rodriguez-Carres M. et al. The Genome of Nectria haematococca: Contribution of Supernumerary Chromosomes to Gene Expansion // PLoS Genet. 2009. V. 5. № 8. https://doi.org/10.1371/journal.pgen.1000618
Lamatsch D.K., Trifonov V., Schories S. et al. Isolation of a cancer-associated microchromosome in the sperm-dependent parthenogen Poecilia formosa // Cytogenet. Genome Res. 2011. V. 135. P. 135–142. https://doi.org/10.1159/000331271
Yoshida K., Terai Y., Mizoiri S. et al. B chromosomes have a functional effect on female sex determination in Lake Victoria cichlid fishes // PLoS Genet. 2011. V. 7. https://doi.org/10.1371/journal.pgen.1002203
Martis M.M., Klemme S., Banaei-Moghaddam A.M. et al. Selfish supernumerary chromosome reveals its origin as a mosaic of host genome and organellar sequences // Proc. Natl Acad. Sci. USA. 2012. V. 109. P. 13343–13346. https://doi.org/10.1073/pnas.1204237109
Graphodatsky A.S., Kukekova A.V., Yudkin D.V. et al. The proto-oncogene C kit maps to canid B-chromosomes // Chromosome Res. 2005. V. 13. P. 113–122. https://doi.org/10.1007/s10577-005-7474-9
Yudkin D.V., Trifonov V.A., Kukekova A.V. et al. Mapping of KIT adjacent sequences on canid autosomes and B chromosomes // Genome Res. 2007. V. 116. P. 100–103. https://doi.org/10.1159/000097424
Duke Becker S.E., Thomas R., Trifonov V.A. et al. Anchoring the dog to its relatives reveals new evolutionary breakpoints across 11 species of the Canidae and provides new clues for the role of B chromosomes // Chromosome Res. 2011. V. 19. P. 685–670. https://doi.org/10.1007/s10577-011-9233-4
Trifonov V.A., Dementyeva P.V., Larkin D.M. et al. Transcription of a protein-coding gene on B chromosomes of the Siberian roe deer (Capreolus pygargus) // BMC Biol. 2013. V. 11. № 90. https://doi.org/10.1186/1741-7007-11-90
Houben A., Jones N., Martins C., Trifonov V. Evolution, composition and regulation of supernumerary B chromosomes // Genes. 2019. V. 10. № 2. https://doi.org/10.3390/genes10020161
Макунин А.И., Трифонов В.А. Современные методы анализа добавочных хромосом // Цитология. 2013. Т. 55. № 3. С. 148–152.
Макунин А.И. Анализ генетического состава В-хромосом млекопитающих с применением высокопроизводительного секвенирования: Дис. … канд. биол. наук. Новосибирск: ФГБУ ИМКБ СО РАН, 2016. 141 с.
Дополнительные материалы отсутствуют.


